Строение атома алюминия, электронная оболочка и схема элемента
4.6
Средняя оценка: 4.6
Всего получено оценок: 471.
4.6
Средняя оценка: 4.6
Всего получено оценок: 471.
Алюминий (Al) – лёгкий металл, занимающий третье место по распространённости в земной коре среди химических элементов. Строение атома алюминия позволяет легко обрабатывать металл: он поддаётся литью, формовке, механическому воздействию.
Строение
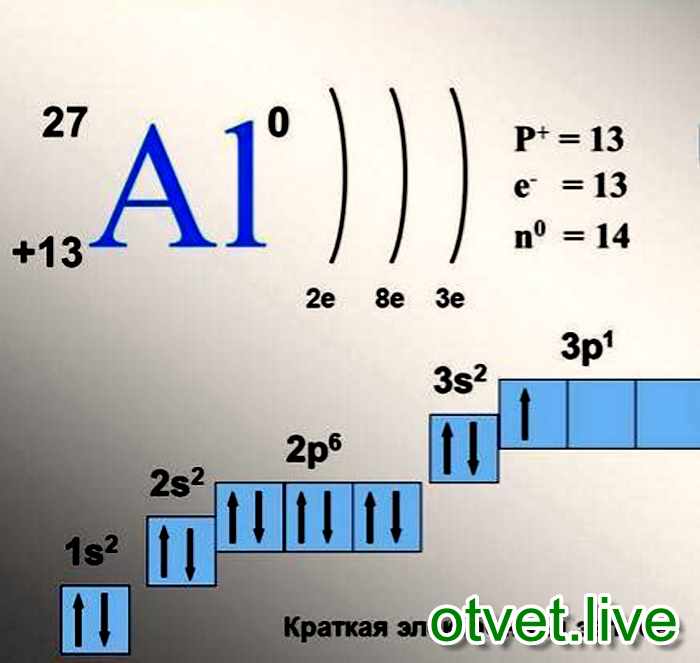
Электронное строение атома элемента алюминия связано с его положением в периодической таблице Менделеева. Алюминий имеет 13 порядковый номер и находится в третьем периоде, в IIIa группе. Относительная атомная масса алюминия – 27. Электронная конфигурация атома алюминия – 1s22s22p63s23p1, модель распределения электронов – +13Al)2)8)3.
Рис. 1. Алюминий в периодической таблице.Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трёх электронных оболочек с 13 электронами.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Металл ценился дороже золота до открытия промышленного способа его получения.
Свойства
Алюминий – серебристый металл, обладающий высокой электропроводностью и пластичностью. Элемент при комнатной температуре легко соединяется с кислородом, образуя на поверхности оксидную плёнку, защищающую металл от коррозии. Образование плёнки препятствует реакции с водой, концентрированными азотной и серной кислотами, поэтому алюминиевая тара подходит для перевозки этих кислот.
Для снятия оксидной плёнки используют соли аммония, горячие щёлочи, сплавы ртути. После разрушения оксидной плёнки алюминий вступает в реакцию со многими неметаллами и соединениями. Основные химические свойства элемента описаны в таблице.
Основные химические свойства элемента описаны в таблице.
Взаимодействие | Ход реакции | Пример |
С водой | Только в условиях отсутствия оксидной плёнки. Образуется гидроксид алюминия | 2Al + 6H2O → 2Al(OH)3 + 3H2 |
С кислородом | Образуется оксид алюминия | 4Al + 3O2 → 2Al2O3 + Q |
С галогенами | При комнатной температуре. С йодом – в присутствии катализатора | 2Al + 3Cl2 → 2AlCl3 |
С серой | При температуре выше 200°С, образуется сульфид алюминия | 2Al + 3S → Al2S3 |
С фосфором | При температуре 500°С, образуется фосфид алюминия | Al + P → AlP |
С азотом | При температуре 800°С, образуется нитрид алюминия | 2Al + N2 → 2AlN |
С углеродом | При температуре 2000°С, образуется карбид алюминия | 4Al + 3C → Al4C3 |
С кислотами | При комнатной температуре реагирует с разбавленными кислотами, при нагревании – с концентрированными. | – 2Al + 3H2SO4 → Al2(SO4)3 + 3H2; – 2Al + 6HCl → 2AlCl3 + 3H2; – Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O |
Со щелочами | Реагируют растворы и сплавы | – 2Al + 2NaOH + 10H2O → 2Na[Al(H2O)2(OH)4] + 3H2; – 2Al + 6KOH → 2KAlO2 + 2K2O + 3H2 |
С оксидами | Вытесняет металлы |
Алюминий не взаимодействует с водородом.
Что мы узнали?
Атом алюминия включает 13 электронов. Схема строения алюминия – 1s22s22p63s23p1. На внешнем уровне находится три электрона, определяющие третью валентность элемента. Алюминий – лёгкий, плавкий металл, легко вступающий в реакцию с кислородом и образующий на поверхности оксидную плёнку. Благодаря плёнке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами. При комнатной температуре алюминий реагирует с галогенами, при нагревании – с серой, фосфором, азотом, углеродом.
Алюминий – лёгкий, плавкий металл, легко вступающий в реакцию с кислородом и образующий на поверхности оксидную плёнку. Благодаря плёнке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами. При комнатной температуре алюминий реагирует с галогенами, при нагревании – с серой, фосфором, азотом, углеродом.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
El’nore Christopher
5/5
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 471.
А какая ваша оценка?
Алюминий, свойства атома, химические и физические свойства
Алюминий, свойства атома, химические и физические свойства.
Поделиться в:
Al 13 Алюминий
26,9815386(8) 1s2 2s2 2p6 3s2 3p1
Алюминий — элемент периодической системы химических элементов Д.
Атом и молекула алюминия. Формула алюминия. Строение алюминия
Цена на алюминий
Изотопы и модификации алюминия
Свойства алюминия (таблица): температура, плотность, давление и пр.
Физические свойства алюминия
Химические свойства алюминия. Взаимодействие алюминия. Реакции с алюминием
Получение алюминия
Применение алюминия
Таблица химических элементов Д.И. Менделеева
Атом и молекула алюминия. Формула алюминия. Строение алюминия:
Алюминий (лат. Aluminium, от лат. alumen – «квасцы») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Al и атомным номером 13. Расположен в 13-й группе (по старой классификации – главной подгруппе третьей группы), третьем периоде периодической системы.
Алюминий – амфотерный металл. Относится к группе лёгких, цветных металлов.
Алюминий обозначается символом Al.
Как простое вещество алюминий при нормальных условиях представляет собой лёгкий металл серебристо-белого цвета.
Молекула алюминия одноатомна.
Химическая формула алюминия Al.
Электронная конфигурация атома алюминия 1s2 2s2 2p6 3s2 3p1. Потенциал ионизации (первый электрон) атома алюминия равен 577,54 кДж/моль (5,985769(3) эВ). прием алюминия
Строение атома алюминия. Атом алюминия состоит из положительно заряженного ядра (+13), вокруг которого по трем оболочкам движутся 13 электронов.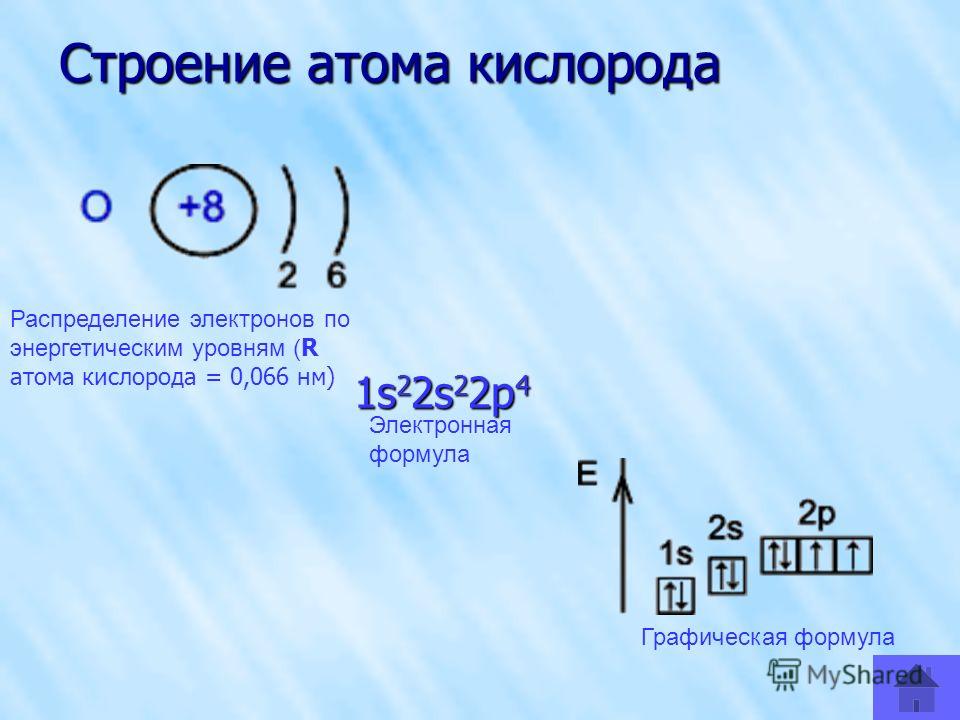 При этом 10 электронов находятся на внутреннем уровне, а 3 электрона – на внешнем. Поскольку алюминий расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома алюминия находятся два спаренных – на s-орбитали и один неспаренный – на p-орбитали электроны. В свою очередь ядро атома алюминия состоит из 13 протонов и 14 нейтронов.
При этом 10 электронов находятся на внутреннем уровне, а 3 электрона – на внешнем. Поскольку алюминий расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома алюминия находятся два спаренных – на s-орбитали и один неспаренный – на p-орбитали электроны. В свою очередь ядро атома алюминия состоит из 13 протонов и 14 нейтронов.
Радиус атома алюминия (вычисленный) составляет 118 пм.
Атомная масса атома алюминия составляет 26,9815386(8) а. е. м.
Алюминий – наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Концентрация алюминия в земной коре составляет 8,1 %.
Алюминий, свойства атома, химические и физические свойства
Изотопы и модификации алюминия:
Свойства алюминия (таблица): температура, плотность, давление и пр.
 :
:Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Алюминий |
| 102 | Прежнее название | |
| 103 | Латинское название | Aluminium |
| 104 | Английское название | Aluminium, Aluminum (в США и Канаде) |
| 105 | Символ | Al |
| 106 | Атомный номер (номер в таблице) | 13 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, лёгкий, цветной металл |
| 109 | Открыт | Ханс Кристиан Эрстед, Дания, 1825 г. |
| 110 | Год открытия | 1825 г. |
| 111 | Внешний вид и пр. | Мягкий, лёгкий и пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 8,1 % |
| 120 | Содержание в морях и океанах (по массе) | 5,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,005 % |
| 122 | Содержание в Солнце (по массе) | 0,006 % |
| 123 | Содержание в метеоритах (по массе) | 0,91 % |
| 124 | Содержание в организме человека (по массе) | 0,00009 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 26,9815386(8) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p1 |
| 203 | Электронная оболочка | K2 L8 M3 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 118 пм |
| 205 | Эмпирический радиус атома* | 125 пм |
| 206 | Ковалентный радиус* | 121 пм |
| 207 | Радиус иона (кристаллический) | Al3+ 53 (4) пм, 67,5 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 184 пм |
| 209 | Электроны, Протоны, Нейтроны | 13 электронов, 13 протонов, 14 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 13-ая группа (по старой классификации – главная подгруппа 3-ей группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1, +2, +3 |
| 302 | Валентность | III |
| 303 | Электроотрицательность | 1,61 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 577,54 кДж/моль (5,985769(3) эВ) |
| 305 | Электродный потенциал | Al3+ + 3e– → Al, Eo = -1,663 В |
| 306 | Энергия сродства атома к электрону | 41,762(5) кДж/моль (0,43283(5) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 2,70 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 2,375 г/см3 (при температуре плавления 660,32 °C и иных стандартных условиях, состояние вещества – жидкость), 2,289 г/см3 (при 1000 °C и иных стандартных условиях, состояние вещества –жидкость) |
| 402 | Температура плавления* | 660,32 °C (933,47 K, 1220,58 °F) |
| 403 | Температура кипения* | 2470 °C (2743 K, 4478 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 10,71 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 284 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,903 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 24,20 Дж/(K·моль) |
| 411 | Молярный объём | 9,993 см³/моль |
| 412 | Теплопроводность | 237 Вт/(м·К) (при стандартных условиях), 237 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 4,050 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 394 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7429-90-5 |
Примечание:
205* Эмпирический радиус атома алюминия согласно [1] и [3] составляет 143 пм.
206* Ковалентный радиус алюминия согласно [1] и [3] составляет 121±4 пм.
401* Плотность алюминия согласно [3] и [4] составляет 2,6989 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 2,699 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления алюминия согласно [3] составляет 660 °C (933,15 K, 1220 °F).
403* Температура кипения алюминия согласно [3] составляет 2518,82 °C ( 2792 K, 4565,88 °F).
407 * Удельная теплота плавления (энтальпия плавления ΔHпл) алюминия согласно [3] и [4] составляет 10,75 кДж/моль и 10,8 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) алюминия согласно [3] и [4] составляет 284,1 кДж/моль и 293 кДж/моль соответственно.
410* Молярная теплоёмкость алюминия согласно [3] составляет 24,20 Дж/(K·моль) и 24,35 Дж/(K·моль).
Физические свойства алюминия:
Химические свойства алюминия.
 Взаимодействие алюминия. Реакции с алюминием:
Взаимодействие алюминия. Реакции с алюминием:
Получение алюминия:
Применение алюминия:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28.
 Никель
Никель - 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62.
 Самарий
Самарий - 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95.
 Америций
Америций - 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Aluminium
- https://de.wikipedia.org/wiki/Aluminium
- https://ru.wikipedia.org/wiki/Алюминий
- http://chemister.
 ru/Database/properties.php?dbid=1&id=222
ru/Database/properties.php?dbid=1&id=222 - https://chemicalstudy.ru/alyuminiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
алюминий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле алюминия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 756
сколько электронов у алюминия?
Химия Электроны
Дэррил М.
мне нужно знать сколько электронов у алюминия
Подписаться І 4
Подробнее
Отчет
4 ответа от опытных наставников
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Эрин Д. ответил 05.12.12
Репетитор
4.9 (13)
Эффективное, превосходное обучение для подростков и взрослых
Смотрите таких репетиторов
Смотрите таких репетиторов
Если вы посмотрите на периодическую таблицу, атомный номер Al равен 13, поэтому он должен иметь 13 протонов (+1) и, следовательно, 13 электронов (-1), чтобы сбалансировать заряд.
Голосовать за 1 голос против
Подробнее
Отчет
Кэти Э. ответил 27.12.12
ответил 27.12.12
Репетитор
4.9 (27)
«Великий наставник с уникальным чувством преподавания»
Смотрите таких наставников
Смотрите таких репетиторов
Чтобы определить количество электронов в элементе, вам нужна только таблица Менделеева. Определите атомный номер (наименьшее из двух чисел в рамке). Это число будет числом протонов, которое также является числом электронов.
Голосовать за 0 голос против
Подробнее
Отчет
Эрик Ф. ответил 07.12.12
Репетитор
0 (0)
Превосходное репетиторство по естественным наукам
См. таких репетиторов
таких репетиторов
Смотрите таких репетиторов
Эрин Д. права, но почему? Убедитесь, что вы узнали «почему», стоящее за этим, чтобы вы могли ответить на другие подобные вопросы.
Атомы всех элементов состоят из трех первичных частиц: протонов, нейтронов и электронов. Каждая из «субатомных» частиц имеет определенные свойства, такие как размер, электрический заряд и т. д., которые имеют решающее значение для стабильности атома. Частицы распадаются следующим образом:
Места заряда относительного размера. » атом)
Нейтрон 1 0 в ядре Должен быть сообщен или дан (т. е. может варьироваться – изотопы –
Для малых элементов наиболее распространенная форма часто
состоит из изотопа, где #protons = #Neutrons)
, поэтому алюминий имеет 13 электронов, потому что ему нужны 13 отрицательных зарядов, чтобы сбалансировать 13 постепенно заряженных протонов (что является периодической таблицей это содержит). Это сделает атом алюминия электрически нейтральным.
Это сделает атом алюминия электрически нейтральным.
Что, если бы у меня были атомы азота (N) или урана (U)?
Эти атомы должны иметь 7 и 92 электрона соответственно. Почему? Посмотрите, можете ли вы использовать приведенный выше материал и выяснить «почему», и вы будете готовы к любым подобным вопросам.
Голосовать за 0 голос против
Подробнее
Отчет
Майкл М. ответил 05.12.12 9+3, ионная форма алюминия, +3 означает, что ваш атом алюминия имеет положительный заряд 3, что означает, что у него на три электрона меньше, чем у неионного атома алюминия.
, поэтому в этом случае ваш ответ будет 10 электронов.
Голосовать за 0 голос против
Подробнее
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Chem4Kids.com: Алюминий: информация об орбитах и соединениях
Посмотрите на доску. В этом поле слева есть вся информация, которую вам нужно знать об одном элементе. Он сообщает вам массу одного атома, сколько частей внутри и где он должен быть помещен в периодической таблице.
В следующем разделе мы рассмотрим электронные орбитали или электронные оболочки. Это может быть новой темой для некоторых из вас.
Это может быть новой темой для некоторых из вас.
Взгляните на картинку ниже. Каждый из этих цветных шаров является электроном. В атоме электроны вращаются вокруг центра, также называемого ядром. Электроны любят быть отдельными снаряды/орбитали . Оболочка номер один может содержать только 2 электрона, оболочка номер два может содержать 8, а для первых восемнадцати элементов оболочка номер три может содержать максимум восемь электронов. Когда вы узнаете об элементах с более чем восемнадцатью электронами, вы обнаружите, что третья оболочка может содержать больше восьми. Как только одна оболочка заполнена, следующий добавленный электрон должен перейти на следующую оболочку.
Итак… для элемента АЛЮМИНИЙ вы уже знаете, что атомный номер говорит вам о количестве электронов. Это означает, что в атоме алюминия 13 электронов. Глядя на картинку, вы можете видеть, что на первой оболочке два электрона, на второй — восемь, а на третьей — три.
► Подробнее об истории и местах, где можно найти алюминий.
► Следующий элемент периодической таблицы.
- Скажи/Найди
- Орбитали/связи
- Предыдущий элемент
- Следующий элемент
- Список элементов
- Периодическая таблица
- Дополнительные темы

 Никель
Никель Самарий
Самарий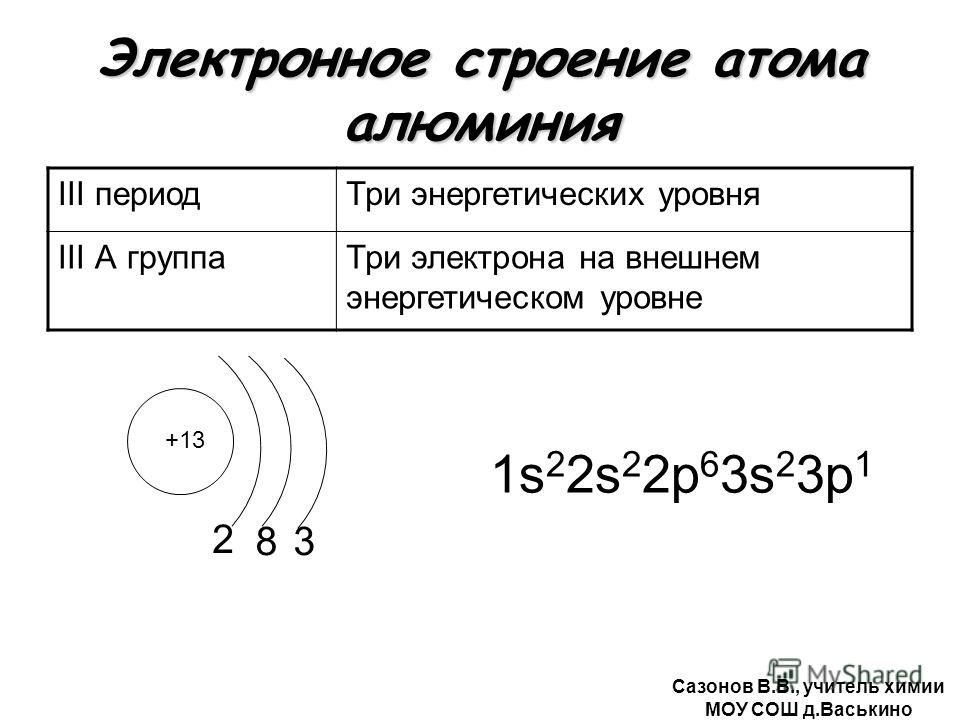 Америций
Америций ru/Database/properties.php?dbid=1&id=222
ru/Database/properties.php?dbid=1&id=222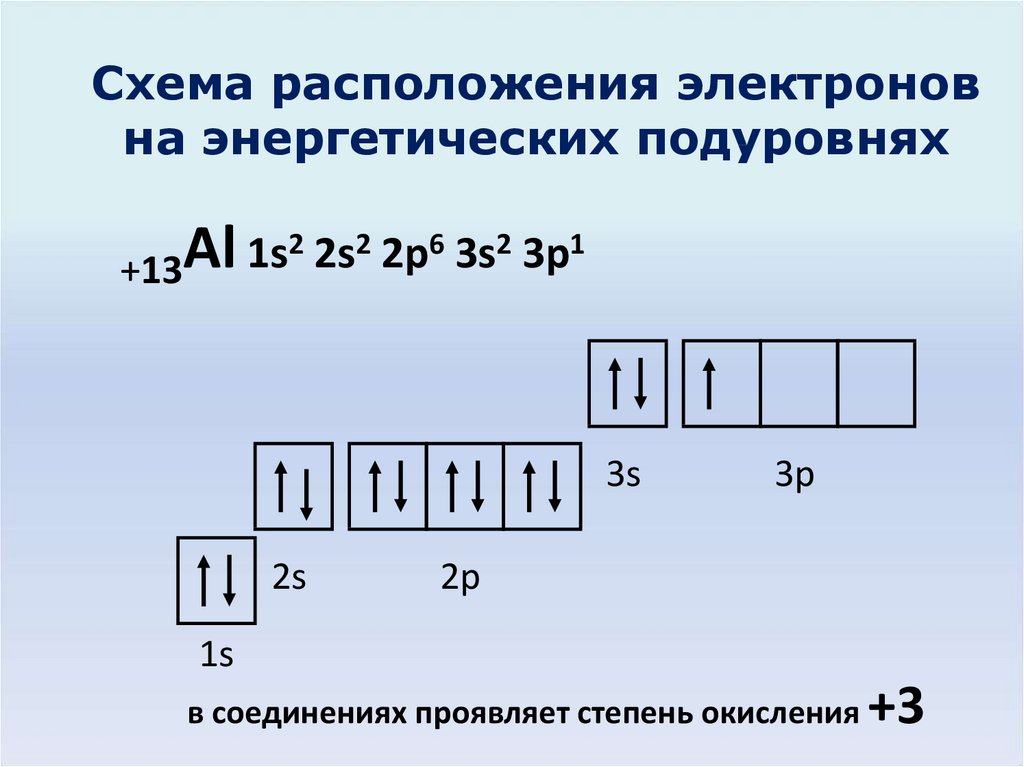 Название трифторид означает, что участвуют три атома фтора.
Название трифторид означает, что участвуют три атома фтора.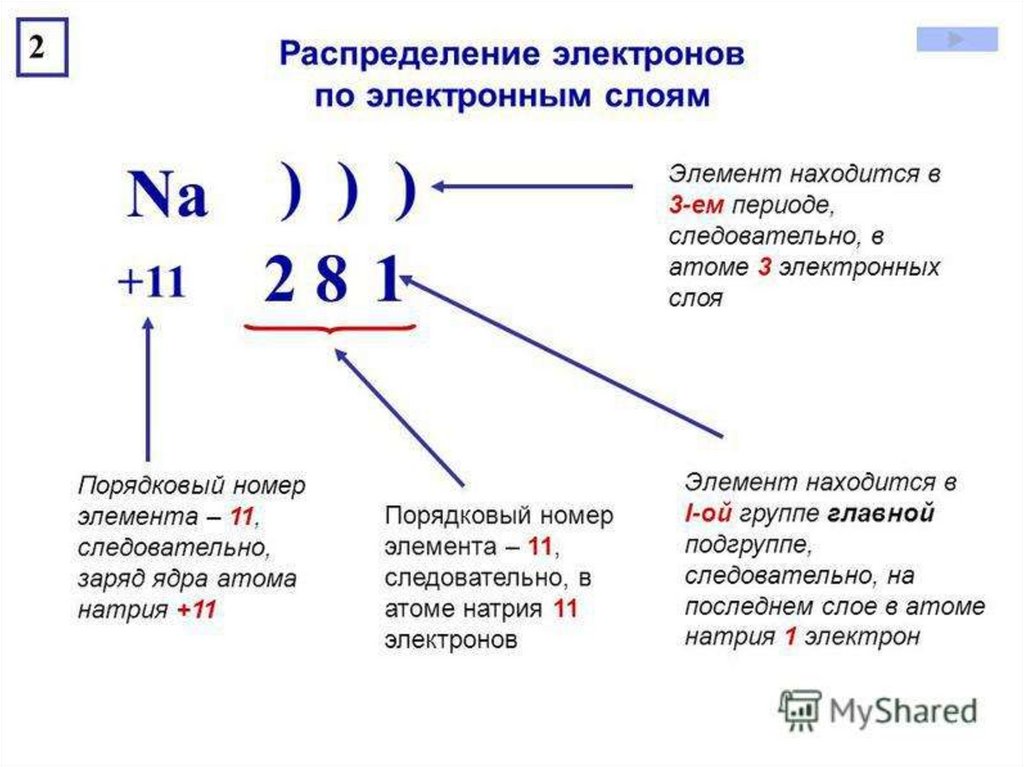
Leave A Comment