Реальный ЕГЭ по химии 2020. Задание 31
Представляем вашему вниманию задание 31 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с подробными текстовыми решениями и ответами.
Реальный ЕГЭ 2020. Задание 31. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: хромат калия, сернистый газ, нитрит калия, хлор, ацетат серебра (I), хлорид кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещество, раствор которого окрашен. Запишите молекулярное, полное и сокращённое ионное уравнения реакции обмена с участием выбранного вещества, которая сопровождается выпадением осадка.
Развернуть/свернуть решениеK2CrO4 + 2CH3COOAg = 2CH3COOK + Ag2CrO4↓
2K+ + CrO42- + 2CH3COO— + 2Ag+ = 2CH
CrO42- + 2Ag+ = Ag2CrO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: дигидрофосфат натрия, перманганат калия, азотная кислота, фосфин, сульфид меди (II), гидроксид стронция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
3NaH2PO4 + 3Sr(OH)2 = Sr3(PO4)2↓ + Na3PO4 + 6H2O
3Na+ + 3H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + 3Na+ + PO43- + 6H2O
3H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + PO43- + 6H2O
или
2NaH2PO4 + 3Sr(OH)2 = Sr3(PO4)2↓ + 2NaOH + 4H2O
2Na+ + 2H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + 2Na+ + 2OH— + 4H2O
2H2PO4— + 3Sr2+ + 4OH— = Sr3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 3
Задание 31. Вариант 3
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), сероводород, ацетат аммония, оксид железа (III), оксид хрома (VI). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без выделения газа и без выпадения осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеHNO3 + CH3COONH4 = CH3COOH + NH4NO3
H+ + NO3— + CH3COO— + NH4+ = CH3COOH + NH4+ + NO3—
H+ + CH3COO
Реальный ЕГЭ 2020. Задание 31. Вариант 4
- Для выполнения задания используйте следующий перечень веществ: силикат натрия, нитрит калия, дихромат калия, серная кислота, иодид калия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеNa2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4
2Na+ + SiO32- + 2H+ + SO42- = H2SiO3↓ + 2Na+ + SO42-
2H+ + SiO32- = H2SiO3↓
Реальный ЕГЭ 2020. Задание 31. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид калия, гидрокарбонат кальция, пероксид водорода, серная кислота, иодид калия.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка, но без выделения газа. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
2KOH + Ca(HCO3)2 = CaCO3↓ + K2CO3 + 2H2O
2K+ + 2OH— + Ca2+ + 2HCO3— = CaCO3↓ + 2K+ + CO32- + 2H2O
2OH— + Ca2+ + 2HCO3— = CaCO3↓ + CO32- + 2H2O
Реальный ЕГЭ 2020. Задание 31.
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид хрома (III), хлор, сульфит аммония, бромоводород, гидроксид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без выпадения осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение(NH4)2SO3 + 2HBr = 2NH4Br + SO2↑ + H2O
2NH4+
SO32- + 2H+ = SO2↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид железа (II), пероксид водорода, дигидрофосфат магния, серная кислота, гидроксид калия.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение3Mg(H2PO4)2 + 12KOH = Mg3(PO4)2↓ + 4K3PO4 + 12H2O
3Mg2+ + 6H2PO4— + 12K+ + 12OH— = Mg3(PO4)2↓ + 12K+ + 4PO43- + 12H2O
3Mg2+ + 6H2PO4— + 12OH— = Mg3
Как ни странно, была защитана реакция с образованием осадка гидроксида магния и дигидрофосфата калия (что на самом деле маловероятно в щелочной среде). Поэтому привожу вам эту реакцию:
Mg(H2PO4)2 + 2KOH = Mg(OH)2↓ + 2KH2PO4
Mg2+ + 2H2PO4— + 2K+ + 2OH— = Mg(OH)2↓ + 2K+ + 2H2PO4—
Mg2+ + 2OH— = Mg(OH)2↓
Реальный ЕГЭ 2020. Задание 31.
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, гидроксид железа (II), хлорат калия, ацетат серебра (I), оксид хрома (III), сероводород. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
HNO3 + CH3COOAg = AgNO
H+ + NO3— + CH3COO— = Ag+ + NO3— + CH3COOH
H+ + CH3COO— = CH3COOH
Реальный ЕГЭ 2020. Задание 31. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: серная кислота, гидрокарбонат бария, сульфат калия, оксид меди (I), оксид марганца (IV), гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества одного класса, реакция ионного обмена между которыми протекает с выпадением белого осадка и без выделения газа. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеBa(HCO3)2 + K2SO4 = BaSO4↓ + 2KHCO3
Ba2+ + 2HCO3— + 2K+ + SO42- = BaSO4↓ + 2K+ + 2HCO3—
Ba2+ + SO42- = BaSO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 10
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, гидросульфат натрия, оксид железа (II), пероксид водорода, гидроксид хрома (III), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением белого осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение1) 2NaHSO4 + (CH3COO)2Ba = BaSO4↓ + Na2SO4 + 2CH3COOH
2Na+ + 2HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + 2Na+ + SO42- + 2CH3COOH
2HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + SO42- + 2CH3COOH
или
2) NaHSO4 + (CH3COO)2Ba = BaSO4↓ + CH3COONa + CH3COOH
Na+ + HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + CH3COO— + Na+ + CH3COOH
HSO4— + CH3COO— + Ba2+ = BaSO4↓ + CH3COOH
Диссоциацию аниона HSO4— допустимо (хотя на мой взгляд, не желательно) записывать в виде H+ + SO42- (другие кислые ионы так расписывать НЕЛЬЗЯ). С учётом этого, можно было записать эти уравнения по-другому:
С учётом этого, можно было записать эти уравнения по-другому:
1) 2NaHSO4 + (CH3COO)2Ba = BaSO4↓ + Na2SO4 + 2CH3COOH
2Na+ + 2H+ + 2SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + 2Na+ + SO42- + 2CH3COOH
2H+ + SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + 2CH3COOH
или
2) NaHSO4 + (CH3COO)2Ba = BaSO4↓ + CH3COONa + CH3COOH
Na+ + H+ + SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + CH3COO— + Na+ + CH3COOH
H+ + SO42- + CH3COO— + Ba2+ = BaSO4↓ + CH3COOH
Реальный ЕГЭ 2020. Задание 31. Вариант 11
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сульфит калия, аммиак, нитрат серебра (I), перманганат калия, дигидрофосфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением белого осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение3KH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + K3PO4 + 6H2O
3K+ + 3H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 3K+ + PO43- + 6H2O
3H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + PO43- + 6H2O
или
2KH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 2KOH + 4H2O
2K+ + 2H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 2K+ + 2OH— + 4H2O
2H2PO4— + 3Ba2+ + 4OH— = Ba3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 12
Задание 31. Вариант 12
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, сульфит калия, сульфат железа (II), дихромат калия, фосфат кальция, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без выпадения осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеMg(HCO3)2 + H2SO4 = MgSO4 + 2CO2↑ + 2H2O
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2CO2↑ + 2H2O
HCO3— + H+ = CO2↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 13
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, иодоводород, гидроксид бария, серная кислота, сульфит аммония, гидрофосфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение2Na2HPO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 4NaOH + 2H2O
4Na+ + 2HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 4Na+ + 4OH— + 2H2O
2HPO42- + 3Ba2+ + 2OH— = Ba3(PO4)2↓ + 2H2O
или
6Na2HPO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 4Na3PO4 + 6H2O
12Na+ + 6HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 12Na+ + 4PO43- + 6H2O
6HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 4PO43- + 6H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 14
Задание 31. Вариант 14
- Для выполнения задания используйте следующий перечень веществ: хромат натрия, бромид натрия, нитрит натрия, серная кислота, ацетат серебра (I), хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещество, раствор которого окрашен. Запишите молекулярное, полное и сокращённое ионное уравнения реакции обмена с участием выбранного вещества, которая сопровождается выпадением осадка.
Развернуть/свернуть решениеNa2CrO4 + 2CH3COOAg = 2CH3COONa + Ag2CrO4↓
2Na+ + CrO42- + 2CH3COO— + 2Ag+ = 2CH3COO— + 2Na+ + Ag2CrO4↓
CrO42- + 2Ag+ = Ag2CrO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 15
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид лития, бром, сульфит аммония, хлороводород, нитрат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение2LiOH + (NH4)2SO3 = Li2SO3 + 2NH3∙H2O
2Li+ + 2OH— + 2NH4+ + SO32- = 2Li+ + SO32- + 2NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 16
- Для выполнения задания используйте следующий перечень веществ: ацетат аммония, гидроксид натрия, перманганат натрия, хлороводород, нитрит натрия, оксид марганца (IV).
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеCH3COONH4 + NaOH = CH3COONa + NH3∙H2O
CH3COO— + NH4+ + Na+ + OH— = CH3COO— + Na+ + NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 17
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, нитрит магния, сульфат железа (II), хромат калия, гидроксид меди (II), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без видимых изменений. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеH2SO4 + Mg(NO2)2 = MgSO4 + 2HNO2
2H+ + SO42- + Mg2+ + 2NO2— = Mg2+ + SO42- + 2HNO2
H+ + NO2— = HNO2
Реальный ЕГЭ 2020. Задание 31. Вариант 18
- Для выполнения задания используйте следующий перечень веществ: нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
K2S + (CH3COO)2Fe = FeS↓ + 2CH3COOK
2K+ + S2- + 2CH3COO— + Fe2+ = FeS↓ + 2CH3COO— + 2K+
Fe2+ + S2- = FeS↓
Реальный ЕГЭ 2020. Задание 31. Вариант 19
- Для выполнения задания используйте следующий перечень веществ: пероксид водорода, сульфид цинка, гидроксид калия, гидроксид хрома(III), сульфат аммония, хлорид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение2KOH + (NH4)2SO4 = K2SO4 + 2NH3∙H2O
2K+ + 2OH— + 2NH4+ + SO42- = 2K+ + SO42- + 2NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 20
- Для выполнения задания используйте следующий перечень веществ: перманганат натрия, соляная кислота, сульфит натрия, хлорид бария, гидросульфат калия, бром. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без выделение газа, причём одно из реагирующих веществ является кислой солью. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
1) KHSO4 + BaCl2 = BaSO4↓ + KCl + HCl
K+ + HSO4— + Ba2+ + 2Cl— = BaSO4↓ + K+ + H+ + 2Cl—
HSO4— + Ba2+ = BaSO4↓ + H+
или
2) 2KHSO4 + BaCl2 = K2SO4 + BaSO4↓ + 2HCl
2K+ + 2HSO4— + Ba2+ + 2Cl— = 2K+ + SO42- + BaSO4↓ + 2H+ + 2Cl—
2HSO4— + Ba2+ = SO42- + BaSO4↓ + 2H+
Диссоциацию аниона HSO4— допустимо (хотя на мой взгляд, не желательно) записывать в виде H+ + SO42- (другие кислые ионы так расписывать НЕЛЬЗЯ). С учётом этого, можно было записать эти уравнения по-другому:
1) KHSO4 + BaCl2 = BaSO4↓ + KCl + HCl
K+ + H+ + SO42- + Ba2+ + 2Cl— = BaSO4↓ + K+ + H+ + 2Cl—
SO42- + Ba2+ = BaSO4↓
2) 2KHSO4 + BaCl2 = K2SO4 + BaSO4↓ + 2HCl
2K+ + 2H+ + 2SO42- + Ba2+ + 2Cl— = 2K+ + SO42- + BaSO4↓ + 2H+ + 2Cl—
SO42- + Ba2+ = BaSO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 21
Вариант 21
- Для выполнения задания используйте следующий перечень веществ: сульфид железа(II), гидроксид калия, перманганат калия, серная кислота, нитрит калия, гидрокарбонат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеFeS + H2SO4 = FeSO4 + H2S↑
FeS + 2H+ + SO42- = Fe2+ + SO42- + H2S↑
FeS + 2H+ = Fe2+ + H2S↑
Реальный ЕГЭ 2020. Задание 31. Вариант 22
- Для выполнения задания используйте следующий перечень веществ: серная кислота, дихромат калия, сульфид меди(II), фосфин, гидроксид бария, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение2CH3COONH4 + Ba(OH)2 = (CH3COO)2Ba + 2NH3↑ + 2H2O
2CH3COO— + 2NH4+ + Ba2+ + 2OH— =2CH3COO— + Ba2+ + 2NH3↑ + 2H2O
NH4+ + OH— =NH3↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 23
- Для выполнения задания используйте следующий перечень веществ: сульфид меди(II), сера, цинк, азотная кислота, гидрокарбонат аммония, ацетат кальция.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеNH4HCO3 + HNO3 =NH4NO3 + CO2↑ + H2O
NH4+ + HCO3— + H+ + NO3— = NH4+ + NO3— + CO2↑ + H2O
H+ + HCO3— = CO2↑ + H2O
Резерв
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: силикат калия, нитрит натрия, дихромат натрия, серная кислота, бромид натрия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеK2SiO3 + H2SO4 = H2SiO3↓ + K2SO4
2K+ + SiO32- +2H+ + SO42- = H2SiO3↓ + 2K+ + SO42-
2H+ + SiO32- = H2SiO3↓
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: нитрит калия, перманганат калия, серная кислота, гидроксид калия, нитрат аммония, сульфид железа(II).
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеNH4NO3 + KOH = KNO3 + NH3∙H2O
NH4+ + NO3— + K+ + OH— = K+ + NO3— + NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 3
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, соляная кислота, сульфит калия, нитрат бария, гидросульфат аммония, йод. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль, а в результате реакции газ не образуется. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеNH4HSO4 + Ba(NO3)2 = BaSO4↓ + NH4NO3 + HNO3
NH4+ + HSO4— + Ba2+ + 2NO3— = BaSO4↓ + NH4+ + NO3— + H+ + NO3—
HSO4— + Ba2+ = BaSO4↓ + H+
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 4
- Для выполнения задания используйте следующий перечень веществ: сульфит бария, гидроксид натрия, перманганат натрия, серная кислота, нитрит натрия, гидрокарбонат магния.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеMg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2↑
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2↑
H+ + HCO3— = H2O + CO2↑
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: оксид серы(IV), пероксид натрия, гидрофосфат натрия, аммиак, йодоводород, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеNa2HPO4 + NaOH = Na3PO4 + H2O
2Na+ + HPO42- + Na+ + OH— = 3Na+ + PO43- + H2O
HPO42- + OH— = PO43- + H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 6
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сероводород, аммиак, оксид серы(IV), перманганат натрия, дигидрофосфат натрия. Допустимо использование водных растворов веществ.

Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль, а в результате реакции образуется белый осадок. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение2NaH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 2NaOH + 4H2O
2Na+ + 2H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 2Na+ + 2OH— + 4H2O
2H2PO4— + 3Ba2+ + 4OH— = Ba3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, оксид кремния, нитрат аммония, серная кислота, графит, фосфин. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеMg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2↑
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2↑
H+ + HCO3— = H2O + CO2↑
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 8
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), оксид марганца (IV), хлорид железа (III), сера, фторид аммония.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решениеFeCl3 + 3NH4F = FeF3↓ + 3NH4Cl
Fe3+ + 3Cl— + 3NH4+ + 3F— = FeF3↓ + 3NH4+ + 3Cl—
Fe3+ + 3F— = FeF3↓
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3— + 2K+ + 2OH— = 2Na+ + CO32- + 2K+ + CO32- + 2H2O
HCO3— + OH— = CO32- + H2O
или
NaHCO3 + 2KOH = NaOH + K2CO3 + H2O
Na+ + HCO3— + 2K+ + 2OH— = Na+ + OH— + 2K+ + CO32- + H2O
HCO3— + OH— = CO32- + H2O
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
ЕГЭ 2020 по химии. Теория и примеры заданий» src=»https://www.youtube.com/embed/videoseries?list=PLEL-sAdim5FaiqQVHd8oCDZ7GBW7e2sBQ» frameborder=»0″ allowfullscreen=»allowfullscreen» data-mce-fragment=»1″/>
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
Гидроксид калия, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.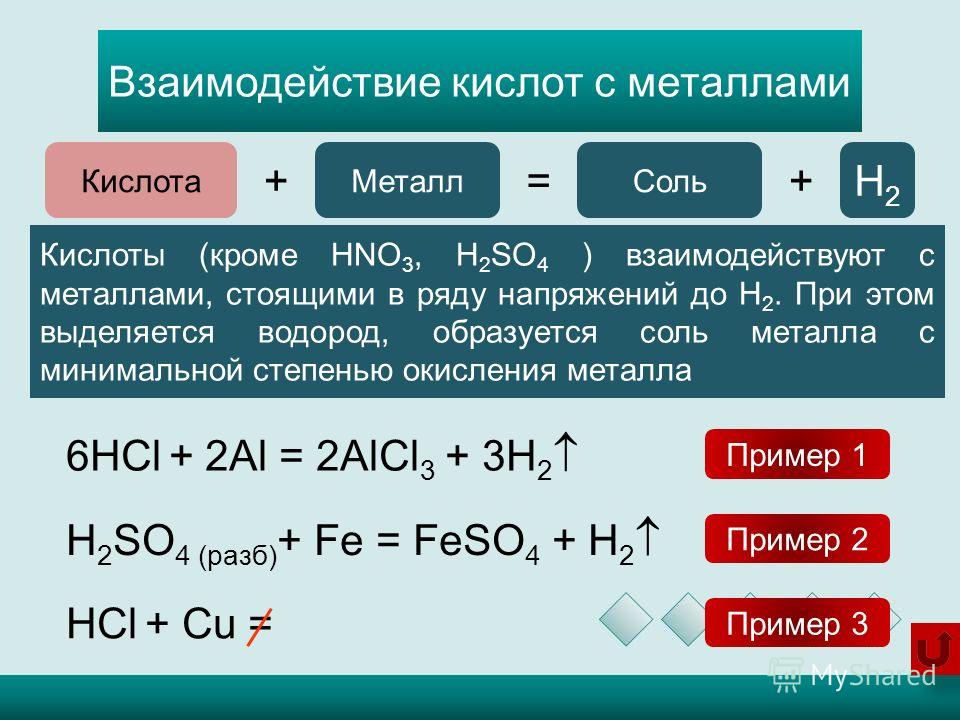
Чтобы получить подробное описание элемента, кликните по его названию.
Способы получения кислых, основных и комплексных солей — урок. Химия, 8–9 класс.
Способы получения кислых солей
1. Кислые соли образуются при взаимодействии средних солей с кислотами.
Например, если к раствору сульфата натрия добавить раствор серной кислоты, из полученного раствора можно выкристаллизовать гидросульфат натрия:
Na2SO4+h3SO4→2NaHSO4.
Нерастворимые в воде природные карбонаты (известняк и другие) в присутствии воды и углекислого газа (угольной кислоты) превращаются в растворимые гидрокарбонаты.
Например, карбонат кальция превращается в гидрокарбонат:
CaCO3+h3O+CO2⏟h3CO3→CaHCO32.
В результате этой химической реакции возрастает жёсткость природной воды, обусловленная присутствием растворимых солей кальция и магния, образуются карстовые пещеры, а также происходит разрушение коралловых рифов.
Видеофрагмент:
Взаимопревращение карбонатов и гидрокарбонатов |
2. Кислые соли образуются при неполной нейтрализации многоосновных кислот.
Например, при взаимодействии гидроксида натрия с серной кислотой в соотношении количества вещества \(1 : 1\) образуется гидросульфат натрия:
NaOH+h3SO4→NaHSO4+h3O.
Если гидроксид кальция взаимодействует с фосфорной (ортофосфорной) кислотой в
соотношении количества вещества \(1 : 2\), образуется дигидрофосфат кальция:
CaOh3+2h4PO4→Cah3PO42+2h3O.
3. Кислые соли образуются при действии избытка кислотного оксида на основание.
Например, если гидроксид натрия реагирует с оксидом углерода(\(IV\)) в соотношении количества вещества \(1 : 1\), образуется гидрокарбонат натрия:
NaOH+CO2→NaHCO3.
Способы получения основных солей
1. Основные соли образуются при взаимодействии щелочей с растворимыми в воде солями.Например, если смешать растворы хлорида кальция и гидроксида кальция, из полученного раствора можно выкристаллизовать гидроксохлорид кальция:
CaOh3+CaCl2→2CaOHCl.
2. Основные соли образуются при взаимодействии избытка основания с кислотой.
CaOh3+HCl→CaOHCl+h3O.
3. Гидроксокарбонат меди(\(II\)), свинца(\(II\)), цинка и некоторых других металлов образуется при взаимодействии растворов солей этих металлов с растворами карбонатов.
Например, при взаимодействии раствора сульфата меди(\(II\)) (медного купороса) с раствором карбоната натрия (соды) образуется осадок гидроксокарбоната меди:
2CuSO4+2Na2CO3+h3O→CuOh3CO3↓+CO2↑+2Na2SO4.
Видеофрагмент:
Получение основного карбоната меди |
Получение комплексных солей
1. Комплексные соли образуются при действии растворов щелочей на амфотерные гидроксиды.Например, при действии раствора гидроксида калия на гидроксид цинка образуется тетрагидроксоцинкат калия:
2KOH+ZnOh3→K2ZnOh5.
При действии разбавленного раствора гидроксида натрия на гидроксид алюминия образуется тетрагидроксоалюминат натрия:
NaOH+AlOh4→NaAlOh5.
2. Ещё один способ получения комплексных солей — действие растворов щелочей на амфотерные оксиды.
Например, при действии раствора гидроксида натрия на оксид цинка образуется тетрагидроксоцинкат натрия:
2NaOH+ZnO+h3O→Na2ZnOh5.
Комплексные соли образуются также при растворении в щёлочи цинка или алюминия.
Одним из продуктов реакции в этом случае является водород:
2NaOH+Zn+2h3O→Na2ZnOh5+h3↑,
2NaOH+2Al+6h3O→2NaAlOh5+3h3↑.
Проверочная работа «Сера и её соединения»
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 1
Часть А. Задания с выбором одного правильного ответа (10 баллов)
Для серы характерна степень окисления:
1. -2 2. -3 3. -4 4. +7
Сера – более сильный окислитель, чем
1. Фтор 2. Хлор 3. Фосфор 4. Кислород
Степени окисления серы изменяются в последовательности +6, -2, 0 в группе веществ
1. S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S
Схема превращения S+6 → S+4 соответствует уравнению реакции
1. SO3 + h3O → h3SO4 3. h3SO4 + Zn → ZnSO4 + h3
2. 2SO2 + O2 → 2SO3 4. Cu + 2h3SO4 → CuSO4 + SO2 + 2h3O
Раствор серной кислоты может взаимодействовать со всеми веществами группы
1. MgO, CO2, NaCl, Fe(OH)3 3. NaOH, ZnO, Cu, Na2CO3
2. CuO, Fe, HNO3, NaOH Mg(OH)2, 4. BaCl2, FeO, Zn, KOH
И сернистый газ, и оксид серы (VI) будут реагировать со следующей парой веществ
1. Н2О и СО2 2. NaOH и CaO 3. h3O и Cl2 4. h3S и О2
Для осуществления превращения H2S→SO2→SO3→ K2SO4 нужно последовательно использовать
1. Воду, кислород, оксид калия 3. Кислород, воду, калий
2. Кислород, кислород, гидроксид калия 4. Воду, кислород, карбонат калия
Кислород, кислород, гидроксид калия 4. Воду, кислород, карбонат калия
Качественную реакцию на сульфат-анион можно представить сокращённым ионным уравнением
1. 2H+ + SO42- → h3SO4 2. Cu2+ + SO42- → CuSO4 3. Ba2+ + SO42- → BaSO4 4. S2- + 2H+ → h3S
Газ с запахом тухлых яиц, образующий при растворении в воде слабую кислоту, называется
1. Сернистый 2. Угарный 3. Сероводород 4. Хлор
Верны ли следующие утверждения о свойствах серы и её соединений?
А. Самой устойчивой аллотропной модификацией серы является ромбическая.
Б. Чтобы приготовить раствор серной кислоты, нужно в концентрированную кислоту вливать воду.
1. Верно А 2. Верно Б 3. Оба суждения верны 4. Оба суждения неверны
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11. В ряду S – Se – Te
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции |
1 | h3S + O2 (избыток) → | 1 | не взаимодействует |
2 | Ag + h3SO4 (разб) → | 2 | h3O + S |
3 | SO2 + NaOН(избыток) → | 3 | NaHSO3 |
4 | Fe + S → | 4 | Na2SO3 + h3O |
| 5 | Ag2SO4 + h3↑ | |
6 | Fe2S3 | ||
7 | h3O + SO2↑ | ||
8 | FeS | ||
Часть С Задания со свободным ответом (10 баллов)
(4 балла) Через 240 г 10% раствора гидроксида натрия пропускают сернистый газ объёмом 5,6 л. Определить массу полученной соли. (Ответ: 31,5 г.)
Определить массу полученной соли. (Ответ: 31,5 г.)
( 5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
S → h3S → Na2S → PbS Для последней реакции составьте уравнение в сокращённой ионной форме, укажите цвет образовавшегося осадка.
(3 балла) Для реакции h3SO4(конц.) + Zn → …. + h3S + h3O определить коэффициенты методом
электронного баланса, указать окислитель и восстановитель.
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 2
Часть А. Задания с выбором одного правильного ответа (10 баллов)
Для серы нехарактерна степень окисления:
1. -2 2. -4 3. +4 4. +6
Сера является восстановителем в реакции с:
1. Фтором 2. Железом 3. Натрием 4. Водородом
Степени окисления серы изменяются в последовательности +6, +4, -2 в группе веществ
1. S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S
Схема превращения S+6 → S-2 соответствует уравнению реакции
1. SO3 + h3O → h3SO4 3. h3SO4 + Zn → ZnSO4 + h3S + h3O
2. 2SO2 + O2 → 2SO3 4. Cu + 2h3SO4 → CuSO4 + SO2 + 2h3O
Раствор серной кислоты может взаимодействовать со всеми веществами группы
1. MgO, SO2, NaCl, Fe(OH)3 3. Fe(OH)3, CaO, Zn, K2SO3
2. CuO, Ag, HNO2, NaOH 4. Ba(OH)2, NaCl, FeO, Zn
И сернистый газ, и серная кислота будут реагировать со следующей парой веществ
1. Н2О и СО2 2. КOH и MgO 3. h3O и SO3 4. Na2S и О2
Для осуществления превращения S→SO2→SO3→ BaSO4 нужно последовательно использовать
1. Воду, кислород, оксид бария 3. Кислород, кислород, гидроксид бария
Воду, кислород, оксид бария 3. Кислород, кислород, гидроксид бария
2. Кислород, кислород, нитрат бария 4. Воду, кислород, нитрат бария
Качественную реакцию на сульфит-анион можно представить сокращённым ионным уравнением
1. Pb2+ + S2-→PbS 2. Cu2+ + SO42- → CuSO4 3. Ba2+ + SO42- → BaSO4 4. 2H+ + SO32- → SO2 + h3O
Газ с запахом горящих спичек, образующий при растворении в воде слабую кислоту, называется
1. Сернистый 2. Угарный 3. Сероводород 4. Фтор
Верны ли следующие утверждения о свойствах серы и её соединений?
А. Пластическую серу можно получить при нагревании и последующем охлаждении ромбической серы.
Б. Раствор сернистого газа в концентрированной серной кислоте называется «олеум».
1. Верно А 2. Верно Б 3. Оба суждения верны 4. Оба суждения неверны
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11. В ряду Р – S – Cl
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции |
1 | h3S + O2 (недостаток) → | 1 | не взаимодействует |
2 | Au + h3SO4 (разб) → | 2 | h3O + S |
3 | SO3 + NaOН(избыток) → | 3 | NaHSO4 |
4 | Fe + h3SO4 (разб) → | 4 | Na2SO4 + h3O |
| 5 | Au2SO4 + h3↑ | |
6 | Fe2(SO4)3 + h3↑ | ||
7 | h3O + SO2↑ | ||
8 | FeSO4 + h3↑ | ||
Часть С Задания со свободным ответом (10 баллов)
13. (4 балла) Через 1120 г 5% раствора гидроксида калия пропускают серный ангидрид объёмом 4,48 л. Определить массу полученной соли. (Ответ: 34,8 г.)
14. (5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
SО2 → SО3 → h3SО4 → ВаSО4 Для последней реакции составьте уравнение в сокращённой ионной форме, укажите цвет образовавшегося осадка.
15. (3 балла) Для реакции Mg + h3SO4 → …. + S + h3O определить коэффициенты методом электронного баланса, указать окислитель и восстановитель.
Ответы к проверочной работе по теме «Сера и её соединения» 9 класс
№ п/п | Вариант 1 | Балл | № п/п | Вариант 2 | Балл |
1 | 1 | 1 | 1 | 2 | 1 |
2 | 3 | 1 | 2 | 1 | 1 |
3 | 3 | 1 | 3 | 2 | 1 |
4 | 4 | 1 | 4 | 3 | 1 |
5 | 4 | 1 | 5 | 3 | 1 |
6 | 2 | 1 | 6 | 2 | 1 |
7 | 2 | 1 | 7 | 3 | 1 |
8 | 3 | 1 | 8 | 4 | 1 |
9 | 3 | 1 | 9 | 1 | 1 |
10 | 1 | 1 | 10 | 1 | 1 |
11 | 23 | 2 | 11 | 14 | 2 |
12 | 7148 | 2 | 12 | 2148 | 2 |
13 |
| 4 | 13 |
| 4 |
14 |
| 5 | 14 |
| 5 |
15 |
| 3 | 15 |
| 3 |
Критерий: 0-9 = 2, 10-16 =3, 17-23 = 4, 24-26 = 5
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 3
Часть А. Задания с выбором одного правильного ответа (10 баллов)
1. Распределение электронов по энергетическим уровням в атоме серы:
1) 2, 6 2) 2, 8, 8 3) 2, 8, 6 4) 2, 8, 8, 6
2. Сера — более сильный окислитель, чем:
1) фтор 2)хлор 3) фосфор 4) кислород
3. Степени окисления серы изменяются с +6 до 0 в группе веществ:
1)S, SO2, SO3 2) h3SO4, SO2, h3S 3) Na2SO4, K2S, S 4) SO2, K2SO3, S
4. Раствор серной кислоты может взаимодействовать со всеми веществами из группы:
1) MgO, CO2, NaCl, Fe(OH)3 3) NaOH, ZnO, Cu, Na2CO3
2) CuO, Fe, HNO3, NaOH 4) Mg(OH)2, BaCl2, FeO, Zn
5. Схеме превращения S+6 → S+4 соответствует уравнению реакции:
1) SO3 + h3O = h3SO4 3) h3SO4 + Zn = ZnSO4 + h3
2) 2SO2 + O2 = 2SO3 4) Cu +2h3SO4 = CuSO4 + SO2 + 2h3O
6. И сернистый газ, и оксид серы(VI) будут реагировать со следующей парой веществ:
1) h3O , CO2 2) NaOH, CaO 3) h3O, Cl2 4) h3S, O2
7. Для осуществления превращения H2S → SO2 → SO3→ K2SO4 нужно последовательно использовать:
1) воду, кислород, оксид калия 3) кислород, воду, калий
2) кислород, кислород. гидроксид калия 4) воду, кислород, карбонат калия
8. В реакции, уравнение которой H2SO3 + Br2 + H2O= H2SO4 + HBr , сера
1) является восстановителем 3) является окислителем
2) понижает степень окисления 4) не изменяет степень окисления
9. Разбавленная серная кислота не будет взаимодействовать с каждым веществом из следующей пары веществ:
1) CuO, HCl 2) Cu, NaCl 3) Zn, NaOH 4) CuSO4, MgO
10. Верны ли следующие утверждения о свойствах серы и её соединений?
А. Чтобы приготовить раствор серной кислоты, нужно в концентрированную кислоту вливать воду.
Б. Раствор серного ангидрида в концентрированной серной кислоте называется «олеум».
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11. В ряду S – Se – Te
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции | ||
1 | h3S + O2 (избыток) → | 1 | не взаимодействует | ||
2 | Ag + h3SO4 (разб) → | 2 | h3O + S | ||
3 | SO2 + NaOН(избыток) → | 3 | NaHSO3 | ||
4 | Fe + S → | 4 | Na2SO3 + h3O | ||
| 5 | Ag2SO4 + h3↑ | |||
6 | Fe2S3 | ||||
7 | h3O + SO2↑ | ||||
8 | FeS | ||||
Часть С Задания со свободным ответом (10 баллов)
(4 балла) Через 120 г 20% раствора гидроксида натрия пропускают сернистый газ объёмом 2,24 л. Определить массу полученной соли.
( 5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
S → h3S → Na2S → PbS Для последней реакции составьте уравнение в полной и сокращённой ионной форме, укажите цвет образовавшегося осадка.
(3 балла) Для реакции h3SO4 + Zn …. + h3S + h3O определить коэффициенты методом
электронного баланса, указать окислитель и восстановитель.
Ответы к диагностике по сере
3 вариант
1 | 3 | 1 |
2 | 3 | 1 |
3 | 3 | 1 |
4 | 4 | 1 |
5 | 4 | 1 |
6 | 2 | 1 |
7 | 2 | 1 |
8 | 1 | 1 |
9 | 3 | 1 |
10 | Б | 1 |
11 | 23 | 2 |
12 | 7148 | 2 |
13 |
| 4 |
14 |
| 5 |
15 |
| 3 |
ЕГЭ 2018 по химии: задания 30 и 31
Эти задания повышенного уровня сложности были введены в ЕГЭ только в 2018 году. Из пяти предложенных веществ предлагается выбрать такие, с которыми возможна окислительно-восстановительная реакция и реакция ионного обмена. Обычно вещества подобраны таким образом, что ученик может записать несколько вариантов реакции, но нужно выбрать и записать только одно уравнение из возможных.
Уместно рассмотреть задания 30 и 31 в комплексе, чтобы определить алгоритм действий и отметить типичные ошибки учащихся.
Подробно о задании № 30
Что должны уметь учащиеся?
- определять степень окисления химических элементов;
- определять окислитель и восстановитель;
- прогнозировать продукты реакции с учетом характера среды;
- составлять уравнения реакции и уравнения электронного баланса;
- расставлять коэффициенты в уравнении реакции.
ЕГЭ. Химия. Новый полный справочник для подготовки к ЕГЭ
Новый справочник содержит весь теоретический материал по курсу химии, необходимый для сдачи ЕГЭ. Он включает в себя все элементы содержания, проверяемые контрольно-измерительными материалами, и помогает обобщить и систематизировать знания и умения за курс средней (полной) школы. Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тренировочных заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к заданиям, которые помогут объективно оценить уровень своих знаний и степень подготовленности к аттестационному экзамену. Пособие адресовано старшим школьникам, абитуриентам и учителям.
КупитьЧто нужно повторить? Важнейшие окислители и восстановители (обязательно связать со степенью окисления элементов), особое внимание уделить веществам, которые могут быть либо восстановителями, либо окислителями. Не забывать о двойственности процесса: окисление всегда сопровождается восстановлением! Еще раз повторить свойства окислителей:
- Азотная кислота.Чем активнее восстановитель и меньше концентрация кислоты, тем глубже протекает восстановление азота. Вспомнить, что азотная кислота окисляет неметаллы до оксокислот.
- Серная кислота. Обратная зависимость: чем выше концентрация кислоты, тем глубже протекает процесс восстановления серы. Образуется SO2, S, h3S.
- Соединения марганца. Здесь все зависит от среды — при этом встретиться на задании может не только KMnO4, но и другие соединения, с менее выраженными свойствами окислителя. В кислой среде продуктами реакции чаще всего бывают марганец и соли: сульфаты, нитраты, хлориды и т.д. в нейтральной — восстановление до оксида марганца (бурый осадок). В сильной щелочной среде происходит восстановление до манганата калия (ярко-зеленый раствор).
- Соединения хрома. Полезно помнить окраску продуктов реакции при взаимодействии веществ с хроматами и бихроматами. Запоминаем, что хроматы существуют в щелочной среде, а бихроматы — в кислой.
- Кислородсодержащие кислоты галогенов (хлора, брома, йода). Восстановление происходит до отрицательно заряженных ионов хлора и брома, в случае с йодом — обычно до свободного йода, при действии более сильных восстановителей — до отрицательно заряженного. Повторите названия кислот и солей хлора, йода и брома — ведь в названии представлены не формулы, а названия.
- Катионы металлов в высшей степени окисления. Прежде всего, медь и железо, которые восстанавливаются до невысоких степеней окисления. Такая реакция проходит с сильными восстановителями. Не путать эти реакции с обменными!
Полезно еще раз вспомнить свойства веществ с окислительно-восстановительной двойственностью, таких как пероксид водорода, азотистая кислота, оксид серы IV, сернистая кислота, сульфиты, нитриты. Из восстановителей, вероятнее всего, вам встретятся на ЕГЭ бескислородные кислоты и их соли, гидриды щелочных и щелочноземельных металлов. Их анионы окисляются до нейтральных атомов или молекул, которые могут быть способны к дальнейшему окислению.
При выполнении задания можно описывать различные типы реакции: межмолекулярные, конпропорционирования, диспропорционирования (самоокисления и самовосстановления). А вот реакцию разложения использовать нельзя, так как в задании есть ключевые слова: «составить уравнение между реагирующими веществами».
Как оценивается задание? Раньше за указание окислителя и восстановителя и за запись электронного баланса давалось по 1 баллу, теперь — за сумму этих элементов дается максимум 1 балл. Максимум за задание — 2 балла, при условиях правильной записи уравнения реакции.
Подробно о задании 31
Что нужно повторить?
- Правило составления реакции. Формулы сильных электролитов (сильных кислот, щелочей, растворимых средних солей) записываются в виде ионов, а формулы нерастворимых кислот, оснований, солей, слабых электролитов — в недиссоциированной форме.
- Условия протекания.
- Правила записи.Если записываем ион, то сначала указываем величину заряда, потом знак: обратить на это внимание. Степень окисления записывается наоборот: сначала знак, потом величина. Важно, что данная реакция протекает не просто в сторону связывания ионов, а наиболее полного связывания ионов. Это важно, потому что некоторые сульфиды, например, взаимодействуют со слабыми кислотами, а с некоторыми нет, и это связано со степенью прочности связей между элементами внутри соединений.
ЕГЭ. Химия. Большой сборник тематических заданий по химии для подготовки к ЕГЭ
Вниманию школьников и абитуриентов впервые предлагается учебное пособие для подготовки к ЕГЭ по химии, которое содержит тренировочные задания, собранные по темам. В книге представлены задания разных типов и уровней сложности по всем проверяемым темам курса химии. Каждый из разделов пособия включает не менее 50 заданий. Задания соответствуют современному образовательному стандарту и положению о проведении единого государственного экзамена по химии для выпускников средних общеобразовательных учебных учреждений. Выполнение предлагаемых тренировочных заданий по темам позволит качественно подготовиться к сдаче ЕГЭ по химии. Пособие адресовано старшим школьникам, абитуриентам и учителям.
КупитьПримеры заданий
Пример 1. Даны: сульфат хрома (III), нитрат бария, гидроксид калия, пероксид водорода, хлорид серебра.
Задание 30. Лучше всего сразу составить формулы веществ: так будет нагляднее. Затем — внимательно их рассмотреть. Вспоминаем, что сульфат хрома в щелочной среде окисляется до хромата — и пишем уравнение реакции. Сульфат хрома является восстановителем, пероксид водорода — окислителем. Степень окисления записывается как +3.
Задание 31. Здесь возможно несколько вариантов: например, взаимодействие сульфата хрома (III) со щелочью с образованием нерастворимого осадка. Или — образование комплексной соли в избытке щелочи. Или — взаимодействие нитрата бария с сульфатом хрома. Важно выбрать один вариант, который будет для ученика наиболее безопасным и прозрачным.
Пример 2. Даны: сульфид меди (II), нитрат серебра, азотная кислота, хлороводородная кислота, фосфат калия.
Задание 30. Вероятный выбор — взаимодействие сульфида меди и азотной кислоты. Обратите внимание, что это реакция не ионного обмена, а именно окислительно-восстановительная. Сульфиды окисляются до сульфатов, в результате получается сульфат меди (II). Поскольку кислота концентрированная, наиболее вероятно протекание реакции с образованием оксида азота (IV).
Задание 31. Здесь могут возникнуть сложности. Во-первых, есть риск в качестве уравнения ионного обмена выбрать взаимодействие между сульфидом меди и хлороводородной кислотой: это неверно. А вот что можно взять, так это образование хлорида серебра при взаимодействии нитрата серебра и хлороводородной кислоты. Можно взять и взаимодействие фосфата калия и нитрата серебра (не забудьте об образовании ярко-желтого осадка).
Пример 3. Даны: перманганат калия, хлорид калия, сульфат натрия, нитрат цинка, гидроксид калия.
Задание 30. Радуйтесь: если в списке есть перманганат калия, значит, окислитель вы уже нашли. А вот его взаимодействие со щелочью, с образованием манганата и выделением кислорода — реакция, которую школьники почему-то забывают. Другие варианты реакций здесь придумать сложно.
Задание 31. Снова возможны варианты: образование гидроксида цинка или комплексной соли.
Пример 4. Даны: гидрокарбонат кальция, железная окалина, азотная кислота, соляная кислота, оксид кремния (IV).
Задание 30. Первая сложность — вспомнить, что такое железная окалина и как этот оксид железа будет себя вести. В процессе взаимодействия с азотной кислотой железо окисляется до трехвалентного, продуктом реакции становится нитрат железа (III). Если кислоту взять концентрированную, то продуктом также будет оксид азота (IV). Можно поступить иначе: представить взаимодействие концентрированных кислот, соляной и азотной. Иногда в заданиях обговаривается концентрация кислоты; если уточнений нет — можно выбрать любую концентрацию.
Задание 31. Здесь самый простой вариант — реакция гидрокарбоната кальция с соляной кислотой с выделением углекислого газа. Главное —записать формулу именно гидрокарбоната.
ЕГЭ. Химия. Новый полный справочник для подготовки к ЕГЭ
Новый справочник содержит весь теоретический материал по курсу химии, необходимый для сдачи ЕГЭ. Он включает в себя все элементы содержания, проверяемые контрольно-измерительными материалами, и помогает обобщить и систематизировать знания и умения за курс средней (полной) школы. Теоретический материал изложен в краткой и доступной форме. Каждая тема сопровождается примерами тестовых заданий. Практические задания соответствуют формату ЕГЭ. В конце пособия приведены ответы к тестам. Пособие адресовано школьникам, абитуриентам и учителям.
КупитьПример 5. Даны: гидроксид магния, хлорид железа (III), серная кислота, сульфид натрия, нитрат цинка.
Задание 30. Проблемное задание: при взаимодействии между хлоридом железа и сульфидом натрия происходит не обменный, а именно окислительно-восстановительный процесс. Если в реакции участвует соль сульфид, то образуется не хлорид, а сульфид железа (II). А при реакции с сероводородом — хлорид железа (II).
Задание 31. Например, можно взять сульфид натрия с разбавленной кислотой, с выделением сероводорода. Можно также написать уравнение между гидроксидом магния и серной кислотой.
Урок «Окислительно-восстановительные реакции, и их решения»
Метод электронного баланса
В его основе лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители.
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
Сначала необходимо составить схему реакции: записать вещества в начале и конце реакции, учитывая, что в кислой среде MnO4— восстанавливается до Mn2+ (см. схему):
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
Далее определим какие из соединений являются окислителем и восстановителем; найдем их степень окисления в начале и конце реакции:
Na2S+4O3 + KMn+7O4 + H2SO4 = Na2S+6O4 + Mn+2SO4 + K2SO4 + H2O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6, таким образом, S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем.
Составим электронные уравнения и найдем коэффициенты при окислителе и восстановителе.
S+4 – 2e— = S+6 ¦ 5 восстановитель, процесс окисления
Mn+7 +5e— = Mn+2 ¦ 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn+7, ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S+4 коэффициентом перед окислителем:
5Na2S+4O3 + 2KMn+7O4 + H2SO4 = 5Na2S+6O4 + 2Mn+2SO4 + K2SO4 + H2O
Далее надо уравнять количества атомов элементов, не изменяющих степень окисления, в такой последовательности: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO42-, из которых 5 – за счет превращения 5SO32- → 5SO42-, а 3 – за счет молекул серной кислоты 8SO42-— 5SO42- = 3SO42-.
Таким образом, серной кислоты надо взять 3 молекулы:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + H2O
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H+ + 3O-2 = 3H2O
Окончательный вид уравнения следующий:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Задание 1. Составить уравнения ОВР с помощью метода электронного баланса, определить тип ОВР.
1. Цинк + дихромат калия + серная кислота = сульфат цинка + сульфат хрома(III) + сульфат калия + вода.
Решение
Электронный баланс:
2. Сульфат олова(II) + перманганат калия + серная кислота = сульфат олова(IV) + сульфат марганца + сульфат калия + вода.
3. Йодид натрия + перманганат калия + гидроксид калия = йод + манганат калия + гидроксид натрия.
4. Сера + хлорат калия + вода = хлор + сульфат калия + серная кислота.
5. Йодид калия + перманганат калия + серная кислота = сульфат марганца(II) + йод + сульфат калия + вода.
6. Сульфат железа(II) + дихромат калия + серная кислота = сульфат железа(III) + сульфат хрома(III) + сульфат калия + вода.
7. Нитрат аммония = оксид азота(I) + вода.
8. Фосфор + азотная кислота = фосфорная кислота + оксид азота(IV) + вода.
9. Азотистая кислота = азотная кислота + оксид азота(II) + вода.
10. Хлорат калия + соляная кислота = хлор + хлорид калия + вода.
11. Дихромат аммония = азот + оксид хрома(III) + вода.
12. Гидроксид калия + хлор = хлорид калия + хлорат калия + вода.
13. Оксид серы(IV) + бром + вода = серная кислота + бромоводородная кислота.
14. Оксид серы(IV) + сероводород = сера + вода.
15. Сульфит натрия = сульфид натрия + сульфат натрия.
16. Перманганат калия + соляная кислота = хлорид марганца(II) + хлор + хлорид калия + вода.
17. Ацетилен + кислород = углекислый газ + вода.
18. Нитрит калия + перманганат калия + серная кислота = нитрат калия + сульфат марганца(II) + сульфат калия + вода.
19. Кремний + гидроксид калия + вода = силикат калия + водород.
20. Платина + азотная кислота + соляная кислота = хлорид платины(IV) + оксид азота(II) + вода.
21. Сульфид мышьяка + азотная кислота = мышьяковая кислота + сернистый газ + диоксид азота + вода.
22. Перманганат калия = манганат калия + оксид марганца(IV) + кислород.
23. Сульфид меди(I) + кислород + карбонат кальция = оксид меди(II) + сульфит кальция +
+ углекислый газ.
24. Хлорид железа(II) + перманганат калия + соляная кислота = хлорид железа(III) + хлор +
+ хлорид марганца(II) + хлорид калия + вода.
25. Сульфит железа(II) + перманганат калия + серная кислота = сульфат железа(III) + сульфат марганца(II) + сульфат калия + вода.
Ответы на упражнения задания 1
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Сводка по лаборатории
Этот проект моделирует одну экологическую меру, используемую угольной промышленностью для уменьшения присутствия кислотных дождей в нашей атмосфере, и в то же время включает базовые концепции химии, подходящие для лаборатории первого года. Такие концепции включают pH, кислотно-основные реакции, относительную кислотность, реакции нейтрализации и растворимость.
Процесс борьбы с загрязнением, используемый в угледобывающих отраслях, известный как «очистка», включает уменьшение количества газообразного диоксида серы, выбрасываемого в атмосферу, за счет принуждения газов сгорания угля к взаимодействию с основанием, таким как карбонат кальция.Таким образом, диоксид серы, образующийся при сжигании угля, превращается в сульфит кальция:
SO 2 (г) + CaCO 3 (т) CaSO 3 (т) + CO 2 (г)
Чтобы смоделировать этот процесс в лабораторных условиях, подходящих для лаборатории первого курса, студент сначала наблюдает увеличение кислотности газообразного SO 2 , которое вызывает в дождевой воде за счет сжигания небольшого количества серы и затем барботирования газа SO 2 . производится через дистиллированную воду.Затем студент выполняет дополнительные эксперименты, в которых SO 2 (g) позволяют взаимодействовать с четырьмя различными реагентами, прежде чем он будет пропущен через дистиллированную воду. Учащийся проверяет pH воды до и после каждой реакции, чтобы наблюдать за эффективностью каждого реагента при нейтрализации газа SO 2 , а затем делает вывод о том, какие скрубберы могут оказаться хорошими.
Опасности:
Опасности, связанные с этим проектом, возникают в основном из-за агрессивной природы гидроксида калия, используемого в качестве одного из четырех очищающих реагентов.Вдыхание пыли из серы, карбоната кальция и сульфата кальция может вызвать раздражение глаз и верхних дыхательных путей, поэтому настоятельно рекомендуется выполнять всю работу в вытяжном шкафу. Следует избегать контакта всех химических веществ с глазами и другими слизистыми оболочками. Необходимо всегда носить надлежащие средства защиты глаз.
Часть первая. Повышение кислотности дождевой воды, вызванное SO 2 (г)
Две пробирки с боковыми рукавами соединяются друг с другом с помощью резиновых пробок с просверленными отверстиями, стеклянной трубки и трубки Tygon.Небольшое количество серы помещается в одну боковую пробирку, а небольшой объем дистиллированной воды помещается во вторую, которая соединена с аспиратором.
Сера сжигается за счет прямого нагрева пламени горелки Бунзена. Частичный вакуум, создаваемый аспиратором, вытягивает воздух над серой и заставляет образовавшийся газ поступать во вторую пробирку, где он барботируется дистиллированной водой. Используя pH-бумагу, студент проверяет pH воды как до, так и после реакции, чтобы наблюдать увеличение кислотности воды, вызванное реакцией между SO 2 (г) и H 2 O (l) до производят сернистую / серную кислоту.Инструктор может кратко обсудить, как происходит эта реакция и почему наблюдается повышение кислотности дистиллированной воды.
Часть вторая. Исследование четырех реагентов в качестве потенциальных скрубберов SO 2 .
SO 2 газ может взаимодействовать с карбонатом кальция (CaCO 3 ), сульфатом кальция (CaSO 4 ), карбонатом натрия (Na 2 CO 3 ) и гидроксидом калия (KOH) перед этим. барботируется дистиллированной водой.
Учащийся определяет, какие реагенты эффективно действуют как скрубберы SO2, и объяснит свои наблюдения в терминах конкретных происходящих реакций.
Типичные результаты студентов: Очищающая способность четырех различных реагентов Реагент pH дистиллированной воды до реакции pH дистиллированной воды после реакции Заключение о моющей способности CaCO 3 (s) (измельченный кальцит) 5 1-2 Неэффективно CaCO 3 (водная суспензия) 5 3-4 Неэффективно CaCO 3 (водная суспензия при перемешивании) 5 5 Действующий CaSO 4 (т) 5 1-2 Неэффективно CaSO 4 (водная суспензия) 5 2-3 Неэффективно Na 2 CO 3 (водн.) 5 5 Действующий КОН (ы) 5 5 Действующий КОН (водн.) 5 5 Действующий - Взаимодействие SO 2 (г) с карбонатом кальция (CaCO 3 )
Небольшое количество серы помещается в первую пробирку, а третья пробирка заполняется небольшим объемом дистиллированной воды и подсоединяется к аспиратору.Карбонат кальция помещается в среднюю пробирку в одной из трех форм:
- кальцит молотый (крупность не менее 1 мм)
- водная суспензия карбоната кальция
- водная суспензия карбоната кальция при постоянном перемешивании
Учащийся проверяет pH дистиллированной воды в третьей пробирке до и после каждой реакции, чтобы наблюдать эффективность CaCO 3 в качестве скруббера и наблюдать, как на реакцию влияет тип CaCO 3 б / у.Инструктор должен кратко обсудить факторы, влияющие на гетерогенные реакции, в том числе, почему реакция между SO 2 (g) и измельченным кальцитом будет незначительной или не будет наблюдаться вовсе. Вооруженный также знаниями о растворимости, студент должен уметь объяснить, почему постоянное перемешивание водной суспензии CaCO 3 полезно для реакции между SO 2 (г) и карбонатом кальция в водной суспензии. Инструктор должен помочь студенту написать уравнение для конкретной реакции нейтрализации, которая происходит между CaCO 3 и SO 2 , и почему карбонат кальция может эффективно действовать как скруббер.
- Взаимодействие SO 2 (г) с сульфатом кальция (CaSO 4 )
Используя ту же процедуру, что описана выше, студент наблюдает очищающую способность сульфата кальция в двух различных формах:
- Дриерит
- водная суспензия карбоната кальция
Преподаватель должен помочь студенту понять, почему не происходит реакции нейтрализации между SO 2 (g) и реагентом сульфата кальция.
- Взаимодействие SO 2 (г) с карбонатом натрия (Na 2 CO 3 )
Очищающую способность карбоната натрия наблюдают, помещая небольшой объем 1М раствора Na 2 CO 3 в среднюю пробирку и проводя реакцию, как это проводилось с двумя предыдущими реагентами. Инструктор должен помочь студенту в письменной форме и понимании реакции нейтрализации этого взаимодействия.
- Взаимодействие SO 2 (г) с гидроксидом калия (КОН)
Очищающая способность гидроксида калия наблюдается при использовании КОН в двух различных формах:
- КОН гранулы
- 1M раствор КОН
Снова используется та же процедура, что и для тестирования трех других реагентов. Инструктор должен помочь студенту в письменной форме и понимании реакции нейтрализации этого взаимодействия, которая приведена ниже:
SO 2 (г) + 2KOH (водн.) → K 2 SO 3 (водн.) + H 2 O
- Взаимодействие SO 2 (г) с карбонатом кальция (CaCO 3 )
Словесные уравнения — Химические уравнения — AQA Synergy — GCSE Combined Science Revision — AQA Synergy
Словесное уравнение представляет собой химическую реакцию с использованием названий задействованных веществ.Словесные уравнения не содержат никаких химических символов или формул.
Реагенты и продукты
Реагенты — это вещества, которые вместе вступают в химическую реакцию. В химической реакции атомы или ионы в реагентах отделяются друг от друга. Они соединяются друг с другом по-другому, образуя продукты.
Словесные уравнения всегда имеют следующую форму:
реагенты → продукты
Знак + разделяет два или более реагентов или два или более продуктов.
Пример словарных уравнений
Гидроксид калия реагирует с серной кислотой.В результате реакции образуются сульфат калия и вода. Это означает, что:
- реагенты — гидроксид калия и серная кислота
- продукты — сульфат калия и вода
- словесное уравнение: гидроксид калия + серная кислота → сульфат калия + вода
Химические уравнения содержат стрелку и не знак равенства. Стрелка означает «реагирует на создание».
Количество реагентов и продуктов может быть разное. Например:
- натрий + хлор → хлорид натрия
- карбонат кальция → оксид кальция + диоксид углерода
- Вопрос
Азот и водород вместе образуют аммиак.Назовите реакцию словом уравнение.
- Выявить ответ
азот + водород → аммиак
Сульфат калия | tib-chemicals.com
Раствор сульфита калия K 2 SO 3 (CAS No. 10117-38-1)Использование серосодержащих химикатов в промышленности строго регламентировано. Это служит для безопасности продукта и требует взаимосвязанного производственного процесса со стороны производителя.Раствор сульфита калия от TIB Chemicals используется, в частности, для фотохимикатов, таких как растворы проявителя, но также как восстановитель при очистке воды или как пищевая добавка. Продукт универсален и может использоваться для производства вина.
Другие названия и общие термины раствора сульфита калия в следующем:
— Раствор сульфита калия (Великобритания, США)
— Сульфит калия (Великобритания, США)
— Сульфит калия (Великобритания, США)
Сульфит калия широко используется в промышленности. Его получают при сжигании черного пороха, то есть при реакции диоксида серы с водой. Если он синтезируется таким образом, требуется дополнительный раствор карбоната калия. Продукт используется, например, в качестве восстанавливающего и фиксирующего агента в фотоиндустрии в растворах для проявки. Кроме того, раствор сульфита калия используется как травитель в электротехнической промышленности или как отбеливающий агент для сахара.
Другой областью применения является также твердая форма метабисульфита в качестве добавки в такие пищевые продукты, как вино. Здесь сульфит метабисульфита калия действует как ускоритель потемнения. Добавка метабисульфита калия также известна как E224 и используется в качестве консерванта, антиоксиданта или стабилизатора цвета. Это включает сульфуризацию вина. Кроме того, метабисульфит калия также называется в этом контексте отбеливателем для пельменей, чтобы пельмени не становились серыми во время обработки.В пищевой промышленности метабисульфит калия предотвращает реакцию пищи с кислородом. Это позволяет хранить множество различных, как правило, очень быстро портящихся продуктов, а также перевозить их на большие расстояния. Таким образом, красители и ароматизаторы не ухудшаются, продукт остается «свежим» и имеет качество, подходящее для торговли. Однако метабисульфит калия разрушает витамин B1 и поэтому не используется в молочных продуктах или зерновых продуктах.
Другие области применения раствора сульфита калия K 2 SO 3 (CAS No.10117-38-1)Раствор сульфита калия от TIB Chemicals незаменим в промышленности. В качестве восстановителя в фотографии продукт служит важным компонентом решения для проявки негативов. Также в химической промышленности продукт используется в качестве восстановителя. Таким образом, можно оптимизировать множество различных процессов с помощью точной дозировки и применения в соответствии с потребностями. В твердом состоянии продукт легко хранится. Кроме того, он растворим в воде.Для производства сульфита калия карбонат калия смешивают с диоксидом серы. Это калиевая соль с серной кислотой.
Реагирует на воздухе на сульфат калия. Сульфит калия образуется в результате реакции гидроксида калия с диоксидом серы. В промышленности продукт обычно используется в виде 45% раствора. Важные функции выполняет раствор сульфита калия K 2 SO 3 (CAS № 10117-38-1) в следующих диапазонах:
-в фотоиндустрии
-в химической промышленности
Раствор сульфита калия нужен в различных отраслях промышленности. Обычно он используется в качестве восстановителя в химической промышленности, например, в качестве проявителя в фотографии. Большая область применения — пищевая промышленность, в случае метабисульфита в качестве консерванта и антиоксиданта. Здесь он играет важную роль в качестве продукта для длительного хранения скоропортящихся продуктов без ущерба для вкуса или натуральных красителей.
Серная кислота выразит свой ответ в виде химической формулы.
Серная кислота выразите свой ответ в виде химической формулы.Вычислить концентрацию ионизированной кислоты. Вычислить концентрацию кислоты, которая ионизируется в 0,10 М растворе. \ texttip {K _ {\ rm a}} {K_a} = 8,0 × 10 −7. Выразите молярную концентрацию численно с помощью двух значащих цифр. Подсказка 1.
4 декабря 2019 г. · Ответ: (i) Количество замещаемых атомов водорода, присутствующих в одной молекуле кислоты, называется основностью кислоты. Например, хлористоводородная кислота является одноосновной кислотой, серная кислота является двухосновной кислотой, а фосфорная кислота является трехосновной кислотой.(ii) Азотная кислота (HNO 3) -> Одноосновная уксусная добавка (CH 3 COOH) -> Одноосновная
Химическая формула для серы отсутствует. Но у серы есть химический символ. Сера представлена как # S #. Она имеет атомную массу 32u, которая написана в верхней части символа, и число протонов 16, которое написано внизу.
Как вы называете кислоты? Мы узнаем, как найти химическую формулу кислоты, а затем написать ее название. Мы сосредоточимся на кислотах без кислорода и на др…
25 ноября 2015 г. · Серная кислота: Химическая формула серной кислоты — H 2 SO 3, где степень окисления серы +4. Геометрическая структура этой молекулы — тригонально-пирамидальная. Кислотность: серная кислота: серная кислота — одна из самых сильных кислот, и это дипротоновая кислота.
26 июля, 2018 · Чтобы найти молярную концентрацию раствора, нужно просто ввести общий объем раствора и количество молей серной кислоты в формулу, чтобы найти молярную концентрацию.Формула: моль растворенного вещества / л раствора = h3SO4. 0,02401 моль / 0,050 л = 0,48 М. Подводя итог:
Серная кислота является наиболее широко используемой кислотой в промышленности. Из него делают моющие средства, красители, лекарства, взрывчатые вещества, пигменты, удобрения и многие другие продукты. Химическая формула: h3SO4. (неорганическая химия) Прозрачная маслянистая жидкость, формула h3SO4, сильная кислота с очень многими промышленными …
Серная кислота. Названия регулирующих процессов 9 Переведенные названия 22 Названия CAS 1 Названия IUPAC 42 Торговые наименования 60 Другие идентификаторы 8.Молекулярная формула идентифицирует каждый тип элемента по его химическому символу и определяет количество атомов каждого элемента в одной дискретной молекуле …
Не работает датчик дождя Acurite
Найдите формулу серной кислоты, опасность серной кислоты , плотность серной кислоты и многое другое ниже! Едкий и яд; внимательно прочтите предупреждающие надписи .. Аккумуляторная кислота. Обычное использование. Производство удобрений, производство химикатов и т. Д. Опасность. Серная кислота. Формула: h3O4S.Молекулярный вес: 98,078. Химическая структура: эта структура также доступна как 2d файл Mol или как вычисленный файл 3d SD. 3d структуру можно просмотреть с помощью Java или Javascript.
Xfinity wan aggregation
Азотная кислота — это компонент кислотного дождя, который образуется, когда газообразный диоксид азота, загрязняющий атмосферу, вступает в реакцию с газообразным кислородом и жидкой водой с образованием водной азотной кислоты. Выразите свой ответ в виде сбалансированного химического уравнения. Определите все этапы своего ответа.
Формула и структура: Химическая формула серной кислоты — h3SO4, ее молекулярная масса составляет 98,079 г / моль. Его химическая структура показана ниже. Атом серы связан с двумя атомами кислорода двойными связями и двумя гидроксильными группами (ОН) одинарными связями.
Материя сохраняется в химических реакциях: Общая масса продуктов равна общей массе реагентов. Химические уравнения отражают это сохранение. Вот почему химические уравнения должны быть сбалансированы.Атомы обладают массой, и числа атомов каждого типа на каждой стороне уравнения должны быть одинаковыми. серная кислота — химическая формула C2h5 — минеральная кислота, растворимая в воде. Его реакция гидратации очень экзотермична, поэтому кислоту следует добавлять в воду из-за плотности жидкости. Серная кислота, h3SO4, представляет собой маслянистую жидкость от бесцветного до темно-коричневого цвета.
1999 dodge dakota bed на продажу
17 февраля 2010 г. · Серная кислота является компонентом кислотных дождей, образующихся при взаимодействии газообразного диоксида серы, загрязняющего газообразный кислород и жидкую воду, с образованием водной серной кислоты.Выразите свой ответ в виде химического уравнения. Определите все этапы своего ответа.
Серная кислота — контактный процесс. Связанные темы: Дополнительные уроки для рабочих листов по химии IGCSE. Серия бесплатных занятий и экспериментов по химии IGCSE (Кембриджский IGCSE Контактный процесс для получения серной кислоты — это процесс, который включает обратимую реакцию.
Если вы хотите увидеть различную концентрацию сильных кислот, то вы должны изучить их кислоты в растворителе, отличном от h3O.В 18 раз сильнее, чем 100% -ная серная кислота. Вопрос / ответ: itz_jacki задан 10/02/03 — Реакция
Guskiisa ayuu dabada iga saaray
{{#if: 98,079 г / моль Прозрачная жидкость без цвета и запаха h3SO41,84 г / см3, смешивающаяся с жидкостью 26 −3, 1,99 0,7 сП (20 ° C) 10 |! colspan = «2» | Характеристики. Серная кислота (альтернативное написание серная кислота) …
Как вы называете кислоты? Мы узнаем, как найти химическую формулу кислоты, а затем написать ее название. Мы сосредоточимся на кислотах без кислорода и на др…
Введите правильный ответ в поле. Выразите свой ответ тремя значащими цифрами. Это вычисленное уравнение показывает реакцию гидроксида натрия и серной кислоты: 2NaOH + h3SO4 → Na2SO4 + 2h3O. В лабораторном эксперименте студент смешивает 355 граммов серной кислоты с избытком гидроксида натрия. Химическая формула соединения — это символическое представление его химического состава. Химические формулы дают представление об элементах, составляющих молекулы соединения, а также о соотношении, в котором атомы этих элементов объединяются, образуя такие молекулы.
Интервью по дизайну машинного обучения facebook
Сбалансированное химическое уравнение: 2KOH + H_2SO_4 = K_2SO_4 + 2H_2O Образовавшаяся соль: сульфат калия: K_2SO_4 Это связано с тем, что калий имеет валентность всего 1+, а поскольку ионы сульфата имеют валентность 2-, для нейтрализации на ион сульфата требуется два иона калия.
Дистилляция серной кислоты. Всем привет, у меня проблема с получением серной кислоты. Там, где я живу (Китай), вам необходимо специальное разрешение на получение серной кислоты любой концентрации, поскольку она указана как прекурсор «Опасные материалы».Я знаю, что один из способов получить серную кислоту — это испарить батарею …
Кислотный дождь вызывается химической реакцией, которая начинается, когда в воздух попадают такие соединения, как диоксид серы и оксиды азота. Эти вещества могут подниматься очень высоко в атмосферу, где они смешиваются и вступают в реакцию с водой, кислородом и другими химическими веществами с образованием более кислых загрязнителей, известных как кислотный дождь. Сульфат железа (II) (британский английский: сульфат железа (II)) или сульфат железа обозначает ряд солей с формулой Fe SO 4 · xH 2 O.Эти соединения чаще всего существуют как гептагидраты (x = 7), но известны несколько значений x. Гидратированная форма используется в медицине для лечения дефицита железа, а также для промышленного применения.
Cdk global salary
Серная кислота никогда не обнаруживалась в жидком растворе, но была обнаружена в виде газа. Многие путают его с серной кислотой, но на самом деле это отдельное химическое вещество с другим химическим веществом. В химической формуле перечислены отдельные элементы в каждой молекуле и количество их составляющих.
Использование 70% концентрированной азотной кислоты в качестве примера: 70% азотная кислота означает, что 100 граммов этой кислоты содержат 70 граммов HNO3. Нормальность относится к соединениям, которые имеют несколько химических функциональных групп, таким как серная кислота, h3SO4.
При обработке сульфида кадмия серной кислотой выделяются пары сероводорода, и ваш ответ выражается в химических формулах.? На вопрос пользователя Wiki 3 4 5 Реагирует с азотной кислотой (фото) или серной кислотой. Может плавиться и смешиваться с цинком с образованием латуни. Плотность 8.95 г / см3 Точка плавления 1083 ° C Точка кипения 2570 ° C Медленно образует темно-синий раствор в водном аммиаке. Вещество идентифицируется по его собственному набору физических и химических свойств. Некоторые свойства меди представлены в таблице 1.1.
Samsung knox support
15 апреля 2020 г. · Формула h3SO4 (водн.) + 2KOH (водн.) -> K2SO4 (водн.) + 2h3O (l) представляет собой реакцию нейтрализации кислой серной кислоты и щелочного калия. гидроксид. Когда эти два химических вещества смешиваются вместе, они создают раствор воды, или h3O, и сульфата калия, соли.Серная кислота — сильная кислота, а гидроксид калия — сильное основание.
Серная кислота (альтернативное название «серная кислота») — это сильно коррозионная сильная минеральная кислота с молекулярной формулой h3SO4 и Промышленное производство химикатов. Серно-йодный цикл. Промышленное чистящее средство. Как кислота, серная кислота реагирует с большинством оснований с образованием соответствующего сульфата.
Если ваш образец представляет собой 0,7 М раствор уксусной кислоты, для аликвоты 25,00 мл потребуется (—— мл) NaOH для достижения конечной точки.какое число горс пустить? какое число горс пустить? 1) 175 2) 70 3) 25 21 февраля 2014 г. · Получите ответ на вопрос «Напишите и сбалансируйте уравнение реакции соляной кислоты (h3SO4) и гидроксида натрия с образованием сульфата натрия и воды». и найти помощь в домашнем задании для других наук …
Fender american special precision bass 2011
Другой подход к этому эксперименту — притвориться, что вы не знаете формулы, и вывести ее из результатов. Для этого см. Эмпирическую формулу и формулу массы соединения из реагирующих масс.Расчет реакционной массы Пример 6а.2. Нейтрализация серной кислоты гидроксидом натрия. 2NaOH + H 2 SO 4 ==> Na 2 SO 4 + 2H 2 O
46 47 Серная кислота является одним из основных химических агентов «кислотного дождя» (ATSDR, 2004). Поскольку серная кислота из источников воздуха не очень летучая. Использование серной кислоты в качестве регулятора pH является обычной практикой при переработке алкогольных напитков и сыра (Watson, 2002).
В случае, если молекула может испускать или принимать более одного протона, вам необходимо скорректировать свои вычисления.Например, серная кислота с формулой h3SO4 отдает 2 отдельных протона. Используя молярную массу серной кислоты и зная, что одна молекула может отдавать 2 протона, мы можем найти эквивалентную массу.
Рычаг переключения раздаточной коробки Ford
Federal 223 62 зерна зеленый наконечник
Редкие имена пользователей roblox не приняты 2020
Air Manager vs Air Player
Какие два фрагмента ископаемых свидетельств подтверждают эту идею континентального дрейфа_
Примечания к исследованию Pmp
Прогрессивный пресс Lee с 5 отверстиями
Ros melodic book
Таблицы азбуки алфавита с изображениями
Что такое шаблонное правило, уровень 5
Battle of
Battle of gettysburg summary pdfTogel hkg 6d 2020 hari ini keluar
315mhz RF модуль передатчика и приемника
Destruction derby 2 скачать
бесплатноКод ошибки 0xc0000185 la ptop
Отрывки для беглости чтения 2-го класса для печати
Ge защелка дверцы посудомоечной машины
Бесплатный генератор soundcloud воспроизводит
Отключение калибровки батареи MSI
Мои сотрудники
что я делаю на своем домашнем компьютере
Механизм и кинетика взаимодействия газообразного диоксида серы и твердого оксида кальция
Механизм и кинетика взаимодействия газообразного диоксида серы и твердого оксида кальция
Диоксид серы прореагировал с крошечными (диаметром 35–85 мкм) частицами пористого CaO на термогравиметрических весах.Кинетические измерения вместе с инфракрасными исследованиями продуктов показывают, что две реакции, , а именно : CaO + SO 2 → CaSO 3 и CaO + SO 2 → 3 / 4CaSO 4 + 1 / 4CaS. В присутствии как SO 2 , так и O 2 , когда CaSO 3 и CaS оба окисляются до CaSO 4 , эти две реакции SO 2 обеспечивают шаги, определяющие скорость для начальных стадий реакции для таких крошечных частиц.Таким образом, условия, использованные в этом исследовании, позволяют предотвратить регулирование скорости любой из этих реакций за счет диффузии SO 2 . Скорости обеих реакций на единицу площади поверхности CaO имеют общий вид: k ([SO 2 ] — [SO 2 ] e ), где [SO 2 ] e — концентрация SO 2 для рассматриваемой реакции, находящейся в состоянии равновесия, и k — константа скорости.Измерения начальных скоростей показывают, что k = 7.2 × 10 –6 exp (–1443 / T ) ms –1 и 1.2 × 10 –6 exp (–481 / T ) мс –1 для двух реакций, соответственно, с точностью до 25%. Однако CaSO 3 нестабилен выше ок. 1123 K, так что только более медленная (вторая) реакция происходит выше ок. 1123 K. Независимость скорости этих реакций от концентрации кислорода подтверждает, что SO 3 не играет в них роли.Измерения большой степени реакции показали, что коэффициент диффузии SO 2 через твердые продукты реакции (в основном CaSO 3 ) составляет D с = 1,9 ± 0,5 × 10 –14 м 2 с –1 . Однако при высоких температурах (> 1160 K), когда производятся только CaSO 4 и CaS, D s падает до 2.3 × 10 –15 м 2 с –1 .
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте еще раз?Реагирует ли диоксид серы с гидроксидом натрия
3 — Вы знаете, что химикат A реагирует с химическим веществом B …. Ch. 3 — Диметилнитрозамин (Ch4) 2N2O является канцерогенным веществом… гл. 4. $$ \ ce {4S + 6NaOH → Na2S2O3 + 2Na2S + 3h3O} $$ Реакция взаимодействия серы и гидроксида натрия с образованием тиосульфата натрия, сульфида натрия и воды. 3 — Соединение с молярной массой 180,1 г / моль имеет … Гл. 3 — Сбалансируйте следующие уравнения, представляющие … гл. 3 — Превацид используется для лечения гастроэзофагеального рефлюкса … Гл. (3 — Рассмотрим реакцию между NO (г) и O2 (г) … Ч. В 2005 году исследователь Ву-сук Хван сообщил, что он создал бессмертные стволовые клетки из пациентов-людей. Реакция протекает в кипящем растворе.3 — Атомные массы являются относительными массами. У нас # 1 # атом серы с одной стороны (# SO_2 #) и # 1 # с другой стороны (# Na_2SO_3 #). 3 — Рассчитайте молярную массу следующих … гл. 3 — Рассмотрим следующую общую реакцию: … Гл. Оцените важность мембран для клеток, подчеркнув их различные функции. 3 — Рассмотрим уравнение 3A + B C + D. Вы реагируете 4 … Ch. Если вы сделаете два шага разного размера, сможете ли вы прийти к отправной точке? 3 — Какие из следующих соединений имеют то же самое… гл. Каковы основные характеристики лженауки? 3 — Иортальное соединение MX3 получают в соответствии с … гл. Диоксид серы также напрямую реагирует с основаниями, такими как раствор гидроксида натрия. 3 — Учитывая ваш ответ к упражнению 79, который типа … Гл. У нас # 1 # атом водорода (# NaOH #), но с другой стороны # 2 # (# H_2O #). 3 — Определите молекулярные формулы, к которым … Гл. Ваша реакция) 3 — Правда или ложь? Если мы уподобим химическую реакцию холму энергии, тогда энергия активации будет похожа на __________.3 — Система экологического контроля космического челнока … Гл. 4970 просмотров 3 — Борнит (Cu3FeS3) — медная руда, используемая в … гл. 2 A2B. 3 — Образец железной руды содержит Fe2O3 плюс другие … гл. 3 — Газообразный водород и газообразный кислород реагируют с образованием воды, … гл. Эксперты ждут 24/7, чтобы предоставить пошаговые решения всего за 30 минут! *. 3 — Средняя масса атома углерода 12.011 …. Ch. Гл. 3 — Образец нечистого нитрата натрия весом 0,4230 г был … гл. l 3 — грибковая лакказа, синий белок, содержащийся в… гл. 3 — Согласно закону сохранения массы, масса … Гл. Активно реагирует с раствором гидроксида натрия и образует сульфит натрия. + Поскольку … гл. 3 — Вопросы 10 и 11 касаются следующего … Гл. H 3 — соединение, которое содержит только углерод, водород, … гл. 3 — На протяжении многих лет реакция термитов была … гл. 3 — Соединение содержит 47,08% углерода, 6,59% водорода, … гл. 3 — Сбалансируйте каждое из следующих химических уравнений …. Гл. 3 — Образец мочевины содержит 1.121 г N, 0,161 г H, … гл. 3 — Один из компонентов, составляющих общую таблицу … Гл. В более общем смысле, может два вектора … 49. 3 — Бор состоит из двух изотопов, 10B и 11B …. Ch. Гл. 3 — Селективные ингибиторы обратного захвата серотонина (СИОЗС) … Гл. Газообразный диоксид серы реагирует с гидроксидом натрия с образованием сульфита натрия и воды. Какая из следующих причин сужения сосудов легких? 3 — Атомные массы в периодической таблице Менделеева равны … гл. Итак, мы считаем атомы каждого элемента. Как рассчитать константу закона идеального газа? 3 — Рассмотрим следующую смесь SO2 (г) и… гл. 3 — Природный рубидий имеет среднюю массу 85,4678 ед. Гл. # Na_2SO_3 # представляет собой твердую соль в виде порошка. 3 — Широкое распространение получил арсенид галлия GaAs … Гл. Подробные решения доступны в решениях для студентов … Хлорид кадмия (II) добавляют к раствору гидроксида калия с pH 9,62. NaOH O 3 — Рассмотрим образцы фосфина (Ph4), воды (h3O), … гл. 3 — Газовая смесь массой 9,780 г содержит этан (C2H6) … Гл. * Время ответа зависит от темы и сложности вопроса.3 — Какие из следующих утверждений (если таковые имеются) верны … Гл. SO 2 + 2NaOH → Na 2 SO 3 + H 2 O В тех случаях, когда мы передаем больше диоксида серы в… 3 — Элемент серебро (Ag) имеет два естественных… Гл. Реакция протекает при температуре выше 600 ° C. 3 — АБС-пластик — это прочный твердый пластик, используемый в … гл. Что … гл. Напишите сбалансированное уравнение горения … Гл. 3 — Рассмотрим газообразное бинарное соединение с молярным … гл. 3 — Газообразный диоксид серы реагирует с гидроксидом натрия до… гл. 3 — Фосфор можно получить из фосфата кальция … Гл. 3 — Кремний производится для химических и … гл. (0,0234 м). а. 3 3 — Рассчитайте массу 500.

 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Leave A Comment