Решутест. Продвинутый тренажёр тестов
Решутест. Продвинутый тренажёр тестов- Главная
- ЕГЭ
- Химия
- Химические свойства сложных веществ
- Химические свойства кислот
Решил заданий
Не решил заданий
Осталось заданий
История решения
8910 — не приступал 6013 — не приступал 9892 — не приступал 5483 — не приступал 6123 — не приступал 1363 — не приступал 5614 — не приступал 6881 — не приступал 1885 — не приступалФормат ответа: цифра или несколько цифр, слово или несколько слов. Вопросы на соответствие «буква» — «цифра» должны записываться как несколько цифр. Между словами и цифрами не должно быть пробелов или других знаков.
Вопросы на соответствие «буква» — «цифра» должны записываться как несколько цифр. Между словами и цифрами не должно быть пробелов или других знаков.
Примеры ответов: 7 или здесьисейчас или 3514
Раскрыть Скрыть
№1Разбавленная серная кислота реагирует лишь с одним из двух веществ
- оксид алюминия и магний
- гидроксид натрия и оксид углерода(II)
- оксид цинка и оксид меди(II)
- ртуть и гидроксид бария
- медь и оксид кремния(IV)
Серная кислота (разб.) реагирует с каждым из двух веществ
- Ca, Na2O
- Fe(OH)2, Cu
- Mg, Ag
- Cu(OH)2, K2CO3
- CO2, Zn
С разбавленной серной кислотой взаимодействует
- Ртуть
- Магний
- Кальций
- Серебро
- Кремний
Концентрированная азотная кислота реагирует с каждым из двух веществ:
- Au, NaOH
- Fe, SiO2
- H2SO4, AgNO3
- Cu, NaOH
- Ca, Zn(OH)2
С разбавленной серной кислотой взаимодействует
- цинк
- кремний
- ртуть
- кальций
- медь
И разбавленная, и концентрированная серная кислота при комнатной температуре реагирует с
- карбонатом кальция
- хлоридом натрия
- медью
- железом
- хлоридом бария
Концентрированная серная кислота при обычных условиях взаимодействует с:
- железом
- алюминием
- гидроксидом цинка
- оксидом кремния (IV)
- гидроксидом меди (II)
Разбавленная серная кислота при обычных условиях взаимодействует с
- серой
- магнием
- медью
- оксидом кремния (IV)
- гидроксидом цинка
Реагируют с серной кислотой, но не реагируют с гидроксидом натрия
- Ca
- P2O5
- Al(OH)3
- Sr(OH)2
- Zn(OH)2
 Регистрация
РегистрацияМы отправили код на:
ИзменитьПолучить код повторно через 00:00
Я прочитал(-а) Политику конфиденциальности и согласен(-на) с правилами использования моих персональных данных
Ништяк!
Решено верно
Браво!
Решено верно
Крутяк!
Решено верно
Зачёт!
Решено верно
Чётко!
Решено верно
Бомбезно!
Решено верно
Огонь!
Решено верно
Юхууу!
Решено верно
Отпад!
Решено верно
Шикарно!
Решено верно
Блестяще!
Решено верно
Волшебно!
Решено верно
Серная кислота: получение и химические свойства
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. nSO3 + H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.

- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота.
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
H2SO4 ⇄ H+ + HSO4–
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4– ⇄ H+ + SO42–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, серная кислота взаимодействует с оксидом магния:
H2SO4 + MgO → MgSO4 + H2O
Еще пример: при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например, серная кислота взаимодействует с гидрокарбонатом натрия:
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
Или с силикатом натрия:
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
NaNO3(тв.) + H2SO4 → NaHSO4 + HNO3
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например, хлорида натрия:
NaCl(тв. ) + H2SO4 → NaHSO4 + HCl
) + H2SO4 → NaHSO4 + HCl
4. Также серная кислота вступает в обменные реакции с солями.
Например, серная кислота взаимодействует с хлоридом бария:
H2SO4 + BaCl2 → BaSO4 + 2HCl
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется сульфат железа (II):
H2SO4(разб.) + Fe → FeSO4 + H2
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
H2SO4 + NH3 → NH4HSO4
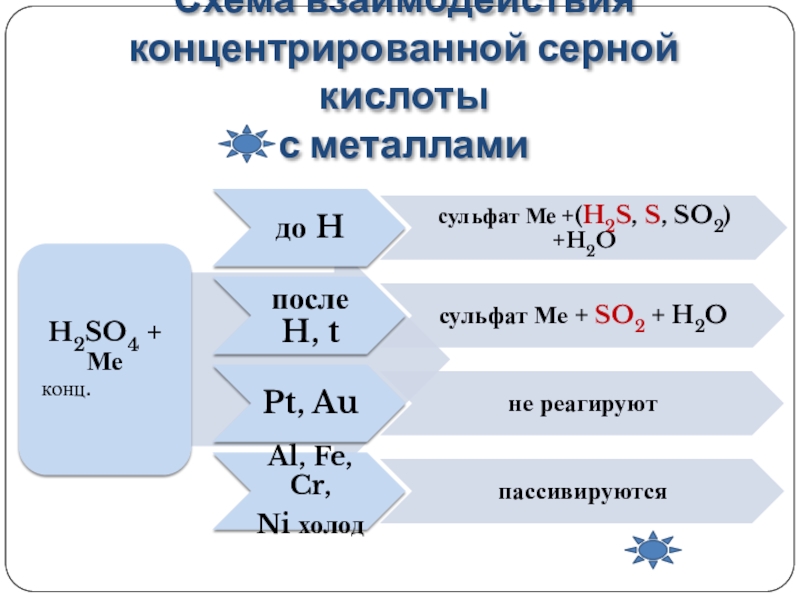
Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
6H2SO4(конц.) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2Al → Al2(SO4)3 + 3SO2 + 6H2O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц. ) + Hg → HgSO4 + SO2 ↑ + 2H2O
) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например, концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц. ) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O
Понравилось это:
Нравится Загрузка…
Реакции элементов 2 группы с кислотами
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3678
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице обсуждаются реакции элементов 2-й группы (бериллий, магний, кальций, стронций и барий) с обычными кислотами.
Реакции с разбавленной соляной кислотой
Каждый металл реагирует с разбавленной соляной кислотой с образованием пузырьков газообразного водорода и бесцветного раствора хлорида металла:
\[ X + 2HCl \rightarrow XCl_2 + H_2\]
Эти реакции становятся более энергичный вниз по группе.
Реакции с разбавленной серной кислотой
Это более сложно из-за образования нерастворимых сульфатов.
Бериллий и магний
Эти металлы реагируют с разбавленной серной кислотой так же, как с разбавленной соляной кислотой; реакция между магнием и разбавленной серной кислотой знакома многим начинающим химикам. Образуется газообразный водород, а также бесцветные растворы сульфата бериллия или магния. Например:
\[ Mg + H_2SO_4 \rightarrow MgSO_4 + H_2\]
Кальций, стронций и барий
Сульфат кальция малорастворим, а сульфаты стронция и бария практически нерастворимы. При воздействии серной кислоты на каждый из этих металлов образуется слой нерастворимого сульфата, замедляющий или полностью останавливающий реакцию. В случае с кальцием образуется некоторое количество водорода вместе с белым осадком сульфата кальция.
Реакции с азотной кислотой
Эти реакции более сложные. Когда металл реагирует с кислотой, металл обычно восстанавливает ионы водорода до газообразного водорода. Элементарный металл в процессе окисляется до катионов металлов.
Элементарный металл в процессе окисляется до катионов металлов.
Однако нитрат-ионы легко восстанавливаются до монооксида азота и диоксида азота. Следовательно, металлы, реагирующие с азотной кислотой, имеют тенденцию образовывать оксиды азота, а не газообразный водород. Если кислота относительно разбавлена, в результате реакции образуется монооксид азота, хотя он немедленно реагирует с атмосферным кислородом, образуя диоксид азота. При использовании концентрированной азотной кислоты непосредственно образуется диоксид азота.
Бериллий
Различные источники расходятся во мнениях относительно того, реагирует ли бериллий с азотной кислотой. Бериллий образует прочный оксидный слой (похожий на алюминий), который замедляет реакции до тех пор, пока его не удалят.
Некоторые источники говорят, что бериллий не реагирует с азотной кислотой. Однако способы получения нитрата бериллия путем взаимодействия порошка бериллия с азотной кислотой легко доступны. Один источник использует полуконцентрированную азотную кислоту, утверждая, что выделяющийся газ представляет собой монооксид азота. Это разумный вывод.
Это разумный вывод.
Реакционная способность бериллия, по-видимому, зависит от его источника и способа его изготовления. Не исключено, что небольшие количества примесей в металле могут влиять на его реакционную способность.
Другие металлы группы 2
Остальные металлы группы 2 производят газообразный водород из очень разбавленной азотной кислоты, но этот газ загрязнен оксидами азота. Образуются также бесцветные растворы нитратов металлов. Возьмем в качестве примера магний, если раствор очень разбавлен:
\[ Mg + 2HNO_3 \rightarrow Mg(NO_3)_2 + H_2\]
При умеренных концентрациях (даже с очень разбавленной кислотой это происходит в некоторой степени):
\[ 3Mg + 8HNO_3 \rightarrow 3Mg(NO_3)_2 + 2NO + 4H_2O\]
И с концентрированной кислотой:
\[ Mg + 4HNO_3 \rightarrow Mg(NO_3)_2 + 2NO_2 + 2H_2O\]
Авторы и ссылки
Джим Кларк (Chemguide.co.uk)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- кислота
- барий
- Бериллий
- кальций
- соляная кислота
- Магний
- азотная кислота
- стронций
- серная кислота
Серная кислота — MOTM май 2008 г.
Серная кислота — MOTM май 2008 г. — версия Jmol| | Майк Томпсон Также доступны: версии HTML, VRML и Chime. | |
Правописание
Если вы хотите, чтобы эта молекула месяца была на sul ph мочевой кислоте, а не на sul f мочевая кислота, нажмите на знак опасности (справа). Раньше его называли «купоросным маслом». На самом деле было бы даже лучше назвать его серной (VI) кислотой.
Контактный процесс
Серная кислота производится в больших количествах, чем любая другая кислота. Почти каждое промышленное изделие в современном мире на каком-то этапе своей истории контактирует с H 2 SO 4 . Это настолько важно, что когда-то годовое производство серной кислоты считалось мерой степени индустриализации страны и заслужило прозвище «король химикатов».
Серная кислота (H 2 SO 4 ) по-прежнему является чрезвычайно важным химическим веществом, используемым в производстве удобрений и взрывчатых веществ. В настоящее время он производится из диоксида серы по контактному процессу. В этом процессе кислород, O 2 , и диоксид серы, SO 2 , реагируют вместе при 450 ° C и давлении 2 атмосферы с помощью оксида ванадия (V) с образованием триоксида серы, SO 3 , газа в 98 % урожай. Затем его растворяют в воде, чтобы получить H 2 СО 4 . [Обратите внимание, что прямое растворение SO 3 в воде нецелесообразно из-за сильно экзотермической природы реакции, при которой вместо жидкости образуется коррозионный туман. Вместо этого SO 3 может быть поглощен существующим H 2 SO 4 для получения олеума (H 2 S 2 O 7 ), который затем может быть смешан с водой с образованием серной кислоты ]. Исходная реакция получения SO 3 имеет высокую энергию активации и поэтому без катализатора протекает очень медленно. Это стало экономически жизнеспособным только тогда, когда в 1746 году Джон Робак разработал процесс со свинцовой камерой, который катализирует реакцию с использованием оксидов азота через промежуточное образование HOSO 9.
В настоящее время он производится из диоксида серы по контактному процессу. В этом процессе кислород, O 2 , и диоксид серы, SO 2 , реагируют вместе при 450 ° C и давлении 2 атмосферы с помощью оксида ванадия (V) с образованием триоксида серы, SO 3 , газа в 98 % урожай. Затем его растворяют в воде, чтобы получить H 2 СО 4 . [Обратите внимание, что прямое растворение SO 3 в воде нецелесообразно из-за сильно экзотермической природы реакции, при которой вместо жидкости образуется коррозионный туман. Вместо этого SO 3 может быть поглощен существующим H 2 SO 4 для получения олеума (H 2 S 2 O 7 ), который затем может быть смешан с водой с образованием серной кислоты ]. Исходная реакция получения SO 3 имеет высокую энергию активации и поэтому без катализатора протекает очень медленно. Это стало экономически жизнеспособным только тогда, когда в 1746 году Джон Робак разработал процесс со свинцовой камерой, который катализирует реакцию с использованием оксидов азота через промежуточное образование HOSO 9. 0205 2 ОНО. Можно утверждать, что открытие этого процесса стало катализатором промышленной революции (а также реакции!) в Великобритании и в результате даже помогло создать Британскую империю!
0205 2 ОНО. Можно утверждать, что открытие этого процесса стало катализатором промышленной революции (а также реакции!) в Великобритании и в результате даже помогло создать Британскую империю!
Свойства серной кислоты
При комнатной температуре чистая серная кислота (100 %) представляет собой ковалентную жидкость. Концентрированная серная кислота 98% (18,7М) представляет собой маслянистую жидкость плотностью 1,83 г/см 3 . Он разлагается при его к.п. (330C) и образует белые пары.
H 2 SO 4 (л) H 2 O (г) + SO 3 (г).
Обратная реакция — как получить серную кислоту.
Для получения информации о безопасности щелкните здесь.
В концентрированном виде обладает несколькими важными свойствами; кислота, окислитель и осушитель, что делает его очень универсальным реагентом. На вкус кислый, а не в лаборатории! Он окрашивает синий лакмус в красный цвет, за исключением случаев, когда это ковалентная молекула 9. 0197 т.е. . 100% H 2 SO 4 .
0197 т.е. . 100% H 2 SO 4 .
Концентрированная серная кислота очень гигроскопична. Его сродство к воде настолько велико, что если оставить стакан наполовину наполненным конц. H 2 SO 4 в течение трех недель его объем значительно увеличился бы, и он стал бы более разбавленным, поскольку поглотил бы так много водяного пара из воздуха.
Тест на серную кислоту (и растворимые сульфаты)
Сначала добавьте разбавленную HNO 3 . Это необходимо для предотвращения осаждения других нерастворимых соединений бария, таких как BaCO 3 или BaSO 3 . Во-вторых, добавьте Ba(NO 3 ) 2 (водн.). Если присутствует серная кислота или сульфат, немедленно будет наблюдаться белый осадок.
Ba 2+ (водн.) + SO 4 2- (водн.) BaSO 4 (тв.) [белый]
В качестве окислителя
Горячая концентрированная серная кислота является окислителем, когда она принимает электроны. Электроны поставляются восстановителем в реакции:
Электроны поставляются восстановителем в реакции:
2 H 2 SO 4 (водн.) + 2e — SO 4 2- (водн.) + 2 H 2 O (л) + SO 9020 5 2 (г)
Реакции с металлами
Zn (s) + 2 H 2 SO 4 (конц.) ZnSO 4 (водн.) + 2H 2 O (л) + SO 2 (г)
Fe (т) + 2 H 2 SO 4 (конц.) FeSO 4 (водн.) + 2H 2 O (л) + SO 2 (г)
Mg (т) + 2 H 2 SO 4 (конц.) MgSO 4 (водн.) + 2H 2 O (ж) + SO 2 (г) 9003 2
Cu (т) + 2 H 2 SO 4 (конц.) CuSO 4 (водн.) + 2H 2 O (л) + SO 2 (г)
Реакции с неметаллами
S (т) + 2 H 2 SO 4 (конц.) 2 H 2 O (л) + 3 SO 2 (г)
C (т) + 2 H 2 SO 4 (конц) 2 H 2 O (ж) + 2 SO 2 (г) + CO 2 (г)
Диоксид серы можно определить с помощью полоски фильтровальной бумаги, смоченной бихроматом калия, цвет которой меняется с оранжевого на зеленый.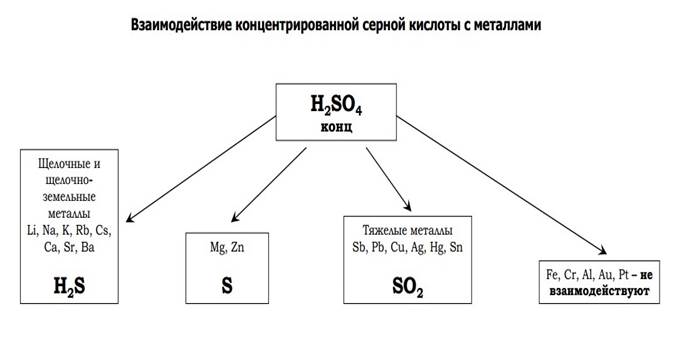
Галогенные соли с конц. серная кислота
Хлориды
Хлориды реагируют только одним образом, независимо от температуры.
NaCl (т) + H 2 SO 4 (л) HCl (г) + NaHSO 4 (т)
Видны туманные пары газообразного хлороводорода. Причина, по которой газообразный хлор не образуется, заключается в том, что серная кислота недостаточно мощна для окисления ионов хлора.
Бромиды
Ионы брома являются более сильным восстановителем, чем ионы хлорида. Поскольку ионы брома больше ионов хлорида, их электроны легче удалить. Ионы брома восстанавливают серную кислоту до диоксида серы в два этапа.
NaBr (т) + H 2 SO 4 (л) HBr (г) + NaHSO 4 (т)
2 HBr (г) + H 2 SO 4 (л) Br 2 (л) + 2 H 2 О (л) + SO 2 (г)
Йодиды
Иодид-ионы даже больше, чем бромид-ионы, а йодид-электроны еще легче удалить. Ионы йодида восстанавливают концентрированную серную кислоту до газообразного йодистого водорода, который дополнительно восстанавливает серную кислоту тремя способами при комнатной температуре.
Ионы йодида восстанавливают концентрированную серную кислоту до газообразного йодистого водорода, который дополнительно восстанавливает серную кислоту тремя способами при комнатной температуре.
Уравнение 1: 8 HI (г) + H 2 SO 4 (л) 4 I 2 (т) + H 2 S (г) + 4 H 2 O (л)
Уравнение 2: 6 HI (г) + H 2 SO 4 (л) 3 I 2 (т) + S (т) + 3 H 2 O (л) 90 032
Уравнение 3: 2 HI (г) + H 2 SO 4 (л) I 2 (т) + SO 2 (г) + H 2 90 206 О (л)
Что можно ожидать, если конц. серной кислоты добавляли к твердому йодиду натрия?
- Запах тухлых яиц из-за токсичности H 2 S (уравнение 1)
- фиолетовый пар йода (уравнения 1-3)
- коричневый вследствие образования трийодидов (I 2 + I — I 3 — )
- темно-серое твердое вещество йода, конденсирующееся на холодной стеклянной посуде
Применение серной кислоты
- азотные удобрения, такие как сульфат аммония (NH 4 ) 2 SO 4
2 NH 3 (водн. ) + H 2 SO 4 (водн.) (NH 4 ) 2 SO 4 (водн.)
) + H 2 SO 4 (водн.) (NH 4 ) 2 SO 4 (водн.) - получение перекиси водорода (H 2 O 2 ) реакцией перекиси бария с серной кислотой. Нерастворимый сульфат бария можно отфильтровать, оставив раствор перекиси водорода.
BaO 2 (т) + H 2 SO 4 (водн.) BaSO 4 (т) + H 2 О 2 (водный) - «протравка» для очистки металлических поверхностей (см. фотографии справа)
- извлечение металлов
- HCl по Мангеймскому процессу
2 NaCl + H 2 SO 4 (водный) Na 2 SO 4 + 2 HCl - моющие средства и мыло
- очиститель канализации
- сушильные газы (кроме аммиака)
- краски и пигменты
- Производство натуральных и искусственных волокон
- Производство суперфосфата
- ВЧ производство
Ca 5 F(PO 4 ) 3 + 5H 2 SO 4 + 10H 2 O 5CaSO 4 . 2 H 2 O + HF + 3H 3 PO 4
2 H 2 O + HF + 3H 3 PO 4 - электролит (33% H 2 SO 4 ) в свинцово-кислотных аккумуляторных батареях, используемых в автомобилях.
Концентрированная серная кислота очень хорошо удаляет воду из сахаров. Когда элементы воды удаляются из сахарозы, это приводит к черной массе углерода (см. фото слева и страницу «Молекула месяца» о глюкозе).
C 12 H 22 O 11 (s) + n H 2 SO 4 (l) 12 C (s) + 1 1 Ч 2 O (л) + n H 2 SO 4 (л)
Серная кислота также может быть использована для дегидратации натриевых солей некоторых карбоновых кислот. Это использование серной кислоты уже упоминалось на странице «Молекула месяца», посвященной угарному газу. Реакции включают протонирование кислотой с последующей дегидратацией.
Реакции серной кислоты
С основаниями
Разбавленная серная кислота нейтрализует основные оксиды или гидроксиды с образованием сульфатных солей и воды. Не забывайте, что серная кислота — сильная кислота (полностью ионизируется в воде).
Не забывайте, что серная кислота — сильная кислота (полностью ионизируется в воде).
CuO (т) + H 2 SO 4 (водн.) CuSO 4 (водн.) + H 2 O (л)
ZnO (т) + H 2 SO 4 (водн.) ZnSO 4 (водн.) + H 2 O (л)
Cu(OH) 2 (с) + H 2 SO 4 (водн.) CuSO4 (водн.) + 2 H 2 O (л)
Zn(OH) 2 (т) + H 2 SO 4 (водн.) ZnSO4 (водн.) + 2 H 2 O (л)
Поскольку серная кислота является двухосновной (ионизируется в две стадии), при взаимодействии с гидроксидом натрия она может образовывать две возможные соли натрия. Чтобы увидеть, какая из них предпочтительнее, вам нужно рассмотреть стехиометрию (количество молей в сбалансированном уравнении) для следующих двух реакций.
2 NaOH (водн.) + H 2 SO 4 (водн. ) Na 2 SO 4 (водн.) + 2 H 2 O (л)
) Na 2 SO 4 (водн.) + 2 H 2 O (л)
NaOH (водн.) + H 2 SO 4 (водн.) NaHSO 4 (водн.) + H 2 O (л)
С карбонатами
Разбавленная серная кислота нейтрализует основные карбонаты с образованием сульфатных солей, воды и двуокиси углерода, что приводит к вскипанию (как показано на фото справа).
Na 2 CO 3 (водн.) + H 2 SO 4 (водн.) Na 2 SO 4 (водн.) + H 90 205 2 О (л) + СО 2 ( г)
MgCO 3 (водн.) + H 2 SO 4 (водн.) MgSO 4 (водн.) + H 2 O (л) + CO 2 9 0206 (г)
Скорость реакции зависит не только от площади поверхности карбоната, концентрации и температуры кислоты, но и от растворимости сульфата. Когда мрамор (CaCO 3 ) вступает в реакцию с разбавленным H 2 SO 4 сначала вскипает, но поскольку сульфат кальция мало растворим в воде, после того как он образуется в виде отложений на поверхности мрамора, реакция вскоре замедляется.
С металлами
Разбавленная серная кислота реагирует с металлами выше водорода в ряду реакционной способности с образованием сульфатных солей и газообразного водорода. Обратите внимание, что реакции металлов с концентрированной серной кислотой различны.
Mg (т) + H 2 SO 4 (водн.) MgSO 4 (водн.) + H 2 (г)
Zn (т) + H 2 SO 4 (водн.) ZnSO 4 (водн.) + H 2 (г)
Fe (т) + H 2 SO 4 (водн.) FeSO 4 (водн.) + H 2 (г)
Железо очищают от ржавчины перед покрытием оловом для получения белой жести и цинком для получения оцинкованного железа.
Сульфаты
Самое большое (80%) использование серной кислоты в производстве сульфатов.
Гипс представляет собой CaSO 4 .2H 2 O и используется для изготовления гипсовых плит, а также гипсовых слепков (см. фото справа). Слабительное « эпсомская соль » представляет собой MgSO 4 .7H 2 O, а зеленый купорос представляет собой FeSO 4 .7H 2 O. В 164 8, Глаубер получил серную кислоту путем перегонки кристаллов этой соли. . Сульфат калия необычен тем, что кристаллизуется без кристаллизационной воды и имеет формулу К 2 СО 4 . Поскольку серная кислота является двухосновной (двухосновной), она способна образовывать две соли в зависимости от количества щелочи, присутствующей в реакционной смеси;
фото справа). Слабительное « эпсомская соль » представляет собой MgSO 4 .7H 2 O, а зеленый купорос представляет собой FeSO 4 .7H 2 O. В 164 8, Глаубер получил серную кислоту путем перегонки кристаллов этой соли. . Сульфат калия необычен тем, что кристаллизуется без кристаллизационной воды и имеет формулу К 2 СО 4 . Поскольку серная кислота является двухосновной (двухосновной), она способна образовывать две соли в зависимости от количества щелочи, присутствующей в реакционной смеси;
2 NaOH (водн.) + H 2 SO 4 (водн.) Na 2 SO 4 (водн.) + H 2 O (л)
NaOH (водн.) + H 2 SO 4 (водн.) NaHSO 4 (водн.) + H 2 O (л)
Серная кислота в космосе
В 1999 году на спутнике Юпитера Европе была обнаружена твердая (замороженная) серная кислота.

 Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800
Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800


 ) + H 2 SO 4 (водн.) (NH 4 ) 2 SO 4 (водн.)
) + H 2 SO 4 (водн.) (NH 4 ) 2 SO 4 (водн.) 2 H 2 O + HF + 3H 3 PO 4
2 H 2 O + HF + 3H 3 PO 4
Leave A Comment