Чтобы понять, с чем реагирует медь, нужно провести химические реакции в лабораторных условиях
Медь является одним из наиболее популярных представителей группы цветных металлов, используемых в промышленности. В таблице Менделеева элемент имеет порядковый номер 29 и обозначается как Cu.
Физические свойства
Данный металл имеет следующие физические характеристики, отличающие его от других элементов:
- Цвет – ярко-рыжий, с розоватым оттенком. При обнаружении медной руды можно принять ее за ржавый предмет.
- При механической обработке или переплавке обладает характерным блеском.
- Характеризуется повышенной пластичностью, легко поддается обработке, штамповке и вытягиванию в проволоку.
- Имеет один из самых высоких показателей электропроводности, что позволяет широко использовать металл при изготовлении проводов.
- Плотность 8920 кг/м3, что почти на 1000 кг больше промышленной стали.
- Начинает плавиться при температуре свыше 1100оС, а закипает при достижении 2500оС.

- При контакте с атмосферным воздухом длительное время начинает покрываться характерной пленкой с зеленым оттенком.
Таким образом, металл имеет свойство самостоятельно противостоять окислению, и изделия из меди пользуются повышенным спросом во многих отраслях промышленности.
Химические реакции с участием меди
В металлургической индустрии медь используется в различных соединениях, вступая в реакцию с другими веществами, что способствует улучшению ее эксплуатационных качеств:
- Оксидные соединения данного металла получаются на основе 2 базовых реакций:
- 2Cu + O2 = 2CuO.
- 4Cu + O2 = 2Cu2O – реакция проходит при нагревании Cu до 140оС и выше.
- Сульфиды меди выделяются при соединении элемента с серой
2Cu + S = Cu2S, активность соединения наступает при повышении температуры.
- Чтобы понять, с чем реагирует медь, необходимо провести реакции с галогенами, например, с бромом, фтором или хлором:
- Cu + Br2 = CuBr2;
- Cu + F2 = CuF2;
- Cu + Cl2 = CuCl2; –
из этих примеров видно, что общая формула реакции выглядит как Cu + Hal2 = CuHal2.
- Данный металл хорошо реагирует с некоторыми концентрированными или разбавленными кислотами, образуя соли, летучие газы и воду:
- с азотной кислотой – 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O;
- с дигидрогенсульфатом – Cu + 2h3SO4 = CuSO4 + SO2 + 2h3O;
- с хлороводородным соединением – Cu + 3HCl = H(CuCl3) + h3.
- При спекании меди с оксидами таких же или других металлов получаются кислородные соединения, обладающие иными свойствами и валентностью:
- с бинарной связью меди и кислорода – Cu + CuO = Cu2O;
- с оксидом железа – Cu + Fe2O3 = 2FeO + CuO.
- При взаимодействии с солями других металлов медь позволяет выделить чистый элемент из жидкого раствора:
- с нитратом серебра – Cu + 2AgNO3 = Cu(NO3)2 + 2Ag, где чистое серебро выпадает в осадок;
- с сульфатом железа – Cu + Fe2(SO4)3 = CuSO4 + 2FeSO4.
Медь также подвергается коррозии под воздействием воды, углекислого газа и кислорода, содержащихся в атмосфере: 2Cu + h3O + CO2 + O2 = (CuOH)2CO3, и данное вещество образует упомянутую выше карбонатную пленку с зелено-серым оттенком.
Медь и ее производные используются во многих отраслях промышленности – при производстве проводов, труб, фитингов, деталей для бытового, медицинского и другого оборудования. Кроме того, данный элемент применяется как катализатор многих химических реакций с целью получения ценных материалов и веществ для смежных индустрий.
Глава 2. Химические свойства меди и ее соединений
§1. Химические свойства простого вещества (ст. ок. = 0).
а) Отношение к кислороду.
В отличие от своих соседей по подгруппе – серебра и золота, — медь непосредственно реагирует с кислородом. Медь проявляет к кислороду незначительную активность, но во влажном воздухе постепенно окисляется и покрывается пленкой зеленоватого цвета, состоящей из основных карбонатов меди:
В сухом воздухе окисление идет очень медленно, на поверхности меди образуется тончайший слой оксида меди:
 К тому
же слой оксида настолько тонок, что
пропускает свет, т.е. просвечивает.
По-иному медь окисляется при нагревании,
например, при 600-800 0C.
В первые секунды окисление идет до
оксида меди (I),
которая с поверхности переходит в оксид
меди (II)
черного цвета. Образуется двухслойное
окисное покрытие.
К тому
же слой оксида настолько тонок, что
пропускает свет, т.е. просвечивает.
По-иному медь окисляется при нагревании,
например, при 600-800 0C.
В первые секунды окисление идет до
оксида меди (I),
которая с поверхности переходит в оксид
меди (II)
черного цвета. Образуется двухслойное
окисное покрытие.Qобразования (Cu2O) = 84935 кДж.
Рисунок 2. Строение оксидной пленки меди.
б) Взаимодействие с водой.
Металлы подгруппы меди стоят в конце электрохимического ряда напряжений, после иона водорода. Следовательно, эти металлы не могут вытеснять водород из воды. В то же время водород и другие металлы могут вытеснять металлы подгруппы меди из растворов их солей, например:
.
Эта реакция окислительно-восстановительная, так как происходит переход электронов:
Молекулярный
водород вытесняет металлы подгруппы
меди с большим трудом. Объясняется это
тем, что связь между атомами водорода
прочная и на ее разрыв затрачивается
много энергии. Реакция же идет только
с атомами водорода.
Объясняется это
тем, что связь между атомами водорода
прочная и на ее разрыв затрачивается
много энергии. Реакция же идет только
с атомами водорода.
Медь при отсутствии кислорода с водой практически не взаимодействует. В присутствии кислорода медь медленно взаимодействует с водой и покрывается зеленой пленкой гидроксида меди и основного карбоната:
в) Взаимодействие с кислотами.
Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислота на медь не действуют.
Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей:
Исключение составляет только иодоводородная кислота, которая вступает в реакцию с медью с выделением водорода и образованием очень устойчивого комплекса меди (I):
2Cu + 3HI → 2H[CuI2] +H2↑
Медь так же реагирует с кислотами – окислителями, например, с азотной:
Cu
+ 4HNO3(конц.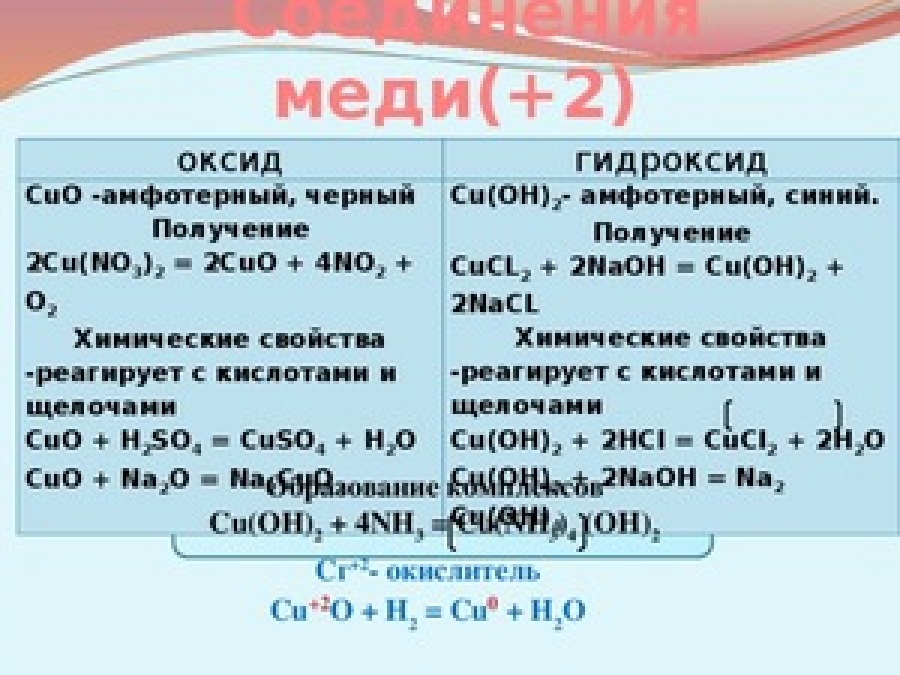 ) →
Cu(NO
) →
Cu(NO
3Cu + 8HNO3(разбав.) → 3Cu(NO3)2+2NO↑+4H2O
А так же с концентрированной холодной серной кислотой:
Cu + H2SO4(конц.) → CuO + SO2↑ + H2O
C горячей концентрированной серной кислотой:
Cu
+ 2H2SO4(конц.,
C безводной серной кислотой при температуре 2000С образуется сульфат меди (I):
2Cu
+ 2H2SO4(безводн. ) 200
°C→
Cu2SO4↓
+ SO2↑
+ 2H2O
) 200
°C→
Cu2SO4↓
+ SO2↑
+ 2H2O
г) Отношение к галогенам и некоторым другим неметаллам.
Qобразования (CuCl) = 134300 кДж
Qобразования (CuCl2) = 111700 кДж
Медь
хорошо реагирует с галогенами, дает два
вида галогенидов: CuX
и CuX2..
При действии галогенов при комнатной
температуре видимых изменений не
происходит, но на поверхности вначале
образуется слой адсорбированных молекул,
а затем и тончайший слой галогенидов.
При нагревании реакция с медью происходит
очень бурно. Нагреем медную проволочку
или фольги и опустим ее в горячем виде
в банку с хлором – около меди появятся
бурые пары, состоящие из хлорида меди
(II)
CuCl2 с
примесью хлорида меди (I)
CuCl.
Реакция происходит самопроизвольно за
счет выделяющейся теплоты.
При этом монохлорид выпадает из раствора в виде белого осадка на поверхности меди.
Медь так же достаточно легко ступает в реакции с серой и селеном при нагревании (300—400 °C):
2Cu +S→Cu2S
2Cu +Se→Cu2Se
А вот с водородом, углеродом и азотом медь не реагирует даже при высоких температурах.
д) Взаимодействие с оксидами неметаллов
Медь при нагревании может вытеснять из некоторых оксидов неметаллов (например, оксид серы (IV) и оксиды азота (II, IV)) простые вещества, образуя при этом термодинамически более устойчивый оксид меди (II):
4Cu+SO2 600-800°C →2CuO + Cu2S
4Cu+2NO2 500-600°C →4CuO + N2↑
2Cu+2NO 500-600°C →2CuO + N2↑
§2. Химические свойства одновалентной меди
(ст.ок. = +1)
Химические свойства одновалентной меди
(ст.ок. = +1)
В водных растворах ион Cu+ очень неустойчив и диспропорционирует:
Cu+↔Cu0+Cu2+
Однако медь в степени окисления (+1) может стабилизироваться в соединениях с очень низкой растворимостью или за счет комплексообразовния [9].
а) Оксид меди (I) Cu2O
Амфотерный оксид. Кристаллическое вещество коричнево-красного цвета. В природе встречается в виде минерала куприта. Исскуственно может быть получен нагреванием раствора соли меди (II) с щелочью и каким-нибудь сильным восстановителем, например, формалином или глюкозой [11]. Оксид меди(I) не реагирует с водой. Оксид меди(I) переводится в раствор концентрированной соляной кислотой с образованием хлоридного комплекса:
Cu2O+4HCl→2H[CuCl2]+ H2O
Так же растворим в концентрированном растворе аммиака и солей аммония:
Cu2O+2NH4+→2[Cu(H2O)(NH3)]+
В разбавленной серной кислоте диспропорционирует на двухвалентную медь и металлическую медь:
Cu2O+H2SO4(разбав. ) →CuSO4+Cu0↓+H2O
) →CuSO4+Cu0↓+H2O
Также оксид меди(I) вступает в водных растворах в следующие реакции:
1. Медленно окисляется кислородом до гидроксида меди(II):
2Cu2O+4H2O+O2→4Cu(OH)2↓
2. Реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди(I):
Cu2O+2HГ→2CuГ↓ +H2O (Г=Cl, Br, J)
3.Восстанавливается до металлической меди типичными восстановителями, например, гидросульфитом натрия в концентрированном растворе:
2Cu2O+2NaSO3→4Cu↓+Na2SO4+H2SO4
Оксид меди(I) восстанавливается до металлической меди в следующих реакциях:
1. При нагревании до 1800 °C (разложение):
При нагревании до 1800 °C (разложение):
2Cu2O —1800 °C →2Cu +O2
2. При нагревании в токе водорода, монооксида углерода, с алюминиеми прочими типичными восстановителями:
Cu2O + H2 —>250°C→2Cu +H2O
Cu2O + CO —250-300°C→2Cu +CO2
3Cu2O + 2Al —1000°C→6Cu +Al2O3
Также, при высоких температурах оксид меди(I) реагирует:
1. C аммиаком (образуется нитрид меди(I))
3Cu2O + 2NH3 —250°C→2Cu3N + 3H2O
2. С оксидами щелочных металлов:
С оксидами щелочных металлов:
Cu2O+M2O-600-800°C →2МCuO (M= Li, Na, K)
При этом образуются купраты меди (I).
Оксид меди (I) заметно реагирует с щелочами [9]:
Cu2O+2NaOH(конц.) +H2O↔2Na[Cu(OH)2]
б) Гидроксид меди (I) CuOH
Гидроксид меди(I) образует жёлтое вещество, не растворяется в воде.
Легко разлагается при нагревании или кипячении:
2CuOH → Cu2O + H2O
в) Галогениды CuF, CuСl, CuBr и CuJ
Все
эти соединения – белые кристаллические
вещества, плохо растворимые в воде, но
хорошо растворимые в избытке NH3,
цианидных ионов, тиосульфатных ионов
и иных сильных комплексообразователей. Иод образует только соединениеCu+1J.
В газообразном состоянии образуются
циклы типа (CuГ)3 [10]. Обратимо растворимы в соответствующих
галогенводородных кислотах:
Иод образует только соединениеCu+1J.
В газообразном состоянии образуются
циклы типа (CuГ)3 [10]. Обратимо растворимы в соответствующих
галогенводородных кислотах:
CuГ + HГ ↔ H[CuГ2] (Г=Cl, Br, J)
Хлорид и бромид меди (I) неустойчивы во влажном воздухе и постепенно превращаются в основные соли меди (II):
4CuГ +2H2O +O2 →4Cu(OH)Г (Г=Cl, Br)
г) Прочие соединения меди (I)
1.
Ацетат меди (I) (СН3СООСu)
— соединение меди, имеет вид бесцветных
кристаллов. В воде медленно гидролизуется
до Сu2О,
на воздухе окисляется до ацетата
двухвалентной меди; Получают СН3СООСu
восстановлением (СН3СОО)2Сu
водородом или медью, сублимацией
(СН3СОО)2Сu
в вакууме или взаимодействием (NH3OH)SO4 с (СН3СОО)2Сu
в р-ре в присутствии Н3СООNH3. Вещество токсично.
Вещество токсично.
2. Ацетиленид меди(I) — красно-коричневые, иногда черные кристаллы. В сухом виде кристаллы детонируют при ударе или нагреве. Устойчивы во влажном состоянии. При детонации в отсутствие кислорода не образуется газообразных веществ. Под действием кислот разлагается. Образуется в виде осадка при пропускании ацетилена в аммиачные растворы солей меди(I):
С2H2 +2[Cu(NH3)2](OH) →Cu2C2↓ +2H2O+2NH3
Данная реакция используется для качественного обнаружения ацетилена.
3. Нитрид меди — неорганическое соединение с формулой Cu3N, тёмно-зелёные кристаллы.
Разлагается при нагревании:
2Cu3N —300°C→6Cu +N2↑
Бурно реагирует с кислотами:
2Cu3N +6HCl —300°C→3Cu↓ +3CuCl2 +2NH3↑
§3. Химические свойства двухвалентной меди
(ст.ок. = +2)
Химические свойства двухвалентной меди
(ст.ок. = +2)
Наиболее устойчивая степень окисления у меди и самая характерная для нее.
а) Оксид меди (II) CuO
CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета. Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
CuO + 2HNO3→Cu(NO3)2 +H2O
При сплавлении CuO со щелочами образуются купраты меди (II):
CuO+2KOH—t°→K2CuO2 +H2O
При нагревании до 1100 °C разлагается [9]:
4CuO-t°→2Cu2O + O2
б) Гидроксид меди (II) Cu(OH)2
Гидроксид
меди(II) — голубое аморфное или кристаллическое
вещество, практически не растворимое
в воде. При нагревании до 70-90 °C порошка
Cu(ОН)2 или его водных суспензий разлагается
до CuО и Н2О:
При нагревании до 70-90 °C порошка
Cu(ОН)2 или его водных суспензий разлагается
до CuО и Н2О:
Cu(OH)2 → CuO + H2O
Является амфотерным гидроксидом. Реагирует с кислотами с образованием воды и соответствующей соли меди:
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты (II):
Гидроксид меди(II) со слабыми кислотами образует основные соли [11]. Очень легко растворяется в избытке аммиака с образованием аммиаката меди:
Cu(OH)2+4NH4OH→[Cu(NH3)4](OH)2+4H2O
Аммиакат
меди имеет интенсивный сине-фиолетовый
цвет, поэтому его используют в аналитической
химии для определения малых количеств
ионов Cu2+ в
растворе.
в) Соли меди (II)
Простые соли меди (II) известны для большинства анионов, кроме цианида и иодида, которые при взаимодействии с катионом Cu2+ образуют ковалентные соединения меди (I), нерастворимые в воде.
Соли меди (+2), в основном, растворимы в воде. Голубой цвет их растворов связан с образованием иона [Cu(H2O)4]2+. Они часто кристаллизуются в виде гидратов. Так, из водного раствора хлорида меди (II) ниже 150С кристаллизуется тетрагидрат, при 15-260С – тригидрат, свыше 260С – дигидрат. В водных растворах соли меди (II) в небольшой степени подвержены гидролизу, и из них часто осаждаются основные соли [9].
1. Пентагидрат сульфата меди (II) (медный купорос)
Наибольшее
практическое значение имеет CuSO4*5H2O,
называемый медным купоросом. Сухая соль
имеет голубую окраску, однако при
несильном нагревании (2000С)
она теряет кристаллизационную воду. Безводная соль белого цвета. При
дальнейшем нагревании до 7000С
она превращается в оксид меди, теряя
триоксид серы:
Безводная соль белого цвета. При
дальнейшем нагревании до 7000С
она превращается в оксид меди, теряя
триоксид серы:
CuSO4—t°→CuO+SO3↑
Готовят медный купорос растворением меди в концентрированной серной кислоте. Эта реакция описана в разделе «Химические свойства простого вещества». Медный купорос применяют при электролитическом получении меди, в сельском хозяйстве для борьбы с вредителями и болезнями растений, для получения других соединений меди [9].
2. Дигидрат хлорида меди (II).
Это темно-зеленые кристаллы, легкорастворимые в воде. Концентрированные растворы хлорида меди имеют зеленый цвет, а разбавленные – голубой. Это объясняется образованием хлоридного комплекса зеленого цвета:
Cu2++4Cl— →[CuCl4]2-
И
его дальнейшим разрушением и образованием
голубого аквакомплекса.
3. Тригидрат нитрата меди (II).
Кристаллическое вещество синего цвета. Получается при растворении меди в азотной кислоте. При нагревании кристаллы сначала теряют воду, затем разлагаются с выделением кислорода и диоксида азота, переходя в оксид меди (II):
2Cu(NO3)2—t°→2CuO+4NO2↑+O2↑
4. Карбонат гидроксомеди (II).
Карбонаты меди малоустойчивы и в практике почти не применяются. Некоторое значение для получения меди имеет лишь основной карбонат меди Cu2(OH)2CO3, который встречается в природе в виде минерала малахита. При нагревании легко разлагается с выделением воды, оксида углерода (IV) и оксида меди (II):
Cu2(OH)2CO3—t°→2CuO+H2O↑+CO2↑
§4. Химические свойства трехвалентной меди
(ст.ок. = +3)
Химические свойства трехвалентной меди
(ст.ок. = +3)
Эта степень окисления является наименее стабильной для меди, и поэтому соединения меди (III) являются скорее исключениями, чем «правилами». Тем не менее, некоторые соединения трехвалентной меди существуют.
а) Оксид меди (III) Cu2O3
Это кристаллическое вещество, темно-гранатового цвета. Не растворяется в воде.
Получается окислением гидроксида меди(II) пероксодисульфатом калия в щелочной среде при отрицательных температурах:
2Cu(OH)2 +K2S2O8+2KOH —-20°C→Cu2O3↓+2K2SO4+3H2O
Это вещество разлагается при температуре 4000С:
Cu2O3—t°→2CuO+O2↑
Окисид
меди (III)
– сильный окислитель. При взаимодействии
с хлороводородом хлор восстанавливается
до свободного хлора [10]:
При взаимодействии
с хлороводородом хлор восстанавливается
до свободного хлора [10]:
Cu2O3+6HCl—t°→2CuCl2+Cl2↑+3H2O
б) Купраты меди (Ш)
Это черные или синие вещества, в воде не устойчивы, диамагнитны, анион – ленты квадратов (dsp2). Образуются при взаимодействии гидроксида меди(II) и гипохлорита щелочного металла в щелочной среде [10]:
2Cu(OH)2 + МClO + 2NaOH→2МCuO3 +NaCl +3H2O (M=Na—Cs)
в) Калия гексафторкупрат(III)
Зеленое
вещество, парамагнитно. Октаэдрическое
строение sp3d2.
Комплекс фторида меди CuF3,
который в свободном состоянии разлагается
при -600С.
Образуется нагреванием смеси хлоридов
калия и меди в атмосфере фтора:
Октаэдрическое
строение sp3d2.
Комплекс фторида меди CuF3,
который в свободном состоянии разлагается
при -600С.
Образуется нагреванием смеси хлоридов
калия и меди в атмосфере фтора:
3KCl + CuCl + 3F2 → K3[CuF6] + 2Cl2
Разлагает воду с образованием свободного фтора.
§5. Соединения меди в степени окисления (+4)
Пока науке известно лишь одно вещество, где медь в степени окисления +4, это гексафторкупрат(IV) цезия – Cs2Cu+4F6 — оранжевое кристаллическое вещество, стабильное в стеклянных ампулах при 00С. Бурно реагирует с водой. Получается фторированием при высоком давлении и температуре смеси хлоридов цезия и меди [10]:
CuCl2 +2CsCl +3F2 —t° р→ Cs2CuF6 +2Cl2
Химия меди — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3722
- Джим Кларк
- Школа Труро в Корнуолле
Медь относится к тому же семейству периодической таблицы, что и серебро и золото, поскольку у каждого из них есть один s-орбитальный электрон поверх заполненной электронной оболочки, которая образует металлические связи. Это сходство электронной структуры делает их похожими по многим характеристикам. Все они обладают очень высокой тепло- и электропроводностью и являются ковкими металлами. Среди чистых металлов при комнатной температуре медь имеет вторую по величине электрическую и теплопроводность после серебра.
Это сходство электронной структуры делает их похожими по многим характеристикам. Все они обладают очень высокой тепло- и электропроводностью и являются ковкими металлами. Среди чистых металлов при комнатной температуре медь имеет вторую по величине электрическую и теплопроводность после серебра.
Введение
Использование меди восходит к глубокой истории. Медные бусы были найдены на территории современного Ирака, датируемого 9000 годом до нашей эры. Металл относительно легко добывать и очищать, что способствует его раннему и широкому использованию. Однако, будучи мягким, он непригоден для изготовления надежных инструментов и оружия. Первые кузнецы еще за 3000 лет до нашей эры научились сочетать медь с другими металлами для получения более прочных сплавов. Латунь (медь и цинк) и бронза (медь и олово) являются двумя примерами. Символ и название меди происходят от латинского 9.0036 cuprum , что буквально означает «с острова Кипр», ранний источник медной руды.
До 1982 года пенни США были из чистой меди. Теперь они в основном цинковые с тонкой оболочкой из меди. Большая часть добываемой сегодня меди очищается и вытягивается в проволоку для использования в электротехнической промышленности. Значительная часть также используется в производстве водопроводных труб. Медь, конечно же, имеет характерный цвет, который знаком большинству людей. Он является одним из лучших электрических проводников и устойчив к коррозии от большинства кислот (кроме азотной и горячей концентрированной серной). При воздействии элементов в течение определенного периода времени на нем образуется зеленоватый налет или патина, представляющая собой карбонат меди (II), защитное покрытие, предотвращающее дальнейший износ.
Теперь они в основном цинковые с тонкой оболочкой из меди. Большая часть добываемой сегодня меди очищается и вытягивается в проволоку для использования в электротехнической промышленности. Значительная часть также используется в производстве водопроводных труб. Медь, конечно же, имеет характерный цвет, который знаком большинству людей. Он является одним из лучших электрических проводников и устойчив к коррозии от большинства кислот (кроме азотной и горячей концентрированной серной). При воздействии элементов в течение определенного периода времени на нем образуется зеленоватый налет или патина, представляющая собой карбонат меди (II), защитное покрытие, предотвращающее дальнейший износ.
Залежи и извлечение меди
Медь встречается как в связанном, так и в свободном состоянии, а также во многих рудах. Важными рудами меди являются медный пирит (\(CuFeS_2\)), куприт и медный глянец. Медные руды в основном находятся на севере Индии. Извлечение меди также включает в себя множество стадий. Руда, используемая для добычи, представляет собой медный колчедан, который измельчается, концентрируется и затем нагревается в присутствии воздуха. При нагревании влага удаляется, а колчедан меди превращается в сульфид железа и сульфид меди.
Руда, используемая для добычи, представляет собой медный колчедан, который измельчается, концентрируется и затем нагревается в присутствии воздуха. При нагревании влага удаляется, а колчедан меди превращается в сульфид железа и сульфид меди.
\[ 2CuFeS_2 + O_2 \rightarrow Cu_2S + 2FeS + SO_2 \]
Доменная печь предназначена для нагрева смеси обожженной руды, порошкообразного кокса и песка. В доменной печи происходят реакции окисления. Сульфид железа образует оксид железа, который соединяется с кремнеземом и образует шлак (\(FeSiO_2\)).
\[ 2FeS + 3O_2 \rightarrow 2FeO + 2SO_2\]
\[ FeO + SiO_2 \rightarrow FeSiO_3\]
Сульфид меди образует закись меди, которая частично превращается в сульфид меди.
\[ Cu_2S + 3 O_2 \rightarrow 2Cu_2O + 2SO_2\]
\[ Cu_2O + FeS \rightarrow Cu_2S + FeO\]
Этот сульфид меди содержит некоторое количество сульфида железа и называется штейном. Штейн удаляют из основного выхода доменной печи. Удаленный штейн переводится в бессемеровский конвертер, который внутри футерован оксидом магния. Этот преобразователь имеет трубы, через которые подается горячий воздух и \(SiO_2\). В этом конвертере \(Cu_2S\) преобразуется в \(Cu_2O\), а \(FeS\) превращается в \(FeO\). Закись железа образует шлак с \(SiO_2\). Образующийся оксид меди реагирует с Cu2S и образует медь.
Этот преобразователь имеет трубы, через которые подается горячий воздух и \(SiO_2\). В этом конвертере \(Cu_2S\) преобразуется в \(Cu_2O\), а \(FeS\) превращается в \(FeO\). Закись железа образует шлак с \(SiO_2\). Образующийся оксид меди реагирует с Cu2S и образует медь.
\[ 2Cu_2O + Cu_2S \rightarrow 6Cu + SO_2\]
Образовавшуюся медь необходимо очистить электролизом.
Реакции ионов меди(II) в растворе
Простейшим ионом, который медь образует в растворе, является типичный синий ион гексааквамеди(II) — [Cu(H 2 O) 6 ] 2+ .
Реакции ионов гексааквамеди(II) с ионами гидроксида
Ионы гидроксида (например, из раствора гидроксида натрия) удаляют ионы водорода из водных лигандов, присоединенных к иону меди. Как только ион водорода был удален из двух молекул воды, у вас остался комплекс без заряда — нейтральный комплекс. Он нерастворим в воде, и образуется осадок.
Цветовая маркировка показывает, что это не реакция обмена лиганда. Кислороды, которые первоначально были связаны с медью, все еще связаны в нейтральном комплексе.
Кислороды, которые первоначально были связаны с медью, все еще связаны в нейтральном комплексе.
В пробирке изменение цвета:
Реакции ионов гексааквамеди(II) с раствором аммиака
Аммиак действует как основание и как лиганд. При небольшом количестве аммиака ионы водорода отрываются от гексаакваиона точно так же, как и в случае гидроксид-иона, с образованием того же нейтрального комплекса. 9{2+} + H_2O\]
Примечание
Вы можете удивиться, почему это второе уравнение дается исходя из исходного гексаакваиона, а не нейтрального комплекса. Объяснить, почему осадок снова растворяется, довольно сложно. Полное объяснение вы найдете на странице о реакциях между ионами гексааква и раствором аммиака.
Изменения цвета:
Реакция ионов гексааквамеди(II) с ионами карбоната
Вы просто получаете осадок того, что можно представить как карбонат меди(II). 9{2-} + 6H_2O\]
Поскольку реакция обратима, вы получаете смесь цветов из-за обоих комплексных ионов. Цвет иона тетрахлоркупрата (II) можно также описать как оливково-зеленый или желтый. Если к зеленому раствору добавить воду, он снова станет синим.
Цвет иона тетрахлоркупрата (II) можно также описать как оливково-зеленый или желтый. Если к зеленому раствору добавить воду, он снова станет синим.
Реакция ионов гексааквамеди(II) с ионами йодида
Ионы меди(II) окисляют ионы йодида до молекулярного йода, и в процессе сами восстанавливаются до йодида меди(I).
9- (aq)\]
Когда раствор тиосульфата натрия вливается из бюретки, окраска йода тускнеет. Когда почти все кончится, добавьте немного раствора крахмала. Он обратимо реагирует с йодом, образуя темно-синий комплекс крахмал-йод, который гораздо легче увидеть.
Медленно добавляйте последние несколько капель раствора тиосульфата натрия, пока не исчезнет синяя окраска. Если вы проследите пропорции реакции с помощью двух уравнений, вы обнаружите, что на каждые 2 моля ионов меди (II), с которыми вы должны были начать, вам нужно 2 моля раствора тиосульфата натрия. Зная концентрацию раствора тиосульфата натрия, легко рассчитать концентрацию ионов меди(II).
Некоторые важные химические вещества меди(I)
Диспропорционирование ионов меди(I) в растворе
Химия меди(I) ограничивается реакцией, которая протекает с участием простых ионов меди(I) в растворе. Это хороший пример диспропорционирования — реакции, при которой что-то окисляется и восстанавливается. Ионы меди (I) в растворе диспропорционируют с образованием ионов меди (II) и осадка меди. Реакция:
Любая попытка получить простое соединение меди(I) в растворе приводит к этому. Например, если вы взаимодействуете с оксидом меди (I) с горячей разбавленной серной кислотой, вы можете ожидать получения раствора сульфата меди (I) и воды. На самом деле вы получаете коричневый осадок меди и синий раствор сульфата меди (II) из-за реакции диспропорционирования.
\[ Cu_2O + H_2SO_4 \rightarrow Cu + CuSO_4 + H_2O\]
Стабилизация степени окисления меди(I)
Мы уже видели, что йодид меди(I) образуется в виде не совсем белого осадка, если добавить раствора иодида калия в раствор, содержащий ионы меди(II). Иодид меди(I) практически нерастворим в воде, поэтому реакции диспропорционирования не происходит. Точно так же хлорид меди (I) может быть получен в виде белого осадка (реакция описана ниже). Если его отделить от раствора и как можно быстрее высушить, он останется белым. Однако при контакте с водой он медленно становится синим по мере образования ионов меди (II). Реакция диспропорционирования происходит только с простыми ионами меди (I) в растворе.
Иодид меди(I) практически нерастворим в воде, поэтому реакции диспропорционирования не происходит. Точно так же хлорид меди (I) может быть получен в виде белого осадка (реакция описана ниже). Если его отделить от раствора и как можно быстрее высушить, он останется белым. Однако при контакте с водой он медленно становится синим по мере образования ионов меди (II). Реакция диспропорционирования происходит только с простыми ионами меди (I) в растворе.
Образование комплексов меди(I) (кроме комплексов с водой в качестве лиганда) также стабилизирует степень окисления меди(I). Например, оба [Cu(NH 3 ) 2 ] + и [CuCl 2 ] — представляют собой комплексы меди (I), которые не диспропорционируют . Хлорсодержащий комплекс образуется при растворении оксида меди(I) в концентрированной соляной кислоте. Вы можете представить, что это происходит в два этапа. Сначала образуется хлорид меди(I): 9-_{(aq)}\]
Вы можете получить белый осадок хлорида меди(I) (упомянутый выше), добавив к этому раствору воду. Это обращает последнюю реакцию, удаляя лишний хлорид-ион.
Это обращает последнюю реакцию, удаляя лишний хлорид-ион.
Авторы и авторство
Эта страница под названием «Химия меди» используется в соответствии с лицензией CC BY-NC 4.0, автором, ремиксом и/или куратором этой страницы является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- медь
- медный пирит
- замена лиганда
Медь | Использование, свойства и факты
медь
См. все носители
- Ключевые люди:
- Джеймс Дуглас Маркус Дейли Уильям Э. Додж Сэр Честер Битти Йохан Готлиб Ган
- Похожие темы:
- обработка меди солнечная батарея CIGS нейзильбер медная работа медно-порфировое месторождение
См. все связанные материалы →
Следите за медью из сырой породы в карьерах до плавки, преобразования и рафинирования в анодные пластины
Посмотреть все видео к этой статье медь (Cu) , химический элемент, красноватый, чрезвычайно пластичный металл группы 11 (Ib) периодической таблицы, который является необычайно хорошим проводником электричества и тепла. Медь встречается в природе в свободном металлическом состоянии. Эта самородная медь была впервые использована (ок. 8000 г. до н.э.) в качестве заменителя камня людьми эпохи неолита (новый каменный век). Металлургия зародилась в Месопотамии, когда медь отливали в формах (ок. 4000 г. до н. э.), превращали в металл из руд с помощью огня и древесного угля и преднамеренно сплавляли с оловом в виде бронзы (ок. 3500 г. до н. э.). Римские поставки меди почти полностью происходили с Кипра. Он был известен как aes Cyprium , «кипрский металл», сокращенный до cyprium , а затем преобразованный в cuprum . См. также бронзу .
Медь встречается в природе в свободном металлическом состоянии. Эта самородная медь была впервые использована (ок. 8000 г. до н.э.) в качестве заменителя камня людьми эпохи неолита (новый каменный век). Металлургия зародилась в Месопотамии, когда медь отливали в формах (ок. 4000 г. до н. э.), превращали в металл из руд с помощью огня и древесного угля и преднамеренно сплавляли с оловом в виде бронзы (ок. 3500 г. до н. э.). Римские поставки меди почти полностью происходили с Кипра. Он был известен как aes Cyprium , «кипрский металл», сокращенный до cyprium , а затем преобразованный в cuprum . См. также бронзу .
| атомный номер | 29 |
|---|---|
| атомный вес | 63,546 | 9 0301
| температура плавления | 1083 °C (1981 °F) |
| температура кипения | 2567 ° C (4653 °F) |
| плотность | 8,96 при 20 °C (68 °F) |
| валентность | 1, 2 |
| электронная конфигурация | 2-8-18-1 или (Ar )3 д 10 4 s 1 |
Самородная медь встречается во многих местах как первичный минерал в базальтовых лавах, а также в виде восстановленных соединений меди, таких как сульфиды, арсениды, хлориды и карбонаты. (О минералогических свойствах меди см. таблица самородных элементов.) Медь встречается в сочетании со многими минералами, такими как халькозин, халькопирит, борнит, куприт, малахит и азурит. Он присутствует в золе водорослей, во многих морских кораллах, в печени человека, во многих моллюсках и членистоногих. Медь играет такую же роль транспорта кислорода в гемоцианине голубокровных моллюсков и ракообразных, как железо в гемоглобине краснокровных животных. Медь, присутствующая в организме человека в качестве микроэлемента, помогает катализировать образование гемоглобина. Медно-порфировое месторождение в Андах Чили является крупнейшим известным месторождением этого минерала. К началу 21 века Чили стала ведущим мировым производителем меди. Другими крупными производителями являются Перу, Китай и США.
(О минералогических свойствах меди см. таблица самородных элементов.) Медь встречается в сочетании со многими минералами, такими как халькозин, халькопирит, борнит, куприт, малахит и азурит. Он присутствует в золе водорослей, во многих морских кораллах, в печени человека, во многих моллюсках и членистоногих. Медь играет такую же роль транспорта кислорода в гемоцианине голубокровных моллюсков и ракообразных, как железо в гемоглобине краснокровных животных. Медь, присутствующая в организме человека в качестве микроэлемента, помогает катализировать образование гемоглобина. Медно-порфировое месторождение в Андах Чили является крупнейшим известным месторождением этого минерала. К началу 21 века Чили стала ведущим мировым производителем меди. Другими крупными производителями являются Перу, Китай и США.
Медь в промышленных масштабах производится в основном путем плавки или выщелачивания, обычно с последующим электроосаждением из сульфатных растворов. Подробное описание производства меди см. в разделе обработка меди. Большая часть производимой в мире меди используется электротехнической промышленностью; большая часть остатка соединяется с другими металлами, образуя сплавы. (Это также технологически важно в качестве гальванического покрытия.) Важными сериями сплавов, в которых медь является основным компонентом, являются латуни (медь и цинк), бронзы (медь и олово) и мельхиоры (медь, цинк и никель, нет). серебро). Есть много полезных сплавов меди и никеля, в том числе монель; два металла полностью смешиваются. Медь также образует важную серию сплавов с алюминием, называемых алюминиевыми бронзами. Бериллиевая медь (2 процента бериллия) — необычный медный сплав, который можно упрочнить термической обработкой. Медь входит в состав многих монетных металлов. Долгое время после того, как бронзовый век перешел в железный век, медь оставалась вторым металлом по использованию и важности после железа. К 19Однако в 60-х годах более дешевый и распространенный алюминий отодвинулся на второе место в мировом производстве.
в разделе обработка меди. Большая часть производимой в мире меди используется электротехнической промышленностью; большая часть остатка соединяется с другими металлами, образуя сплавы. (Это также технологически важно в качестве гальванического покрытия.) Важными сериями сплавов, в которых медь является основным компонентом, являются латуни (медь и цинк), бронзы (медь и олово) и мельхиоры (медь, цинк и никель, нет). серебро). Есть много полезных сплавов меди и никеля, в том числе монель; два металла полностью смешиваются. Медь также образует важную серию сплавов с алюминием, называемых алюминиевыми бронзами. Бериллиевая медь (2 процента бериллия) — необычный медный сплав, который можно упрочнить термической обработкой. Медь входит в состав многих монетных металлов. Долгое время после того, как бронзовый век перешел в железный век, медь оставалась вторым металлом по использованию и важности после железа. К 19Однако в 60-х годах более дешевый и распространенный алюминий отодвинулся на второе место в мировом производстве.
| страна | добыча на руднике в 2016 г. (метрические тонны)* | % мировой добычи полезных ископаемых | доказанные запасы 2016 г. (метрические тонны)* | % мировых доказанных запасов |
|---|---|---|---|---|
| *Оцененный. | ||||
| ** Из-за округления данные не складываются в общую сумму. | ||||
| Источник: Министерство внутренних дел США, Сводные данные о минеральном сырье, 2017 г. | ||||
| Чили | 5 500 000 | 28,4 | 210 000 000 903:00 | 29,2 |
| Перу | 2 300 000 | 11,9 | 81 000 000 | 11. 3 3 |
| Китай | 1 740 000 | 9,0 | 28 000 000 | 3,9 |
| Соединенные Штаты | 1 410 000 | 7.3 | 35 000 000 | 4.9 |
| Австралия | 970 000 | 5,0 | 89 000 000 | 12,4 |
| Конго (Киншаса) 903:00 | 910 000 | 4.7 | 20 000 000 | 2,8 |
| Замбия | 740 000 | 3,8 | 20 000 000 | 7. 4 4 |
| Канада | 720 000 | 3,7 | 11 000 000 | 1,5 |
| Россия | 710 000 | 3,7 | 30 000 000 | 4.2 |
| Мексика | 620 000 | 3.2 | 46 000 000 903:00 | 6.4 |
| другие страны | 3 800 000 | 19,6 | 150 000 000 | 20,8 |
| мировой итог | 19 400 000** | 100** | 720 000 000 | 100** 903:00 |
Медь — один из самых пластичных металлов, не особо прочный и твердый. Прочность и твердость заметно увеличиваются при холодной обработке из-за образования удлиненных кристаллов той же гранецентрированной кубической структуры, которая присутствует в более мягкой отожженной меди. Обычные газы, такие как кислород, азот, двуокись углерода и двуокись серы, растворяются в расплавленной меди и сильно влияют на механические и электрические свойства затвердевшего металла. Чистый металл уступает только серебру по тепло- и электропроводности. Природная медь представляет собой смесь двух стабильных изотопов: меди-63 (690,15%) и меди-65 (30,85%).
Прочность и твердость заметно увеличиваются при холодной обработке из-за образования удлиненных кристаллов той же гранецентрированной кубической структуры, которая присутствует в более мягкой отожженной меди. Обычные газы, такие как кислород, азот, двуокись углерода и двуокись серы, растворяются в расплавленной меди и сильно влияют на механические и электрические свойства затвердевшего металла. Чистый металл уступает только серебру по тепло- и электропроводности. Природная медь представляет собой смесь двух стабильных изотопов: меди-63 (690,15%) и меди-65 (30,85%).
Викторина «Британника»
Викторина «118 названий и символов периодической таблицы»
Поскольку медь находится ниже водорода в электродвижущем ряду, она не растворяется в кислотах с выделением водорода, хотя и будет реагировать с окисляющими кислотами, такими как азотная и горячая концентрированная серная кислота. Медь противостоит действию атмосферы и морской воды. Однако длительное воздействие воздуха приводит к образованию тонкого зеленого защитного покрытия (патины), которое представляет собой смесь гидроксокарбоната, гидроксосульфата и небольшого количества других соединений.



Leave A Comment