Гидроксид меди(II) | это… Что такое Гидроксид меди(II)?
У этого термина существуют и другие значения, см. Гидроксид меди.
Гидроксид меди(II) — Cu(ОН)2, голубое аморфное или кристаллическое вещество с ромбической кристаллической решеткой (а = 0,2949 нм, b = 1,059 нм, с = 0,5256 нм, z = 4). Cu(ОН)2 практически не растворим в воде[1]. При нагревании до 70-90 °C порошка Cu(ОН)2 или его водных суспензий разлагается до CuО и Н2О.
Получение
В лаборатории получают действием на холоде растворимых гидроксидов, кроме NH4OH, на растворимые соли меди, например:
- Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
- CuSO4 + 2KOH → Cu(OH)2 + K2SO4
При получении не следует добавлять слишком много щелочи, так как гидроксид меди разлагается даже от небольшого избытка щелочи на оксид и воду. Легкость разложения гидроксида меди (II) определяется его строением, которое отлично от структур гидроксидов других двухзарядных катионов. Упрощенно его можно представить как линейные цепи из квадратов [Cu(OH)4], соединенные друг с другом общими сторонами. Друг относительно друга цепи расположены таким образом, что атомы кислорода соседних цепей, находящихся снизу и сверху, дополняют координационное число атомов меди до шести. Для перестройки этой структуры в оксид требуется лишь отщепление части гидроксильных групп (оксоляция) и разворот некоторых цепей относительно друг друга.
Упрощенно его можно представить как линейные цепи из квадратов [Cu(OH)4], соединенные друг с другом общими сторонами. Друг относительно друга цепи расположены таким образом, что атомы кислорода соседних цепей, находящихся снизу и сверху, дополняют координационное число атомов меди до шести. Для перестройки этой структуры в оксид требуется лишь отщепление части гидроксильных групп (оксоляция) и разворот некоторых цепей относительно друг друга.
Свойства
Гидроксид меди(II)
Является амфотерным гидроксидом. Реагирует с кислотами с образованием воды и соответствующей соли меди:
- Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты (II): Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]
Как и все нерастворимые основания, гидроксид меди II при нагревании разлагается на оксид и воду, в данном случае, на оксид меди(II):
- Cu(OH)2 → (t°) CuO + H2O
При длительном стоянии на воздухе, обогащённым кислородом, гидроксид меди (II) вступает в обратимую реакцию с кислородом, образуя грязно-красный оксид меди (III):
4Cu(OH)2 + O2 ↔ 2Сu2O3↓ + H2O
Равновесие в этой реакции сдвинуто влево.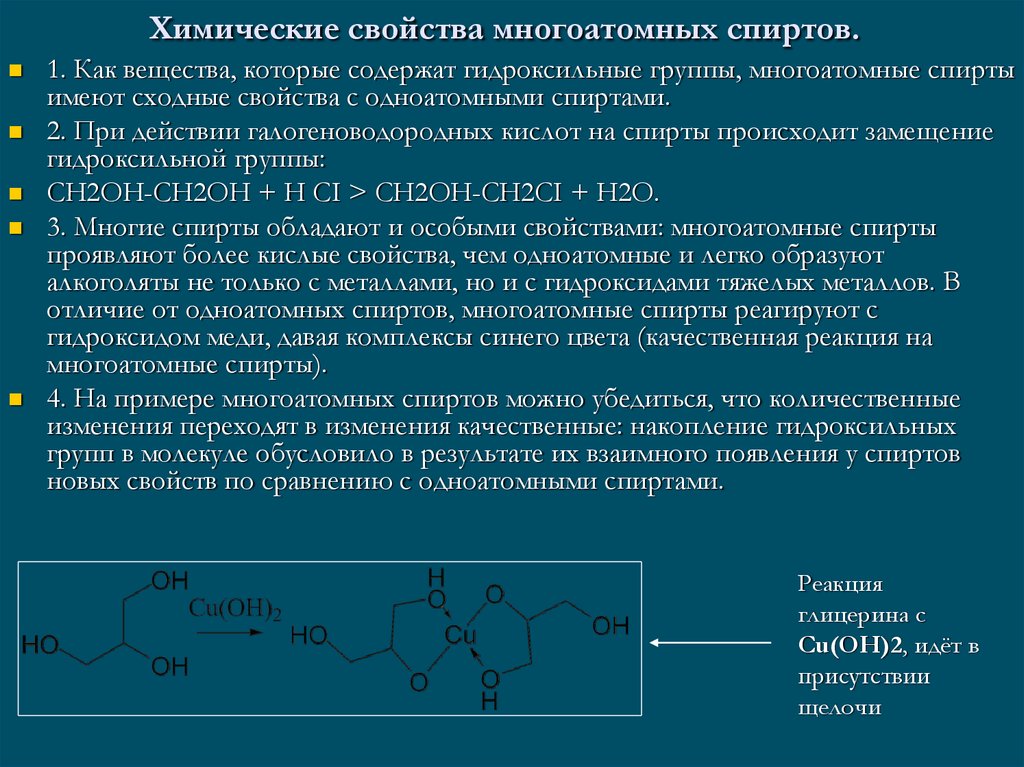
При избытке влаги может образоваться гидроксид куприла (III):
4Cu(OH)2 + O2 → 4CuO(OH)↓ + H2O
Очень легко растворяется в избытке аммиака с образованием аммиаката меди:
- Cu(OH)2+4NH4OH=[Cu(NH3)4](OH)2+4H2O
или
Cu(OH)2+4NH3=[Cu(NH3)4](OH)2
Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu2+ в растворе.
Примечания
- ↑ Демонстрация нерастворимости (видео)
Гидроксид меди (II), характеристика, свойства и получение, химические реакции
Гидроксид меди (II), характеристика, свойства и получение, химические реакции.
Поделиться в:
Гидроксид меди (II) – неорганическое вещество, имеет химическую формулу Cu(OH)
Краткая характеристика гидроксида меди (II)
Физические свойства гидроксида меди (II)
Получение гидроксида меди (II)
Химические свойства гидроксида меди (II)
Химические реакции гидроксида меди (II)
Применение и использование гидроксида меди (II)
Краткая характеристика гидроксида меди (II):
Гидроксид меди (II) – неорганическое кристаллическое или аморфное вещество ярко-голубого цвета.
Химическая формула гидроксида меди (II) Cu(OH)2.
Не растворяется в воде. Растворимость в воде 0,000673 г/100 мл.
Не горит. Термически неустойчивый. При нагревании до 70-90 °C порошка Cu(ОН)2 или его водных суспензий разлагается на оксид меди (II) и воду.
Гидроксид меди токсичен.
Физические свойства гидроксида меди (II):
| Наименование параметра: | Значение: |
| Химическая формула | Cu(OH)2 |
| Синонимы и названия иностранном языке | сopper(II) hydroxide (англ. |
| Тип вещества | неорганическое |
| Внешний вид | ярко-голубые кристаллы либо ярко-голубая водная суспензия (аморфное состояние) |
| Цвет | ярко-голубой |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество – кристаллы, при 20 °C), кг/м3 | 3370 |
| Плотность (состояние вещества – твердое вещество – кристаллы, при 20 °C), г/см3 | |
| Температура разложения, °C | 70 |
| Гигроскопичность | отсутствует |
| Молярная масса, г/моль | 97,561 |
* Примечание:
— нет данных.
Получение гидроксида меди (II):
В лаборатории гидроксид меди (II) получается действием на холоде растворимых гидроксидов металлов на растворимые соли меди в результате следующих химических реакций:
- 1.
 в результате взаимодействия нитрата меди (II) с гидроксидом натрия:
в результате взаимодействия нитрата меди (II) с гидроксидом натрия:
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3.
При этом гидроксид меди (II) выпадает в осадок.
- 2. в результате взаимодействия сульфата меди (II) и гидроксида калия:
2KOH + CuSO4 → Cu(OH)2 + K2SO4.
При этом гидроксид меди (II) выпадает в осадок.
- 3. в результате взаимодействия нитрата меди (II) с гидроксидом калия:
Cu(NO3)2 + 2KOH → Cu(OH)2 + 2KNO3.
При этом гидроксид меди (II) выпадает в осадок.
- 4. в результате взаимодействия сульфата меди (II) с гидроксидом кальция:
Ca(OH)2 + CuSO4 → Cu(OH)2 + CaSO
При этом гидроксид меди (II) выпадает в осадок.
- 5.
 в результате взаимодействия хлорида меди (II) с гидроксидом натрия:
в результате взаимодействия хлорида меди (II) с гидроксидом натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl.
При этом гидроксид меди (II) выпадает в осадок.
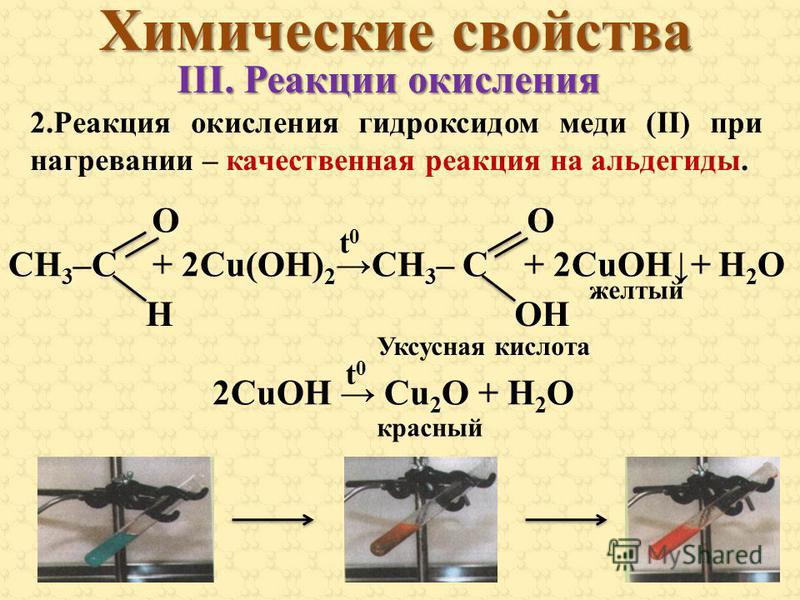
Химические свойства гидроксида меди (II). Химические реакции гидроксида меди (II):
Гидроксид меди (II) – слабое основание. Проявляет амфотерные свойства.
Химические свойства гидроксида меди (II) аналогичны свойствам гидроксидов других амфотерных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида меди (II) с ортофосфорной кислотой:
Cu(OH)2 + H3PO4 → Cu3(PO4)2 + 6H2O.
В результате реакции образуются фосфат меди (II) и вода. В качестве исходного вещества используется разбавленный раствор ортофосфорной кислоты.
2. реакция гидроксида меди (II) с азотной кислотой:
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O.
В результате реакции образуются нитрат меди (II) и вода. В качестве исходного вещества используется разбавленный раствор азотной кислоты.
Аналогично проходят реакции гидроксида меди (II) и с другими кислотами.
3. реакция гидроксида меди (II) и сероводорода:
Cu(OH)2 + H2S → CuS + 2H2O.
В результате реакции образуются сульфид меди (II) и вода. В ходе реакции используется суспензия гидроксида меди (II) и насыщенный раствор сероводорода.
4. реакция гидроксида меди (II) и оксида углерода:
2Cu(OH)2 + CO2 → Cu2(OH)2CO3 + H2O.
В результате реакции образуются карбонат-дигидроксид димеди (II) и вода.
5. реакция гидроксида меди (II) и оксида селена:
SeO2 + Cu(OH)2 → CuSeO3 + 2H2O (to).
В результате реакции образуются селенит меди (II) и вода. Реакция протекает при нагревании.
Реакция протекает при нагревании.
6. реакция гидроксида меди (II) и гидроксида натрия:
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4].
В результате реакции образуется тетрагидроксокупрат натрия.
7. реакция гидроксида меди (II), аммиака и воды:
Cu(OH)2 + 4NH3 + 2H2O → [Cu(NH3)4(H2O)2](OH)2.
В результате реакции образуется гидроксид диакватетрааммин меди (I).
8. реакция гидроксида меди (II) и гидрата аммиака:
Cu(OH)2 + 4(NH3•H2O) → [Cu(NH3)4](OH)2 + 4H2O.
В результате реакции образуются гидроксид тетрааммин меди (II) и вода. Гидрат аммиака используется в ходе реакции в виде концентрированного раствора.
Гидроксид тетрааммин меди (II) имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu2+ в растворе.
9. реакция гидроксида меди (II) с кислородом:
4Cu(OH)2 + O2 ⇄ 4Cu2O3 + 2H2O.
При длительном нахождении на воздухе, обогащённом кислородом, гидроксид меди (II) вступает в обратимую реакцию с кислородом, образуя грязно-красный оксид меди (III). В результате реакции образуется оксид меди (III) и вода.
4Cu(OH)2 + O2 → 4CuО(ОН) + H2O.
При избытке влаги может образоваться гидроксид куприла (III) и вода.
10. реакция термического разложения гидроксида меди (II):
Cu(OH)2 → CuO + H2O (t = 70-90 oC).
В результате реакции образуются оксид меди (II) и вода.
Применение и использование гидроксида меди (II):
Гидроксид меди (II) используется:
– как пигмент при производстве стекол, керамики, красок,
– как катализатор в химической промышленности.
Примечание: © Фото https://www.
гидроксид меди (II) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида меди (II) реакции
Коэффициент востребованности 13 039
Последовательность химических реакций
Превращение меди: последовательность химических реакций- Цели
- Реакции
- Процедура
Цели
- Укажите разнообразие веществ, частью которых может быть элемент:
металл —> синий раствор —> синее твердое вещество —> черное твердое вещество —> синий раствор (снова) —> металл (снова).
- Сохранение массы и кротов:
- Мы должны добыть столько меди, сколько начали.
- Одинаковое количество меди на каждой стадии: одинаковое количество молей.
- Опыт работы со стандартными химическими методами: фильтрация и количественные переносы.

Реакции
Cu(тв) —> [Cu(H 2 O) 6 ] 2+ (водн.) —> Cu(OH) 2 (тв) —> CuO(тв) —> [Cu(H 2 O) 6 ] 2+ (водный) —> Cu(s)- Металлическая медь «растворяется» в азотной кислоте (HNO 3 ). Фактически ион нитрата окисляет металлическую медь до иона меди (II), в то время как сам превращается в газ NO
Cu (т) + 4 H 3 O + (водн.) + 2 NO 3 — (водн.) —> [Cu(H 2 O) 6 ] + 2 5 (водн.) + 2 NO 2 (г)
- Ион гидроксида (ОН —
 В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди, Cu(OH) 2 , синий осадок.
В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди, Cu(OH) 2 , синий осадок.[Cu(H 2 O) 6 ] 2+ (водн.) + 2 OH — —> Cu(OH) 2 (т) + 6 H 2 O (ж)
- При нагревании гидроксида меди образуется оксид меди, CuO, a черный твердый.
Cu(OH) 2 (т) —> CuO (т) + H 2 O (ж)
- Оксид меди растворяется в кислоте, регенерируя ион меди (II), который снова связывается с вода.
- Наконец, металлический цинк восстанавливает гидратированный ион меди (II) обратно в металлическую медь, в то время как сам окисляется до ионов цинка (II). Мы видели эту реакцию раньше в лаборатории хлорида меди).

[Cu(H 2 O) 6 ] 2+ (водн.) + Zn (тв.) —> Cu (тв.) + Zn 2+ (водн.) + 6 H 2 O ( тел.)
В то же время часть металлического цинка, находящегося в избытке, восстанавливает ионы гидроксония до H 2 .Zn (тв) + 2 H 3 O + (водн.) —> Zn 2+ (водн.) + H 2 (г) + 2 H 2 O (л)
- 4
- 4
- 4
- 4
Процедура
Я не буду подробно описывать процедуру шаг за шагом, но подчеркну некоторые аспекты безопасности и (выделено жирным шрифтом ) некоторые места, где наша процедура отличается от процедуры в лабораторном пакете.- Преобразование Cu(s) в [Cu(H 2 O) 6 ] 2+ (водный)
- Возьмите кусок медной проволоки и взвесьте его с точностью до 0,01 г . Кусочки проволоки ближе к 0,50 г, чем к 0,35 г. Это нормально: используйте детали, которые мы предоставляем.

- Используйте около 4-5 мл концентрированного раствора HNO 3 .
- Будьте осторожны с азотной кислотой: как и другие сильные кислоты, она вызывает жжение при попадании на кожу и может повредить одежду; в отличие от большинства других кислот, он также окрашивает пораженный участок в желтый цвет.
- Если некоторое количество меди останется нерастворенным к моменту окончания производства газа, то поставьте химический стакан на горячие плиты в вытяжных шкафах, чтобы ускорить реакцию.
- Важно выполнять этот шаг в вытяжном шкафу, поскольку коричневый газ NO 2 является раздражителем. Держите смеси в вытяжном шкафу до тех пор, пока не добавите 10 мл дистиллированной воды после полного растворения меди.
- Возьмите кусок медной проволоки и взвесьте его с точностью до 0,01 г . Кусочки проволоки ближе к 0,50 г, чем к 0,35 г. Это нормально: используйте детали, которые мы предоставляем.
- Преобразование [Cu(H 2 O) 6 ] 2+ (водн.) в Cu(OH) 2 (s)
- Будьте осторожны при обращении с NaOH, так как это сильное основание, которое вызывает жжение при контакте с кожей.
 Добавьте по каплям раствор NaOH к раствору меди.
Добавьте по каплям раствор NaOH к раствору меди. - После образования синего осадка периодически проверяйте кислотность раствора, погружая палочку для перемешивания в раствор и касаясь ею красной лакмусовой бумажки. Старайтесь не переносить синий осадок на лакмусовую бумагу: это приведет к некоторой потере меди и, возможно, к ложному синему цвету на лакмусовой бумаге. Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавление 0034 — идет на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим, чтобы вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
- Будьте осторожны при обращении с NaOH, так как это сильное основание, которое вызывает жжение при контакте с кожей.
- Преобразование Cu(OH) 2 (т) в CuO(т)
- Добавить воду в реакционную смесь, полученную на предыдущем этапе, и добавьте также один или два кипящих камня .

- Содержимое стакана нагреть, но не кипятить . Кипячение делает черный CuO настолько мелким, что этап фильтрации становится чрезмерно долгим. Нагревайте химический стакан, пока весь синий Cu(OH) 2 не исчезнет и не заменится черным CuO.
- Отфильтровать и промыть CuO, как описано в процедуре (часть C). Держите твердое вещество на фильтровальной бумаге, а фильтрат выбросьте.
- Добавить воду в реакционную смесь, полученную на предыдущем этапе, и добавьте также один или два кипящих камня .
- Преобразование CuO(s) обратно в [Cu(H 2 O) 6 ] 2+ (водный)
- Растворите CuO на фильтровальной бумаге, как описано в процедуре (часть D).
- Раствор серной кислоты вызывает коррозию и вызывает жжение кожи при контакте с ней.
- Преобразование [Cu(H 2 O) 6 ] 2+ (водный) обратно в Cu(s)
- Добавьте около 1 г Zn к синему раствору, полученному на предыдущем шаге, и после того, как раствор полностью потеряет свой синий цвет, вам может понадобиться добавить немного серной кислоты, чтобы прореагировать избыток Zn.

- Металлическую медь трижды промыть дистиллированной водой и перенести в чашку для выпаривания, как описано в процедуре (часть Е), а затем трижды промыть изопропанолом порциями по 5 мл. Промывка изопропанолом сократит время, необходимое для этапа сушки.
- Высушите медь над стаканом с кипящей водой, как описано в процедуре (Е). Взвесьте сухую медь и запишите массу. Вычислите процент восстановленной меди.
- Добавьте около 1 г Zn к синему раствору, полученному на предыдущем шаге, и после того, как раствор полностью потеряет свой синий цвет, вам может понадобиться добавить немного серной кислоты, чтобы прореагировать избыток Zn.
Гидроксид меди – химическая формула, применение
Гидроксид меди (Cu(OH) 2 ), иначе обозначаемый как Гидроксид меди (II) или Гидроксид меди , представляет собой неорганическое соединение, представляющее собой 7 твердое кристаллическое вещество. Обычно это голубовато-зеленое твердое вещество или бледно-зеленовато-голубое твердое вещество . Это сильное основание , но его действие трудно обнаружить из-за низкой растворимости в воде.
Алхимики были первыми, кто произвел Cu(OH) 2 из сульфата меди (синего купороса) и растворов NaOH или KOH(Iye). Хотя гидроксид меди был известен человечеству примерно с 5000 г. до н.э., когда началась выплавка меди.
Соединение было произведено в промышленных масштабах, когда его начали использовать в пигментах для керамики и живописи. Коммерческое производство было в 1600-х и 1700-х годах и в цветах, таких как 9.0273 бременский зеленый и синий вердитер.
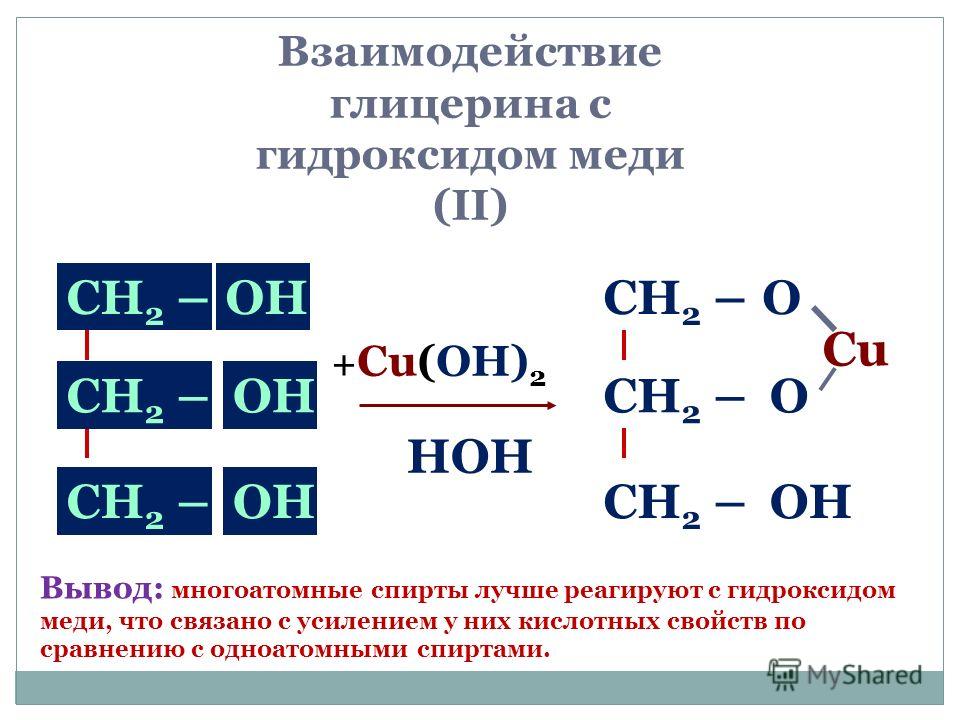
Структура и химическая формулаХимическая формула гидроксида меди: Cu(OH) 2 . Его молекула представляет собой ионное соединение, состоящее из ионов ОН – и Cu 2+ .
Структура кристаллов гидроксида меди определена методом рентгеноструктурного анализа . Было обнаружено, что центральный атом Cu представляет собой квадратную пирамиду , а плоская и аксиальная длины связей Cu-O равны 1,9. 6 Å и 2,36 Å соответственно. Плоские ионы гидроксида дважды или трижды соединяют соседние атомы меди.
6 Å и 2,36 Å соответственно. Плоские ионы гидроксида дважды или трижды соединяют соседние атомы меди.
Теперь давайте перейдем к обсуждению свойств этого соединения, которое подразумевает физические свойства и химические свойства.
Физические свойства.{\theta}_{298}\))- Reaction with ammonia
- The Реакция гидроксида меди и раствора аммиака приводит к образованию темно-синего цвета раствора комплекса комплексного иона тетраамминмеди ([Cu(NH 3 ) 4 ] +2 ).
- В присутствии кислорода Cu(OH) 2 катализирует окисление растворов аммиака с образованием нитратов аммиака меди , которые находятся в форме Cu(NO 2 ) 2 (NH
- 0 1 3 90) х .

- Он слегка растворяется в концентрированной щелочи и образует [Cu(OH) 4 ] 2- , так как это слабоаморфное химическое соединение .
- Реагирует с серной кислотой с образованием сульфата меди.
Cu(OH) 2 + H 2 SO 4 -> CuSO 4 + 2H 2 O
- Голубоватое соединение меди реагирует с азотной кислотой.
Cu (OH) 2 + 2HNO 3 -> CU (№ 3 ) 2 + 2H 2 O
COPPE добавление гидроксида калия и растворимой соли меди(II).
- Используется для производства ариламинов .
- Используется для превращения кислых гидразидов в карбоновые кислоты .
 Он используется, чтобы избежать любой реакции с чувствительными функциональными группами при синтезе карбоновых кислот.
Он используется, чтобы избежать любой реакции с чувствительными функциональными группами при синтезе карбоновых кислот.
- Гидроксид меди получают из сульфат меди(II) реакцией его разбавленного раствора и гидроксида натрия . Однако выход этого метода содержит примеси, такие как вода и гидроксид натрия.
2NaOH(водн.) + CuSO 4 (водн.) -> Cu(OH) 2 (т) + Na 2 SO 4 (водн.)
- воды
- Это соединение редко встречается в виде чистого минерала, чаще всего встречается в сочетании с CO 2 в качестве основного карбоната меди(II), который представляет собой минерал малахит . Минерал Cu(OH) 2 спертинит .
2Cu(OH) 2 + CO 2 -> Cu 2 CO 3 (OH) 2 (malachite) + H 2 O
- Используется в производстве искусственного шелка , так как гидроксид меди в растворе аммиака может растворять целлюлозу.
 Раствор Cu(OH) 2 в растворе NH 3 известен как реактив Швейцера .
Раствор Cu(OH) 2 в растворе NH 3 известен как реактив Швейцера . - Используется для лечения рыб в аквариумной индустрии , так как может убивать внешних паразитов, трематод, морского ихтика, ручейника и морского бархата.
- Может использоваться в качестве замены бордоской смеси , которая является фунгицидом и нематоцидом.
- Cu(OH) 2 также иногда используется в качестве красителя в керамической промышленности .
- Он используется в продукте, который используется для контроля роста корней растения в горшке.
- Гидроксид меди и сульфат меди используются в пестицидах и инсектицидах в виде смеси.
- Также используется в качестве консерванта для древесины .
- Чрезмерное вдыхание его паров может вызвать кашель и одышку , между прочим.


 в результате взаимодействия нитрата меди (II) с гидроксидом натрия:
в результате взаимодействия нитрата меди (II) с гидроксидом натрия: в результате взаимодействия хлорида меди (II) с гидроксидом натрия:
в результате взаимодействия хлорида меди (II) с гидроксидом натрия:
 В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди, Cu(OH) 2 , синий осадок.
В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди, Cu(OH) 2 , синий осадок.

 Добавьте по каплям раствор NaOH к раствору меди.
Добавьте по каплям раствор NaOH к раствору меди.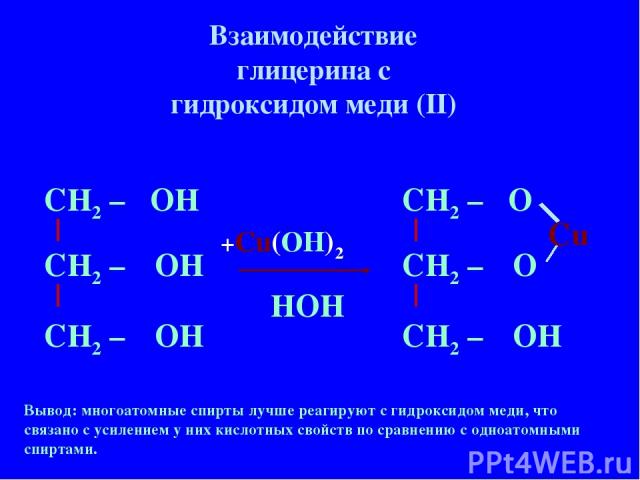

 Он используется, чтобы избежать любой реакции с чувствительными функциональными группами при синтезе карбоновых кислот.
Он используется, чтобы избежать любой реакции с чувствительными функциональными группами при синтезе карбоновых кислот. Раствор Cu(OH) 2 в растворе NH 3 известен как реактив Швейцера .
Раствор Cu(OH) 2 в растворе NH 3 известен как реактив Швейцера .
Leave A Comment