Характерные химические свойства водорода и галогенов.
Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген | Физические свойства |
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически,
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром и йод вытесняют серу из растворов сульфидов и или сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
scienceforyou.ru
Водород. Физические и химические свойства, получение » HimEge.ru
 Водород H — самый распространённый элемент во Вселенной (около 75 % по массе), на Земле — девятый по распространенности. Наиболее важным природным соединением водорода является вода.
Водород H — самый распространённый элемент во Вселенной (около 75 % по массе), на Земле — девятый по распространенности. Наиболее важным природным соединением водорода является вода.
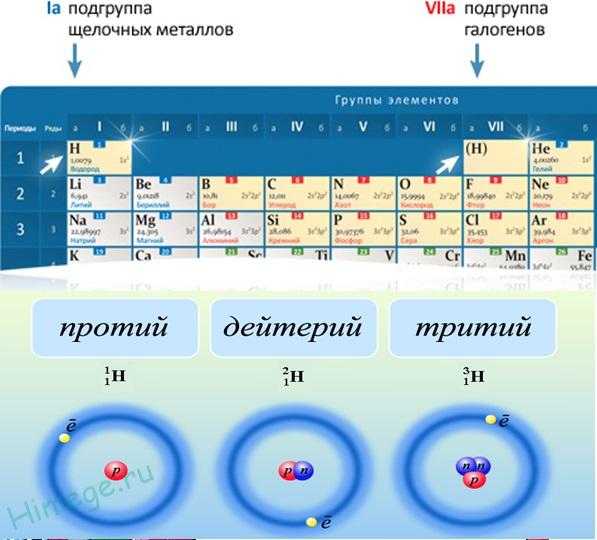
Водород занимает первое место в периодической системе (Z = 1). Он имеет простейшее строение атома: ядро атома – 1 протон, окружено электронным облаком, состоящим из 1 электрона.
В одних условиях водород проявляет металлические свойства (отдает электрон), в других — неметаллические (принимает электрон).
В природе встречаются изотопы водорода: 1Н — протий (ядро состоит из одного протона), 2Н — дейтерий (D — ядро состоит из одного протона и одного нейтрона), 3Н — тритий (Т — ядро состоит из одного протона и двух нейтронов).
Простое вещество водород
Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью.
Физические свойства. Водород — бесцветный нетоксичный газ без запаха и вкуса. Молекула водорода не полярна. Поэтому силы межмолекулярного взаимодействия в газообразном водороде малы. Это проявляется в низких температурах кипения (-252,6 0С) и плавления (-259,2 0С).
Водород легче воздуха, D (по воздуху) = 0,069; незначительно растворяется в воде (в 100 объемах h3O растворяется 2 объема h3). Поэтому водород при его получении в лаборатории можно собирать методами вытеснения воздуха или воды.
Получение водорода
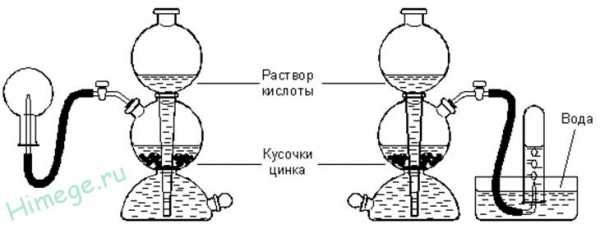
В лаборатории:
1.Действие разбавленных кислот на металлы:
Zn +2HCl → ZnCl2 +H2↑
2.Взаимодействие щелочных и щ-з металлов с водой:
Ca +2H2O → Ca(OH)2 +H2↑
3.Гидролиз гидридов: гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
NaH +H2O → NaOH +H2↑
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
4.Действие щелочей на цинк или алюминий или кремний:
2Al +2NaOH +6H2O → 2Na[Al(OH)4] +3H2↑
Zn +2KOH +2H2O → K2[Zn(OH)4] +H2↑
Si + 2NaOH + H2O → Na2SiO3 + 2H2
5. Электролиз воды. Для увеличения электрической проводимости воды к ней добавляют электролит, например NаОН, Н2SO4 или Na2SO4. На катоде образуется 2 объема водорода, на аноде — 1 объем кислорода.
2H2O → 2H2+О2
Промышленное получение водорода
1. Конверсия метана с водяным паром, Ni 800 °С (самый дешевый):
CH4 + H2O → CO + 3 H2
CO + H2O → CO2 + H2
В сумме:
CH4 + 2 H2O → 4 H2 + CO2
2. Пары воды через раскаленный кокс при 1000оС:
С + H2O → CO + H2
CO +H2O → CO2 + H2
Образующийся оксид углерода (IV) поглощается водой, этим способом получают 50 % промышленного водорода.
3. Нагреванием метана до 350°С в присутствии железного или никелевого катализатора:
СH4 → С + 2Н2↑
4. Электролизом водных растворов KCl или NaCl, как побочный продукт:
2Н2О + 2NaCl→ Cl2↑ + H2↑ + 2NaOH
Химические свойства водорода
- В соединениях водород всегда одновалентен. Для него характерна степень окисления +1, но в гидридах металлов она равна -1.
- Молекула водорода состоит из двух атомов. Возникновение связи между ними объясняется образованием обобщенной пары электронов Н:Н или Н2
- Благодаря этому обобщению электронов молекула Н2 более энергетически устойчива, чем его отдельные атомы. Чтобы разорвать в 1 моль водорода молекулы на атомы, необходимо затратить энергию 436 кДж: Н2 = 2Н, ∆H° = 436 кДж/моль
- Этим объясняется сравнительно небольшая активность молекулярного водорода при обычной температуре.
- Со многими неметаллами водород образует газообразные соединения типа RН4, RН3, RН2, RН.
1) С галогенами образует галогеноводороды:
Н2 + Cl2 → 2НСl.
При этом с фтором — взрывается, с хлором и бромом реагирует лишь при освещении или нагревании, а с йодом только при нагревании.
2) С кислородом:
2Н2 + О2 → 2Н2О
с выделением тепла. При обычных температурах реакция протекает медленно, выше 550°С — со взрывом. Смесь 2 объемов Н2 и 1 объема О2 называется гремучим газом.
3) При нагревании энергично реагирует с серойь(значительно труднее с селеном и теллуром):
Н2 + S → H2S (сероводород),
4) С азотом с образованием аммиака лишь на катализаторе и при повышенных температурах и давлениях:
ЗН2 + N2 → 2NН3
5) С углеродом при высоких температурах:
2Н2 + С → СН4 (метан)
6) С щелочными и щелочноземельными металлами образует гидриды (водород – окислитель):
Н2 + 2Li → 2LiH
в гидридах металлов ион водорода заряжен отрицательно (степень окисления -1), то есть гидрид Na+H— построен подобно хлориду Na+Cl—
Со сложными веществами:
7) С оксидами металлов (используется для восстановления металлов):
CuO + H2 → Cu + H2O
Fe3O4 + 4H2 → 3Fe + 4Н2О
8) с оксидом углерода (II):
CO + 2H2 → CH3OH
Синтез — газ (смесь водорода и угарного газа) имеет важное практическое значение, тк в зависимости от температуры, давления и катализатора образуются различные органические соединения, например НСНО, СН3ОН и другие.
9)Ненасыщенные углеводороды реагируют с водородом, переходя в насыщенные:
СnН2n + Н2 → СnН2n+2.

himege.ru
Урок 22. Химические свойства водорода – HIMI4KA
В уроке 22 «Химические свойства водорода» из курса «Химия для чайников» узнаем с какими веществами реагирует водород; выясним, какими химическими свойствами обладает водород.

Водород вступает в химические реакции с простыми и сложными веществами. Однако при обычных условиях водород малоактивен. Для его взаимодействия с другими веществами необходимо создать условия: повысить температуру, применить катализатор и др.
Реакции водорода с простыми веществами
При нагревании водород вступает в реакции соединения с простыми веществами — кислородом, хлором, азотом, серой.
Если поджечь на воздухе чистый водород, выходящий из газоотводной трубки, он горит ровным, еле заметным пламенем. Теперь поместим трубку с горящим водородом в банку с кислородом (рис. 95).
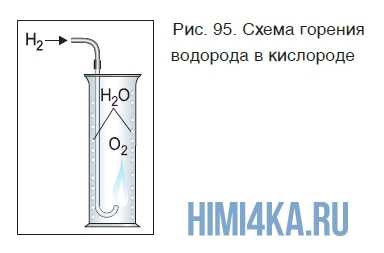
Горение водорода продолжается, при этом на стенках банки видны капли воды, образующейся в результате реакции:
При горении водорода выделяется много теплоты. Температура кислородно-водородного пламени достигает больше 2000 °С.
Химическая реакция водорода с кислородом относится к реакциям соединения. В результате реакции образуется оксид водорода (вода). Это значит, что произошло окисление водорода кислородом, т. е. эту реакцию мы можем назвать и реакцией окисления.
Если же в пробирку, опрокинутую вверх дном, собрать немного водорода методом вытеснения воздуха, а затем поднести к ее отверстию горящую спичку, то раздастся громкий «лающий» звук небольшого взрыва смеси водорода с воздухом. Такую смесь называют «гремучей».
На заметку: Способность водорода в смеси с воздухом образовывать «гремучий газ» часто являлась причиной катастроф на воздушных шарах, заполненных водородом. Нарушение герметичности оболочки шара приводило к пожару и даже взрыву. В наше время воздушные шары заполняют гелием или постоянно нагнетаемым горячим воздухом.
В атмосфере хлора водород сгорает с образованием сложного вещества — хлороводорода. При этом протекает реакция:
Реакция водорода с азотом происходит при повышенной температуре и давлении в присутствии катализатора. В результате реакции образуется аммиак NH3:
Если струю водорода направить на расплавленную в пробирке серу, то у ее отверстия ощутится запах тухлых яиц. Так пахнет газ сероводород H2S — продукт реакции водорода с серой:
На заметку: Водород способен не только растворяться в некоторых металлах, но и реагировать с ними. При этом образуются химические соединения, называемые гидридами (NaH — гидрид натрия). Гидриды некоторых металлов используют как горючее в ракетных двигателях на твердом топливе, а также при получении термоядерной энергии.
Реакции водорода со сложными веществами
Водород реагирует при повышенной температуре не только с простыми, но и со сложными веществами. Рассмотрим в качестве примера его реакцию с оксидом меди(II) CuO (рис. 96).
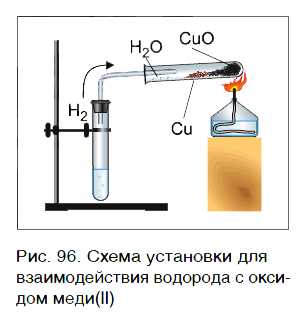
Пропустим водород над нагретым порошком оксида меди(II) CuO. По мере протекания реакции цвет порошка изменяется с черного на коричнево красный. Это цвет простого вещества меди Cu. В ходе реакции на холодных частях пробирки появляются капельки жидкости. Это еще один продукт реакции — вода H2O. Отметим, что в отличие от простого вещества меди вода — сложное вещество.
Уравнение реакции оксида меди(II) с водородом:
Водород в реакции с оксидом меди(II) проявляет способность отнимать у оксида металла кислород, тем самым восстанавливать металл из этого оксида. В результате происходит восстановление меди из сложного вещества CuO до металлической меди (Cu).
Реакции восстановления — это реакции, в ходе которых сложные вещества отдают атомы кислорода другим веществам.
Вещество, отнимающее атомы кислорода, называют восстановителем. В реакции с оксидом меди(II) восстановитель — водород. Так же реагирует водород и с оксидами некоторых других металлов, например PbO, HgO, MoO3, WO3 и др. Окисление и восстановление всегда взаимосвязаны между собой. Если одно вещество (Н2) окисляется, то другое (CuO) — восстанавливается, и наоборот.
Краткие выводы урока:
- При нагревании водород реагирует с кислородом, хлором, азотом, серой.
- Восстановление — это отдача атомов кислорода сложными веществами другим веществам.
- Процессы окисления и восстановления взаимосвязаны между собой.
Надеюсь урок 22 «Химические свойства водорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Свойства водорода — урок. Химия, 8–9 класс.
Физические свойства
Водород имеет молекулярное строение. Его молекула h3 состоит из двух атомов, соединённых ковалентной неполярной связью.
При обычных условиях водород — газ без цвета, запаха и вкуса. Это самое лёгкое вещество на Земле. Его плотность равна примерно \(0,9\) г/дм³. Водород в \(14,5\) раз легче воздуха.
В воде водород растворяется плохо (примерно \(2\) объёма на \(100\) объёмов воды), но может поглощаться некоторыми металлами. Например, \(1\) объём палладия может растворить до \(900\) объёмов водорода.
Температура кипения водорода низкая. Она равна \(–253\) °С. Ниже температура кипения только у гелия.
Молекулы водорода благодаря своей малой массе и размерам могут проникать сквозь стенки сосуда, в котором он содержится. Заполненный водородом шарик через некоторое время сдувается. При температуре \(300\)–\(600\) °С водород способен диффундировать сквозь стенки стеклянного или металлического сосуда.
Химические свойства
При комнатной температуре химическая активность водорода низкая. Она значительно повышается при нагревании.
1. Взаимодействие с простыми веществами-неметаллами (кроме фосфора, кремния, инертных газов).
- Водород реагирует с кислородом. При этом образуется вода:
2h3+O2=t2h3O.
Смесь водорода с кислородом или с воздухом взрывоопасна.
- При освещении или нагревании идёт реакция с хлором, и образуется хлороводород:
h3+Cl2=hν2HCl.
Подобным образом водород реагирует и с другими галогенами: фтором, бромом, иодом.
- Если водород пропускать над нагретой серой, то образуется сероводород:
h3+S=th3S.
- В присутствии катализатора при повышенном давлении водород реагирует с азотом с образованием аммиака:
N2+3h3=t,p,k2Nh4.
Обрати внимание!
В реакциях с неметаллами водород является восстановителем.
2. Взаимодействие с простыми веществами-металлами.
При нагревании водород реагирует со щелочными и щелочноземельными металлами с образованием гидридов:
2Na+h3=t2NaH,
Ca+h3=tCah3.
Обрати внимание!
В реакциях с металлами водород является окислителем.
3. Взаимодействие со сложными веществами.
- Водород способен реагировать с оксидами металлов (кроме оксидов щелочных и щелочноземельных металлов, бериллия, магния, алюминия):
WO3+3h3=tW+3h3O,
CuO+h3=tCu+h3O.
- Водород реагирует с угарным газом с образованием метилового спирта:
CO+2h3→Ch4OH.
- Водород вступает в реакции со многими органическими веществами.
Источники:
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 137 с.
www.yaklass.ru
С чем реагирует водород
В химических реакциях водород является восстановителем:
Еще более сильным восстановителем является атомарный водород. Он образуется из молекулярного в электрическом разряде в условиях низкого давления. За доли секунды атомы водорода рекомбинируют в молекулы с выделением энергии в видимом диапазоне — водород «светится». Высокой восстановительной активностью обладает также водород в момент выделения, образующийся при взаимодействии металла с кислотой. Данная реакция протекает на поверхности цинка, и образующийся при восстановлении ионов водород в первый момент содержит некоторую долю атомов Н, адсорбированных поверхностным слоем металла. Этим и объясняется его сильная восстановительная активность. Такой водород восстанавливает, например, , в :
Важное значение имеет взаимодействие водорода с оксидом азота (II):
используемое в очистительных системах при производстве азотной кислоты. Восстановительные свойства водород проявляет также в реакциях гидрирования органических соединений, а также в процессах гидроформилирования:
ru.solverbook.com
Водород – HIMI4KA

Водород занимает особое положение в Периодической системе химических элементов Д.И. Менделеева. По числу валентных электронов, способности образовывать в растворах гидратный ион H+ он сходен со щелочными металлами, и его следует поместить в I группу. По числу электронов, необходимых для завершения внешней электронной оболочки, значению энергии ионизации, способности проявлять отрицательную степень окисления, малому атомному радиусу водород следует поместить в VII группу периодической системы. Таким образом, размещение водорода в той или иной группе периодической системы в значительной мере условно, но в большинстве случаев его помещают в VII группу.
Электронная формула водорода 1s1. Единственный валентный электрон находится непосредственно в сфере действия атомного ядра. Простота электронной конфигурации водорода отнюдь не означает, что химические свойства этого элемента просты. Напротив, химия водорода во многом отличается от химии других элементов. Водород в своих соединениях способен проявлять степени окисления +1 и –1.
Существует большое количество методов получения водорода. В лаборатории его получают взаимодействием некоторых металлов с кислотами, например:
Водород можно получить электролизом водных растворов серной кислоты или щелочей. При этом происходит процесс выделения водорода на катоде и кислорода на аноде.
В промышленности водород получают главным образом из природных и попутных газов, продуктов газификации топлива и коксового газа.
Простое вещество водород (H2) представляет собой горючий газ без цвета и запаха. Температура кипения –252,8 °C. Водород в 14,5 раз легче воздуха, мало растворим в воде.
Молекула водорода устойчива, обладает большой прочностью. Из-за высокой энергии диссоциации (435 кДж/моль) распад молекул H2 на атомы происходит в заметной степени лишь при температуре выше 2000 °C.
Для водорода возможны положительная и отрицательная степени окисления, поэтому в химических реакциях водород может проявлять как окислительные, так и восстановительные свойства. В тех случаях, когда водород выступает в качестве окислителя, он ведет себя подобно галогенам, образуя аналогичные галогенидам гидриды (гидридами называют группу химических соединений водорода с металлами и менее электроотрицательными, чем он, элементами):
По окислительной активности водород существенно уступает галогенам. Поэтому ионный характер проявляют лишь гидриды щелочных и щелочноземельных металлов. Ионные, а также комплексные гидриды, например, являются сильными восстановителями. Их широко используют в химических синтезах.
В большинстве реакций водород ведет себя как восстановитель. При нормальных условиях водород не взаимодействует с кислородом, однако при поджигании реакция протекает со взрывом:
Смесь двух объемов водорода с одним объемом кислорода называют гремучим газом. При контролируемом горении происходит выделение большого количества тепла, и температура водородно-кислородного пламени достигает 3000 °C.
Реакция с галогенами протекает, в зависимости от природы галогена, по-разному:
С фтором такая реакция идет со взрывом даже при низких температурах. С хлором на свету реакция также протекает со взрывом. С бромом реакция идет значительно медленнее, а с йодом не доходит до конца даже при высокой температуре. Механизм этих реакций радикальный.
При повышенной температуре водород взаимодействует с элементами VI группы — серой, селеном, теллуром, например:
Очень важной является реакция водорода с азотом. Эта реакция обратима. Для смещения равновесия в сторону образования аммиака используют повышенное давление. В промышленности данный процесс осуществляют при температуре 450–500 °C в присутствии различных катализаторов:
Водород восстанавливает многие металлы из оксидов, например:
Данную реакцию используют для получения некоторых чистых металлов.
Огромную роль играют реакции гидрирования органических соединений, которые широко используют как в лабораторной практике, так и в промышленном органическом синтезе.
Сокращение природных источников углеводородного сырья, загрязнение окружающей среды продуктами сгорания топлива повышают интерес к водороду как к экологически чистому топливу. Вероятно, водород будет играть важную роль в энергетике будущего.
В настоящее время водород широко применяют в промышленности для синтеза аммиака, метанола, гидрогенизации твердого и жидкого топлива, в органическом синтезе, для сварки и резки металлов и т. д.
Вода H2O, оксид водорода, является важнейшим химическим соединением. При нормальных условиях вода — бесцветная жидкость, без запаха и вкуса. Вода — самое распространенное вещество на поверхности Земли. В человеческом организме содержится 63–68% воды.
Физические свойства воды во многом являются аномальными. При нормальном атмосферном давлении вода кипит при 100 °C. Температура замерзания чистой воды 0 °C. B отличие от других жидкостей плотность воды при охлаждении возрастает не монотонно, а имеет максимум при +4 °C. Теплоемкость воды очень высока и составляет 418 кДж/моль·K. Теплоемкость льда при 0 °C составляет 2,038 кДж/моль·K. Аномально высокой является теплота плавления льда. Электропроводность воды очень мала. Аномальные физические свойства воды объясняют ее строение. Валентный угол H–O–H равен 104,5°. Молекула воды представляет собой искаженный тетраэдр, в двух вершинах которого располагаются атомы водорода, а две другие заняты орбиталями неподеленных пар электронов атома кислорода, не участвующих в образовании химических связей.
Вода является стабильным соединением, ее разложение на кислород и водород происходит лишь под действием постоянного электрического тока или при температуре около 2000 °C:
Вода непосредственно взаимодействует с металлами, стоящими в ряду стандартных электронных потенциалов до водорода. Продуктами реакции в зависимости от природы металла могут быть соответствующие гидроксиды и оксиды. Скорость реакции в зависимости от природы металла также изменяется в широких пределах. Так, натрий вступает в реакцию водой уже при комнатной температуре, реакция сопровождается выделением большого количества тепла; железо реагирует с водой при температуре 800 °С:
Вода может вступать в реакцию со многими неметаллами. Так, при обычных условиях вода обратимо взаимодействует с хлором:
При повышенной температуре вода взаимодействует с углем с образованием так называемого синтез-газа — смеси оксида углерода (II) и водорода:
При обычных условиях вода реагирует со многими основными и кислотными оксидами с образованием оснований и кислот соответственно:
Реакция идет до конца, если соответствующее основание или кислота растворимы в воде.
Пероксид водорода (H2O2) представляет собой бесцветную жидкость, очень неустойчивую при комнатной температуре. Концентрированные растворы пероксида водорода взрывоопасны. В лаборатории H2O2 получают с помощью обменной реакции между пероксидом бария и концентрированной серной кислотой:
В химических реакциях H2O2 может проявлять свойства как окислителя, так и восстановителя, например:
himi4ka.ru
Водород при определенных условиях реагирует с
Водород – первый элемент Периодической системы Д.И. Менделеева. Природный водород состоит из трех изотопов: — протий, — дейтерий, — тритий. Неметалл. В обычных условиях представляет собой бесцветный трудносжижаемый газ, очень мало растворимый в воде.
Водород проявляет сильные восстановительные свойства при повышенных температурах, реагирует с металлами, неметаллами и оксидами металлов.
Так, водород взаимодействует с фтором (1) в широком диапазоне температур (от до комнатной), сгорание водорода в атмосфере хлора (2) хоть и происходит при комнатной температуре, но обязательно на свету, реакции с азотом (3) и углеродом (4) протекают при нагревании под давлением и с участием катализаторов.
;
;
;
.
Чтобы смесь, состоящая из водорода и натрия / кальция прореагировала, необходимо нагреть её до температуры или соответственно:
;
.
Водород при определенных условиях реагирует с солями, кислотными оксидами и другими сложными веществами. Так, реакция взаимодействия с сульфатом натрия протекает при нагревании () и участии катализатора ():
.
В реакции с диоксидом углерода катализатором выступает оксид меди (I), а требуемая температура нагрева равна :
.
ru.solverbook.com

Leave A Comment