2.5.5. Реакции замещения
2.5.5. Реакции замещения2.5.5. Реакции замещения
В молекулах алканов связи C-Н пространственно более доступны для атаки другими частицами, чем менее прочные связи C-C. В определенных условиях происходит разрыв именно С-Н-связей и осуществляется замена атомов водорода на другие атомы или группы атомов.
1. Галогенирование
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов. Реакция алканов с хлором и бромом идет на свету или при нагревании.
Хлорирование метана:
При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.
В разработке теории цепных реакций большую роль сыграли труды академика, лауреата Нобелевской премии Н.Н. Семенова. Механизм радикального замещения (символ SR) на примере монохлорирования метана
— анимация I (153 Кб)
— анимация II со звуковым комментарием (742 Кб) Стадия 1 – зарождение цепи — появление в зоне реакции свободных радикалов. Под действием световой энергии гомолитически разрушается связь в молекуле Cl:Cl на два атома хлора с неспаренными электронами (свободные радикалы) ·Cl:
Стадия 2 – рост (развитие) цепи
водорода H· значительно выше, чем метильного радикала ·СН3).
Стадия 3 – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
Видеоопыт «Взаимодействие алканов с бромом при нагревании».
2. Нитрование алканов (реакция Коновалова)
На алканы действует pазбавленная азотная кислота пpи нагpевании и давлении. В pезультате пpоисходит замещение атома водоpода на остаток азотной кислоты – нитpогpуппу NO Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитpосоединениями.
Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитpосоединениями.
Схема реакции:
При нитровании алканов также соблюдается порядок реакционной способности С-Н-связей, характерный для реакций радикального замещения:
Стрет.– Н > Свтор.– Н > Cперв.– Н
Например:
- См. также Реакции замещения в алканах
Химия — 10
Проверьте себя
ЗАДАЧА
2
При пропускании хлороводорода, полученного при хлорировании 1 моль этана, образовалось 298 г соли. Определите формулу органического вещества, полученного при хлорировании этана.
ОТВЕТ
C2H2Cl4
ЗАДАЧА
3
Вычислите практический выход продукта при крекинге бутана, если объёмная
доля бутана в полученной газовой смеси составляет 60%.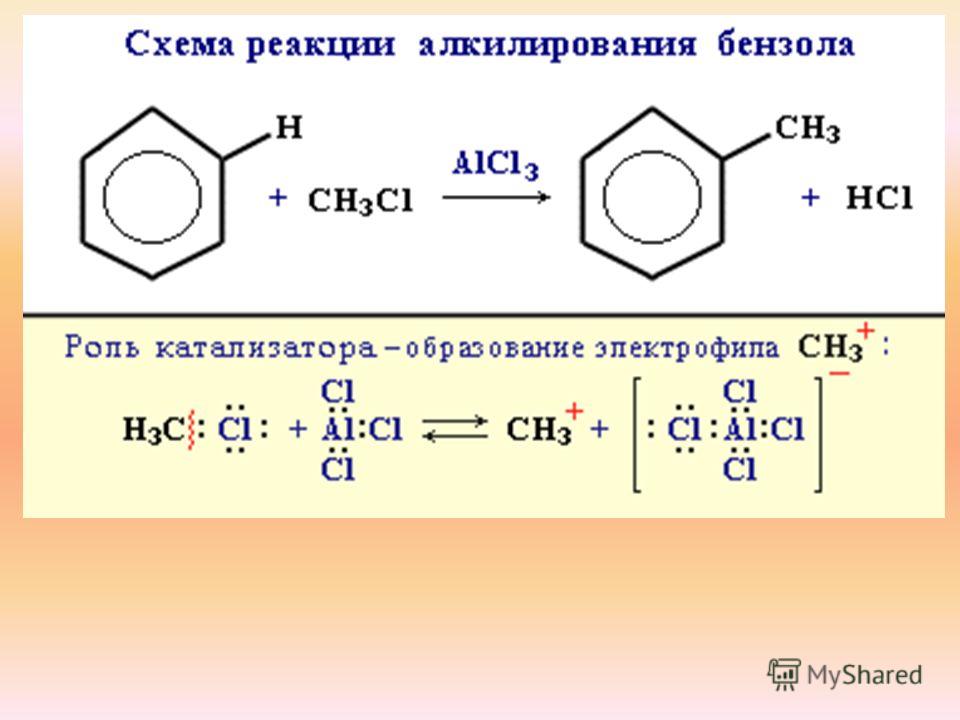
ОТВЕТ
25%
Проверьте изученное
Определите формулу органического вещества и число молекул хлороводорода, полученных при взаимодействии одной молекулы пропана с шестью молекулами хлора.
Что неверно для реакции метана с хлором?
1. Может протекать в темноте
2. Реакция замещения
3. Получается водородВыделите алканы по схеме.

1. этан
2. пропан
3. 2-метилпропан
4. 2,2-диметилпропан
A) C4H5Cl4
B) C3H4Cl4
C) C3H2Cl6
D) C4H6Cl4
E) C4H4Cl5Объём метана (н.у.), литр 4,48 x Определите х.

A) 1
D) 0,8B) 0,1
E) 0,4C) 0,2
1. Хлорирование этана
2.Крекинг бутана
3. Реакция метана с разбавленной HNO3Связи, разрывающиеся в молекулах алканов при химических реакциях C-C C-H Какие превращения необходимы для получения бутана из метана?
4.
 13: Реакции алканов – краткий обзор
13: Реакции алканов – краткий обзор- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 136858
Цель обучения
- распознавать и различать две основные реакции алканов – горение и галогенирование
Сжигание
Полное сгорание (при достаточном количестве кислорода) любого углеводорода дает диоксид углерода и воду . Очень важно, чтобы вы могли написать правильно сбалансированные уравнения для этих реакций, потому что они часто возникают как часть термохимических расчетов. Некоторые легче, чем другие. Например, алканы с четным числом атомов углерода немного тверже, чем с нечетным!
Пример: сжигание пропана
Например, с пропаном (C 3 H 8 ) вы можете сбалансировать углерод и водород, записывая уравнение. Ваш первый черновой вариант будет таким:
Ваш первый черновой вариант будет таким:
\[ C_3H_8 + O_2 \rightarrow 3CO_2 + 4H_2O\]
Подсчет кислорода приводит непосредственно к окончательной версии:
\[ C_3H_8 + 5O_2 \rightarrow 3CO_2 + 4H_2O\] Пример
:Сжигание бутана
С бутаном (C 4 H 10 ) вы можете снова сбалансировать углерод и водород, записывая уравнение.
\[ C_4H_{10} + O_2 \rightarrow 4CO_2 + 5H_2O\]
Подсчет кислорода приводит к небольшой проблеме — с 13 справа. Простой трюк состоит в том, чтобы позволить себе иметь «шесть с половиной» молекул O 2 слева.
\[ C_4H_{10} + 6\dfrac{1}{2}\, O_2 \rightarrow 4CO_2 + 5H_2O\]
Если вас это оскорбляет, удвойте все:
\[ 2C_4H_{10} + 13 O_2 \ rightarrow 8CO_2 + 10 H_2O\]
Углеводороды труднее воспламеняются по мере того, как молекулы становятся больше. Это связано с тем, что более крупные молекулы не так легко испаряются — реакция идет намного лучше, если кислород и углеводород хорошо перемешаны в виде газов. Если жидкость не очень летучая, только те молекулы, которые находятся на поверхности, могут реагировать с кислородом. Молекулы большего размера имеют большее притяжение Ван-дер-Ваальса, что затрудняет их отрыв от своих соседей и превращение в газ.
Если жидкость не очень летучая, только те молекулы, которые находятся на поверхности, могут реагировать с кислородом. Молекулы большего размера имеют большее притяжение Ван-дер-Ваальса, что затрудняет их отрыв от своих соседей и превращение в газ.
При полном сгорании все углеводороды будут гореть синим пламенем. Однако сгорание имеет тенденцию быть менее полным по мере увеличения числа атомов углерода в молекулах. Это означает, что чем крупнее углеводород, тем больше вероятность того, что вы получите желтое дымное пламя. Неполное сгорание (при недостатке кислорода) может привести к образованию углерода или монооксида углерода. Проще говоря, водород в углеводороде получает первый шанс на кислород, а углерод получает все, что осталось! Присутствие в пламени тлеющих частиц углерода делает его желтым, а в дыму часто виден черный углерод. Угарный газ образуется в виде бесцветного ядовитого газа.
Примечание: почему окись углерода ядовита
Кислород переносится кровью гемоглобином, который, к сожалению, связывается точно с тем же участком гемоглобина, что и кислород. Разница в том, что монооксид углерода связывается необратимо (или очень сильно), что делает эту конкретную молекулу гемоглобина бесполезной для переноса кислорода. Если вы вдохнете достаточно угарного газа, вы умрете от своего рода внутреннего удушья.
Разница в том, что монооксид углерода связывается необратимо (или очень сильно), что делает эту конкретную молекулу гемоглобина бесполезной для переноса кислорода. Если вы вдохнете достаточно угарного газа, вы умрете от своего рода внутреннего удушья.
Галогенирование алканов
Галогенирование представляет собой замену одного или нескольких атомов водорода в органическом соединении галогеном (фтором, хлором, бромом или йодом). В отличие от сложных превращений горения, галогенирование алкана, по-видимому, представляет собой простой процесс.0082 реакция замещения , в которой разрывается связь С-Н и образуется новая связь С-Х. Хлорирование метана, показанное ниже, представляет собой простой пример этой реакции.
CH 4 + Cl 2 + энергия → CH 3 Cl + HCl
Поскольку разрываются только две ковалентные связи (C-H и Cl-Cl) и образуются две ковалентные связи (C-Cl и H- Cl), эта реакция кажется идеальным случаем для механистических исследований и предположений.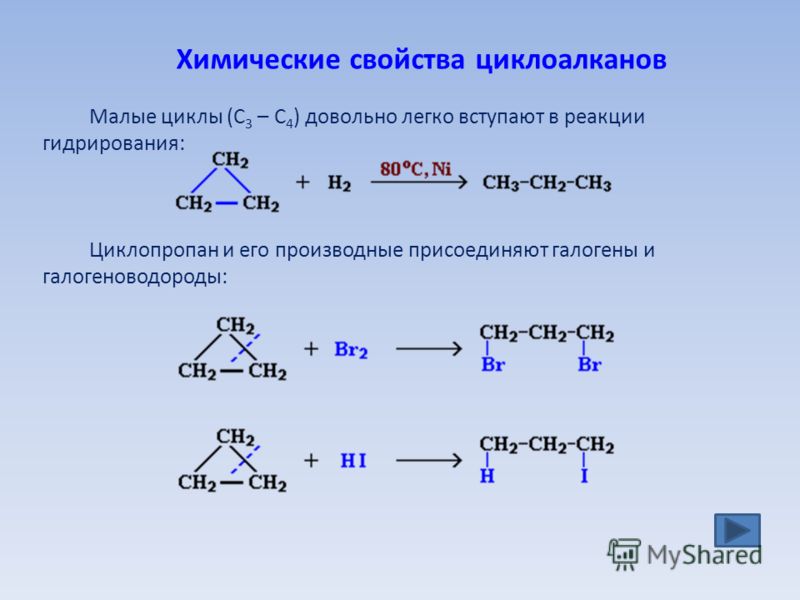 Однако одна сложность заключается в том, что все атомы водорода алкана могут подвергаться замещению, что приводит к смеси продуктов, как показано в следующем 9.0094 несбалансированное уравнение . Относительные количества различных продуктов зависят от пропорции двух используемых реагентов. В случае метана большой избыток углеводорода способствует образованию в качестве основного продукта хлористого метила; тогда как избыток хлора способствует образованию хлороформа и четыреххлористого углерода.
Однако одна сложность заключается в том, что все атомы водорода алкана могут подвергаться замещению, что приводит к смеси продуктов, как показано в следующем 9.0094 несбалансированное уравнение . Относительные количества различных продуктов зависят от пропорции двух используемых реагентов. В случае метана большой избыток углеводорода способствует образованию в качестве основного продукта хлористого метила; тогда как избыток хлора способствует образованию хлороформа и четыреххлористого углерода.
CH 4 + Cl 2 + энергия → CH 3 Cl + CH 2 Cl 2 + CHCl 3 + CCl 4 + HCl
В присутствии пламени реакции подобны реакции с фтором – образуется смесь углерода и галогеноводорода. Интенсивность реакции значительно падает по мере перехода от фтора к хлору и к брому. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, которые происходят при комнатной температуре.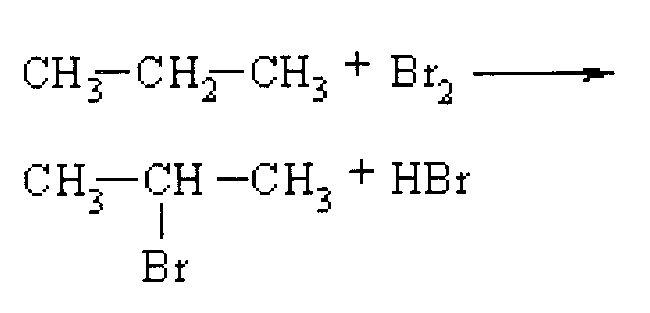 Рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.
Рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.
Происходят реакции замещения, в которых атомы водорода в метане по одному замещаются атомами хлора. В итоге вы получите смесь хлорметана, дихлорметана, трихлорметана и тетрахлорметана.
Исходная смесь бесцветного и зеленого газа будет производить пары хлористого водорода и туман органических жидкостей. Все органические продукты жидкие при комнатной температуре, за исключением хлорметана, который представляет собой газ.
Если вы использовали бром, вы могли либо смешать метан с парами брома, либо барботировать метан через жидкий бром — в любом случае, подвергая воздействию ультрафиолетового света. Первоначальная смесь газов, конечно, была бы красно-коричневой, а не зеленой. Никто не решился бы использовать эти реакции в качестве средства получения этих органических соединений в лаборатории, потому что смесь продуктов было бы слишком утомительно разделять. Механизмы реакций объясняются на отдельных страницах.
Крупные алканы и хлор
Вы снова получили бы смесь продуктов замещения, но стоит кратко взглянуть на то, что происходит, если замещается только один из атомов водорода (монозамещение) — просто чтобы показать, что все не всегда так просто, как кажется! Например, с пропаном вы можете получить один из двух изомеров:
Если бы единственным фактором был случай, вы бы ожидали получить в три раза больше изомера с хлором на конце. Есть 6 атомов водорода, которые могут быть заменены на концевых атомах углерода, по сравнению только с двумя в середине. На самом деле вы получаете примерно одинаковое количество каждого из двух изомеров. Если вы используете бром вместо хлора, большая часть продукта образуется там, где бром присоединен к центральному атому углерода.
Циклоалканы
Реакции циклоалканов, как правило, такие же, как и у алканов, за исключением очень малых, особенно циклопропана. В присутствии УФ-излучения циклопропан будет вступать в реакцию замещения с хлором или бромом точно так же, как нециклический алкан.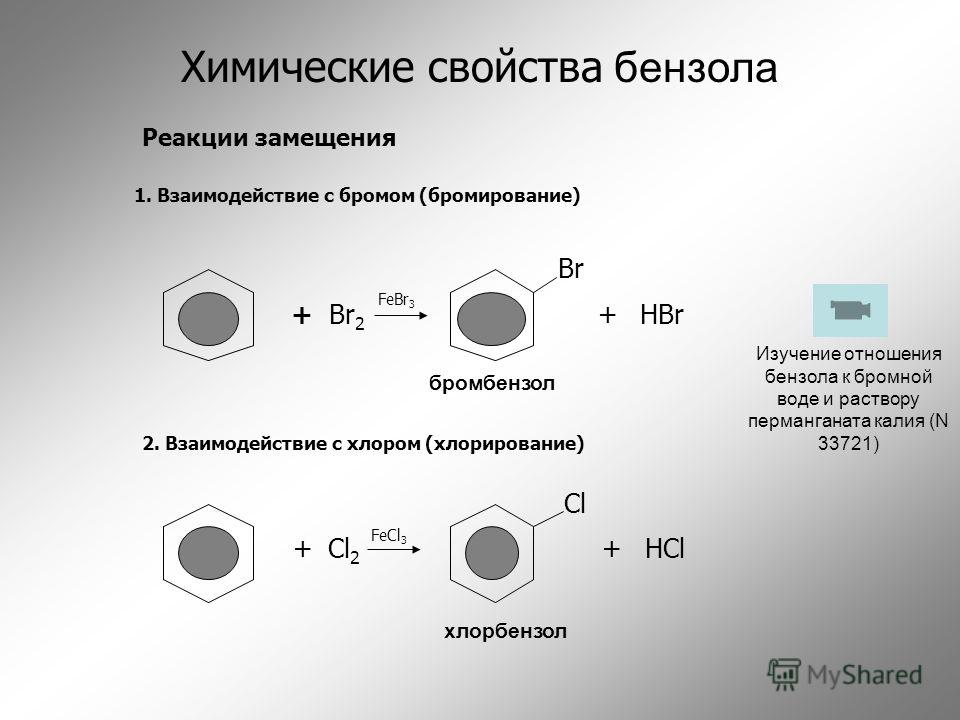
Это все еще может происходить в присутствии света, но вы также получите реакции замещения. Кольцо сломано, потому что циклопропан сильно страдает от деформации кольца. Валентные углы в кольце составляют 60°, а не нормальное значение около 109,5°, когда углерод образует четыре одинарные связи. Перекрытие между атомными орбиталями при образовании углерод-углеродных связей хуже, чем обычно, и между связывающими парами существует значительное отталкивание. Система становится более стабильной, если кольцо разорвано.
Упражнение
1. Классифицируйте следующие реакции как горение или галогенирование.
- Ответить
1. а) галогенирование
б) сжигание
Авторы и ссылки
Джим Кларк (Chemguide.
 co.uk)
co.uk)Уильям Ройш, почетный профессор (штат Мичиган, Университет штата Мичиган), виртуальный учебник органической химии
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Включено
- да
- Теги

Реакционная способность алканов
Реакции алканов |
|---|
Алканы и циклоалканы, за исключением циклопропана, вероятно, являются наименее химически активным классом органических соединений. Несмотря на свою относительную инертность, алканы вступают в несколько важных реакций, которые обсуждаются в следующем разделе.
1. Сжигание
Горение соединений углерода, особенно углеводородов, было самым важным источником тепловой энергии для человеческих цивилизаций на протяжении всей истории человечества. Практическое значение этой реакции нельзя отрицать, но массовые и неконтролируемые химические изменения, происходящие при горении, затрудняют вывод механизмов. Используя в качестве примера горение пропана, мы видим из следующего уравнения, что каждая ковалентная связь в реагентах была разорвана, и в продуктах образовался совершенно новый набор ковалентных связей. Никакая другая обычная реакция не вызывает столь глубоких и всеобъемлющих изменений, а механизм горения настолько сложен, что химики только начинают изучать и понимать некоторые его элементарные особенности.
Никакая другая обычная реакция не вызывает столь глубоких и всеобъемлющих изменений, а механизм горения настолько сложен, что химики только начинают изучать и понимать некоторые его элементарные особенности.
В отношении этой реакции важны два момента :
1. Поскольку все ковалентные связи в молекулах реагентов разорваны, количество тепла, выделяющегося в этой реакции, связано с прочностью этих связей (и, конечно, , прочность связей, образующихся в изделиях). Точные измерения теплоты сгорания могут дать полезную информацию о структуре молекул.
2. Важна стехиометрия реагентов. Если подается недостаточное количество кислорода, некоторые из продуктов будут состоять из окиси углерода, высокотоксичного газа.
Теплота сгорания
Исходя из предыдущего обсуждения, мы могли бы ожидать, что изомеры будут иметь одинаковую теплоту сгорания. Однако несколько простых измерений развеют это убеждение. Так, теплота сгорания пентана составляет -782 ккал/моль, а его изомера 2,2-диметилпропана (неопентана) -777 ккал/моль. Подобные различия отражают тонкие структурные вариации, в том числе большую энергию связи 1º-C–H по сравнению с 2º-C–H и стерическую скученность соседних групп. В циклических соединениях с малым кольцом деформация кольца может быть основным фактором термодинамической стабильности и химической реакционной способности. В следующей таблице приведены данные о теплоте сгорания для некоторых простых циклоалканов в сравнении с увеличением на CH 2 единица для длинноцепочечных алканов.
Однако несколько простых измерений развеют это убеждение. Так, теплота сгорания пентана составляет -782 ккал/моль, а его изомера 2,2-диметилпропана (неопентана) -777 ккал/моль. Подобные различия отражают тонкие структурные вариации, в том числе большую энергию связи 1º-C–H по сравнению с 2º-C–H и стерическую скученность соседних групп. В циклических соединениях с малым кольцом деформация кольца может быть основным фактором термодинамической стабильности и химической реакционной способности. В следующей таблице приведены данные о теплоте сгорания для некоторых простых циклоалканов в сравнении с увеличением на CH 2 единица для длинноцепочечных алканов.
| Циклоалкан (CH 2 ) n | CH 2 Единицы n | ΔH 25º ккал/моль | ΔH 25º на CH 2 Единица измерения | Кольцевой штамм ккал/моль | 468,7 9Циклобутан | n = 4 |
| Циклопентан | n = 5 | 741,5 | 148,3 | 6,5 |
| Циклогексан | n = 6 | 882,1 | 147,0 | 0,0 |
| 9 | 6,3 | |||
| Циклооктан | n = 8 | 1186. 0 0 | 148.2 | 9.6 |
| Циклонон 90 0308 | 1335.0 | 148.3 | 11.7 | |
| Циклодекан | n = 10 | 1481 | 148.1 | 11.0 |
| CH 3 (CH 2 ) м CH 3 9 м большой = 9 08 — | 147,0 | 0,0 | |
Основным источником кольцевой деформации в кольцах меньшего размера является угловая деформация и деформация затмения. Как отмечалось в другом месте, циклопропан и циклобутан вносят большой вклад в обе деформации, при этом угловая деформация является особенно серьезной. Изменения химической активности вследствие угловой деформации резко выражены в случае циклопропана и также очевидны для циклобутана. Некоторые примеры показаны на следующей диаграмме. Реакции циклопропана представляют собой реакции присоединения, многие из которых инициируются электрофильной атакой. Пиролитическое превращение β-пинена в мирцен, вероятно, происходит при начальном разрыве связи 1:6 с образованием аллильного 3º-бирадикала с последующим разрывом связи 5:7.
Пиролитическое превращение β-пинена в мирцен, вероятно, происходит при начальном разрыве связи 1:6 с образованием аллильного 3º-бирадикала с последующим разрывом связи 5:7.
2. Галогенирование
Галогенирование представляет собой замену одного или нескольких атомов водорода в органическом соединении галогеном (фтором, хлором, бромом или йодом). В отличие от сложных превращений горения, галогенирование алкана представляет собой простую реакцию замещения , в которой разрывается связь С-Н и образуется новая связь С-Х. Хлорирование метана, показанное ниже, представляет собой простой пример этой реакции.
CH 4 + Cl 2 + энергия —— > CH 3 Cl + HCl
Поскольку разрываются только две ковалентные связи (C-H и Cl-Cl) и образуются две ковалентные связи (C-Cl и H-Cl), эта реакция кажется идеальным случаем для изучения механизмов и предположений. Однако одна сложность заключается в том, что все атомы водорода алкана могут подвергаться замещению, что приводит к смеси продуктов, как показано в следующем 9. 0094 несбалансированное уравнение . Относительные количества различных продуктов зависят от пропорции двух используемых реагентов. В случае метана большой избыток углеводорода способствует образованию в качестве основного продукта хлористого метила; тогда как избыток хлора способствует образованию хлороформа и четыреххлористого углерода.
0094 несбалансированное уравнение . Относительные количества различных продуктов зависят от пропорции двух используемых реагентов. В случае метана большой избыток углеводорода способствует образованию в качестве основного продукта хлористого метила; тогда как избыток хлора способствует образованию хлороформа и четыреххлористого углерода.
Следующие факты должны учитываться любым разумным механизмом реакции галогенирования.
1. Реакционная способность галогенов уменьшается в следующем порядке: F 2 > Cl 2 > Br 2 > I 2 .
2. Мы ограничим наше внимание хлором и бромом, так как фтор настолько взрывоопасн, что его трудно контролировать, а йод вообще неактивен.
3. Хлорирование и бромирование обычно экзотермичны.
4. Потребление энергии в виде тепла или света необходимо для инициирования этих галогенирований.
5. Если для инициирования галогенирования используется свет, на каждый поглощенный фотон света реагируют тысячи молекул.
6. Реакции галогенирования могут проводиться как в газовой, так и в жидкой фазе.
7. При хлорировании в газовой фазе присутствие кислорода (ловушки радикалов) тормозит реакцию.
8. В жидкофазном галогенировании радикальные инициаторы, такие как пероксиды, облегчают реакцию.
Наиболее вероятным механизмом галогенирования является цепная реакция с участием нейтральных промежуточных соединений, таких как свободные радикалы или атомы. Самой слабой ковалентной связью в реагентах является связь галоген-галоген (Cl-Cl = 58 ккал/моль; Br-Br = 46 ккал/моль), поэтому инициирующей стадией является гомолитический разрыв этой связи под действием тепла или света, обратите внимание, что хлор и бром поглощают видимый свет (они окрашены). Описан механизм цепной реакции хлорирования метана. 902:30
Бромирование алканов происходит по аналогичному механизму, но более медленно и более селективно, поскольку атом брома является менее реактивным агентом отщепления водорода, чем атом хлора, что отражает более высокая энергия связи H-Cl, чем H-Br.
Описан механизм цепной реакции хлорирования метана. 902:30
Бромирование алканов происходит по аналогичному механизму, но более медленно и более селективно, поскольку атом брома является менее реактивным агентом отщепления водорода, чем атом хлора, что отражает более высокая энергия связи H-Cl, чем H-Br.
Посмотреть анимированную модель свободнорадикальной цепной реакции бромирования
Селективность
При галогенировании алканов крупнее этана образуются изомерные продукты. Таким образом, хлорирование пропана дает как 1-хлорпропан, так и 2-хлорпропан в виде монохлорированных продуктов. Возможны четыре конституционно-изомерных дихлорированных продукта, и пять конституциональных изомеров существуют для трихлорированных пропанов. Можете ли вы написать структурные формулы четырех дихлорированных изомеров?
Галогенирование пропана раскрывает интересную особенность этих реакций. Все атомы водорода в сложном алкане не обладают одинаковой реакционной способностью . Например, пропан имеет восемь атомов водорода, шесть из которых структурно эквивалентны первичным , а два других — вторичным . Если бы все эти атомы водорода были одинаково реакционноспособны, галогенирование должно давать моногалогенированные продукты 1-галогенпропана и 2-галогенпропана в соотношении 3:1, отражая первичные/вторичные числа. Это не то, что мы наблюдаем. Светоиндуцированное хлорирование в газовой фазе при 25 ºC дает 45% 1-хлорпропана и 55% 2-хлорпропана.
Например, пропан имеет восемь атомов водорода, шесть из которых структурно эквивалентны первичным , а два других — вторичным . Если бы все эти атомы водорода были одинаково реакционноспособны, галогенирование должно давать моногалогенированные продукты 1-галогенпропана и 2-галогенпропана в соотношении 3:1, отражая первичные/вторичные числа. Это не то, что мы наблюдаем. Светоиндуцированное хлорирование в газовой фазе при 25 ºC дает 45% 1-хлорпропана и 55% 2-хлорпропана.
CH 3 -CH 2 -CH 3 + Cl 2 — > 45% CH 3 -CH 20 1 2 Cl + 55% CH 3 -CHCl-CH 3
Результаты бромирования (индуцированного светом при 25 ºC) еще более удивительны: 2-бромпропан составляет 97% монобромсодержащего продукта.
CH 3 -CH 2 -CH 3 + Br 2 —— > 3% CH 3 -CH 2 -CH 2 Br + 97% CH 3 -CHBr-CH 3
Эти результаты убедительно свидетельствуют о том, что 2°-водороды по своей природе более реакционноспособны, чем 1°-водороды, примерно в 3:1 раз. Дальнейшие эксперименты показали, что 3º-водороды еще более реакционноспособны по отношению к атомам галогенов. Так, светоиндуцированное хлорирование 2-метилпропана дало преимущественно (65%) 2-хлор-2-метилпропан, продукт замещения единственного 3º-водорода, несмотря на присутствие в молекуле девяти 1º-водородов.
Дальнейшие эксперименты показали, что 3º-водороды еще более реакционноспособны по отношению к атомам галогенов. Так, светоиндуцированное хлорирование 2-метилпропана дало преимущественно (65%) 2-хлор-2-метилпропан, продукт замещения единственного 3º-водорода, несмотря на присутствие в молекуле девяти 1º-водородов.
(CH 3 ) 3 CH + Cl 2 —— > 65% (CH 3 ) 3 9004 % CCl 3 ( 0 904 % CCl 3 + 041 ) 2 ЧЧЧ 2 Кл
Если вы не уверены в терминах первичный (1º), вторичный (2º) и третичный (3º), нажмите здесь.
Из обзора двух стадий свободнорадикальной цепной реакции галогенирования должно быть ясно, что первой стадией (отщепление водорода) является этап определения продукта . После образования углеродного радикала последующее связывание с атомом галогена (на втором этапе) может происходить только в месте радикала. Следовательно, понимание предпочтительности замещения у 2-х и 3-х атомов углерода должно исходить из анализа этого первого шага.
Первый этап:
R 3 CH + X · —— > R 3 C · + H-XВторой шаг:
R 3 C · + X 2 —— > R 3 CX + X ·Поскольку продукт H-X является общим для всех возможных реакций, различия в реакционной способности можно объяснить только различиями в энергиях диссоциации связи C-H. В нашем предыдущем обсуждении энергии связи мы предполагали средние значения для всех связей данного типа, но теперь мы видим, что это не совсем так. В случае углерод-водородных связей существуют значительные различия, и были измерены удельные энергии диссоциации (энергия, необходимая для гомолитического разрыва связи) для различных видов связей С-Н. Эти значения приведены в следующей таблице.
| R (в R–H) | метил | этил | и-пропил | т-бутил | фенил | бензил | аллил | винил |
|---|---|---|---|---|---|---|---|---|
| Энергия диссоциации связи (ккал/моль) | 103 | 98 | 95 | 93 | 110 | 85 | 88 | 112 |
Разница в энергии диссоциации связи C-H, указанная для первичных (1º), вторичных (2º) и третичных (3º) центров, согласуется с наблюдениями за галогенированием, о которых сообщалось выше, в том смысле, что мы ожидаем, что более слабые связи будут разрываться легче, чем сильные связи.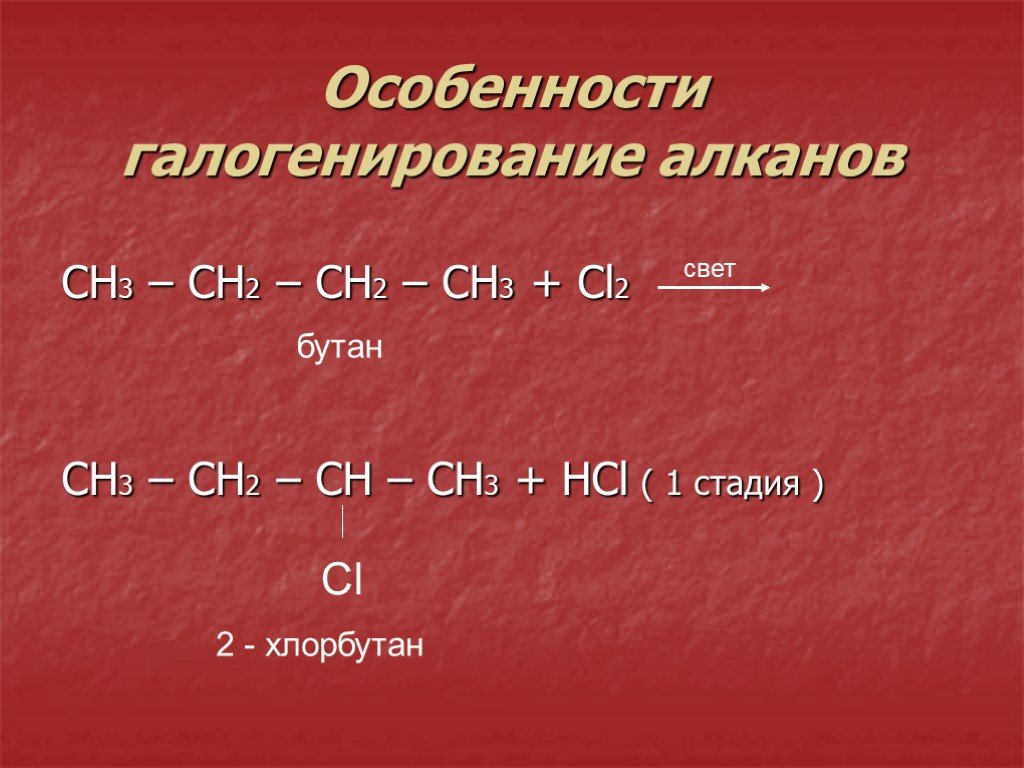 Исходя из этого, мы ожидаем, что бензильные и аллильные центры будут исключительно реакционноспособными при свободнорадикальном галогенировании, как показали эксперименты. Метильная группа толуола, C 6 H 5 CH 3 , легко хлорируется или бромируется в присутствии инициаторов свободных радикалов (обычно пероксидов), а этилбензол аналогичным образом хлорируется исключительно в бензильной позиции. Водороды, связанные с ароматическим кольцом (упомянутые выше как фенильные атомы водорода), имеют относительно высокие энергии диссоциации связи и не являются замещенными.
Исходя из этого, мы ожидаем, что бензильные и аллильные центры будут исключительно реакционноспособными при свободнорадикальном галогенировании, как показали эксперименты. Метильная группа толуола, C 6 H 5 CH 3 , легко хлорируется или бромируется в присутствии инициаторов свободных радикалов (обычно пероксидов), а этилбензол аналогичным образом хлорируется исключительно в бензильной позиции. Водороды, связанные с ароматическим кольцом (упомянутые выше как фенильные атомы водорода), имеют относительно высокие энергии диссоциации связи и не являются замещенными.
Поскольку углерод-углеродные двойные связи быстро присоединяют хлор и бром в жидкофазных растворах, реакции свободнорадикального замещения алкенов этими галогенами необходимо проводить в газовой фазе или другими галогенирующими реагентами. Одним из таких реагентов является N-бромсукцинимид (NBS), показанный во втором уравнении ниже. При использовании NBS в качестве бромирующего агента аллильное бромирование легко достигается в жидкой фазе.
Одним из таких реагентов является N-бромсукцинимид (NBS), показанный во втором уравнении ниже. При использовании NBS в качестве бромирующего агента аллильное бромирование легко достигается в жидкой фазе.
Гомолизы ковалентной связи, которые определяют перечисленные выше энергии диссоциации связи, могут быть описаны общим уравнением:
Поскольку атом водорода является общим для всех приведенных здесь случаев в энергиях диссоциации, мы можем объяснить различия в энергии диссоциации связи к различиям в стабильности алкильных радикалов (R 3 C · ) по мере изменения замещения углерода. Это приводит нас к выводу, что:
стабильность алкильных радикалов увеличивается в следующем порядке: фенил < первичный (1º) < вторичный (2º) < третичный (3º) < аллил ≈ бензил . |
Плохая стабильность фенильных радикалов C 6 H 5 · , в свою очередь, может быть связана с различным состоянием гибридизации углерода, несущего неспаренный электрон (sp 2 против sp 3 ).
Энергия диссоциации связи и радикальная стабильность |



 co.uk)
co.uk)

Leave A Comment