Почему мы до сих пор не умеем делать воду — и как научиться ее беречь
Лето — разве не идеальное время, чтобы бросить побольше льда в лимонад, наполнить бассейн и почаще принимать долгий, освежающий душ? Если коротко — то нет.
На самом деле, когда мы все наслаждаемся прекрасной погодой, легко забыть о важности экономии воды. Но разве не было бы проще, если бы мы могли просто делать воду с нуля? В конце концов, сегодня мы можем изготавливать самые разнообразные вещи — от бриллиантов до бургеров.
Н-2-О нет!
Теоретически, сделать воду должно быть легко. Надо лишь взять два атома водорода и соединить с атомом кислорода — разве это может быть сложно? Оказывается, может — и даже очень.
Просто смешав водород с кислородом, воду вы не получите — для того, чтобы их соединить, нужна энергия. Проблема с добавлением в это уравнение энергии заключается в том, что масштабная химическая реакция легковоспламеняющегося водорода и кислорода (который как раз и поддерживает горение) может привести к довольно большому взрыву. Поэтому опасности в этой затее больше, чем пользы.
Поэтому опасности в этой затее больше, чем пользы.
- «Безглютеновая вода» и другие маркетинговые стратегии
- Питьевая вода на планете загрязнена пластиком — обзор СМИ
- Руки мыли? Правильно ли мы делаем это
Если мы не можем просто сделать воду из ее атомов, есть ли другие способы ее создать? В последнее время ученые сосредотачиваются на получении воды из воздуха и использовании для этого влажности. К сожалению, большинство таких исследований находятся на ранних стадиях и проводятся в небольших масштабах. То есть, бороться с нехваткой воды и засухой таким образом сейчас, безусловно, нельзя.
Настоящая жажда
Однако засуха — не единственная причина, почему мы работаем над тем, чтобы научиться делать воду. Население Земли постоянно увеличивается — и спрос на воду также растет.
Кроме того, в мире до сих пор есть места, где нет доступа к чистой воде. Хотя около 71% поверхности Земли — это вода, большая ее часть — это соленая вода, то есть не питьевая. Лишь 2% воды на Земле является пресной и безопасной для питья, и более половины ее находится в полярных ледяных шапках, откуда мы не можем ее получить. В то же время много чистой, питьевой воды мы теряем просто потому, что воспринимаем ее как должное.
Хотя около 71% поверхности Земли — это вода, большая ее часть — это соленая вода, то есть не питьевая. Лишь 2% воды на Земле является пресной и безопасной для питья, и более половины ее находится в полярных ледяных шапках, откуда мы не можем ее получить. В то же время много чистой, питьевой воды мы теряем просто потому, что воспринимаем ее как должное.
Нам так легко получить воду у себя дома и на работе, что мы забываем, что это ограниченный ресурс и однажды он, вполне вероятно, закончится. По всем этим причинам поиск новых способов создания воды становится все более актуальным.
Голубая планета №2?
Підпис до фото,Можем ли мы добывать воду на других планетах?
Ученые заинтересованы не только в создании и сборе воды на Земле. На самом деле, их исследования распространяются на самые удаленные уголки космоса. Сейчас астронавты NASA полагаются на свою Систему восстановления воды (Water Recovery System) для переработки водорода и углекислого газа в космосе для получения воды (и метана). В космосе у них нет дождя и водоемов, которые есть здесь у нас, поэтому количество воды еще более ограничено. Было бы почти идеально, если бы мы могли брать воду из космоса — но насколько это реально?
В космосе у них нет дождя и водоемов, которые есть здесь у нас, поэтому количество воды еще более ограничено. Было бы почти идеально, если бы мы могли брать воду из космоса — но насколько это реально?
- На Марсе нашли озеро. С водой
В прошлом году ученые обнаружили доказательства наличия льда на так называемой темной стороне Луны. Ранее подобные образования льда находили и на других планетах, например на Меркурии. Не трудно представить, как сильно это взволновало научное сообщество. Возможность брать воду с Луны и других планет не только открывает водные ресурсы за пределами Земли, но также дает возможность дальнейшего исследования космоса.
Но лед — не единственный водный ресурс в космосе. На Марсе есть ряд возможных источников воды — нам просто нужно найти способ ее добычи. Например, воду можно было бы собирать из атмосферы, из почвы или даже добывать из полезных ископаемых — возможности бесконечны. К сожалению, наши технологии еще не настолько развиты.
А может, начать с того, чтобы беречь то, что имеем?
Поэтому, возможно, вода — это не столь ограниченный ресурс, как мы считали изначально. Но пока возможность получать воду в глобальном или даже планетарном масштабе все еще недоступна.
- Зачем люди пьют неочищенную «сырую» воду и безопасно ли это?
Так что же мы можем сделать для сохранения воды, которая уже есть? Самое главное — не воспринимать воду как должное. Вот пять полезных советов, которые помогут вам уменьшить количество потребляемой воды:
- Не принимайте душ слишком долго. В жаркую погоду понятно желание принимать душ чаще. Однако, когда вы его принимаете, делайте это недолго, или даже замените долгий душ частично наполненной ванной.
- Не оставляйте кран открытым, когда в этом нет необходимости. Чаще всего так происходит, когда вы чистите зубы или умываетесь — но подумайте, что вся эта вода просто стекает в канализацию!
- Используйте стиральную или посудомоечную машины только с полной загрузкой.
 Одна полная загрузка экономит гораздо больше воды, чем две или три частичных.
Одна полная загрузка экономит гораздо больше воды, чем две или три частичных. - Не поливайте газон и растения избыточно. А также поливайте их в прохладное время суток — например, вечером вода не испаряется на солнце, поэтому расходуется меньше.
- Держите бутылку с водой в холодильнике, а не ждите, пока из крана потечет холодная.
В среднем человек использует около 9 000 литров воды в год — этого достаточно для наполнения двух бензиновых цистерн! Еще страшнее думать, что, по прогнозам, к 2025 году более 60% людей будут иметь ограниченный доступ к пресной воде.
Даже самая незначительная экономия воды может иметь огромное значение — если в ней будет участвовать большое количество людей.
Следите за нашими новостями в Twitter и Telegram
Удар для любителей нефти: два шага к новой энергетике
Недавние технологические разработки приблизили использование искусственного фотосинтеза для получения чистой энергии
Сразу две исследовательские группы объявили о серьезных успехах на пути к искусственному фотосинтезу — процессу, при котором вода расщепляется солнечным светом с образованием водорода и кислорода. Водород и кислород при этом образуют эффективное и экологически чистое топливо: при их реакции образуется опять же вода. Немецкие исследователи разработали эффективный катализатор, обеспечивающий разложение воды. Тем временем ученые из британского Кембриджа предложили систему полуискусственного фотосинтеза с использованием отдельных элементов живых организмов.
Водород и кислород при этом образуют эффективное и экологически чистое топливо: при их реакции образуется опять же вода. Немецкие исследователи разработали эффективный катализатор, обеспечивающий разложение воды. Тем временем ученые из британского Кембриджа предложили систему полуискусственного фотосинтеза с использованием отдельных элементов живых организмов.
Почти вся энергия, используемая человечеством, поступает к нам от Солнца (исключение — энергия распада урана, которая идет от другого источника — давно потухших звезд). Именно энергия Солнца заключена во всех видах ископаемого топлива: ее запасли для нас живые организмы прежних эпох.
Живая природа выработала исключительно эффективный способ использовать энергию Солнца — фотосинтез. Прилетевший от Солнца фотон растения и цианобактерии используют, чтобы разбить молекулу воды на кислород и водород. Кислород они тут же выбрасывают, а водород в конечном счете используют для того, чтобы обвешать им молекулу углекислого газа, превратив ее в органику.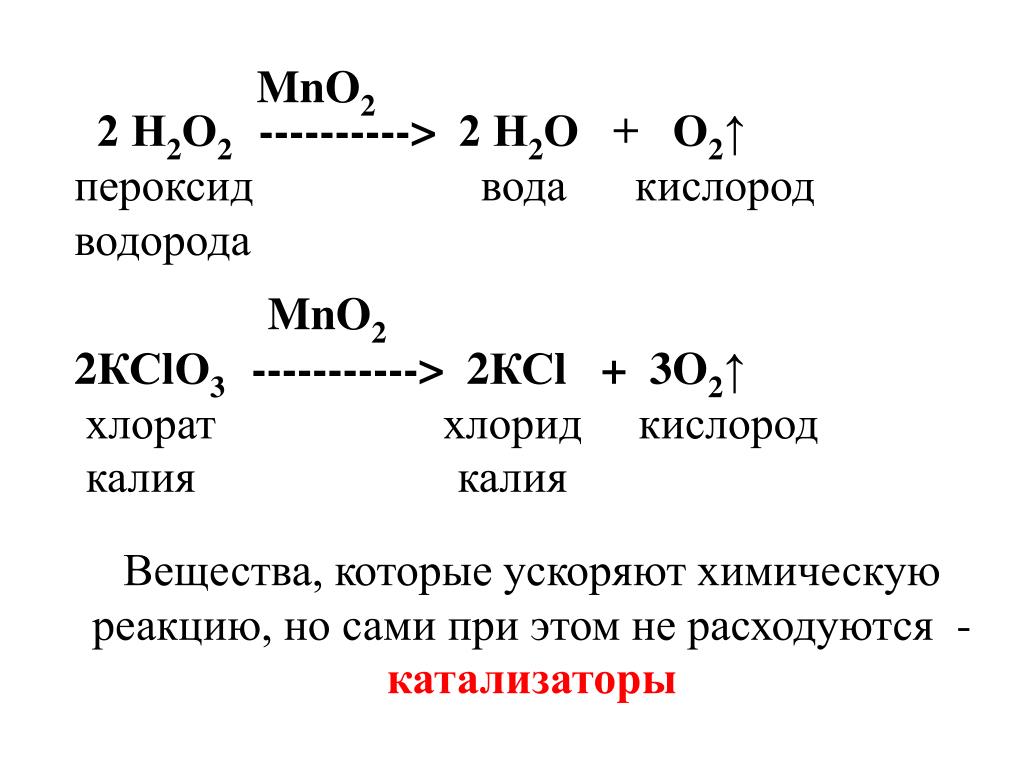
Синтез органики из углекислого газа, воды и солнечного света — процесс, который удается растениям так хорошо, что людям нет никакого смысла его копировать: достаточно просто посадить побольше лесов. Однако инженеров очень привлекает другая возможность: если не доводить природный процесс до конца, а остановить его на стадии расщепления воды, можно запасать солнечную энергию в виде водорода и кислорода. Водород и кислород по отдельности выделяют многие микроорганизмы, но вот объединить эти процессы для обеспечения собственной энергетики живая природа не додумалась (она нашла для этого более изысканные и безопасные химические реакции). Между тем такой технологический процесс мог бы многократно покрыть все сегодняшние энергетические потребности человечества.
Йохен Фельдман и Яцек Столарчик из Мюнхена, а также Франк Вюртнер из Вюрцбурга решили важнейшую проблему: как эффективно разделить воду на водород и кислород и не дать им соединиться обратно. Их подход основан на довольно традиционной технологии использования полупроводников. После поглощения фотона в полупроводнике создается пара из электрона и положительно заряженной «дырки». Электрон используется для того, чтобы «восстановить» из воды водород. В прежних инженерных решениях «дырки» старались как можно быстрее удалить из полупроводника с помощью химических реагентов, и таким образом вторая, более медленная часть реакции — «окисление» кислорода «дыркой» — оставалась неосуществленной.
Зачем нам использовать наработки древних растений, если мы сами научимся делать то же, что и они, — только лучше?
Эту проблему и решили исследователи. В их системе две половинки реакции протекают на одной наночастице, хоть и разнесены в пространстве. Наночастицы представляют собой стержни из полупроводника, сульфата кадмия. На концы стержней нанесены частицы платины, которая служит акцептором для возбужденных электронов. Там и происходит реакция восстановления водорода. Тем временем на боковые поверхности стержней нанесен разработанный исследователями катализатор на основе рутения: он обеспечивает исключительно быструю доставку «дырок» к ионам кислорода. Скорость особенно важна, поскольку «дырки» химически активны и быстро разрушают катализатор. В итоге две части реакции катализируются одним типом наночастиц, и происходит полное расщепление воды на кислород и водород в одну стадию.
В их системе две половинки реакции протекают на одной наночастице, хоть и разнесены в пространстве. Наночастицы представляют собой стержни из полупроводника, сульфата кадмия. На концы стержней нанесены частицы платины, которая служит акцептором для возбужденных электронов. Там и происходит реакция восстановления водорода. Тем временем на боковые поверхности стержней нанесен разработанный исследователями катализатор на основе рутения: он обеспечивает исключительно быструю доставку «дырок» к ионам кислорода. Скорость особенно важна, поскольку «дырки» химически активны и быстро разрушают катализатор. В итоге две части реакции катализируются одним типом наночастиц, и происходит полное расщепление воды на кислород и водород в одну стадию.
Ученые из Кембриджа придерживались другого подхода: они объединили в одном дизайне инженерные технологии человека и компоненты природных живых систем. Получившийся в результате процесс преподнес исследователям сюрприз: он позволил использовать энергию солнечного света даже более эффективно, чем это делает природный фотосинтез в растениях.
Преимущества полуискусственного фотосинтеза в том, что для него не нужны дорогие и токсичные катализаторы, ограничивающие возможности полностью искусственных систем, вроде описанной выше. С другой стороны, полуискусственные процессы, возможно, вскоре удастся масштабировать до промышленного уровня.
Авторы использовали молекулярное оборудование природной фотосистемы II, добавив к нему фермент гидрогеназу из водорослей, восстанавливающий протоны до водорода. В природном фотосинтезе ничего подобного не происходит, так как выделяющиеся при расщеплении воды протоны сразу же вовлекаются в другие биохимические процессы. Однако исследователям удалось совместить две биологические реакции, в обычных условиях разобщенные: работу фермента гидрогеназы и расщепление воды фотосистемой II. Оба «живых» компонента фиксировали на фотоаноде, покрытом особым красителем. В результате природный процесс был оптимизирован: вместо кислорода и восстановленной из СО
Что происходит, когда водород и кислород объединяются?
••• Zolnierek/iStock/GettyImages
Обновлено 30 апреля 2018 г.
Клэр Джексон
Водород — высокореактивное топливо. Молекулы водорода бурно реагируют с кислородом, когда существующие молекулярные связи разрываются и образуются новые связи между атомами кислорода и водорода. Поскольку продукты реакции находятся на более низком энергетическом уровне, чем реагенты, результатом является взрывное выделение энергии и образование воды. Но водород не вступает в реакцию с кислородом при комнатной температуре, для воспламенения смеси нужен источник энергии.
Но водород не вступает в реакцию с кислородом при комнатной температуре, для воспламенения смеси нужен источник энергии.
TL;DR (слишком длинный; не читал)
Водород и кислород объединяются, образуя воду, и в процессе выделяют много тепла.
Смесь водорода и кислорода
Смесь газов водорода и кислорода при комнатной температуре без химической реакции. Это связано с тем, что скорость молекул не обеспечивает достаточной кинетической энергии для активации реакции во время столкновений между реагентами. Образуется смесь газов, которая может вступить в бурную реакцию, если в смесь будет введено достаточное количество энергии.
Энергия активации
Введение искры в смесь приводит к повышению температуры некоторых молекул водорода и кислорода. Молекулы при более высоких температурах движутся быстрее и сталкиваются с большей энергией. Если энергии столкновения достигают минимальной энергии активации, достаточной для «разрыва» связей между реагентами, то следует реакция между водородом и кислородом. Поскольку водород имеет низкую энергию активации, для запуска реакции с кислородом требуется лишь небольшая искра.
Поскольку водород имеет низкую энергию активации, для запуска реакции с кислородом требуется лишь небольшая искра.
Экзотермическая реакция
Как и все виды топлива, реагенты, в данном случае водород и кислород, находятся на более высоком энергетическом уровне, чем продукты реакции. Это приводит к чистому высвобождению энергии реакции, и это известно как экзотермическая реакция. После того, как один набор молекул водорода и кислорода прореагировал, высвобождаемая энергия запускает реакцию молекул в окружающей смеси, высвобождая больше энергии. Результатом является взрывная, быстрая реакция, которая быстро высвобождает энергию в виде тепла, света и звука.
Поведение электронов
На субмолекулярном уровне причина различия энергетических уровней между реагентами и продуктами лежит в электронных конфигурациях. Каждый атом водорода имеет по одному электрону. Они объединяются в молекулы из двух, так что они могут разделить два электрона (по одному на каждого).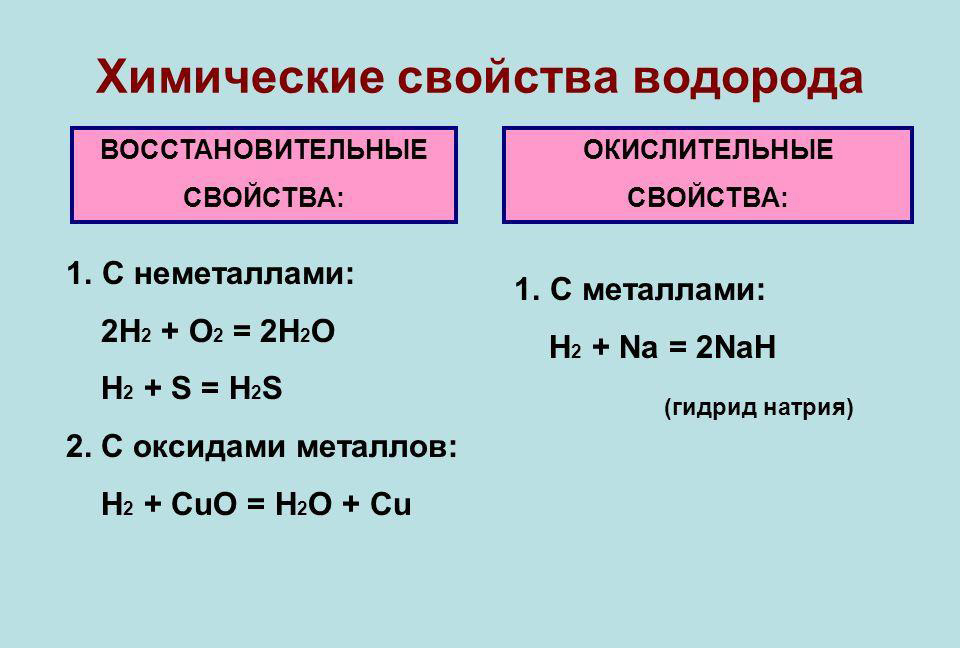 Это связано с тем, что самая внутренняя электронная оболочка находится в более низком энергетическом состоянии (и, следовательно, более стабильна), когда занята двумя электронами. Каждый атом кислорода имеет по восемь электронов. Они объединяются в молекулы из двух, разделяя четыре электрона, так что их самые внешние электронные оболочки полностью заняты восемью электронами каждая. Однако гораздо более стабильное выравнивание электронов возникает, когда два атома водорода делят электрон с одним атомом кислорода. Требуется лишь небольшое количество энергии, чтобы «сбить» электроны реагентов «с» их орбит, чтобы они могли перестроиться в более энергетически стабильное выравнивание, образуя новую молекулу h3O.
Это связано с тем, что самая внутренняя электронная оболочка находится в более низком энергетическом состоянии (и, следовательно, более стабильна), когда занята двумя электронами. Каждый атом кислорода имеет по восемь электронов. Они объединяются в молекулы из двух, разделяя четыре электрона, так что их самые внешние электронные оболочки полностью заняты восемью электронами каждая. Однако гораздо более стабильное выравнивание электронов возникает, когда два атома водорода делят электрон с одним атомом кислорода. Требуется лишь небольшое количество энергии, чтобы «сбить» электроны реагентов «с» их орбит, чтобы они могли перестроиться в более энергетически стабильное выравнивание, образуя новую молекулу h3O.
Продукты
После электронной перестройки водорода и кислорода с образованием новой молекулы продуктом реакции является вода и тепло. Тепло можно использовать для выполнения работы, например, для привода турбин путем нагревания воды. Продукты производятся быстро из-за экзотермической цепной природы этой химической реакции.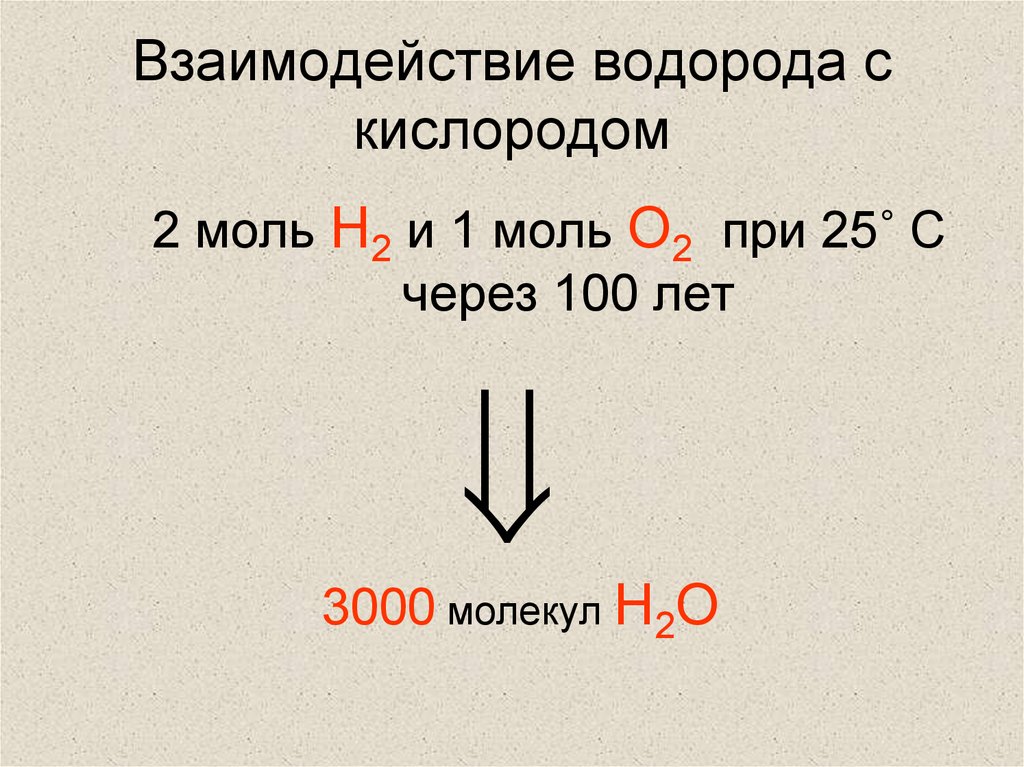 Как и все химические реакции, эта реакция не является легко обратимой.
Как и все химические реакции, эта реакция не является легко обратимой.
Статьи по теме
Об авторе
Клэр Джексон — независимый писатель, который начал писать в 2008 году и начал писать для eHow в 2010 году. Она пишет на темы, связанные с физикой и здоровьем. Имея опыт написания научных статей, она обычно включает в свои статьи много информации. Клэр имеет степень магистра клинических исследований и степень бакалавра наук в области физики.
Электрокатализаторы для реакций с участием кислорода/водорода — PubMed
Сохранить цитату в файл
Формат: Резюме (текст) PubMedPMIDAbstract (текст) CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Невозможно загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Электронная почта: (изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? воскресеньепонедельниквторниксредачетвергпятницасуббота
Формат отчета: РезюмеРезюме (текст)АбстрактАбстракт (текст)PubMed
Отправить максимум:
1 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Редакция
. 2022 19 апреля; 27 (9): 2628.
doi: 10,3390/молекулы27092628.
Принадлежности
- 1 Институт физической химии, Химический колледж Цзилиньского университета, 2519 Jiefang Road, Чанчунь 130021, Китай.
- 2 Ключевая лаборатория углеродных наноматериалов Внутренней Монголии, Наноинновационный институт (НИИ), Колледж химии и материаловедения, Университет Миньзу Внутренней Монголии, Тунляо 028000, Китай.

- PMID: 35565978
- PMCID: PMC9100071
- DOI: 10,3390/молекул27092628
Бесплатная статья ЧВК
Editorial
Jingqi Guan et al. Молекулы. .
Бесплатная статья ЧВК
. 2022 19 апреля; 27 (9): 2628.
doi: 10,3390/молекулы27092628.
Авторы
Цзинци Гуань 1 , Инь Ван 2
Принадлежности
- 1 Институт физической химии, Химический колледж Цзилиньского университета, 2519Jiefang Road, Чанчунь 130021, Китай.

- 2 Ключевая лаборатория углеродных наноматериалов Внутренней Монголии, Наноинновационный институт (НИИ), Колледж химии и материаловедения, Университет Миньзу Внутренней Монголии, Тунляо 028000, Китай.
- PMID: 35565978
- PMCID: ПМС9100071
- DOI: 10,3390/молекул27092628
Абстрактный
Реакции с участием кислорода/водорода являются ключевыми реакциями во многих технологиях, связанных с энергетикой, таких как электролитическая вода, электрокаталитическое восстановление диоксида углерода, электрохимический синтез аммиака, перезаряжаемые металло-воздушные батареи и возобновляемые топливные элементы [. ..].
..].
Заявление о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Похожие статьи
Усовершенствованный кислородный электрокатализатор для воздушно-дышащих электродов в воздушно-цинковых батареях.
Кунду А., Маллик С., Гора С., Радж Ч.Р. Кунду А. и др. Интерфейсы приложений ACS. 2021 1 сентября; 13 (34): 40172-40199. doi: 10.1021/acsami.1c08462. Epub 2021 23 августа. Интерфейсы приложений ACS. 2021. PMID: 34424683
Многофункциональные наноструктурированные электрокатализаторы для преобразования и хранения энергии: современное состояние и перспективы.

Гош С., Басу Р.Н. Гош С. и др. Наномасштаб. 21 июня 2018 г.;10(24):11241-11280. дои: 10.1039/c8nr01032c. Наномасштаб. 2018. PMID: 29897365 Обзор.
Контролируемый морфологией синтез наноструктур Zn-Co-Mixed Sulfide на бумаге из углеродного волокна для создания эффективных перезаряжаемых цинково-воздушных батарей и электролиза воды.
Ву С, Хань С, Ма С, Чжан В, Дэн И, Чжун С, Ху В. Ву С и др. Интерфейсы приложений ACS. 2017 12 апреля; 9(14):12574-12583. дои: 10.1021/acsami.6b16602. Epub 2017 28 марта. Интерфейсы приложений ACS. 2017. PMID: 28319373
Углеродные азотные нанотрубки как эффективные бифункциональные электрокатализаторы для реакций восстановления и выделения кислорода.

Ядав Р.М., Ву Дж., Кочандра Р., Ма Л., Тивари К.С., Ге Л., Йе Г., Вайтай Р., Лу Дж., Аджаян П.М. Ядав Р.М. и др. Интерфейсы приложений ACS. 2015 10 июня;7(22):11991-2000. doi: 10.1021/acsami.5b02032. Epub 2015 26 мая. Интерфейсы приложений ACS. 2015. PMID: 25970133
Богатые углеродом наноматериалы: увлекательные водородные и кислородные электрокатализаторы.
Чжан Дж., Чен Г., Мюллен К., Фэн С. Чжан Дж. и др. Adv Mater. 2018 июль 24:e1800528. doi: 10.1002/adma.201800528. Онлайн перед печатью. Adv Mater. 2018. PMID: 30043531 Обзор.
Посмотреть все похожие статьи
Рекомендации
- Чжоу К., Ван М., Ли Ю., Лю Ю.
 , Чен Ю., Ву Ц., Ван С. Изготовление высокотекстурированных двумерных слоев SnSe с настраиваемыми электронными свойствами для выделения водорода. Молекулы. 2021;26:3319. doi: 10,3390/молекулы26113319.
—
DOI
—
ЧВК
—
пабмед
, Чен Ю., Ву Ц., Ван С. Изготовление высокотекстурированных двумерных слоев SnSe с настраиваемыми электронными свойствами для выделения водорода. Молекулы. 2021;26:3319. doi: 10,3390/молекулы26113319.
—
DOI
—
ЧВК
—
пабмед
- Чжоу К., Ван М., Ли Ю., Лю Ю.
- Сун С., Хе Ю., Ван Б., Пэн С., Тонг Л., Лю К., Ю Дж., Тан Х. Сплав PtNi, покрытый пористым углеродом, легированным азотом, в качестве высокоэффективных катализаторов реакций выделения водорода. Молекулы.
 2022;27:499. doi: 10,3390/молекулы27020499.
—
DOI
—
ЧВК
—
пабмед
2022;27:499. doi: 10,3390/молекулы27020499.
—
DOI
—
ЧВК
—
пабмед
- Сун С., Хе Ю., Ван Б., Пэн С., Тонг Л., Лю К., Ю Дж., Тан Х. Сплав PtNi, покрытый пористым углеродом, легированным азотом, в качестве высокоэффективных катализаторов реакций выделения водорода. Молекулы.
- Зондерманн Л., Цзян В., Швиро М., Списс А., Вошко Д., Радемахер Л., Джаниак С. Металлоорганические каркасы на основе никеля в качестве электрокатализаторов для молекул реакции выделения кислорода (OER). 2022;27:1241. doi: 10,3390/молекулы27041241. — DOI — ЧВК — пабмед
- Liu X.
 , Wang Y., Fan L., Zhang W., Cao W., Han X., Liu X., Jia H. Sm0.5Sr0.5Co1-xNixO3-delta — новый бифункциональный электрокатализатор для восстановления/выделения кислорода Реакции. Молекулы. 2022;27:1263. doi: 10,3390/молекулы27041263.
—
DOI
—
ЧВК
—
пабмед
, Wang Y., Fan L., Zhang W., Cao W., Han X., Liu X., Jia H. Sm0.5Sr0.5Co1-xNixO3-delta — новый бифункциональный электрокатализатор для восстановления/выделения кислорода Реакции. Молекулы. 2022;27:1263. doi: 10,3390/молекулы27041263.
—
DOI
—
ЧВК
—
пабмед
- Liu X.
- Войтасек Д., Лерх С., Цзян В., Швиро М., Ройч С., Штрасснер Т., Джаниак С. Легкое осаждение наночастиц Pt на восстановленном оксиде графита в перестраиваемых арилалкильных ионных жидкостях для катализаторов ORR.

- Войтасек Д., Лерх С., Цзян В., Швиро М., Ройч С., Штрасснер Т., Джаниак С. Легкое осаждение наночастиц Pt на восстановленном оксиде графита в перестраиваемых арилалкильных ионных жидкостях для катализаторов ORR.

 Одна полная загрузка экономит гораздо больше воды, чем две или три частичных.
Одна полная загрузка экономит гораздо больше воды, чем две или три частичных.



 , Чен Ю., Ву Ц., Ван С. Изготовление высокотекстурированных двумерных слоев SnSe с настраиваемыми электронными свойствами для выделения водорода. Молекулы. 2021;26:3319. doi: 10,3390/молекулы26113319.
—
DOI
—
ЧВК
—
пабмед
, Чен Ю., Ву Ц., Ван С. Изготовление высокотекстурированных двумерных слоев SnSe с настраиваемыми электронными свойствами для выделения водорода. Молекулы. 2021;26:3319. doi: 10,3390/молекулы26113319.
—
DOI
—
ЧВК
—
пабмед 2022;27:499. doi: 10,3390/молекулы27020499.
—
DOI
—
ЧВК
—
пабмед
2022;27:499. doi: 10,3390/молекулы27020499.
—
DOI
—
ЧВК
—
пабмед , Wang Y., Fan L., Zhang W., Cao W., Han X., Liu X., Jia H. Sm0.5Sr0.5Co1-xNixO3-delta — новый бифункциональный электрокатализатор для восстановления/выделения кислорода Реакции. Молекулы. 2022;27:1263. doi: 10,3390/молекулы27041263.
—
DOI
—
ЧВК
—
пабмед
, Wang Y., Fan L., Zhang W., Cao W., Han X., Liu X., Jia H. Sm0.5Sr0.5Co1-xNixO3-delta — новый бифункциональный электрокатализатор для восстановления/выделения кислорода Реакции. Молекулы. 2022;27:1263. doi: 10,3390/молекулы27041263.
—
DOI
—
ЧВК
—
пабмед
Leave A Comment