ICSC 1480 — НИТРАТ БАРИЯ
ICSC 1480 — НИТРАТ БАРИЯ« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRGerman — DEHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| НИТРАТ БАРИЯ | ICSC: 1480 (Апрель 2004) |
| CAS #: 10022-31-8 |
| UN #: 1446 |
| EINECS #: 233-020-5 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее, но способствует возгоранию других веществ. Риск взрыва при контакте с горючими веществами или восстановительными веществами. Риск взрыва при контакте с горючими веществами или восстановительными веществами. |
НЕ допускать контакта с легковоспламеняющимися веществами. | В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. НЕ использовать двуокись углерода. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! СТРОГО СОБЛЮДАТЬ ГИГИЕНИЧЕСКИЕ ТРЕБОВАНИЯ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Сбивчивое дыхание. Боли в горле. См. проглатывание. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Обратиться за медицинской помощью. |
| Кожа | Покраснение. Боль. | Защитные перчатки.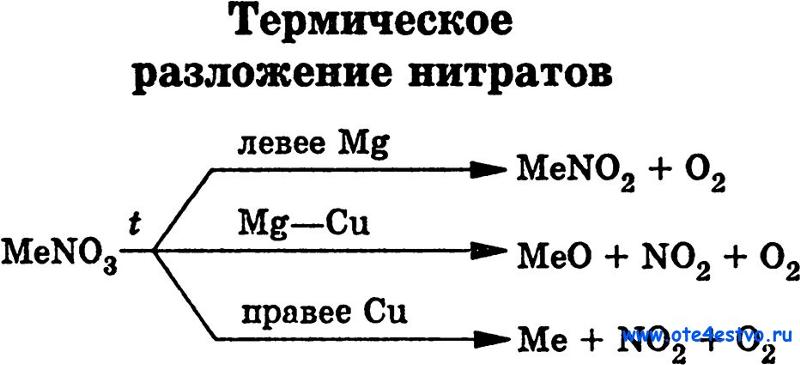 |
Сначала промыть большим количеством воды в течение не менее 15 минут, затем удалить загрязненную одежду и снова промыть. |
| Глаза | Покраснение. Боль. | Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Чрезмерное слюноотделение. Брюшные судороги. Боль в животе. Диарея. Тошнота. Рвота. Сбивчивое дыхание. Слабость. | Не принимать пищу, напитки и не курить во время работы. | Вызвать рвоту (ТОЛЬКО В СОЗНАНИИ!). См. Примечания. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. Затем смыть большим количеством воды. НЕ допускать попадания этого химического вещества в окружающую среду. Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. При необходимости, сначала намочить, чтобы избежать появления пыли. Затем смыть большим количеством воды. НЕ допускать попадания этого химического вещества в окружающую среду. Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от горючих веществ, восстановителей, порошкообразных материалов и пищевых продуктов и кормов. Хранить в местах не имеющих сливов или доступа к канализации | |
| УПАКОВКА | |
Не перевозить с продуктами питания и кормами для животных. |
| НИТРАТ БАРИЯ | ICSC: 1480 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: BaN2O6 / Ba(NO3)2  4 4
Разлагается Температура плавления: 590°C Плотность: 3.24 g/cm³ Растворимость в воде, г/100 мл при 20°C: 8.7 (умеренная) |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| EU-OEL: (как Ba): 0.5 mg/m3 как TWA |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| Вещество опасно для водных организмов. |
| ПРИМЕЧАНИЯ |
|---|
| Данные о температуре разложения отсутствуют в литературе. Промойте загрязненную одежду большим количеством воды ввиду опасности возгорания Приобретает чувствительность к ударам при загрязнении магниево-алюминиевыми сплавами, порошком серы и порошками легких металлов. 
|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: Xn; R: 20/22; S: (2)-28 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Виды химических реакций — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства.
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Выполнено: Федотовой Антониной Валериевной
ГОУ школа 336 Невского района
2. Классификация химических реакций.
По числу и составу исходных веществи продуктов реакций.
3. Реакции соединения
Это такие реакции, в которых изнескольких простых или сложных
веществ образуется одно сложное
вещество:
2h3+O2
h3+Cl2
2h3O
2HCl
4. Реакции разложения
Это реакции, в которых изодного сложного вещества
получается несколько простых или
сложных веществ:
2KClO3
2KCl+3O2
5. Реакция замещения
Это реакция между простым иcложным веществом, приводящая
к образованию другого простого и
сложного вещества:
Zn+2HCl
ZnCl2+h3
6. Реакция обмена
Это реакция между двумя сложнымивеществами, приводящая к образованию
других сложных веществ.
Реакция обмена возможна только при
условии образования в продуктах
реакции нерастворимого вещества, газа
или малодиссоциируемого вещества,
например, воды:
AgNO3+HCl
AgCl +HNO3
7.
 Классификация химических реакций.по обратимости
Классификация химических реакций.по обратимостиНаличие
процесса
Участие
катализатора поверхности
раздела фаз
Тепловой
эффект
эндотермические
Обратимые и
необратимые
каталитические
гомогенные
гетерогенные
экзотермические
8. Обратимые и необратимые реакции.
Обратимые реакции -протекают во взаимнопротивоположных направлениях:
N2 + 3h3 2Nh4
Необратимые реакции –протекают при одних
и
тех же условиях только в одном направлении:
BaCl2+2AgNO3 Ba(NO3)2+2AgCl
9. Каталитические реакции.
Каталитические реакции- протекаютв присутствии катализатора:
C2h5+h3O
h3SO4
C2H5OH
10. Гомогенные и гетерогенные реакции.
Гомогенные- протекают между веществаминаходящимися в одном агрегатном
состоянии:
NaOH+HCl
NaCl+h3Oж
Ж
Ж
Гетерогенные- протекают между
веществами находящимися в разном
агрегатном состоянии:
Mg+2HCl
MgCl2+h3
ТВ
Ж
11.
 Экзотермические и эндотермические реакции.Эндотермические- протекают с
Экзотермические и эндотермические реакции.Эндотермические- протекают свыделением тепла:
N2+3h3
2Nh4+Q
Эндотермические- протекают с
поглощением тепла:
N2+O2
2NO-Q
12. Окислительно-восстановительные реакции.
Окислительновосстановительные реакции.В ходе окислительно-восстановительных
реакций изменяются степени окисления
элементов:
2Fe0 +3Сu+2Cl2-2
2Fe+3Cl3-1+3Cu0
Fe0-3e
Fe+3 восстановитель (окисление)
Cu+2+2e
Cu0 окислитель (восстановление)
13. Спасибо за внимание
English Русский Правила
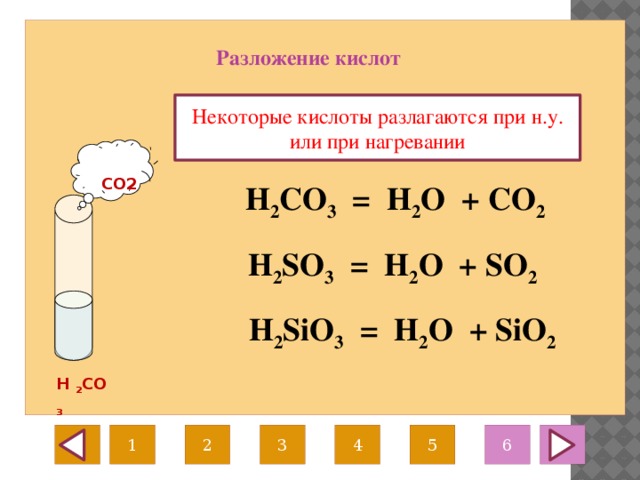
ТЕРМОУСТОЙЧИВОСТЬ КАРБОНАТОВ И НИТРАТОВ 2-Й ГРУППЫ На этой странице рассматривается влияние тепла на карбонаты и нитраты элементов 2-й группы — бериллия, магния, кальция, стронция и бария. Он описывает и поясняет, как изменяется термическая стабильность соединений по мере продвижения вниз по Группе. Факты Воздействие тепла на карбонаты группы 2 Все карбонаты этой группы подвергаются термическому разложению с образованием оксида металла и газообразного диоксида углерода. Термическое разложение — это термин, обозначающий расщепление соединения при нагревании. Все эти карбонаты представляют собой белые твердые вещества, и образующиеся оксиды также представляют собой белые твердые вещества. Если «X» представляет любой из элементов:
По мере спуска по Группе карбонаты должны нагреваться сильнее, прежде чем они разложатся. Влияние тепла на нитраты группы 2 Все нитраты этой группы подвергаются термическому разложению с образованием оксида металла, диоксида азота и кислорода. Нитраты представляют собой белые твердые вещества, и образующиеся оксиды также представляют собой белые твердые вещества. Опять же, если «X» представляет любой из элементов: 2X(NO 3 ) 2 (s) 2XO(s) + 4NO 2 (g) + O 2 (g) По мере того, как вы спускаетесь по Группе, нитраты также должны нагреваться сильнее, прежде чем они разложатся. Сводка Как карбонаты, так и нитраты становятся более термически стабильными по мере продвижения вниз по Группе. Те, что внизу, должны быть нагреты сильнее, чем те, что наверху, прежде чем они разложатся. Пояснения На этой странице предлагается два разных взгляда на проблему. Вам нужно выяснить, что из этого ваши экзаменаторы, скорее всего, ожидают от вас, чтобы вы не ввязывались в более сложные вещи, чем вам на самом деле нужно. | ||||||||||||
Примечание: Если вы готовитесь к экзамену в Великобритании (уровень A или его эквивалент) и у вас нет копий учебного плана и предыдущих работ, перейдите по этой ссылке, чтобы узнать, как их получить. | ||||||||||||
Подробные пояснения даны для карбонатов, потому что диаграммы легче рисовать, а их уравнения также проще. Точно такие же аргументы применимы и к нитратам. Объяснение тенденции с точки зрения поляризующей способности положительного иона Небольшой ион 2+ имеет большой заряд, упакованный в небольшой объем пространства. Он имеет высокую плотность заряда и будет оказывать заметный искажающий эффект на любые отрицательные ионы, оказавшиеся рядом с ним. Более крупный ион 2+ имеет тот же заряд, распределенный по большему объему пространства. Структура карбонат-иона Если бы вы рассчитали структуру карбонат-иона с помощью «точек и крестиков» или подобного метода, вы, вероятно, получили бы: Здесь показаны две одинарные связи углерод-кислород и одна двойная, причем два атома кислорода несут отрицательный заряд. К сожалению, в реальных карбонатных ионах все связи идентичны, а заряды рассредоточены по всему иону, хотя и сосредоточены на атомах кислорода. Мы говорим, что зарядов делокализованный . Это более сложная версия связи, с которой вы могли столкнуться в бензоле или в ионах, таких как этаноат. Для целей этой темы вам не нужно понимать, как возникла эта связь. | ||||||||||||
Примечание: Если вам интересно, вы можете перейти по этим ссылкам на бензол или органические кислоты. Любая из этих ссылок, вероятно, вовлечет вас в довольно трудоемкий обход! | ||||||||||||
На следующей диаграмме показаны делокализованные электроны. Поляризация карбонат-иона А теперь представьте, что произойдет, если этот ион поместить рядом с положительным ионом. Положительный ион притягивает к себе делокализованные электроны карбонат-иона. Карбонат-ион становится поляризованным. При нагревании двуокись углерода высвобождается, оставляя оксид металла. Сколько вам нужно нагреть карбонат, прежде чем это произойдет, зависит от того, насколько поляризован ион. Если он сильно поляризован, вам нужно меньше тепла, чем если бы он был слабо поляризован. Чем меньше положительный ион, тем выше плотность заряда и тем большее влияние он окажет на ион карбоната. По мере того, как положительные ионы становятся больше по мере продвижения вниз по Группе, они оказывают меньшее влияние на ионы карбоната рядом с ними. Чтобы компенсировать это, вам нужно больше нагревать соединение, чтобы заставить углекислый газ вырваться на свободу и покинуть оксид металла. Другими словами, по мере продвижения вниз по Группе карбонаты становятся более термически устойчивыми. А нитраты? Аргумент здесь точно такой же. Небольшие положительные ионы в верхней части группы поляризуют нитрат-ионы больше, чем более крупные положительные ионы в нижней части. Начертить диаграммы, чтобы показать, как это происходит, гораздо сложнее, потому что в этом процессе участвуют более одного нитрат-иона. От вас не ожидают, что вы попытаетесь нарисовать это на экзамене. Объяснение тенденции с точки зрения энергетики процесса Глядя на изменение энтальпии Если вы подсчитаете изменения энтальпии при разложении различных карбонатов, вы обнаружите, что все изменения являются довольно сильно эндотермическими. Это означает, что реакции, вероятно, должны постоянно нагреваться, чтобы они происходили. | ||||||||||||
Примечание: Если вас не устраивают изменения энтальпии, вы можете изучить раздел энергетики Chemguide или мою книгу по химическим расчетам. 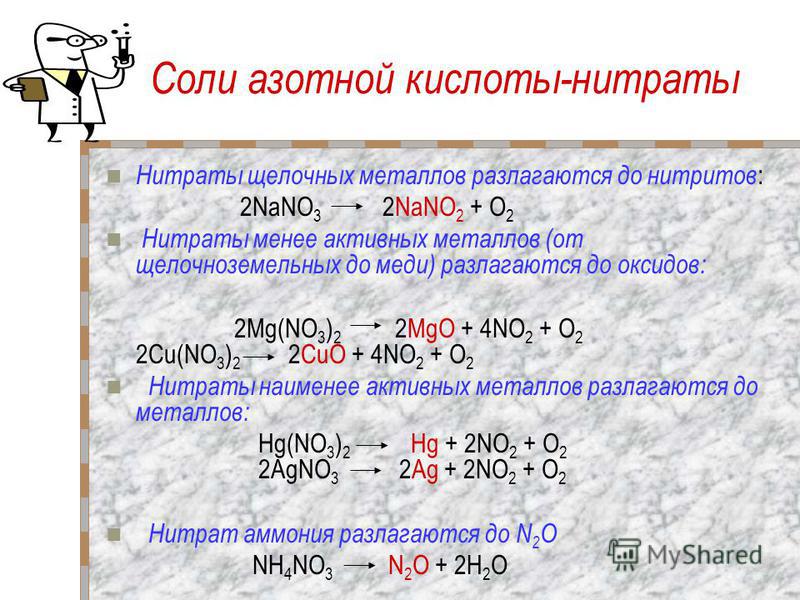 | ||||||||||||
Изменения энтальпии (в кДж моль -1 ), рассчитанные мною по изменениям энтальпии образования, приведены в таблице. Цифры для расчета содержания карбоната бериллия отсутствовали. Помните, что реакция, о которой мы говорим, это:
Вы можете видеть, что реакции становятся более эндотермическими по мере продвижения вниз по Группе. Именно этого и следовало ожидать, поскольку карбонаты становятся более термически стабильными. Вы должны поставлять все большее количество тепловой энергии, чтобы заставить их разлагаться. Объяснение изменения энтальпии Вот тут-то и начинаются сложности! Если вы не знакомы с циклами закона Гесса (или с циклами Борна-Габера) и с энтальпиями решетки (энергией решетки), вы не поймете следующий момент. Не тратьте время на его просмотр. Использование энтальпийного цикла Вы можете покопаться, чтобы найти основные причины все более эндотермических изменений по мере продвижения вниз по Группе, нарисовав энтальпийный цикл, включающий энтальпии решетки карбонатов и оксидов металлов. Как ни странно, существует два способа определения энтальпии решетки. Чтобы сделать аргумент математически проще, в оставшейся части этой страницы я буду использовать менее распространенную версию (что касается учебных программ уровня A в Великобритании): Энтальпия решетки — это количество тепла, необходимое для расщепления одного моля кристалла в его стандартном состоянии на отдельные газообразные ионы. MgO(т) Mg 2+ (г) + O 2- (г) LE= +3889 кДж моль -1 | ||||||||||||
Примечание: Энтальпия решетки обычно определяется как тепло, выделяющееся при образовании 1 моля кристалла из его газообразных ионов. В этом случае энтальпия решетки для оксида магния будет равна -3889 кДж моль -1 . Используемый здесь термин правильнее было бы назвать «энтальпией диссоциации решетки». | ||||||||||||
Интересующий нас цикл выглядит так: Вы можете применить к этому закон Гесса и найти два маршрута, которые будут иметь одинаковое изменение энтальпии, потому что они начинаются и заканчиваются в одних и тех же местах. По причинам, которые мы вскоре рассмотрим, энтальпии решетки как оксидов, так и карбонатов падают по мере продвижения вниз по Группе. Энтальпия решетки оксида падает быстрее, чем энтальпия карбоната. Если вы внимательно подумаете о том, что происходит со значением общего изменения энтальпии реакции разложения, вы увидите, что оно постепенно становится более положительным по мере продвижения вниз по группе. Объяснение относительного падения энтальпии решетки Величина энтальпии решетки определяется несколькими факторами, одним из которых является расстояние между центрами положительных и отрицательных ионов в решетке. Силы притяжения максимальны, если расстояния между ионами малы. Если притяжения велики, то для разделения ионов придется затратить много энергии — энтальпия решетки будет велика. Энтальпии решетки как карбонатов, так и оксидов падают по мере продвижения вниз по Группе, потому что положительные ионы становятся больше. Межионные расстояния увеличиваются, поэтому притяжение ослабевает.
Энтальпии решетки падают с разной скоростью из-за разных размеров двух отрицательных ионов — оксида и карбоната. Оксидный ион относительно мал для отрицательного иона (0,140 нм), тогда как карбонатный ион велик (рисунка нет). В оксидах при переходе от оксида магния к оксиду кальция, например, межионное расстояние увеличивается с 0,205 нм (0,140 + 0,065) до 0,239 нм (0,140 + 0,099) — увеличение примерно на 17%. В карбонатах межионное расстояние определяется гораздо более крупным карбонатным ионом. Хотя межионное расстояние будет увеличиваться на ту же величину при переходе от карбоната магния к карбонату кальция, в процентах от общего расстояния увеличение будет намного меньше. На некоторых выдуманных фигурках это ясно видно. Я не могу найти значение радиуса карбонат-иона, поэтому не могу использовать реальные цифры. Ради аргумента предположим, что радиус карбонат-иона составляет 0,3 нм. Межионные расстояния в двух случаях, о которых мы говорим, увеличились бы с 0,365 нм до 0,39 нм.9 нм — прирост всего около 9%. Скорость, с которой две энергии решетки падают по мере того, как вы спускаетесь вниз по Группе, зависит от процентного изменения при переходе от одного соединения к другому. Исходя из этого, энтальпии решетки оксидов должны падать быстрее, чем энтальпии карбонатов. А нитраты? Ион нитрата больше, чем ион оксида, поэтому его радиус имеет тенденцию преобладать над межионным расстоянием. Энтальпия решетки оксида снова будет падать быстрее, чем нитрата. если бы вы построили подобный цикл выше по странице, применялись бы те же аргументы.
В меню группы 2 . . . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2002 г. (последнее изменение: декабрь 2021 г.) | ||||||||||||
Формула нитрата бария – структура, свойства, применение, примеры вопросов
Барий – это элемент с атомным номером 56. Он обозначается буквой «Ba». Это пятый элемент группы II, который является щелочноземельным металлом. Барий в свободном состоянии в природе не встречается из-за его высокой реакционной способности. Барий является сильным основным оксидом, его степень окисления +1, +2.
Что такое азот?
Азот — это элемент с атомным номером 7. Он обозначается буквой «N». Это элемент 15 группы, который является неметаллом. Это самый легкий элемент группы. Азот является сильным кислотным оксидом, и его степень окисления равна -3, -2, -1, 0, +1, +2, +3, +4, +5.
Он обозначается буквой «N». Это элемент 15 группы, который является неметаллом. Это самый легкий элемент группы. Азот является сильным кислотным оксидом, и его степень окисления равна -3, -2, -1, 0, +1, +2, +3, +4, +5.
Что такое кислород?
Кислород — это элемент с атомным номером 8. Он обозначается буквой «О». Это элемент группы халькогенов, высокореактивный неметалл. Кислород является сильным окислителем и имеет степень окисления -2, -1, 0, +1, +2.
Нитрат бария
Нитрат бария представляет собой неорганическое соединение, также известное как динитрат бария, нитробарит или даже соль бария. Соль бария обычно находится в кристаллическом состоянии белого цвета. Соединение является негорючим по своей природе. Но, при использовании в качестве окислителя, горит зеленым пламенем и может взорваться из-за длительного воздействия пламени.
Молекулярная формула
Соединение нитрата бария образуется путем соединения двух частей нитрата и одной части бария. Следовательно, молекулярная формула нитрата бария имеет вид
Следовательно, молекулярная формула нитрата бария имеет вид
Молекулярная формула нитрата бария = Ba(NO 3 ) 2
Структурная формула
Структурная формула соединения дает позиционную структуру атомов в соединении. Структура нитрата бария указана как
Процесс производства нитрата бария
Производство нитрата бария может осуществляться двумя различными способами. Процессы инициируются исходными компонентами бария.
Процесс I
В первом процессе в качестве источника используется карбонат бария. Для производства нитрата бария следуют следующие этапы;
- Этап I: Сначала растворите карбонат бария (BaCO 3 ) в азотной кислоте (HNO 3 ).
- Стадия II: Осаждение примесей железа.

- Стадия III: Отделите примеси железа с помощью фильтрации.
- Стадия IV: Выпаривание избытка растворителя.
- Стадия V: Кристаллизация нитрата бария.
Процесс II
Во втором процессе в качестве источника используется сульфид бария. Для производства нитрата бария сульфид бария (BaS) смешивают с азотной кислотой (HNO 3 ).
А при высоких температурах нитрат бария разлагается на оксид бария, нитрит и кислород.
2BA (№ 3 ) 2 => 2BAO + 2NO 2 + O 2
Использование NITRATE BARIUM
- .
- Используется в качестве окислителя, пропеллента и вспенивателя.
- Используется в родентицидах.
- Используется во взрывчатых веществах.
- Используется в детонаторах.
- Используется в производстве красок.
- Соединение используется для изготовления керамической глазури.

- Он также используется в качестве компонента некоторых взрывчатых веществ.
- Также используется в трассирующих пулях.
Примеры вопросов
Вопрос 1. Каков показатель преломления нитрата бария?
Ответ:
Показатель преломления нитрата бария равен 1,565.
Вопрос 2. Какая реакция протекает при разложении нитрата бария?
Ответ:
При воздействии высокой температуры на нитрат бария (Ba(NO 3 ) 2 ) он разлагается на оксид бария, нитрит и кислород.
2Ba(NO 3 ) 2 =>2BaO + 4NO 2 + O 2
Вопрос 3. Каково влияние нитрата бария на здоровье человека?
Ответ:
Влияние нитрата бария на здоровье человека:
- При контакте может вызвать раздражение кожи или глаз.
- При случайном проглатывании может вызвать рвоту, диарею, повышение артериального давления.
- Нитрат бария может вызывать кровотечения в кишечнике, желудке, почках и др.
Вопрос 4. Назовите взрывчатое вещество, в котором используется нитрат бария.
Ответ:
Нитрат бария используется в заряде взрывчатого вещества «SR 365».
Вопрос 5. Перечислите стадии производства нитрата бария.
Ответ:
Этапы производства нитрата бария:
- Растворяют карбонат бария в азотной кислоте.
- Осаждение примесей железа
- Фильтрация
- Выпаривание
- Кристаллизация
Вопрос 6. Что произойдет, если азотнокислый барий длительное время находится в пламени?
Ответ:
Нитрат бария является негорючим веществом, но способствует процессу горения горючих веществ.



 Вместе с кислородом выделяется бурый газообразный диоксид азота. Нитраты магния и кальция обычно имеют кристаллизационную воду, и твердое вещество может растворяться в собственной кристаллизационной воде с образованием бесцветного раствора до того, как оно начнет разлагаться.
Вместе с кислородом выделяется бурый газообразный диоксид азота. Нитраты магния и кальция обычно имеют кристаллизационную воду, и твердое вещество может растворяться в собственной кристаллизационной воде с образованием бесцветного раствора до того, как оно начнет разлагаться. Вы должны посмотреть на свой учебный план и прошлые экзаменационные работы — вместе с их схемами оценок
Вы должны посмотреть на свой учебный план и прошлые экзаменационные работы — вместе с их схемами оценок  Плотность его заряда будет ниже, и он будет вызывать меньше искажений для близлежащих отрицательных ионов.
Плотность его заряда будет ниже, и он будет вызывать меньше искажений для близлежащих отрицательных ионов. Затенение призвано показать, что больше шансов обнаружить их вокруг атомов кислорода, чем вблизи углерода.
Затенение призвано показать, что больше шансов обнаружить их вокруг атомов кислорода, чем вблизи углерода.

 Например, для оксида магния это количество тепла, необходимое для осуществления 1 моля этого превращения:
Например, для оксида магния это количество тепла, необходимое для осуществления 1 моля этого превращения: Но они не падают с той же скоростью.
Но они не падают с той же скоростью. 065
065
 Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.
Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.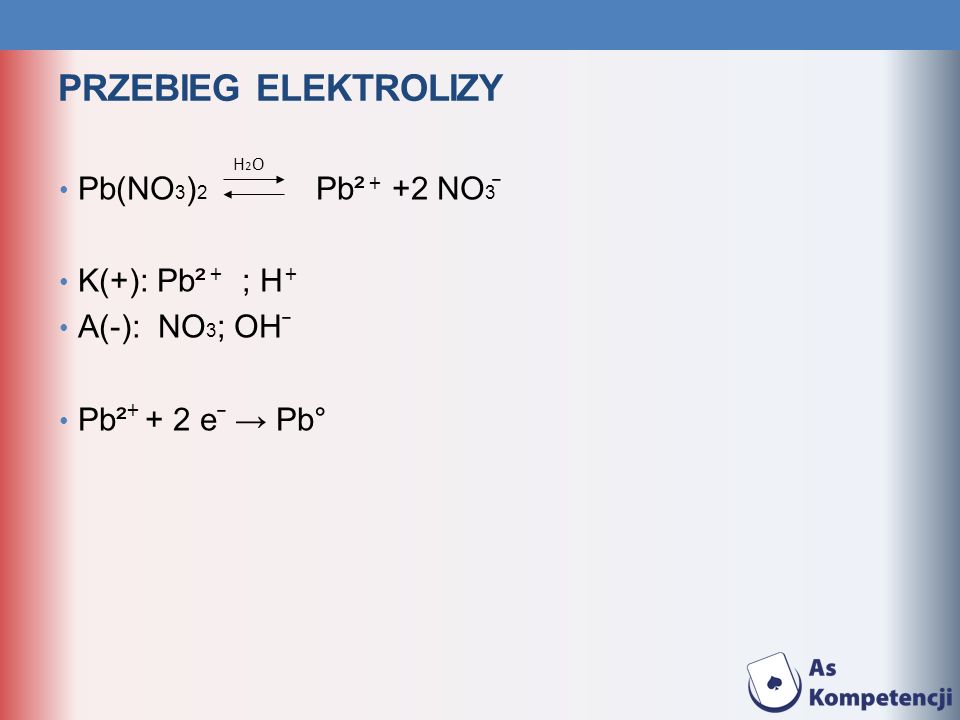



Leave A Comment