Серная кислота аккумуляторная
Оптовые поставки по России и странам СНГ
Узнать стоимость
Формула: h3SO4
Код ТН ВЭД: 2807001000
Стандарт: ГОСТ 667-73
Описание:
Серная кислота — бесцветная маслянистая жидкость, не имеющая запаха. С водой и серным ангидридом смешивается в любых соотношениях с выделением большого количества тепла. Контактная серная кислота с массовой долей моногидрата 92,5-94,0% является водным раствором моногидрата (100% серной кислоты). В технике под серной кислотой подразумевают любые соединения H2SO4 с водой. Водные растворы серной кислоты характеризуются массовой долей в них H2SO4 или SO3
Серная кислота — одна из самых активных неорганических кислот.
Применение:
Серная кислота используется в производстве минеральных удобрений, красителей, химических волокон, а также в металлургии. Она применяется для различных технологических целей в текстильной, пищевой и др. отраслях промышленности. Аккумуляторная серная кислота применяется после разбавления ее дистиллированной водой в качестве электролита для заливки свинцовых аккумуляторов.
В качестве электролита для аккумуляторных батарей применяют раствор серной аккумуляторной кислоты в дистиллированной воде. Для различных климатических и температурных условий, в которых батарее предстоит работать, используют электролит различной плотности. Плотность электролита зависит от концентрации раствора серной аккумуляторной кислоты — чем больше концентрация раствора, тем больше плотность электролита и от температуры раствора — чем выше температура, тем ниже плотность. Концентрация или плотность электролита является точным критерием степени разряженности аккумулятора. В качестве точки отсчета, для определения текущей степени разряженности аккумулятора, принимается нормативная плотность электролита, т.е. плотность, приобретенная после первого полого заряда. Для свинцовых аккумуляторов характерно сильное разбавление электролита во время разряда из-за участия в реакции серной аккумуляторной кислоты с образованием воды. В заряженных аккумуляторах концентрация кислоты равна 30…40%. Чем меньше объем электролита, в сравнении с массой электродов, тем быстрее снижается концентрация кислоты при разряде. В конце разряда она составляет от 10 до 25%.
Концентрация или плотность электролита является точным критерием степени разряженности аккумулятора. В качестве точки отсчета, для определения текущей степени разряженности аккумулятора, принимается нормативная плотность электролита, т.е. плотность, приобретенная после первого полого заряда. Для свинцовых аккумуляторов характерно сильное разбавление электролита во время разряда из-за участия в реакции серной аккумуляторной кислоты с образованием воды. В заряженных аккумуляторах концентрация кислоты равна 30…40%. Чем меньше объем электролита, в сравнении с массой электродов, тем быстрее снижается концентрация кислоты при разряде. В конце разряда она составляет от 10 до 25%.
ГОСТ 667-73
Влияние суперпластификатора и ускорителя набора прочности ПФМ-НЛК на подвижность бетонной смеси и прочностные характеристики бетона
Оставить заявку
| Технические характеристики | Высший сорт | Первый сорт |
|---|---|---|
| Массовая доля моногидрата (H2SO4), % | 92-94 | 92-94 |
| Массовая доля железа (Fe), % | 0,005 | 0,01 |
| Массовая доля остатка после прокаливания, %, не более | 0,02 | 0,03 |
| Массовая доля оксидов азота (N2O4 |
0,00003 | 0,00001 |
| Массовая доля мышьяка (As), %, не более | 0,00005 | 0,00008 |
| Массовая доля хлористых соединений (Cl), %, не более | 0,0002 | 0,0003 |
| Массовая доля марганца (Mn), %, не более | 0,00005 | 0,0001 |
| Массовая доля суммы тяжелых металлов в пересчете на свинец (Pb), %, не более | 0,01 | 0,01 |
| Массовая доля меди (Cu), %, не более | 0,0005 | 0,0005 |
| Массовая доля веществ, восстанавливающих KMnO4, см3 раствора с (1/5 KMnO4) = 0,01 моль/дм3, не более | 4,5 | 7 |
| Прозрачность | Должна выдерживать испытание по п. 3.13 3.13 |
|
Упаковка:
Серная кислота упаковывается в ж/д и авто цистерны, канистры, кубовые емкости.
Хранение:
Техническая серная кислота и олеум (концентрированная серная кислота) должны храниться в емкостях из стали или спецстали, как нефутерованных, так и футерованных кислотоупорным кирпичом или кислотоустойчивым материалом.
Транспортировка:
Серную кислоту техническую транспортируют в железнодорожных сернокислотных цистернах в соответствии с правилами перевозок грузов. На цистерны должны быть нанесены специальные трафареты в соответствии с правилами перевозок грузов, действующими на ж.д. транспорте.
Техника безопасности:
Кислота серная пожаро- и взрывобезопасна, при соприкосновении ее с водой происходит бурная реакция с большим выделением тепла, паров и газов.
 Токсична. По степени воздействия на организм относится к веществам 2-го класса опасности. При работе с серной кислотой обязательно применять спецодежду.
Токсична. По степени воздействия на организм относится к веществам 2-го класса опасности. При работе с серной кислотой обязательно применять спецодежду.
Выгодно
Низкие цены за счёт прямых контрактов с производителями
Надёжно
Работаем более 20 лет (с 1997 года) под одним ИНН.
Товар на складе
Более 3 000 тонн продукции в наличии на наших складах
Качество гарантируем
Работаем только с проверенными поставщиками.
Доставим как надо
Контролируем товар на всем пути
Введите ваше имя
Введите ваш телефон
Нажимая кнопку «Получить бесплатную консультацию», Вы соглашаетесь с условиями Политики конфиденциальности.Заявка направленная после 17:00 (+7 GMT),
обрабатывается на следующий день в рабочее время.
Введите ваше имя
Введите ваш телефон
Укажите ваш регион (город)
Нажимая кнопку «Узнать стоимость», Вы соглашаетесь с условиями Политики конфиденциальности.
Наш специалист свяжется с Вами в ближайшее время.
Заявка направленная после 17:00 (+7 GMT),
обрабатывается на следующий день в рабочее время.
Введите ваше имя
Введите ваш телефон
Укажите ваш регион (город)
Нажимая кнопку «Оставить заявку», Вы соглашаетесь с условиями Политики конфиденциальности.
Серная кислота, подготовка к ЕГЭ по химии
Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется
при изготовлении красителей, органическом синтезе и в производстве серной кислот.
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В водном растворе диссоциирует ступенчато.
H2SO4 ⇄ H+ + HSO4—
HSO4— ⇄ H+ + SO42-
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.
Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.
MgO + H
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
BaBr2 + H2SO4 → BaSO4↓ + 2HBr
MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
S + H2SO4 → SO2 + H2O
C + H2SO4 → CO2 + SO2 + H2O
Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Fe + H2SO4(разб.) → FeSO4 + H2↑
Zn + H2SO4(разб.) → ZnSO4 + H2↑
Cu + H2SO4(разб. ) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.
Na + H2SO4(конц.) → Na2SO4 + H2S + H2O
Zn + H2SO4(конц.) → ZnSO4 + S + H2O
Cu + H2SO4(конц.) → CuSO4 + SO2 + H2O
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3.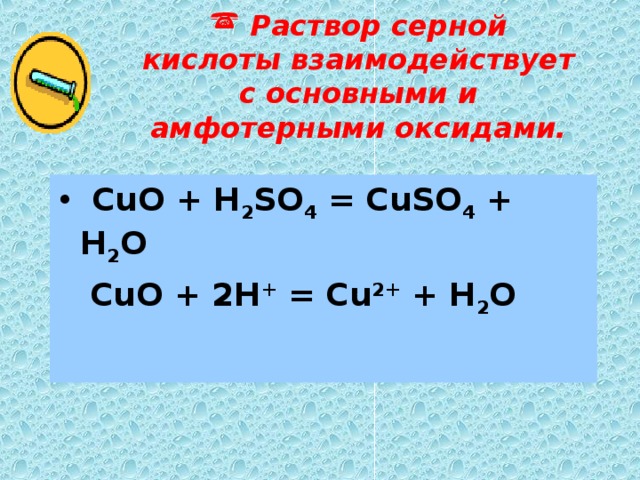 В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
Fe + H2SO4(конц.) → (t) Fe2(SO4)3 + SO2 + H2O
Cr + H2SO4(конц.) → (t) Cr2(SO4)3 + SO2 + H2O
Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Какой тип реакции происходит при взаимодействии серной кислоты со щелочью?
••• Hemera Technologies/PhotoObjects.net/Getty Images
Обновлено 25 апреля 2017 г.
Автор John Brennan
Если вы когда-либо смешивали уксус (который содержит уксусную кислоту) и бикарбонат натрия, который является основанием, вы уже видели кислотно-щелочную реакцию или реакцию нейтрализации. Точно так же, как уксус и пищевая сода, когда серная кислота смешивается с основанием, они нейтрализуют друг друга. Такая реакция называется реакцией нейтрализации.
Характеристики
Химики определяют кислоты и основания тремя разными способами, но наиболее полезное повседневное определение описывает кислоту как вещество, которое хочет отдавать ионы водорода, в то время как основание хочет их забрать. Сильные кислоты лучше отдают свои ионы водорода, а серная кислота определенно является сильной кислотой, поэтому, когда она находится в воде, она почти полностью депротонирована — практически все молекулы серной кислоты отдали оба своих иона водорода. Эти пожертвованные ионы водорода принимаются молекулами воды, которые становятся ионами гидроксония. Формула иона гидроксония – h4O+.
Сильные кислоты лучше отдают свои ионы водорода, а серная кислота определенно является сильной кислотой, поэтому, когда она находится в воде, она почти полностью депротонирована — практически все молекулы серной кислоты отдали оба своих иона водорода. Эти пожертвованные ионы водорода принимаются молекулами воды, которые становятся ионами гидроксония. Формула иона гидроксония – h4O+.
Реакция
Когда основание или щелочной раствор добавляют к серной кислоте, кислота и основание реагируют, нейтрализуя друг друга. Основной вид отбирает ионы водорода у молекул воды, поэтому он имеет высокую концентрацию гидроксид-ионов. Ионы гидроксида и гидроксония реагируют, образуя молекулы воды, оставляя соль (продукт кислотно-щелочной реакции). Поскольку серная кислота является сильной кислотой, может произойти одно из двух. Если основание является сильным основанием, таким как гидроксид калия, полученная соль (например, сульфат калия) будет нейтральной, другими словами, ни кислотой, ни основанием. Однако, если основание является слабым основанием, таким как аммиак, полученная соль будет кислой солью, которая действует как слабая кислота (например, сульфат аммония). Важно отметить, что, поскольку она имеет два иона водорода, которые она может отдать, одна молекула серной кислоты может нейтрализовать две молекулы основания, такого как гидроксид натрия.
Однако, если основание является слабым основанием, таким как аммиак, полученная соль будет кислой солью, которая действует как слабая кислота (например, сульфат аммония). Важно отметить, что, поскольку она имеет два иона водорода, которые она может отдать, одна молекула серной кислоты может нейтрализовать две молекулы основания, такого как гидроксид натрия.
Серная кислота и пищевая сода
Поскольку пищевая сода часто используется для нейтрализации пролитой кислоты из аккумуляторной батареи в автомобилях или разлитой кислоты в лабораториях, реакция серной кислоты с пищевой содой является распространенным примером, который имеет небольшой поворот. Когда бикарбонат пищевой соды вступает в контакт с раствором серной кислоты, он принимает ионы водорода, превращаясь в угольную кислоту. Угольная кислота может разлагаться с образованием воды и углекислого газа; однако по мере реакции серной кислоты и пищевой соды концентрация угольной кислоты быстро увеличивается, что способствует образованию двуокиси углерода. Когда этот углекислый газ выходит из раствора, образуется бурлящая масса пузырьков. Эта реакция является простой иллюстрацией принципа Ле Шателье: когда изменения концентрации нарушают динамическое равновесие, система реагирует так, что стремится восстановить равновесие.
Когда этот углекислый газ выходит из раствора, образуется бурлящая масса пузырьков. Эта реакция является простой иллюстрацией принципа Ле Шателье: когда изменения концентрации нарушают динамическое равновесие, система реагирует так, что стремится восстановить равновесие.
Другие примеры
Реакция между серной кислотой и карбонатом кальция в некотором роде похожа на реакцию с пищевой содой — углекислый газ высвобождается, а соль, которая остается, представляет собой сульфат кальция. Реакция серной кислоты с сильным основанием гидроксида натрия дает сульфат натрия, а серная кислота с оксидом меди образует синее соединение сульфата меди (II). Серная кислота настолько сильная кислота, что ее можно использовать, чтобы приклеить ион водорода к азотной кислоте, образуя ион нитрония. Эта реакция используется в производстве одного из самых известных в мире взрывчатых веществ — 2,4,6-тринитротолуола или тротила.
Статьи по теме
Ссылки
- Колледж Элмхерст: Нейтрализация
- «Органическая химия, структура и функции»; Питер Воллхардт и др.
 ; 2011
; 2011
Об авторе
Живя в Сан-Диего, Джон Бреннан пишет о науке и окружающей среде с 2006 года. Ежемесячный выпуск Бэй». Бреннан имеет степень бакалавра биологических наук Калифорнийского университета в Сан-Диего.
Photo Credits
Hemera Technologies/PhotoObjects.net/Getty Images
Реакции алкенов с серной кислотой
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3764
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице представлены факты и простой, лаконичный механизм реакций электрофильного присоединения между серной кислотой и алкенами, такими как этен и циклогексен.
Реакция электрофильного присоединения этилена к серной кислоте
Реакция алкенов с концентрированной серной кислотой на холоду с образованием алкилгидросульфатов. Например, этен реагирует с образованием этилгидросульфата.
\[ \ce{CH_2=CH_2 + H_2SO_4 \rightarrow CH_3CH_2OSO_2OH}\]
Структуру молекулы продукта иногда записывают как \(CH_3CH_2HSO_4\), но версия уравнения лучше, потому что она показывает, как все атомы связаны. Вы также можете найти его в виде \(CH_3CH_2OSO_3H\).
Все, что вам нужно сделать, это узнать структуру серной кислоты, и после этого механизм точно такой же, как с бромистым водородом. Как вы узнаете, формула продукта неизбежным образом вытекает из механизма.
Механизм реакции между этиленом и серной кислотой
Атомы водорода присоединены к очень электроотрицательным атомам кислорода, что означает, что атомы водорода будут иметь небольшой положительный заряд, а атомы кислорода будут слегка отрицательными.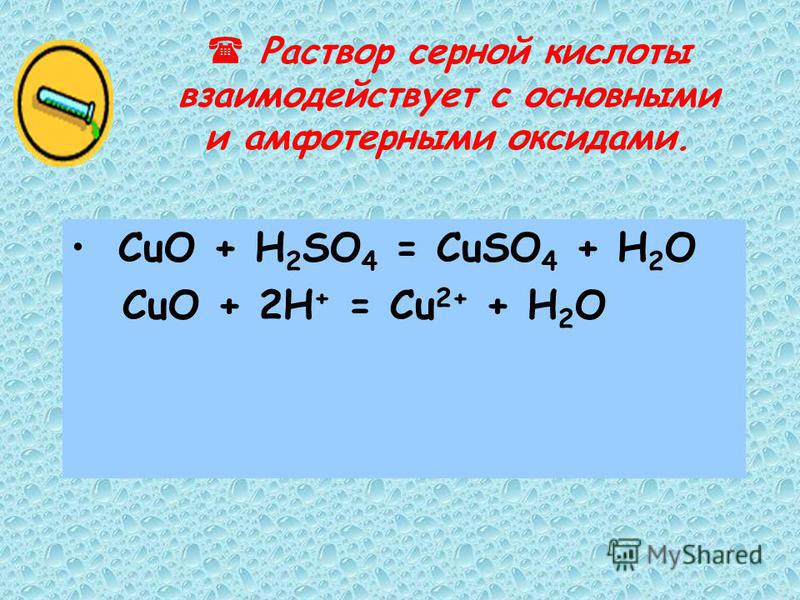

 ; 2011
; 2011
Leave A Comment