Какие из следующих веществ относят к электролитам? § 15-16, задача 1. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/класс
Какие из следующих веществ относят к электролитам? § 15-16, задача 1. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Какие из следующих веществ относят к электролитам, а какие — к неэлектролитам: этиловый спирт, водный раствор гидроксида калия, расплав гидроксида калия, водный раствор сульфата меди(П), соляная кислота, водный раствор глюкозы, раствор кислорода в воде?
Лучший ответ
Привет. К электролитам относятся водный раствор гидроксида калия, расплав гидроксида калия, водный раствор сульфата меди (II), соляная кислота. К неэлектролитам относятся этиловый спирт, водный раствор глюкозы, раствор кислорода в воде.
К электролитам относятся водный раствор гидроксида калия, расплав гидроксида калия, водный раствор сульфата меди (II), соляная кислота. К неэлектролитам относятся этиловый спирт, водный раствор глюкозы, раствор кислорода в воде.
еще ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Какой был проходной балл в вузы в 2017 году?
Какой был средний балл ЕГЭ поступивших в российские вузы на бюджет в этом году? (Подробнее.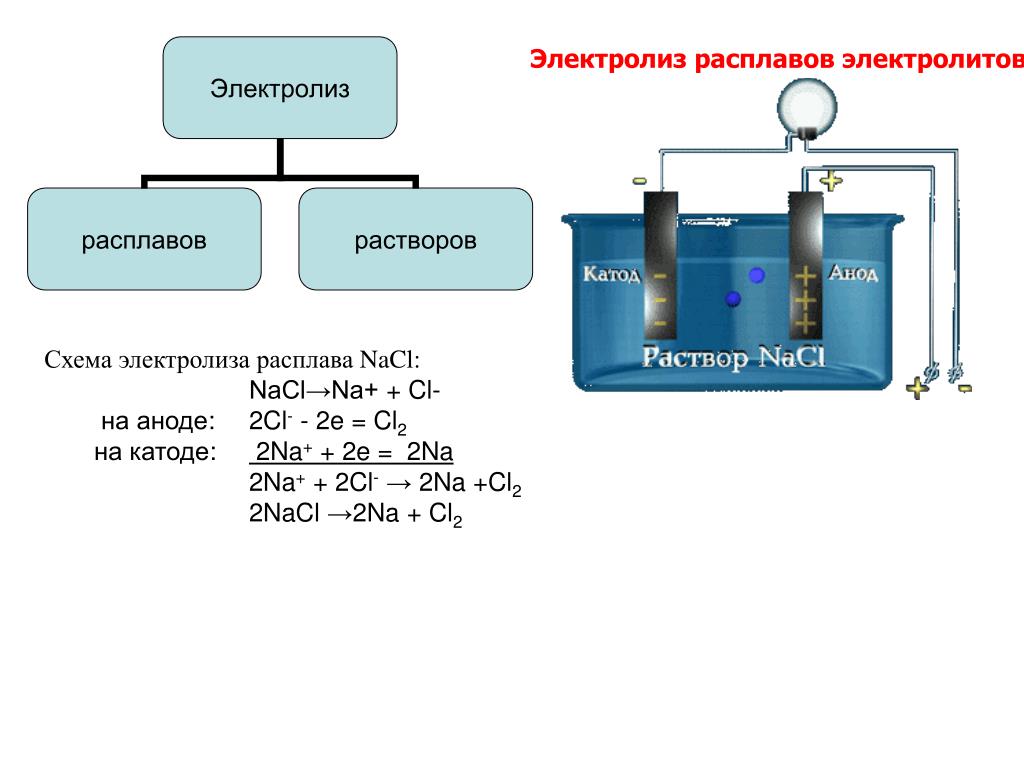
Поступление11 классЕГЭНовости
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
ГДЗЕГЭРусский языкЦыбулько И.П.
Гидроксид калия KOH раствор. Химические растворы. … Производитель Россия
Калия гидроксид (кали едкое, пищевая добавка Е525, гидроокись калия, калия гидрат окиси, каустический поташ) – едкая щелочь широкого спектра применения.
Технический гидрат окиси калия применяют для производства удобрений, синтетического каучука, электролитов для аккумуляторов, реактивов, ксантогенатов, солей, в медицинской промышленности и в других отраслях народного хозяйства
Физико-химические свойства
Гидроксид калия KOH — бесцветное кристаллическое вещество без запаха. Температура плавления 380°С. Температура кипения 1320°С. Плотность 2,12 г/см3. Сильно гигроскопичен, на воздухе кристаллы расплываются вследствие поглощения влаги. Разлагает материалы органического происхождения, водные растворыры корродируют стекло, расплавы – фарфор, платину; концентрированные растворы вызывают тяжёлые ожоги кожи и слизистых оболочек.
Растворимость калия гидроксида в различных растворителях
| Растворитель | Температура, °С | Растворимость, г/100г растворителя |
| Этанол | 28 | 38,7 |
| Метанол | 28 | 55 |
| Вода | 0 | 97,6 |
| 10 | 102,4 | |
| 20 | 112,4 | |
| 25 | 117,9 | |
| 40 | 135,3 | |
| 60 | 147,5 | |
| 80 | 162,5 | |
| 100 | 179,3 | |
| 120 | 206 | |
| 140 | 367 |
Применение
Гидроксид калия является практически универсальным химическим соединением. Ниже приведены примеры материалов и процессы в которых он используется:
Ниже приведены примеры материалов и процессы в которых он используется:
- нейтрализация кислот,
- алкалиновые батареи,
- катализ,
- моющие средства,
- буровые растворы,
- красители,
- удобрения,
- газоочистка,
- металлургическое производство,
- перегонка нефти,
- различные органические и неорганические вещества,
- производство бумаги,
- пестициды,
- фармацевтика,
- регулирование pH,
- карбонат калия и другие калийные соединения,
- мыла,
- синтетический каучук.
Одна из важнейших областей применения гидроксида калия — производство мягкого мыла. Смеси калиевых и натриевых мыл используются для получения жидких мыл, моющих средств, шампуней, кремов для бритья, отбеливателей и некоторых фармацевтических препаратов.
Другая важная область применения — производство различных солей калия.
Гидроксид калия также применяют вместе с каустической содой в производстве многих красителей и других органических соединений, а также как адсорбент газов, дегидратирующий агент, осадитель нерастворимых гидроксидов металлов, в щелочных аккумуляторах, для получения различных соединений калия.
Кроме того, гидроксид калия используется для обеззараживания сточных вод, в азотной промышленности для осушки газов, в резинотехнической промышленности в качестве «калийного мыла», предотвращающего слипание крошки каучука и др.
Жидкий технический гидроксид калия применяется при производстве удобрений, синтетического каучука, электролитов, реактивов, в медицинской промышленности.
Чешуированный гидроксид калия используется в производстве удобрений и синтетического каучука, в фармацевтической промышленности и в других отраслях.
Гидроокись калия техническая применяется для выщелачивания отливок стального литья, для поддержания в заданных пределах щелочности буровых растворов, для производства удобрений, синтетического каучука и в других отраслях.
Регулятор кислотности Е525 разрешён в продуктах из какао и шоколада в количестве до 70 г/кг от сухого обезжиренного вещества, также Е525 используется как катализатор перерэтерификации глицерином рафинированных жиров и саломасов из хлопкового или подсолнечного масла: дозировка катализатора 0,3% от массы жира.
Характеристики
| Страна производитель | Россия |
| Дополнительные характеристики | |
|---|---|
| Назначение | химический раствор |
| Форма выпуска | Жидкость |
| Стандарт | ГОСТ 9285-78 |
| Химическая формула | KOH |
| Степень токсичности | 2 |
| Взрыво- и пожароопасность | Негорюч, взрывобезопасен |
Питание щелочных батарей с помощью гидроксида калия
Щелочные батареи буквально стали неотъемлемой частью нашей жизни. Они используются во всем: от слуховых аппаратов до пультов дистанционного управления, игрушек и видеоигр. Фактически, с момента своего основания в 1950-х годах эта отрасль превратилась в многомиллиардную индустрию. Ожидается, что к 2022 году рынок щелочных батарей вырастет до 8 миллиардов евро.
Они используются во всем: от слуховых аппаратов до пультов дистанционного управления, игрушек и видеоигр. Фактически, с момента своего основания в 1950-х годах эта отрасль превратилась в многомиллиардную индустрию. Ожидается, что к 2022 году рынок щелочных батарей вырастет до 8 миллиардов евро.
Однако так было не всегда. Одной из первых батарей, которая стала использоваться в коммерческих целях, была батарея из ацетата свинца. Он был изобретен в 1859 году., но по-прежнему остается основной технологией в автомобильных аккумуляторных батареях. Щелочная батарея в том виде, в каком мы ее знаем сегодня, была впервые представлена в 1959 году. Именно эта батарея с некоторыми усовершенствованиями технологии с течением времени стала широко популярной благодаря своей стоимости и эффективности.
Как работают щелочные батареи
Щелочные батареи в основном представляют собой замкнутую химическую реакцию. Каждая ячейка состоит из анода, катода и электролита, который способствует переносу электронов. В стандартной щелочной батарее катод сделан из диоксида марганца, который образует слой на внутренней стороне корпуса батареи. Анод состоит из порошка цинка, диспергированного в растворе электролита. Гидроксид калия является стандартным раствором электролита для щелочных аккумуляторов. Другие компоненты батареи включают сепаратор, чтобы анод и катод были электрически разделены, и токосъемник для улавливания электронов.
В стандартной щелочной батарее катод сделан из диоксида марганца, который образует слой на внутренней стороне корпуса батареи. Анод состоит из порошка цинка, диспергированного в растворе электролита. Гидроксид калия является стандартным раствором электролита для щелочных аккумуляторов. Другие компоненты батареи включают сепаратор, чтобы анод и катод были электрически разделены, и токосъемник для улавливания электронов.
Когда щелочная батарея подключена к цепи, происходит химическая реакция. На катоде происходит реакция восстановления с образованием гидроксильных ионов. В то же время цинковый анод окисляется за счет поглощения ионов гидроксила, при этом высвобождаются электроны. Именно эти электроны питают электрические устройства.
Щелочная батарея разряжается, когда заканчиваются ресурсы для завершения химической реакции. Первым заканчивающимся химическим веществом является диоксид магния, а это означает, что больше не могут образовываться гидроксильные ионы и больше не высвобождаются электроны.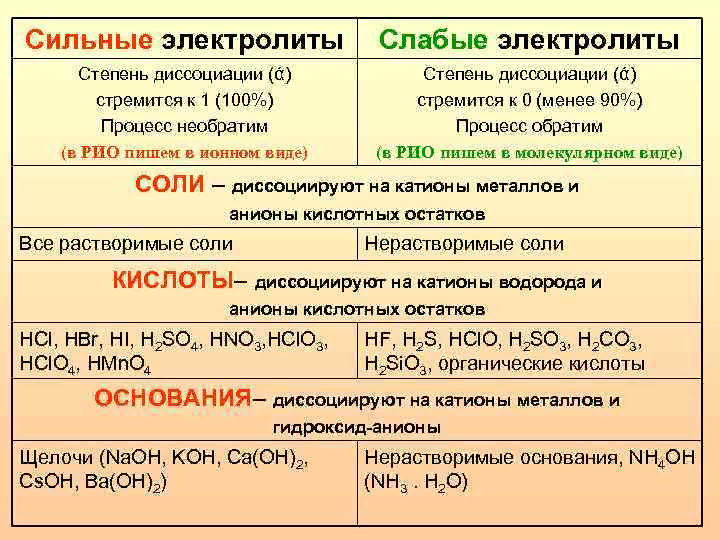
Факторы, влияющие на работу щелочных батареек
Важно отметить, что напряжение батарейки со временем снижается. Это допустимо, поскольку электрические устройства могут нормально функционировать в диапазоне от 0,9 до 1,5 вольт.
Производители батарей описывают работу щелочных батарей и факторы, влияющие на их работу, следующим образом:
- Чем ниже температура, тем менее эффективна щелочная батарея. Низкие температуры препятствуют движению ионов. Замедление химической активности снижает напряжение батареи, в то время как потребляемый ток остается постоянным.
- Еще одним фактором, влияющим на срок службы щелочной батареи, является величина потребляемого тока. Чем больше нагрузка на батарею, тем быстрее будут израсходованы химические вещества, и батарея разрядится.
Преимущества щелочных батарей с гидроксидом калия
До изобретения щелочных батарей наиболее распространенным типом используемых батарей были угольно-цинковые батареи. Но производительность щелочных батарей намного превосходит более раннюю технологию. Они имеют удвоенную энергоемкость и служат от четырех до девяти раз дольше. Щелочные батареи также имеют очень хороший срок годности — до десяти лет без заметного ухудшения характеристик.
Но производительность щелочных батарей намного превосходит более раннюю технологию. Они имеют удвоенную энергоемкость и служат от четырех до девяти раз дольше. Щелочные батареи также имеют очень хороший срок годности — до десяти лет без заметного ухудшения характеристик.
Перезаряжаемые батареи, такие как никель-металловодородные батареи и ионно-литиевые батареи, стали более популярными благодаря сокращению отходов при перезарядке. Литий-ионные аккумуляторы — это аккумуляторы с высокими эксплуатационными характеристиками, которые способны обеспечить значительно более высокую емкость, чем щелочные аккумуляторы. Они также намного дороже, что делает их менее подходящими для многих повседневных электронных применений щелочных батарей.
Отходы и переработка щелочных батарей
Щелочные батареи на основе гидроксида калия не вредны для окружающей среды. Они не содержат токсичных химических веществ, таких как ртуть, которые являются контролируемыми веществами. Поэтому их можно утилизировать как неопасные отходы. Однако всегда лучше перерабатывать материалы, чем отправлять их на свалки, где они будут медленно разлагаться. Каждая щелочная батарея содержит небольшое количество цинка, марганца и стали, каждый из которых может быть использован повторно после восстановления.
Однако всегда лучше перерабатывать материалы, чем отправлять их на свалки, где они будут медленно разлагаться. Каждая щелочная батарея содержит небольшое количество цинка, марганца и стали, каждый из которых может быть использован повторно после восстановления.
Контакты Vynova
Vynova является ведущим европейским производителем гидроксида калия. У нас есть производственные площадки в Бельгии и Франции. В наших производственных процессах используются наилучшие доступные технологии, обеспечивающие эффективную работу и экологическую ответственность. Свяжитесь с одним из наших торговых представителей калия здесь или посетите наш веб-сайт, чтобы узнать больше о нас.
Является ли KOH электролитом? (Подробное объяснение)
Гидроксид калия является обычным веществом. Вы наверняка видели это название в списке ингредиентов тонны предметов домашнего обихода, от мыла до упакованной еды.
Но сначала давайте замедлимся и проясним несколько вещей. KOH — это химическая формула гидроксида калия и ключ к ответам на все наши вопросы.
Но почему КОН так вездесущ?
А что делает КОН?
Является ли КОН электролитом? Да, КОН является сильным электролитом, так как полностью диссоциирует на ионы К+ и ОН- в водном растворе или в расплавленном состоянии. Он легко проводит электричество через свой водный раствор благодаря наличию свободных ионов. Соединение, которое полностью диссоциирует в водном растворе, считается сильным электролитом.
Ион калия (K+) заряжен положительно для KOH, так как он отдает один электрон со своей внешней орбиты, а ион OH- принимает электрон, получает отрицательный заряд.
Когда KOH растворяется в воде или расплавляется, эти ионы разделяются и могут проводить электричество! Именно это свойство делает KOH электролитом.
Давайте рассмотрим это дальше!
Что такое электролит?
Электролит представляет собой вещество, которое диссоциирует с образованием заряженных ионов при растворении в воде или нагревании до жидкого состояния.
Ионы бывают двух видов, т.е. положительно заряженные катионы и противоположные им отрицательно заряженные анионы. Благодаря этому свойству электролитов они могут проводить электрический ток при растворении в воде или при нахождении в расплавленном состоянии.
Способность проводить электричество является фундаментальной характеристикой электролита.
Чтобы идентифицировать электролит, мы должны задать один ключевой вопрос. Каков его химический состав? Что именно входит в состав молекулы?
Электролит должен представлять собой соединение, способное диссоциировать с образованием ионов. Если этого не сделать, соединение не сможет проводить электричество, даже если его можно растворить в воде или нагреть до расплавления.
Например, молекула глюкозы (C6h22O6) не диссоциирует на ионы ни при каких условиях. Даже при растворении в воде глюкоза не разделяется на ионы и не может проводить электричество.
Почему KOH является электролитом?
KOH является ионным соединением, то есть его атомы удерживаются вместе из-за противоположных зарядов положительно заряженного K и отрицательно заряженного OH.
Электростатическое притяжение между двумя противоположно заряженными ионами притягивает их друг к другу.
Это притяжение удерживает их вместе в кристаллической структуре в сухом виде и при комнатной температуре. Но когда эта структура разрушается, они становятся заряженными ионами, способными проводить электрический заряд! Когда KOH является сухим и представляет собой кристаллическое твердое вещество, он не может проводить электричество и вместо этого действует как изолятор.
Эта кристаллическая структура обусловлена структурой решетки, состоящей из положительно и отрицательно заряженных ионов, и может быть разрушена при определенных условиях.
Для гидроксида калия кристаллическая структура разрушается, когда KOH помещают в воду или нагревают выше 360°C при нормальном поверхностном атмосферном давлении.
Ионы диссоциируют по мере растворения вещества, в результате чего ионы взвешиваются в воде. Поскольку ионы разделяются на K+ и OH-, раствор KOH и воды теперь может проводить электричество! Эта способность КОН ионизировать делает его электролитом.
Сильные и слабые электролиты
Теперь мы понимаем, что электролиты проводят электричество. Но мы также знаем, что проводники можно назвать сильными или слабыми в зависимости от того, сколько электричества они могут проводить.
Точно так же электролиты также классифицируются как сильные электролиты и слабые электролиты.
В отличие от сильных электролитов слабые электролиты не полностью диссоциируют в воде. Слабые электролиты оставляют после себя недиссоциированные молекулы.
Некоторые молекулы становятся ионами, но другие остаются молекулами, а некоторые ионы даже снова становятся молекулами. Количество молекул, которые диссоциируют с образованием ионов, часто составляет всего 1% и обычно не увеличивается более чем на 10%.
Этот факт означает, что для проведения электричества доступно меньше ионов, что делает их слабее.
Некоторые примеры слабых электролитов включают h3CO3 (угольная кислота), HC2h4O2 (уксусная кислота), Nh4 (аммиак) и h4PO4 (фосфорная кислота).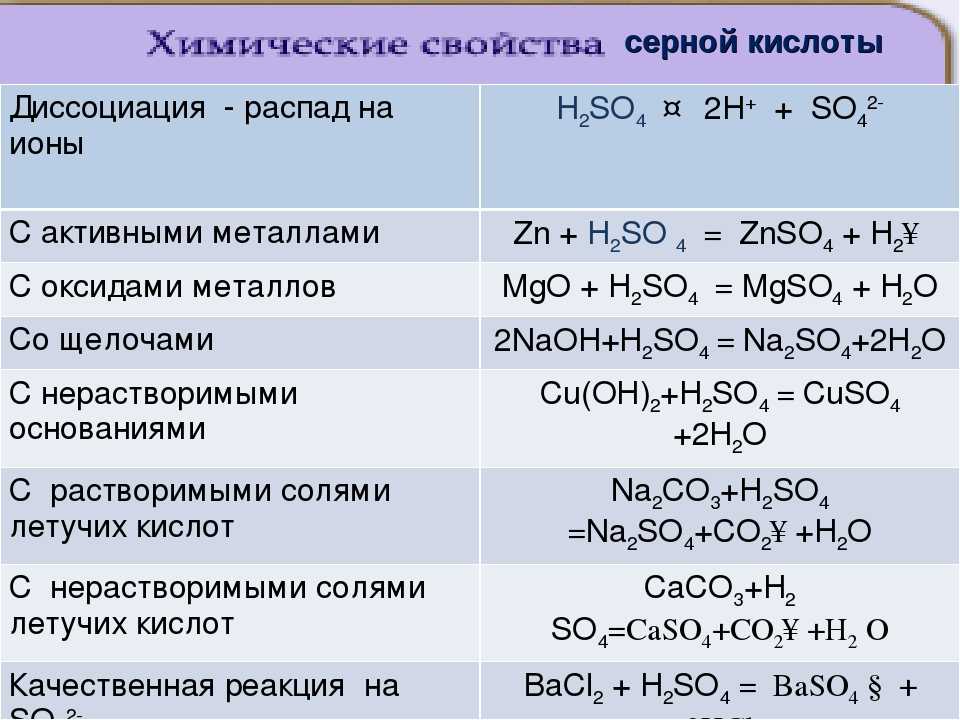
Все эти вещества не ионизируются полностью, в отличие от сильных электролитов.
Эти реакции могут быть представлены двойной стрелкой (прямая и обратная реакции):
Ch4COOH (водн.) ⇆ Ch4COO- (водн.) + H+ (водн.)
Факторы, определяющие прочность электролита
Теперь мы знаем, как электролит может проводить электричество. Становится очевидным, что у каждого электролита есть ограничение на то, сколько электричества он может проводить.
Ключом к тому, насколько сильным является электролит, является количество ионов, которые он может образовать. Итак, что диктует эта способность?
Как видно из приведенной выше таблицы различий, количество ионов, которое может образовать электролит, делает его хорошим электролитом. Но есть небольшая оговорка.
Высокая концентрация химического вещества в воде не гарантирует, что это хороший раствор электролита, даже если химическое вещество хорошо растворяется!
Почему так? Потому что высокая концентрация может привести к тому, что ионы снова и снова будут образовывать молекулы, а это прямо противоположно тому, чего мы хотим.
Для определения прочности электролита необходимо учитывать образование ионов, а не растворимость вещества в воде.
Почему КОН называют сильным электролитом?
Чтобы называться сильным электролитом, вещество должно полностью диссоциировать с образованием ионов при растворении в воде.
На стадии, когда в водном растворе присутствуют только ионы и нет недиссоциированных молекул, электролит является максимально прочным. Сильные кислотные и сильные щелочные вещества являются сильнейшими электролитами.
Мы можем определить, насколько сильным является электролит, посмотрев на стрелку реакции диссоциации электролита.
Предположим, что стрелка указывает только на конец произведения химического уравнения. В этом случае стрелка указывает на то, что диссоциированные ионы не превращаются в молекулы.
Например, диссоциация KOH может быть представлена следующим образом:
KOH (водн.) → K+ (водн.) + OH- (водн.)
Такие вещества, как KOH (гидроксид калия), HCl (хлороводород), h3SO4 (серная кислота) и NaOH (гидроксид натрия) являются сильными электролитами.
Поскольку сильные электролиты полностью диссоциируют, они могут проводить большое количество электрического заряда. Кроме того, когда их водные растворы концентрированы, они оказываются поразительно агрессивными!
Большое количество ионов означает, что они реагируют с большинством вещей, особенно с органическими веществами, такими как кожа и волосы. Этот факт означает, что вы должны быть осторожны при обращении с этими веществами!
Однако не все сильные электролиты обладают свойством коррозионной активности! Это часто ограничивается электролитами сильных кислот и сильных оснований.
Например, NaCl (хлорид натрия или поваренная соль) полностью диссоциирует в воде и поэтому является сильным электролитом. Но он совершенно не агрессивный!
Но HCl (соляная кислота) также является сильным электролитом, но очень коррозийным, поскольку это также сильная кислота. А NaCl — это просто соль.
Использование и свойства КОН
КОН имеет некоторые повседневные применения.
KOH используется для растворения некоторых видов бородавок и кутикулы. Он довольно агрессивен при растворении в воде. Его ионы реагируют практически со всем и могут разрушать кератин и клетки кожи на молекулярном уровне.
Эта коррозионная активность также помогает врачам диагностировать грибковые инфекции! Поскольку KOH может удалять ненужные органические вещества и помогать им микроскопически визуализировать грибок, создающий хаос.
KOH используется в некоторых фармацевтических косметических средствах. Это использование вдохновлено, главным образом, уникальной способностью гидроксида калия разлагать или удалять мягкие ткани и волосы.
Поэтому неудивительно, что значительное количество нашего мыла, кремов для бритья и продуктов для ногтей содержит гидроксид калия.
Он также используется для производства стабилизаторов кислотности для продуктов питания и сельского хозяйства. И KOH также используется в чистящих средствах для промышленного использования!
KOH также используется в инженерном деле для некоторых увлекательных проектов! KOH используется в батареях и для изготовления микросуперконденсаторов из-за того, насколько он хороший проводник.

Leave A Comment