Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида)
| Органоиды | Характеристики |
| 1. Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Рибосомы 5. Комплекс Гольджи 6. Вакуоль | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение М) Движение клетки Н) Двухмембранные О) Связь клетки с внешней средой П) Управление делением ядра Р) Есть только у растений С) Есть только у животных |
Выберите неверные утверждения и исправьте их на верные
1. ЭПС — это часть комплекса Гольджи. 2. Лизосомы образуются из пузырьков комплекса Гольджи. 3. Шероховатая ЭПС покрыта рибосомами. 4. Включения — это непостоянные образования клетки. 5. Клеточная стенка есть только у растений. 6. У растений нет клеточного центра. 7. Жгутики и реснички различаются по функциям. 8. Митохондрии отличаются от пластид наличием ДНК. 9. Комплекс Гольджи — это часть ЭПС. 10. Рибосомы образуются в ядре. 11. ЭПС всегда покрыта рибосомами. 12. Включения — это постоянные образования клетки. 13. Клеточной стенки нет только у животных. 14. У растений нет клеточного центра. 15. Жгутики и реснички не различаются по функциям. 16. Пластиды отличаются от митохондрий наличием ДНК.
- Установите правильную последовательность действий при работе с микроскопом
A. В отверстие предметного столика направить зеркалом свет Б. Поставить штативом к себе на расстоянии 5-10 см от края стола B.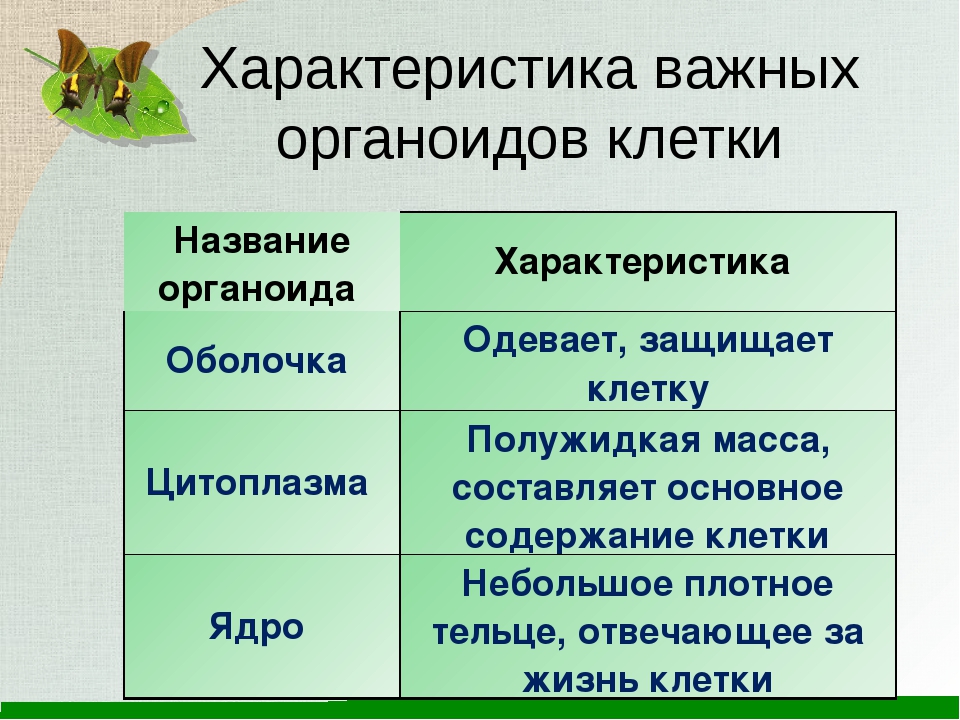 Поместить препарат на предметный столик Г. Глядя в окуляр, медленно поворачивая винт, поднять тубус, пока не появится четкое изображение предмета Д. Пользуясь винтом, плавно опустить тубус так, чтобы нижний край объектива оказался на расстоянии 1–2 мм от препарата.
Поместить препарат на предметный столик Г. Глядя в окуляр, медленно поворачивая винт, поднять тубус, пока не появится четкое изображение предмета Д. Пользуясь винтом, плавно опустить тубус так, чтобы нижний край объектива оказался на расстоянии 1–2 мм от препарата.
Часть С. Дайте развернутый ответ на вопросы
II. Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида). (26 баллов)
| Органоиды | Характеристики |
| 1. Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Пластиды 5. Рибосомы 6. ЭПС 7. Клеточный центр 8. Комплекс Гольджи 9. Лизосомы 10. Жгутики и реснички | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение М) Движение клетки Н) Двухмембранные О) Связь клетки с внешней средой П) Управление делением ядра Р) Есть только у растений С) Есть только у животных |
III. Уберите лишнее. (3 балла)
Плазматическая мембрана, ЭПС, митохондрия, комплекс Гольджи, лизосома
IV. Заполните пробелы, пользуясь подсказками в скобках. (3 балла)
………………+……………..+………………=………………..
(кристы, митохондрия, внутренняя мембрана, наружная мембрана)
V.Выберите правильный ответ. (5 баллов)
1. Хемосинтез происходит:
А) в хлоропластах Б) в вакуолях В) в лейкопластах Г) в цитоплазме
2. Образование РНК НЕ происходит в:
А) в ЭПС Б) в ядре В) в митохондрии Г) в хлоропласте
3. Рибосомы состоят:
А) из РНК и белков Б) из РНК, белков и липидов
В) из ДНК и белков Г) из белков и липидов
4. Какие пластиды содержат пигмент хлорофилл?
Какие пластиды содержат пигмент хлорофилл?
А) лейкопласты Б) хлоропласты В) хромопласты Г) все пластиды
5. Крупные частицы попадают в клетку путем:
А) пиноцитоза Б) диффузии В) фагоцитоза Г) облегченной диффузии
Тест по теме: «СТРОЕНИЕ КЛЕТКИ» (10 класс)
Вариант 4.
Максимальное количество баллов — 63
I. Описать органоиды (ЭПС, пластиды) по плану. (16 баллов)
а) Функции б) Строение в) Химический состав
II. Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида). (26 баллов)
| Органоиды | Характеристики |
| 1. Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Пластиды 5. Рибосомы 6. ЭПС 7. Клеточный центр 8. Комплекс Гольджи 9. Лизосомы 10. Жгутики и реснички | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение М) Движение клетки Н) Двухмембранные О) Связь клетки с внешней средой П) Управление делением ядра Р) Есть только у растений С) Есть только у животных |
III. Уберите лишнее. (3 балла)
Оболочка, гиалоплазма, органоиды, цитоплазма, включения
IV. Заполните пробелы, пользуясь подсказками в скобках. (3 балла)
…………….+…………….+………………=………………
(ДНК, пластиды, две мембраны, рибосомы)
V. Выберите правильный ответ. (5 баллов)
1. К прокариотам относятся:
А) бактерии Б) грибы В) растения Г) животные
2. Образование белка НЕ происходит в:
А) в митохондриях Б) в ядре В) в пластидах Г) в рибосомах
3. Клеточная стенка грибов состоит:
А) из муреина Б) из хитина В) из целлюлозы Г) из крахмала
4. Какие вещества не входят в состав клеточной оболочки?
Какие вещества не входят в состав клеточной оболочки?
А) белки Б) липиды В) нуклеиновые кислоты Г) углеводы
5. Митохондрия по строению отличается от ядра наличием:
А) двух мембран Б) ДНК В) РНК Г) рибосом
VI. Определите, правильно ли данное высказывание (да — нет). (10 баллов)
1. Рибосома состоит из двух субъединиц.
2. Функция хлоропластов, хромопластов и лейкопластов — фотосинтез.
3. Бактерии и грибы относятся к прокариотам.
4. Молекула ДНК прокариотов имеет форму кольца.
5. Органоиды — это непостоянные образования клетки.
6. Клеточная стенка растений состоит из целлюлозы.
7. У прокариотов нет оформленного ядра.
8. Жгутики и реснички различаются по длине.
Тест по теме Клетка 9 класс
Тест по теме: «СТРОЕНИЕ КЛЕТКИ»
Вариант 1.
1. Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида).
Органоиды | Характеристики |
1.Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Пластиды 5. Рибосомы 6. ЭПС 7. Клеточный центр 8. Комплекс Гольджи 9. Лизосомы | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение Н) Двухмембранные О) Связь клетки с внешней средой П) Управление делением ядра Р) Есть только у растений С) Есть только у животных |
2. Рибосомы, лизосомы, клеточный центр, жгутик, ресничка | |
3. Выберите правильный ответ.
1. Фотосинтез происходит:
А) в хлоропластах Б) в вакуолях В) в лейкопластах Г) в цитоплазме
2. Образование РНК происходит:
А) в ЭПС Б) в ядре В) в комплексе Гольджи Г) в цитоплазме
3. Ферменты, расщепляющие белки, жиры, углеводы, содержатся:
А) в рибосомах Б) в лизосомах В) в цитоплазме Г) в ЭПС
4. Жиры и углеводы образуются:
А) в рибосомах Б) в комплексе Гольджи В) в вакуолях Г) в цитоплазме
5. Белки, жиры и углеводы накапливаются про запас:
А) в рибосомах Б) в комплексе Гольджи В) в вакуолях Г) в цитоплазме
Тест по теме: «СТРОЕНИЕ КЛЕТКИ»
Вариант 2.
1. Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида).
Органоиды | Характеристики |
1. Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Пластиды 5. Рибосомы 6. ЭПС 7. Клеточный центр 8. Комплекс Гольджи 9. Лизосомы | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение М) Движение клетки Н) Двухмембранные О) Связь клетки с внешней средой П) Управление делением ядра Р) Есть только у растений С) Есть только у животных |
2. Уберите лишнее.
Уберите лишнее.
Ядро, митохондрия, комплекс Гольджи, пластиды
3. Выберите правильный ответ.
1. Накопление крахмала происходит:
А) в хлоропластах Б) в вакуолях В) в лейкопластах Г) в цитоплазме
2. Образование ДНК происходит:
А) в ЭПС Б) в ядре В) в комплексе Гольджи Г) в цитоплазме
3. Ферменты, расщепляющие белки, жиры, углеводы, синтезируются:
А) на рибосомах Б) на лизосомах В) на клеточном центре Г) на комплексе Гольджи
4. Внутренняя мембрана хлоропласта называется:
А) кристы Б) матрикс В) тилакоид Г) строма
5. Белки, жиры и углеводы накапливаются про запас:
А) в рибосомах Б) в комплексе Гольджи В) в лизосомах Г) в цитоплазме
Тест по теме: «СТРОЕНИЕ КЛЕТКИ»
Вариант 3.
1. Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида).
Органоиды | Характеристики |
1. Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Пластиды 5. Рибосомы 6. ЭПС 7. Клеточный центр 8. Комплекс Гольджи 9. Лизосомы | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение М) Движение клетки Н) Двухмембранные О) Связь клетки с внешней средой П) Управление делением ядра Р) Есть только у растений С) Есть только у животных |
2.
Плазматическая мембрана, ЭПС, митохондрия, комплекс Гольджи, лизосома
3. Выберите правильный ответ.
1. Привлекают насекомых:
А) в хлоропласты Б) хромопласты В) в лейкопласты
2. Образование РНК НЕ происходит в:
А) в ЭПС Б) в ядре В) в митохондрии Г) в хлоропласте
3. Рибосомы состоят:
А) из РНК и белков Б) из РНК, белков и липидов
В) из ДНК и белков Г) из белков и липидов
4. Какие пластиды содержат пигмент хлорофилл?
А) лейкопласты Б) хлоропласты В) хромопласты Г) все пластиды
5. Крупные частицы попадают в клетку путем:
А) пиноцитоза Б) диффузии В) фагоцитоза Г) облегченной диффузии
Тест по теме: «СТРОЕНИЕ КЛЕТКИ»
Вариант 4.
1. Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида).
Органоиды | Характеристики |
1. Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Пластиды 5. Рибосомы 6. ЭПС 7. Клеточный центр 8. Комплекс Гольджи 10. | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение М) Движение клетки Н) Двухмембранные О) Связь клетки с внешней средой П) Управление делением ядра Р) Есть только у растений С) Есть только у животных |
2. Уберите лишнее.
Уберите лишнее.
Оболочка, гиалоплазма, органоиды, цитоплазма, включения
3. Выберите правильный ответ.
1. К прокариотам относятся:
А) бактерии Б) грибы В) растения Г) животные
2. Внутренняя мембрана митохондрий называется:
А) тилакоиды Б) строма В) граны Г) кристы
3. Клеточная стенка грибов состоит:
А) из муреина Б) из хитина В) из целлюлозы Г) из крахмала
4. Какие вещества не входят в состав клеточной оболочки?
А) белки Б) липиды В) нуклеиновые кислоты Г) углеводы
5. Митохондрия по строению отличается от ядра наличием:
А) двух мембран Б) ДНК В) РНК Г) рибосом
Характеристики | |
1.Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Пластиды 5. Рибосомы 6. ЭПС 7. Клеточный центр 8. Комплекс Гольджи 9. Лизосомы 10. Жгутики и реснички | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение М) Движение клетки Н) Двухмембранные О) Связь клетки с внешней средой П) Управление делением ядра Р) Есть только у растений С) Есть только у животных |
III. Рибосомы, лизосомы, клеточный центр, жгутик, ресничка IV. Заполните пробелы, пользуясь подсказками в скобках. (3 балла) …………………+…………………+…………………..=……… …. . . . (цитоплазма, гиалоплазма, органоиды, включения) | Характеристики |
1. Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Пластиды 5. Рибосомы 6. ЭПС 7. Клеточный центр 8. Комплекс Гольджи 9. Лизосомы 10. Жгутики и реснички | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение М) Движение клетки Н) Двухмембранные О) Связь клетки с внешней средой П) Управление делением ядра Р) Есть только у растений С) Есть только у животных | Характеристики |
1. Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Пластиды 5. Рибосомы 6. ЭПС 7. Клеточный центр 8. Комплекс Гольджи 9. Лизосомы 10. Жгутики и реснички | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение М) Движение клетки Н) Двухмембранные О) Связь клетки с внешней средой П) Управление делением ядра Р) Есть только у растений С) Есть только у животных | Характеристики |
1. Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Пластиды 5. Рибосомы 6. ЭПС 7. Клеточный центр 8. Комплекс Гольджи 9. Лизосомы 10. Жгутики и реснички | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение М) Движение клетки Н) Двухмембранные О) Связь клетки с внешней средой П) Управление делением ядра Р) Есть только у растений С) Есть только у животных |
15.
 Какие функции выполняет в клетке вода?
Какие функции выполняет в клетке вода?16. Описать органоиды (эпс, пластиды) по плану.
а) Функции б) Строение в) Количество в клетке г) Химический состав
17. Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида).
Органоиды | Характеристики |
1. Плазматическая мембрана 2. Ядро 3. Митохондрии 4. Пластиды 5. Рибосомы 6. ЭПС 7. Клеточный центр 8. Комплекс Гольджи 9. Лизосомы 10. Цитоскелет 11. Жгутики и реснички | А) Транспорт веществ по клетке, пространственное разделение реакций в клетке Б) Синтез белка В) Фотосинтез Г) Движение органоидов по клетке Д) Хранение наследственной информации Е) Немембранные Ж) Синтез жиров и углеводов 3) Содержит ДНК И) Одномембранные К) Обеспечение клетки энергией Л) Самопереваривание клетки и внутриклеточное пищеварение |
М) Движение клетки Н) Двухмембранные О) Связь клетки с внешней средой П) Управление цитоскелетом и делением ядра Р) Есть только у растений С) Есть только у животных |
18.
 Уберите лишнее.
Уберите лишнее.Оболочка, гиалоплазма, органоиды, цитоплазма, включения
19. Заполните пробелы, пользуясь подсказками в скобках.
…………….+…………….+………………=………………
(ДНК, пластиды, две мембраны, рибосомы)
Выберите правильный ответ.
20. К прокариотам относятся:
А) бактерии Б) грибы В) растения Г) животные
21. Образование белка не происходит:
А) в митохондриях Б) в ядре В) в пластидах Г) в рибосомах
22. Клеточная стенка грибов состоит:
А) из муреина Б) из хитина В) из целлюлозы Г) из крахмала
23. Какие вещества не входят в состав клеточной оболочки?
А) белки Б) липиды В) нуклеиновые кислоты Г) углеводы
24. Митохондрия по строению отличается от ядра наличием:
А) двух мембран Б) ДНК В) РНК Г) рибосом
25. Определите, правильно ли данное высказывание (да — нет).
1. Клетки животных не имеют клеточной стенки.
2. Клеточная стенка бактерий состоит из целлюлозы.
3. Растения, животные и грибы относятся к эукариотам.
4. Органоиды — это постоянные образования.
5. Пиноцитоз — это вид фагоцитоза.
6. Плазмалемма состоит из двух слоев липидов.
7. Рибосомы клетки крупнее рибосом митохондрии.
8. Молекула ДНК эукариотов имеет форму кольца.
9. Пластиды различаются по функциям.
10. Митохондрии, в отличие от пластид, способны самостоятельно делиться, независимо от деления клетки.
Тема но 5. Строение клетки
Тема № 5 Строение клетки
Вариант 1
Максимальное количество баллов — 63
I. Описать органоиды (рибосомы, комплекс Гольджи) по плану. (16 баллов)
а)Функции
б)Строение
в)Количество в клетке
г)Химический состав
II.
 Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида). (26 баллов)
Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида). (26 баллов)Органоиды Характеристики
Плазматическая мембрана
Ядро
Митохондрии
Пластиды
5.Рибосомы6.ЭПС
Клеточный центр
Комплекс ГольджиЛизосомы
10.Цитоскелет
11.Жгутики и реснички A)Транспорт веществ по клетке, пространственное разделение реакций в клетке
Б) Синтез белка
B)Фотосинтез
Г) Движение органоидов по клетке
Д) Хранение наследственной информации
Е) НемембранныеЖ)Синтез жиров и углеводов
3) Содержит ДНК
И) ОдномембранныеК) Обеспечение клетки энергией
Л) Самопереваривание клетки и внутриклеточное пищеварение
М)Движение клетки
Н) ДвухмембранныеО) Связь клетки с внешней средой
П) Управление цитоскелетом и делением ядра
Р) Есть только у растений
III.Уберите лишнее. (3 балла)
Рибосомы, лизосомы, клеточный центр, жгутик, ресничка
IV.Заполните пробелы, пользуясь подсказками в скобках. (3 балла)
++=
(цитоплазма, гиалоплазма, органоиды, включения)
65
V.Выберите правильный ответ. (5 баллов)
1.Фотосинтез происходит:
А) в хлоропластахВ) в лейкопластах
Б) в вакуоляхГ) в цитоплазме
2.Образование РНК происходит:
А) в ЭПСВ) в комплексе ГольджиБ) в ядреГ) в цитоплазме
3.Ферменты, расщепляющие белки, жиры, углеводы, содержатся:
и рибосомахВ) в цитоплазме
н лиюсомахГ) в ЭПС
4.Жиры и углеводы образуются:
А) в рибосомахВ) в вакуолях
Б) в комплексе ГольджиГ) в цитоплазме
5.Белки, жиры и углеводы накапливаются про запас:А) в рибосомахВ) в вакуолях
Б) в комплексе ГольджиГ) в цитоплазме
VI.Определите, правильно ли данное высказывание (да — нет). (10 баллов)
ЭПС — это часть комплекса Гольджи.
Лизосомы образуются из пузырьков комплекса Гольджи.
Шероховатая ЭПС покрыта рибосомами.
Цитоскелет выполняет защитную функцию.
5.Включения — это непостоянные образования клетки.
6. Клеточная стенка есть только у растений.
7. У растений нет клеточного центра.
8. Жгутики и реснички различаются по функциям.
9. Облегченная диффузия — это вид активного транспорта.
10. Митохондрии отличаются от пластидов наличием ДНК.
Вариант 2
Максимальное количество баллов — 63
I.Описать органоиды (митохондрии, клеточный центр) по плану. (16 баллов)
а)Функции
б)Строение
в)Количество в клетке
г)Химический состав
II.Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида). (26 баллов)
Органоиды Характеристики
1. Плазматическая мембрана
2. Ядро
3. Митохондрии
4. Пластиды
5. Рибосомы
6. ЭПС
7. Клеточный центр
8. Комплекс Гольджи9. Лизосомы
10. Цитоскелет11. Жгутики и реснички А) Транспорт веществ по клетке, пространственное разделение реакций в клетке
Б) Синтез белка
В) Фотосинтез
Г) Движение органоидов по клетке
Д) Хранение наследственной информации
Е) НемембранныеЖ)Синтез жиров и углеводов
3) Содержит ДНК
И) ОдномембранныеК) Обеспечение клетки энергией
Л) Самопереваривание клетки и внутриклеточное пищеварение
М)Движение клетки
Н) ДвухмембранныеО) Связь клетки с внешней средой
П) Управление цитоскелетом и делением ядра
Р) Есть только у растений
С) Есть только у животных
III. Уберите лишнее. (3 балла)
Ядро, митохондрия, комплекс Гольджи, пластиды
IV. Заполните пробелы, пользуясь подсказками в скобках. (3 балла)
++=
(лейкопласты, пластиды, хромопласты, хлоропласты)
67
V.Выберите правильный ответ. (5 баллов)
1.Накопление крахмала происходит:-А) в хлоропластах Б) в вакуолях В) в лейкопластах Г) в цитоплазме
2.Образование ДНК происходит:
А) в ЭПС Б) в ядре В) в комплексе Гольджи Г) в цитоплазме
3.
 Ферменты, расщепляющие белки, жиры, углеводы, синтезируются:
Ферменты, расщепляющие белки, жиры, углеводы, синтезируются:А) на рибосомах Б) на лизосомах В) на клеточном центре Г) на комплексе Гольджи4.Жиры и углеводы образуются:
А) в рибосомах Б) в комплексе Гольджи В) в вакуолях Г) в цитоплазме
5.Белки, жиры и углеводы накапливаются про запас:А) в рибосомах Б) в комплексе Гольджи В) в лизосомах Г) в цитоплазме
VI.Определите, правильно ли данное высказывание (да — нет) (10 баллов)
Комплекс Гольджи — это часть ЭПС.
Рибосомы образуются в ядре.
ЭПС всегда покрыта рибосомами.
Цитоскелет состоит из сократительных белков.
Включения — это постоянные образования клетки.6. Клеточной стенки нет только у животных.
У растений нет клеточного центра.
Жгутики и реснички не различаются по функциям.
9.Канальные белки обеспечивают активный транспорт.10. Пластиды отличаются от митохондрий наличием ДНК.
Вариант 3
Максимальное количество баллов — 63
I. Описать органоиды (ядро, лизосома) по плану. (16 баллов)
а)Функции б) Строение в)Количество в клетке г) Химический состав
П. Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида). (26 баллов)
Органоиды
Характеристики
Плазматическая мембрана
Ядро
Митохондрии
Пластиды
Рибосомы
ЭПС
Клеточный центр
Комплекс ГольджиЛизосомы
ЦитоскелетЖгутики и реснички
A)Транспорт веществ по клетке, пространственное разделениереакций в клетке
Б) Синтез белка
B)Фотосинтез
Г) Движение органоидов по клетке
Д) Хранение наследственной информации
Е) НемембранныеЖ)Синтез жиров и углеводов
3) Содержит ДНК
И) ОдномембранныеК) Обеспечение клетки энергией
Л) Самопереваривание клетки и внутриклеточное пищеварение
М)Движение клетки
Н) ДвухмембранныеО) Связь клетки с внешней средой
П) Управление цитоскелетом и делением ядра
Р) Есть только у растений
C)Есть только у животных
III.
 Уберите лишнее. (3 балла)
Уберите лишнее. (3 балла)Плазматическая мембрана, ЭПС, митохондрия, комплекс Гольджи, лизосома
IV. Заполните пробелы, пользуясь подсказками в скобках. (3 балла)
++=
(кристы, митохондрия, внутренняя мембрана, наружная мембрана)
Выберите правильный ответ. (5 баллов)
1.Хемосинтез происходит:
А) в хлоропластах Б) в вакуолях В) в лейкопластах Г) в цитоплазме
2.Образование РНК НЕ происходит в:
А) в ЭПС Б) в ядре В) в митохондрии Г) в хлоропласте
3.Рибосомы состоят:
А) из РНК и белков Б) из РНК, белков и липидов В) из ДНК и белков Г) из белков и липидов
Какие пластиды содержат пигмент хлорофилл?А)лейкопласты Б) хлоропласты В)хромопласты Г) все пластиды
Крупные частицы попадают в клетку путем:А) пиноцитоза Б) диффузииВ) фагоцитоза Г) облегченной диффузии
VI.Определите, правильно ли данное высказывание (да — нет).(10 баллов)
Рибосома состоит из двух субъединиц.
Функция хлоропластов, хромопластов и лейкопластов — фотосинтез.
Бактерии и грибы относятся к прокариотам.
Молекула ДНК прокариотов имеет форму кольца.
Органоиды — это непостоянные образования клетки.
Клеточная стенка растений состоит из целлюлозы.
У прокариотов нет оформленного ядра.
Жгутики и реснички различаются по длине.
Пиноцитоз — это вид эндоцитоза.
10. Митохондрии сходны с пластидами наличием собственных рибосом.
Вариант 4
Максимальное количество баллов — 63
I. Описать органоиды (ЭПС, пластиды) по плану. (16 баллов)
а) Функции б) Строение в) Количество в клетке г) Химический состав
П. Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида). (26 баллов)
Органоиды Характеристики
1. Плазматическая мембрана
2. Ядро
3. Митохондрии
4.
 Пластиды
Пластиды5. Рибосомы
6. эпс7. Клеточный центр
8. Комплекс Гольджи 9. Лизосомы
10. Цитоскелет 11. Жгутики и реснички А) Транспорт веществ по клетке, пространственное разделение реакций в клетке
Б) Синтез белка
В) Фотосинтез
Г) Движение органоидов по клетке
Д) Хранение наследственной информации
Е) НемембранныеЖ) Синтез жиров и углеводов
3) Содержит ДНК
И) ОдномембранныеК) Обеспечение клетки энергией
Л) Самопереваривание клетки и внутриклеточное пищеварение
М)Движение клетки
Н) ДвухмембранныеО) Связь клетки с внешней средой
П) Управление цитоскелетом и делением ядра
Р) Есть только у растений
С) Есть только у животных
III. Уберите лишнее. (3 балла)
Оболочка, гиалоплазма, органоиды, цитоплазма, включения
Заполните пробелы, пользуясь подсказками в скобках. (3 балла)
++=
(ДНК, пластиды, две мембраны, рибосомы)
V. Выберите правильный ответ. (5 баллов)
1.К прокариотам относятся:
А) бактерииВ) растения
Б) грибыГ) животные.
2.Образование белка не происходит:
А) в митохондрияхВ) в пластидах
Б) в ядреГ) в рибосомах
3.Клеточная стенка грибов состоит:
А) из мурей наВ) из целлюлозы
Б) из хитинаГ)из крахмала
Какие вещества не входят в состав клеточной оболочки?А) белкиВ) нуклеиновые кислотыБ) липидыГ) углеводы
Митохондрия по строению отличается от ядра наличием:А) двух мембранВ) РНК
Б) ДНКГ) рибосом
VI. Определите, правильно ли данное высказывание (да — нет). (10 баллов)
Клетки животных не имеют клеточной стенки.
Клеточная стенка бактерий состоит из целлюлозы.
Растения, животные и грибы относятся к эукариотам.
Органоиды — это постоянные образования.
Пиноцитоз — это вид фагоцитоза.
Плазмалемма состоит из двух слоев липидов.
Рибосомы клетки крупнее рибосом митохондрии.
Молекула ДНК эукариотов имеет форму кольца.
Пластиды различаются по функциям.
10. Митохондрии, в отличие от пластидов, способны самостоятельно делиться, независимо от деления клетки.

Вариант 5
Максимальное количество баллов — 85 ТВОРЧЕСКИЙ УРОВЕНЬ
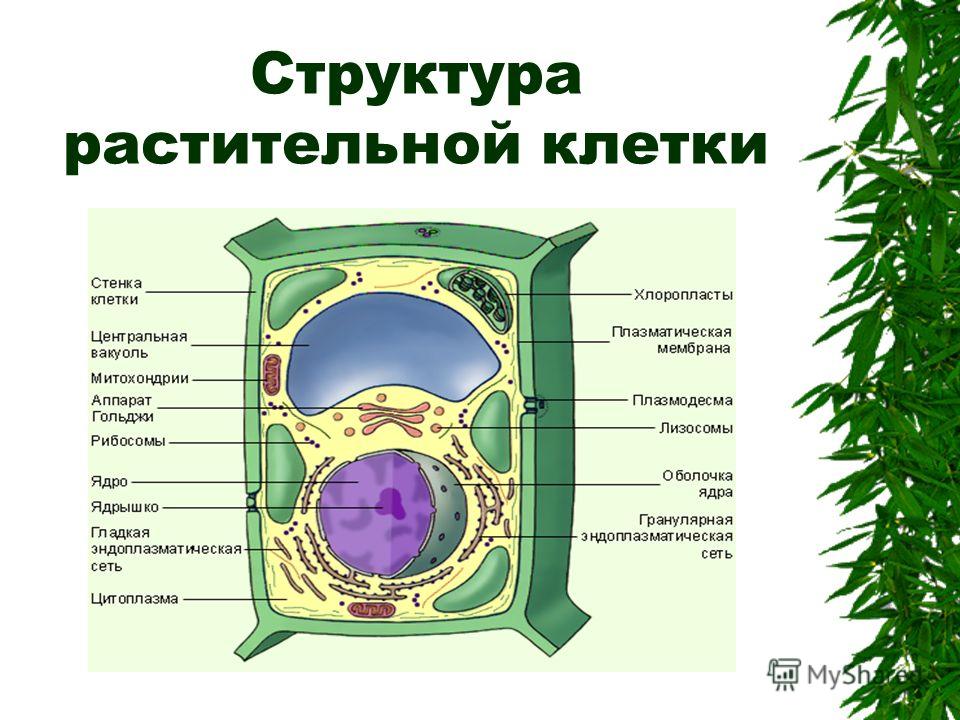
I. Нарисуйте схему строения животной или растительной клетки в виде топографической карты, подпишите структурные элементы. (10 баллов)
II. Составьте путеводитель по карте-схеме клетки, с кратким описанием для каждого структурного элемента: какие вещества там можно найти, какие процессы можно наблюдать, особенности структуры и т.п. (30 баллов)
III. Заполните таблицу «Строение эукариотической клетки». (20 баллов)
Структурный элемент клетки Химический состав Особенности строения Функции, разновидности (если есть) Количество в клетке
IV. Назовите отличия активного и пассивного транспорта веществ через мембрану. (3 балла)
V. Найдите черты сходства (помимо сходства в строении) у всех. (15 баллов)
Немембранных органоидов
Одномембранных органоидов
Двумембранных органоидов
Напишите памятку: «Как отличить клетку Прокариота от клетки Эукариота». Укажите не менее 5-ти отличий. (7 баллов)
8418830-3594100084061303572510008394065521208000Вопросы для блицопроса по теме
Как называется жидкая часть цитоплазмы?
Как называются постоянные образования клетки?
Как называются непостоянные образования клетки?
На какие группы можно разделить органоиды по строению?
Перечислите немембранные органоиды.
Перечислите 1-мембранные органоиды.
Перечислите 2-мембранные органоиды.
Назовите функции плазмалеммы.
Сколько слоев липидов входит в состав мембраны?
У какой группы живых организмов нет клеточной стенки?
Из какого вещества состоит клеточная стенка растений?
Из какого вещества состоит клеточная стенка грибов?
Из какого вещества состоит клеточная стенка бактерий?
Какие группы живых организмов относятся к эукариотам?
Какие группы живых организмов относятся к прокариотам?
Какие органоиды есть у прокариотов?
Каких органоидов нет у прокариотов?
Назовите функции ядра.
Назовите функции митохондрий.
Что общего в строении у митохондрий и ядра?
Чем различаются по строению митохондрии и ядро?
Что общего у митохондрий и бактерий?
Назовите функции ЭПС.
Что у бактерий выполняет функции ЭПС?
Назовите функции лизосом.
Назовите функции рибосом.
Что такое шероховатая ЭПС?
Назовите функции комплекса Гольджи.
Какие органоиды есть только у животных?
Какой части клетки нет только у животных?
Назовите функции клеточного центра.
Какие органоиды есть только у растений?
Назовите функции вакуолей у растений.
У каких еще организмов бывают вакуоли?
Назовите виды вакуолей у простейших.
Назовите функции пищеварительной вакуоли.
Назовите функции сократительной вакуоли.
Назовите виды пластидов.
Назовите функции хлоропластов.
Назовите функции хромопластов.
Назовите функции лейкопластов.
Назовите 2 общих черты строения пластидов, митохондрий и ядра.
Назовите функции жгутиков.
Назовите функции ресничек.
Каковы отличия по движению жгутиков и ресничек?
Чем по строению отличаются жгутики эукариот и прокариот?
Назовите функции пероксисом.
Назовите виды транспорта веществ через мембрану.
Дайте определение активного транспорта.
Дайте определениепассивного транспорта.
Назовите виды эндоцитоза.
Что такое пиноцитоз?
Что такое фагоцитоз?
Дайте определение понятию «осмос».
Тема № 5. СТРОЕНИЕ КЛЕТКИ
Вариант 1
II) 1- О, И; 2- Д, 3, Н; 3- 3, К, Н; 4- В, 3, К, Н, Р; 5- Б, Е; 6- А, И; 7- Е, П, С; 8- Ж, И; 9- И, Л; 10- Г, Е, М; 11- Е, М; III) ли-зосомы; IV) А) гиалоплазма + органоиды + включения = цитоплазма; V) 1 а, 2 б, 3 б, 4 б, 5 г; VI) 1 нет, 2 да, 3 да, 4 нет, 5 да, 6 нет,7да, 8 да, 9 нет, 10 нет
Вариант 2
II) 1- О, И; 2- Д, 3, Н; 3- 3, К, Н; 4- В, 3, К, Н, Р; 5- Б, Е; 6- А, И; 7- Е, П, С; 8- Ж, И; 9- И, Л; 10- Г, Е, М; 11- Е, М; III) комплекс Гольджи; IV) А) лейкопласты + хромопласты + хлороп-ласты = пластиды; V) 1 г, 2 б, 3 а, 4 б, 5 г; VI) 1 да, 2 да, 3 нет, 4 да, 5 нет, 6 да, 7 да, 8 нет, 9 да, 10 нетВариант 3
II) 1- О, И; 2- Д, 3, Н; 3- 3, К, Н; 4- В, 3, К, Н, Р; 5- Б, Е; 6- А, И; 7- Е, П, С; 8- Ж, И; 9- И, Л; 10- Г, Е, М; 11- Е, М; III) митохондрии; IV) А) кристы + внутренняя мембрана + наружная мембрана = митохондрия; V) 1 г, 2 а, 3 а, 4 б, 5 в; VI) 1 да, 2 нет, 3 нет, 4 да, 5 нет, 6 да, 7 да, 8 да, 9 да, 10 даВариант 4
II) 1- О, И; 2- Д, 3, Н; 3- 3, К, Н; 4- В, 3, К, Н, Р; 5- Б, Е; 6- А, И; 7- Е, П, С; 8- Ж, И; 9- И, Л; 10- Г, Е, М; 11- Е, М; III) цитоплазма; IV) А) ДНК + 2 мембраны + рибосомы = пластиды; V) 1 а, 2 б, 3 б, 4 в, 5 г; VI) 1 да, 2 нет, 3 да,’4 да, 5 нет, 6 да, 7 да,8нет, 9 да, 10 нет
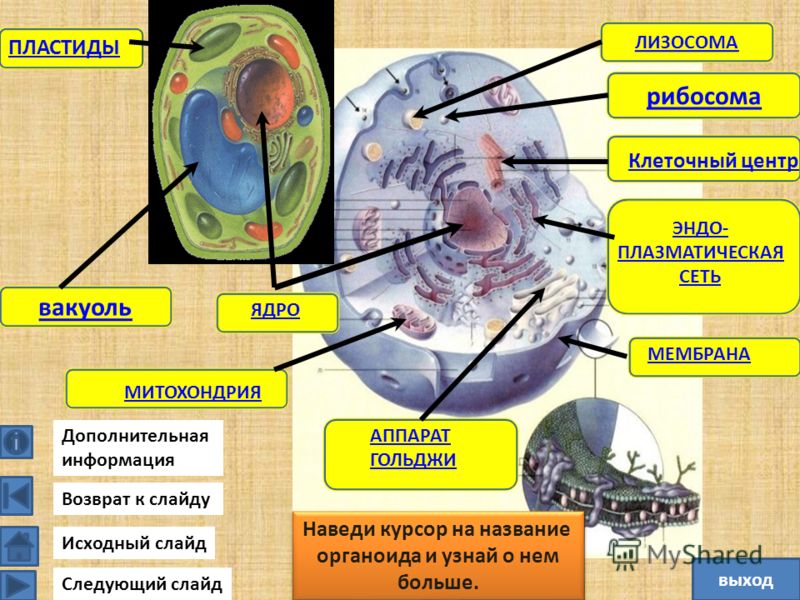
Урок по биологии 10 класса Митохондрии и пластиды
Дата:
Класс: 10
Тема: « Органоиды клетки. Митохондрии и пластиды»
Митохондрии и пластиды»
Цели : ознакомить с особенностями двумембранных органелл клетки- митохондриями и пластидами, их функциями и строением; продолжить формирование умений самостоятельно добывать знания, делать выводы, сравнения, умения выделять главное, навыков работы с учебной литературой через усвоение знаний о митохондриях и пластидах.
Ход урока
I.Организационный момент.
1.Проверка наличие учащихся.
2.Создание правила робы групп.
3.Тренинг для создания коллоборативной среды «Построимся»
II.Контроль знаний .
Фронтальный опрос.
Что называется комплекс Гольджи?
Какая связь существует между комплексом Гольджи и плазматической сетью?
Почему лизосомы называют органами пищеварения?
Какие гидролизующие ферменты находятся в лизосомах?
На данном этапе урока проводится письменная проверочная работа (на 10 минут). Учащимся предлагаются готовые тесты, которые они заполняют и обмениваются листами ответов. (Приложение 1).
Распределите характеристики соответственно органоидам клетки (поставьте буквы, соответствующие характеристикам органоида, напротив названия органоида). (Приложение 2)
III. Изучение строения митохондрий и пластид.
Митохондрии- важнейшие органоиды клетки.
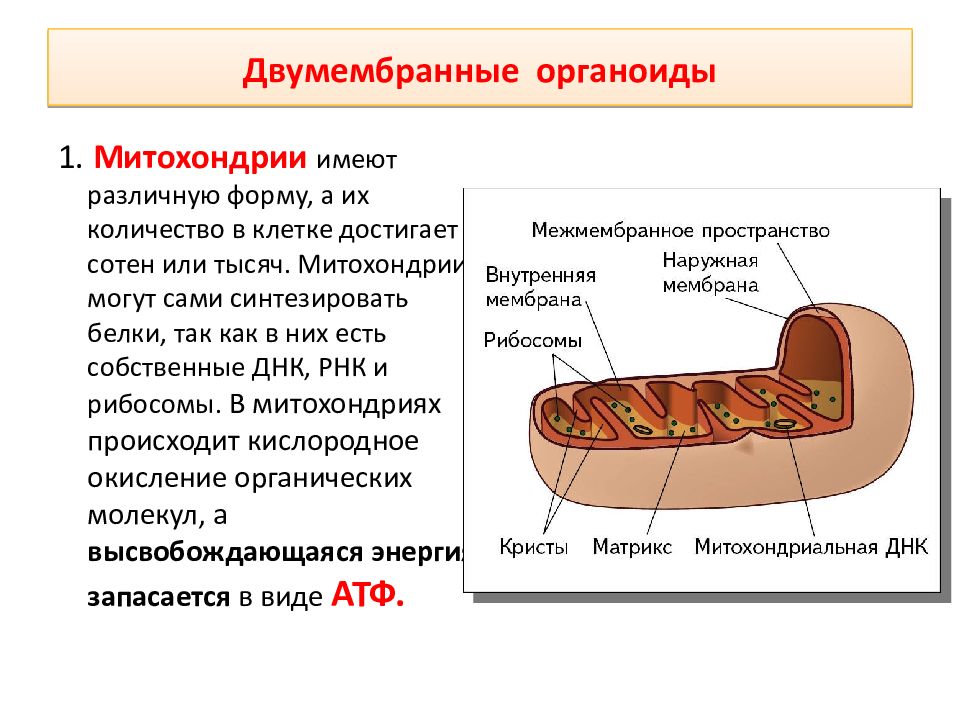
Число митохондрий в клетке не постоянно в зависимости от типа, фазы развития и прямо пропорционально функциональной зависимости клетки. Форма и величина их также меняются, они являются динамичными структурами: могут расти в длину, сжиматься, ветвиться, делиться. Митохондрии имеют наружную и внутреннюю мембраны. Наружная мембрана гладкая, обладает высокой проницаемостью. Внутренняя имеет складчатую поверхность и образует складки-кристы, увеличивающие ее площадь. Внутренняя полость-матрикс, содержит ДНК, и-РНК, р-РНК, рибосомы, ряд витаминов и включения. ДНК обуславливает генетическую автономность митохондрий.
Задание №1.
Перечислите труды ученых, открывшие митохондрии:
1. Р.А. Келер____________________________________
Р.А. Келер____________________________________
2.Р. Альтман__________________________________
3.К.Бенда______________________________________
Задание №2. Пользуясь учебником, сформулируйте и запишите в тетрадь функции митохондрий. (самостоятельная работа 5 -7 мин.)
функции митохондрий:
-участвуют в обмене веществ, так как содержат ферменты;
-участвуют в процессе дыхания, синтезе АТФ;
-осуществляют синтез белка, так как имеют свою специфическую ДНК.
Задание №3. учащимся предлагается ответить на вопросы:
— Перечислите известные вам виды пластид.
—Назовите их местонахождение в частях растений.
Задание №4.
Вспомните и нарисуйте по памяти схему:
группа: строение животной клетки
группа: строения растительной клетки
Рассказ об особенностях строения пластид, с демонстрацией таблицы «Растительная клетка» и «Животной клетки»
Демонстрируется слайд «Строение хлоропласта»
Хлоропласты- это зеленые пластиды. Цвет хлоропластов обеспечивается магнийорганическим веществом хлорофиллом. Хлорофилл поглощает лучи в красной и синей области спектра, а отражает в зеленой. Вот почему хлорофилл, хлоропласт и лист растения воспринимаются нашим глазом как зеленые.
Хлоропласт состоит из наружной и внутренней мембран. Наружная мембрана гладкая. Внутренняя мембрана складчатая, образует выросты внутрь хлоропласта- ламеллы. Совокупность ламелл называют стромой. Ламеллы могут образовывать локальные расширения, имеющие вид уплощенных мешочков-тилакоидов. Тилакоиды располагаются стопками, один над другим, напоминая стопки монет. Эти стопки называются гранами. Пигмент хлорофилл располагается внутри мембран тилакоида. У лейкопластов стромы почти нет, а у хромопластов строма развита несколько хуже, чем у хлоропластов. В строме содержатся ДНК, рибосомы, ферменты. Клетке достаточно одного хлоропласта после деления, чтобы он воспроизвел себе подобный. Хлоропласты могут переходить в хромопласты, а лейкопласты-в хлоропласты.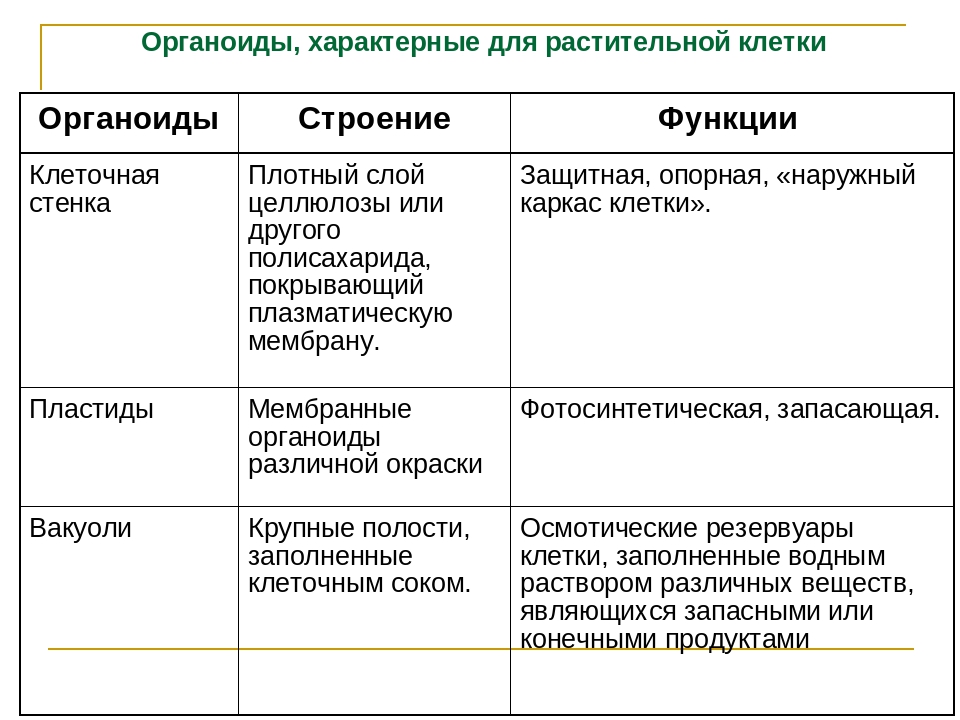
Задание №4.
Опишите функции пластидов:
Хлоропласты участвуют в ____________________________________.
Хлоропласты регулируют_________________________, хранят питательные вещества и часть_______________________________.
Пластиды придают цвет_____________________________________.
После того как изучено строение митохондрий и пластид, учитель просит сравнить эти органоиды и определить черты сходства и различия.(Самостоятельная работа 5-7 мин.)
Сходства :
-имеют одинаковые размеры, оболочки состоят из двух мембран и сами мембраны имеют сходное строение
-имеют собственные ДНК
-способность к самоудвоению
Различия:
— в митохондриях синтезируются молекулы АТФ, а в хлоропластах не только синтез АТФ, но и происходит использование АТФ в процессе фотосинтеза.
—число митохондрий в клетке больше, чем число хлоропластов.
-различный набор ферментов.
Учащимся предлагаются рисунки строения митохондрии и хлоропласта, которые вклеиваются в тетрадь.
IV.Закрепление знаний.
Биологический диктант «Путешествие по клетке» (Приложение 3)
V.Домашнее задание
1Выучить параграф 5
Составить тест по теме «Строение органоидов клетки», «Функции органоидов клетки».
Приготовить презентацию по изученной теме.(2 3 задания навыбор!)
Как клеточные органеллы работают вместе
Клетки, из которых состоят все организмы, представляют собой высокоорганизованные структуры, специально предназначенные для выполнения процессов, необходимых для жизни. Простейшие клетки принадлежат прокариотам, например, бактериям. Клетки эукариот — животных, растений, грибов и простейших — более сложны. Внутри каждой эукариотической клетки специализированные структуры, называемые органеллами, работают вместе, чтобы выполнять все жизненные функции. Одна из важнейших функций клетки — производство и обработка белков.Некоторые органеллы непосредственно участвуют в синтезе белка, в то время как другие обеспечивают поддержку, выполняя вспомогательные функции, необходимые для того, чтобы клетка функционировала должным образом для синтеза белка.
Ядро
Ядро — это центр управления клеткой, в которой размещена ДНК. ДНК содержит всю генетическую информацию клетки, а также информацию, необходимую клетке для выполнения своих функций, включая воспроизводство. Здесь ДНК производит РНК путем транскрипции, которая запускает процесс синтеза белка.Ядрышко — это небольшая органелла внутри ядра, где производятся рибосомы. В клетках растений хлоропласты, необходимые для фотосинтеза, находятся в ядре.
Эндоплазматическая сеть
Структура эндоплазматической сети подобна складчатой мембране. Бывают двух видов: грубый и гладкий. Гладкая эндоплазматическая сеть — это место, где происходит синтез липидов и где органелла обрабатывает токсичные вещества внутри клетки. Грубый эндоплазматический ретикулум назван так из-за его грубого вида из-за рибосом, прикрепленных к его складкам.Здесь происходит большая часть синтеза белка.
Рибосомы
Рибосомы обычно прикрепляются к шероховатой эндоплазматической сети, но также могут свободно плавать в цитоплазме. Они являются основным местом синтеза белка.
Аппарат Гольджи
Аппарат Гольджи работает как почта. Белки упаковываются и отправляются в аппарат Гольджи для распределения. Образуются пузырьки, которые затем доставляются к участку на клеточной мембране, где они высвобождают белковые молекулы во время экзоцитоза или охватывают внешние вещества и включают их в клетку во время эндоцитоза.Некоторые из везикул, несущих белок, остаются в аппарате Гольджи для хранения. Комплекс Гольджи также отвечает за создание лизосом.
Пузырьки
Пузырьки — это небольшие мешочки, которые содержат вещества и переносят их по клетке. Они также переносят вещества в клетку и из клетки. Везикулы транспортируют вещества от места синтеза к клеточной мембране для экспорта и от клеточной стенки к другим органеллам с импортированными веществами.
Плазменная мембрана
Плазменная мембрана представляет собой двухслойный барьер, который отделяет клетку от окружающей среды и позволяет импортировать или экспортировать определенные вещества.Белки в мембране контролируют прохождение молекул внутрь и наружу клетки.
Митохондрии
Митохондрии, отвечающие за метаболизм клетки, являются энергетической установкой клетки, которая преобразует энергию пищи в АТФ, который используется для клеточных функций.
Цитоскелет
Цитоплазма
Цитоплазма представляет собой водный субстрат, составляющий внутреннюю часть клетки и окружающий органеллы. Он заполняет пространство между органеллами и помогает цитоскелету перемещать везикулы, несущие белок, по клетке от эндоплазматического ретикулума к комплексу Гольджи и плазматической мембране.
Лизосомы
Корень лизировать означает ослабление или расцепление. Задача лизосом — расщеплять изношенные или поврежденные компоненты клетки, переваривать инородные частицы и защищать клетку от бактерий и вирусов, нарушающих клеточную мембрану. Лизосомы используют ферменты для выполнения этих функций.
Protein Power
Большая часть усилий клетки направлена на производство белков. Белки выполняют множество важных функций в организме. Есть два типа белков: структурные белки и ферменты.Структурные белки используются для формирования каркаса тканей, таких как кость, кожа, волосы и кровь, таких как коллаген, и ферментов, которые используются для регулирования клеточных функций путем облегчения химических реакций, таких как пищеварение. Органеллы клетки должны работать вместе, чтобы осуществлять синтез белка, использовать белки внутри клетки и транспортировать их из клетки.
Синтез белков
Для создания белков ДНК транскрибирует информацию в РНК в ядре. Транскрипция похожа на копирование информации из ДНК и применение этой информации в новом формате.РНК покидает ядро и проходит через цитоплазму к рибосомам грубого эндоплазматического ретикулума. Здесь РНК проходит трансляцию. Как и при переводе с одного языка на другой, информация, которую ДНК копирует на РНК во время транскрипции, транслируется в последовательность аминокислот. Аминокислотные цепи или полипептиды собираются в правильной последовательности для образования белков.
Транскрипция похожа на копирование информации из ДНК и применение этой информации в новом формате.РНК покидает ядро и проходит через цитоплазму к рибосомам грубого эндоплазматического ретикулума. Здесь РНК проходит трансляцию. Как и при переводе с одного языка на другой, информация, которую ДНК копирует на РНК во время транскрипции, транслируется в последовательность аминокислот. Аминокислотные цепи или полипептиды собираются в правильной последовательности для образования белков.
Упаковка и транспортировка
После того, как белки синтезируются, часть грубого эндоплазматического ретикулума отщепляется и отделяется, образуя везикулу, заполненную белком.Везикула перемещается в комплекс Гольджи, где при необходимости белок модифицируется и переупаковывается в новую везикулу. Оттуда везикулы переносят белок к другой органелле, где он будет использоваться внутри клетки или к плазматической мембране для секреции. Везикулы также могут хранить белок внутри клетки для дальнейшего использования. Микрофиламенты и микротрубочки цитоскелета перемещают пузырьки в нужное место.
Органеллы | Безграничная анатомия и физиология
Плазменная мембрана и цитоплазма
Плазматическая мембрана состоит из фосфолипидного бислоя, который регулирует концентрацию веществ, которые могут проникать в клетку.
Задачи обучения
Объясните структуру и назначение плазматической мембраны клетки
Основные выводы
Ключевые моменты
- Все эукариотические клетки имеют окружающую плазматическую мембрану, также известную как клеточная мембрана.
- Плазматическая мембрана состоит из фосфолипидного бислоя со встроенными белками, который отделяет внутреннее содержимое клетки от окружающей среды.
- Только относительно небольшие неполярные материалы могут легко перемещаться через липидный бислой плазматической мембраны.
- Пассивный транспорт — это движение веществ через мембрану, не требующее использования энергии, в то время как активный транспорт — это перемещение веществ через мембрану с использованием энергии.

- Осмос — это диффузия воды через полупроницаемую мембрану вниз по градиенту ее концентрации; это происходит, когда существует дисбаланс растворенных веществ вне клетки по сравнению с внутри клетки.
Ключевые термины
- фосфолипид : любой липид, состоящий из диглицерида в сочетании с фосфатной группой и простой органической молекулой, такой как холин или этаноламин; они являются важными составляющими биологических мембран
- гипертонический : имеющий большее осмотическое давление, чем другой
- гипотонический : имеющий более низкое осмотическое давление, чем другое; клетка в этой среде заставляет воду попадать в клетку, вызывая ее набухание.
Плазменная мембрана
Несмотря на различия в структуре и функциях, все живые клетки в многоклеточных организмах имеют окружающую плазматическую мембрану (также известную как клеточная мембрана). Поскольку внешний слой вашей кожи отделяет ваше тело от окружающей среды, плазматическая мембрана отделяет внутреннее содержимое клетки от внешней среды. Плазматическая мембрана может быть описана как бислой фосфолипидов со встроенными белками, которые контролируют прохождение органических молекул, ионов, воды и кислорода в клетку и из нее.Отходы (такие как углекислый газ и аммиак) также покидают клетку, проходя через мембрану.
Плазматическая мембрана эукариот : Плазматическая мембрана эукариот представляет собой фосфолипидный бислой, в который встроены белки и холестерин.
Клеточная мембрана представляет собой чрезвычайно гибкую структуру, состоящую в основном из двух соседних листов фосфолипидов. Холестерин, который также присутствует, способствует текучести мембраны. Одиночная молекула фосфолипида состоит из полярной фосфатной «головы», которая является гидрофильной, и неполярного липидного «хвоста», которая является гидрофобной.Ненасыщенные жирные кислоты приводят к изгибам гидрофобных хвостов. Фосфолипидный бислой состоит из двух фосфолипидов, расположенных хвост к хвосту. Гидрофобные хвосты соединяются друг с другом, образуя внутреннюю часть мембраны. Полярные головки контактируют с жидкостью внутри и снаружи ячейки.
Фосфолипидный бислой состоит из двух фосфолипидов, расположенных хвост к хвосту. Гидрофобные хвосты соединяются друг с другом, образуя внутреннюю часть мембраны. Полярные головки контактируют с жидкостью внутри и снаружи ячейки.
Фосфолипидный бислой : фосфолипидный бислой состоит из двух смежных слоев фосфолипидов, расположенных хвостом к хвосту. Гидрофобные хвосты соединяются друг с другом, образуя внутреннюю часть мембраны.Полярные головки контактируют с жидкостью внутри и снаружи ячейки.
Основная функция плазматической мембраны — регулировать концентрацию веществ внутри клетки. Эти вещества включают ионы, такие как Ca ++ , Na + , K + и Cl — ; питательные вещества, включая сахара, жирные кислоты и аминокислоты; и продукты жизнедеятельности, особенно диоксид углерода (CO 2 ), которые должны покинуть ячейку.
Двухслойная липидная структура мембраны обеспечивает клетке контроль доступа за счет проницаемости.Фосфолипиды плотно упакованы вместе, в то время как мембрана имеет гидрофобную внутреннюю часть. Эта структура делает мембрану избирательно проницаемой. Мембрана, обладающая избирательной проницаемостью, позволяет без посторонней помощи проходить через нее только веществам, отвечающим определенным критериям. В случае плазматической мембраны только относительно небольшие неполярные материалы могут перемещаться через липидный бислой (помните, липидные хвосты мембраны неполярны). Некоторыми примерами этих материалов являются другие липиды, кислород и углекислый газ, а также спирт.Однако водорастворимые материалы, такие как глюкоза, аминокислоты и электролиты, нуждаются в некоторой помощи для прохождения через мембрану, потому что они отталкиваются гидрофобными хвостами фосфолипидного бислоя.
Транспорт через мембрану
Все вещества, которые проходят через мембрану, делают это одним из двух общих методов, которые подразделяются на категории в зависимости от того, требуется ли энергия. Пассивный (не требующий энергии) транспорт — это перемещение веществ через мембрану без затрат клеточной энергии.Во время этого типа транспорта материалы перемещаются путем простой диффузии или облегченной диффузии через мембрану вниз по градиенту их концентрации. Вода проходит через мембрану в процессе диффузии, называемом осмосом. Осмос — это диффузия воды через полупроницаемую мембрану вниз по градиенту ее концентрации. Это происходит, когда существует дисбаланс растворенных веществ вне клетки по сравнению с внутри клетки. Раствор с более высокой концентрацией растворенных веществ называется гипертоническим, а раствор с более низкой концентрацией растворенных веществ — гипотоническим.Молекулы воды будут диффундировать из гипотонического раствора в гипертонический раствор (если на них не действуют гидростатические силы).
Пассивный (не требующий энергии) транспорт — это перемещение веществ через мембрану без затрат клеточной энергии.Во время этого типа транспорта материалы перемещаются путем простой диффузии или облегченной диффузии через мембрану вниз по градиенту их концентрации. Вода проходит через мембрану в процессе диффузии, называемом осмосом. Осмос — это диффузия воды через полупроницаемую мембрану вниз по градиенту ее концентрации. Это происходит, когда существует дисбаланс растворенных веществ вне клетки по сравнению с внутри клетки. Раствор с более высокой концентрацией растворенных веществ называется гипертоническим, а раствор с более низкой концентрацией растворенных веществ — гипотоническим.Молекулы воды будут диффундировать из гипотонического раствора в гипертонический раствор (если на них не действуют гидростатические силы).
Осмос : Осмос — это диффузия воды через полупроницаемую мембрану вниз по градиенту ее концентрации. Если мембрана проницаема для воды, но не для растворенного вещества, вода выровняет свою концентрацию, диффундируя в сторону более низкой концентрации воды (и, следовательно, в сторону более высокой концентрации растворенного вещества). В стакане слева раствор с правой стороны мембраны гипертонический.
В отличие от пассивного транспорта, активный (требующий энергии) транспорт — это перемещение веществ через мембрану с использованием энергии аденозинтрифосфата (АТФ). Энергия расходуется, чтобы способствовать движению материала через мембрану в направлении против градиента их концентрации. Активный транспорт может происходить с помощью протеиновых насосов или везикул. Другой формой этого типа транспорта является эндоцитоз, при котором клетка окружает внеклеточные материалы, используя свою клеточную мембрану.Противоположный процесс известен как экзоцитоз. Здесь клетка экспортирует материал с помощью везикулярного транспорта.
Цитоплазма
Плазматическая мембрана клетки также помогает удерживать цитоплазму клетки, которая обеспечивает гелеобразную среду для органелл клетки. В цитоплазме происходит большинство клеточных процессов, включая метаболизм, сворачивание белков и внутреннюю транспортировку.
В цитоплазме происходит большинство клеточных процессов, включая метаболизм, сворачивание белков и внутреннюю транспортировку.
Эндоплазматический ретикулум
Эндоплазматический ретикулум — это органелла, отвечающая за синтез липидов и модификацию белков.
Задачи обучения
Опишите структуру эндоплазматического ретикулума и его роль в синтезе и метаболизме
Основные выводы
Ключевые моменты
- Если к эндоплазматическому ретикулуму (ER) прикреплены рибосомы, это называется грубым ER; в противном случае это называется гладкой ER.
- Белки, производимые грубым эндоплазматическим ретикулумом, предназначены для использования вне клетки.
- Функции гладкой эндоплазматической сети включают синтез углеводов, липидов и стероидных гормонов; детоксикация лекарств и ядов; и хранение ионов кальция.
Ключевые термины
- люмен : полость или канал внутри трубки или трубчатого органа.
- ретикулум : Сеть
Эндоплазматический ретикулум
Эндоплазматический ретикулум (ER) представляет собой серию взаимосвязанных мембранных мешочков и канальцев, которые в совокупности модифицируют белки и синтезируют липиды. Однако эти две функции выполняются в отдельных областях ER: грубая ER и гладкая ER. Полая часть канальцев ER называется просветом или цистернальным пространством.Мембрана ER, представляющая собой бислой фосфолипидов, залитый белками, непрерывна с ядерной оболочкой.
грубая ER
Шероховатый эндоплазматический ретикулум : На этой микрофотографии, полученной с помощью просвечивающего электронного микроскопа, показан грубый эндоплазматический ретикулум и другие органеллы в клетке поджелудочной железы.
Шероховатый эндоплазматический ретикулум (RER) назван так потому, что рибосомы, прикрепленные к его цитоплазматической поверхности, придают ему вид шипов при просмотре в электронный микроскоп. Рибосомы переносят свои недавно синтезированные белки в просвет RER, где они претерпевают структурные модификации, такие как сворачивание или приобретение боковых цепей. Эти модифицированные белки будут включены в клеточные мембраны — мембраны ER или других органелл — или секретироваться из клетки (например, белковые гормоны, ферменты). RER также производит фосфолипиды для клеточных мембран. Если фосфолипиды или модифицированные белки не предназначены для того, чтобы оставаться в RER, они достигнут своего назначения через транспортные везикулы, которые отпочковываются от мембраны RER.Поскольку RER участвует в модификации белков (например, ферментов), которые будут секретироваться из клетки, RER в изобилии присутствует в клетках, которые секретируют белки. Это, например, случай с клетками печени.
Рибосомы переносят свои недавно синтезированные белки в просвет RER, где они претерпевают структурные модификации, такие как сворачивание или приобретение боковых цепей. Эти модифицированные белки будут включены в клеточные мембраны — мембраны ER или других органелл — или секретироваться из клетки (например, белковые гормоны, ферменты). RER также производит фосфолипиды для клеточных мембран. Если фосфолипиды или модифицированные белки не предназначены для того, чтобы оставаться в RER, они достигнут своего назначения через транспортные везикулы, которые отпочковываются от мембраны RER.Поскольку RER участвует в модификации белков (например, ферментов), которые будут секретироваться из клетки, RER в изобилии присутствует в клетках, которые секретируют белки. Это, например, случай с клетками печени.
Гладкая ER
Гладкая эндоплазматическая сеть (ГЭР) является продолжением RER, но на ее цитоплазматической поверхности мало рибосом или нет их. Функции SER включают синтез углеводов, липидов и стероидных гормонов; детоксикация лекарств и ядов; и хранение ионов кальция.В мышечных клетках специальный SER, называемый саркоплазматической сетью, отвечает за хранение ионов кальция, необходимых для запуска скоординированных сокращений мышечных клеток.
Аппарат Гольджи
Аппарат Гольджи сортирует и упаковывает материалы перед тем, как они покинут камеру, чтобы гарантировать, что они прибудут в нужное место назначения.
Задачи обучения
Описать структуру аппарата Гольджи и его роль в модификации и секреции белков
Основные выводы
Ключевые моменты
- Аппарат Гольджи представляет собой серию сплюснутых мешочков, которые сортируют и упаковывают клеточные материалы.
- Аппарат Гольджи имеет цис-грань на стороне ER и транс-грань, противоположную ER.
- Лицо trans выделяет материалы в пузырьки, которые затем сливаются с клеточной мембраной для высвобождения из клетки.

Ключевые термины
- везикула : мембраносвязанный компартмент в клетке.
Аппарат Гольджи
Мы уже упоминали, что пузырьки могут отпочковываться из ER и транспортировать свое содержимое в другое место, но куда эти пузырьки уходят? Прежде чем добраться до конечного пункта назначения, липиды или белки в транспортных пузырьках все еще необходимо отсортировать, упаковать и пометить, чтобы они оказались в нужном месте.Сортировка, маркировка, упаковка и распределение липидов и белков происходит в аппарате Гольджи (также называемом телом Гольджи), в серии уплощенных мембран.
Аппарат Гольджи сортирует и упаковывает клеточные продукты : Аппарат Гольджи в этом лейкоците виден как стопка полукруглых сплющенных колец в нижней части изображения. Рядом с аппаратом Гольджи можно увидеть несколько пузырьков.
Приемная сторона аппарата Гольджи называется цис-гранью.Противоположная сторона называется трансфайсом. Транспортные везикулы, сформированные из ER, перемещаются к цис-лицу, сливаются с ней и выводят свое содержимое в просвет аппарата Гольджи. Когда белки и липиды проходят через Гольджи, они претерпевают дальнейшие модификации, которые позволяют их сортировать. Наиболее частая модификация — добавление коротких цепочек молекул сахара. Эти недавно модифицированные белки и липиды затем маркируются фосфатными группами или другими небольшими молекулами, чтобы их можно было направить по назначению.
Наконец, модифицированные и помеченные белки упаковываются в секреторные пузырьки, которые отпочковываются из транс-поверхности Гольджи. В то время как некоторые из этих везикул откладывают свое содержимое в другие части клетки, где они будут использоваться, другие секреторные везикулы сливаются с плазматической мембраной и высвобождают свое содержимое за пределы клетки.
В другом примере формы, следующей за функцией, клетки, которые участвуют в большой секреторной активности (например, клетки слюнных желез, которые секретируют пищеварительные ферменты, или клетки иммунной системы, которые секретируют антитела), имеют большое количество Гольджи. В клетках растений аппарат Гольджи выполняет дополнительную роль в синтезе полисахаридов, некоторые из которых встраиваются в клеточную стенку, а некоторые используются в других частях клетки.
В клетках растений аппарат Гольджи выполняет дополнительную роль в синтезе полисахаридов, некоторые из которых встраиваются в клеточную стенку, а некоторые используются в других частях клетки.
Лизосомы
Лизосомы — это органеллы, которые переваривают макромолекулы, восстанавливают клеточные мембраны и реагируют на чужеродные вещества, попадающие в клетку.
Задачи обучения
Опишите, как лизосомы функционируют как система утилизации клеточных отходов.
Основные выводы
Ключевые моменты
- Лизосомы расщепляют / переваривают макромолекулы (углеводы, липиды, белки и нуклеиновые кислоты), восстанавливают клеточные мембраны и реагируют на чужеродные вещества, такие как бактерии, вирусы и другие антигены.
- Лизосомы содержат ферменты, разрушающие макромолекулы и чужеродных захватчиков.
- Лизосомы состоят из липидов и белков, с единственной мембраной, покрывающей внутренние ферменты, чтобы не дать лизосомам переваривать саму клетку.
- Лизосомы находятся во всех клетках животных, но редко встречаются в клетках растений из-за прочной клеточной стенки, окружающей растительную клетку, которая не пропускает посторонние вещества.
Ключевые термины
- фермент : глобулярный белок, катализирующий биологическую химическую реакцию
- лизосома : органелла, обнаруженная во всех типах клеток животных, которая содержит широкий спектр пищеварительных ферментов, способных расщеплять большинство биологических макромолекул.
Лизосома выполняет три основные функции: расщепление / переваривание макромолекул (углеводов, липидов, белков и нуклеиновых кислот), восстановление клеточной мембраны и реакция на чужеродные вещества, такие как бактерии, вирусы и другие антигены. Когда пища съедается или поглощается клеткой, лизосома высвобождает свои ферменты для расщепления сложных молекул, включая сахара и белки, в полезную энергию, необходимую клетке для выживания. Если пища не предоставляется, ферменты лизосомы переваривают другие органеллы внутри клетки, чтобы получить необходимые питательные вещества.
Если пища не предоставляется, ферменты лизосомы переваривают другие органеллы внутри клетки, чтобы получить необходимые питательные вещества.
В дополнение к их роли в качестве пищеварительного компонента и средства рециркуляции органелл в клетках животных, лизосомы считаются частью эндомембранной системы. Лизосомы также используют свои гидролитические ферменты для уничтожения патогенов (болезнетворных организмов), которые могут проникнуть в клетку. Хороший пример этого — группа белых кровяных телец, называемых макрофагами, которые являются частью иммунной системы вашего тела. В процессе, известном как фагоцитоз или эндоцитоз, часть плазматической мембраны макрофага инвагинирует (складывается) и поглощает патоген.Инвагинированный участок с патогеном внутри затем отщепляется от плазматической мембраны и становится пузырьком. Везикула сливается с лизосомой. Затем гидролитические ферменты лизосомы уничтожают патоген.
Лизосомы переваривают чужеродные вещества, которые могут нанести вред клетке. : Макрофаг поглотил (фагоцитировал) потенциально патогенную бактерию, а затем сливается с лизосомами внутри клетки, чтобы уничтожить патоген. Другие органеллы присутствуют в клетке, но для простоты не показаны.
Лизосома состоит из липидов, составляющих мембрану, и белков, составляющих ферменты внутри мембраны. Обычно лизосомы имеют размер от 0,1 до 1,2 мкм, но размер варьируется в зависимости от типа клеток. Общая структура лизосомы состоит из набора ферментов, окруженных однослойной мембраной. Мембрана является важным аспектом ее структуры, потому что без нее ферменты в лизосоме, которые используются для разрушения чужеродных веществ, просочились бы и переварили всю клетку, вызывая ее смерть.
Лизосомы находятся почти в каждой животной эукариотической клетке. Они настолько распространены в клетках животных, потому что, когда клетки животных поглощают или поглощают пищу, им необходимы ферменты, содержащиеся в лизосомах, чтобы переваривать и использовать пищу для получения энергии. С другой стороны, лизосомы не часто встречаются в растительных клетках. Лизосомы не нужны растительным клеткам, потому что их клеточные стенки достаточно жесткие, чтобы удерживать крупные / чужеродные вещества, которые лизосомы обычно переваривают, из клетки.
С другой стороны, лизосомы не часто встречаются в растительных клетках. Лизосомы не нужны растительным клеткам, потому что их клеточные стенки достаточно жесткие, чтобы удерживать крупные / чужеродные вещества, которые лизосомы обычно переваривают, из клетки.
Пероксисомы
Пероксисомы нейтрализуют вредные токсины и осуществляют липидный обмен и реакции окисления, расщепляющие жирные кислоты и аминокислоты.
Задачи обучения
Назовите различные функции, которые пероксисомы выполняют внутри клетки.
Основные выводы
Ключевые моменты
- Липидный обмен и химическая детоксикация — важные функции пероксисом.
- Пероксисомы отвечают за реакции окисления, расщепляющие жирные кислоты и аминокислоты.
- Пероксисомы контролируют реакции, которые нейтрализуют свободные радикалы, вызывающие повреждение и гибель клеток.
- Пероксисомы химически нейтрализуют яды посредством процесса, в результате которого образуется большое количество токсичного H 2 O 2 , который затем превращается в воду и кислород.
- Печень — это орган, который в первую очередь отвечает за детоксикацию крови перед ее распространением по телу; в результате клетки печени содержат большое количество пероксисом.
Ключевые термины
- фермент : глобулярный белок, катализирующий биологическую химическую реакцию
- свободный радикал : любая молекула, ион или атом, имеющий один или несколько неспаренных электронов; они, как правило, обладают высокой реакционной способностью и часто встречаются только как временные частицы.
Пероксисомы
Тип органелл, обнаруженный как в клетках животных, так и в клетках растений, пероксисома представляет собой мембраносвязанную клеточную органеллу, которая в основном содержит ферменты. Пероксисомы выполняют важные функции, включая метаболизм липидов и химическую детоксикацию.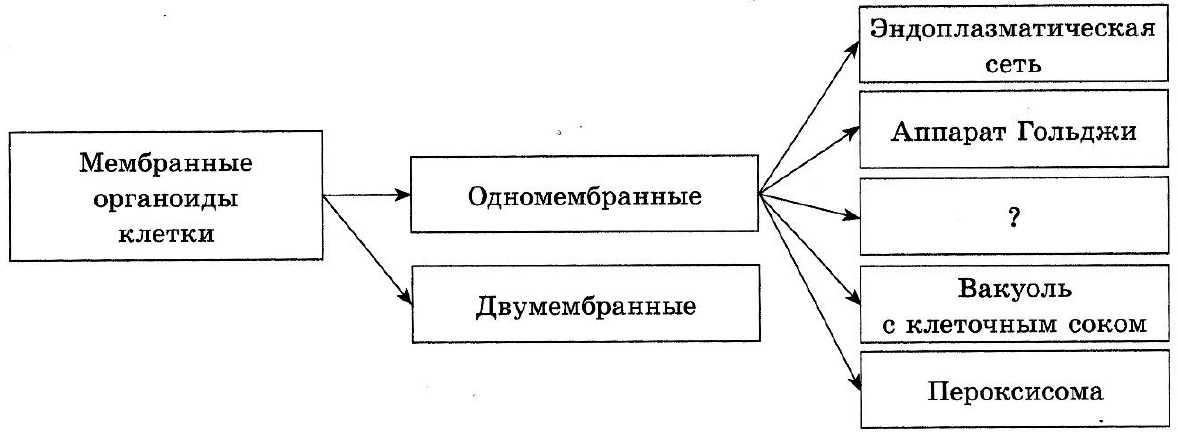 Они также проводят реакции окисления, расщепляющие жирные кислоты и аминокислоты.
Они также проводят реакции окисления, расщепляющие жирные кислоты и аминокислоты.
Пероксисомы : Пероксисомы представляют собой мембраносвязанные органеллы, которые содержат множество ферментов для детоксикации вредных веществ и метаболизма липидов.
В отличие от пищеварительных ферментов, содержащихся в лизосомах, ферменты в пероксисомах служат для переноса атомов водорода от различных молекул к кислороду, производя перекись водорода (H 2 O 2 ). Таким образом, пероксисомы нейтрализуют попадающие в организм яды, такие как алкоголь. Чтобы понять важность пероксисом, необходимо понять концепцию активных форм кислорода.
Активные формы кислорода (АФК), такие как пероксиды и свободные радикалы, являются высокореактивными продуктами многих нормальных клеточных процессов, включая митохондриальные реакции, которые производят АТФ и метаболизм кислорода.Примеры ROS включают гидроксильный радикал ОН, H 2 O 2 и супероксид (O -2 ). Некоторые АФК важны для определенных клеточных функций, таких как клеточные сигнальные процессы и иммунные ответы против чужеродных веществ. Однако многие АФК вредны для организма. Свободные радикалы реактивны, потому что они содержат свободные неспаренные электроны; они могут легко окислять другие молекулы по всей клетке, вызывая клеточное повреждение и даже смерть клетки. Считается, что свободные радикалы играют роль во многих деструктивных процессах в организме, от рака до ишемической болезни сердца.
Пероксисомы контролируют реакции, нейтрализующие свободные радикалы. В процессе они производят большое количество токсичного H 2 O 2 , но содержат ферменты, которые превращают H 2 O 2 в воду и кислород. Эти побочные продукты затем безопасно попадают в цитоплазму. Как и миниатюрные очистные сооружения, пероксисомы нейтрализуют вредные токсины, поэтому они не наносят вред клеткам. Печень — это орган, который в первую очередь отвечает за детоксикацию крови перед ее распространением по телу; клетки печени содержат исключительно большое количество пероксисом.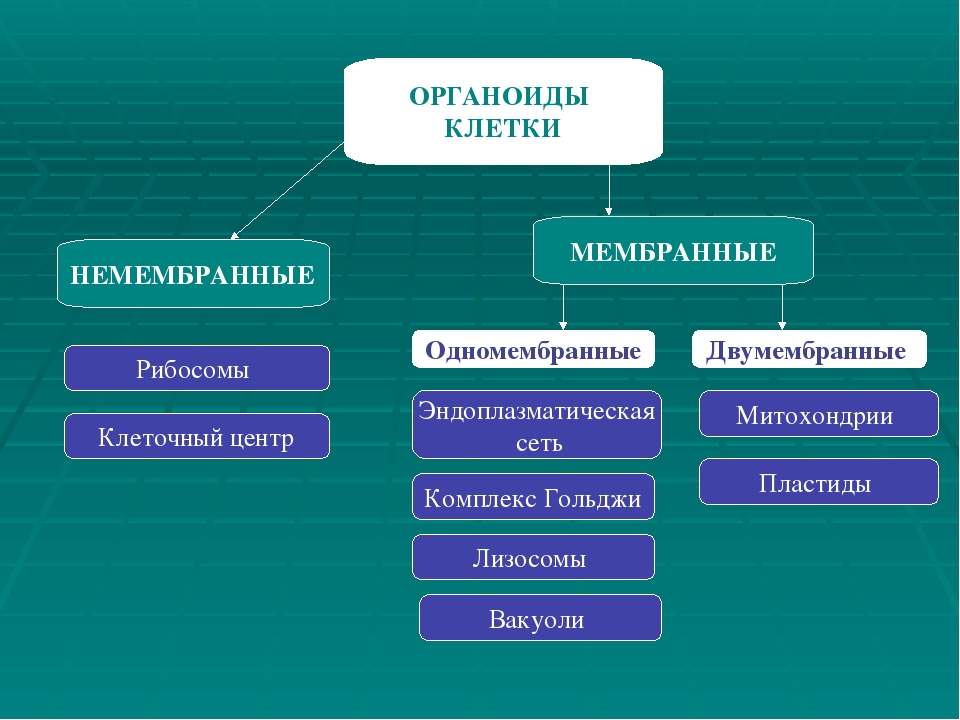
Митохондрии
Митохондрии — это органеллы, которые отвечают за образование аденозинтрифосфата (АТФ), основной молекулы, переносящей энергию в клетке.
Задачи обучения
Объясните роль митохондрий.
Основные выводы
Ключевые моменты
- Митохондрии содержат собственные рибосомы и ДНК; В сочетании с их двойной мембраной эти особенности предполагают, что когда-то они могли быть свободноживущими прокариотами, которые были поглощены более крупной клеткой.
- Митохондрии играют важную роль в клеточном дыхании за счет производства АТФ с использованием химической энергии, содержащейся в глюкозе и других питательных веществах.
- Митохондрии также ответственны за образование кластеров железа и серы, которые являются важными кофакторами многих ферментов.
Ключевые термины
- альфа-протеобактерии : таксономический класс внутри филума Proteobacteria — фототропные протеобактерии.
- аденозинтрифосфат : многофункциональный нуклеозидтрифосфат, используемый в клетках в качестве кофермента, часто называемый «молекулярной единицей энергетической валюты» при внутриклеточном переносе энергии.
- кофактор : неорганическая молекула, необходимая для функционирования фермента
Одним из основных отличий прокариот от эукариот является наличие митохондрий.Митохондрии — это двухмембранные органеллы, содержащие собственные рибосомы и ДНК. Каждая мембрана представляет собой бислой фосфолипидов, залитый белками. Эукариотические клетки могут содержать от одной до нескольких тысяч митохондрий, в зависимости от уровня потребления энергии клеткой. Каждая митохондрия имеет длину от 1 до 10 микрометров (или больше) и существует в клетке в виде органеллы, которая может быть яйцевидной, червеобразной или сложно разветвленной.
Структура митохондрий
Большинство митохондрий окружены двумя мембранами, что могло бы произойти, когда один мембраносвязанный организм был поглощен вакуолью другим мембраносвязанным организмом. Внутренняя мембрана митохондрий обширна и включает значительные складки, называемые кристами, которые напоминают текстурированную внешнюю поверхность альфа-протеобактерий. Матрикс и внутренняя мембрана богаты ферментами, необходимыми для аэробного дыхания.
Внутренняя мембрана митохондрий обширна и включает значительные складки, называемые кристами, которые напоминают текстурированную внешнюю поверхность альфа-протеобактерий. Матрикс и внутренняя мембрана богаты ферментами, необходимыми для аэробного дыхания.
Структура митохондрий : На этой электронной микрофотографии показана митохондрия в просвечивающем электронном микроскопе. Эта органелла имеет внешнюю мембрану и внутреннюю мембрану. Внутренняя мембрана содержит складки, называемые кристами, которые увеличивают площадь ее поверхности.Пространство между двумя мембранами называется межмембранным пространством, а пространство внутри внутренней мембраны называется митохондриальным матриксом. Синтез АТФ происходит на внутренней мембране.
Митохондрии имеют собственную (обычно) кольцевую хромосому ДНК, которая стабилизируется за счет прикрепления к внутренней мембране и несет гены, аналогичные генам, экспрессируемым альфа-протеобактериями. Митохондрии также имеют особые рибосомы и передающие РНК, которые напоминают эти компоненты у прокариот.Все эти особенности подтверждают гипотезу о том, что митохондрии когда-то были свободноживущими прокариотами.
Функция митохондрий
Митохондрии часто называют «электростанциями» или «энергетическими фабриками» клетки, потому что они ответственны за выработку аденозинтрифосфата (АТФ), основной молекулы, несущей энергию в клетке. АТФ представляет собой кратковременную запасенную энергию клетки. Клеточное дыхание — это процесс производства АТФ с использованием химической энергии, содержащейся в глюкозе и других питательных веществах.В митохондриях этот процесс использует кислород и производит углекислый газ в качестве побочного продукта. Фактически, углекислый газ, который вы выдыхаете при каждом вдохе, возникает в результате клеточных реакций, которые производят углекислый газ в качестве побочного продукта.
Важно отметить, что в мышечных клетках очень высокая концентрация митохондрий, производящих АТФ. Вашим мышечным клеткам нужно много энергии, чтобы ваше тело двигалось. Когда ваши клетки не получают достаточно кислорода, они не производят много АТФ. Вместо этого небольшое количество АТФ, которое они производят в отсутствие кислорода, сопровождается образованием молочной кислоты.
Вашим мышечным клеткам нужно много энергии, чтобы ваше тело двигалось. Когда ваши клетки не получают достаточно кислорода, они не производят много АТФ. Вместо этого небольшое количество АТФ, которое они производят в отсутствие кислорода, сопровождается образованием молочной кислоты.
Помимо аэробной генерации АТФ, митохондрии выполняют несколько других метаболических функций. Одна из этих функций — генерировать кластеры железа и серы, которые являются важными кофакторами многих ферментов. Такие функции часто связаны с уменьшением происходящих из митохондрий органелл анаэробных эукариот.
Происхождение митохондрий
Существует две гипотезы происхождения митохондрий: эндосимбиотическая и аутогенная, но в настоящее время наиболее признанной теорией является эндосимбиоз.Эндосимбиотическая гипотеза предполагает, что митохондрии изначально были прокариотическими клетками, способными реализовывать окислительные механизмы. Эти прокариотические клетки могли быть поглощены эукариотом и стали эндосимбионтами, живущими внутри эукариота.
Организация типов клеток (Раздел 1, Глава 8) Нейронаука в Интернете: Электронный учебник для нейронаук | Кафедра нейробиологии и анатомии
8.1 Введение в нейроны и глиальные клетки
По оценкам, нервная система человека состоит примерно из 360 миллиардов неневральных глиальных клеток и 90 миллиардов нервных клеток.Более того, существуют сотни различных типов нейронов, основанных только на морфологии. Часто похожие нейроны обладают совершенно разными свойствами. Например, они используют разные нейротрансмиттеры и реагируют на них. В этом разделе рассматриваются клеточные компоненты нервной ткани. Студенты должны уметь описывать нейроны и глию, их морфологические компоненты, видимые в световой и электронный микроскоп, а также некоторые из фундаментальных функциональных ролей, которые эти типы клеток играют в нервной системе.
8.2 Модель Neuron
| jpg=»»> |
Рис. 8.1. |
Изучив модель нейрона выше, узнайте больше о функциях каждой структуры, нажав на список ниже.
- Cell Soma
- Дендрит
- Начальный сегмент и аксонный холм
- Аксон
- Нервные окончания
- Нервно-мышечный узел
8.3-х элементная сома
Щелкните идентифицированные структуры на модельном нейроне, чтобы перейти к соответствующему разделу. |
Область нейрона, содержащая ядро, известна как тело клетки , сома или перикарион (рис. 8.2). Тело клетки — это метаболический центр нейрона.
Внутренняя часть сомы состоит из цитоплазмы, геля внутри микротрабекулярной решетки, образованной микротрубочками и связанных с ними белков, которые составляют цитоскелет .
Энергетический метаболизм и синтез макромолекул, используемых клеткой для поддержания своей структуры и выполнения своей функции, являются основными видами деятельности нейрональной сомы. Как описано в главе 6, он также действует как рецептивная область для синаптических входов от других клеток. В цитоплазму нейронов встроены органеллы, общие для других клеток, ядро , ядрышко , эндоплазматический ретикулум , аппарат Гольджи , митохондрии , рибосомы , лизосомы и , эндосомы , эндосомы , Пероксисомы .Многие из этих клеточных включений отвечают за экспрессию генетической информации, контролирующей синтез клеточных белков, участвующих в производстве энергии, росте и замене материалов, потерянных в результате истирания.
Рис. 8.2 (См. Увеличенное изображение) |
8.4 Дендриты
Щелкните идентифицированные структуры на модельном нейроне, чтобы перейти к соответствующему разделу. |
Мембрана нейрона действует как рецептивная поверхность на всем ее протяжении; однако специфические входные данные (называемые афферентами) от других клеток принимаются в основном на поверхности тела клетки и на поверхности специализированных отростков, известных как дендриты.Дендритные отростки могут широко разветвляться и часто покрыты выступами, известными как дендритных шипов . Шипы обеспечивают огромное увеличение площади поверхности, доступной для синаптических контактов. Дендритные отростки и шипы нейронов по существу представляют собой расширения цитоплазмы, содержащие большинство органелл, обнаруженных в теле клетки. Дендриты содержат многочисленные упорядоченные массивы микротрубочек и меньше нейрофиламентов (см. Ниже). Белки, связанные с микротрубочками (MAP) в дендрите, имеют более высокий молекулярный вес, чем белки, обнаруженные в аксоне.Примером является MAP2. Кроме того, микротрубочки в дендритах имеют свои положительные концы по направлению к соме клетки. Митохондрии часто расположены продольно. Грубый эндоплазматический ретикулум и рибосомы присутствуют в больших, но не в маленьких дендритах. Форма и протяженность «дендритного дерева» отдельного нейрона указывают на количество и разнообразие информации, получаемой и обрабатываемой этим нейроном. Дендритные шипы часто содержат микрофиламентов , которые представляют собой цитоскелетный элемент , ответственный за изменения формы шипов, наблюдаемые в некоторых примерах синаптической пластичности.
Дендритные шипы часто содержат микрофиламентов , которые представляют собой цитоскелетный элемент , ответственный за изменения формы шипов, наблюдаемые в некоторых примерах синаптической пластичности.
Рис. 8.3 (см. Увеличенное изображение) |
Информация принимается дендритом через массив рецепторов на поверхности дендрита, которые реагируют на передатчики, высвобождаемые из окончаний аксонов других нейронов. Дендриты могут состоять из одного ответвления от сомы или разветвленной сети, способной принимать входные данные от тысяч других клеток.Например, средний мотонейрон спинного мозга с дендритным деревом среднего размера получает 10 000 контактов, из которых 2 000 находятся на соме и 8 000 — на дендритах.
8.5 Начальный сегмент и аксонный холм
Щелкните идентифицированные структуры на модельном нейроне, чтобы перейти к соответствующему разделу. |
Конусообразная область тела клетки, где берет начало аксон, называется аксоном бугорком .Эта область свободна от рибосом, и большинства других клеточных органелл, за исключением цитоскелетных элементов и органелл, которые транспортируются вниз по аксону. нейрофиламентов в бугорке аксона объединяются в пучки. Область между бугорком аксона и началом миелиновой оболочки известна как начальный сегмент . Во многих случаях эта область является анатомическим местом инициации потенциала действия.Область под аксолеммой в этой области имеет материал, который темнеет при просмотре с помощью ЭМ. Эта область показана на рисунке 8. 4. На самом дальнем конце аксона и его коллатералах находятся небольшие ответвления, кончики которых представляют собой пуговичные цитоплазматические увеличения, называемые терминальными бутонами или нервными окончаниями .
4. На самом дальнем конце аксона и его коллатералах находятся небольшие ответвления, кончики которых представляют собой пуговичные цитоплазматические увеличения, называемые терминальными бутонами или нервными окончаниями .
Рис. 8.4 (см. Увеличенное изображение) |
8,6 Аксон
Щелкните идентифицированные структуры на модельном нейроне, чтобы перейти к соответствующему разделу. |
Другой тип процесса в идеализированном нейроне — аксон. Каждый нейрон имеет только один аксон, и он обычно более прямой и гладкий, чем дендритные профили. Аксоны также содержат пучки микротрубочек и нейрофиламентов и разбросанных митохондрий .Большинство MAP в аксоне имеют более низкий молекулярный вес, чем в дендрите. Преобладающий MAP в аксонах — это tau . Микрофиламенты внутри аксона обычно связаны с областью, прилегающей к плазмалемме, и часто являются наиболее плотными в узлах Ranvier . За пределами начальных сегментов аксоплазма лишена грубого эндоплазматического ретикулума и свободных рибосом. Ветви аксонов известны как axon collaterales . Сам аксон часто окружен мембранным материалом, называемым миелиновой оболочкой, образованным глиальными клетками.Миелиновая оболочка действует для изоляции плазмалеммы аксона таким образом, что требует более быстрого распространения деполяризации плазмалеммы и увеличивает скорость проведения нервного импульса (см. Главу 3).
Рис. |
8,7 Нервное окончание
Щелкните идентифицированные структуры на модельном нейроне, чтобы перейти к соответствующему разделу. |
Часть плазматической мембраны нервного окончания, которая специализируется на формировании функциональных контактов с другими клетками, — это синапс .
Когда нейроны взаимодействуют с мышечными волокнами, область функционального контакта называется нервно-мышечным соединением или двигателем замыкательной пластиной (глава 4).Согласно классическому определению синапса, когда нерв , заканчивающийся синапсом на дендрите или соме второго нейрона, называется либо аксодендритом , либо аксосоматическим синапсом , соответственно (Глава 7). Однако почти все возможные комбинации пре- и постсинаптических элементов были обнаружены в центральной нервной системе. Эти различные типы синапсов обозначаются сочетанием названия структуры пресинаптического элемента с названием постсинаптической структуры.Например, когда передача информации происходит от аксона к аксону или от одного терминала к другому, задействованный синапс называется аксоаксоническим синапсом .
8.8 Клеточные элементы в типичном нервном окончании
Области функциональных контактов между нейронами (синапсами) имеют отличные морфологические характеристики. Хотя размер и форма бутонов отдельных нейронов сильно различаются, синапсы можно идентифицировать по наличию следующего:
- Существует пресинаптический комплемент мембраносвязанных синаптических везикул.
 Это сферические пузырьки в нервных окончаниях возбуждения, показанные на рис. 8.6. В тормозных нейронах синаптические пузырьки часто уплощены, как показано на рис. 8.7.
Это сферические пузырьки в нервных окончаниях возбуждения, показанные на рис. 8.6. В тормозных нейронах синаптические пузырьки часто уплощены, как показано на рис. 8.7. - Нервное окончание часто имеет скопления плотного материала в цитоплазме, непосредственно прилегающих к мембране на пре- и постсинаптической стороне соединения (они известны как пресинаптическая плотность или постсинаптическая плотность, соответственно). Этот плотный материал на пресинаптической стороне является считается местом прикрепления пузырьков. плотный материал на постсинаптической стороне является местом, где преобладают рецепторные белки и каналы.
- Присутствует много митохондрий , особенно в нервном окончании; и
- Имеется отчетливая синаптическая щель или межклеточное пространство примерно 20-40 нм.
- Присутствует эндоплазматический ретикулум , который регулирует уровень Ca 2+ .
- Эндосомальная мембрана , которая участвует в рециклировании синаптических пузырьков.
8.9 Варианты конструкции
Существует множество разновидностей «модельного» нейрона, описанного выше. Важная модификация, которая происходит особенно в рецепторных нейронах, включает обозначение нейронального отростка как дендрита или как аксона. Классически аксон был идентифицирован как миелинизированный или немиелинизированный процесс, который передает сигналы от тела клетки. Классический вид дендрита представляет собой немиелинизированную трубку цитоплазмы, которая несет информацию к телу клетки.Однако это различие не распространяется на ВСЕ нейроны. Некоторые клетки имеют миелинизированный отросток, который передает сигналы телу клетки. Следовательно, морфологически «дендрит» и «аксон» могут быть неразличимы. Ни положение тела клетки, ни присутствие или отсутствие миелина не всегда являются полезным критерием для понимания ориентации нейрона. Область инициирования импульса является более надежным ориентиром для понимания функционального фокуса клетки.Эта область аналогична начальному участку модельного нейрона, рассмотренному выше. Обычно волокно или отросток, который содержит начальный сегмент или триггерную зону, называют аксоном. Обратите внимание, как показано на рисунке 8.8, зона срабатывания не обязательно должна быть непосредственно рядом с телом ячейки.
Рисунок 8.8 |
8.10 Именование нейронов
Для классификации и наименования нейронов разработано множество соглашений. Один из старейших, разработанный Гольджи в конце 1800-х годов, основан на сложности дендритного дерева нейрона. Благодаря этому подходу клетки классифицируются на униполярные, биполярные и мультиполярные нейроны, как показано на рис. 8.8. Униполярные клетки имеют только один клеточный отросток и в основном встречаются у беспозвоночных. Однако сенсорные нейроны позвоночных — еще одна форма этого типа клеток.Поскольку эти клетки начинают свое развитие как биполярные нейроны, а затем становятся униполярными по мере созревания, их называют псевдо-униполярными клетками . Биполярные клетки присутствуют в сетчатке и обонятельной луковице . Мультиполярные клетки составляют остальные типы нейронов и, следовательно, являются наиболее многочисленными типами. Они были далее подразделены на подкатегории клеток Гольджи типа II , которые представляют собой небольшие нейроны, обычно интернейроны, и клеток Гольджи типа I , которые являются большими мультиполярными нейронами.
Клетки также названы по их форме (например, пирамидных клеток , показанных на рисунке 8.9) или по имени человека, который их первым описал (например, клетки Пуркинье , показанные на рисунке 8.10). Совсем недавно клетки были названы в соответствии с их функцией или содержащимся в них нейротрансмиттером (например, группы норадреналиновых клеток ЦНС, описанные в главе 12). Это описание возможно благодаря развитию гистохимических и иммуноцитохимических методов для специфической идентификации нейромедиатора типа , используемого нейронами.
Два варианта морфологии клеток. Слева находится пирамидальная ячейка, названная в честь ее характерной пирамидальной формы. Эта клетка находится в коре головного мозга. Справа — сома и дендриты клетки Пуркинье, обнаруженные в мозжечке и названные в честь ученого Пуркинье. | ||
8.11 Органелл
Многие термины, используемые в этом разделе, определены ниже.
Аксолемма — это плазмалемма аксона.
Эндоплазматический ретикулум — это лабиринт, ограниченный мембраной участок в цитоплазме, где синтезируются липиды и образуются мембраносвязанные белки. В некоторых областях нейрона ER лишен рибосом и называется гладким ER. Гладкий ER участвует в буферизации Ca 2+ и в биосинтезе и рециклинге синаптических пузырьков, как будет обсуждаться в главе 10.
Эндосома — это мембранно-ограниченная органелла, которая несет материалы, попавшие в организм в результате эндоцитоза, и передает их лизосомам и пероксисомам для деградации. Он также функционирует в нервном окончании, перерабатывая синаптические пузырьки.
Аппарат Гольджи представляет собой набор уложенных друг на друга органелл с гладкой поверхностью, связанных с мембраной, где белки и липиды, образующиеся в эндоплазматическом ретикулуме, модифицируются и сортируются.
Лизосомы содержат ферменты, которые переваривают соединения, образующиеся внутри или вне клеток.Они участвуют в превращении белков в аминокислоты и гликогена в глюкозу, основное питательное вещество нейронов. Их ферменты действуют при кислом pH. Как будет описано ниже, они также служат везикулами для обратного транспорта от окончаний аксонов к соме. Многие лизосомы разлагаются до гранул липофусцина, которые накапливаются по мере старения организма и рассматриваются как отходы нейронов. Лизосомы образуются в результате отпочкования аппарата Гольджи. Они имеют различные формы и размеры, связанные с мембраной, от 250 до 700 нм в диаметре.
Микрофиламенты — это филаменты диаметром 7 нм, расположенные в виде парной спирали из двух нитей глобулярного актина. Микрофиламенты особенно заметны в синаптических окончаниях, в дендритных шипах и в ассоциации с аксолеммой.
Микротрубочки представляют собой трубчатые структуры диаметром от 20 до 25 нм, которые образуют рыхлые пучки вокруг ядра и воронки в основании аксональных и дендритных отростков, где они образуют параллельные массивы, распределенные в продольном направлении. Они состоят из димеров α- и β-субъединиц тубулина и содержат ассоциированные белки, известные как белки, ассоциированные с микротрубочками (MAPS).MAPS регулируют полимеризацию субъединиц тубулина с образованием микротрубочек. Димеры α- и β-субъединиц тубулина полимеризуются с образованием прото-филаментов, расположенных в виде спирали, так что 13 димерных субъединиц составляют каждый полный оборот α-спирали. Кроме того, микротрубочки не являются непрерывными, и каждая микротрубочка состоит из множества единиц размером 100 нм. Микротрубочки участвуют в аксоплазматическом транспорте (см. Ниже).
Митохондрии распространены повсеместно по цитоплазме всей нервной клетки и особенно многочисленны при пресинаптических специализациях.
Нейрофиламенты — это тип промежуточных волокон, обнаруженных в нервных клетках. Нейрофиламенты участвуют в поддержании формы и механической прочности нейрона. Хотя нейрональные нейрофиламенты классифицируются как промежуточные филаменты, их состав в нейронах отличается от состава других клеток. Они состоят из трех субъединиц, которые образуют трубочку диаметром 10 нм. Это нейрофиламент окрашивается тяжелым металлом, что позволяет визуализировать форму нейронов.Нейрофиламенты образуют рыхлые пучки вокруг ядра клетки и других органелл и воронки в основании аксональных и дендритных отростков, где они образуют параллельные массивы, распределенные в продольном направлении. Нейрофиламентов больше, чем микротрубочек в аксонах, тогда как микротрубочек больше, чем нейрофиламентов в дендритах. Именно нейрофиламенты модифицируются при болезни Альцгеймера с образованием нейрофибриллярных клубков.
Ядрышко находится в центре ядер всех нейронов.Это заметное, глубоко окрашенное сферическое включение размером около одной трети ядра. Ядрышко синтезирует рибосомную РНК, которая играет важную роль в синтезе белка.
Ядро нейрона большое и круглое, обычно расположено в центре. В некоторых клетках в ядре видны массы глубоко окрашивающего хроматина. Ядерная мембрана нейронов похожа на мембрану других клеток — это двойная мембрана, перемежающаяся порами (ядерными порами), которые участвуют в ядерно-цитоплазматических взаимодействиях.Ядро нейронов имеет сферическую форму и имеет диаметр от 3 до 18 микрометров в зависимости от размера нейрона. Нейроны с длинными аксонами имеют более крупное тело и ядро клетки. Как и в других клетках, основным компонентом ядра является дезоксирибонуклеиновая кислота (ДНК), составляющая хромосом и генов.
Пероксисомы — это небольшие мембраносвязанные органеллы, которые используют молекулярный кислород для окисления органических молекул. Они содержат некоторые ферменты, которые либо производят, либо разлагают перекись водорода.
Плазмалемма нейрона представляется в электронном микроскопе как типичная двухслойная клеточная мембрана толщиной примерно 10 нм.
Постсинаптическая плотность — это темный материал постсинаптической клетки, прилегающей к синапсу. Рецепторы, ионные каналы и другие сигнальные молекулы, вероятно, связаны с этим материалом.
Пресинаптическая плотность — это область темного окрашиваемого материала пресинаптической мембраны, где, как предполагается, синаптические везикулы состыковываются перед слиянием с пресинаптической мембраной.
Рибосомы — это частицы, состоящие из рибосомной РНК и рибосомного белка, которые связываются с мРНК и катализируют синтез белков. Когда рибосомы прикреплены к внешним мембранам ER, органелла называется грубым ER. Грубый ER в пластинках с вкраплениями рибосом виден в световой микроскоп как вещество Ниссля. В световых микроскопических препаратах внешний вид вещества Ниссля варьирует в разных типах нейронов. Он может иметь вид густо окрашенных овоидов, тонкодисперсных частиц или скоплений гранул.
Синапс — это соединение, которое позволяет сигналам проходить от нервной клетки к другой клетке или от одной нервной клетки к мышечной клетке. Синаптическая щель — это промежуток между мембраной пре- и постсинаптической клетки. В химическом синапсе сигнал переносится диффузионным нейромедиатором. Щель между пресинаптической клеткой и постсинаптическими клетками имеет ширину от 20 до 40 нм и может казаться прозрачной или полосатой. Недавние исследования показали, что расщелина сама по себе не является пустым пространством, а заполнена углеводосодержащим материалом.
Синаптические везикулы — это небольшие сферические органеллы в цитоплазме нейронов, которые содержат нейромедиатор и различные белки, необходимые для секреции нейромедиатора. Везикулы, содержащие тормозной нейромедиатор, часто бывают плоскими или эллиптическими, тогда как везикулы, содержащие возбуждающий нейромедиатор, обычно более сферические.
8.12 Глиальные клетки и функции
Рисунок 8.11 |
Самыми многочисленными клеточными составляющими центральной нервной системы являются ненейрональные, нейроглиальные («нервный клей») клетки, которые занимают пространство между нейронами. Было подсчитано, что существует примерно 360 миллиардов глиальных клеток, которые составляют 80-90% клеток ЦНС. В этом разделе будут рассмотрены общие классификации нейроглиальных клеток и описаны некоторые общие свойства, которые отличают нейроглию от нейронов.
Нейроглия отличается от нейронов в нескольких общих чертах тем, что они
- не образуют синапсов,
- имеют по существу только один тип процесса,
- сохраняют способность делиться, а
- менее электрически возбудимы, чем нейроны.
Нейроглии классифицируются по размеру и форме их ядра и отличаются от нейронов на уровне светового микроскопа. Щелочные (основные) красители используются для выявления морфологии ядра.Кроме того, используются несколько металлических красителей, показывающих форму клетки и архитектуру цитоплазмы. Характеристики ядер, включая размер, форму, интенсивность окрашивания и распределение хроматина, используются для различения типов клеток в патологическом материале. Также используются характеристики тела клетки, включая размер, форму, расположение, структуру ветвления и плотность отростков.
Нейроглия делится на две основные категории в зависимости от размера: макроглия , и микроглия.Макроглия имеет эктодермальное происхождение и состоит из астроцитов , олигодендроцитов и эпендимальных клеток . Клетки Microglia , вероятно, мезодермального происхождения. Сравнение различных типов нейроглии показано на рисунке 8.11.
8,13 Макроглии
Щелкните глиальную клетку, чтобы перейти к соответствующему разделу. |
8.14 Протоплазматические астроциты
Протоплазматические астроциты находятся в основном в сером веществе. Со специфическими пятнами серебра или глии их клеточные тела и процессы очень нерегулярны. Эти отростки могут быть большими или очень мелкими, иногда образующими пласты, которые проходят между аксонами и дендритами и могут даже окружать синапсы.Эти тонкие пластинчатые отростки придают телу протоплазматической клетки астроцита «нечеткий» или мутный вид под световым микроскопом. В цитоплазме можно увидеть пучки тонких фибрилл. Ядро протоплазматического астроцита имеет эллипсоидную или бобовидную форму с характерными пятнами хроматина. Отмечены определенные типы межклеточных контактов между отростками протоплазматических астроцитов. Они, вероятно, опосредуют ионный обмен между клетками.
8.15 Волокнистые астроциты
Волокнистые астроциты обнаруживаются в основном в белом веществе, имеют более гладкий контур клеточного тела, чем протоплазматические астроциты, как видно из глиальных пятен, и имеют отростки, которые имеют тенденцию выходить из тела клетки радиально.Эти отростки более узкие и разветвляются, образуя концы ножек на кровеносных сосудах, эпендиме и мягкой мозговой оболочке. Следовательно, отростки фиброзных астроцитов не образуют листов и не имеют тенденции соответствовать форме окружающих нейронов или сосудистых элементов. Основной отличительной чертой фиброзных астроцитов, как следует из названия, является обилие глиальных фибрилл, расположенных параллельными рядами в цитоплазме и простирающихся в отростки.
При окрашивании по Нисслю фиброзные астроциты имеют ядро , по существу такое же, как у протоплазматического типа, с пятнистым внешним видом.Межклеточные соединения также наблюдались между фиброзными астроцитами.
Рис. 8.14 |
Оба типа астроцитов функционируют, чтобы поддерживать нейроны в непосредственной близости от них.Они создают физический барьер между клетками, поддерживают ионное и pH-равновесие внеклеточного пространства вокруг нейронов и постоянно изменяют химическую среду соседних клеток. Как показано на рис. 8.14, астроциты образуют сплошную оболочку вокруг внешней поверхности ЦНС ( глиальных лимитанов, ) и кровеносных сосудов ( периваскулярных стоп, ). Во время развития они образуют каркас, по которому нервные клетки мигрируют, чтобы достичь своей зрелой структуры. Во время травмы астроциты пролиферируют и фагоцитируют мертвых клеток.Это часто приводит к образованию глиального рубца .
Помимо этих общих функций, астроциты также действуют более специализированными способами, облегчая функцию нейронов. Они метаболизируют нейротрансмиттеры, удаляя их из синаптической щели. Например, глутамат аминокислоты поглощается астроцитами и инактивируется путем преобразования в глутамин. Затем глутамин транспортируется в нейрон для повторного синтеза в глутамат (см. Главу 13). Более свежие данные указывают на то, что астроциты могут резко изменять размер как часть физиологической регуляции нейрональной среды.Эти функции будут обсуждаться в следующих разделах.
8,16 Олигодендроглии
Щелкните глиальную клетку, чтобы перейти к соответствующему разделу. |
Олигодендроциты также расположены как в сером, так и в белом веществе. Это преобладающий тип клеток в белом веществе, где они часто располагаются в виде рядов клеток между группами нейрональных отростков. Они называются межпучковой олигодендроглии и участвуют в образовании и поддержании миелина, окружающего нейрональные отростки поблизости.В сером веществе олигодендроглии обычно располагаются около нейронов и, следовательно, известны как перинейрональные сателлитные клетки . Клеточные тела олигодендроглии часто располагаются около капилляров, но у них отсутствуют определенные периваскулярные концевые ножки, характерные для астроцитов.
Отростки олигодендроцитов меньше и более тонкие, чем астроциты, а форма тела клетки от многоугольной до сферической. Ядро олигодендроцита , меньше, чем у астроцита, эксцентрично расположено в теле клетки, содержит сгустки хроматина и может окрашиваться щелочными красителями.Цитоплазма олигодендроцитов имеет тенденцию быть темнее, чем у астроцитов с серебряными пятнами, и не содержит глиальных фибрилл (хотя они действительно содержат микротрубочек ).
Роль олигодендроглии в центральной нервной системе, особенно межпучковых олигодендроцитов , заключается в образовании и поддержании миелина. Миелин — это оболочка из мембранного материала, описанная д-ром Бирном, которая обертывает аксон нейрона, как показано на рисунке 8.15 для облегчения проведения потенциала действия посредством скачкообразной проводимости. Миелин состоит из концентрических слоев мембран, уплотненных друг относительно друга с внутренним (то есть против нервного волокна) и внешним воротником цитоплазмы. Как показано на рис. 8.15, один олигодендроцит способствует миелинизации нескольких соседних нервных отростков. Более того, более одного олигодендроцита вносят вклад в миелинизацию одного междоузлия аксона.Пластинки миелиновых мембран являются результатом спирального обертывания аксона цитоплазматическими отростками межпучковой олигодендроглии. Кроме того, олигодендроцит, образующий конкретный миелин междоузлия (то есть миелин между двумя узлами), редко можно увидеть непосредственно рядом с обернутым миелином отростком. Это связано с тем, что тонкие цитоплазматические мостики соединяют область тела клетки олигодендроцита с внешней оболочкой миелина. Важно отметить, что область аксона, открытая в узле Ранвье , не является голой.Это может быть место разветвления аксона, место синаптических контактов или оно может быть покрыто различными глиальными отростками. Аксон в узловой области обычно содержит скопления органелл, особенно митохондрий .
В периферической нервной системе (ПНС) шванновских клеток ответственны за образование миелина. Эти клетки миелинизируют аксоны иначе, чем межпучковые олигодендроглии. Как показано на рис. 8.16, они мигрируют вокруг аксона, закладывая мембрану, покрывающую аксон, выдавливая цитоплазму шванновской клетки.Кроме того, каждое междоузлия аксона ПНС представляет собой одну шванновскую клетку. Кроме того, немиелинизированные аксоны в ПНС также окружены мембранами, образованными шванновскими клетками.
Рис. 8.16. Просмотр ЭМ ячейки Шванна. |
8,17 Эпендима
Щелкните глиальную клетку, чтобы перейти к соответствующему разделу. |
Эпендимальные клетки происходят из зародышевого эпителия , выстилающего просвет нервной трубки , и, таким образом, также являются эктодермальными производными (наряду с нейронами, астроцитами и олигодендроцитами). Эпендимные клетки выстилают желудочков головного мозга и центральный канал спинного мозга спинного мозга . Они расположены в виде однослойного столбчатого эпителия и имеют многие гистологические характеристики простого эпителия, которые варьируются от плоского до кубовидного в зависимости от их расположения.Эпендима, образующая слизистую оболочку желудочков, не соединяется с базальной пластиной , а опирается непосредственно на нижележащую нервную ткань. Как показано на рис. 8.17, поверхность, обращенная к желудочку, содержит множество микроворсинок и ресничек . Эти реснички перемещают цереброспинальных жидкости ( CSF ) в желудочков . Боковые границы эпендимных клеток относительно прямые и образуют стыки с соседними клетками.
Эпендимные клетки видоизменяются в различных областях желудочков в слои кубовидного эпителия, которые действительно лежат на базальной мембране (образованной выростом мягкой мозговой оболочки) над богатым слоем сосудистой сети и соединительной ткани. Это сосудистая оболочка plexus , изученная в лаборатории, которая отвечает за секрецию, поглощение и транспортировку веществ в спинномозговую жидкость и из нее.
Рисунок 8.17 Просмотрите слой эпендима. |
8,18 Микроглия
Щелкните глиальную клетку, чтобы перейти к соответствующему разделу. |
Микроглия, в отличие от других типов глиальных клеток, происходит из эмбриональной мезодермы .Они присутствуют во всей центральной нервной системе, но обычно незаметны в зрелой нормальной ткани и их трудно идентифицировать с помощью светового или электронного микроскопа. Их больше в сером веществе, и они могут поражать до 5-10% нейроглии в коре головного мозга.
По общему виду микроглия похожа на олигодендроциты, хотя они меньше и имеют волнообразные отростки с шиповидными выступами. Ядра микроглии имеют удлиненную или треугольную форму и глубоко окрашиваются щелочными красителями.
После повреждения нервной ткани микроглии размножаются и мигрируют к месту повреждения, где они очищают клеточный дебрис путем фагоцитоза . Реагирующая микроглия имеет набухшую форму с укороченными отростками и ее трудно отличить от фагоцитов с периферии или мигрирующих периваскулярных клеток . Подсчитано, что по крайней мере одна треть фагоцитов, появляющихся в области поражения, имеет происхождение из ЦНС.
Проверьте свои знания
Какие из следующих типов клеток пролиферируют в ЦНС в ответ на повреждение? (Примечание: существует более одного правильного ответа.)
А. Нейроны
Б. Микроглия
C. Волокнистые астроциты
D. Протоплазматические астроциты
E. Макрофаги
Какие из следующих типов клеток пролиферируют в ЦНС в ответ на повреждение? (Примечание: существует более одного правильного ответа.)
A. Нейроны. Этот ответ НЕПРАВИЛЬНЫЙ.
Хотя в настоящее время спорным, перевес доказательств указывает на то, что нейроны не претерпевают деление клеток, когда они созреют в процессе развития организма.
Б. Микроглия
C. Волокнистые астроциты
D. Протоплазматические астроциты
E. Макрофаги
Какие из следующих типов клеток пролиферируют в ЦНС в ответ на повреждение? (Примечание: существует более одного правильного ответа.)
А. Нейроны
B. Microglia. Ответ ПРАВИЛЬНЫЙ!
Микроглия как делится, так и мигрирует в области клеточного повреждения в центральной нервной системе в ответ на повреждение.C. Волокнистые астроциты
D. Протоплазматические астроциты
E. Макрофаги
Какие из следующих типов клеток пролиферируют в ЦНС в ответ на повреждение? (Примечание: существует более одного правильного ответа.)
А. Нейроны
Б. Микроглия
C. Волокнистые астроциты. Ответ ПРАВИЛЬНЫЙ!
Как фиброзные, так и протоплазматические астроциты подвергаются клеточному делению в ответ на повреждение.D. Протоплазматические астроциты
E. Макрофаги
Какие из следующих типов клеток пролиферируют в ЦНС в ответ на повреждение? (Примечание: существует более одного правильного ответа.)
А. Нейроны
Б. Микроглия
C. Волокнистые астроциты
D. Протоплазматические астроциты. Ответ ПРАВИЛЬНЫЙ!
Как фиброзные, так и протоплазматические астроциты подвергаются клеточному делению в ответ на повреждение.
E. Макрофаги
Какие из следующих типов клеток пролиферируют в ЦНС в ответ на повреждение? (Примечание: существует более одного правильного ответа.)
А. Нейроны
Б. Микроглия
C. Волокнистые астроциты
D. Протоплазматические астроциты
E. Макрофаги. Ответ ПРАВИЛЬНЫЙ!
Макрофаги появляются в ЦНС после травмы и работают вместе с глиальными клетками ЦНС, фагоцитируя остатки ЦНС.
Какой из следующих типов клеток отвечает за поддержание pH внеклеточного пространства ЦНС? (Примечание: существует более одного правильного ответа.)
A. Микроглия
Б. Волокнистые астроциты
С.Протоплазматические астроциты
D. Эпендимные клетки
E. Макрофаги
Какой из следующих типов клеток отвечает за поддержание pH внеклеточного пространства ЦНС? (Примечание: существует более одного правильного ответа.)
A. Microglia. Этот ответ НЕПРАВИЛЬНЫЙ.
Б. Волокнистые астроциты
C. Протоплазматические астроциты
Д.Эпендимные клетки
E. Макрофаги
Какой из следующих типов клеток отвечает за поддержание pH внеклеточного пространства ЦНС? (Примечание: существует более одного правильного ответа.)
A. Микроглия
B. Волокнистые астроциты. Ответ ПРАВИЛЬНЫЙ!
C. Протоплазматические астроциты
D. Эпендимные клетки
E.Макрофаги
Какой из следующих типов клеток отвечает за поддержание pH внеклеточного пространства ЦНС? (Примечание: существует более одного правильного ответа.)
A. Микроглия
Б. Волокнистые астроциты
C. Протоплазматические астроциты. Ответ ПРАВИЛЬНЫЙ!
D. Эпендимные клетки
E. Макрофаги
Какой из следующих типов клеток отвечает за поддержание pH внеклеточного пространства ЦНС? (Примечание: существует более одного правильного ответа.)
A. Микроглия
Б. Волокнистые астроциты
C. Протоплазматические астроциты
D. Эпендимные клетки. Этот ответ НЕПРАВИЛЬНЫЙ.
E. Макрофаги
Какой из следующих типов клеток отвечает за поддержание pH внеклеточного пространства ЦНС? (Примечание: существует более одного правильного ответа.)
А.Микроглия
Б. Волокнистые астроциты
C. Протоплазматические астроциты
D. Эпендимные клетки
E. Макрофаги. Этот ответ НЕПРАВИЛЬНЫЙ.
Масштабируемость клеток и размер органелл
Органогенез.Апрель-июнь 2010 г .; 6 (2): 88–96.
Кафедра биохимии и биофизики; Калифорнийский университет в Сан-Франциско; Сан-Франциско, Калифорния, США
Автор, ответственный за переписку.Поступило 5 февраля 2010 г .; Принято 8 февраля 2010 г.
Эта статья цитируется в других статьях в PMC.Abstract
Каким образом контролируется размер — фундаментальный вопрос биологии. В этом обзоре мы обсуждаем использование масштабных соотношений, например степенных законов формы y ∝ x α , чтобы обеспечить основу для сравнения и интерпретации измерений размеров.Такой анализ может проиллюстрировать биологические и физические принципы, лежащие в основе наблюдаемых тенденций, как это было предложено для аллометрической зависимости скорости метаболизма или структуры конечностей от массы организма. Методы измерения размера на меньших масштабах продолжают совершенствоваться, что приводит к большему количеству данных по контролю размера в клетках и органеллах. Ожидается, что изменение размера этих структур будет влиять на характер роста, функциональную способность и внутриклеточный транспорт. Кроме того, органеллы, такие как ядро, митохондрии и эндоплазматический ретикулум, демонстрируют широко варьирующуюся морфологию, которая влияет на их свойства масштабирования.Мы даем краткое описание этих проблем для отдельных органелл и завершаем обсуждение того, как применить эту концепцию, чтобы лучше понять механизмы контроля размера в клеточной среде.
Ключевые слова: соотношения масштабирования , клетка, органелла, контроль размера, степенной закон, аллометрия
Введение
«Природа везде работает в масштабе, и все соответственно имеет свой размер». Этими словами 1 Д’Арси Вентворт Томпсон элегантно определяет то, что остается одной из великих загадок науки: регулирование размеров биологических организмов и их субструктур.Он также предлагает использовать масштабные соотношения — сравнение измерений в различных измерениях (как пространственных, так и временных) — как мощный инструмент для решения этого вопроса. Поскольку клетки образуют основу всех биологических структур, в этом обзоре мы исследуем масштабные отношения с клеточной точки зрения. Для начала мы вводим понятие масштабирования и его использование в биологии; в следующем разделе мы обсудим важность масштабирования для различных аспектов клеточной биологии; затем мы представляем эмпирические данные о масштабировании размеров конкретных органелл; наконец, мы делаем вывод о перспективе использования масштабного анализа, чтобы дать представление о молекулярных механизмах, которые составляют основу всей биологии.
При сравнении измерений размеров зависимость одной переменной от другой часто можно описать с помощью степенного отношения, где y ∝ x α . Например, площадь поверхности сферы A масштабируется как квадрат радиуса и объем, V , масштабируется как куб радиуса, или A ∝ r 2 и V ∞ r 3 . В биологии одним из наиболее часто описываемых масштабов этой формы является аллометрическая взаимосвязь между метаболизмом организма и массой тела, с противоречивыми доказательствами, основанными на измерениях гомеотерм, которые обычно интерпретируются как подтверждающие одно из двух широко описанных значений α = 2/3 (рассмотрено в исх. 2 ) или 3/4 (см. Ссылки 3 — 5 ). Продолжающееся исследование предмета предполагает, что даже существование универсального закона метаболического масштабирования вызывает некоторые сомнения, и что масштабирование может зависеть от подмножества исследуемых организмов. 6 , 7 Например, тепловыделение, измеренное в протистах по сравнению с размером ячейки, показывает значение α = 1 (см. Ссылку 8 ). Другим распространенным предметом масштабирования у макроскопических организмов является сравнение размеров опорных структур (конечностей, стеблей) и общей массы организма. 9 , 10 Чем больше габарит, тем больше нагрузка на опору, и сила, которую можно выдержать, пропорциональна диаметру этой опоры. Это ограничивает способ, которым размер таких структур масштабируется с общей массой, что имеет значение для максимального размера организмов и способов передвижения, возможных для конечностей с определенными размерами.
Эти примеры иллюстрируют, как масштабирование может использоваться для информирования нашего мышления о лежащих в основе биологических, химических и инженерных принципах конструирования организмов.Движущей силой анализа масштабирования обычно является предположение, что интересующая переменная каким-то образом связана с некоторым геометрически определенным параметром, для которого может быть получено масштабирование. В случае метаболизма масштабирование в 2/3 степени исторически было оправдано как следствие поддержания постоянной температуры у гомеотермных организмов. Точное соотношение масштабирования возникает из соотношения между объемом и площадью поверхности, где первое оценивается как пропорциональное массе тела, метаболизму и выработке тепла, а второе — скорости потери тепла телом. 11 Масштабирование в 3/4 степени было оправдано исследованием свойств транспортных сетей в более крупных организмах (которые часто имеют фрактальную природу) и того, как их геометрия масштабируется по мере роста. 12 Хотя споры по поводу того, какой из этих степенных показателей лучше всего описывает данные, продолжается, использование масштабирования обеспечивает основу для анализа результатов, а также руководство для будущих экспериментов, необходимых для проверки этих моделей.
На практике общий метод определения отношения масштабирования между двумя переменными заключается в преобразовании данных из линейных декартовых координат в логарифмический график (или полулогарифмический график, если предполагается экспоненциальная зависимость).Математически этот метод сводит задачу к линейной, наклон которой равен степенному показателю α (). Журнал-лог-анализ очень эффективен благодаря своей способности подбирать наборы данных, которые в противном случае было бы трудно интерпретировать. Однако пределы такого анализа обсуждались с упором на способность данных при экстремальных и резко отклоняющихся значениях искажать наиболее подходящее значение α. Из-за задействованных логарифмических преобразований α следует рассматривать как геометрическое, а не арифметическое среднее распределение возможных значений. 13 — 15
Иллюстрация использования логарифмических графиков для анализа степенных зависимостей масштабирования. Функции вида y = Cx α , где префактор C используется для нормализации графиков до желаемого диапазона. Функция построена для α = 1/2 (синий), 1 (красный), 3/2 (зеленый) и 2 (желтый) в линейных координатах (слева) и логарифмических координатах (справа). В логарифмических координатах линии имеют наклон = α и точку пересечения по оси y = log C .
На сегодняшний день свойства биологического масштабирования в основном анализируются для масштабов длины от уровня всего организма до уровня органов, тканей и целых клеток. Меньше всего было выполнено на уровне субклеточных органелл. Во многом это связано с тем, что соответствующие измерения размеров и функций относительно легче выполнять на более крупных организмах. В частности, дифракционный предел является основным препятствием для использования световой микроскопии для измерения размеров в масштабе микрометра или меньше.Такого рода экспериментальные проблемы ограничивают возможность сбора точных данных о размерах небольших и морфологически сложных клеточных и органеллярных структур. Однако постоянное совершенствование оборудования, методов и анализа изображений делает такие эксперименты возможными, а количественные измерения размеров субклеточных структур становятся все более рутинными. 16 — 18 Таким образом, пришло время изучить, как масштабирование относится к вопросам клеточной биологии.
Влияние масштабирования размеров на функции клеток и органелл
В структуре клеток важны несколько соотношений масштабирования. Один из них — это размерное масштабирование — как объем, площадь поверхности и длина ячеек и их подструктур соотносятся друг с другом по мере роста ячейки. Эти отношения зависят как от формы клетки, так и от того, как она растет. Рассмотрим случай, когда клетка удваивается в объеме до деления, а затем делится, образуя двух дочерей аналогичной формы ().В идеальном случае изотропного трехмерного роста сферической ячейки () удвоение объема требует примерно 60% увеличения площади поверхности и 25% увеличения диаметра. Существует несоответствие, поскольку объем увеличился вдвое, а площадь поверхности — нет. Следовательно, чтобы достичь подобия формы, делящиеся сферические клетки должны обеспечивать большую площадь поверхности мембраны 19 , 20 и / или удалять объем. 21 Различные соотношения масштабирования между размерами клеток могут быть достигнуты во время цикла клеточного деления для клеток с несферической формой клеток или поляризованным ростом.Для примерно цилиндрических делящихся дрожжей Schizosaccharomyces pombe рост клетки происходит за счет удлинения вдоль цилиндрической оси при сохранении площади поперечного сечения (). 22 Фактически, геометрия была уменьшена с трех измерений до одного, и поэтому увеличение объема линейно пропорционально как площади поверхности, так и осевой длине. Таким образом, деление клеток не требует резких изменений формы. Ситуация более сложная у почкующихся дрожжей, Saccharomyces cerevisiae , где объем материнских клеток остается в основном постоянным, в то время как размер зачатка показывает комбинацию поляризованного (или апикального) и изотропного роста (). 23 Здесь форма пары мать-почка непосредственно перед делением примерно в два раза превышает исходный объем и площадь поверхности, как и в случае с делящимися дрожжами. Однако увеличение объема и площади поверхности во время роста почек труднее сопоставить друг с другом.
Следующие рисунки иллюстрируют три модели роста клеток. В каждом случае ячейка (левая фиолетовая) растет, как показано серыми стрелками, пока общий объем ячейки ( V ) не увеличится в два раза по сравнению с исходным значением (средний фиолетовый) с некоторым увеличением площади поверхности ( A ).Разделение создает двух дочерних элементов (правая фиолетовая и желтая) с V и A , равными исходному значению. (I) Сферическая клетка изотропно растет в трех измерениях. Объем масштабируется иначе, чем площадь поверхности, оставляя несоответствие двух размеров во время разделения. (II) У делящихся дрожжей клетка растет вдоль длинной оси, поэтому V и A оба масштабируются по длине, L . (III) У почкующихся дрожжей клетка сначала испытывает поляризованный рост, чтобы сформировать почку, затем почка растет, пока не достигает размера материнской клетки.
Даже самый простой вопрос о том, как рост клеток изменяется со временем или прогрессирует по клеточному циклу, также был предметом интенсивных исследований и дискуссий. Двумя наиболее распространенными моделями роста клеток являются линейная и экспоненциальная, которые известны как решение уравнений нулевого и первого порядка. Как линейный 24 , так и экспоненциальный рост 25 , 26 были описаны в различных типах клеток, хотя эти возможности часто трудно различить, 27 , 28 и более сложные модели роста также имеют было сообщено. 26 , 29 , 30 В первом случае скорость увеличения размера ячейки (обычно измеряемая по объему) не зависит от ее текущего размера и предположительно является результатом фактор, ограничивающий рост, такой как импорт питательных веществ, который остается постоянным независимо от размера клеток. 24 Экспоненциальный рост происходит, когда существует линейная зависимость между скоростью роста и размером, предполагая, что более крупная клетка имеет пропорционально большую способность к метаболизму и росту. 28
На простом уровне клетки представляют собой мембранные структуры, которые включают более мелкие субструктуры или органеллы. Каждая из этих органелл выполняет определенную функцию и имеет характерную морфологию, хотя она варьируется от организма к организму. По мере роста клетки, как правило, органеллы также удовлетворяют более высокую потребность в их функциях. 31 Каким образом размер органелл зависит от размера клеток — это вопрос, привлекающий все большее внимание, поскольку достижения в области микроскопии и других методов визуализации позволяют лучше определять размер клеток и органелл.Простая модель, которую следует учитывать, состоит в том, что функциональная потребность в органеллах увеличивается с размером клетки и, соответственно, размер органелл увеличивается с прямым линейным масштабным соотношением. Однако даже в этой слишком базовой структуре возникает несколько вопросов. Какова соответствующая мера размера как для клетки, так и для органеллы? Отличается ли соответствующий размер клеток в органеллах? Какова взаимосвязь между размером и функцией органелл и как это можно измерить?
Морфология может влиять на функцию несколькими способами.Что касается емкости, интуитивно понятно, что по мере того, как органелла становится больше, она сможет выполнять больше функций, за которые она отвечает, включая метаболизм, передачу сигналов, хранение и гомеостаз. Большинство органелл имеют мембранную и просветную среду для выполнения этих функций, и эти параметры характеризуются площадью поверхности и объемом соответственно. Баланс между двухмерным и трехмерным размером определяет возможные формы органеллы.
Есть несколько транспортных факторов, которые могут зависеть от морфологии.Первый — это транспорт между органеллой и другими точками клетки. Централизованная органелла, такая как ядро, очевидно, будет отбирать образцы гораздо более ограниченной области клетки, чем распределенная сеть, и эта локализация может влиять на то, как долго доставляется груз к этой органелле и от нее. Кроме того, клеточный транспорт происходит посредством многих механизмов, и мы обсудим два из них: диффузию и активный транспорт с использованием моторных белков, перемещающихся по цитоскелету. Эти виды транспорта показывают разные зависимости среднего времени перевозки отрасстояние. Многие процессы передачи сигналов включают приток и последующую диффузию ионов Ca 2+ или других видов, которые обычно встречаются в различных концентрациях. 32 Эффективное расстояние, d , на которое передающий сигнал распространяется, масштабируется как квадратный корень из времени ( d ∝ t 1/2 ), и поэтому диффузия более эффективна на более коротких масштабах длины. Транспорт, опосредованный моторными белками, требует ввода АТФ и позволяет доставить груз в определенные места назначения.Пройденное расстояние линейно масштабируется со временем ( d ∝ t), что более эффективно, чем диффузия на больших масштабах длины. Затем происходит перенос материала изнутри органеллы наружу (или наоборот), что достигается с помощью ряда пассивных или активных механизмов. Скорость этих процессов, вероятно, частично ограничена размером мембраны или площадью поверхности в органелле, и отношение площади поверхности к объему может регулироваться для достижения соответствующего количества транспорта туда и обратно между внутренностями органеллы. и цитоплазма.Такая регуляция может привести к изменениям в количестве мембраны или просвета и может происходить в некоторой степени независимо для двух параметров, и это будет отражаться на общей форме органеллы.
Так же, как клетки демонстрируют разные модели роста, существует несколько способов увеличения размера органелл: (I) Изотропное трехмерное расширение обычно обнаруживается для более крупных круглых органелл, таких как ядро. (II) Распределенные сети, такие как митохондрии и трубчатый эндоплазматический ретикулум (ER) в определенных клетках, распространяются за счет увеличения линейной длины сети, сохраняя размеры поперечного сечения примерно постоянными.(III) Органеллы, существующие в множестве копий, можно просто увеличить в количестве, как в случае пероксисом. Возможны также комбинации этих масштабных свойств, как, например, в грибковой вакуоли, которая может быть обнаружена в единой круглой морфологии (I), а также в фрагментированном наборе более мелких пузырьков (III).
Более того, каждый из этих случаев имеет различные свойства масштабирования при увеличении размера органелл и клеток (). Линейное масштабирование объема между органеллой, демонстрирующей изотропный рост, и клеткой даст постоянное соотношение между размерами органеллы и клетки (пурпурная сфера).Имея только одну такую органеллу, легко оптимизировать расстояния переноса в другие места в клетке, поместив ее в центре. Однако наличие двух или более органелл обязательно нарушает эту симметрию, оставляя по крайней мере одну дальше от некоторых областей клетки. Этот эффект хорошо проиллюстрирован на микрофотографиях электронной томографии самого маленького известного эукариота, Ostreococcus tauri. Клетки O. tauri содержат только единичные копии нескольких органелл, которые плотно упакованы в относительно небольшой объем клетки, причем многие органеллы расположены на периферии клетки. 33 Из-за размеров этого организма все органеллы все еще находятся на небольшом расстоянии от всех других точек в объеме клетки. Однако с более крупными клетками эти расстояния будут увеличиваться, и это может быть причиной того, что у других организмов только небольшое количество органелл имеет такую морфологию. Таким образом, форма органелл может влиять на клеточную организацию.
Карикатура иллюстрации масштабирования органелл в зависимости от размера клетки. Ячейка справа вдвое больше диаметра левой.Восьмикратное увеличение объема клеток коррелирует с пропорциональным увеличением: (I) объема централизованной органеллы (фиолетовый), (II) общей длины сети трубчатых органелл (черные линии), (III) числа копий органелл с несколько копий (красный). Желтая органелла показывает эффект восьмикратного увеличения площади поверхности, а не объема централизованной органеллы.
Органеллы с сетчатой морфологией (и черные линии) или множественные копии (, красные сферы) могут быть более легко распределены по клетке по мере необходимости.Интересный сценарий возникает для линейных сетей, которые локализованы на периферии изотропно растущей клетки, как в случае митохондрий в S. cerevisiae . 34 Предполагая линейное масштабирование между объемом клетки и длиной органелл, по мере роста клетки ее площадь поверхности увеличивается как V клетка 2/3 , что означает пропорционально меньшую площадь на единицу длины сети, и увеличится площадь органеллы.Свойства сети, такие как разветвление и интервал, можно регулировать, чтобы приспособить масштабирование плотности к точке. Существует верхний предел того, насколько может быть достигнута упаковка, указывающий точку перехода, в которой сеть вынуждена войти в объем ячейки, чтобы получить доступ к большему доступному пространству. Имея в виду эти общие соображения, мы теперь рассмотрим масштабирование и регуляцию размера конкретных органелл.
Масштабирование размеров конкретных органелл
Ядро.
Вообще говоря, если клетка содержит ядро, оно будет содержать только одно, обычно имеющее форму одного сфероидального объекта, расположенного несколько в центре.Основная функция ядра — хранение и поддержание генетического материала, что влечет за собой репликацию ДНК и регуляцию транскрипции мРНК. Сборка рибосом также происходит в суборганелле, ядрышке. Важность ядра и относительно простая геометрия сделали его, пожалуй, наиболее изученной органеллой с точки зрения масштабирования. 35
Размер ядра в первом приближении будет связан с количеством ДНК в клетке, и поэтому его объем будет релевантным параметром размера для определения емкости.Размер ядра действительно коррелирует с размером генома 36 , 37 и плоидностью. 38 , 39 Поскольку хромосомная ДНК реплицируется во время S-фазы клеточного цикла, можно ожидать, что размер ядра будет зависеть от клеточного цикла. Такая тенденция наблюдалась в клетках HeLa, где объем ядра, рассчитанный по данным микроскопии, примерно удваивался к концу S-фазы. 40
Соотношение между ядерным и цитоплазматическим объемом, или кариоплазматическое соотношение, долгое время наблюдалось, поддерживая постоянное значение, 41 , 42 , что предполагает, что общий объем клетки или цитоплазмы является еще одним возможным регулятор размера ядра.Регулировка размера ядра при трансплантации между клетками различного размера поддерживает эту идею, 43 , как и возможное уменьшение макронуклеаров в гиперядерных Stentor клетках. 44 Более поздние исследования дрожжей S. cerevisiae 45 и S. pombe 46 показали общую линейную масштабную зависимость между экстраполированными объемами ядра и клетки. Масштабирование, по-видимому, не зависит от плоидности, при этом диплоиды имеют как более крупные ядра, так и более крупные размеры клеток, чем гаплоиды, примерно в аналогичных пропорциях. 46 , 47 Интересно, что размер ядра у S. cerevisiae и S. pombe не увеличивался резко в начале S-фазы (в отличие от клеток HeLa), чего можно было бы ожидать, если бы Содержание ДНК было основным определяющим фактором. 45 , 46 Кроме того, эксперименты с несколькими ядрами S. pombe показывают взаимосвязь между размером ядра и объемом соседней цитоплазмы, что дает больше доказательств у дрожжей механизма поддержания постоянного кариоплазматического соотношения. 46
Митохондрии.
Часто митохондрии в эукариотической клетке будут организованы в сеть с ответвлениями, содержащими отдельные единицы, соединенные кончиком к кончику, 48 , хотя также могут быть обнаружены другие морфологии, такие как изолированные или агрегированные единицы. 49 Индивидуумы остаются отдельными, но постоянно участвуют в событиях слияния и деления, которые необходимы для поддержания общей морфологии. 50 , 51 Было обнаружено, что число копий митохондриальной ДНК (мтДНК) больше для более крупных клеток, 52 , и хотя мтДНК не была определенно связана с количеством митохондрий, 53 общее значение состоит в том, что больше клетки содержат больше митохондрий.В клетках HeLa соотношение количества митохондрий, площади внешней мембраны и объема по отношению к объему цитоплазмы является постоянным на протяжении всего клеточного цикла. 54 Линейное масштабирование размеров связано с тем, что форма митохондриальной единицы примерно постоянна, а расширение митохондриальной сети увеличивает длину, сохраняя при этом площадь внешней поверхности и объем на единицу длины.
Митохондрии имеют внешнюю мембрану, которая определяет каноническую форму таблетки снаружи органеллы.Заключительные реакции, ведущие к синтезу АТФ, происходят через внутреннюю мембрану, которая имеет множество крист, возможно, частично для увеличения способности органелл к этим реакциям. Следовательно, топология внешней и внутренней мембран должна быть сбалансирована с тремя отдельными объемами (цитоплазма, межмембранное пространство, внутренний матрикс). Синтезированный АТФ транспортируется через мембраны органелл, затем диффундирует по клетке, обеспечивая химическую движущую силу для других функций. Морфология сети митохондрий помогает оптимизировать эти транспортные проблемы, потому что она имеет увеличенное соотношение площади поверхности к объему по сравнению со сферической органеллой и позволяет распределяться по клетке. 12 , 55 Такие сети могут быть спроектированы так, чтобы гарантировать минимальное расстояние до других частей клетки, что может привести к зависимости между морфологиями митохондрий и клеток.
Эндоплазматическая сеть.
ER, возможно, морфологически наиболее сложная органелла, и ее можно разделить на несколько различных типов. Rough ER (rER) украшен рибосомами и в значительной степени отвечает за синтез и транслокацию белка. Функции, выполняемые гладким ER (sER), варьируются от метаболизма липидов в мембране до накопления кальция в просвете.Другие типы ER включают переходный ER (tER) — сайты доставки белка в почкующиеся пузырьки для входа в секреторный путь — и ядерную оболочку — сайт транспорта в ядро и из ядра. Эти классы могут иметь различную морфологию, начиная от сетей канальцев и заканчивая более крупными листами и двойной мембранной оболочкой ядерной оболочки. Различные кривизны мембраны в rER и sER были предложены как способ сортировки белков и сохранения их функций в физически разделенных областях. 56
Измерение общего количества ER во всех этих отдельных и сложных структурах обычно затруднено, и недавние разработки методов измерения свойств сети обещают предоставить новое понимание морфологии ER и масштабирования размера. 57 Такое количественное определение позволит проанализировать, поддерживаются ли разветвление и плотность ER постоянными по отношению к размеру клетки. Было показано, что размер ER зависит от функциональной потребности, причем rER и sER пролиферируют, когда требуется большее количество секреции и детоксикации, соответственно 58 — 60 Одним из интересных путей, влияющих на пролиферацию ER, является ответ развернутого белка (UPR ), во время которого накопление неправильно свернутых белков в просвете ЭПР запускает серию ответов, включая активацию белков просвета и синтез липидов. 61 Таким образом, UPR вызывает изменения как в объеме, так и в поверхностных количествах, как это наблюдалось для rER и было предложено как основную роль в биогенезе ER. 62
ER также тесно связан или даже непрерывен со многими другими органеллами, включая митохондрии 63 — 66 и плазматическую мембрану. 67 , 68 Эти соединения обеспечивают быстрые механизмы переноса ионов и вновь синтезированных липидов, а также накладывают ограничения на распределение ER.Таким образом, то, как размер ER масштабируется с размером клетки, вероятно, будет иметь некоторую обратную связь с ростом др. Органелл.
Аппарат Гольджи.
Секреторные везикулы, содержащие вновь синтезированные белки из ER, доставляются в Golgi. Здесь белки посттрансляционно модифицируются, а затем сортируются для доставки через секреторный путь в соответствующие конечные пункты назначения. Гольджи — это набор мембранных цистерн, которые могут быть отдельными и распределенными, как у почкующихся дрожжей, или располагаться в стопке, как в клетках животных.Структура стопки имеет полярность с цис- и транс-гранью, часто ориентированными на ER и ядро (или плазматическую мембрану) соответственно. 69 Насколько нам известно, только ограниченные измерения были выполнены непосредственно для размера Гольджи, и его масштабирование с размером ячейки еще не измерено. 70 , 71 Кажется вероятным, что общий размер будет определяться динамическим равновесием между пузырьками, доставленными в органеллу и отпочковавшимися из нее.
Вакуоль / лизосома.
Морфология грибковых вакуолей очень изменчива и динамична. У дрожжей вакуоль может существовать как где угодно, от одной круглой структуры до набора более мелких структур. 72 Он становится более или менее фрагментированным посредством механизмов слияния и деления, 73 — 75 и переходит в более сложные структуры во время деления клеток. 76 Морфология органелл сильно зависит от окружающей среды, и ее динамика зависит от различных сигналов.У S. cerevisiae обнаружена корреляция между большим размером вакуолей и истощением питательных веществ, что, возможно, указывает на большую потребность в функциях рециркуляции вакуолей для продолжения синтеза необходимых белков при наличии ограниченных ресурсов. Вакуоль также играет большую роль в ответ на осмотический стресс. 77 , 78 Измерения на S. pombe показали, что слияние вакуолей и набухание составляют один из компонентов реакции клетки на гипоосмотические условия. 79 Это увеличивает возможный диапазон масштабирования объема вакуоли на единицу площади поверхности и увеличивает способность вакуоли поглощать избыточную воду и буферизовать концентрацию осмолита клетки. Было идентифицировано большое количество мутаций, которые классифицируются по их влиянию на морфологию вакуолей, и они будут полезны для измерения взаимосвязи между масштабированием размера и функцией. 80 — 83 Вакуоли растений демонстрируют схожее разнообразие возможных структур, хотя иногда они отличаются тем, что они часто занимают более половины доступного объема клеток.Таким образом, в дополнение к функциям, перечисленным выше для дрожжей, они также поддерживают тургорное давление для структурной поддержки клетки. 84
Лиосомы в клетках животных обычно не являются централизованными органеллами, а скорее существуют в виде более мелких круглых структур, присутствующих в больших копиях 85 , или в виде трубчатой сети. 86 Они транспортируются по микротрубочкам, 87 , и это может позволить им отбирать образцы большего объема клетки на предмет элементов, которые необходимо разложить.Недавние исследования пролили свет на генетические механизмы, связывающие биогенез лизосом с потребностью клеток в его функции. 88
Множественные органеллы.
Клетка содержит множество органелл, которые обычно существуют в нескольких дискретных копиях. Пероксисомы, например, представляют собой относительно небольшие круглые везикуло-подобные структуры, ответственные за детоксикацию пероксида и окисление жирных кислот. Имея несколько копий, они могут быть распределены по ячейке по мере необходимости. Они способны сливаться, 89 они делятся во время клеточного цикла, и они пролиферируют и разлагаются в ответ на сигналы окружающей среды. 90 Изменчивость количества и размера пероксисом может затруднить определение корреляции с общим размером клеток. Центриоли, с другой стороны, помогают организовать митотическое веретено, а также могут действовать, чтобы закрепить реснички на клеточной мембране. Обычно они присутствуют в клетке в определенном количестве, и это подразумевает строгую регуляцию репликации и сегрегации во время цикла деления клетки. У инфузорий одноклеточные организмы могут содержать сотни или тысячи центриолей и ресничек, и было показано, что количество центриолей линейно зависит от длины клетки, что указывает на координацию между производством центриолей и ростом клеток. 91
Реснички.
Как органелла, которая выступает из поверхности, ресничка (жгутик) представляет собой особый случай масштабирования, поскольку она не испытывает тех же ограничений по размеру, что и другие внутренние клеточные структуры. Связь с основным телом клетки ограничивается точкой прикрепления на мембране. Как количество ресничек, так и их длина сильно различаются для разных типов клеток, что и ожидается для клеток с разными функциями и требованиями к подвижности.Геометрия ресничек в первую очередь измеряется их длиной, которая влияет на типы биений, возможных для создания движения. Масштабный анализ силы, оказываемой ресничкой, показывает, что результирующая скорость жидкости выражается как обратный квадрат длины реснички. 92 Теоретические модели, основанные на подобных масштабных представлениях, могут дать представление о возможных микроскопических механизмах, с помощью которых достигается наблюдаемое биение. 93 Длина ресничек, по-видимому, линейно масштабируется с диаметром клеток (Marshall WF, неопубликованные данные), и сообщалось о мутантах, которые одновременно изменяют как размер клеток, так и длину ресничек. 94 Это масштабное соотношение может отражать тот факт, что размер клетки определяет скорость синтеза белков ресничек, что, в свою очередь, влияет на скорость роста ресничек. 95
Благодаря относительно простой геометрии механизмы, влияющие на длину ресничек, были широко изучены, что дало много понимания основных принципов контроля размера органелл. 96 Как предлагается в модели точки равновесия, длина этой динамической псевдоодномерной структуры зависит от конкуренции между ростом и разборкой. 97 , 98 Хотя скорость разборки относительно постоянна, скорость роста зависит от нескольких факторов, включая длину жгутиков, частоту впрыскивания строительного материала из клетки, количество строительного материала на инъекцию и скорость при котором этот материал доставляется к кончику жгутика. 99 Механизмы, влияющие на некоторые из этих переменных, все еще в значительной степени неизвестны, но скорость транспортировки различных белковых комплексов груза была измерена у многих различных организмов. 100 , 101
Применение и интерпретация анализа масштабирования в клеточной биологии
Интерпретация данных в контексте масштабирования сталкивается с несколькими проблемами. Во-первых, какие параметры размера органелл нужно сравнивать? Для трехмерных объектов обычно необходимо измерять три параметра: длину, площадь поверхности и объем. Это дает на первый взгляд девять возможных сравнений размеров двух структур, и это число быстро растет с каждым отдельным объектом или переменной (время, плотность, субпопуляции), которые необходимо включить.Некоторые подмножества этих масштабных отношений часто оказываются избыточными и поэтому не предоставляют дополнительной информации. Например, в случае, когда две структуры демонстрируют одинаковый образец роста (т. Е. Изотропный, удлинение и т. Д.), Сравнения длина-длина, площадь-площадь и объем-объем будут показывать одинаковые тенденции масштабирования (, фиолетовый объект) . Или, в случае определенных геометрических форм (например, для сферы), где длина, площадь поверхности и / или площадь объема легко связаны друг с другом, различные масштабы этих параметров будут предсказуемыми.Предположения, основанные на гипотезах, и предварительные знания, конечно, также могут быть использованы для ограничения параметров для сравнения. Остальные соотношения масштабирования можно анализировать индивидуально с помощью математических методов, представленных ранее. После обнаружения определенные тенденции масштабирования, как правило, проще обосновать существующими моделями, как это обсуждалось с линейными и экспоненциальными темпами роста или степенными отношениями, которые могут быть выведены из основных кинетических или геометрических принципов.
Во-вторых, что говорит нам масштабирование, особенно в случае органелл и клеточной биологии? Масштабирование размера подразумевает механизм как для восприятия, так и для контроля.Это может быть достигнуто как непосредственно как основная функция какого-либо регулирующего пути, так и косвенно как следствие действий других процессов. В любом случае характер масштабирования может предоставить информацию о том, какие параметры важны для определения размера. Как обсуждалось, возможные регуляторные элементы для размера ядра включают общее количество ДНК и поддержание постоянной пропорции к объему цитоплазмы. Функциональная необходимость варьируется в зависимости от типа ткани и влияет на размер и плотность митохондрий, которые в мышечных клетках обычно выше, чем в других органах. 102 Макроскопически-микроскопическая функциональная связь также обнаружена между уровнем физической подготовки человека и митохондриальной массой. 103
Масштабный анализ размера также может дать представление о том, как морфология органелл зависит от способа, которым она построена (и наоборот). Изменения в мембране и объеме просвета должны быть скоординированы, чтобы органеллы достигли своей правильной формы. 104 Для органелл, таких как грибковая вакуоль, липид доставляется через везикулы в секреторных или эндосомных путях переноса, которые обычно имеют гораздо более высокое соотношение мембрана-просвет, чем конечная структура.Затем для поддержания общей морфологии органеллы требуется приток воды, а это дополнительно требует транспорта осмолита для поддержания осмотического баланса. Эти функции регулируются градиентами концентрации и мембранными каналами, которые отвечают за диффузию и активный транспорт через мембрану. Другой пример — это контроль размера участков белка tER на ER. В модели, предложенной Гликом, сайт tER растет за счет агрегации белков и сжимается за счет удаления белка в зарождающихся пузырьках.Скорость этих процессов зависит от окружности участка и площади, соответственно, и конкуренция между ними определяет размер участка в установившемся состоянии. 105 Почкование и слияние пузырьков из ER, в свою очередь, влияет на формирование и созревание цистерн Гольджи.
Принцип динамического контроля размера (который был описан в модели точки баланса для контроля длины ресничек) применим также к др. Органеллам, все из которых обладают механизмами увеличения и уменьшения размера.Митохондрии могут делиться путем деления. Гольджи, вакуоль и плазматическая мембрана увеличивают количество липидов за счет слияния везикул. Как место синтеза липидов, ER может расширяться на основе диффузии липидов внутри его мембраны, и этот процесс может иметь отношение к росту мембран в других органеллах, продолжающих ER. Уменьшение размера органелл может происходить за счет образования пузырьков, эндоцитоза, разделения на дочерние клетки и аутофагии. Относительный вклад этих конкурирующих процессов приводит к росту или сокращению, а масштабирование и динамика размеров обеспечивают основу для интерпретации этих изменений.
Два недавних исследования процессов деления клеток показывают важность масштабирования для понимания динамики субклеточных структур. 106 Хара и Кимура обнаружили, что митотическое веретено и скорость его удлинения зависят от размера клетки, 107 и Carvalho et al. обнаружили, что время закрытия сократительного кольца во время цитокинеза не зависит от размера клетки. 107 В обоих исследованиях масштабирование используется для разработки моделей для объяснения наблюдаемого поведения на основе белков и задействованных сил, и, таким образом, они иллюстрируют, как в сочетании с генетикой и биохимией анализ масштабирования по размеру приводит к пониманию молекулярных механизмов, которые в конечном итоге управляют всеми клеточными процессами.По мере совершенствования экспериментальных методов измерения размеров на субклеточных масштабах мы будем лучше понимать принципы того, как контролируются размеры клеток и органелл.
Таблица 1
Сводка характеристик и функций различных органелл, связанных с масштабированием по размеру
| Форма | Номер | Функции | Транспорт | Вместимость | |
| центральный отсек | Один | Хранение генетической информации (обычно только одна / две копии), транскрипция | Ядерные поры опосредуют транспорт мРНК, рибосом и т. Д. | Хранение и транскрипция ДНК в просвете, транспорт через мембрану | |
| ER | Много: распределенная сеть канальцев, большие листы, ядерная оболочка | Одна сеть | Синтез белков / мембран, транслокация, трафик | Доставка белков / липидов через отрастающие везикулы в секреторный путь или через диффузию | Ca 2+ хранение в просвете, трансляцию белков и синтез липидов в мембране |
| Golgi | Множественные дискообразные цистерны, иногда расположенные в стопке | Одна к множественный | Перемещение / сортировка белков, посттрансляционная модификация, синтез липидов | Белки входят и выходят посредством доставки секреторных пузырьков и отпочкования | Модификация белков в просвете и мембране, слияние / отрастание пузырьков на мембране |
| Вакуоль / лизосома | Сгруппированные или распределенные сферические отсеки 904 24 | От одного к нескольким людям | Распад, хранение и переработка отходов, стрессовая реакция, аутофагия | Мембранные каналы и слияние везикул доставляют мембрану, цитоплазму, белки и т. Д. | Просвет — это место, где происходит большая часть обработки, хранения и буферизации |
| Митохондрии | Варьируется: общая распределенная линейная сеть, иногда сгруппированные | Одна сеть, содержащая множество людей | Дыхание, синтез липидов | Переносимые метаболиты и продукты дыхания через мембрану | Длина и количество связаны с дыхательной способностью |
| Пероксисома | Отдельные маленькие сферические структуры | Несколько особей | Обработка отходов | Отдельные органеллы переносятся вдоль цитоскелета | Увеличивается с числом и индивидуальным размером |
| Жгутики / реснички | Удлиненные и трубчатые | Один или несколько особей | Движение, химическое восприятие | Транспорт клеток и ресничек происходит через поры мембраны, внутрицилиарный транспорт по центральным микротрубочкам | Ленг Это влияет на характер ударов / биений, подвижность клеток |
Благодарности
Мы хотели бы поблагодарить Уилла Лудингтона и Сюзанну Рафельски за полезные комментарии.Y.-H.M.C. благодарит стипендию доктора наук Герберта Бойера за поддержку. W.F.M. благодарит за поддержку программы Searle Scholars Program и W.M. Фонд Кека.

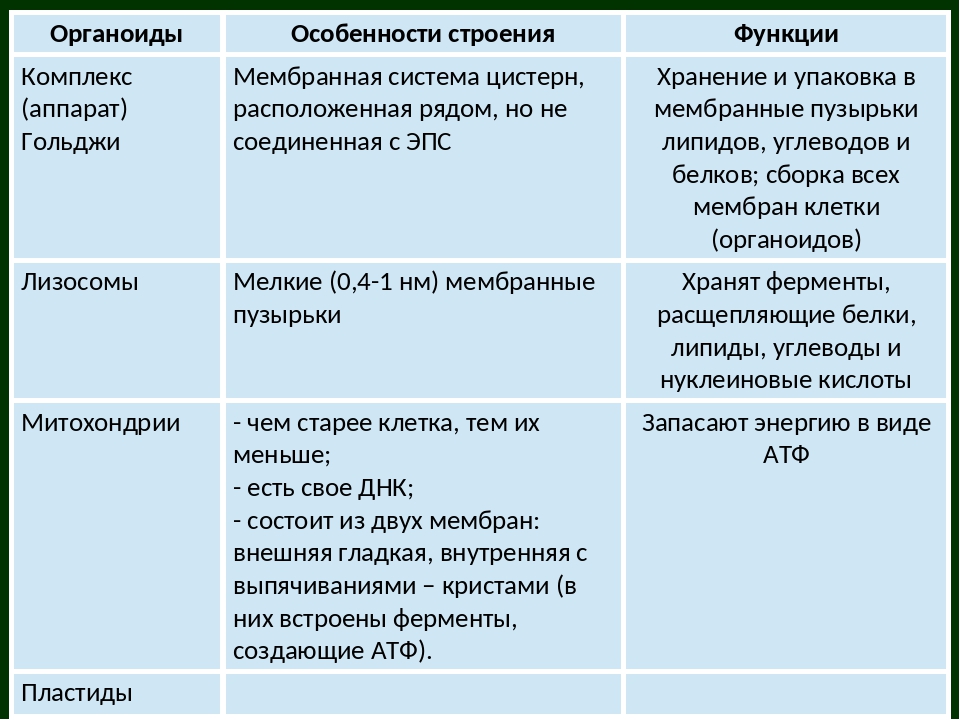 Уберите лишнее.
Уберите лишнее.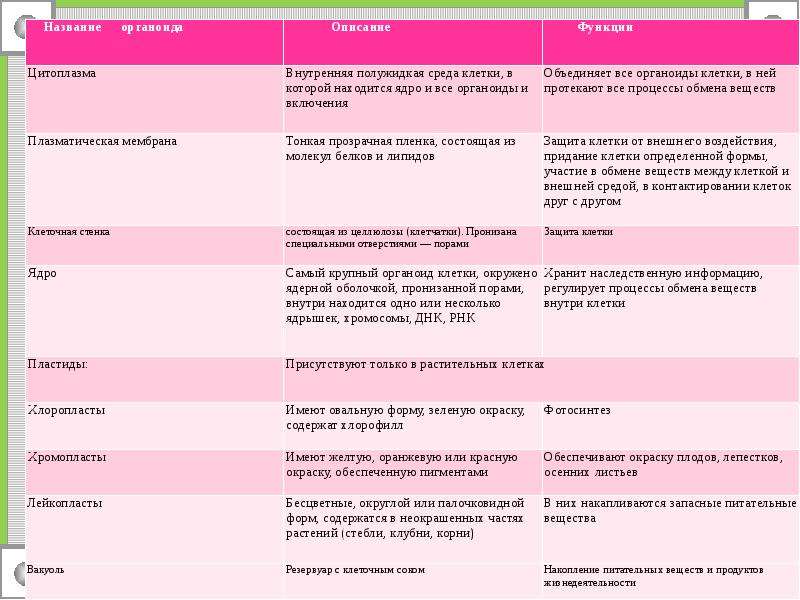 Уберите лишнее. (3 балла)
Уберите лишнее. (3 балла) Уберите лишнее. (3 балла)
Уберите лишнее. (3 балла)
 Образование РНК НЕ происходит в:
Образование РНК НЕ происходит в: Заполните пробелы, пользуясь подсказками в скобках. (3 балла)
Заполните пробелы, пользуясь подсказками в скобках. (3 балла)

 8.5 (см. Увеличенное изображение)
8.5 (см. Увеличенное изображение)  Это сферические пузырьки в нервных окончаниях возбуждения, показанные на рис. 8.6. В тормозных нейронах синаптические пузырьки часто уплощены, как показано на рис. 8.7.
Это сферические пузырьки в нервных окончаниях возбуждения, показанные на рис. 8.6. В тормозных нейронах синаптические пузырьки часто уплощены, как показано на рис. 8.7.
Leave A Comment