Ответов пока нет | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Изменение свойств простых веществ и соединений элементов в группах и периодах 11 класс онлайн-подготовка на Ростелеком
Тема 2: Строение атома. Периодический закон
Периодический закон
- Видео
- Тренажер
- Теория
Сущность явления периодичности
Периодичность означает повторение физических и химических свойств элементов и их соединений через определенные интервалы.
Например, щелочные металлы (элементы IА подгруппы) располагаются в таблице через каждые 8 или 18 элементов. Во всех атомах щелочных металлов на последнем электронном слое находится по 1 электрону, который они легко отдают, выступая в роли восстановителей. Элементы галогены располагаются в периодической системе в VIIА подгруппе, на внешнем слое в их атомах находится 7 электронов. Галогены – типичные неметаллы, сильные окислители, причем сходны состав и свойства образуемых ими не только простых, но и сложных веществ.
Следовательно, периодичность свойств элементов и их соединений обусловлена повторением электронных конфигураций атомов. В этом заключается физический смысл периодического закона.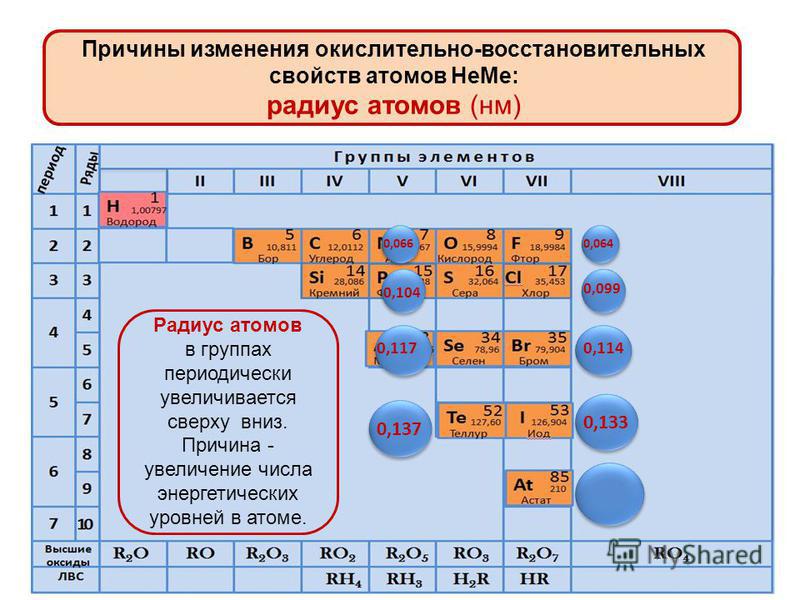
Изменение свойств элементов в периодах
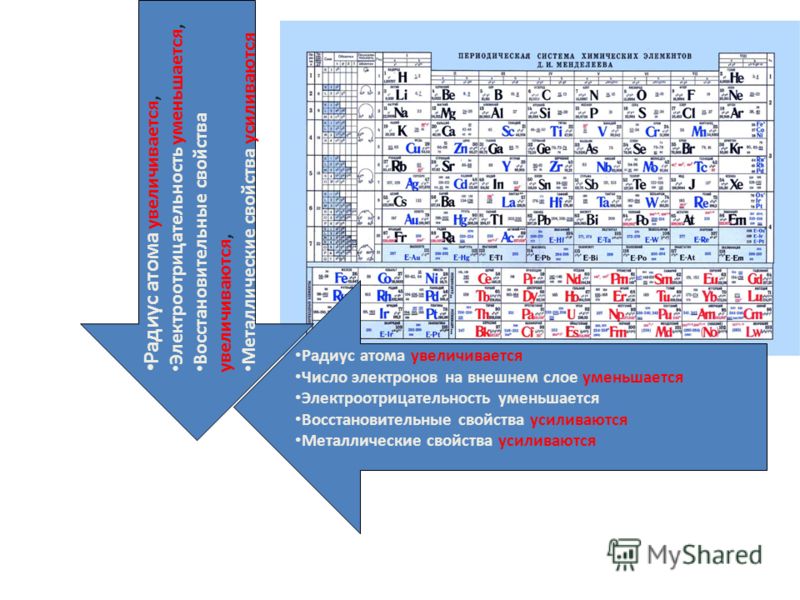
В периодах с увеличением заряда ядра происходит последовательное увеличение числа электронов на внешнем уровне и уменьшение радиусов атомов (рис. 1).
Рис. 1. Изменение радиуса атомов в периоде
Так как возрастает притяжение электронов к ядру, увеличивается относительная электроотрицательность. Металлические и восстановительные свойства простых веществ, образуемых атомами этих элементов, убывают, все труднее становится атомам отдавать электроны. Неметаллические и окислительные свойства нарастают (Таблица 1).
Таблица 1. Некоторые свойства элементов второго периода и образованных ими веществ
|
Группа |
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
|
1. |
3Li |
4Be |
5B |
6C |
7N |
8O |
9F |
10Ne |
|
2. Строение внешнего энергетического уровня |
2s1 |
2s2 |
2s22p1 |
2s22p2 |
2s22p3 |
2s22p4 |
2s22p5 |
2s22p6 |
|
3. |
0,159 |
0,104 |
0,078 |
0,062 |
0,052 |
0,045 |
0,040 |
0,035 |
|
4. Относительная электроотрицательность |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
— |
|
5. Свойства простого вещества |
Щелочной металл |
Металл |
Неметалл |
Неметалл |
Неметалл |
Активный неметалл |
Очень активный неметалл |
Благородный газ |
|
6. |
Сильный восстановитель |
Восстановитель |
Слабый окислитель |
Слабый окислитель |
Окислитель |
Сильный окислитель |
Очень сильный окислитель |
Химически инертен |
|
7. Кислотно-основные свойства высших оксида и гидроксида |
+1 Li2O основный оксид LiOH сильное основание |
+2 BeO амфотерный оксид
Be(OH)2 амфотерный гидроксид |
+3 B2O3 кислотный оксид
H3BO3 очень слабая кислота |
+4 CO2 кислотный оксид
H2CO3 слабая кислота |
+5 N2O5 кислотный оксид
HNO3 сильная кислота |
—— |
—— |
—— |
|
8. |
—— |
—— |
—— |
СН4 безразличные |
NH3 основные |
H2O амфотерные |
HF кислотные |
Изменение свойств элементов в группах
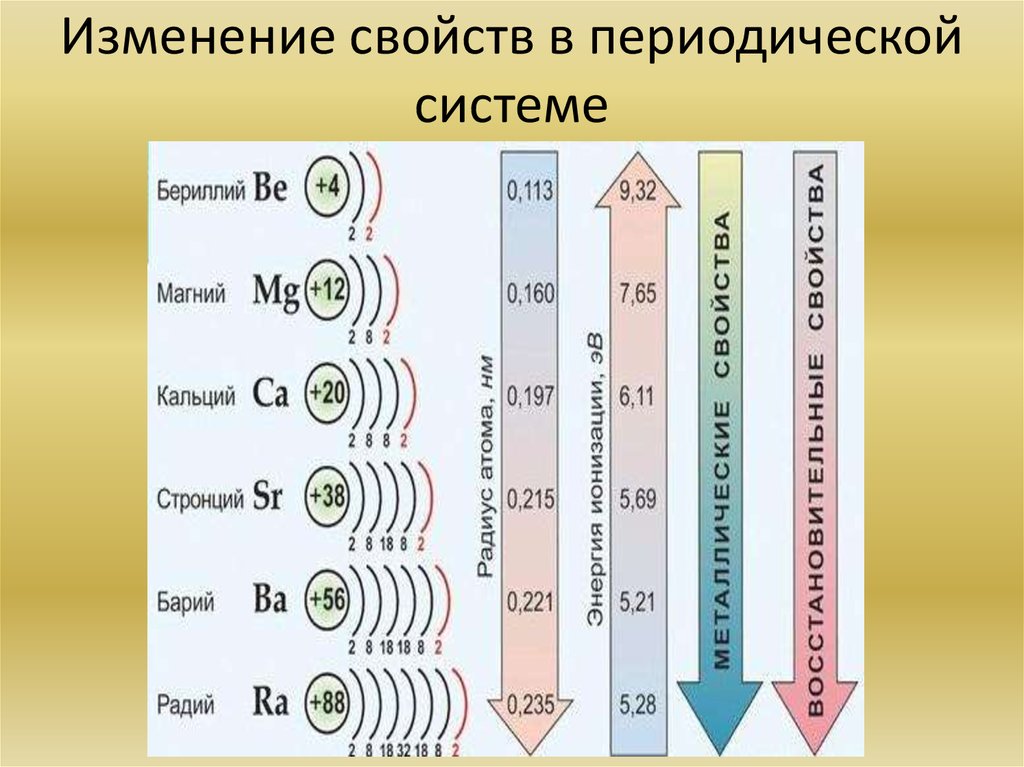
В главных подгруппах с увеличением заряда ядра атомов (сверху вниз) радиусы атомов увеличиваются, следовательно, электроотрицательность, окислительные и неметаллические свойства ослабевают.
Рассмотрим некоторые закономерности изменения свойств элементов и их соединений на примере элементов главной подгруппы II группы (Таблица 2).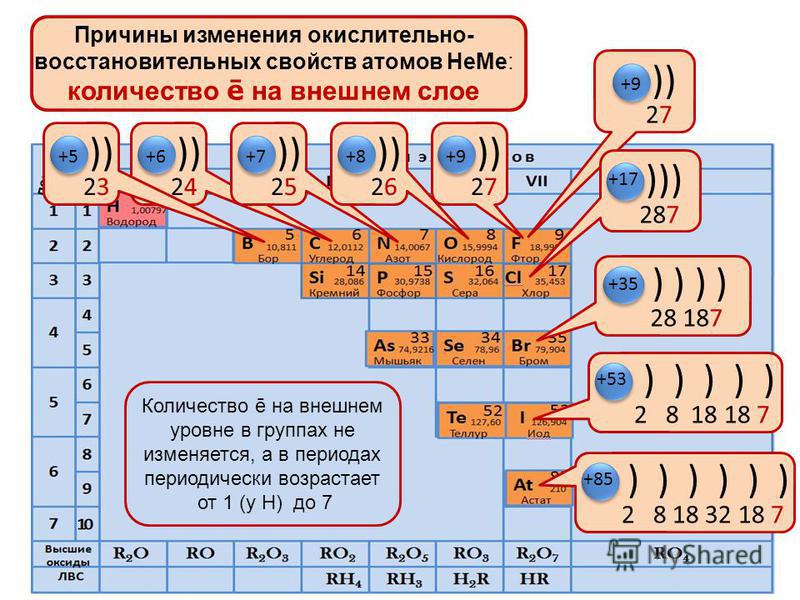 Во IIА подгруппе с увеличением заряда ядра сверху вниз увеличивается радиус атомов, т. к. при неизменном количестве внешних электронов увеличивается число занятых электронами энергетических уровней. Относительная электроотрицательность уменьшается. Свойства оксидов и гидроксидов этих элементов изменяются от амфотерных к основным.
Во IIА подгруппе с увеличением заряда ядра сверху вниз увеличивается радиус атомов, т. к. при неизменном количестве внешних электронов увеличивается число занятых электронами энергетических уровней. Относительная электроотрицательность уменьшается. Свойства оксидов и гидроксидов этих элементов изменяются от амфотерных к основным.
Таблица 2. Некоторые свойства элементов IIА подгруппы и их соединений
Для элементов VIIА подгруппы и их соединений наблюдаются те же закономерности (Таблица 3).
Таблица 3. Некоторые свойства элементов VIIА подгруппы и их соединений
Подведение итогов урока
На данном уроке была рассмотрена периодическая зависимость наиболее важных свойств атомов химических элементов и их соединений от зарядов ядер атомов. Вы узнали, как предсказать свойства элементов и образованных ими веществ на основании их положения в Периодической системе.
Список литературы
- Новошинский И. И., Новошинская Н.
 С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008 (§§ 6, 7).
С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008 (§§ 6, 7). - Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учеб. для общеобраз. учрежд.: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2010 (§3).
- Радецкий А. М. Химия. Дидактический материал. 10–11 классы. – М.: Просвещение, 2011.
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008 (с. 35–36).
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «mok-chem.ru» (Источник)
- Интернет-портал «distant-lessons.ru» (Источник)
- Интернет-портал «alhimik.ru» (Источник)
Домашнее задание
- с. 35 №№ 6.2, 6.6, 6.11 из Сборника задач и упражнений по химии для средней школы (Хомченко И.
 Д.), 2008.
Д.), 2008. - Напишите формулы летучих водородных соединений химических элементов третьего периода. Выберите их них вещество, которое наиболее активно реагирует: а) со щелочью; б) с кислотой.
Заметили ошибку?
Расскажите нам об ошибке, и мы ее исправим.Видеоурок: Изменение свойств простых веществ и соединений элементов в группах и периодах по предмету Химия за 11 класс.
6.15: Периодические тренды — Атомный радиус
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53707
 0(откроется в новом окне))
0(откроется в новом окне))Как все эти люди могут поместиться в таком маленьком пространстве?
Мероприятия привлекают к себе большое количество людей. Даже мероприятие на открытом воздухе может быть заполнено так, что места для большего количества людей просто не останется. Вместимость толпы зависит от количества места в зале, а количество места зависит от размера заполняющих его объектов. Мы можем поместить в заданное пространство больше людей, чем слоны, потому что слоны крупнее людей. По той же причине мы можем поместить в одно и то же пространство больше белок, чем людей. Знание размеров объектов, с которыми предстоит работать, может быть важным при принятии решения о том, сколько места необходимо.
Атомный радиус
Размер атомов важен для объяснения поведения атомов или соединений. Одним из способов выражения размера атомов является использование атомных радиусов . Эти данные помогают нам понять, почему некоторые молекулы подходят друг другу и почему части других молекул становятся слишком тесными при определенных условиях.
Размер атома определяется краем его орбитали. Однако границы орбит нечеткие и меняются в разных условиях. Чтобы стандартизировать измерение атомных радиусов, измеряется расстояние между ядрами двух одинаковых атомов, связанных вместе. Атомный радиус определяется как половина расстояния между ядрами идентичных атомов, связанных вместе. 9{-12}\) метров. Например, межъядерное расстояние между двумя атомами водорода в молекуле \(\ce{H_2}\) составляет \(74 \: \text{pm}\). Следовательно, атомный радиус атома водорода равен \(\frac{74}{2} = 37 \: \text{pm}\).
Рисунок \(\PageIndex{3}\): Атомные радиусы репрезентативных элементов, измеренные в пикометрах. (Источник: Christopher Auyeung; Источник: CK-12 Foundation; Лицензия: CC BY-NC 3.0 (открывается в новом окне))Периодическая тенденция
Атомный радиус атомов обычно уменьшается слева направо по периоду. Есть несколько небольших исключений, например, радиус кислорода немного больше, чем радиус азота. В течение определенного периода протоны добавляются к ядру по мере того, как электроны добавляются к тому же основному энергетическому уровню. Эти электроны постепенно притягиваются ближе к ядру из-за его повышенного положительного заряда. Поскольку сила притяжения между ядрами и электронами увеличивается, размер атомов уменьшается. Эффект уменьшается по мере продвижения вправо за период из-за отталкивания электронов, которое в противном случае привело бы к увеличению размера атома.
Эти электроны постепенно притягиваются ближе к ядру из-за его повышенного положительного заряда. Поскольку сила притяжения между ядрами и электронами увеличивается, размер атомов уменьшается. Эффект уменьшается по мере продвижения вправо за период из-за отталкивания электронов, которое в противном случае привело бы к увеличению размера атома.
Group Trend
Атомный радиус атомов внутри группы обычно увеличивается сверху вниз. По мере увеличения атомного номера вниз по группе положительный заряд ядра снова увеличивается. Однако при этом увеличивается и число занятых основных энергетических уровней. Высшие главные энергетические уровни состоят из орбиталей большего размера, чем орбитали с более низких энергетических уровней. Эффект большего числа основных энергетических уровней перевешивает увеличение заряда ядра, и поэтому атомный радиус увеличивается вниз по группе.
Рисунок \(\PageIndex{4}\): График зависимости атомного радиуса от атомного номера. Каждый последующий период показан другим цветом.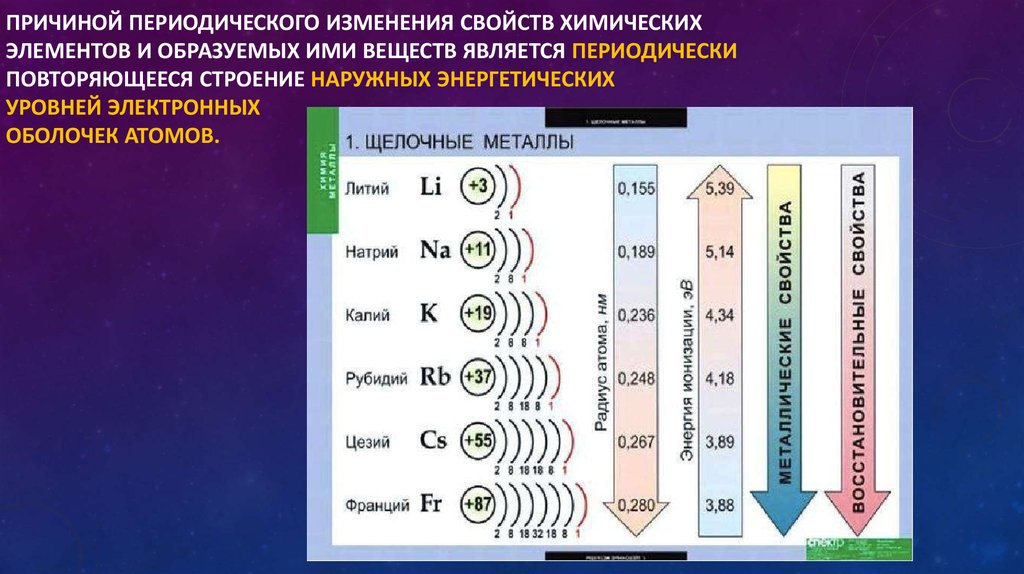 По мере увеличения атомного номера в течение периода атомный радиус уменьшается. (Источник: Christopher Auyeung; Источник: CK-12 Foundation; Лицензия: CC BY-NC 3.0 (открывается в новом окне))
По мере увеличения атомного номера в течение периода атомный радиус уменьшается. (Источник: Christopher Auyeung; Источник: CK-12 Foundation; Лицензия: CC BY-NC 3.0 (открывается в новом окне))Резюме
- Атомный радиус определяется как половина расстояния между ядрами двух одинаковых атомов, связанных вместе.
- Атомный радиус атомов обычно уменьшается слева направо по периоду.
- Атомный радиус атомов внутри группы обычно увеличивается сверху вниз.
Обзор
- Дайте определение «атомному радиусу».
- Каковы единицы измерения атомного радиуса?
- Как изменяется атомный радиус различных элементов в течение периода?
- Как изменяется атомный радиус сверху вниз внутри группы?
- Объясните, почему атомный радиус водорода намного меньше атомного радиуса калия.
Эта страница под названием 6.15: Periodic Trends- Atomic Radius распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts.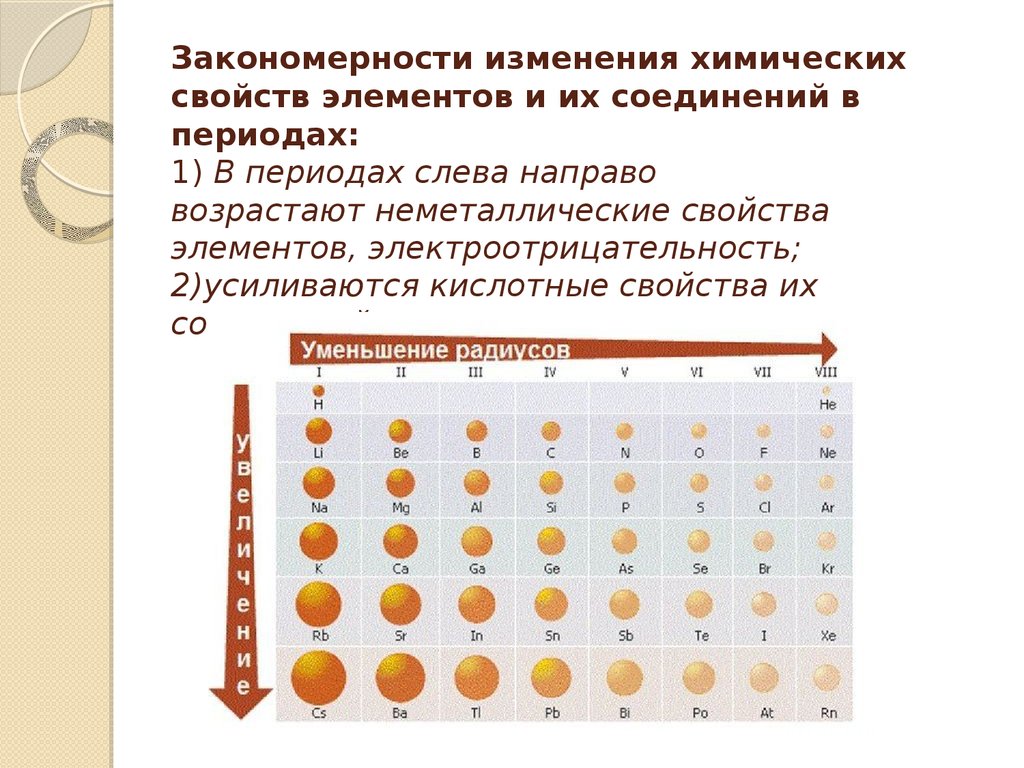 ; подробная история редактирования доступна по запросу.
; подробная история редактирования доступна по запросу.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд CK-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- нет на странице
- Теги
- источник@https://flexbooks.
 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
- источник@https://flexbooks.
Атомный радиус элементов
Корпускуляризм
Корпускуляризм был предложенной Декартом теорией, согласно которой вся материя состоит из мельчайших частиц.
Рене Декарт
Рене Декарт был известным математиком и философом 16-го века, который выдвинул теорию корпускуляризма об атоме
Блеск
Блеск — это термин, обозначающий отражающую поверхность, которая отражает свет, создавая блестящий вид.
Полупроводники
Полупроводники — это термин для описания металлоидов, которые способны проводить ток при подаче электрической энергии за счет движения электронов, но измерения проводимости не такие высокие, как у металлов, из-за меньшего количества электронов, несущих заряд или менее упорядоченная структура.
Ионное соединение
Ионное соединение представляет собой связь, которая образуется между металлами и неметаллами с образованием большой ионной решетки
Ядерный синтез
Ядерный синтез — это процесс, происходящий на Солнце. Атомы водорода под воздействием большого количества тепла и давления вынуждены объединяться, образуя более крупный атом гелия
Атомы водорода под воздействием большого количества тепла и давления вынуждены объединяться, образуя более крупный атом гелия
Принцип неопределенности
Принцип неопределенности Гейзенберга используется для описания взаимосвязи между импульсом и положением электрона. Где, если точное положение электрона известно, импульс будет неопределенным.
Гейзенберг
Вернер Гейзенберг был немецким физиком, пионером в области квантовой механики. Он разработал принцип неопределенности относительно импульса и положения электрона.
Лепестки
Лепестки относятся к форме электронных волн и области с наибольшей вероятностью, где этот электрон как частица может быть найден.
Принцип исключения Паули
Исключение Паули относится к теории, согласно которой каждый электрон может иметь только уникальный набор из 4 квантовых чисел, и никакие два электрона не могут иметь одинаковые квантовые числа
Квантовые числа
Квантовые числа — это используемый термин описать присвоение чисел электронам как математическую функцию для описания их импульса и энергии.
Модель Бора
Модель Бора относится к трактовке электронов как частиц, вращающихся вокруг ядра.
Квантовая механика
Термин квантовая механика относится к уровням энергии и теоретической области физики и химии, где математика используется для объяснения поведения субатомных частиц.
Впадина
Впадина — это самая нижняя точка поперечной волны.
Пик
Пик — это самая высокая точка поперечной волны.
Колебательные моды
Колебательные моды — это термин, используемый для описания постоянного движения молекулы. Обычно это вибрации, вращения и перемещения.
Erwin Schrodinger
Эрвин Шредингер был австрийским физиком, который использовал математические модели для усовершенствования модели Бора об электроне и создал уравнение для предсказания вероятности нахождения электрона в заданном положении.
Щелочной металл
Щелочные металлы, находящиеся в группе 1 периодической таблицы (ранее известной как группа IA), настолько реакционноспособны, что обычно встречаются в природе в сочетании с другими элементами. Щелочные металлы — это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении.
Щелочные металлы — это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении.
Щелочноземельные металлы
Щелочноземельные металлы — вторая по реакционной способности группа элементов в периодической таблице. Они находятся в группе 2 периодической таблицы (формально известной как группа IIA).
Неизвестные элементы
Неизвестные элементы (или трансактиниды) являются самыми тяжелыми элементами периодической таблицы. Это мейтнерий (Mt, атомный номер 109), дармштадтий (Ds, атомный номер 110), рентгений (Rg, атомный номер 111), нихоний (Nh, атомный номер 113), московий (Mc, атомный номер 115), ливерморий (Lv , атомный номер 116) и теннессин (Ts, атомный номер 117).
Постпереходный металл
Постпереходные металлы находятся между переходными металлами (слева) и металлоидами (справа). К ним относятся алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi).
Oganesson
Oganesson (Og) — радиоактивный элемент с атомным номером 118 в таблице Менделеева, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит. Он находится в группе 18. Он имеет символ Og.
Он находится в группе 18. Он имеет символ Og.
Теннессин
Теннессин (Ts) — радиоактивный элемент с атомным номером 117 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит. Он находится в группе 17. Он имеет символ Ts.
Ливерморий
Ливерморий (Lv) — радиоактивный элемент с атомным номером 116 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит. Он находится в группе 16. Он имеет символ Lv.
Московий
Московий (Mc) — радиоактивный металл с атомным номером 115 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Он находится в группе 15. Он имеет символ Mc.
Флеровий
Флеровий (Fl) — радиоактивный металл с атомным номером 114 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств его производства. Он находится в группе 14. Он имеет символ Fl.
Нихоний
Нихоний (Nh) — радиоактивный металл с атомным номером 112 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Он находится в группе 13. Он имеет символ Nh.
Copernicium
Copernicium (Cr) — радиоактивный металл с атомным номером 112 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 11. Он имеет символ Rg.
Рентгений
Рентгений (Rg) — радиоактивный металл с атомным номером 111 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 11. Он имеет символ Rg.
Darmstadtium
Darmstadtium (Ds) — радиоактивный металл с атомным номером 110 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 10. Он имеет символ Ds 9.0026
Мейтнерий
Мейтнерий (Mt) — радиоактивный металл с атомным номером 109 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 9. Он имеет символ Mt
Это переходный металл группы 9. Он имеет символ Mt
Хассий
Хассий (Hs) — радиоактивный металл с атомным номером 108 в периодической таблице, его внешний вид полностью неизвестен из-за ничтожных количеств. производится из него. Это переходный металл группы 8. Он имеет символ Hs.
Борий
Борий (Bh) — радиоактивный металл с атомным номером 107 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 7. Он имеет символ Bh.
Сиборгий
Сиборгий (Sg) — радиоактивный металл с атомным номером 106 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 6. Он имеет символ Sg.
Дубний
Дубний (Db) — радиоактивный металл с атомным номером 105 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 5. Он имеет символ Db.
Он имеет символ Db.
Резерфордий
Резерфордий (Rf) — радиоактивный металл с атомным номером 104 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 4. Он имеет символ Rf.
Lawrencium
Lawrencium (Lr) — серебристо-белый радиоактивный металл с атомным номером 103 в периодической таблице. Это актиноидный металл с символом Lr.
Нобелий
Нобелий (No) — радиоактивный металл с атомным номером 102 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это актиноидный металл с символом №
Менделевий
Менделевий (Md) — радиоактивный металл с атомным номером 101 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это актиноидный металл с символом Md. 9.0026
Фермий
Фермий (Fm) представляет собой серебристо-белый радиоактивный металл с атомным номером 100 в периодической таблице. Это актиноидный металл с символом Fm.
Это актиноидный металл с символом Fm.
Эйнштейний
Эйнштейний (Es) — серебристо-белый радиоактивный металл с атомным номером 99 в периодической таблице. Это актиноидный металл с символом Es.
Калифорний
Калифорний (Cf) — серебристо-белый радиоактивный металл с атомным номером 98 в периодической таблице. Это актиноидный металл с символом Cf.
Берклий
Берклий (Bk) представляет собой серебристый радиоактивный металл с атомным номером 97 в периодической таблице. Это актиноидный металл с символом Bk.
Кюрий
Кюрий (Cm) — серебристо-белый радиоактивный металл с атомным номером 96 в периодической таблице. Это актиноидный металл с символом Cm.
Америций
Америций (Am) представляет собой серебристый радиоактивный металл с атомным номером 95 в периодической таблице. Это актиноидный металл с символом Am.
Плутоний
Плутоний (Pu) представляет собой серебристый радиоактивный металл с атомным номером 94 в периодической таблице. Это актиноидный металл с символом Pu.
Это актиноидный металл с символом Pu.
Нептуний
Нептуний (Np) представляет собой серебристый радиоактивный металл с атомным номером 93 в периодической таблице. Это актиноидный металл с символом Np.
Протактиний
Протактиний (Па) представляет собой блестящий серебристый радиоактивный металл с атомным номером 91 в периодической таблице. Это актиноидный металл с символом Pa.
Торий
Торий (Th) — серебристо-белый радиоактивный металл с атомным номером 90 в периодической таблице. Это актиноидный металл с символом Th.
Актиний
Актиний (Ac) представляет собой серебристый радиоактивный металл с атомным номером 89 в периодической таблице. Это актиноидный металл с символом Ac.
Радий
Радий (Ra) — металл серебристо-белого цвета, имеющий атомный номер 88 в периодической таблице. Это щелочноземельный металл с символом Ra, расположенный во 2-й группе периодической таблицы.
Франций
Франций (Fr) считается металлом серого цвета, имеющим атомный номер 87 в периодической таблице. Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.
Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.
Радон
Радон (Rn) представляет собой бесцветный радиоактивный газ без запаха, неметалл, имеющий атомный номер 86 в периодической таблице в 18-й группе. Он имеет символ Rn.
Астатин
Астатин (At) — радиоактивный неметалл с атомным номером 85 в периодической таблице в группе 17. Он имеет символ At.
Полоний
Полоний (Po) представляет собой серебристо-серый металл с атомным номером 84 в периодической таблице в 16-й группе. Он имеет символ Po.
Висмут
Висмут (Bi) — твердый стальной серый металл, имеющий атомный номер 83 в периодической таблице в 15-й группе. Он имеет символ Bi.
Свинец
Свинец (Pb) — мягкий серый металл, имеющий атомный номер 82 в периодической таблице в 14-й группе. Он имеет символ Pb.
Таллий
Таллий (Tl) — мягкий серый металл, имеющий атомный номер 81 в периодической таблице в 13-й группе. Он имеет символ Tl.
Ртуть
Ртуть (Hg) представляет собой жидкий металл серебристого цвета, имеющий атомный номер 80 в периодической таблице. Это переходный металл группы 12. Он имеет символ Hg.
Золото
Золото (Au) — мягкий металл золотистого цвета, имеющий атомный номер 79 в периодической таблице. Это переходный металл группы 11. Он имеет символ Au.
Платина
Платина (Pt) — тяжелый белый металл с атомным номером 78 в периодической таблице. Это переходный металл группы 10. Он имеет символ Pt.
Иридий
Иридий (Ir) — тяжелый белый металл с атомным номером 77 в периодической таблице. Это переходный металл группы 9. Он имеет символ Ir.
Осмий
Осмий (Os) представляет собой твердый мелкий черный порошок или бело-голубой металл с атомным номером 76 в периодической таблице. Это переходный металл группы 8. Он имеет символ Os.
Рений
Рений (Re) — металл серебристо-белого цвета, имеющий атомный номер 75 в периодической таблице.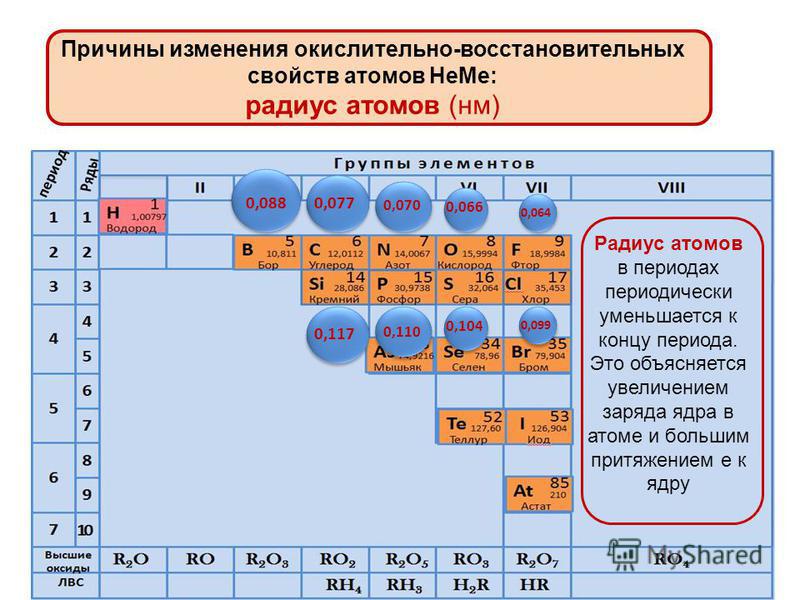 Это переходный металл группы 7. Он имеет символ Re.
Это переходный металл группы 7. Он имеет символ Re.
Вольфрам
Вольфрам (W) — металл серо-стального цвета, имеющий атомный номер 74 в периодической таблице. Это переходный металл группы 6. Он имеет символ W.
Тантал
Тантал (Ta) представляет собой металл серого цвета с атомным номером 73 в периодической таблице. Это переходный металл группы 5. Он имеет символ Та.
Гафний
Гафний (Hf) — металл серебристого цвета с атомным номером 72 в периодической таблице. Это переходный металл группы 4. Он имеет символ Hf.
Лютеций
Лютеций (Lu) — металл серебристо-белого цвета, имеющий атомный номер 71 в периодической таблице. Это лантаноидный металл. Он имеет символ Лу.
Иттербий
Иттербий (Yb) представляет собой металл серебристого цвета с атомным номером 70 в периодической таблице. Это лантаноидный металл. Он имеет символ Yb.
Тулий
Тулий (Tm) представляет собой металл серебристого цвета с атомным номером 69 в периодической таблице.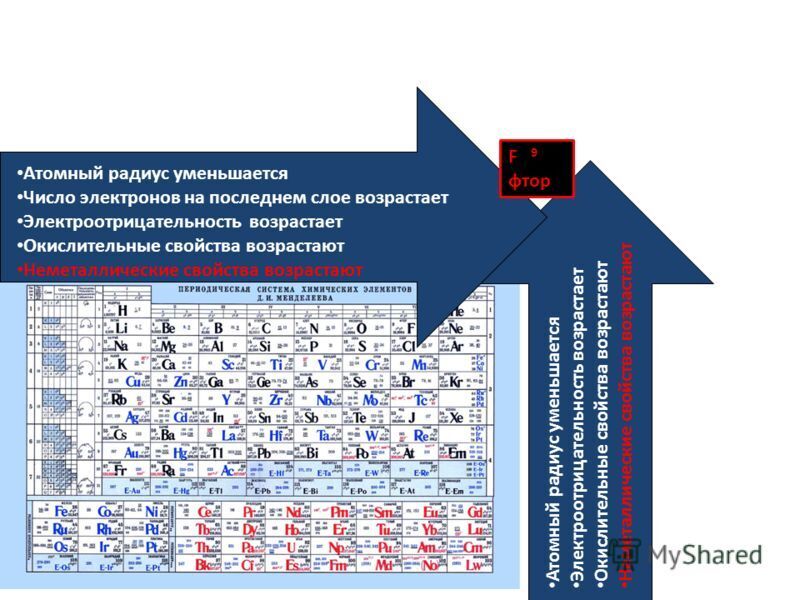 Это лантаноидный металл. Он имеет обозначение Tm.
Это лантаноидный металл. Он имеет обозначение Tm.
Эрбий
Эрбий (Er) — металл серебристого цвета с атомным номером 68 в периодической таблице. Это лантаноидный металл. Он имеет символ Er.
Гольмий
Гольмий (Но) — металл серебристого цвета с атомным номером 67 в периодической таблице. Это лантаноидный металл. Он имеет символ Хо.
Диспрозий
Диспрозий (Dy) представляет собой металл серебристого цвета с атомным номером 66 в периодической таблице. Это лантаноидный металл. Он имеет символ Dy.
Тербий
Тербий (Tb) представляет собой металл серебристо-серого цвета, имеющий атомный номер 65 в периодической таблице. Это лантаноидный металл. Он имеет символ Tb.
Гадолиний
Гадолиний (Gd) — металл серебристо-белого цвета, имеющий атомный номер 64 в периодической таблице. Это лантаноидный металл. Он имеет символ Gd.
Европий
Европий (Eu) представляет собой металл серебристо-белого цвета, имеющий атомный номер 63 в периодической таблице.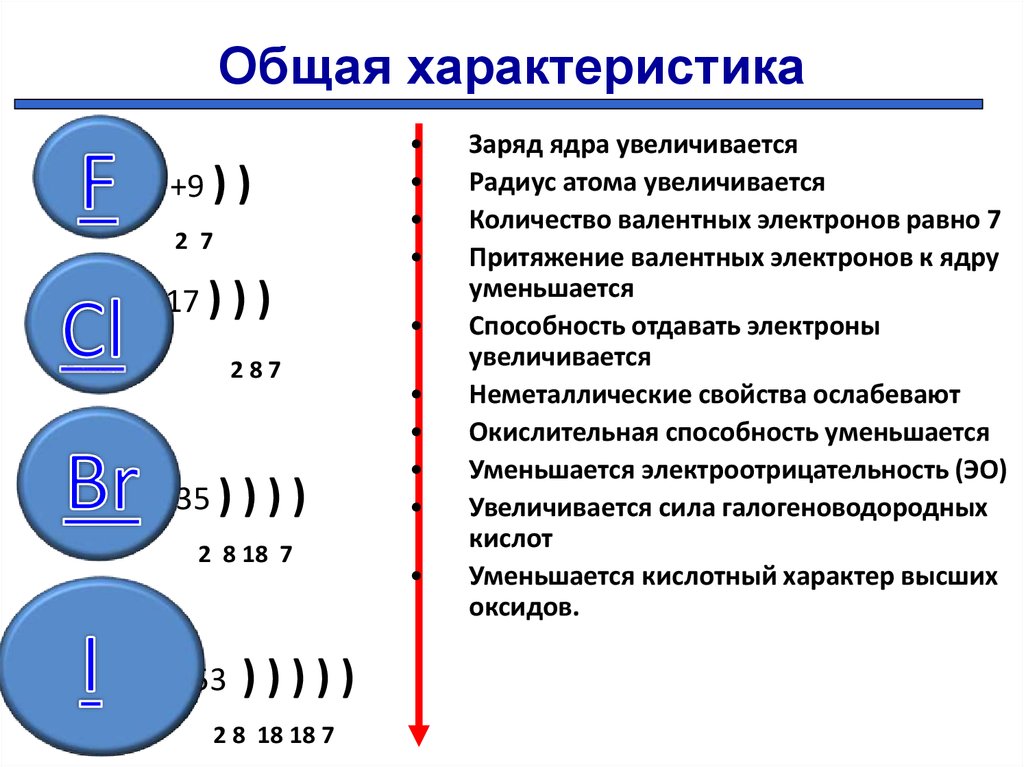 Это лантаноидный металл. Он имеет символ Eu.
Это лантаноидный металл. Он имеет символ Eu.
Самарий
Самарий (Sm) представляет собой металл серебристого цвета с атомным номером 62 в периодической таблице. Это лантаноидный металл. Он имеет символ Sm.
Прометий
Прометий (Pm) — редкий металл с атомным номером 61 в периодической таблице. Это лантаноидный металл. Он имеет символ Pm.
Неодим
Неодим (Nd) представляет собой серебристо-белый металл с атомным номером 60 в периодической таблице. Это лантаноидный металл. Он имеет символ Nd.
Празеодим
Празеодим (Pr) представляет собой серебристо-белый металл с атомным номером 59 в периодической таблице. Это лантаноидный металл. Он имеет обозначение Pr.
Церий
Церий (Ce) представляет собой металл серо-железного цвета, имеющий атомный номер 58 в периодической таблице. Это лантаноидный металл. Он имеет символ Ce.
Лантан
Лантан (La) — мягкий серебристо-белый металл с атомным номером 57 в периодической таблице. Это лантаноидный металл. Имеет обозначение La.
Это лантаноидный металл. Имеет обозначение La.
Барий
Барий (Ba) — мягкий серебристо-белый металл с атомным номером 56 в периодической таблице. Это щелочноземельный металл, расположенный во 2-й группе периодической таблицы. он имеет символ Ba.
Цезий
Цезий (Cs) — мягкий металл серого цвета, имеющий атомный номер 55 в периодической таблице. Это щелочной металл и находится в группе 1 периодической таблицы. он имеет символ Cs.
Ксенон
Ксенон (Xe) существует в виде бесцветного газа без запаха и химически инертен. Он имеет атомный номер 54 в периодической таблице и принадлежит к группе 18, Благородные газы. Это неметалл с символом Xe.
Йод
Йод (I) представляет собой пурпурно-серый твердый неметалл. Он имеет атомный номер 53 в периодической таблице. Он расположен в группе 17, галогены. Он имеет символ I.
Теллур
Теллур (Te) — серебристо-белый полуметалл с атомным номером 52 в периодической таблице. Он расположен в 16 группе периодической таблицы.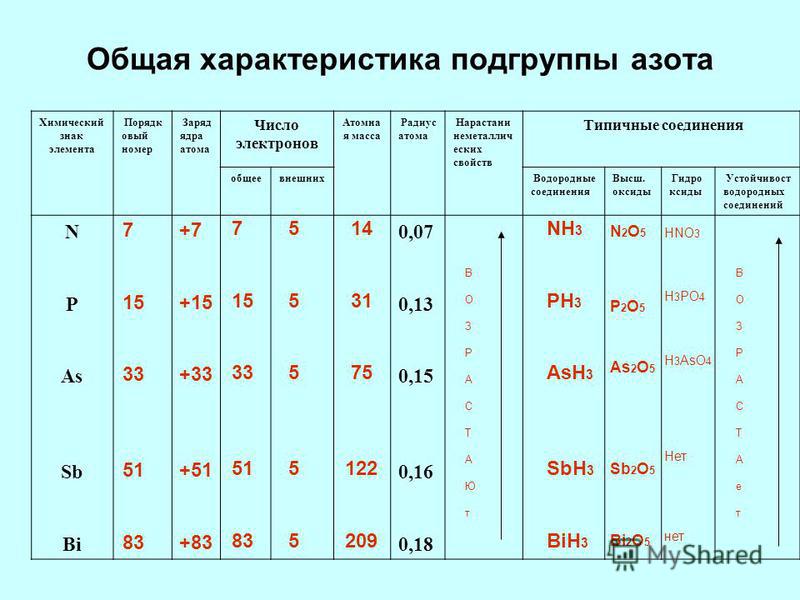 Он имеет символ Те.
Он имеет символ Те.
Сурьма
Сурьма (Sb) представляет собой твердый хрупкий серебристо-белый полуметалл с атомным номером 51 в периодической таблице. Он расположен в 15 группе периодической таблицы. Он имеет символ Sb.
Олово
Олово (Sn) — серебристо-белый металл с атомным номером 50 в периодической таблице. Он расположен в 14 группе периодической таблицы. Он имеет обозначение Sn.
Индий
Индий (In) — серебристо-белый металл с атомным номером 49 в периодической таблице. Он расположен в 13 группе периодической таблицы. Он имеет символ In.
Кадмий
Кадмий (Cd) — бело-голубой металл с атомным номером 48 в периодической таблице. Это переходный металл, расположенный в 12-й группе периодической таблицы. Он имеет обозначение Cd.
Серебро
Серебро (Ag) — металл серебра, имеющий атомный номер 47 в периодической таблице. Это переходный металл, расположенный в 11-й группе периодической таблицы. Он имеет символ Ag.
Палладий
Палладий (Pd) представляет собой серебристо-белый металл с атомным номером 46 в периодической таблице.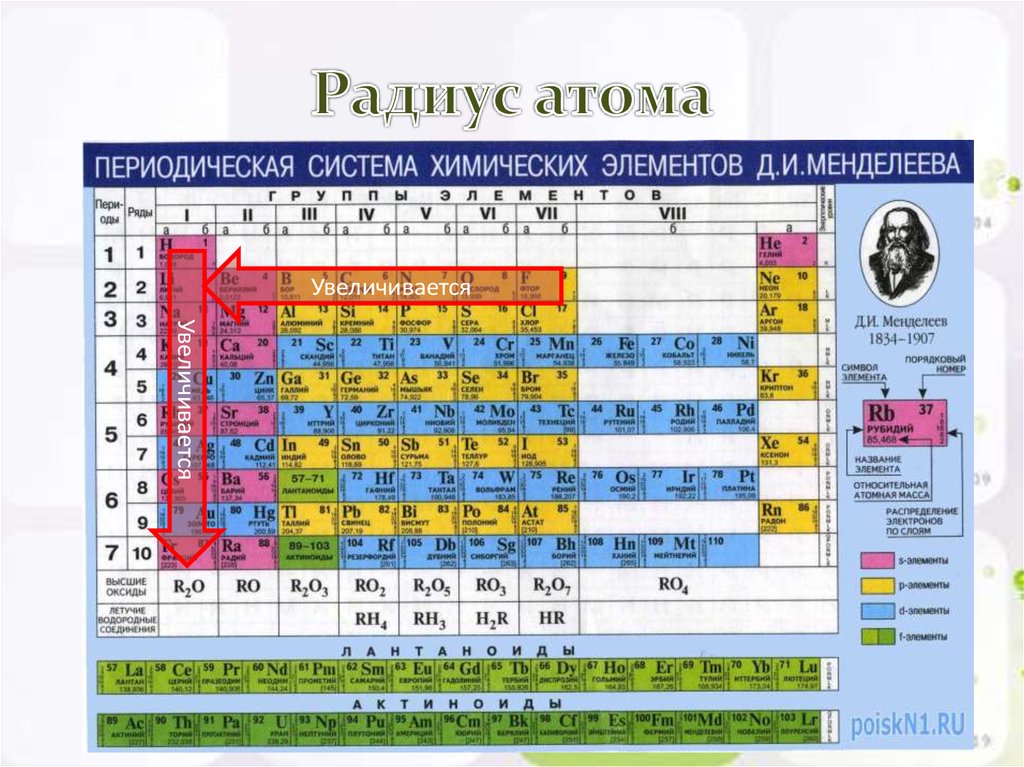 Это переходный металл, расположенный в 10-й группе периодической таблицы. Он имеет обозначение Pd.
Это переходный металл, расположенный в 10-й группе периодической таблицы. Он имеет обозначение Pd.
Родий
Родий (Rh) представляет собой хрупкий серебристо-белый металл с атомным номером 45 в периодической таблице. Это переходный металл, расположенный в группе 9.периодической таблицы. Он имеет обозначение Rh.
Рутений
Рутений (Ru) представляет собой хрупкий металл серебристо-серого цвета, имеющий атомный номер 44 в периодической таблице. Это переходный металл, расположенный в 8-й группе периодической таблицы. Имеет обозначение Ru.
Технеций
Технеций (Tc) представляет собой серебристо-серый металл с атомным номером 43 в периодической таблице. Это переходный металл, расположенный в 7-й группе периодической таблицы. Он имеет символ Tc.
Молибден
Молибден (Mo) представляет собой серебристо-белый металл с атомным номером 42 в периодической таблице. Это переходный металл, расположенный в 6-й группе периодической таблицы. Он имеет обозначение Mb.



 Радиус атома, нм
Радиус атома, нм Окислительно-восстановительные свойства простого вещества
Окислительно-восстановительные свойства простого вещества Свойства водных растворов газообразных водородных соединений
Свойства водных растворов газообразных водородных соединений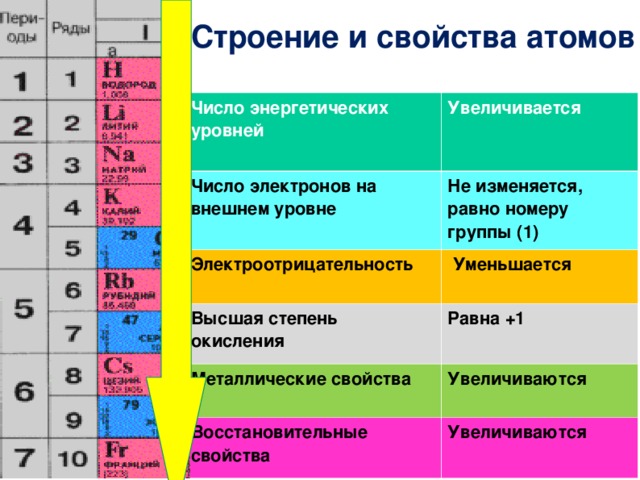 С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008 (§§ 6, 7).
С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008 (§§ 6, 7). Д.), 2008.
Д.), 2008. ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
Leave A Comment