1 Пропан → 2-хлорпропан → пропанол-2 → пропанон-2 → 1,1,1-трииодпропанон-2 → иодоформ
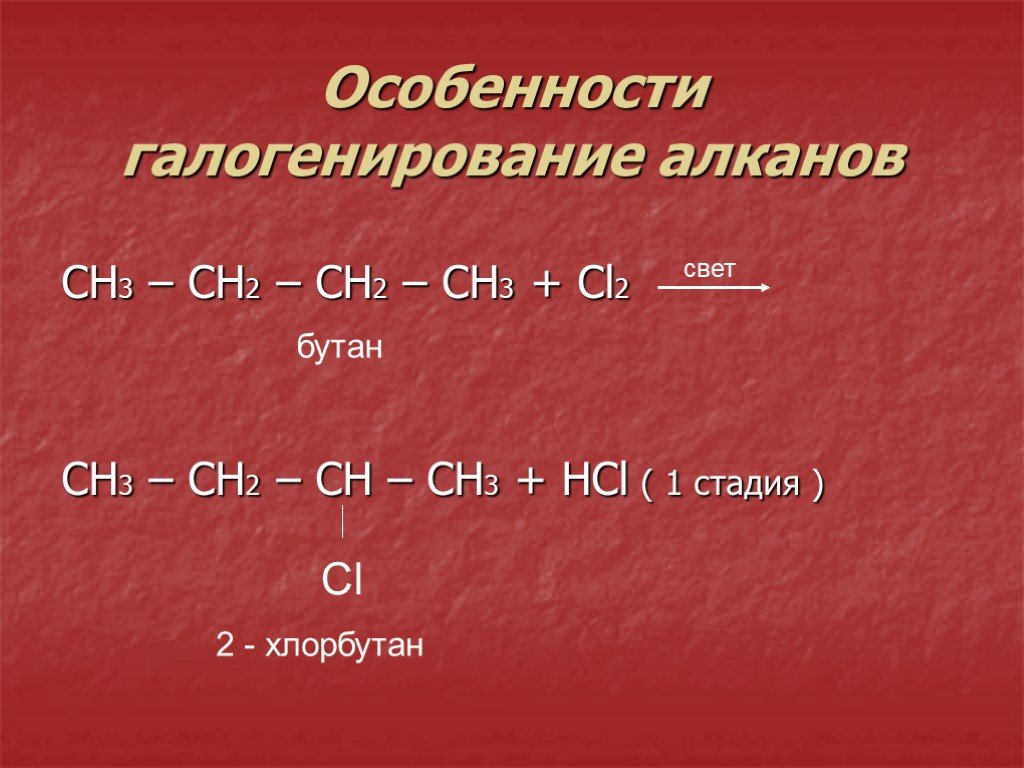
1 Ch4 – СН2 – Ch4+Cl2=Ch4-CHCL-Ch4+HCL
2 Ch4-CHCL-Ch4+KOH=Ch4-CHOH-Ch4+KCL
3 Ch4-CHOH-Ch4+KMnO4=Ch4-CO-Ch4
4 Ch4-CO-Ch4+I2=I3C-CO-Ch4+h3
5 I3C-CO-Ch4+NaOH=CHI3+Ch4-COONa
2) Натрия бензоата, свинца ацетата и натрия салицилата
Натрия бензоат+FeCl3=розовато-желтый осадок(МО желтый)
Свинца ацетат+FeCl3 = желто-красный раствор(МО красный)
Натрия салицилат +FeCl3= кроваво-красный раствор
Билет №43
1)Ацетилен → ацетальдегид → этанол → хлорэтан → этиламин → n-этилацетамид
CH≡CH A B C D E
1 CH≡CH + h3O→ CH3–CH=O
2 CH3–CH=O +h3→ CH3–CH2–OH
3 CH3–CH2–OH +HCl→ CH3– CH2–Cl+h3O
4 CH3– CH2–Cl +2Nh4→ CH3 – CH2 – NH2 +Nh5Cl
5 CH3 – CH2 – NH2 + Ch4COOH→ +h3O
2)уксусной кислоты, калия ацетата и резорцина
Уксусная кислота(МО красный)+NaOH=желтокрасный раствор
Калия ацетат(МО желтый)+ FeCl3= желто-красный раствор
Резорцин+ FeCl3= синефиолетовое окрашивание
Билет №44
1 CH3 – СН2 – CH3 A B C D E
Пропан → 2-бромпропан → пропен-1 → уксуснаякислота→ ацетилхлорид → фенилацетат
1 CH3 – СН2 – CH3 +Br2=Ch4-CHBr-Ch4+HBr
2 Ch4-CHBr-Ch4+ KOH = Ch4-CH=Ch3+KBr+h3O
3 Ch4-CH=Ch3+KMnO4 = Ch4COOH+HCOOH
4 Ch4COOH+PCl5=Ch4COCl+POCl3+HCL
5 Ch4COCl+C6H5ONa=C6H5OC2H5+NaCl
2)растворы натрия бензоата, калия ацетата и натрия салицилата,
Натрия бензоат+FeCl3=розовато-желтый осадок(МО желтый)
Калия ацетат(МО желтый)+ FeCl3= желто-красный раствор
Натрия салицилат +FeCl3= кроваво-красный раствор
Билет №45
1 CH3 – СН2 – CH3 A B C D E
Пропан → 2-бромпропан → пропен-1 → уксуснаякислота→ ацетилхлорид → фенилацетат
1 CH3 – СН2 – CH3 +Br2=Ch4-CHBr-Ch4+HBr
2 Ch4-CHBr-Ch4+ KOH = Ch4-CH=Ch3+KBr+h3O
3 Ch4-CH=Ch3+KMnO4 = Ch4COOH+HCOOH
4 Ch4COOH+PCl5=Ch4COCl+POCl3+HCL
5 Ch4COCl+C6H5ONa=C6H5OC2H5+NaCl
2)мочевина, формалин и глицерин
Мочевина+Сu(OH)2=розовато-фиолетовое окрашивание
Формалин+[Ag(Nh4)2OH]= черный оссадок
Глицерин+Cu(OH)2=раствор интенсивного синего цвета
Билет №46
Пропен-1 → 2-хлорпропан → пропанамин-2 → N-изопропил-бензамид → бензойная кислота → μ-нитробензойная кислота
1 CH2 = СН – CH3 +HCl=Ch4-CHCl-Ch4
2 Ch4-CHCl-Ch4+2Nh4=Ch4-CHNh3-Ch4+Nh5Cl
3 Ch4-CHNh3-Ch4+C6H5COCl=C6H5-CO-NH-CH-Ch4-Ch4 + HCL
4 C6H5-CO-NH-CH-Ch4-Ch4+ h3O=C6H5COOH+…
5C6H5COOH+KNO3= C6h5-COOH-NO2+ KOH
2)формалина, глюкозы и глицерина
Формалин+[Ag(Nh4)2OH]= черный оссадок
Глюкоза+Cu(OH)2 = ярко-сине васильковое окрашивание
Глицерин+Cu(OH)2=раствор интенсивного синего цвета
Билет №47
Пропен-1 → пропанол-2 → 2-хлорпропан → пропанамин-2 → N-изопропил-бутанамид → бутират Na
CH2 = СН2 – CH3 A B C D E
1 CH2 = СН2 – CH3+h3O=Ch4-CHOH-Ch4
2 Ch4-CHOH-Ch4+HCl=Ch4-CCl-Ch4+h3O
3 Ch4-CCl-Ch4+2Nh4= Ch4-CHNh3-Ch4+Nh5CL
4 Ch4-CHNh3-Ch4+C4H9COCL = C3H7-CO-NH-CH-Ch4-Ch4+HCl
5 C3H7-CO-NH-CH-Ch4-Ch4+ NaOH= C3H7-COONa+…
2)
натрия бензоата, терпингидрата и
щавелевой кислоты.
Натрия бензоат+FeCl3=розовато-желтый осадок(МО желтый)
Терпингидрат+н2o+t= жидкость цветочного запаха
Щавелевая кислота+CaCl2=осадок белого цвета
Билет №48
CH2 = CH2 A B C D E
Этилен → хлорэтан → этанол → этилацетатацетамид → ацетат Na
1 CH2 = CH2 +HCl = Ch4-Ch3-Cl
2 Ch4-Ch3-Cl+ KOH = Ch4-Ch3-OH+KCl
3 Ch4-Ch3-OH +Ch4COOH = Ch4CO-O-C2H5 +h3O
4 Ch4CO-O-C2H5 +Nh4 = Ch4CO-Nh3 + C2H5OH
5 Ch4CO-Nh3 +NaOH = Ch4-COONa +Nh4
2)порошки натрия бензоата , резорцина и щавелевой кислоты
Натрия бензоат+FeCl3=розовато-желтый осадок(МО желтый)
Резорцин+ FeCl3= синефиолетовое окрашивание
Щавелевая кислота+CaCl2=осадок белого цвета
Билет №49
Этилен → этанол → этилацетат → ацетат Na → уксусная кислота → 2,2,2-трихлоруксусная кислота
CH2 = СН2 A B C D E
1 Ch3 =СН2+ h3O= Ch4-Ch3-OH
2 Ch4-Ch3-OH + Ch4-COOH = Ch4-CO-O-C2H5 +h3O
3 Ch4-CO-O-C2H5 + NaOH = Ch4-COONa + C2H5OH
4 Ch4-COONa +HCl = Ch4COOH +NaCl
5 Ch4COOH + 3Cl2 = Cl3C-COOH + 3HCl
2)бензойной
кислоты, мочевины и натрия цитрата.
Бензойная кислота+FeCl3= осадок телесного цвета
Мочевина+Сu(OH)2=розовато-фиолетовое окрашивание
Натрия цитрат+СaCl2=осадок белого цвета
Билет №50
CH≡CH A B C D E
Ацетилен → ацетальдегид → этанол → этилен → этилхлорид → → диэтиловый эфир
1 CH≡CH + h3O→ CH3–CH=O
2 CH3–CH=O +h3→ CH3–CH2–OH
3 CH3–CH2–OH =Сh3=Сh3 + h3O
4 Сh3=Сh3+ HCl = Ch4-Ch3-Cl
5 Ch4-Ch3-Cl + C6H5ONa = C6H5-O-C2H5 + NaCl
2)натрия салицилат, бензойной кислоты и терпингидрата
Натрия салицилат +FeCl3= кроваво-красный раствор
Бензойная кислота+FeCl3= осадок телесного цвета
Терпингидрат+н2o+t= жидкость цветочного запаха
Билет №51
Бензол → этилбензол → n-нитроэтилбензол → n-этиланилин → n-этилбензол-диазоний хлорид → 4’гидрокси-4-этилазобензол
A B C D E
2)натрия бензоата, уксусной кислоты и резорцина.
Натрия бензоат+FeCl3=розовато-желтый осадок(МО желтый)
Уксусная кислота(МО красный)+NaOH=желтокрасный раствор
Резорцин+ FeCl3= синефиолетовое окрашивание
Билет №52
Пиридин A B C D
E
2-аминопиридин
Пиридин → 3-нитропиридин → 3-аминопиридин → 3-пириди-нийдиазоний хлорид → 3’пиридин-4-диметиламиназобензол
2) Резорцин+ FeCl3= синефиолетовое окрашивание
Свинца ацетат+FeCl3 = желто-красный раствор(МО красный)
Фенол+ FeCl3=сине-фиолетовое окрашивание
Билет №54
CH4 A B C D E
Метан → хлорметан → метанол → формальдегид → муравьи-ная кислота → этилформиат
1 Сh5+Cl2 = Ch4CL+HCl
2Ch4Cl + KOH = Ch4OH+ KCl
3 Ch4OH + [O] = H-CH=O
4 H-CH=O+ 2Cu(OH)2 = HCOOH +Cu2O+2h3O
5HCOOH+ C2H5OH = HCO-O-C2H5 +h3O
2)
ацетилена, этилена и этана.
Ацетилен+[Ag(Nh4)2OH]= осадок белого цвета
Этан+KMnO4, Br2=не обесцвечивание раствора
Этилен+KMnO4, Br2= обесцвечивание раствора
Билет №55
Бензол → бромбензол→ n-бромнитробензол→ n-броманилин → n-бромбензол-диазоний хлорид → 4’бром-4-диметиламиноазобензол
A B C D E
2) винной кислоты, уксусной кислоты и фенола.
Винная кислота+KOH=белый осадок
Уксусная кислота(МО красный)+NaOH=желтокрасный раствор
Фенол+ FeCl3=сине-фиолетовое окрашивание
Билет 56
CH3 – СН2 – CH3 A B C D E
Пропан → 2-хлорпропан → 2-метилпронанонитрил → 2-метил-пропановая кислота → этил(2-метилпропановая кислота) → 2-метилпропанамид
1Ch4-Ch3-Ch4+Cl2 = Ch4-CHCl-Ch4 + HCl
2 Ch4-CHCl-Ch4 + K-C≡N = Ch4-CH-CN-Ch4 +KCL
3 Ch4-CH-CN-Ch4 + 2h3O
2)бутина-1, бутена-1 и бутана
Бутан+KMnO4, Br2=не обесцвечивание раствора
Бутен-1+KMnO4, Br2= обесцвечивание раствора
Бутин-1+[Ag(Nh4)2OH]= осадок белого цвета
Билет 57
Бензол → пропилбензол → n-нитропропилбензол → n-пропиланилин →
n-пропилбензолдиазоний хлорид → 2,4-дигидрокси-4’-пропилазобензол
2 A B C D E
2)ментола,
салициловой кислоты и натрия цитрата.
Метанол+I2+KOH=осадок, со стойким запахом
Салициловая кислота+ FeCl3=фиолетовое окрашивание
Натрия цитрат+СaCl2=осадок белого цвета
Билет 58
CH3 – CH2 – CH2 – CH3 A B C D E
Бутан → 2-бромбутан → 2-метилбутанонитрил → 2-метил-бутановаякислота → 2-метилбутаноилхлорид → фенил-2-метилбутират.
1 CH3 – CH2 – CH2 – CH3+ Br2 = Ch4-CHBr-Ch3-Ch4+HBr
2 Ch4-CHBr-Ch3-Ch4 +KNC = Ch4Ch3CH(CN)Ch4 +KBr
3 Ch4Ch3CH(CN)Ch4 + 2h3O = Ch4Ch3CH(COOH)-Ch4 + Nh4
4 Ch4Ch3CH(COOH)-Ch4 + PCl5 = Ch4Ch3CH(Ch4) –COCl + HCl + POCl3
5 Ch4Ch3CH(Ch4) –COCl + C6H5ONa = NaCl = Ch4-Ch3-CH(Ch4)CO-O-C6H5
2)пентана, пентина-1 и пентина-2
Пентан+KMnO4, Br2=не обесцвечивание раствора
Билет 59
Бензол → этилбензол → 1-бром-1-фенилэтан → 2-фенил-пропанонитрил → 2-фенил-пропановая кислота → 2-фенил-пропанамид
A B C D E
2)
бензойной кислоты, натрия салицилата и хлоралгидрата
Бензойная кислота+FeCl3= осадок телесного цвета
Натрия салицилат +FeCl3= кроваво-красный раствор
Хлоралгидрат+NaOH= помутнение раствора появление
Билет 60
резорцина,
салициловой кислоты и натрия бензоата.
Резорцин+ FeCl3= синефиолетовое окрашивание
Салициловая кислота+ FeCl3=фиолетовое окрашивание
Натрия бензоат+FeCl3=розовато-желтый осадок(МО желтый)
Билет 61
Пропин-1 → ацетон → 1,1,1-трииодпропанон-2 → ацетат натрия → уксусный ангидрид → ацетилсалициловая кислота
HC≡C – СH3 A B C D E
1 CH≡C-Ch4 +h3O = Ch4-CO-Ch4
2 Ch4-CO-Ch4 + 3I2 = Ch4-CO-CI3 + 3HI
3 Ch4-CO-CI3 + NaOH = CHI3+Ch4COONa
4 Ch4COONa+Ch4COCL =
2)салициловая кислота, глицерин и резорцин
Салициловая кислота+ FeCl3=фиолетовое окрашивание
Глицерин+Cu(OH)2=раствор интенсивного синего цвета
Резорцин+ FeCl3= синефиолетовое окрашивание
Билет 62
Гексен-3 A B C D E
Гексен-3 → пропионовая кислота → 2-бромпропионовая кислота → 2-аминопропионовая кислота → 2-аминопропаноил-хлорид → фенил(2-аминопропионат)
1 Ch4-Ch3-CH=CH-Ch3-Ch4+KMnO4= 2 Ch4-CH-COOH
2 Ch4-CH-COOH+ Br2 = Ch4-CHBr-COOH+HBr
3 Ch4-CHBr-COOH+ Nh4 = Ch4-CHNh3-COOH +HBr
4 Ch4-CHNh3-COOH +PCl5 = Ch4-CHNh3COCl + POCl3 + HCl
5 Ch4-CHNh3COCl + C6H5ONa = CY3-CHNh3-CO-O-C6H5 +NaCL
2)этанол,
глицерин и резорцин.
Этанол+ I2+KOH=осадок, со стойким запахом
Глицерин+Cu(OH)2=раствор интенсивного синего цвета
Резорцин+ FeCl3= синефиолетовое окрашивание
Билет №63
бензилбензоат, глицин и лимонтар.
Бензилбензоат+Fecl3=розовое окрашивание
Глицин+нингидрин=сине-фиолетовое окрашивание
Лимонтар+ацетальдегид= розовато-фиолетовое окрашивание
Билет 64
Пропаналь A B C D
E
Пропаналь → пропионовая кислота → 2-бромпропионовая кислота → молочная кислота → метиллактат
2)калия ацетата, муравьиной кислоты и фенола
Калия ацетат(МО желтый)+ FeCl3= желто-красный раствор
Муравьиная кислота+[Ag(Nh4)2OH]=осадок белого цвета и выделение газа
Фенол+ FeCl3=сине-фиолетовое окрашивание
Билет 65
Пиридин → 3-метилпиридин → пиридин-3-карбоновая кислота → хлорангидрид никотиновой кислоты → никотинамид → диэтиламид никотиновой кислоты
Пиридин A B C D
E
2)растворы
калия ацетата, муравьиной кислоты и
этанола.
Калия ацетат(МО желтый)+ FeCl3= желто-красный раствор
Муравьиная кислота+[Ag(Nh4)2OH]=осадок белого цвета и выделение газа
Этанол+ I2+KOH=осадок, со стойким запахом
Билет 66
Пропионовая кислота A B C D E
Пропионовая кислота → 2-бромпропионовая кислота → молочная кислота → муравьиная кислота → этилформиат → натрия формиат
2)формалин, хлоралгидрат и камфора
Формалин+[Ag(Nh4)2OH]= черный оссадок
Хлоралгидрат+NaOH= помутнение раствора появление
Камфора(белый порошок.комки. мало растворим в воде.)
Билет 67
Пропин-1 → пропен-1 → 2-хлорпропан → пропанол-2 → изопропилацетат → ацетамид
HC≡C – СH3 A B C D E
2)формалина, винной кислоты и вазелинового масла
Формалин+[Ag(Nh4)2OH]= черный оссадок
Винная кислота+KOH=белый осадок
Вазелиновое масло+Br2= раствор не обесцвечивается
Билет 68
Метан A B C D E
Метан → хлорметан → метанол → метилсалицилат → салициловая кислота → ацетилсалициловая кислота
2)вазелинового
масла, этанола и фенола.
Вазелиновое масло+Br2= раствор не обесцвечивается
Этанол+ I2+KOH=осадок, со стойким запахом
Фенол+ FeCl3=сине-фиолетовое окрашивание
Билет 69
Этанол → этаналь → 2-хлорэтаналь → хлоруксусная кислота → аминоуксусная кислота → 2-аминоацетилхлорид
Этанол A B C D E
CH3 – CH2OH → CH3 – CH = O → ClCH2 – CH = O → ClCH2 – COOH → NH2 – COOH → NH2 – COCl
2)растворы калия ацетата, винной кислоты и этанола
Калия ацетат(МО желтый)+ FeCl3= желто-красный раствор
Винная кислота+KOH=белый осадок
Этанол+ I2+KOH=осадок, со стойким запахом
Билет 70
Бутанол-1 A B C D
E
Бутанол-1 → масляная кислота → 2-бромбутаноат → 2-аминобутановая кислота → пропанамин-1 → N-пропилацетамид
2)уксусной кислоты, калия ацетата и фенола
Уксусная кислота(МО красный)+NaOH=желтокрасный раствор
Калия ацетат(МО желтый)+ FeCl3= желто-красный раствор
Фенол+ FeCl3=сине-фиолетовое окрашивание
Билет 71
Пропанол-1 → 1-хлорпропан → бутанонитрил → масляная кислота → бутаноилхлорид → N-этилбутанамид
Пропанол-1 A B C D E
2) Бензойная кислота+FeCl3= осадок телесного цвета
Натрия бензоат+FeCl3=розовато-желтый осадок(МО желтый)
Натрия салицилат +FeCl3= кроваво-красный раствор
Билет 72
Бензол A B C D E
Бензол → толуол → фенилхлорметан → бензиловый спирт → бензилбензоат → бензоатNа
2)
реактива Толленса. Из каких компонентов
состоит реактив Толленса?
Из каких компонентов
состоит реактив Толленса?
Ацетилен+[Ag(Nh4)2OH]= осадок белого цвета
Бутин-1+[Ag(Nh4)2OH]= осадок белого цвета
Муравьиная кислота+[Ag(Nh4)2OH]=осадок белого цвета
Билет 73
Этан → хлорэтан → этанол → этаналь → 2,2,2-трихлорэтаналь → хлороформ
CH3 – CH3 A B C D E
О. 1) CH3 – CH3 + Cl2→ CH3 – CH2Cl +HCl
2) CH3 – CH2Cl+KOH→ CH3 – CH2OH+hcl
3)CH3 – CH2OH +CuO→ CH3 – CH = O+Cu+h3O
4) CH3 – CH = O+Cl2 → Cl3C – CH = O
5) 2Cl3C – CH = O+Ca(OH)2 → 2CHCl3+…
2)бензойной кислоты, салициловой кислоты и щавелевой
Бензойная кислота+FeCl3= осадок телесного цвета
Салициловая кислота+ FeCl3=фиолетовое окрашивание
Щавелевая кислота+CaCl2=осадок белого цвета
Билет 74
Пропен-1 → 2-хлорпропан → пропанамин-2 → N-изопропил-бензамид → бензойная кислота → μ-нитробензойная кислота
1 CH2 = СН – CH3 +HCl=Ch4-CHCl-Ch4
2 Ch4-CHCl-Ch4+2Nh4=Ch4-CHNh3-Ch4+Nh5Cl
3 Ch4-CHNh3-Ch4+C6H5COCl=C6H5-CO-NH-CH-Ch4-Ch4 + HCL
4 C6H5-CO-NH-CH-Ch4-Ch4+ h3O=C6H5COOH+…
5C6H5COOH+KNO3= C6h5-COOH-NO2+ KOH
2)мочевина, глюкоза и глицерин,
Мочевина+Сu(OH)2=розовато-фиолетовое окрашивание
Глюкоза+Cu(OH)2 = ярко-сине васильковое окрашивание
Глицерин+Cu(OH)2=раствор интенсивного синего цвета
Билет 75
Этилен → этанол → этилацетат → ацетат Na → уксусная кислота → 2,2,2-трихлоруксусная кислота
CH2 = СН2 A B C D E
1 Ch3 =СН2+ h3O= Ch4-Ch3-OH
2 Ch4-Ch3-OH + Ch4-COOH = Ch4-CO-O-C2H5 +h3O
3 Ch4-CO-O-C2H5 + NaOH = Ch4-COONa + C2H5OH
4 Ch4-COONa +HCl = Ch4COOH +NaCl
5 Ch4COOH + 3Cl2 = Cl3C-COOH + 3HCl
2)терпингидрат,
натрия салицилата и щавелевой кислоты.
Терпингидрат+н2o+t= жидкость цветочного запаха
Натрия салицилат +FeCl3= кроваво-красный раствор
Щавелевая кислота+CaCl2=осадок белого цвета
Билет 76
CH4 A B C D E
Метан → хлорметан → метанол → формальдегид → муравьи-наякислота → этилформиат
1 Сh5+Cl2 = Ch4CL+HCl
2Ch4Cl + KOH = Ch4OH+ KCl
3 Ch4OH + [O] = H-CH=O
4 H-CH=O+ 2Cu(OH)2 = HCOOH +Cu2O+2h3O
5HCOOH+ C2H5OH = HCO-O-C2H5 +h3O
2)бутина-1, бутина-2 и бутана.
Бутан+KMnO4, Br2=не обесцвечивание раствора
Бутин-1+[Ag(Nh4)2OH]= осадок белого цвета
Билет 77
A B C D E
Бензол → толуол → бензойная кислота → бензоилхлорид → → фенилбензоат → бензоат натрия
2)пропена-1, пропина-1 и пропана
Пропан+KMnO4, Br2=не обесцвечивание раствора
Пропен-1+KMnO4, Br2=обесцвечивание раствора
Билет 78
Гексен-3 A B C D E
Гексен-3 → пропионовая кислота → 2-бромпропионовая кислота → 2-аминопропионовая кислота → 2-аминопропаноил-хлорид → фенил(2-аминопропионат)
1 Ch4-Ch3-CH=CH-Ch3-Ch4+KMnO4= 2 Ch4-CH-COOH
2 Ch4-CH-COOH+ Br2 = Ch4-CHBr-COOH+HBr
3 Ch4-CHBr-COOH+ Nh4 = Ch4-CHNh3-COOH +HBr
4 Ch4-CHNh3-COOH +PCl5 = Ch4-CHNh3COCl + POCl3 + HCl
5 Ch4-CHNh3COCl + C6H5ONa = CY3-CHNh3-CO-O-C6H5 +NaCL
2)этанол, формалин и резорцин
Этанол+ I2+KOH=осадок, со стойким запахом
Формалин+[Ag(Nh4)2OH]= черный оссадок
Резорцин+ FeCl3= синефиолетовое окрашивание
Билет 79
2) Глицерин+Cu(OH)2=раствор интенсивного синего цвета
Глюкоза+Cu(OH)2 = ярко-сине васильковое окрашивание
Мочевина+Сu(OH)2=розовато-фиолетовое окрашивание
Билет 80
Бензол → пропилбензол → n-нитропропилбензол → n-пропиланилин →
n-пропилбензолдиазоний хлорид → 2,4-дигидрокси-4’-пропилазобензол
2 A B C D E
фелинга
Спирты.
 Фенолы
Фенолы
Дидактический материал
Характерные химические свойства предельных одноатомных и многоатомных спиртов; фенола.
1. При окислении пропанола-1 образуется
1) пропилена
2) пропанон
3) пропаналь
4) пропан
2. В схеме реакции
NaOH + X → C2H5OH + NaCl
веществом «Х» является
1) хлорэтан
2) 1,2-дибромэтан
3) ацетилен
4) этаналь
3. В результате дегидратации пропанола-1 образуется
1) пропанол-2 2) пропан 3) пропен 4) пропин
4. В схеме превращений пропанол-1→ X → пропанол-2
веществом «X» является
1) 2-хлорпропан
2) пропановая кислота
3) пропин
4) пропен
5. Атом кислорода в молекуле фенола образует
1) одну σ-связь
2) две σ-связи
3) одну σ- и одну π-связи
4) две π-связи
6. С гидроксидом натрия реагируют оба вещества
С гидроксидом натрия реагируют оба вещества
1) уксусная кислота и фенол
2) фенол и глицерин
3) глицерин и пропанол
4) пропанол и анилин
7. С гидроксидом меди(II) реагирует
1) CH2OH — CH2OH
2) C6H5 — OH
3) CH3 — OH
4) CH3 — O — CH3
8. В порядке усиления кислотных свойств расположены вещества
1) фенол — этанол — глицерин
2) этанол — глицерин — фенол
3) глицерин — этанол — фенол
4) глицерин — фенол — этанол
9. В результате нагревания пропанола-1 с концентрированной серной кислотой при температуре свыше 140° образуется преимущественно
1) простой эфир
2) сложный эфир
3) алкен
4) альдегид
10. Бутанол-2 можно получить
1) восстановлением бутаналя
2) щёлочным гидролизом 1-хлорбутана
3) восстановлением бутановой кислоты
4) гидратацией бутена-1
11. Этанол не взаимодействует с
Этанол не взаимодействует с
1) Na 2) NaOH 3) CuO 4) HCl
12. Фенол реагирует с каждым из веществ
1) бромная вода и гидроксид натрия
2) гидроксид натрия и вода
3) вода и соляная кислота
4) соляная кислота и бромная вода
13. Пропанол-2 взаимодействует с
1) Cu(OH)2 2) NaOH 3) HCl 4) H2
14. В результате нагревания бутанола-1 с концентрированной серной кислотой при температуре менее 140° образуется преимущественно
1) простой эфир
2) сложный эфир
3) алкен
4) альдегид
15. Высокий выход пропанола-1 не достигается при
1) щёлочном гидролизе 1-хлорпропана
2) восстановлении пропаналя
3) щёлочном гидролизе пропилового эфира карбоновой кислоты
4) гидратации пропена
16. C помощью гидроксида меди(II) можно обнаружить в растворе
1) пропилен
2) пропанол
3) фенол
4) пропандиол-1,2
17. Метанол реагирует с
1) KOH 2) Cu(OH)2 3) CH3COOH 4) Cu
18. При окислении пропанола-1 образуется
При окислении пропанола-1 образуется
1) CH3-CHOH-CH2OH
2) CH3-CH2-CH=O
3) CH3-CH=CH2
4) CH3-CO-CH3
19. Среди утверждений:
А. Гидроксильная группа оттягивает электронную плотность с бензольного кольца фенола.
Б. Влияние бензольного кольца на гидроксильную группу в молекуле фенола приводит к усилению кислотных свойств.
1) верно только А
2) верно только Б
3) верны А и Б
4) неверны оба утверждения
20. Влияние бензольного кольца на гидроксильного группу в молекуле фенола доказывает реакция фенола с
1) гидроксидом натрия
2) формальдегидом
3) бромной водой
4) азотной кислотой
21. При дегидратации этилового спирта образуется
1) бутан 2) этен 3) этин 4) пропен
22. К фенолам относится вещество, формула которого
1) C6H5 — O — Ch4
2) C6H13 — OH
3) C6H5 — OH
4) C6H5 — CH3
23. Фенол в водном растворе является
Фенол в водном растворе является
1) сильной кислотой
2) слабой кислотой
3) слабым основанием
4) сильным основанием
24. Наличие группы — OH в составе фенола
1) облегчает протекание реакции замещения
2) затрудняет протекание реакции замещения
3) не влияет на протекание реакции замещения
4) способствует протеканию реакции присоединения
25. Фенол реагирует с
1) Br2 2) Na2CO3 3) NaCl 4) Cu(OH)2
26. Этанол можно получить из этилена в результате реакции
1) гидратации
2) гидрирования
3) галогенирования
4) гидрогалогенирования
27. При щёлочном гидролизе 2-хлорбутана преимущественно образуется
1) бутанол-2
2) бутанол-1
3) бутаналь
4) бутен-2
28. При щёлочном гидролизе 1,2-дихлорпропана образуется
1) пропанол-1
2) пропанол-2
3) пропаналь
4) пропандиол-1,2
29. Для предельных одноатомных спиртов характерно взаимодействие с
Для предельных одноатомных спиртов характерно взаимодействие с
1) NaOH (p-p) 2) Na 3) Cu(OH)2 4) Cu
30. Пропанол не взаимодействует с
1) Hg 2) O2 3) HCl 4) K
31. Фенол взаимодействует с
1) соляной кислотой
2) гидроксидом натрия
3) этиленом
4) метаном
32. Одноатомные спирты не взаимодействуют с
1) уксусной кислотой
2) металлическим натрием
3) метаном
4) кислородом
33. В схеме превращений
C2H5OH —>X —>СН3СООН веществом Х является
I) метаналь 2) бутаналь 3) этаналь 4) пропаналь
34. При нагревании метанола с кислородом на медном катализаторе образуется
I) формальдегид
2) ацетальдегид
3) метан
4) диметиловый эфир
35. Фенол не реагирует с
1) FcCl3 2) HNO3 3) NaOH 4) HCI
36. С каждым из двух веществ: Cu(OH)2 и HBr будет взаимодействовать
1) этиленгликоль
2) этанол
3) диметиловый эфир
4) метанол
37. При дегидратации этилового спирта образуется
При дегидратации этилового спирта образуется
1) бутан
2) этен
3) этин
4) пропен
Ответы: 1-3, 2-1, 3-3, 4-4, 5-2, 6-1, 7-1, 8-2, 9-3, 10-4, 11-2, 12-1, 13-3, 14-1, 15-4, 16-4, 17-3, 18-2, 19-2, 20-3,
21-2, 22-3, 23-2, 24-1, 25-1, 26-1, 27-1, 28-4, 29-2, 30-1, 31-2, 32-3, 33-3, 34-1, 35-4, 36-1, 37-2.
При взаимодействии пропилена с $HCl$ в присутствии пероксида образуется:(A) 1-хлорпропан(B) 1,1-дихлорпропан(C) 2-хлорпропан(D) 1,2-дихлорпропан
Дата последнего обновления : 27 марта 2023 г.
•
Всего просмотров: 280,2K
•
Просмотры сегодня: 6,57K
Ответ
Проверенные
280,2K+ Просмотры
СТАВИЛИ: ВОПРОС УПРАВИТСЯ. Это означает, что существует процесс без присутствия перекиси. Возможно, результаты обоих этих процессов будут противоположными. 9{+}\]
Это явление известно как эффект пероксида.
Из приведенного выше обсуждения можно сделать вывод, что ответом на этот вопрос является (А) 1-хлорпропан.
Примечание:
Следует иметь в виду, что правило Марковникова применимо к любому асимметричному алкену или алкину, но присутствие пероксида не всегда гарантирует «анти» процесс. Есть определенные условия, которые должны быть соблюдены в первую очередь.
Недавно обновленные страницы
Большинство эубактериальных антибиотиков получено из ризобий класса 12 биологии NEET_UG
Саламиновые биоинсектициды были извлечены из биологии класса А 12 NEET_UG
Какое из следующих утверждений относительно бакуловирусов класса 12 биологии NEET_UG
Канализационные или городские канализационные трубы не должны поступать непосредственно класс 12 биологии NEET_UG
Очистка сточных вод выполняется A Микробы B Удобрения класс 12 биологии NEET_UG
Иммобилизация фермента – это преобразование активного фермента класса 12 биологии NEET_UG
Большинство эубактериальных антибиотиков получают из ризобий класса 12 биологии NEET_UG
Саламиновые биоинсектициды были извлечены из биологии класса А 12 NEET_UG
Какое из следующих утверждений относительно бакуловирусов класса 12 биологии NEET_UG
Канализационные трубы непосредственно класс 12 биологии NEET_UG
Очистка сточных вод выполняется A Микробы B Удобрения класс 12 биологии NEET_UG
Иммобилизация ферментов – это A Преобразование активного фермента класса 12 биологии NEET_UG
Актуальные сомнения

 Галогениды водорода включают хлористый водород и бромистый водород. Если вы хотите, чтобы вам подробно объяснили механизмы, внизу страницы есть ссылка.
Галогениды водорода включают хлористый водород и бромистый водород. Если вы хотите, чтобы вам подробно объяснили механизмы, внизу страницы есть ссылка.

 Он более стабилен (и поэтому его легче образовать), чем первичный карбокатион, который получился бы, если бы водород присоединился к центральному атому углерода, а бром — к концевому.
Он более стабилен (и поэтому его легче образовать), чем первичный карбокатион, который получился бы, если бы водород присоединился к центральному атому углерода, а бром — к концевому.
Leave A Comment