Повышение температуры заставило растения поглощать больше углекислого газа
Сотрудники Исследовательского центра изменения климата Университета Пердью (США) изучили адаптацию растений к повышению температуры и обнаружили, что нагревание стимулирует процессы, связанные с фотосинтезом, в том числе обмен углекислого газа. В лабораторных условиях разные растения при повышении температуры окружающей среды в среднем фиксировали больше, а выделяли меньше CO2. Работа опубликована в журнале Global Change Biology.
Углекислый газ (CO2) является естественным компонентом
атмосферы нашей планеты, однако его избыточный выброс, наряду с другими
парниковыми газами, является причиной глобального потепления. Приток
углекислоты в атмосферу осуществляется в результате натуральных процессов —
дыхания и вулканической активности, однако с начала индустриальной революции
основной вклад вносит человек, сжигая ископаемое топливо. Отток углекислого
газа производится растениями, которые в процессе фотосинтеза фиксируют СО2 и
превращают его в сахара с участием света и воды.
Специалисты по
исследованию последствий изменения климата решили выяснить, как увеличение
температуры, без изменения других параметров среды, влияет на процессы фотосинтеза
и газообмена растениями. Эксперимент
охватил разные виды растений, различающиеся по типу фотосинтеза,
продолжительности жизни (однолетние и многолетние) и произрастанию (тропические
либо нетропические). Всего в исследовании было использовано 22 вида, включая культивируемые
растения, такие как рис, кукуруза и огурцы, а также деревья, такие как береза и
сосна. Растения выращивали в лабораторных условиях и в течение недели выдерживали
при определенной температуре, от 15 до 35 градусов Цельсия. За это время
биохимические процессы должны были адаптироваться к заданным условиям.
Ученых интересовали такие параметры фотосинтеза, как скорость фиксации углерода, обусловленная работой двух ферментов-карбоксилаз, уровень генерации энергии в процессе работы электрон-транспортной цепи и уровень темнового дыхания, в процессе которого растения выделяют углекислый газ. Эти параметры были измерены у адаптированных к определенной температуре растений. Кроме того, адаптированные растения подвергали кратковременному (в течение нескольких минут) действию экстремальных температур до 50 градусов, чтобы выяснить устойчивость биохимических параметров.
В итоге все растения при
повышении температуры окружающей среды смогли адаптироваться к ней. Уровень фотосинтеза у
растений возрос, как и газообмен. Увеличилось как поглощение углекислого газа,
так и выделение его в процессе дыхания. Однако сравнение скоростей процессов
фиксации углекислого газа и дыхания показало, что нагрев в среднем сдвигает
баланс в сторону усвоения углекислоты. Кроме того, предварительная адаптация к
повышенной температуре сделала растения менее чувствительными к ее внезапному
кратковременному скачку.
Ученые отмечают, что эти обнадеживающие результаты получены при достаточном количестве воды и питательных веществ в почве. Между тем следствием глобального потепления может стать не только повышение температуры, но и засуха, поэтому надеяться на то, что экосистема сама справится с изменением климата благоприятным для человечества образом, не стоит.
С началом индустриальной революции в XVIII веке концентрация углекислого газа в атмосфере
возросла
на 43 процента. Средняя температура на планете с начала ХХ века
возросла
почти на градус.
Дарья Спасская
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Увеличиваются ли молекулы при нагревании? / Хабр
Все мы знаем, что если надуть пластиковую бутылку горячим воздухом, крепко-накрепко закрыть крышкой, а потом охладить, то бутылка сожмётся. Причина этого лежит в физике 8-го класса, или, если точнее, в законе Гей-Люссака, утверждающем, что отношение объёмов при разных температурах равно отношению абсолютных температур.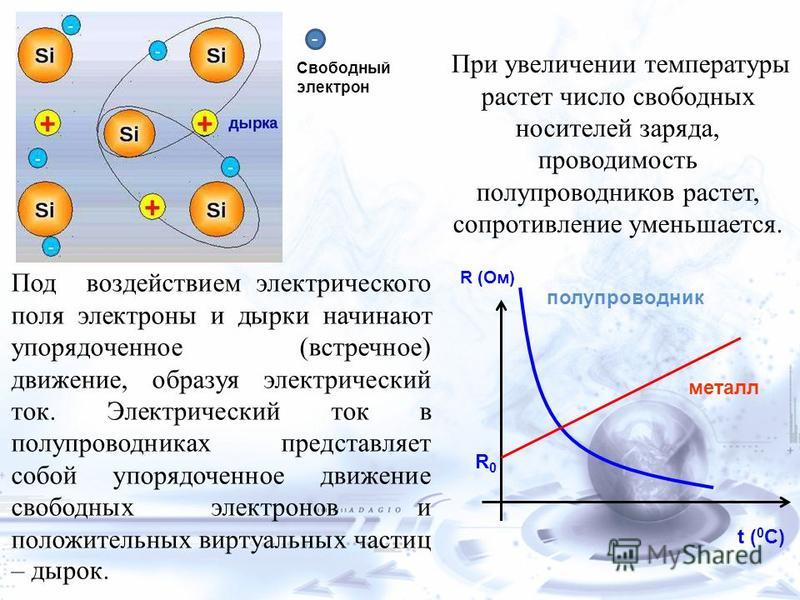 То есть ещё со школьных времён (а может и раньше) нам всем известно, что при нагревании некоторого количества газа его объём увеличивается, а при охлаждении — уменьшается.
То есть ещё со школьных времён (а может и раньше) нам всем известно, что при нагревании некоторого количества газа его объём увеличивается, а при охлаждении — уменьшается.
А что насчёт того, из чего этот газ состоит? Увеличивается ли объём самих частичек газа, то есть размер атомов и молекул? Банальный ответ на этот банальный вопрос под катом.
Ха-ха, попались!
Ответ на этот вопрос весьма прост: как мы определим
размер частиц (что такое размер атома/молекулы в зависимости от температуры), такой ответ мы и получим. Поскольку атомы по-своей сути — это одноатомные молекулы, то дальше мы будем называть все эти частицы единым термином «молекула«.
Если взять бутылку с газом, и из этой бутылки взять одну единственную молекулу, то окажется, что для неё не возможно (по-честному) даже принципиально измерить температуру. Частица находится в каком-то конкретном (квантовом) состоянии, которое мы можем определить и измерить, но при этом мы не сможем засунуть  Связанно это с тем, что «температура» — это свойство макроскопических (т.е. больших) систем, состоящих из большого числа частиц. А значит если молекул в системе мало, то и измерять у этой системы нечего. «Большое число частиц», конечно, это плавающее понятие, но обычно оно измеряется в молях, или в числах Авогадро (), поэтому очевидно, что одна молекула горааааздо меньше этого порядка величин, а значит само понятие температуры не применимо к одной, двум, да даже десяти молекулам.
Связанно это с тем, что «температура» — это свойство макроскопических (т.е. больших) систем, состоящих из большого числа частиц. А значит если молекул в системе мало, то и измерять у этой системы нечего. «Большое число частиц», конечно, это плавающее понятие, но обычно оно измеряется в молях, или в числах Авогадро (), поэтому очевидно, что одна молекула горааааздо меньше этого порядка величин, а значит само понятие температуры не применимо к одной, двум, да даже десяти молекулам.
Что такое температура?
Но что вообще такое температура? Ещё со школы мы знаем, что есть т.н. абсолютная температура T, измеряемая в градусах Кельвина. Именно она стоит во всех газовых законах, в частности в уравнении Менделеева-Клайперона.
Для забывших, как выглядит уравнение Менделеева-Клайперона
Это уравнение имеет вид , где P — давление, V — объём, n — количество вещества (в молях), R = 8.
Абсолютная температура связанна с относительной температурой t, измеряемой в градусах Цельсия, как , и абсолютный ноль (T=0, или же ) — это недостижимая величина. Ещё всем в голову вбивают мантру:
абсолютная температура является мерой средней кинетической энергии молекул.
Но эта мантра не объясняет, что же именно из себя представляет температура.
Попробуем разобраться. Начнём с простого примера. Закроем глаза и представим себе Африку: жаркую, солнечную, заполненную равнинными саваннами, и с горой Килиманджаро торчащей посередине. А ещё там есть слоны.
Каждый слон имеет определённую (большую) массу, и поэтому любое поднятие своей туши из равнинной местности в горную — это большая затрата энергии.
Представим, что слоны голодные, поэтому энергии у них мало. Будучи слоном, я бы в таком состоянии не попёрся бы в гору, а тусовался бы в саванне. В горы бы я ходил только по очень-очень большой нужде. В результате, если бы мы сняли фотографию Африки со спутника, она бы выглядела примерно так, как показано на картинке ниже: много-много слонов на равнине, и очень мало смелых и отчаянных в горах, причём, чем выше — меньше вероятность найти слона.
Будучи слоном, я бы в таком состоянии не попёрся бы в гору, а тусовался бы в саванне. В горы бы я ходил только по очень-очень большой нужде. В результате, если бы мы сняли фотографию Африки со спутника, она бы выглядела примерно так, как показано на картинке ниже: много-много слонов на равнине, и очень мало смелых и отчаянных в горах, причём, чем выше — меньше вероятность найти слона.
А теперь представим, что слоны хорошенько поели, да ещё какой-нибудь [Роскомнадзор] ещё для скорости им в еду подсыпали, так что энергии у слонов много. В этом случае, что равнина, что гора, слоны будут туда переться без особой устали, поэтому теперь вероятность отыскать слона на равнине и в горах будет отличаться уже меньше, чем в предыдущем примере (см. картинку ниже), хотя всё ещё будет сохраняться правило: чем выше на гору — тем меньше слонов.
Эти два примера весьма точно иллюстрируют случаи газа с низкой (первый) и высокой (второй) температурой. У каждой молекулы (слона) есть какая-то своя энергия, в нашем примере — это гравитационная энергия , где
 8 м/c2 — ускорение свободного падения, а h — высота над равниной. Из энергии каждой конкретной частицы (места, где нашли слона) мы не можем ничего сказать о том, как всех слонов покормили в целом, но именно то, сколько на всех выделили еды, или другими словами, сколько энергии вкачали в среднем во всю систему, даст нам распределение слонов по ландшафту Африки. Собственно, температура в наших примерах — это общая величина накормленности всех слонов во всей Африке. Именно поэтому мантра из школьного курса физики и оказывается верна — температура — это то, сколько в среднем энергии (причем, как кинетической, так и потенциальной) имеет каждая молекула, или, что в данном случае эквивалентно, какова вероятность найти частицу с очень большой энергией. Но более точно, температура — это параметр распределения Больцмана (или Гиббса) — распределения частиц по состояниям с различной энергией. Это распределение говорит нам, что чем выше температура, тем больше высокоэнергетических молекул относительно числа низкоэнергетических мы имеем.
8 м/c2 — ускорение свободного падения, а h — высота над равниной. Из энергии каждой конкретной частицы (места, где нашли слона) мы не можем ничего сказать о том, как всех слонов покормили в целом, но именно то, сколько на всех выделили еды, или другими словами, сколько энергии вкачали в среднем во всю систему, даст нам распределение слонов по ландшафту Африки. Собственно, температура в наших примерах — это общая величина накормленности всех слонов во всей Африке. Именно поэтому мантра из школьного курса физики и оказывается верна — температура — это то, сколько в среднем энергии (причем, как кинетической, так и потенциальной) имеет каждая молекула, или, что в данном случае эквивалентно, какова вероятность найти частицу с очень большой энергией. Но более точно, температура — это параметр распределения Больцмана (или Гиббса) — распределения частиц по состояниям с различной энергией. Это распределение говорит нам, что чем выше температура, тем больше высокоэнергетических молекул относительно числа низкоэнергетических мы имеем.
Собственно, распределение Больцмана имеет вид:
где n(E) — это число частиц с энергией E, R — универсальная газовая постоянная (см. предыдущий спойлер), а T, само собой, температура.
В примере же со слонами мы иллюстрировали т.н. барометрическую формулу: частный случай распределения Больцмана, показывающий как меняется давление газа с увеличением высоты:
где P(h) — это давление на высоте h, , а M — это молярная масса газа.
Растут ли атомы от температуры?
Теперь, собственно, можно перейти к вопросу: а растут ли, например, атомы при росте температуры. Само собой, каждый конкретный атом находится в каком-то квантовом состоянии, поэтому от температуры его размер не зависит, но вот средний размер всех атомов в сосуде с газом от той самой температуры зависеть уже будет.
Представим себе, например, атом водорода: тяжёлый протон, а вокруг него летает электрон. Поскольку протон положительный, а электрон отрицательный, то один притягивает другой по закону Кулона, который выглядит точно так же как ньютоновская гравитация, поэтому в этом смысле атом вполне себе напоминает, например, Солнце и Землю, летающую вокруг него. Только, как говорит нам (далеко не полностью удачная, см. например, тут) атомная модель Бора, в отличие от системы «звезда + планета», электрон летает вокруг ядра только по орбитам определённого радиуса.
Так или иначе, чем больше энергии мы закачиваем в атом водорода, тем более широкая орбита будет доступна электрону для полёта вокруг ядра. Естественно, если мы возьмём один конкретный атом, мы можем узнать его орбиту, и она ничего нам о температуре всех атомов не скажет. Но вот если мы измерим радиусы у множества атомов, а потом усредним полученные величины, то у нас действительно возникнет зависимость от температуры для этого среднего числа. В результате получится что-то типа такой картинки:
В результате получится что-то типа такой картинки:
Из неё видно, что чтобы начать замечать хоть какие-то изменения в размере электронной оболочки, нужно ооочень сильно нагреть атом (в данном случае до более 10000 градусов). Это в целом общий тренд.
Как была посчитана эта зависимость
Подробнее о формулах можно узнать в этом посте.
Если кратко, то радиус орбиты (R) в зависимости от главного квантового числа n=1,2,3… — это
где R0=5.3×10−11 метра − это боровский радиус. Энергия (E) же орбиты имеет вид
где Eh= 4.3597447222071(85)×10−18 Джоулей − это энергия Хартри.
Далее используя распределение Больцмана для одной частицы, мы можем посчитать среднее значение радиуса от температуры как
Знаменатель у нас появляется из-за того, что полная вероятность всех исходов измерений должна быть равна единице.
Иными словами,
ответ на вопрос поста: да, при нагревании электронные оболочки атомов (и молекул) в среднем расширяются. Но, это увеличение очень маленькое, и требует нагрева до очень высоких температур, к которым мы в обыденной жизни не привыкли.
Растут ли молекулы от температуры?
Теперь зададимся вопросом: а что если наша молекула составлена не из одного, а из двух, трёх или более атомов? Можем ли мы что-то сказать о межатомных расстояниях в ней, как ведут они себя при повышении температуры? Для простоты, естественно, ограничимся двухатомными молекулами, кои, в частности, составляют как минимум 98.7 % нашей атмосферы (азот и кислород).
У нас есть один атом, у нас есть второй атом: ммммм, и расстояние между ними, обозначим его как R. Как ведёт себя потенциальная энергия взаимодействия этих атомов в зависимости от R?
- Если мы разведём атомы оооочень далеко друг от друга, то химическая связь между ними давно будет разорвана.
 Поэтому особой разницы от того, что расстояние мы увеличим от «очень много» до «очень много и ещё чуть-чуть», мы не заметим. Иными словами при R → ∞ у нас должна быть горизонтальная асимптота.
Поэтому особой разницы от того, что расстояние мы увеличим от «очень много» до «очень много и ещё чуть-чуть», мы не заметим. Иными словами при R → ∞ у нас должна быть горизонтальная асимптота. - Если же, наоборот, мы будем пытаться впихнуть один атом в другой (R → 0), то в какой-то момент мы выгоним из пространства между этими атомами все электроны, ибо те не идиоты, чтобы тусоваться в токсичной высокоэнергетической атмосфере, и у нас останутся два голых положительно заряженных ядра, отталкивающиеся друг от друга через Кулоновскую силу. Т.е. при R → 0 у нас будет вертикальная асимптота, стремящая потенциальную энергию взаимодействия атомов в высокоэнергетическую бесконечность.
- Ну и, логично, что не будь какого-то минимума на этой потенциальной кривой между R=0 и R → ∞, то самих молекул о которых мы говорим, не существовало бы.
В итоге мы понимаем, что кривая потенциальной энергии взаимодействия имеет следующий вид:
Атомы в молекуле всегда колеблются, даже при абсолютном нуле, когда никакой лишней энергии не осталось. Из-за принципа неопределённости они не могут просто скатиться в минимальную по энергии точку на потенциале и
Из-за принципа неопределённости они не могут просто скатиться в минимальную по энергии точку на потенциале и сдохнуть лежать, свернувшись калачиком: им приходится совершать т.н. нулевые колебания. Если же энергия у них выше, то и колеблются они с большей амплитудой. Поэтому возникает вопрос: а как конкретно колеблются атомы?
Если бы слева и справа от точки минимума потенциал был одинаков, как, например, в случае закона Гука, то атомы во время колебаний отклонялись бы в область малых значений межатомных расстояний ровно то же количество времени, сколько и в область больших значений. В этом случае бы среднее значение межатомного расстояния при любой температуре было бы равно значению расстояния в точке минимума. Иными словами, если бы мы взяли газ, и в любой момент времени сфоткали все молекулы, а потом посчитали бы среднее значение для всех расстояний между атомами, то в итоге получили бы расстояние в точке минимума.
Но реальность у нас другая: слева от точки минимума (при R → 0) у молекулы стоит жёсткая стенка, а справа (при R → ∞) — мягкий диван. Вопрос: где будет больше времени проводить молекула: долбиться о стенку, или валяться на диване? Правильно: конечно на диване. Иными словами, распределение расстояний в молекуле, что при абсолютном нуле, что при какой-то температуре, будет несимметричным, поэтому среднее значение расстояний будет сдвинуто в сторону больших расстояний относительно минимального. Мало того, при повышении температуры, т.е. когда мы будем закачивать больше кинетической энергии в систему, увеличивая амплитуду колебаний, молекула будет видеть гораздо более жёсткую стенку, и гораздо более мягкий диван. Поэтому среднее значение межатомных расстояний будет расти с ростом температуры, а значит и средний размер молекул, причём всех, не только двухатомных, будет увеличиваться.
Вопрос: где будет больше времени проводить молекула: долбиться о стенку, или валяться на диване? Правильно: конечно на диване. Иными словами, распределение расстояний в молекуле, что при абсолютном нуле, что при какой-то температуре, будет несимметричным, поэтому среднее значение расстояний будет сдвинуто в сторону больших расстояний относительно минимального. Мало того, при повышении температуры, т.е. когда мы будем закачивать больше кинетической энергии в систему, увеличивая амплитуду колебаний, молекула будет видеть гораздо более жёсткую стенку, и гораздо более мягкий диван. Поэтому среднее значение межатомных расстояний будет расти с ростом температуры, а значит и средний размер молекул, причём всех, не только двухатомных, будет увеличиваться.
К сожалению, чтобы посчитать этот рост среднего расстояния, потребуется много больше усилий, чем в случае атома водорода. Но можно пойти другим путём, и поискать, а не исследовался ли этот вопрос в экспериментах?
И порывшись на просторах этих наших Интернетов, можно набрести на следующую работу: J. Chem. Phys. 79, 170 (1983). В ней делали эксперимент буквально описанный выше:
Chem. Phys. 79, 170 (1983). В ней делали эксперимент буквально описанный выше:
- брали кучу молекул углекислого газа (CO2) и нагревали их до разных температур, в диапазоне температур от комнатной (300 K ≈ 25oC) до «ай как горячо» (1000 К ≈ 730oC ),
- при каждой выбранной температуре делали «фотку» всех молекул при помощи электронов (этот метод зовётся газовой электронографией, о нём можно немного почитать здесь),
- ну а дальше буквально измеряли средние значения для межатомных расстояний на каждой фотке.
В результате они, в частности, получили следующую зависимость средней длины двойной связи C=O в молекуле углекислого газа (O=C=O):
Из графика видно, что при нагреве от комнатной температуры до 1000 градусов К это среднее значение выросло почти на 0.004 Å (1 ангстрем, Å, = 10—10 метров). Конечно, в наших привычных величинах это очень мало, но сама длина связи C=O в этой молекуле составляет 1. 2 Å, так что это рост на почти 0.3 %! Вполне себе заметная величина при нагреве, достижимом привычными средствами (например, газовой плитой).
2 Å, так что это рост на почти 0.3 %! Вполне себе заметная величина при нагреве, достижимом привычными средствами (например, газовой плитой).
Зачем это вообще знать?
Да хотя бы просто ради любопытства. Разве не прикольно поспорить с коллегой на чашку кофе, что при нагреве контейнера с едой в микроволновке помимо объёма газа увеличится и размер частиц газа? Ну и в практическом смысле это тоже важно. Все эти температурные расширения/уменьшения всяких макроскопических объектов, таких как рельсы, провода линий электропередач, да даже крышки банки под горячей водой, работают ровно по тому же механизму, что и для молекул газа: средние межатомные расстояния увеличиваются, т.к. в систему при увеличении температуры закачивается больше энергии движения частиц. И по-моему, осознание того, что за такими обыденными явлениями стоят такие нетривиальные процессы, вдохновляет на новые подвиги и свершения.
Всех благ, и да пребудет с Вами межатомная сила.
21.1: Энтропия увеличивается с повышением температуры
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 14476
Цели обучения
- Дать определение энтропии и ее связи с потоком энергии.
Мы можем составить вместе первый и второй закон для обратимого процесса, в котором нет другой работы, кроме объемной (\(PV\)) работы, и получить:
\[dU= δq_{rev} + δw_{rev} \nonumber \]
Энтропия – это рассеяние энергии и связано с теплотой:
\[δq_{об}= TdS \nonumber \]
Работа связана с изменением объема:
\[δw_{об}= -PdV \nonumber \]
Подставляем их в наше выражение для \(dU\) для обратимых изменений:
\[dU= TdS -PdV \nonumber \]
У нас больше нет функций пути в выражении, так как \(U\), \(S\) и \(V\) все функции состояния . Это означает, что это выражение должно быть точным дифференциалом. Мы можем обобщить выражение для необратимых процессов, но тогда оно превратится в неравенство:
Это означает, что это выражение должно быть точным дифференциалом. Мы можем обобщить выражение для необратимых процессов, но тогда оно превратится в неравенство:
\[dU≤ TdS — PdV \nonumber \]
и объем: \(U(S,V)\). \(S\) и \(V\) — это 9{T_2}{\frac{C_V(T)}{T}dT} \nonumber \]
Если мы знаем, как \(C_V\) изменяется с температурой, мы можем вычислить изменение энтропии, \(\Delta S\ ). Поскольку теплоемкость всегда положительна, энтропия должна увеличиваться с повышением температуры. Ничто не мешает нам выразить \(U\) в других переменных, например \(Т\) и \(V\). На самом деле, если мы это сделаем, мы сможем вывести некоторые интересные соотношения.
Пример 21.1.1
- Запишите \(U\) как функцию \(T\) и \(V\).
- Запишите \(U\) как функцию своих естественных переменных.
- Переставьте (2), чтобы найти выражение для \(dS\).
- Замените (1) на (3) и переставьте. Это определение \(C_V\).

- Запишите \(S\) как функцию \(T\) и \(V\).
Мы также можем вывести выражение для изменения энтропии как функции теплоемкости при постоянном давлении, \(C_P\). Для начала нам нужно перейти от внутренней энергии \(U\) к энтальпии \(H\):
\[\begin{align*} H &= U + PV \\[4pt] dH &= dU +d(PV) \\[4pt] &= dU + PdV + VdP \end{align*} \nonumber \]
Для обратимых процессов:
\[\begin{align*} dH &= dU + PdV + VdP \\[4pt] &= TdS -PdV + PdV + VP \\[4pt] &= TdS + VdP \end{align*} \nonumber \]
Естественными переменными энтальпии являются \(S\) и \(P\) (не: \(V\)). Вывод, подобный приведенному выше, показывает, что изменение энтропии при температуре связано с теплоемкостью при постоянном давлении: 9{T_2}{\frac{C_P(T)}{T}dT} \nonumber \]
Это означает, что если мы знаем теплоемкости как функцию температуры, мы можем рассчитать, как энтропия изменяется с температурой. Обычно проще получить данные при постоянных \(P\) условиях, чем при постоянных \(V\), поэтому маршрут с \(C_p\) является более распространенным.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
Изменение климата – повышение температуры
Избранные онлайн-программы
Повышение температуры
В последние годы ученые отмечают быстрое повышение средней температуры по всей стране. Согласно отчету Совета по защите национальных ресурсов (NRDC) под названием «Убийственная летняя жара», к концу 21 века средняя температура в Соединенных Штатах может подняться на целых 11 градусов по Фаренгейту. «Риски для здоровья населения наиболее велики, когда высокие температуры смешиваются с другими погодными условиями, вызывая то, что известно как «экстремальная жара» или EHE», — говорится в отчете. Дни EHE происходят, когда температура, температура точки росы, облачный покров, скорость ветра и приземное атмосферное давление создают условия, достаточно опасные, чтобы вызвать смертельные случаи, связанные с жарой.
Согласно отчету Совета по защите национальных ресурсов (NRDC) под названием «Убийственная летняя жара», к концу 21 века средняя температура в Соединенных Штатах может подняться на целых 11 градусов по Фаренгейту. «Риски для здоровья населения наиболее велики, когда высокие температуры смешиваются с другими погодными условиями, вызывая то, что известно как «экстремальная жара» или EHE», — говорится в отчете. Дни EHE происходят, когда температура, температура точки росы, облачный покров, скорость ветра и приземное атмосферное давление создают условия, достаточно опасные, чтобы вызвать смертельные случаи, связанные с жарой.
Данные через NCDC. По данным четырех основных глобальных метеорологических и атмосферных агентств, за последние 30 лет температура постепенно повышалась; 2000-е официально объявлены самым теплым десятилетием в истории человечества.
Большинство экспертов по изменению климата согласны с тем, что парниковые газы, которые удерживают тепло и не дают ему покинуть атмосферу Земли, в основном ответственны за скачок температуры. Несмотря на то, что во всем мире делается акцент на сокращении выбросов парниковых газов, температура продолжает расти. Статья в Science Daily недавно отметил, что только в марте 2012 года в Соединенных Штатах было побито более 15 000 однодневных температурных рекордов.
Несмотря на то, что во всем мире делается акцент на сокращении выбросов парниковых газов, температура продолжает расти. Статья в Science Daily недавно отметил, что только в марте 2012 года в Соединенных Штатах было побито более 15 000 однодневных температурных рекордов.
Предыдущие EHE (такие как мощная волна тепла, обрушившаяся на Южную Калифорнию в 2006 г.) стали причиной тысяч смертей и травм; теперь, по прогнозам NRDC, к 2100 году из-за изменения климата умрут до 150 000 американцев. Центры по контролю за заболеваниями (CDC) отмечают, что пожилые люди, младенцы и хронически больные люди считаются наиболее уязвимыми для смерти, связанной с жарой. . К наиболее частым причинам смерти, связанным с повышением температуры, относятся следующие состояния:
- Тепловое истощение: По данным клиники Майо, тепловое истощение характеризуется обильным потоотделением и учащенным пульсом/сердцебиением; эти два симптома по существу указывают на перегрев тела. Другие признаки теплового истощения включают головокружение, низкое кровяное давление и мышечные спазмы.
 Люди, которые подозревают, что у них тепловое истощение, должны немедленно прекратить все, что они делают, уйти в относительно прохладное место и пить прохладную воду или спортивные напитки, наполненные электролитом.
Люди, которые подозревают, что у них тепловое истощение, должны немедленно прекратить все, что они делают, уйти в относительно прохладное место и пить прохладную воду или спортивные напитки, наполненные электролитом. - Тепловой удар: Тепловой удар можно охарактеризовать как «усугубляющееся тепловое истощение»; Клиника Майо отмечает, что у людей с диагнозом теплового удара обычно температура превышает 104 градуса по Фаренгейту. В дополнение к температуре наружного воздуха симптомы теплового удара могут усугубляться приемом рецептурных препаратов, ранее существовавшими заболеваниями, высокой влажностью и даже употреблением алкоголя в жаркий день. В отличие от теплового удара, тепловой удар требует медицинской помощи; невылеченный тепловой удар может негативно повлиять на мозг, сердце, почки и мышцы.
- Сердечно-сосудистые заболевания: По данным Национального института наук об окружающей среде, экстремальная жара (как и экстремальный холод) связана с более высоким уровнем заболеваемости сердечно-сосудистыми заболеваниями и состояниями, такими как инсульты и аритмия.
 Сердечно-сосудистые заболевания уже являются самым смертоносным заболеванием в Соединенных Штатах, а инсульты занимают третье место среди основных причин смерти в стране.
Сердечно-сосудистые заболевания уже являются самым смертоносным заболеванием в Соединенных Штатах, а инсульты занимают третье место среди основных причин смерти в стране. - Болезнь почек: Длительное воздействие чрезмерно высоких температур может привести к серьезным проблемам с почками, примечания American Family Physician автор Джеймс Л. Глейзер, доктор медицинских наук. Рабдомиолиз, состояние, вызванное повреждением тканей, часто возникает в результате теплового удара и связано с длительным заболеванием почек. Также может быть нарушена способность организма регулировать потребление воды, что может привести к инфекциям почек и/или мочевого пузыря.
- Обострение аллергии: Поскольку два основных аллергена — пыльца и амброзия — распространяются в относительно теплые месяцы; EPA отмечает, что весенние сезоны аллергии наступают каждый год раньше в результате повышения температуры.
В дополнение к человеческим жертвам необходимо учитывать значительные финансовые последствия.

 Поэтому особой разницы от того, что расстояние мы увеличим от «очень много» до «очень много и ещё чуть-чуть», мы не заметим. Иными словами при R → ∞ у нас должна быть горизонтальная асимптота.
Поэтому особой разницы от того, что расстояние мы увеличим от «очень много» до «очень много и ещё чуть-чуть», мы не заметим. Иными словами при R → ∞ у нас должна быть горизонтальная асимптота.
 Люди, которые подозревают, что у них тепловое истощение, должны немедленно прекратить все, что они делают, уйти в относительно прохладное место и пить прохладную воду или спортивные напитки, наполненные электролитом.
Люди, которые подозревают, что у них тепловое истощение, должны немедленно прекратить все, что они делают, уйти в относительно прохладное место и пить прохладную воду или спортивные напитки, наполненные электролитом. Сердечно-сосудистые заболевания уже являются самым смертоносным заболеванием в Соединенных Штатах, а инсульты занимают третье место среди основных причин смерти в стране.
Сердечно-сосудистые заболевания уже являются самым смертоносным заболеванием в Соединенных Штатах, а инсульты занимают третье место среди основных причин смерти в стране.
Leave A Comment