Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Режим работы и обучения
Студенту
Информация для студентов очной и заочной формы обученияЦентр дополнительного образования и профориентационной работы
Факультет последипломного образования
Информация о вузе
Информация о ПМФИВиртуальный кабинет психологической помощи
О приеме заявлений о зачислении в порядке перевода от граждан РФ, Украины, Донецкой и Луганской народных республик
Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВO ВолгГМУ Минздрава России осуществляет прием заявлений о зачислении в порядке перевода от граждан Российской Федерации, а также от граждан Украины, Донецкой и Луганской народных республик, вынужденно покинувших территорию республик и прибывших на территорию Российской Федерации, изъявивших желание перевестись для обучения в ПМФИ.
Перевод осуществляется на программы, реализуемые в ПМФИ, в соответствии с действующим законодательством, Положениями и Уставом ВолгГМУ.
Заявления о переводе принимаются ежедневно с 9:00 до 17:00 (выходные дни: суббота, воскресенье).
Ответственные сотрудники за прием заявлений о переводе:
ЧАХИРОВА Виктория Анатольевна, начальник учебного отдела
Тел. +7 (906) 460-09-80
e-mail: [email protected]
Дирекция ПМФИ
Центр дополнительного образования и профориентационной работы
Повышение квалификации
- Для педагогических работников
Профессиональная переподготовка
- Для педагогических работников
ПМФИ в: Youtube Instagram Вконтакте
Юбилей ПМФИ — 75
СЛОВО ДИРЕКТОРА
О ВУЗЕ
Пятигорский медико-фармацевтический институт, как правопреемник Пятигорской государственной фармацевтической академии, является признанным лидером фармацевтического образования России.
Ахвердова Ольга Альбертовна
Директор, доктор психологических наук, кандидат медицинских наук
Подробнее о вузе
Виртуальный кабинет психологической помощи
Очные психологические консультации (с использованием дистанционных технологий)
Время работы: пятница с 18:00 — 20:00 (платформа VooVMeeting)
Психолог invites you to a meeting on VooVMeeting
Meeting Topic: Психологическая служба
Meeting Time: 2022/3/18 17:00-19:00 (GMT+03:00) Moscow Standard Time — Moscow Recurrence:Every Fri
Click the link to join the meeting or to add it to your meeting list: https://voovmeeting.com/dm/9LrpICRwUcOT
#VooVMeeting: 818-0338-2767 Meeting Password: 12345
Attendees: Психолог
Заочные психологические консультации
e-mail: ovz@pmedpharm. ru
ru
Подробнее
Дополнительное профессиональное образование медицинских и фармацевтических специалистов
Все программы разработаны в соответствии с требованиями профессиональных стандартов, нормативной базой министерства здравоохранения и министерства образования Российской Федерации.
Для специалистов с высшим и средним профессиональным фармацевтическим и медицинским образованием:
- Провизоров;
- Фармацевтов;
- Врачей;
- Среднего медицинского персонала;
Больше информации
Новости
Читать все
В ПМФИ прошёл открытый турнир города Пятигорска по парковому волейболу среди женских команд 4х4
14 марта 2023
Студенты-первокурсники отметили Всемирный день чтения вслух
13 марта 2023
Как связаны Кисловодск и 8 Марта?
7 марта 2023
В ПМФИ прошёл турнир по волейболу среди женских команд вузов Пятигорска
7 марта 2023
А ну-ка, девушки!
7 марта 2023
Директор ПМФИ Ольга Альбертовна Ахвердова поздравляет сотрудниц института с 8 Марта
7 марта 2023
Расписание он-лайн
Уточните курс и группу для просмотра актуального расписания.
Посмотреть расписание
Материалы
Доступ к методическим,
консультационным и справочным
материалам, лекциям, тестовым
заданиям.
Узнать больше
Галерея Посмотреть фотографии
Кафедры и подразделения
Учебный процесс в вузе осуществляется на 27 кафедрах
и в 41 подразделении.
Узнать больше
Сайт олимпиады ЖМИ здесь и участвуй!
ПМФИ — Соорганизатор направления «Фармация», материалы
Главный корпус ПМФИ —
Пятигорского филиала ФГБОУ ВО ВолгГМУ
Минздрава России
Объявления
Важно
Летняя онлайн языковая школа в Центре мировых языков и культур
26 мая 2022
Важно
Летняя профильная школа Юного провизора Пятигорского медико-фармацевтического института начнет свою работу в июне
23 мая 2022
Важно
Собеседование на восстановление по специальности «Фармация», «Стоматология», «Лечебное дело», «Медицинская биохимия», будет проходить 30 августа 2021 г.
6 июля 2021
Читать все
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование:
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
№1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
— полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
— полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13. 07.2016.
07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
Что такое Водородное топливо — Свойства Водорода
Lh3 является самым экологически чистым видом моторного топлива, поэтому его перспективы очевидны
Водородное топливоВ Австралии на бурых углях в штате Виктория отрабатывается технология технология газификации угля с последующим выделением водорода, вернее удаления серы, ртути и двуокиси углерода (СО2).
В Норвегии — Nel Hydrogen отрабатывает технологию использования ВИЭ для высокотемпературного электролиза для разделения воды на водород и кислород, который будет выбрасываться в атмосферу.
Kawasaki Heavy Industries разрабатывает морской танкер — водородовоз для транспортировки жидкого водорода ( LH2).
Водород
Водород (H) является самым распространенным элементом на Земле, но в обычных условиях он не встречается ни в виде водорода H, ни в виде газообразного водорода (H2).
Благодаря своим характеристикам он легко вступает в реакцию с другими органическими соединениями с образованием, например, воды (H2O).
Во время этой реакции образования воды из водорода и воздуха выделяется энергия, которую можно использовать в качестве электричества.
Чтобы сделать эту реакцию полезной для промышленного производства электроэнергии, необходимо произвести водород, например из воды путем разделения атомов на кислород и водород посредством электролиза.
Есть другие технологии:
- использование газов, оставшихся от химических процессов, например метана, угля, нефти и биомассы.
Для производства водорода существуют разные способы, которые сильно различаются как с точки зрения экологичности, так и с точки зрения стоимости.
Экологичность — важный критерий производства водорода.
Чем больше оксидов углерода выделяется при производстве водорода, тем менее экологичным он будет считаться.
Для простоты каждый «сорт» произведенного по разным технологиям принято обозначать цветом, хотя правильнее — по углеродному следу.
Реакция взаимодействия водорода с кислородом происходит с выделением тепла.
Если взять 1 моль H2 (2 г) и 0,5 моль O2 (16 г) при стандартных условиях и возбудить реакцию, то согласно уравнению
Н2 + 0,5 О2= Н2О
после завершения реакции образуется 1 моль H2O (18 г) с выделением энергии 285,8 кДж/моль.
Для сравнения: теплота сгорания ацетилена — 1300 кДж/моль, пропана — 2200 кДж/моль.
1 м³ водорода весит 89,8 г (44,9 моль), поэтому для получения 1 м³ водорода будет затрачено 12832,4 кДж энергии.
1 кВт*ч = 3600 кДж, поэтому получим 3,56 кВт*ч электроэнергии.
Целесообразность перехода на водородное топливо можно оценить, сравнив имеющийся тариф на 1 кВт*ч электричества и, к примеру, стоимость 1 м³ газа или стоимость другого энергоносителя.
При сжигании водорода получается чистая вода.
То есть водородное топливо производится без вреда для окружающей среды, в отличие от газа или бензина.
Для получения водорода используют химические методы, в тч реакции разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа.
Она проводится при высокой температуре:
СН4 + 2Н20 = CO2 + 4Н2 — 165 кДж
- 1.Электролиз водных растворов солей:
2NaCl + 2H2O → h3↑ + 2NaOH + Cl2
- 2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
h3O + C ⇄ h3 + CO
-
3.Из природного газа.

Конверсия с водяным паром: CH4 + H2O ⇄ CO + 3H2 (1000 °C) Каталитическое окисление кислородом: 2CH4 + O2 ⇄ 2CO + 4H2
- 4. Крекинг и реформинг углеводородов в процессе переработки нефти.
- 5. Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и соляную кислоту:
Zn + 2HCl → ZnCl2 + H2↑
- 6.Взаимодействие кальция с водой:
Ca + 2H2O → Ca(OH)2 + H2↑
- 7.Гидролиз гидридов:
NaH + H2O → NaOH + H2↑
- 8.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Zn + 2KOH + 2H2O → K2[Zn(OH)4] + h3↑
-
9 .
 С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e— → H2↑ + 2H2O
- Биореактор для производства водорода
Газообразный водород может существовать в 2х формах (модификациях) — в виде орто — и пара-водорода.
В молекуле ортоводорода (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны).
Разделить аллотропные формы водорода можно адсорбцией на активном угле при температуре жидкого азота.
При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода.
При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25).
Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25).
Без катализатора превращение происходит медленно, что дает возможность изучить свойства отдельных аллотропных форм.
Молекула водорода двухатомна — Н₂. При обычных условиях — это газ без цвета, запаха и вкуса.
Водород — самый легкий газ, его плотность во много раз меньше плотности воздуха. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре.
Как самые легкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому.
Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Молекулы водорода Н₂ довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2=2Н — 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2 и с единственным неметаллом — фтором, образуя фтороводород:
F2+H2=2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении.
Он может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н20
Записанное уравнение отражает реакцию восстановления — процесс, в результате которого от соединения отнимается кислород; вещества, отнимающие кислород, называются восстановителями (при этом они сами окисляются).
Реакция восстановления противоположна реакции окисления.
Обе эти реакции всегда протекают одновременно как 1 процесс: при окислении (восстановлении) одного вещества обязательно одновременно происходит восстановление (окисление) другого.
N2 + 3H2 → 2 NH3
С галогенами образует галогеноводороды:
F2 + H2 → 2 HF, реакция протекает со взрывом в темноте и при любой температуре, Cl2 + H2 → 2 HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH4
Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2O Fe2O3 + 3H2 → 2 Fe + 3H2O WO3 + 3H2 → W + 3H2O
Геохимия водорода
Водород — самый распространенный элемент, и все элементы образуются из него в результате термоядерных и ядерных реакций.
На Земле содержание водорода понижено по сравнению с Солнцем.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением.
Он мигрирует в верхние слои атмосферы и улетучивается в космос.
- для атомно-водородной сварки,
- в пищевой промышленности, как пищевая добавка E949- упаковочный газ, для производства маргарина из жидких растительных масел,
- химической промышленности — при производстве аммиака, мыла и пластмасс,
- в качестве ракетного топлива,
Водородная энергетика
Водороду уделяется такое пристальное внимание не зря.
Подобно батареям, водород в основном используется как форма хранения энергии.
Они оба зависят от первичной энергии, такой как солнечная и ветровая, для зарядки или генерации, и при необходимости могут быть преобразованы в электричество.
Тем не менее, водород превосходит батареи по многим параметрам:
- более чистый производственный процесс,
- нулевое загрязнение после утилизации; более высокая плотность энергии.

Водород можно производить с помощью воды и электричества, а батареи часто зависят от токсичных материалов, таких как цинк, никель и марганец, которые оказывают неблагоприятное воздействие на окружающую среду при их добыче в открытых карьерах или на морском дне и после их утилизации.
При преобразовании водорода в электричество производится только вода и тепло.
Водород также имеет гораздо более высокую плотность энергии (33 кВт*ч / кг), чем батареи (около 1 кВт*ч / кг), и чем бензин и дизельное топливо (около 12 кВт*ч / кг), что делает его особенно выгодным для транспорта и в качестве мобильного энергоносителя
Водород при смеси с воздухом образует взрывоопасную смесь — гремучий газ.
Наибольшую взрывоопасность — при объемном отношении водорода и кислорода 2:1, или водорода и воздуха приближенно 2:5, так как в воздухе кислорода содержится примерно 21%.
Водород пожароопасен.
Объяснение урока: Термическое разложение | Nagwa
В этом объяснителе мы научимся описывать и приводить примеры реакций термического разложения.
Реакция разложения включает расщепление соединения на более простые соединения или даже элементы.
Перекись водорода — это химическое вещество, содержащее кислород и водород и являющееся ключевым ингредиентом многих типов красок для волос. Перекись водорода не очень стабильное соединение, и со временем она будет постепенно разлагаться с образованием воды и кислорода.
Следующее уравнение показывает этот процесс разложения: перекись водородавода+кислород2HO()2HO()+O()2222llg
Безусловно, наиболее распространенным типом реакции разложения является термическое разложение. Как следует из названия, термальный разложение описывает вещество, которое разлагается при нагревании.
Многие химические соединения различных типов разлагаются при нагревании. Типичным примером являются карбонаты металлов.
Типичным примером являются карбонаты металлов.
Определение: Термическое разложение
Термическое разложение – это распад вещества при нагревании с образованием двух или более других веществ.
Многие карбонаты металлов разлагаются при нагревании с образованием оксида металла и диоксида углерода, как показано ниже. общее словесное уравнение.
Реакция: разложение карбоната металла
Карбонат металламеталлоксид+диоксид углерода
Мы знаем, что реакции термического разложения являются химическими реакциями, поскольку образуются новые вещества, хотя мы этого не делаем. взаимодействие карбоната с любыми другими химическими веществами.
Термическое разложение может происходить для многих различных карбонатов, но не для всех карбонатов металлов. Например, медь, свинец,
и все карбонаты цинка разрушаются при нагревании с помощью горелки Бунзена. Однако другие карбонаты, такие как карбонат калия,
не будет термически разлагаться, если не будет нагрет до очень высокой температуры.
Рассмотрим некоторые словесные и символьные уравнения для этих реакций.
Термическое разложение карбоната меди — захватывающая реакция. Мы можем наблюдать некоторые интересные цвета изменяется по мере того, как сине-зеленый карбонат меди превращается в угольно-черный оксид меди следующим образом: карбонат меди(II)оксид+диоксид углеродаCuCO()CuO()+CO()32ssg
Аналогичным образом карбонат свинца разлагается при нагревании: карбонат свинца(II)оксид+диоксид углеродаPbCO()PbO()+CO()32ssg
Пример 1. Определение массы продуктов реакции термического разложения
Студент поместил небольшое количество карбоната цинка в пробирку. Она взвесила пробирку и цинк карбоната и нашли их массу равной 55 г. Затем она сильно нагревают пробирку в течение 5 минут. После того, как пробирка остыла, она снова взвесила ее и оставшийся внутри порошок. Что нового масса пробирки и соединения цинка?
- Более 55 г
- Менее 55 г
- 55 г
Ответ
По закону сохранения массы масса реагентов в начале реакции
должна равняться массе продуктов в конце реакции.
Таким образом, в конце реакции карбонат цинка прореагирует, превратившись в оксид цинка и углерод. диоксид. Однако углекислый газ — это газ, поэтому он вырвется из пробирки. Без углекислый газ, новая масса будет представлять собой только пробирку и оставшийся оксид цинка, который будет быть менее 55 г. Правильный ответ Б.
Карбонат цинка также может термически разлагаться, хотя и не так быстро, как карбонат свинца и меди: карбонат цинкацинкоксид+диоксид углеродаZnCO()ZnO()+CO()32ssg
Пример 2. Определение правильного химического уравнения для разложения карбоната цинка
Какое из следующих химических уравнений описывает термическое разложение карбоната цинка?
- ZnCO()ZnO()+CO()32ssg
- ZnO()+CO()ZnCO()sgs23
- ZnC+O()2ZnO()+CO()222gsg
- 2ZnO()+C()2Zn()+CO()ssg2
- 2Zn()+O()2ZnO()sgs2
Ответ
более простые вещества. В случае
карбоната, это включает образование оксида и углекислого газа.
Если мы посмотрим на доступные нам варианты, мы увидим правильную формулу карбоната цинка. (ZnCO3) в ответе А и ответе Б. Однако только в ответе А мы имеем вещество, разбито, что является нашим определением разложения, поэтому правильный ответ — А.
Давайте посмотрим на устройство, которое мы могли бы использовать для проведения реакции термического разложения.
Существует несколько различных способов установки этого аппарата, но большинство установок состоят из
- пробирки для нагрева,
- пробирки для подачи,
- пробирки с небольшим количеством известковой воды.
Карбонат можно нагреть, а полученный диоксид углерода проверить, чтобы мы знали, когда произошла реакция. Типичная установка показана на рисунке ниже.
В случае с карбонатом меди достаточно легко заметить, что реакция произошла, потому что нет сине-зеленое твердое вещество остается.
В случае карбоната цинка определить сложнее, так как карбонат и твердый оксид
оба белого цвета. Чтобы определить, разложился ли карбонат цинка, мы можем проверить образование углекислого газа.
Чтобы определить, разложился ли карбонат цинка, мы можем проверить образование углекислого газа.
Углекислый газ можно проверить с помощью водного раствора гидроксида кальция, известного как известковая вода. Когда мы пузыримся углекислого газа через известковую воду, происходит химическая реакция, и известковая вода мутнеет.
Пример 3. Использование утверждений для описания реакции разложения
Какое из следующих утверждений верно?
Ответ
В этом вопросе диаграмма дает нам несколько вариантов ответа. Первый выбор относится к тому, разрушается ли оксид вниз в карбонат или карбонат распадается на оксид. Оксид – более простое вещество, чем карбонат.
Термическое разложение основано на расщеплении веществ под действием тепла с образованием более простых веществ, поэтому Утверждение внизу «карбонат распадается на оксид» является правильным первым шагом.
Второй вариант, который у нас есть, относится к другому продукту этой реакции. Карбонат состоит из атома металла в виде
а также атомы углерода и кислорода.
Карбонат состоит из атома металла в виде
а также атомы углерода и кислорода.
В реакции разложения атомы углерода и кислорода удаляются в виде газообразного диоксида углерода. Известковая вода, на с другой стороны, представляет собой насыщенный раствор гидроксида кальция, используемый для проверки на наличие углекислого газа.
Учитывая информацию, становится ясно, что вторым продуктом этой реакции разложения является углекислый газ, и поэтому утверждение 4 является правильным ответом.
При проведении реакции термического разложения необходимо учитывать важные соображения безопасности. Когда
реакция закончилась, необходимо, чтобы пробирка с известковой водой была отделена от пробирки подачи. Если этого не сделать, то по мере остывания оборудования газ в нагнетательной трубке и пробирке будет сжиматься.
сокращение будет всасывать холодную известковую воду вверх по трубке подачи и в еще очень горячую пробирку, что может вызвать
стекло треснет или даже разобьется.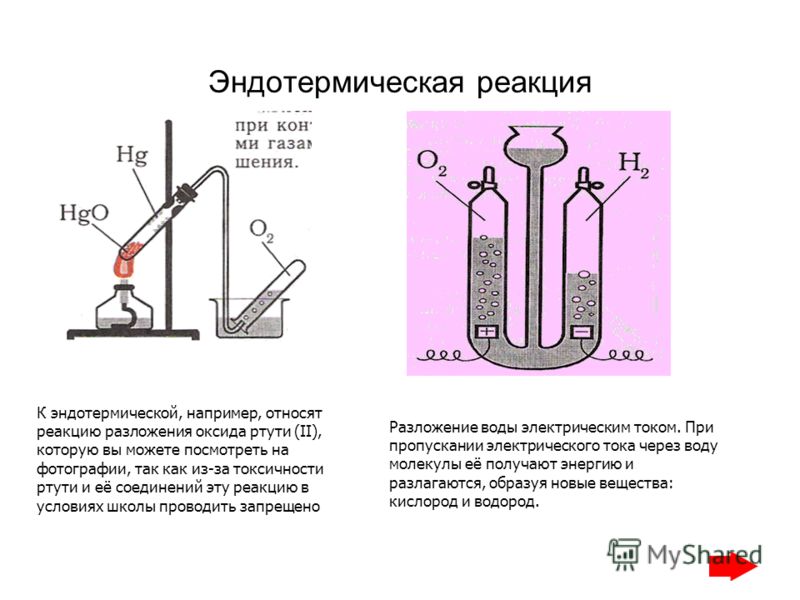 Этот эффект известен как обратный всасывающий .
Этот эффект известен как обратный всасывающий .
Реакции термического разложения имеют множество применений во всем мире.
Например, карбонат кальция термически разлагается с образованием оксида кальция (CaO), а также известный как негашеная известь. Негашеная известь была важным ингредиентом в производстве бетона.
Термическое разложение также полезно при обжиге некоторых нечистых руд. Малахит — медная руда, содержащая большая доля карбоната меди; характерный цвет можно увидеть на фотографии ниже.
Карбонат меди в малахите можно превратить в оксид меди путем термического разложения.
Пример 4: Определение исходного материала, присутствующего в малахите
Малахит представляет собой нечистую руду, используемую для образования оксида меди(II). Производство оксида меди(II) предполагает обжиг малахита в большой печи при высоких температурах. Какой химикат должен быть присутствует в малахите с образованием оксида меди(II) при реакциях, протекающих внутри печи?
- Медь(II) карбонат
- Медь хлорид
- Медь(II) оксид
- Медь металлическая
- Медь сульфид
Ответ
в значительных
количества с соединениями в руде.
В реакциях термического разложения карбонаты металлов разлагаются под действием тепла с образованием оксидов металлов и диоксида углерода.
Для того, чтобы в конце процесса обжига присутствовал оксид меди, соединение меди, способное к термическому разложению должен был присутствовать в малахите.
Глядя на список различных доступных нам вариантов, единственное медное вещество, способное к термическому разложению для легкого образования оксида меди (II) из этого списка является карбонатом меди (II), поэтому правильный ответ — A.
Последний пример — разложение вещества, известного как азид натрия. Азид натрия (NaN3) это химическое вещество, содержащееся в некоторых типах автомобильных подушек безопасности.
Электронный контроллер взрывает смесь азида и других химикатов при обнаружении сильного удара. Взрыв производит достаточно тепла, чтобы разложить азид натрия и произвести большие объемы газообразного азота. наполнение подушки безопасности: азид натрия+азот2NaN()2Na()+3N()32ssg
Карбонаты — не единственные типы химических веществ, которые могут быть термически разложены:
Гидроксид меди, светло-голубое твердое вещество, также может быть разложен при нагревании: гидроксид меди(II)оксид+водаCu(OH)()CuO()+HO()22ssg
Другое соединение меди, сульфат меди, также может термически разлагаться с образованием кислого газа триоксида серы и оксида меди: сульфат меди(II)оксид+триоксид серыCuSO()CuO()+SO()43ssg
Реакция разложения, получившая известность благодаря работе Джозефа Пристли и Антиона Лавуазье, была разложение оксида ртути, HgO: оксид ртутиртуть+кислород2HgO()2Hg()+O()slg2
Кислород, образующийся в результате этой реакции, может снова зажечь светящуюся лучинку.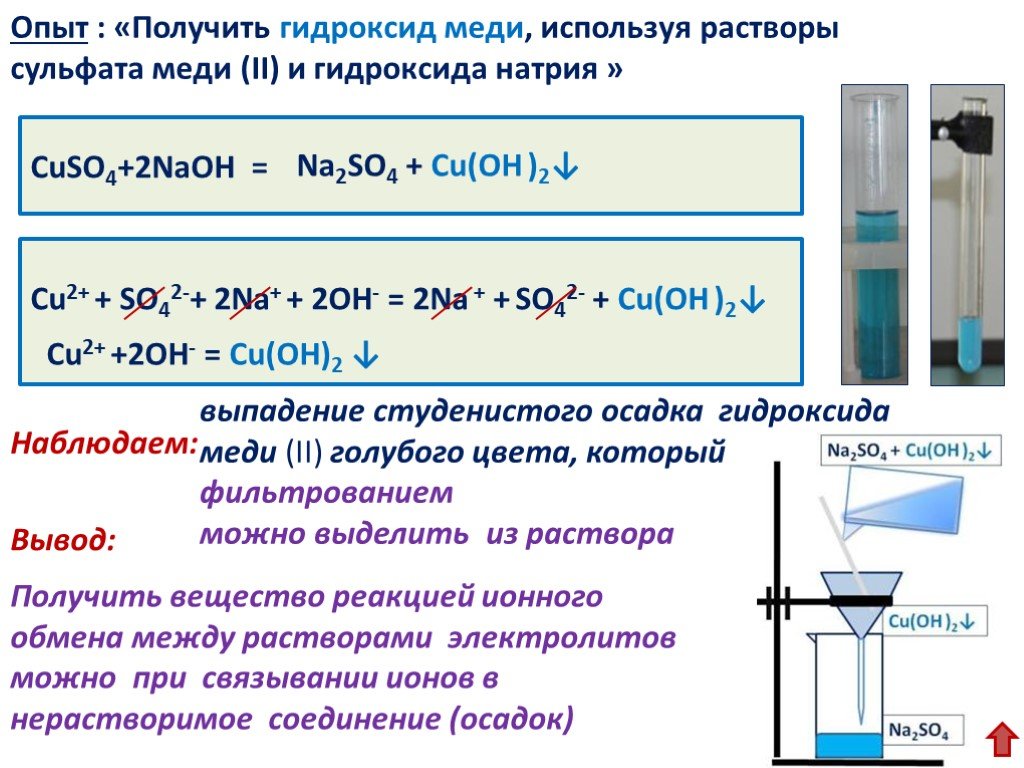
Последним примером термического разложения, который мы рассмотрим, является термическое разложение нитрата натрия с образованием желто-белая нитритная соль натрия и газообразный кислород: нитрат натриянитрит натрия+кислород2NaNO()2NaNO()+O()322ssg
Пример 5: Идентификация обычного соединения, присутствующего при сжигании нескольких соединений меди
Некоторые из следующих соединений меди могут подвергаться термическому разложению; другие термостабильны:
- Cu(OH)2
- CuBr2
- CuCO3
- CuSO4
- CuCl2
- CuO
- CuS
- Cu
- CuO2
- O2
- CuO
- CO2
Ответ
Существуют различные соединения меди, способные вступать в реакции термического разложения.
Учитывая список представленных нам веществ, гидроксид меди, карбонат меди и медь сульфаты способны разлагаться при нагревании.
При разложении каждого из этих веществ образуется различный газ. В случае
выделяется гидроксид, вода в виде пара; с карбонатом выделяется углекислый газ;
и, наконец, с сульфатом выделяется триоксид серы.
В случае
выделяется гидроксид, вода в виде пара; с карбонатом выделяется углекислый газ;
и, наконец, с сульфатом выделяется триоксид серы.
Однако, несмотря на то, что образуются разные газы, во всех этих трех реакциях образуется медь(II) также оксид. Поэтому правильный ответ D, CuO.
Ключевые моменты
- Реакции термического разложения – это реакции разложения, протекающие при нагревании.
- Термическое разложение – это химическое изменение с образованием новых веществ.
- Карбонаты металлов термически разлагаются на оксиды металлов и углекислый газ.
- Наличие углекислого газа можно проверить с помощью известковой воды.
- При проведении реакции термического разложения важно избегать обратного всасывания в конце эксперимента.
- Реакции термического разложения необходимы во многих ситуациях, включая производство
бетона, обжиг нечистых руд и реакции в автомобильных подушках безопасности.

- Оксид ртути, карбонат меди, сульфат меди, гидроксид меди, нитрат натрия, свинец карбонат и карбонат цинка могут подвергаться реакциям термического разложения.
Q3 Химическая реакция обычно сопровождается определенными внешними признаками или характеристиками Т…
Перейти к
- Написание словесных уравнений
- Упражнение
- Вопросы объективного типа
- Материя и ее состав
- Физические и химические изменения
- Элементы, соединения и смеси
- Атомная структура
- Язык химии
- Металлы и неметаллы
- Воздух и атмосфера
Главная > Союзные решения Класс 7 Химия > Глава 5 — Язык химии > Упражнение > Вопрос 3
Вопрос 3 Упражнение
В3) Химическая реакция обычно сопровождается определенными внешними признаками или характеристиками. К ним относятся — изменение — (а) цвета (б) состояния (в) запаха (г) выделения газа (д) образования осадка (е) выделения или поглощения тепла. Относительно изменения цвета укажите изменение цвета при нагревании следующих веществ: (1) карбонат меди (2) карбонат цинка (3) оксид ртути [II] (4) оксид свинца [IV].
К ним относятся — изменение — (а) цвета (б) состояния (в) запаха (г) выделения газа (д) образования осадка (е) выделения или поглощения тепла. Относительно изменения цвета укажите изменение цвета при нагревании следующих веществ: (1) карбонат меди (2) карбонат цинка (3) оксид ртути [II] (4) оксид свинца [IV].
Ответ:
Решение:
- Карбонат меди имеет зеленый цвет, при нагревании дает черный твердый оксид меди. CuCO_3→CuO+CO_2[г]
- Карбонат цинка имеет белый цвет, при нагревании дает желтое твердое вещество — оксид цинка. ZnCO_3→ZnO+CO_2[г]
- Оксид ртути [II] красного цвета, при нагревании становится серебристым. 2HgO→2Hg+O_2[г]
- Оксид свинца [IV] коричневого цвета, при нагревании желтеет. 2PbO_2→2PbO+O_2
Связанные вопросы
1) Объясните термин «химическая реакция», уделив особое внимание «реагентам» и «продуктам».
Q1) Выберите правильный ответ из A, B, C, D и E для каждого утверждения, приведенного ниже: A: Водород B: Медь.


 С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:

Leave A Comment