Периодический закон и Периодическая система
Гурына Ира
Химия для 9 классаВ начале XX века была создана теория строения атома, на основе которой периодический закон в настоящее время формулируется так: «Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атома.»
- Между положением элемента в периодической системе и его электронным строением существует связь.
- Порядковый номер элемента в периодической системе равен заряду ядра атома (следовательно, порядковый номер показывает число протонов в ядре и число электронов в атоме).
- Каждый период начинается элементом, в атомах которого начинает застраиваться новый электронный слой, причём номер этого слоя равен номеру периода (следовательно, номер периода показывает число электронных слоёв в атомах элементов данного периода).

- Элементы, атомы которых обладают сходными по строению электронными оболочками, попадают в одну подгруппу периодической системы. У всех элементов главных подгрупп электронами заполняется внешний электронный слой, причём число электронов на этом слое равно номеру группы.
У элементов I и II групп электронами заполняется s-подуровень, поэтому они называются s-элементами. У элементов III-VIII групп происходит заполнение р-подуровня, поэтому эти элементы относятся к семейству р-элементов. У элементов побочных подгрупп происходит заполнение электронами d-подуровня предпоследнего слоя, а у лантаноидов и актиноидов f-подуровня предпредпоследнего слоя.
- Свойства элементов определяются их строением. Элементы, имеющие на последнем слое 1 – 2 электрона являются металлическими, 2 – 5 электронов – переходными, 4 – 8 электронов – неметаллическими.
В периоде с возрастанием заряда ядра атомов металлические свойства уменьшаются, а неметаллические усиливаются.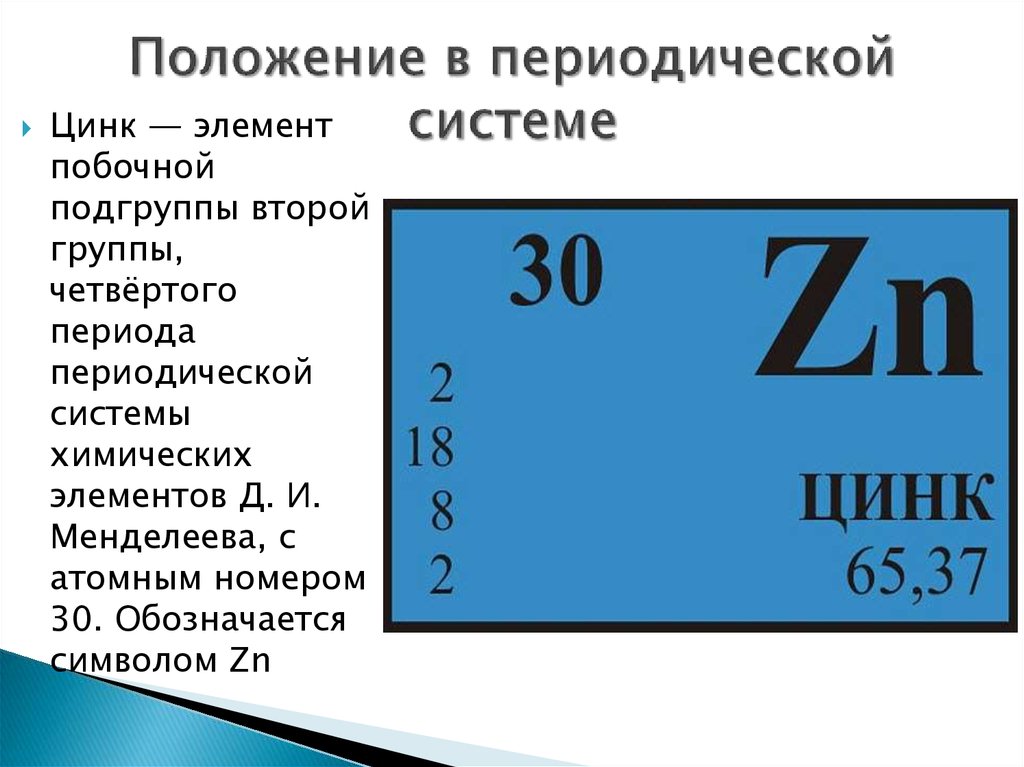 Это связано с увеличением числа электронов на последнем слое.
Это связано с увеличением числа электронов на последнем слое.
В главной подгруппе с возрастанием заряда ядра атомов металлические свойства усиливаются, а неметаллические уменьшаются. Это связано с увеличением числа электронных слоёв, а следовательно с уменьшением сил притяжения электронов последнего слоя к ядру.
Периодическое повторение свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и повторением электронных структур атома.
Химическая активность элементов определяется строением внешнего электронного слоя. Активность галогенов объясняется нехваткой 1 электрона до завершения внешнего слоя. У инертных элементов внешний электронный слой завершён, поэтому они химически неактивны. У атомов щелочных металлов 1 электрон на последнем слое является как бы лишним.
Полезные ссылки
Источник материала
Периодическая система как условная запись периодического закона (видео)
Характеристика элементов по положению в таблице Менделеева (видео)
Изменение свойств элементов и их соединений по периодам и группам (видео)
Периодический закон и Периодическая система химических элементов (видео)
Описание элемента по положению в Периодической системе (видео)
Закономерности изменения электроотрицательности элементов в группе и периоде (видео)
Дополнительные материалы
Периодический закон и периодическая система элементов Менделеева (видео)
Периодическая система элементов (видео)
Поделиться Share Tweet
Атом
Атом
Atom
Атом — наименьшая
составная часть вещества, сохраняющая его химические свойства. Атом состоит
из тяжелого положительно заряженного ядра, имеющего размер ~10–13 см и электронов, образующих электронные оболочки атома. Размеры атомов определяются
размерами их электронных оболочек и составляют ~10
Атом состоит
из тяжелого положительно заряженного ядра, имеющего размер ~10–13 см и электронов, образующих электронные оболочки атома. Размеры атомов определяются
размерами их электронных оболочек и составляют ~10
Состояние электрона в атоме характеризуется значением его орбитального момента L, определяемого квантовым числом l, L = ћ[l(l+1)]1/2
Замкнутая s оболочка (l=0) содержит 2 электрона
N = (2s+1)(2l+1) = (2·(1/2)+1)(2·0+1) = 2.
Замкнутая р оболочка (l=1) содержит 6 электронов
N = (2s+1)(2l+1) = (2·(1/2+1)(2·1+1) = 6.
Замкнутая d оболочка содержит 10 электронов.
Все электроны с заданным квантовым числом n образуют электронный
слой, содержащий 2n
Максимальное число электронов K, L, M, N-слоях
| K-слой | L-слой | M-слой | N-слой |
| n = 1 | n = 2 | n = 3 | n = 4 |
| l = 0, 1 | l = 0, 1, 2 | l = 0, 1, 2, 3 | |
| 2 электрона | 2 + 6 = 8 электронов | 2 + 6 + 10 = 18 электронов | 2 + 6 + 10 + 14 = 32 электрона |
Наиболее близко к ядру расположен К-слой, затем L-слой и т.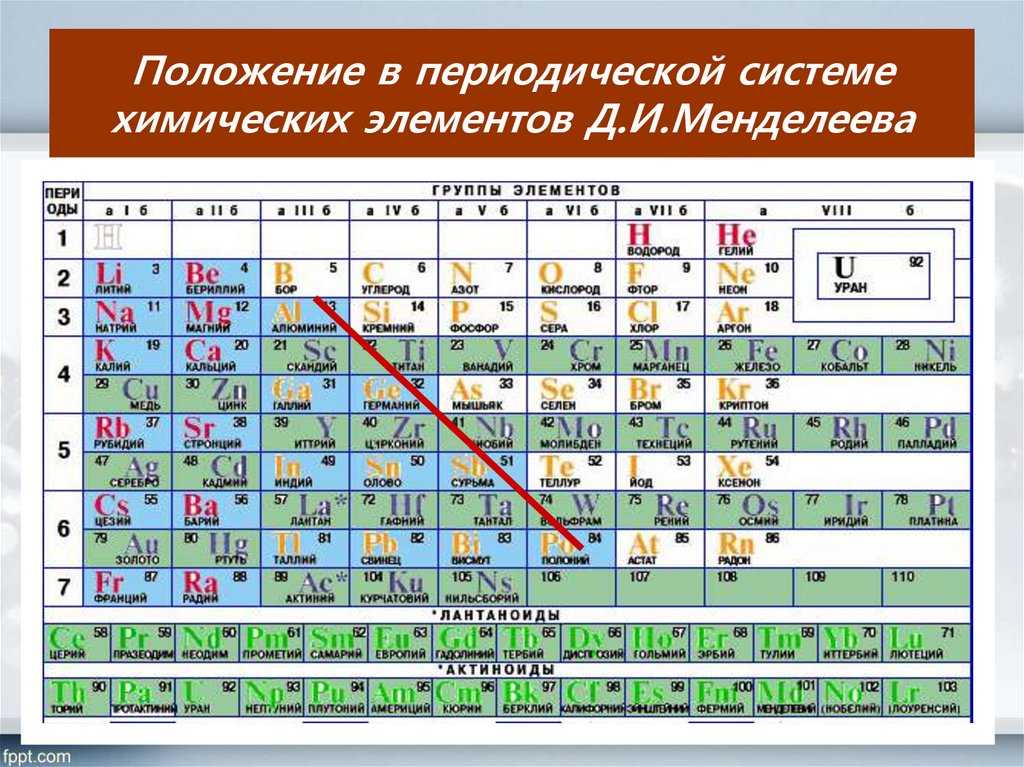 д. При заданном
значении n сначала заполняются состояния с l = 0, затем l = 1, l = 2 и т.д.
д. При заданном
значении n сначала заполняются состояния с l = 0, затем l = 1, l = 2 и т.д.
Последовательное заполнение электронных слоев объясняет Периодический
закон элементов, открытый Д.И. Менделеевым. Периоды в Периодической системе
Д.И. Менделеева соответствуют последовательному заполнению оболочек. Для
элементов 1 периода происходит заполнение оболочки 1s. Для элементов 2 и
3 периодов — заполнение оболочек 2s, 2p, 3s, 3p, 3d. Однако по мере увеличения
числа электронов (заряда ядра Z) такой порядок заполнения нарушается из-за
конкуренции близких по энергии связи электронов. Справедливо следующее правило:
чем меньше l, тем сильнее волновая функция проникает в область, экранируемую
облаком внутренних электронов. В результате этого при заданном значении
n энергия электронов возрастает с увеличением l (рис.).

Правило Маделунга. Из двух оболочек ниже по энергии располагается та, для которой величина n = l оказывается наименьшей. Если для двух оболочек значения сумм n = l совпадают, то ниже по энергии лежит оболочка с меньшим значением n. |
| Рис. Относительное расположение электронных оболочек атомов (не в масштабе). Справа указан заряд Z ядра атома, с которого начинается заполнение указанной подоболочки. |
Распределение электронов в атоме по оболочкам определяет
его электронную конфигурацию. Так, например, электронная конфигурация атома 27Al, имеющего 13 электронов, записывается в виде 1s2 2s2 2p6 3s2 3p1. Последовательно
выписываются электронные оболочки, начиная от ближайшей к ядру. Верхний
индекс указывает число электронов на данной оболочке. Последовательность
заполнения электронами различных атомных оболочек приведена в таблице П2
(Приложение).
Верхний
индекс указывает число электронов на данной оболочке. Последовательность
заполнения электронами различных атомных оболочек приведена в таблице П2
(Приложение).
Для каждой электронной конфигурации можно построить определённое
количество термов (состояний), характеризующихся определёнными значениями
полного орбитального момента
полного спинового момента
и полного момента количества движения
всех электронов данного атома.
Электростатическое и спин-орбитальное взаимодействия электронов атома
приводят к тому, что терм расщепляется на несколько состояний — мультиплет,
число компонентов которого определяется числом возможных ориентаций векторов
и
в пространстве,
т.е. числом возможных значений квантового числа j.
Состояния атома с различными значениями L обозначаются заглавными
буквами латинского алфавита:
L = | 0 | 1 | 2 | 3 | 4 | 5 |
S | P | D | F | G | H |
Сверху слева от этого символа указывается величина 2s+1, а справа внизу
значение полного момента J. Символ 4p5/2 соответствует
состоянию атома с L = 1, S = 3/2, J = 5/2.
Символ 4p5/2 соответствует
состоянию атома с L = 1, S = 3/2, J = 5/2.
Конкуренция спин-орбитального и электростатического взаимодействий
определяет порядок сложения орбитальных и спиновых моментов. В том случае,
когда электростатическое взаимодействие много больше спин-орбитального,
орбитальные моменты отдельных электронов складываются в полный орбитальный
момент L. Спиновые моменты отдельных электронов складываются в полный спиновый
момент S.
= + .
Такая схема связи называется L–S связью. В основном она реализуется для
основных состояний лёгких ядер.
В случае, когда спин-орбитальное взаимодействие много больше
электростатического, полные моменты отдельных электронов объединяются в
полный момент атома
.
Такая схема связи называется j–j связью и реализуется в основном в тяжелых
ядрах.
Для определения основного терма данной конфигурации используют
эмпирические правила Хундта.
Ниже по энергии лежит терм, у которого мультиплетность является максимальной.
При равенстве мультиплетностей нескольких термов минимальной энергией обладает терм с максимальным значением суммарного орбитального момента конфигурации.
Если атомная подоболочка заполнена менее, чем наполовину, наименьшую энергию имеет состояние с минимальным значением J, если атомная оболочка заполнена более, чем наполовину, то наименьшую энергию имеет состояние с максимальным J.
Наряду с электронной конфигурацией, соответствующей наибольшей энергии связи всех электронов атома, при возбуждении одного или нескольких электронов образуются возбуждённые электронные конфигурации. Переходы между различными термами атома образуют спектр возбуждённых состояний атома.
Периодическая таблица | Определение, элементы, группы, сборы, тенденции и факты
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Дмитрий Менделеев Лотар Мейер Поль-Эмиль Лекок де Буабодран
- Похожие темы:
- химический элемент атом группа периодический закон период
Просмотреть весь связанный контент →
Популярные вопросы
Что такое периодическая таблица?
Периодическая таблица представляет собой табличный массив химических элементов, упорядоченных по атомному номеру, от элемента с наименьшим атомным номером, водорода, до элемента с наибольшим атомным номером, оганесона. Атомный номер элемента — это число протонов в ядре атома этого элемента. У водорода 1 протон, а у оганесона 118.
Атомный номер элемента — это число протонов в ядре атома этого элемента. У водорода 1 протон, а у оганесона 118.
Что общего у групп периодической таблицы?
Группы периодической таблицы отображаются в виде вертикальных столбцов, пронумерованных от 1 до 18. Элементы в группе имеют очень похожие химические свойства, которые возникают из-за количества присутствующих валентных электронов, то есть количества электронов в внешняя оболочка атома.
Откуда взялась периодическая таблица?
Расположение элементов в периодической таблице определяется электронной конфигурацией элементов. Из-за принципа запрета Паули не более двух электронов могут занимать одну и ту же орбиталь. Первый ряд периодической таблицы состоит всего из двух элементов, водорода и гелия. Чем больше у атомов электронов, тем больше у них орбит, доступных для заполнения, и, таким образом, строки содержат больше элементов в нижней части таблицы.
Почему таблица Менделеева делится?
Периодическая таблица имеет две строки внизу, которые обычно отделены от основной части таблицы.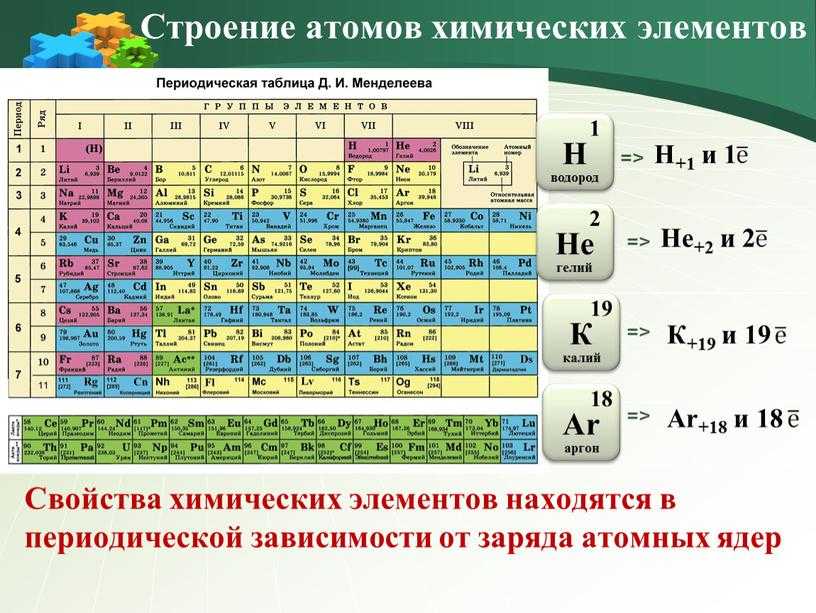 Эти ряды содержат элементы лантаноидного и актиноидного рядов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (актиний до лоуренсия) соответственно. Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
Эти ряды содержат элементы лантаноидного и актиноидного рядов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (актиний до лоуренсия) соответственно. Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
периодическая таблица , полностью периодическая таблица элементов , в химии организованный ряд всех химических элементов в порядке возрастания атомного номера, т. е. общего числа протонов в атомном ядре. Когда химические элементы расположены таким образом, в их свойствах возникает повторяющаяся закономерность, называемая «периодическим законом», при которой элементы в одном столбце (группе) обладают сходными свойствами. Неоценимое значение для развития химии имело первоначальное открытие, сделанное Д.И. Менделеевым в середине 19 в.
Как периодический закон помогает нам понять свойства элементов и то, как они соотносятся друг с другом?
Посмотреть все видео к этой статье До второго десятилетия 20-го века фактически не признавалось, что порядок элементов в периодической системе соответствует их атомным номерам, целые числа которых равны положительным электрическим зарядам атомные ядра, выраженные в электронных единицах. В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
История периодического закона
Узнайте, как устроена таблица Менделеева
Просмотреть все видео к этой статье В первые годы XIX века наблюдалось бурное развитие аналитической химии — искусства различать различные химические вещества — и, как следствие, накопление обширных знаний о химических и физических свойствах как элементов, так и соединений. Это быстрое распространение химических знаний вскоре потребовало классификации, ибо на классификации химических знаний основана не только систематизированная литература по химии, но и лабораторное искусство, с помощью которого химия передается как живая наука от одного поколения химиков к другому. Отношения между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отставала от классификации соединений.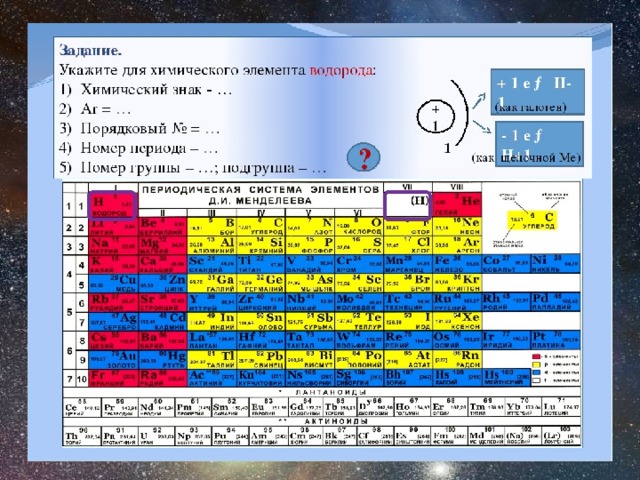 Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Викторина по Британике
Факты, которые вы должны знать: Викторина по периодической таблице
Дж.В. Доберейнер в 1817 году показал, что совокупный вес, то есть атомный вес, стронция находится посередине между весами кальция и бария, а несколько лет спустя он показал, что существуют и другие подобные «триады» (хлор, бром и йод [галогены] и литий, натрий и калий [щелочные металлы]). Ж.-Б.-А. Дюма, Л. Гмелин, Э. Ленссен, Макс фон Петтенкофер и Дж. П. Кук расширили предположения Доберейнера между 1827 и 1858 гг., показав, что подобные отношения простираются дальше, чем триады элементов: фтор добавляется к галогенам, а магний — к щелочноземельным. металлы, в то время как кислород, сера, селен и теллур были отнесены к одному семейству, а азот, фосфор, мышьяк, сурьма и висмут — к другому семейству элементов.
Позднее были предприняты попытки показать, что атомные массы элементов могут быть выражены арифметической функцией, и в 1862 г. А.-Э.-Б. де Шанкуртуа предложил классификацию элементов, основанную на новых значениях атомных весов, данных системой Станислао Канниццаро 1858 года. Де Шанкуртуа нанес атомные веса на поверхность цилиндра с окружностью 16 единиц, что соответствует приблизительному атомному весу кислород. Получившаяся винтовая кривая перенесла тесно связанные элементы в соответствующие точки цилиндра, расположенные выше или ниже друг друга, и, следовательно, он предположил, что «свойства элементов — это свойства чисел» — замечательное предсказание в свете современных знаний.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться
Классификация элементов
В 1864 г. Дж.А.Р. Ньюлендс предложил классифицировать элементы в порядке увеличения атомного веса, при этом элементам присваивались порядковые номера от единицы и вверх, и они были разделены на семь групп, обладающих свойствами, тесно связанными с первыми семью из известных тогда элементов: водород, литий, бериллий, бор, углерод.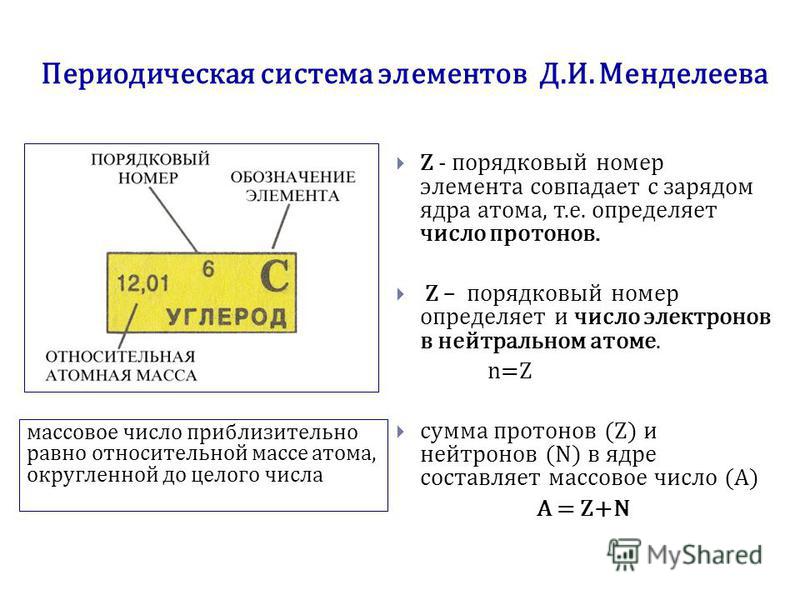 , азот и кислород. Это соотношение было названо законом октав по аналогии с семью интервалами музыкальной гаммы.
, азот и кислород. Это соотношение было названо законом октав по аналогии с семью интервалами музыкальной гаммы.
Затем в 1869 году Менделеев в результате обширной корреляции свойств и атомных весов элементов с особым вниманием к валентности (то есть числу одинарных связей, которые может образовать элемент) предложил периодический закон, согласно которой «элементы, расположенные в соответствии с величиной атомного веса, обнаруживают периодическое изменение свойств». Лотар Мейер независимо пришел к аналогичному заключению, опубликованному после выхода статьи Менделеева.
Периодическая таблица элементов | Живая наука
Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Периодическая таблица, также называемая периодической таблицей элементов, представляет собой упорядоченное расположение 118 известных химических элементов. Химические элементы расположены слева направо и сверху вниз в порядке возрастания атомного номера или числа протонов в ядре атома , что обычно совпадает с увеличением атомной массы.
Горизонтальные строки в периодической таблице называются периодами, где каждый номер периода указывает количество орбиталей для элементов в этой строке согласно Лос-Аламосская национальная лаборатория (открывается в новой вкладке). (Атомы имеют протоны и нейтроны в своем ядре, а вокруг него электроны расположены на орбиталях, где атомная орбиталь — это математический термин, описывающий местоположение электрона, а также его волнообразное поведение.)
Для например, период 1 включает элементы, которые имеют одну атомную орбиталь, на которой вращаются электроны; период 2 имеет две атомные орбитали, период 3 имеет три и так далее до периода 7. Столбцы или группы периодической таблицы представляют собой атомные элементы, которые имеют одинаковое количество валентных электронов, или те электроны, которые находятся на самой внешней орбитальной оболочке. . Например, все элементы группы 8A (или VIIIA) имеют полный набор из восьми электронов на орбите с самой высокой энергией, согласно химику Уильяму Ройшу на его веб-странице в Мичиганском государственном университете . Элементы, которые занимают один и тот же столбец в периодической таблице (называемые «группой»), имеют идентичные конфигурации валентных электронов и, следовательно, химически ведут себя одинаково. Например, все элементы группы 18 являются инертными газами, то есть они не реагируют ни с какими другими элементами.
Элементы, которые занимают один и тот же столбец в периодической таблице (называемые «группой»), имеют идентичные конфигурации валентных электронов и, следовательно, химически ведут себя одинаково. Например, все элементы группы 18 являются инертными газами, то есть они не реагируют ни с какими другими элементами.
Связанный: Как сгруппированы элементы?
Кто создал периодическую таблицу?
Дмитрий Менделеев, русский химик и изобретатель, по мнению Королевского химического общества, считается «отцом» периодической таблицы . В 1860-х годах Менделеев был популярным лектором в университете в Санкт-Петербурге, Россия. В то время не существовало современных учебников органической химии на русском языке, поэтому Менделеев решил написать один. По словам Академии Хана, работая над этой книгой под названием «Принципы химии» (два тома, 1868–1870 гг.), Он одновременно занимался проблемой неупорядоченных элементов .
(Изображение предоставлено: Oxford Science Archive/Print Collector/Getty Images) Расположить элементы в любом порядке оказалось бы довольно сложно. В то время было известно 63 химических элемента, атомный вес каждого из которых был рассчитан с использованием гипотезы Авогадро, согласно которой равные объемы газов при одинаковых температуре и давлении содержат одинаковое число молекул.
В то время было известно 63 химических элемента, атомный вес каждого из которых был рассчитан с использованием гипотезы Авогадро, согласно которой равные объемы газов при одинаковых температуре и давлении содержат одинаковое число молекул.
В то время существовало всего две стратегии классификации этих элементов: разделение их на металлы и неметаллы или группировка по количеству валентных электронов элемента (или тех электронов, которые находятся на самой внешней оболочке). Первый раздел книги Менделеева касался только восьми известных элементов — углерода, водорода, кислорода, азота, хлора, фтора, брома и йода — и эти две стратегии работали для этих конкретных элементов, согласно Майклу Д. Гордину в его книге. «Хорошо упорядоченная вещь: Дмитрий Менделеев и тень периодической таблицы» (Princeton University Press, исправленное издание, 2018 г.). Но их было недостаточно, чтобы с пользой отсортировать 55 дополнительных химических элементов, известных в то время.
Итак, согласно Королевскому химическому обществу, Менделеев записал свойства каждого элемента на карточках, а затем начал упорядочивать их по возрастанию атомного веса. Именно тогда он заметил регулярное появление определенных типов элементов и заметил корреляцию между атомным весом и химическими свойствами.
Именно тогда он заметил регулярное появление определенных типов элементов и заметил корреляцию между атомным весом и химическими свойствами.
Но точно Эврика! Момент, который привел Менделеева к стратегии сортировки, позволившей создать его полную периодическую таблицу, окутан тайной. «Чрезвычайно трудно реконструировать процесс, посредством которого Менделеев пришел к своей периодической организации элементов по их атомному весу», — писал Гордин о полной периодической таблице. «Проблема с точки зрения историка заключается в том, что, хотя Менделеев хранил почти все документы и черновики, которые попадали ему в руки после того, как он верил, что станет знаменитым, он не делал этого до формулировки периодического закона».
Здесь показана первая Периодическая таблица элементов Менделеева. (Изображение предоставлено: Photo12/Universal Images Group через Getty Images)(открывается в новой вкладке)
Гордин продолжил: «Есть два основных пути, которыми Менделеев мог уйти от признания важности атомного веса как хорошего инструмента классификации. к наброску периодической системы: либо он выписал элементы в порядке их атомного веса рядами и заметил периодическое повторение, либо он собрал несколько «естественных групп» элементов, таких как галогены и щелочные металлы, и заметил закономерность увеличения масса.» Оказывается, единственное известное высказывание Менделеева, связанное с его методом, было сделано в апреле 1869 года.; он писал, что «собрал тела с наименьшим атомным весом и расположил их в порядке увеличения их атомного веса», согласно книге Гордина.
к наброску периодической системы: либо он выписал элементы в порядке их атомного веса рядами и заметил периодическое повторение, либо он собрал несколько «естественных групп» элементов, таких как галогены и щелочные металлы, и заметил закономерность увеличения масса.» Оказывается, единственное известное высказывание Менделеева, связанное с его методом, было сделано в апреле 1869 года.; он писал, что «собрал тела с наименьшим атомным весом и расположил их в порядке увеличения их атомного веса», согласно книге Гордина.
Каким бы ни был его мыслительный процесс, Менделеев в конечном итоге расположил элементы в соответствии как с атомным весом, так и с валентными электронами. Он не только оставил место для еще не открытых элементов, но и предсказал свойства пяти из этих элементов и их соединений. В марте 1869 года он представил находки Русскому химическому обществу. Позже в том же году его новая периодическая система была опубликована в виде реферата в немецком периодическом химическом журнале 9. 0085 Zeitschrift fϋr Chemie (открывается в новой вкладке) (Journal of Chemistry), согласно Калифорнийского университета, Сан-Диего (открывается в новой вкладке).
0085 Zeitschrift fϋr Chemie (открывается в новой вкладке) (Journal of Chemistry), согласно Калифорнийского университета, Сан-Диего (открывается в новой вкладке).
Чтение периодической таблицы
Периодическая таблица содержит огромное количество информации:
Атомный номер: Количество протонов в ядре атома называется атомным номером этого элемента. Количество протонов определяет, какой это элемент, а также определяет химическое поведение элемента. Например, атомов углерода всегда имеют шесть протонов; атомов водорода всегда имеют один; а атомов кислорода всегда имеют восемь. Различные версии одного и того же элемента, называемые изотопами, могут иметь разное количество нейтронов; также элемент может приобретать или терять электроны, чтобы стать заряженными, и в этом случае они называются ионами.
Атомный символ: Атомный символ (или символ элемента) представляет собой аббревиатуру, выбранную для обозначения элемента («C» для углерода, «H» для водорода и «O» для кислорода и т. д.). Эти символы используются на международном уровне и иногда являются неожиданными. Например, символ вольфрама — «W», потому что другое название этого элемента — вольфрам. Кроме того, атомный символ золота — «Au», потому что слово «золото» на латыни — «aurum».
д.). Эти символы используются на международном уровне и иногда являются неожиданными. Например, символ вольфрама — «W», потому что другое название этого элемента — вольфрам. Кроме того, атомный символ золота — «Au», потому что слово «золото» на латыни — «aurum».
Атомная масса: Стандартная атомная масса элемента — это средняя масса элемента, выраженная в атомных единицах массы (а.е.м.). Несмотря на то, что каждый атом имеет примерно целое число атомных единиц массы, вы заметите, что атомная масса в периодической таблице является десятичной; это потому, что это число представляет собой средневзвешенное значение различных встречающихся в природе изотопов элемента на основе их распространенности. Изотоп — это разновидность элемента с другим числом нейтронов в ядре. (Чтобы рассчитать среднее количество нейтронов в элементе, вычтите количество протонов (атомный номер) из атомной массы.)
Например, вот как можно рассчитать атомную массу углерода, который имеет два изотопа:
Умножьте распространенность изотопа на его атомную массу:
Углерод-12: 0,9889 x 12,0000 = 11,8668
Углерод -13 : 0,0111 x 13,0034 = 0,1443
Затем сложите результаты:
11,8668 + 0,1443 = 12,0111 = атомный вес углерода
Атомная масса элементов 93-118: 90 048 Для созданных в лаборатории трансурановых элементов (элементов помимо урана , который имеет атомный номер 92), нет «естественной» численности, Лос-Аламосская национальная лаборатория (LANL) отметила . Для этих элементов атомный вес самого долгоживущего изотопа указан в периодической таблице, согласно Международному союзу теоретической и прикладной химии (IUPAC) — мировому авторитету в области химической номенклатуры и терминологии. Эти атомные веса следует считать условными, поскольку в будущем может быть получен новый изотоп с более длительным периодом полураспада (сколько времени требуется для разложения 50% этого элемента), согласно LANL
Для этих элементов атомный вес самого долгоживущего изотопа указан в периодической таблице, согласно Международному союзу теоретической и прикладной химии (IUPAC) — мировому авторитету в области химической номенклатуры и терминологии. Эти атомные веса следует считать условными, поскольку в будущем может быть получен новый изотоп с более длительным периодом полураспада (сколько времени требуется для разложения 50% этого элемента), согласно LANL
Сверхтяжелые элементы или элементы с атомным номером выше 104 также попадают в эту неприродную категорию. Чем больше ядро атома — которое увеличивается с увеличением количества протонов внутри — тем обычно более нестабилен этот элемент. Таким образом, согласно ИЮПАК, эти негабаритные элементы мимолетны, длятся всего миллисекунды, прежде чем распасться на более легкие элементы. Например, сверхтяжелые элементы 113, 115, 117 и 118 прошли проверку IUPAC в декабре 2015 года, заполнив седьмую строку или точку в таблице. Несколько разных лабораторий производили сверхтяжелые элементы. Атомные номера, временные названия и официальные названия:
Атомные номера, временные названия и официальные названия:
- 113: унунтрий (Uut), нихоний (Nh)
- 115: унунпентий (Uup), московий (Mc)
- 117: унунсептий (Uus), теннессин (Ts)
- 118: unun октиум (Ууо), оганесон (Og)
Как устроена Периодическая таблица?
Водород делит свой единственный валентный электрон с одним из валентных электронов кислорода; когда два атома водорода образуют эти ковалентные связи с одним атомом кислорода, в результате получается h3O или вода. (Изображение предоставлено: Encyclopaedia Britannica/UIG через Getty Images) Периодическая таблица упорядочена по атомному весу и валентным электронам. Эти переменные позволили Менделееву разместить каждый элемент в определенной строке (называемой периодом) и столбце (называемой группой). Таблица состоит из семи строк и 18 столбцов. Каждый элемент в одной строке имеет такое же количество атомных орбиталей (пространств, где существуют электроны), что и другие элементы в этой строке или периоде. Это означает, что все элементы третьего периода — натрий, магний, алюминий, кремний, фосфор, сера, хлор и аргон — имеют три атомные орбитали, на которых находятся их электроны. Между тем столбец или группа означает количество электронов в самой внешней оболочке атома; они называются валентными электронами, и это электроны, которые могут химически связываться с валентными электронами других элементов. Валентные электроны могут быть либо разделены с другим элементом, что является типом ковалентной связи, либо заменены типом ионной связи, согласно 9.0085 Lumen Learning (открывается в новой вкладке).
Это означает, что все элементы третьего периода — натрий, магний, алюминий, кремний, фосфор, сера, хлор и аргон — имеют три атомные орбитали, на которых находятся их электроны. Между тем столбец или группа означает количество электронов в самой внешней оболочке атома; они называются валентными электронами, и это электроны, которые могут химически связываться с валентными электронами других элементов. Валентные электроны могут быть либо разделены с другим элементом, что является типом ковалентной связи, либо заменены типом ионной связи, согласно 9.0085 Lumen Learning (открывается в новой вкладке).
Например, все элементы во втором столбце имеют два валентных электрона; в третьем столбце у них три валентных электрона. Есть некоторые исключения из этого правила для переходных элементов, которые заполняют более короткие столбцы в центре периодической таблицы. Эти переходные элементы
Давайте рассмотрим пример: мы можем выбрать селен , который имеет атомный номер 34, что означает, что в нейтральном атоме селена всего 34 электрона.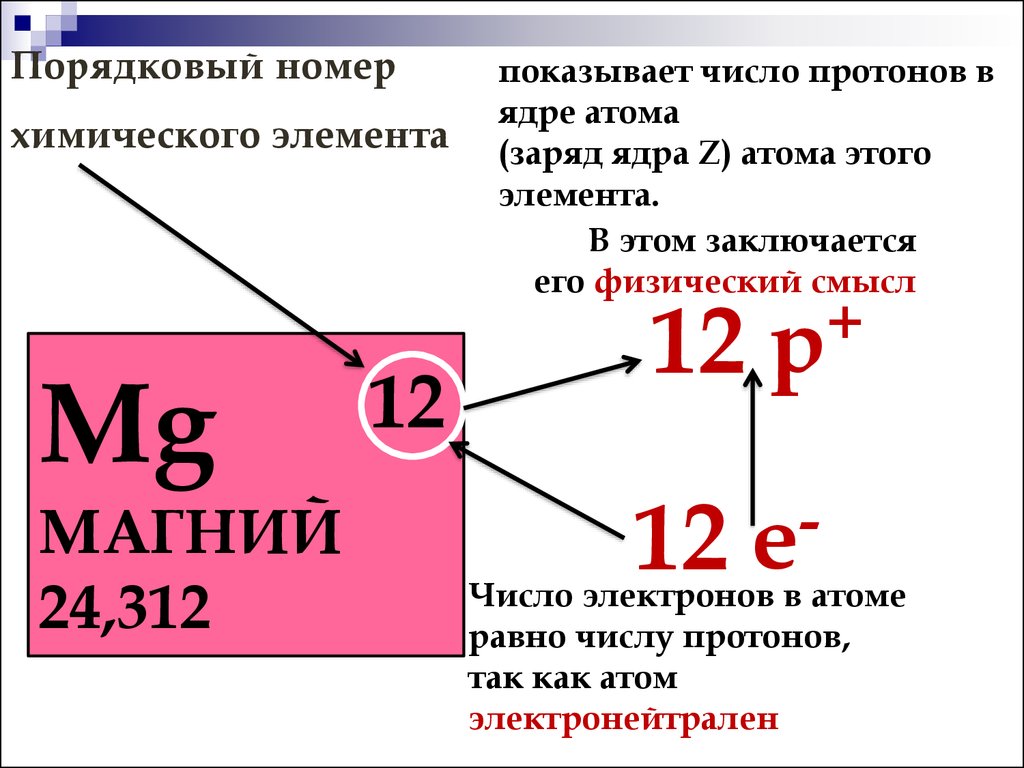 Этот неметалл находится в периоде 4, группе 6А. Это означает, что селен удерживает свои электроны на четырех атомных орбиталях и имеет шесть валентных электронов или шесть электронов на самой внешней орбитали. Вы также можете выяснить, сколько электронов находится на его первой, второй и третьей орбиталях: первая орбиталь может содержать максимум два электрона, а вторая имеет четыре суборбитали и, таким образом, может содержать в общей сложности восемь электронов. Третья оболочка атома, состоящая из девяти суборбиталей, может содержать максимум 18 электронов, согласно Факультет химии и биохимии Университета штата Флорида (открывается в новой вкладке). Это означает, что селен имеет 2, 8, 18 и 6 электронов на первой, второй, третьей и четвертой атомной орбитали соответственно.
Этот неметалл находится в периоде 4, группе 6А. Это означает, что селен удерживает свои электроны на четырех атомных орбиталях и имеет шесть валентных электронов или шесть электронов на самой внешней орбитали. Вы также можете выяснить, сколько электронов находится на его первой, второй и третьей орбиталях: первая орбиталь может содержать максимум два электрона, а вторая имеет четыре суборбитали и, таким образом, может содержать в общей сложности восемь электронов. Третья оболочка атома, состоящая из девяти суборбиталей, может содержать максимум 18 электронов, согласно Факультет химии и биохимии Университета штата Флорида (открывается в новой вкладке). Это означает, что селен имеет 2, 8, 18 и 6 электронов на первой, второй, третьей и четвертой атомной орбитали соответственно.
Как сегодня используется Периодическая таблица?
Зная, что определенные элементы, собранные вместе на столе, обладают определенными характеристиками и поведением, ученые могут выяснить, какие из них лучше всего подходят для определенных отраслей и процессов.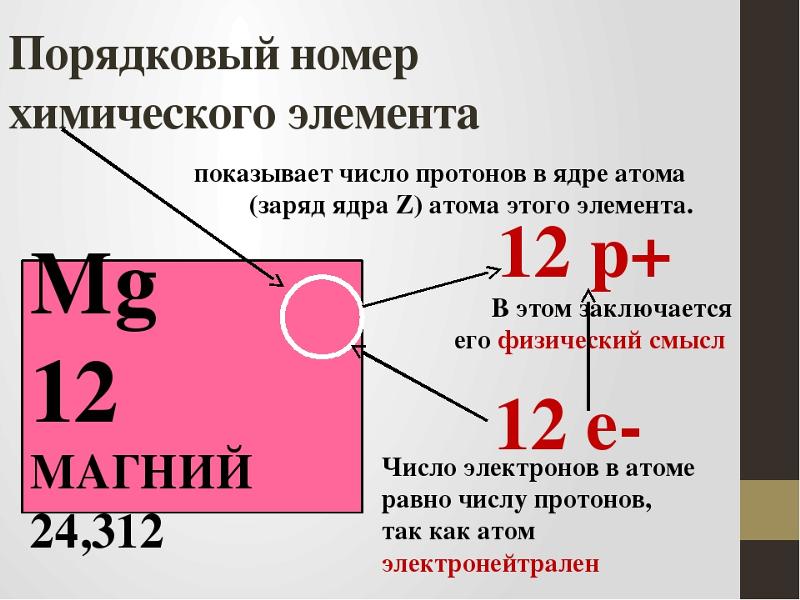 Например, инженеры используют различные комбинации элементов в группах III и V таблицы для создания новых полупроводниковых сплавов, таких как нитрид галлия (GaN) и нитрид индия (InN), согласно 9.0085 Национальный институт стандартов и технологий (открывается в новой вкладке) (NIST).
Например, инженеры используют различные комбинации элементов в группах III и V таблицы для создания новых полупроводниковых сплавов, таких как нитрид галлия (GaN) и нитрид индия (InN), согласно 9.0085 Национальный институт стандартов и технологий (открывается в новой вкладке) (NIST).
В общем, химики и другие ученые могут использовать таблицу, чтобы предсказать, как определенные элементы будут реагировать друг с другом. Щелочные металлы, например, находятся в первой колонке или группе таблицы и, как правило, имеют один валентный электрон и поэтому несут заряд +1. Этот заряд означает, что они «энергично реагируют с водой и легко соединяются с неметаллами», — написала химик Энн Мари Хельменстайн 9 сентября.0085 МысльКо. Магний, который находится в той же группе в таблице, что и кальций, становится полезным в составе сплавов для костных имплантатов, сообщает NIST. Поскольку эти сплавы являются биоразлагаемыми, они служат каркасом, а затем исчезают после того, как на структурах нарастает естественная кость.


Leave A Comment