Периодическая система химических элементов. Большая российская энциклопедия
Научные законы, утверждения, уравнения
- Области знаний:
- Общие вопросы химии, Основные понятия и законы
- Другие наименования:
- Таблица Менделеева
Периоди́ческая систе́ма хими́ческих элеме́нтов, упорядоченное множество химических элементов и их естественная классификация. Является табличным представлением периодического закона, открытого Д. И. Менделеевым. Прообразом периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленная Менделеевым в 1869 г. По мере совершенствования этой таблицы Менделеев развил представления о периодах и группах элементов и о месте каждого элемента в системе. К 1871 г. в книгу «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма периодической системы химических элементов. Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).
Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).
Таблица, составленная Дмитрием Менделеевым. 1869. БРЭ. Т. 25.Физический смысл периодичности в свойствах элементов стал ясен после появления планетарной модели атома (Э. Резерфорд, 1911), и было показано (А. ван ден Брук и Г. Мозли, 1913–1914), что порядковый номер элемента в периодической системе химических элементов равен положительному заряду (Z) ядра атома. Теория периодической системы в основном создана Н. Бором (1913–1921) на базе квантовой модели атома. Бор разработал схему построения электронных конфигураций атомов по мере возрастания Z, опирающуюся на определённую последовательность заполнения электронами оболочек и подоболочек в атомах с ростом числа
Современная периодическая система химических элементов включает более ста химических элементов. Наиболее тяжёлые элементы получены ядерным синтезом. Порядок заполнения электронами уровней в атомах определяется правилами, совокупность которых называют «принципом построения»: заполнение атомных орбиталей (АО) происходит в порядке увеличения энергии орбиталей: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 6d и т.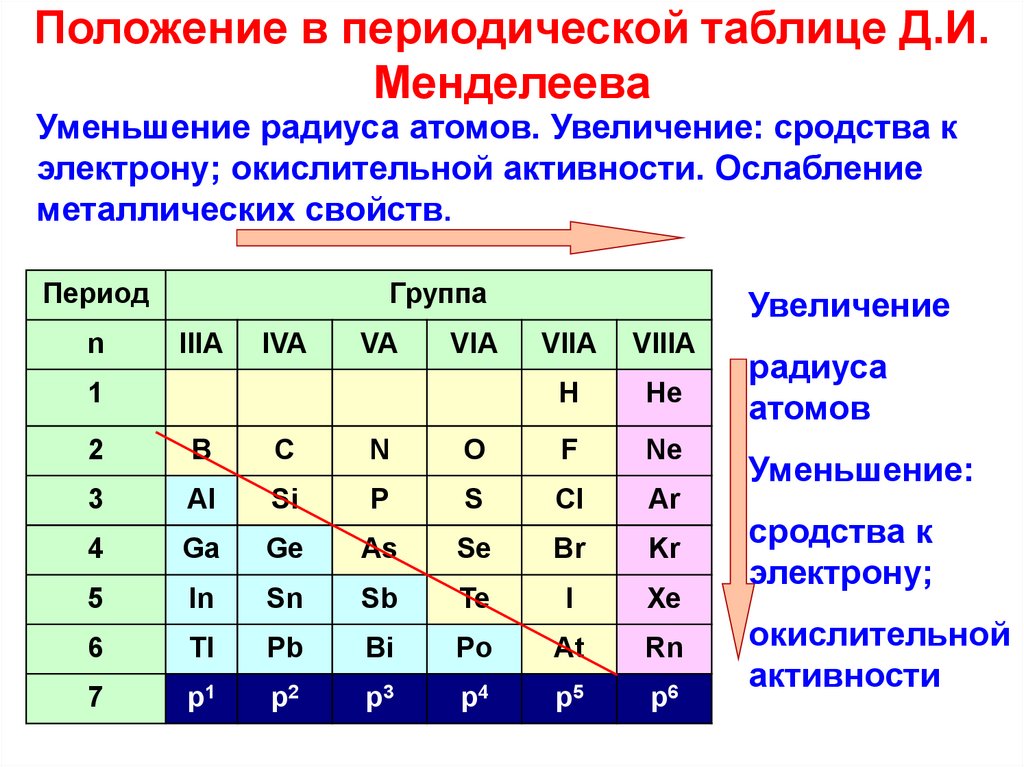
Согласно (n+l)-правилу Клечковского, построение электронных конфигураций главным образом происходит в соответствии с последовательным увеличением суммы (n+l). При этом в пределах каждой такой суммы сначала заполняются подоболочки с бóльшими l и меньшими n, затем с меньшими l и бóльшими n.
Опубликовано свыше 500 вариантов периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем её структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Д. И. Менделеевым, усовершенствована в 1905 А. Вернером). В структуре периодической системы химических элементов выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.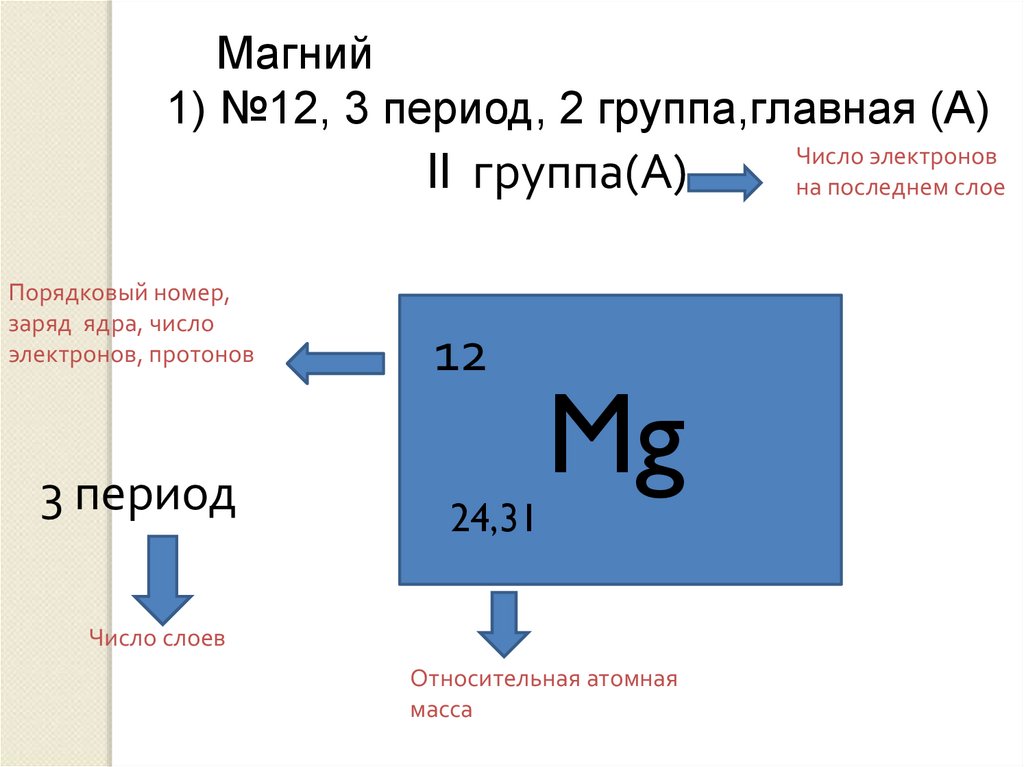
Короткая форма периодической системы химических элементов.
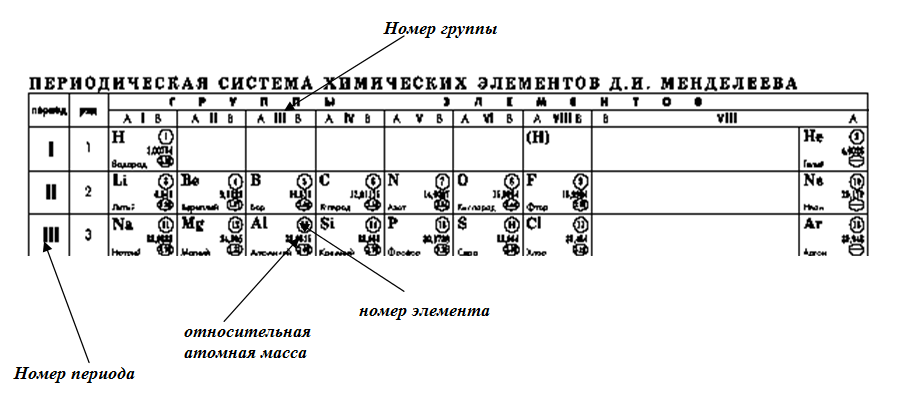
Архив БРЭ.Современная форма периодической системы химических элементов (в 1989 ИЮПАК рекомендована длинная форма) состоит из 7 периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма – из 8 групп. Число элементов в периодах, начиная со второго, попарно повторяется: 8, 8, 18, 18, 32, 32,… (первый период содержит два элемента). Номер группы элементов короткого варианта соответствует числу валентных электронов во внешней электронной оболочке атомов. В длиннопериодном варианте номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).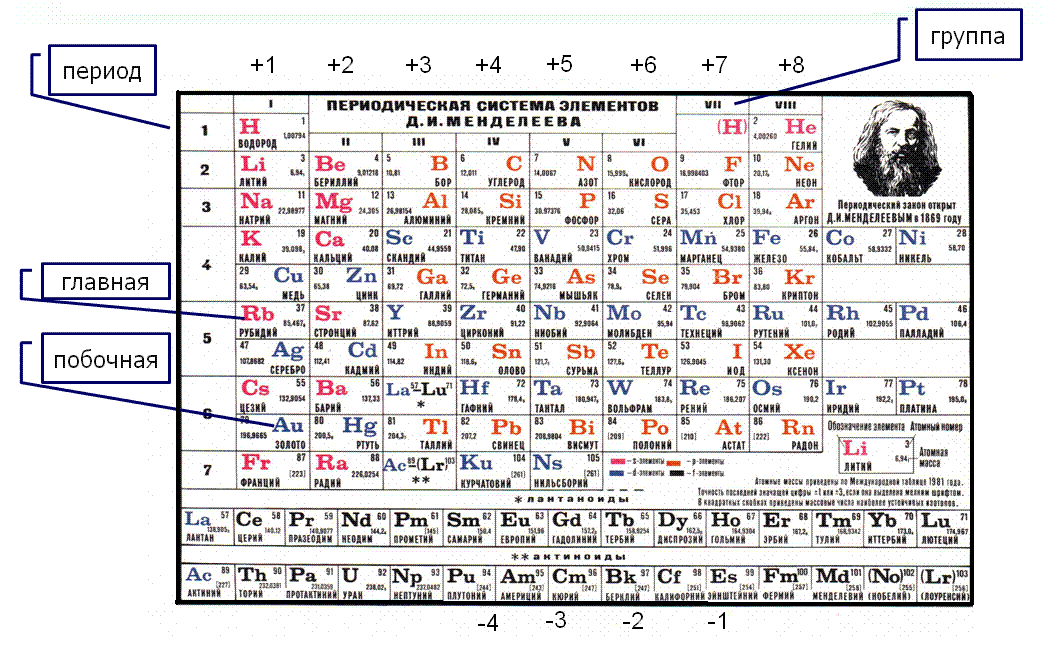
Первый период содержит два элемента – Н и Не. Водород имеет некоторое сходство как со щелочными элементами, так и с галогенами. В связи с этим символ Н помещают либо в подгруппу Iа, либо в подгруппу VIIa короткого варианта, либо в обе одновременно.
Второй и третий периоды (Li – Ne; Na – Ar) содержат по 8 элементов, причём характер изменения химических свойств вертикальных аналогов во многом близок. Элементы первых трёх периодов относятся к главным подгруппам короткого варианта периодической системы химических элементов.
Элементы групп 1 и 2 длинной формы называются s-элементами, групп 13–18 – p-элементами, групп 3–12 – d-элементами; d-элементы (за исключением цинка, кадмия и ртути) называют также переходными элементами.
Четвёртый период (K – Kr) содержит 18 элементов. После K и Са (s-элементы) следует ряд из десяти (Sc – Zn) 3
 Переходные элементы проявляют высшие степени окисления, в основном равные номеру группы короткого варианта периодической системы химических элементов (исключая Co, Ni и Cu). Элементы от Ga до Kr относятся к главным подгруппам (р-элементы).
Переходные элементы проявляют высшие степени окисления, в основном равные номеру группы короткого варианта периодической системы химических элементов (исключая Co, Ni и Cu). Элементы от Ga до Kr относятся к главным подгруппам (р-элементы).Пятый период (Rb – Xe) построен аналогично четвёртому; в нём также имеется «вставка» из десяти переходных 4d-элементов (Y – Cd). Особенности изменения свойств в этом периоде: в триаде Ru – Rh – Pd рутений проявляет максимальную степень окисления +8, родий +6, палладий +5; все элементы главных подгрупп, включая Хе, проявляют высшие степени окисления, равные номеру группы.
Шестой период (Сs – Rn) содержит 32 элемента. В него, помимо десяти 5d-элементов (La, Hf – Hg), входит семейство из четырнадцати 4f-элементов – лантаноидов (лантанидов, Ln). В степени окисления +3, +4 они являются химическими аналогами актиноидов, в степени окисления +2 – щёлочноземельных элементов. Лантаноиды размещены в группе 3 длинной формы, клетка La, и для удобства вынесены под таблицу.
Седьмой период, подобно шестому, содержит 32 элемента. Актиний – аналог лантана. После Ас следует семейство из четырнадцати 5f-элементов – актиноидов (актинидов, An) (Z= 90–103). В периодической системе химических элементов их размещают в клетке Ас и, подобно Ln, записывают отдельной строкой под таблицей. Этот приём предполагает наличие существенного химического сходства элементов двух f-семейств. Именно на этом основывалась «актинидная концепция» Г. Сиборга (1944), сыгравшая ведущую роль при разработке методов разделения продуктов деления урана и поиске новых элементов. Однако эта концепция справедлива лишь для трёх- и четырёхвалентных An. Актиноиды же проявляют степени окисления от +2 до +7 (последняя характерна для Np, Pu, Am) и +8 (для плутония). Для наиболее тяжёлых An характерна стабилизация низших степеней окисления (+2 или даже +1 для Md).
Экспериментальные оценки химии элементов с Z=104 (резерфордий) и Z=105 (дубний) позволили заключить, что они являются аналогами соответственно Hf и Та, т. е. 6d-элементами (должны располагаться в IVб и Vб подгруппах короткой формы). Химическая идентификация элементов с Z=106–118 не проводилась из-за слишком коротких «времён жизни» синтезированных изотопов, но в соответствии со структурой периодической системы можно считать, что элементы Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn относятся к 6
Памятник-таблица «Периодическая система элементов Д. И. Менделеева». Авторы: Владимир Фролов, Давид Кричевский.Периодическая система химических элементов является важным звеном эволюции атомно-молекулярного учения, способствует уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов.
Дата публикации: 1 августа 2022 г. в 14:10 (GMT+3)
тест для 11 класса по теме «Строение атома. Строение вещества» | Тест по химии (11 класс):
ТЕСТ 11 класс
Периодический закон.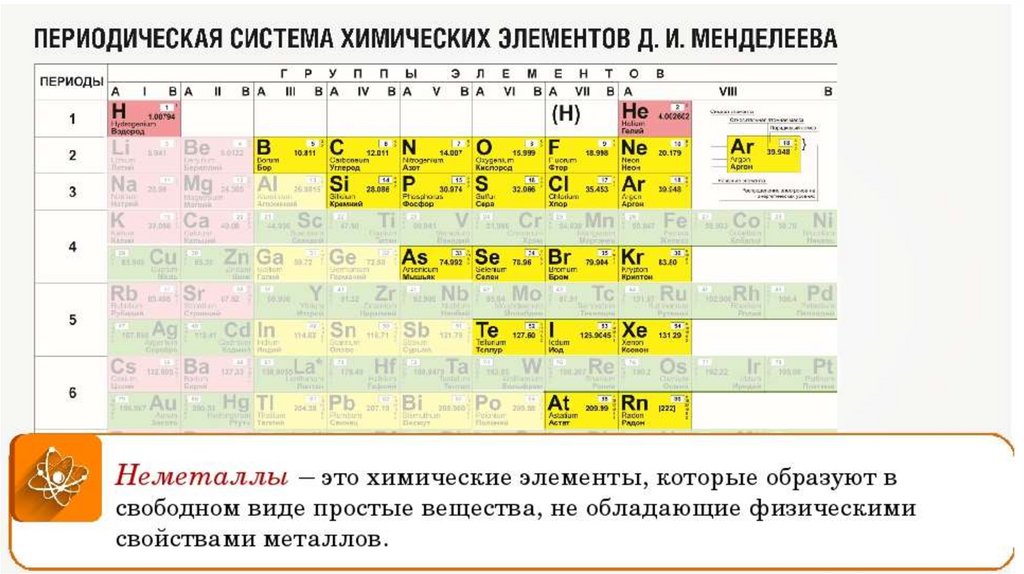
Периодическая система
Химических элементов.
Строение атома.
Вариант 1
ЧастьА.
1) (2 балла). Электроны были открыты:
А).Н.Бором. В).Дж.Томсоном.
Б).Э.Резерфордом. Г). Д.Чедвигом.
2) (2 балла). Порядковый номер элемента в периодической системе определяется:
А). Зарядом атома.
Б). Числом электронов в наружном слое атома.
В). Числом электронных слоёв в атоме.
Г). Числом нейтронов в атоме.
3*) (2 балла). Общий запас энергии электронов в атоме характеризует:
А). Главное квантовое число.
Б). Магнитное квантовое число.
В). Орбитальное квантовое число.
Г). Спиновое квантовое число.
4) (2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергитических уровней:
А). B и Si. Б). S и SE. В). K и Са. Г). Mn и Fe.
5) (2 балла). s-Элементом является:
А). Барий. Б).Америций. В). Галлий. Г). Ванадий.
6) (2 балла). Электронная конфигурация …3d64s2 соответствует элементу:
Электронная конфигурация …3d64s2 соответствует элементу:
A). Аргону. Б). Железу. В). Криптону. Г). Рутению
7) ( 2 балла). Амфотерным гидроксидом является вещество, формула которого:
А). Be(OH)2. Б). h3SiO3. В). Mg(OH)2 . Г). Ba(OH)2.
8) (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А). Sr-Rb-K. Б). Na-K-Ca. В). Na-K-Ca. Г). Al-Mg-Be.
9) ( 2 балла). Элемент Э с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле:
А). Э2О. Б). Э2О3. В). ЭО2. Г). Э2О5.
10) (2 балла) Изотоп железа, в ядре которого содержится 28 нейтронов, обозначают:
А). 54/26Fe. Б). 56/26Fe. В). 57/26Fe. Г). 58/26Fe.
11) (9 баллов). Установите соответствие.
А).1s22s2 1). Бериллий.
Б).1s22s22p3 2). Натрий.
В).1s22s22p63s1 3). Хлор.
Г).1s22s22p63s23p5 4). Азот.
Формула высшего оксида.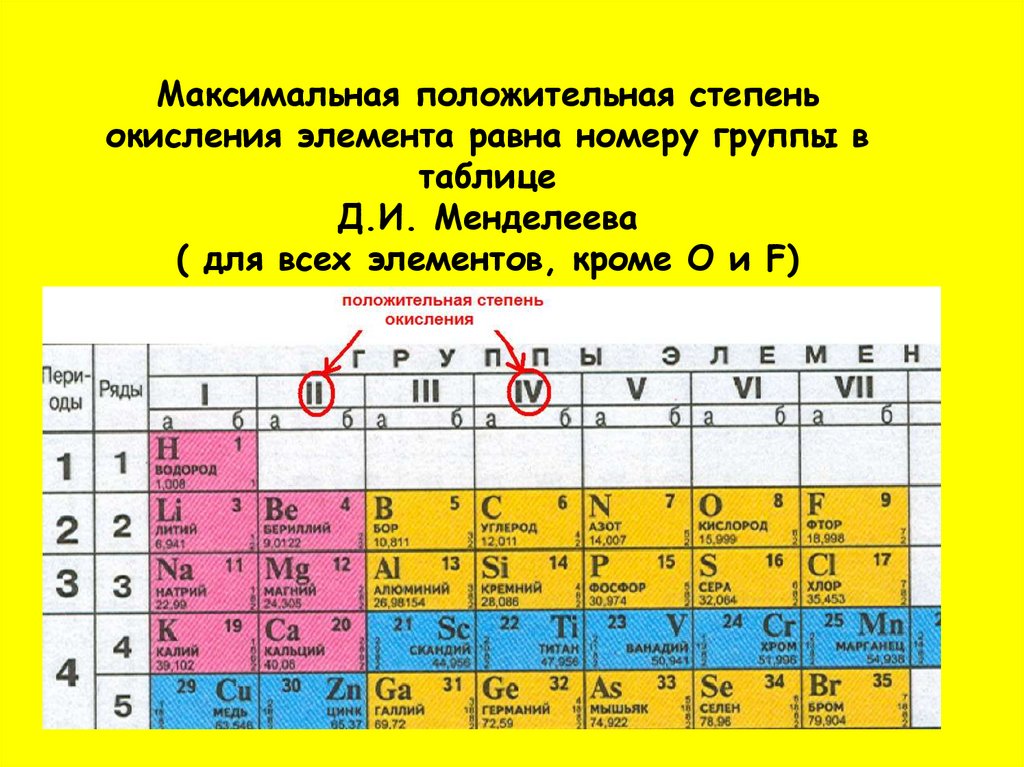
1.Э2O 2. ЭО 3. ЭО2 4.Э2О7.
Формула высшего гидроксида
1.ЭOН 2. Э(ОН) 3. НЭО3 4.НЭО4.
Часть Б.
12) (3 балла). На основании положения в Периодической системе расположите элементы: Бериллий, Бор, Магний, Натрий – в порядке возрастания восстановительных свойств. Обьясните ответ.
13) (6 баллов). Как и почему в Периодической системе изменяются неметаллические свойства?
А). В пределах периода
Б). В пределах главной подгруппы
14).(7 баллов). Составьте электронную формулу элемента с порядковым номером 32 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
15) (5 баллов). Какие химические свойства характерны для оксида элемента 2-го периода, главной подгруппы I группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
Вариант 2
Часть А.
1) (2 балла). Атомные ядра были открыты:
А. Д.Менделеевым. В.Дж.Томсоном.
Д.Менделеевым. В.Дж.Томсоном.
Б.Э.Резерфордом. Г.Д.Чедвигом.
2) (2 балла). Номер периода в Периодической системе определяется:
А). Зарядом ядра атома.
Б). Числом электронов в наружном слое атома.
В). Числом электронных слоёв в атоме.
Г). Числом электронов в атоме.
3*) (2 балла). Форму электронных орбиталей характеризует:
А). Главное квантовое число.
Б). Магнитное квантовое число.
В). Орбитальное квантовое число.
Г). Спиновое квантовое число.
4) (2балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергитических уровней:
А). S и Cl. Б). Be и B. В). Kr и Xe. Г). Mo и Se.
5) (2 балла). p-Элементом является:
А). Скандий. Б). Барий. В). Мышьяк. Г). Гелий.
6) (2 балла). Электронная конфигурация …3d104s2 соответствует элементу:
A). Кальцию. Б). Криптону. В). Кадмию. Г). Цинку.
7) ( 2 балла). Амфотерным гидроксидом является вещество, формула которого:
А).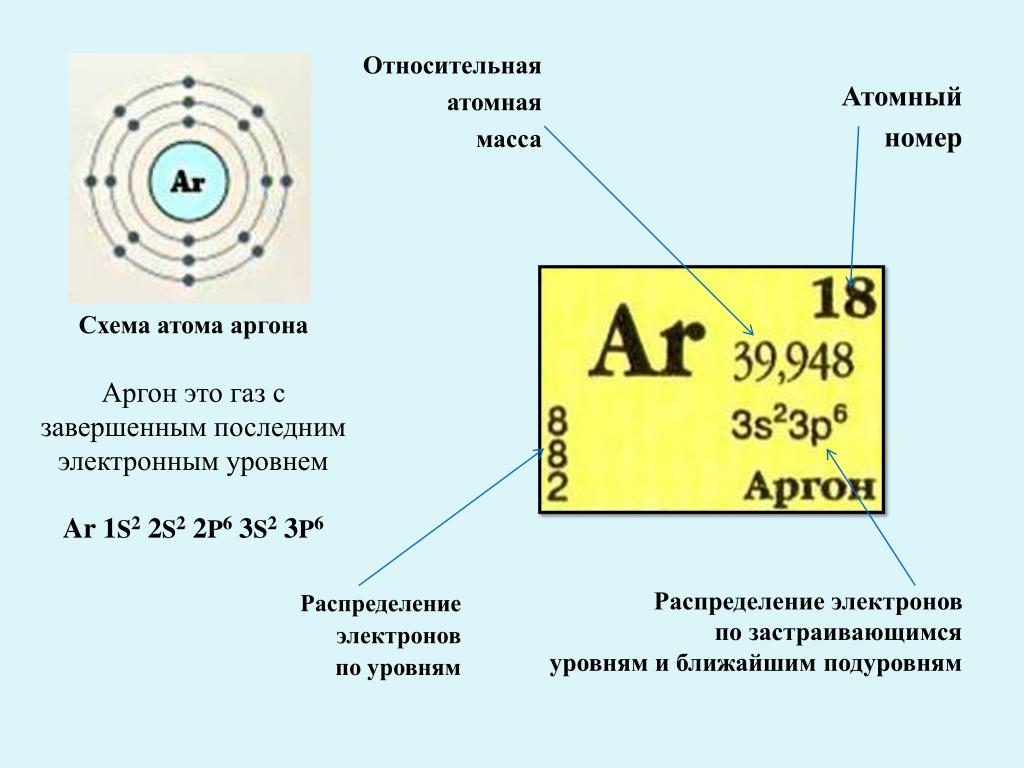 Zn(OH)2. Б). Mg(OH)2. В). Ca(OH)2 . Г). Cr(OH)2.
Zn(OH)2. Б). Mg(OH)2. В). Ca(OH)2 . Г). Cr(OH)2.
8) (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А). Mg-Ca-Zn. Б). Al-Mg-Ca. В). Sr-Rb-K. Г).Ge-Si-Sb.
9) ( 2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p1 образует высший оксид, соответствующий формуле:
А). Э2О. Б). Э2О3. В). ЭО2. Г). ЭО3.
10) (2 балла) Изотоп железа, в ядре которого содержится 22 нейтрона, обозначают:
А). 40/20Ca. Б). 42/20Ca. В). 44/20Ca. Г). 48/20Ca.
11) (9 баллов). Установите соответствие.
А).1s22s22p63s23p1 1). Алюминий.
Б).1s22s22p63s2 2). Калий.
В).1s22s22p63s23p63d104s24p4 3). Селен.
Г).1s22s22p63s23p64s1 4). Магний.
Формула высшего оксида.
1.Э2O 2. Э2О3 3. ЭО 4.ЭО3.
Формула высшего гидроксида
1.ЭOН 2. Э(ОН)2 3. Э(ОН)3 4.Н2ЭО4.
Часть Б.
12) (3 балла).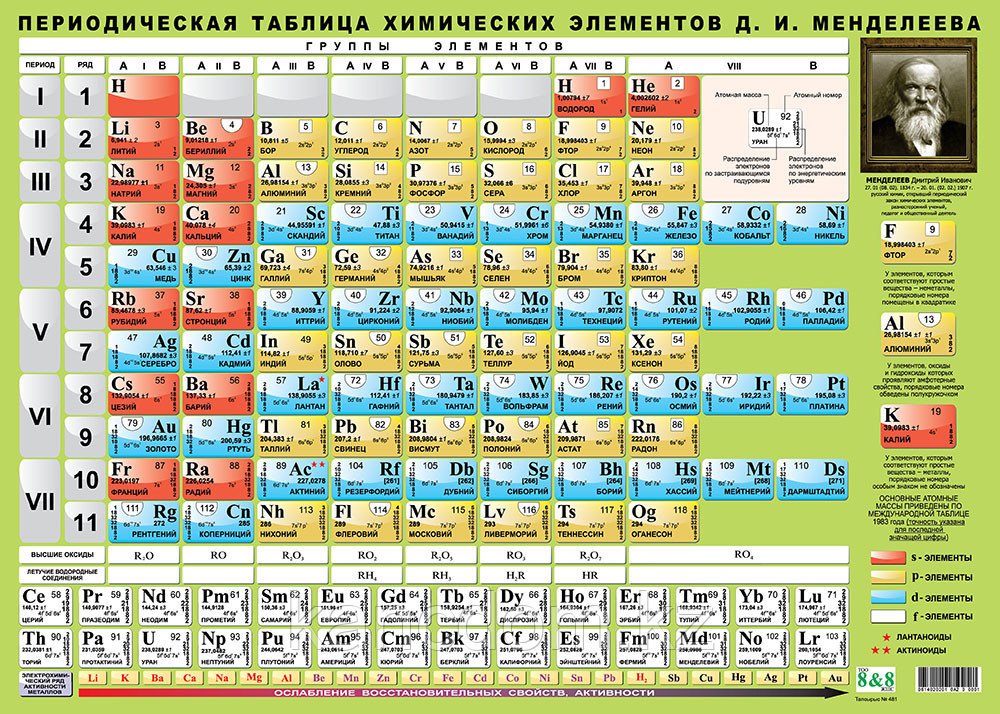 На основании положения в Периодической системе расположите элементы: Германий, Мышьяк, Сера, Фосфор – в порядке убывания окислительныхсвойств. Обьясните ответ.
На основании положения в Периодической системе расположите элементы: Германий, Мышьяк, Сера, Фосфор – в порядке убывания окислительныхсвойств. Обьясните ответ.
13) (6 баллов). Как и почему в Периодической системе изменяются металлические свойства?
А). В пределах периода.
Б). В пределах главной подгруппы.
14).(7 баллов). Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
15) (5 баллов). Какие химические свойства характерны для оксида элемента 3-го периода, главной подгруппы VI группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
Вариант 3
Часть А.
1) (2 балла). Нейтроны были открыты:
А.Н.Бором. В.Г.Мозли.
Б.Д.Менделеевым. Г.Д.Чедвигом.
2) (2 балла). Номер группы (для элементов главных подгрупп) в Периодической системе определяется:
А).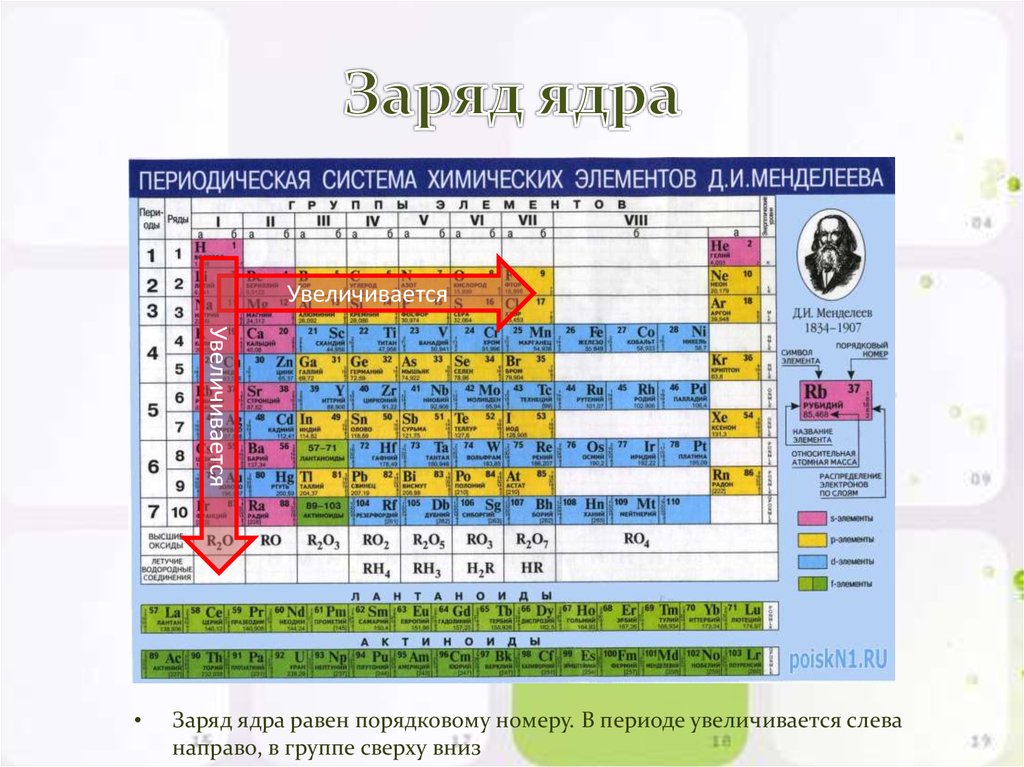 Число протонов в атоме.
Число протонов в атоме.
Б). Числом электронов в наружном слое атома.
В). Числом электронных слоёв в атоме.
Г). Числом нейтронов в атоме.
3*) (2 балла). Ориентацию электронных орбиталей в пространстве характеризует:
А). Главное квантовое число.
Б). Магнитное квантовое число.
В). Орбитальное квантовое число.
Г). Спиновое квантовое число.
4) (2балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергитических уровней:
А). Ba и K. Б). Sb и Bi. В). Ti и Ge. Г). Kr и Fe.
5) (2 балла). d-Элементом является:
А). Калий. Б). Кремний. В). Аргон. Г). Медь.
6) (2 балла). Электронная конфигурация …3d54s2 соответствует элементу:
A). Брому. Б). Кальцию. В). Марганцу. Г). Хлору.
7) ( 2 балла). Амфотерным оксидом является вещество, формула которого:
А). CrO. Б). Cr2O3. В). CrO3. Г). FeO.
8) (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А). Al-Ga-Ge. Б). Ca-Sr-Ba. В). K-Na-Li. Г). Mg-Ca-Zn.
Al-Ga-Ge. Б). Ca-Sr-Ba. В). K-Na-Li. Г). Mg-Ca-Zn.
9) ( 2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p1 образует высший оксид, соответствующий формуле:
А). ЭО. Б). Э2О3. В). Э2О5. Г). ЭО3.
10) (2 балла) Изотоп железа, в ядре которого содержится 30 нейтронов, обозначают:
А). 54/26Fe. Б). 56/26Fe. В). 57/26Fe. Г). 58/26Fe.
11) (9 баллов). Установите соответствие.
А).1s22s22p1 1). Бор.
Б).1s22s1 2). Бром.
В).1s22s22p63s23p3 3). Фосфор.
Г).1s22s22p63s23p63d104s24p5 4). Литий.
Формула высшего оксида.
1.Э2O 2. Э2О3 3. Э2О5 4.Э2О7.
Формула высшего гидроксида
1.ЭOН 2. НЭО3 3. Н3ЭО3 4.НЭО4.
Часть Б.
12) (3 балла). На основании положения в Периодической системе расположите элементы: Алюминий, Калий, Кальций, Магний – в порядке убывания восстановительных свойств. Обьясните ответ.
Обьясните ответ.
13) (6 баллов). Почему заряды ядер атомов элеиентов расположенных в порядке возрастания порядковых номеров в Периодической системе, изменяются монотонно, а свойства элементов периодически?
14).(7 баллов). Составьте электронную формулу элемента с порядковым номером 38 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
15) (5 баллов). Какие химические свойства характерны для гидроксидов металлов? Ответ подтвердите, написав уравнения реакций.
Вариант 4
1) (2 балла). Протоныбыли открыты:
А.Г.Паули. В.Дж.Томсоном.
Б.Э.Резерфордом. Г.Д.Чедвигом.
2) (2 балла). Общее число электронов в атоме элемента определяют, используя Периодическую систему по номеру:
А). Группы. Б). Периода. В). Ряда. Г). Порядковому.
3*) (2 балла). Собственное вращение электрона характеризует:
А). Главное квантовое число.
Главное квантовое число.
Б). Магнитное квантовое число.
В). Орбитальное квантовое число.
Г). Спиновое квантовое число.
4) (2балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергитических уровней:
А). Sn и Si. Б). As и Se. В). Zn и Ca. Г). Mo и Te.
5) (2 балла). d-Элементом является:
А). Германий. Б). Калий. В). Селен. Г). Уран.
6) (2 балла). Электронная конфигурация …4s24p6 соответствует элементу:
A). Брому. Б). Железу. В). Неону. Г). Криптону.
7) ( 2 балла). Амфотерным оксидом является вещество, формула которого:
А). Ga(OH)3. Б). Mg(OH)2. В). LiOH. Г). Sc(OH).
8) (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А). K-Rb-Sr. Б). Al-Mg-Be. В). Be-Li-Cs. Г).Ge-Sn-Sb.
9) ( 2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p1 образует высший оксид, соответствующий формуле:
А). Э2О. Б). Э2О3. В). ЭО2. Г). ЭО3.
Б). Э2О3. В). ЭО2. Г). ЭО3.
10) (2 балла) Изотоп железа, в ядре которого содержится 22 нейтрона, обозначают:
А). 40/20Ca. Б). 42/20Ca. В). 44/20Ca. Г). 48/20Ca.
11) (9 баллов). Установите соответствие.
А).1s22s22p3 1). Азот.
Б).1s22s22p63s23p4 2). Кальций.
В).1s22s22p63s23p2 3). Кремний.
Г).1s22s22p63s23p64s2 4). Сера.
Формула высшего оксида.
1.ЭO 2. ЭО2 3. Э2О5 4.ЭО3.
Формула высшего гидроксида
1.Н2ЭО4 2. Э(ОН)2 3. Н3ЭО3 4.НЭО4.
Часть Б.
12) (3 балла). На основании положения в Периодической системе расположите элементы: Кислород, Мышьяк, Сера, Фосфор – в порядке убывания окислительных свойств. Обьясните ответ.
13) (6 баллов). Перечислите основные правила (законы), в соответствии с которыми происходит заполнение электронами уровней, подуровней и орбиталей в электронной оболочке атомов элементов.
14).(7 баллов). Составьте электронную формулу элемента с порядковым номером 34 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
15) (5 баллов). Какие химические свойства характерны для гидроксидов неметаллов? Ответ подтвердите, написав уравнения реакций.
Строение вещества
Вариант 1
Часть А.
1). (2 балла). Формула вещества с ковалентной полярной связью:
А). Cl2. Б). KCl. В). Nh4. Г). O2.
2). (2 балла). Вещество между молекулами которого существует водородная связь:
А). Этанол. Б). Метан.
В). Водород. Г). Бензол.
3). (2 балла). Число общих электронных пар в молекуле водорода:
А). Одна. Б). Две.
В). Три. Г). Четыре
4). ( 2 балла). Полярность химической связи увеличивается в ряду соединений, формулы которых:
А). Nh4, HI, O2. Б). Ch5, h3O, HF.
Nh4, HI, O2. Б). Ch5, h3O, HF.
В). Ph4, h3S, h3. Г). HCl, Ch5, Cl2.
5). (2 балла). Вид гибридизации электронных орбиталей атома фосфора в молекуле соединения, формула которого Ph4:
А). sp2. Б). sp3. В). sp. Г). Не гибридизированны.
6). (2 балла). Кристаллическая решетка хлорида магния:
А). Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
7). (2 балла). Число σ- и π- связей в молекуле этина:
А). 5σ и π – нет. Б). 2σ и 3π.
В). 2σ и 3π. Г). 4σ и 1π.
8). (2 балла). Вещества формулы которых Ch4-Ch3-OH и Ch4-O-Сh4, — это:
А). Гомологи.
Б). Изомеры.
В). Одно и то же вещество.
9). (2 балла). Гомологом вещества, формула которого Ch3=CH-Ch4, является:
А). Бутан. Б). Бутен-2. В). Бутен-2. Г). Бутин-1.
10). Вещество формула которго Ch4-CH-CH-Ch4
׀ ׀
Ch4 OH
называют:
А). 2-Метилбутанол-3. Б). 1,3-Диметилпропанол-1.
2-Метилбутанол-3. Б). 1,3-Диметилпропанол-1.
В). 3-Метилбутанол-2. Г). Пентанол-2.
Часть Б.
11). (8 баллов). Составьте схему образования соединений, состоящих из химических элементов.
А). Магния и Фтора. Б). Селена и Водорода.
Укажите тип химической связи в каждом соединении.
12). (4балла). Какую геометрическую форму имеет молекула соединения с ковалентной связью из задания 11?
13). (8 баллов). Расположите соединения, формулы которых
Ch3ClCOOH, C6H5OH, Ch4COOH, C2H5OH, в порядке возрастания кислотных свойств. Объясните ответ.
14). (6 баллов). Составьте структурные формулы не менее трёх возможных изомеров веществ состава C4H6. Назовите эти вещества.
15). (4 балла). Какой обьём кислорода потребуется для полного сгорания 1 кг этилена (этена)?
Вариант 2
Часть А.
1). (2 балла). Формула вещества с ионной связью:
А). HCl. Б). KBrl. В). P4. Г). Ch4OH.
2). (2 балла). Вещество с металлическойсвязью:
А). Оксид калия. Б). Медь.
В). Кремний. Г). Гидроксид магния.
3). (2 балла). Число общих электронных пар в молекуле азота:
А). Одна. Б). Две.
В). Три. Г). Четыре
4). (2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых:
А). Cl2, h3S, CO2. Б). Nh4, Ph4, SO2.
В). HCl, HBr, HI. Г). Bh4, Nh4, HF.
5). (2 балла). Вид гибридизации электронных орбиталей атома cеры в молекуле соединения, формула которого h3S:
А). sp3. Б). sp2. В). sp. Г). Не гибридизированны.
6). (2 балла). Кристаллическая решетка оксида кремния (VI):
А). Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
7). (2 балла). Число σ- и π- связей В молекуле этена:
А). 6σ и π – нет. Б). 3σ и 3π.
В). 4σ и 3π. Г). 5σ и 1π.
4σ и 3π. Г). 5σ и 1π.
8). (2 балла). Вещества формулы которых Ch3=CH-Сh3 и Ch3=С-Сh4, — это:
А). Гомологи. ׀
Б). Изомеры. Ch4
В). Одно и то же вещество.
9). (2 балла). Гомологом вещества, формула которого Ch4-Ch3-Ch3-OH, является:
А). Бутаналь. Б). Бутанол-2. В). Этаналь. Г). Этанол.
10). Вещество формула которго Ch4-C=Ch3,
׀
Ch4-Ch3
называют:
А).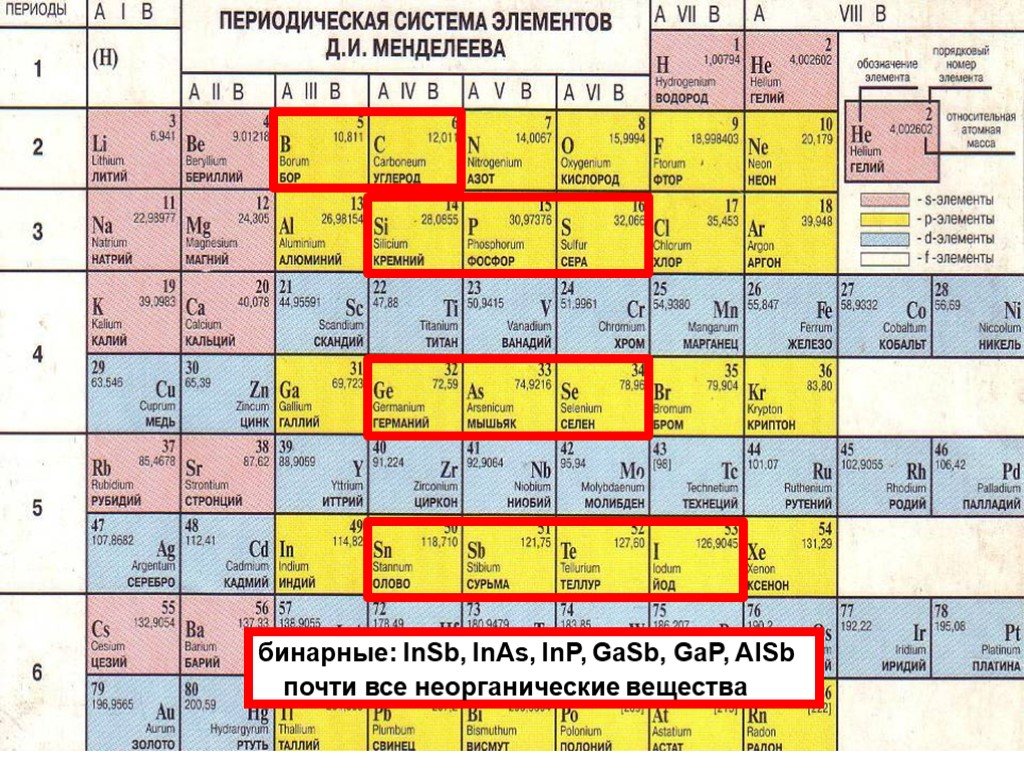 2-Метилбутен-1. Б). 2-Этилпропен-2.
2-Метилбутен-1. Б). 2-Этилпропен-2.
В). 2-Этилпропен-1. Г). 2-Метилбутен -2.
Часть Б.
11). (8 баллов). Составьте схему образования соединений, состоящих из химических элементов.
А). Кальция и Фтора. Б). Мышьяка и Водорода.
Укажите тип химической связи в каждом соединении.
12). (4балла). Какую геометрическую форму имеет молекула соединения с ковалентной связью из задания 11?
13). (8 баллов). Расположите соединения, формулы которых
Ch4Nh3, Nh4, C6H5Nh3, C2H5Nh3, в порядке возрастания кислотных свойств. Объясните ответ.
14). (6 баллов). Составьте структурные формулы не менее трёх возможных изомеров веществ состава C4H8O2. Назовите эти вещества.
15). (4 балла). Какой обьём кислорода потребуется для полного сгорания 1
м3 пропана?
Вариант 3
Часть А.
1). (2 балла). Формула вещества с ковалентной неполярной связью:
Формула вещества с ковалентной неполярной связью:
А). MgCl2. Б). HF. В). N2. Г).Al.
2). (2 балла). Вещество с металлической связью:
А). Кислород. Б). Метан.
В).Фторид натрия. Г). Этаналь.
3). (2 балла). Число общих электронных пар в молекуле фтора:
А). Одна. Б). Две.
В). Три. Г). Четыре
4). (2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых:
А). HI, HCl2, HF. Б). HBr, O2, h3S.
В). h3S, Nh4, Ch5. Г). h3O, Ph4, HI.
5). (2 балла). Вид гибридизации электронных орбиталей атома cеры в молекуле соединения, формула которого C2h3:
А). sp3. Б). sp2. В). sp. Г). Не гибридизированны.
6). (2 балла). Кристаллическая решетка оксида сахарозы:
А). Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
7). (2 балла). Число σ- и π- связей В молекуле метаналя:
А). 2σ и 2π. Б). 4σ и π– нет.
В). 3σ и 1π. Г). 4σ и 1π.
Г). 4σ и 1π.
8). (2 балла). Вещества формулы которых Ch4 Сh4 Сh4
׀ ׀ ׀
это: C≡C-Ch3-Сh3 и Ch4-С≡С-Сh3,
А). Гомологи.
Б). Изомеры.
В). Одно и то же вещество.
9). (2 балла). Изомером вещества, формула которого Ch4-CH-CH-Ch4, является:
А). Бутан. Б). Бутин-2. В). Метилцикопропан. Г). Бутадиен-1,3.
10). Вещество формула которго Nah3PO4,
называют:
А). Гидрофосфат натрия. Б). Фосфат натрия.
В). Дигидрофосфат натрия. Г). Фосфит натрия.
Дигидрофосфат натрия. Г). Фосфит натрия.
Часть Б.
11). (8 баллов). Составьте схему образования соединений, состоящих из химических элементов.
А). Кальция и Серы. Б). Бора и Фтора.
Укажите тип химической связи в каждом соединении.
12). (4балла). Какую геометрическую форму имеет молекула соединения с ковалентной связью из задания 11?
13). (8 баллов). Расположите соединения, формулы которых
H-CO-OH, Ch4H-OH, H-OH, C6H5-OH, в порядке возрастания кислотных свойств. Объясните ответ.
14). (6 баллов). Составьте структурные формулы не менее трёх возможных изомеров веществ состава C5h22O. Назовите эти вещества.
15). (4 балла). Какой обьём водорода потребуется для получения 1 т аммиака?
Вариант 4
Часть А.
1). (2 балла). Формула вещества с металлической связью:
А). O2. Б). h3O. В). Ca. Г).Nh4.
В). Ca. Г).Nh4.
2). (2 балла). Вещество сковалентной полярной связью:
А). Фтороводород. Б). Хлор.
В).Пероксид натрия. Г). Фторид натрия.
3). (2 балла). Число общих электронных пар в молекуле бромоводорода:
А). Одна. Б). Две.
В). Три. Г). Четыре
4). (2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых:
А). Ph4, HCl, HF. Б). HF, h3O, Nh4.
В). Ch5, Ph4, h3O. Г). h3O, HI , Nh4.
5). (2 балла). Вид гибридизации электронных орбиталей атома углерода в молекуле соединения, формула которого C6H6:
А). sp3. Б). sp2. В). sp. Г). Не гибридизированны.
6). (2 балла). Кристаллическая решетка оксида белого фосфора:
А). Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
7). (2 балла). Число σ- и π- связей В молекуле уксусной кислоты:
А). 7σ и 1π. Б). 6σ и 2π.
В). 8σ и π– нет. Г). 5σ и 3π.
8). (2 балла).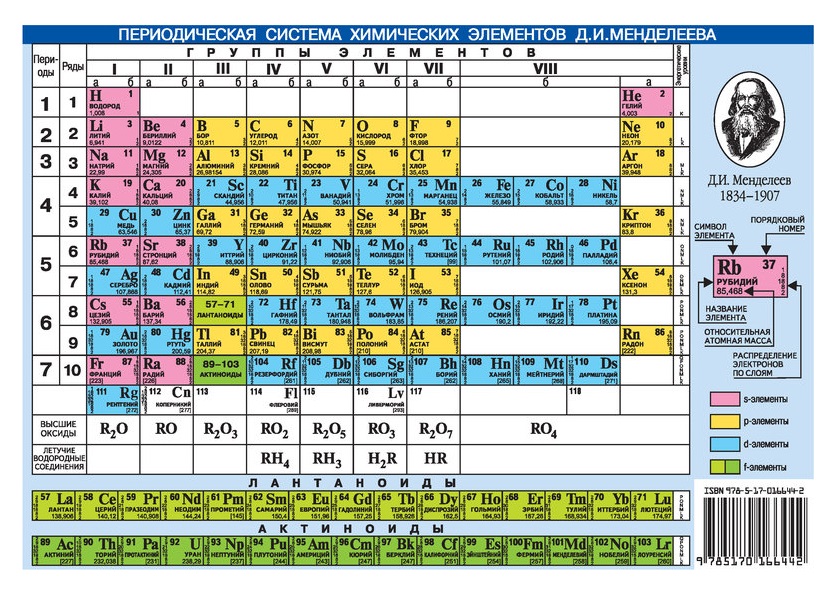 Вещества формулы которых C2H5COOH и Ch4COOH
Вещества формулы которых C2H5COOH и Ch4COOH
А). Гомологи.
Б). Изомеры.
В). Одно и то же вещество.
9). (2 балла). Изомером вещества, формула которого Na2S, является:
А). Бутан. Б). Бутин-2. В). Метилцикопропан. Г). Бутадиен-1,3.
10). Вещество формула которго Nah3PO4,
называют:
А). Гидросульфид натрия. Б). Сульфит натрия.
В). Сульфид натрия. Г). Сульфат натрия.
Часть Б.
11). (8 баллов). Составьте схему образования соединений, состоящих из химических элементов.
А). Кремния и Водорода. Б). Натрия и Кислорода.
Укажите тип химической связи в каждом соединении.
12). (4балла). Какую геометрическую форму имеет молекула соединения с ковалентной связью из задания 11?
(4балла). Какую геометрическую форму имеет молекула соединения с ковалентной связью из задания 11?
13). (8 баллов). Расположите соединения, формулы которых
C2H5OH, HCOOH, ClCh3- HCOOH, C6H5OH, в порядке возрастания кислотных свойств. Объясните ответ.
14). (6 баллов). Составьте структурные формулы не менее трёх возможных изомеров веществ состава C4H8. Назовите эти вещества.
15). (4 балла). Какой обьём ацетилена можно получить из 1 кгкальция?
Периодическая таблица | Определение, элементы, группы, сборы, тенденции и факты
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Дмитрий Менделеев Лотар Мейер Поль-Эмиль Лекок де Буабодран
- Похожие темы:
- химический элемент атом группа периодический закон период
Просмотреть весь связанный контент →
Популярные вопросы
Что такое периодическая таблица?
Периодическая таблица представляет собой табличный массив химических элементов, упорядоченных по атомному номеру, от элемента с наименьшим атомным номером, водорода, до элемента с наибольшим атомным номером, оганесона. Атомный номер элемента — это число протонов в ядре атома этого элемента. У водорода 1 протон, а у оганесона 118.
Атомный номер элемента — это число протонов в ядре атома этого элемента. У водорода 1 протон, а у оганесона 118.
Что общего у групп периодической таблицы?
Группы периодической таблицы отображаются в виде вертикальных столбцов, пронумерованных от 1 до 18. Элементы в группе имеют очень похожие химические свойства, которые возникают из-за количества присутствующих валентных электронов, то есть количества электронов в внешняя оболочка атома.
Откуда взялась периодическая таблица?
Расположение элементов в периодической таблице определяется электронной конфигурацией элементов. Из-за принципа запрета Паули не более двух электронов могут занимать одну и ту же орбиталь. Первый ряд периодической таблицы состоит всего из двух элементов, водорода и гелия. Чем больше у атомов электронов, тем больше у них орбит, доступных для заполнения, и, таким образом, строки содержат больше элементов в нижней части таблицы.
Почему таблица Менделеева делится?
Периодическая таблица имеет две строки внизу, которые обычно отделены от основной части таблицы. Эти ряды содержат элементы лантаноидного и актиноидного рядов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (актиний до лоуренсия) соответственно. Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
Эти ряды содержат элементы лантаноидного и актиноидного рядов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (актиний до лоуренсия) соответственно. Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
периодическая таблица , полностью периодическая таблица элементов , в химии организованный ряд всех химических элементов в порядке возрастания атомного номера, т. е. общего числа протонов в атомном ядре. Когда химические элементы расположены таким образом, в их свойствах возникает повторяющаяся закономерность, называемая «периодическим законом», при которой элементы в одном столбце (группе) обладают сходными свойствами. Неоценимое значение для развития химии имело первоначальное открытие, сделанное Д.И. Менделеевым в середине 19 в.
Как периодический закон помогает нам понять свойства элементов и то, как они соотносятся друг с другом?
Посмотреть все видео к этой статье До второго десятилетия 20-го века фактически не признавалось, что порядок элементов в периодической системе соответствует их атомным номерам, целые числа которых равны положительным электрическим зарядам атомные ядра, выраженные в электронных единицах. В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
История периодического закона
Узнайте, как устроена таблица Менделеева
Просмотреть все видео к этой статье В первые годы XIX века наблюдалось бурное развитие аналитической химии — искусства различать различные химические вещества — и, как следствие, накопление обширных знаний о химических и физических свойствах как элементов, так и соединений. Это быстрое распространение химических знаний вскоре потребовало классификации, ибо на классификации химических знаний основана не только систематизированная литература по химии, но и лабораторное искусство, с помощью которого химия передается как живая наука от одного поколения химиков к другому. Отношения между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отставала от классификации соединений. Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Britannica Quiz
Периодическая таблица элементов
Дж.В. Доберейнер в 1817 году показал, что совокупный вес, то есть атомный вес, стронция находится посередине между весами кальция и бария, а несколько лет спустя он показал, что существуют и другие подобные «триады» (хлор, бром и йод [галогены] и литий, натрий и калий [щелочные металлы]). Ж.-Б.-А. Дюма, Л. Гмелин, Э. Ленссен, Макс фон Петтенкофер и Дж. П. Кук расширили предположения Доберейнера между 1827 и 1858 гг., показав, что подобные отношения простираются дальше, чем триады элементов: фтор добавляется к галогенам, а магний — к щелочноземельным. металлы, в то время как кислород, сера, селен и теллур были отнесены к одному семейству, а азот, фосфор, мышьяк, сурьма и висмут — к другому семейству элементов.
Позднее были предприняты попытки показать, что атомные массы элементов могут быть выражены арифметической функцией, и в 1862 г. А.-Э.-Б. де Шанкуртуа предложил классификацию элементов, основанную на новых значениях атомных весов, данных системой Станислао Канниццаро 1858 года. Де Шанкуртуа нанес атомные веса на поверхность цилиндра с окружностью 16 единиц, что соответствует приблизительному атомному весу кислород. Получившаяся винтовая кривая перенесла тесно связанные элементы в соответствующие точки цилиндра, расположенные выше или ниже друг друга, и, следовательно, он предположил, что «свойства элементов — это свойства чисел» — замечательное предсказание в свете современных знаний.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться
Классификация элементов
В 1864 г. Дж.А.Р. Ньюлендс предложил классифицировать элементы в порядке увеличения атомного веса, при этом элементам присваивались порядковые номера от единицы и вверх, и они были разделены на семь групп, обладающих свойствами, тесно связанными с первыми семью из известных тогда элементов: водород, литий, бериллий, бор, углерод. , азот и кислород. Это соотношение было названо законом октав по аналогии с семью интервалами музыкальной гаммы.
, азот и кислород. Это соотношение было названо законом октав по аналогии с семью интервалами музыкальной гаммы.
Затем в 1869 году Менделеев в результате обширной корреляции свойств и атомных весов элементов с особым вниманием к валентности (то есть числу одинарных связей, которые может образовать элемент) предложил периодический закон, согласно которой «элементы, расположенные в соответствии с величиной атомного веса, обнаруживают периодическое изменение свойств». Лотар Мейер независимо пришел к аналогичному заключению, опубликованному после выхода статьи Менделеева.
Эволюция периодической системы
Примечание редактора: это только текстовая версия. Полную версию с иллюстрацией можно приобрести здесь (PDF).
Периодическая таблица элементов — один из самых влиятельных символов в науке: единый документ, объединяющий большую часть наших знаний по химии. Версия висит на стене почти каждой химической лаборатории и лекционного зала в мире. Действительно, ничего подобного в других научных дисциплинах не существует.
История периодической системы классификации элементов насчитывает более 200 лет. На протяжении всей своей долгой истории периодическая таблица оспаривалась, изменялась и совершенствовалась по мере развития науки и открытия новых элементов [см. «Создание новых элементов» Питера Армбрустера и Фрица Петера Хессбергера]. Но, несмотря на кардинальные изменения, происшедшие в науке за последнее столетие, а именно на развитие теорий относительности и квантовой механики, революции в фундаментальной природе периодической системы не произошло. В некоторых случаях новые результаты первоначально ставили под сомнение теоретические основы периодической таблицы, но каждый раз ученым в конечном итоге удавалось включить результаты, сохранив при этом фундаментальную структуру таблицы. Примечательно, что периодическая таблица примечательна как своими историческими корнями, так и актуальностью в наши дни.
Термин «периодический» отражает тот факт, что химические свойства элементов проявляются через определенные регулярные промежутки времени.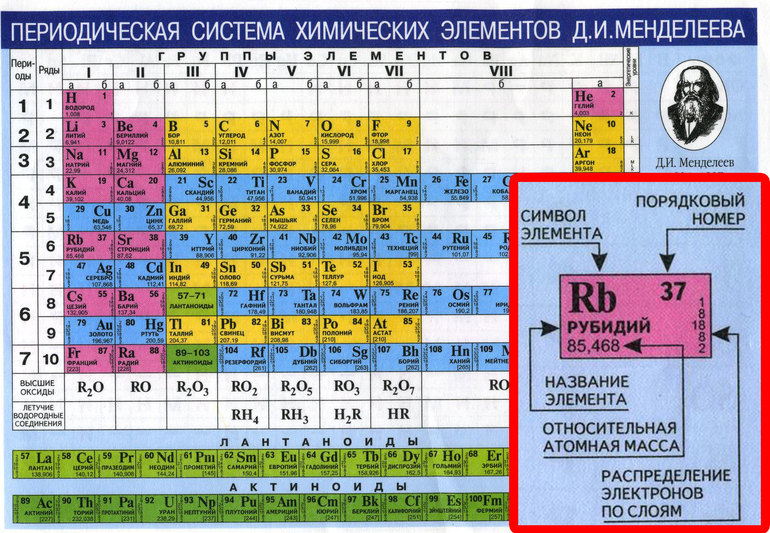 Если бы не упрощение, обеспечиваемое этой таблицей, изучающим химию пришлось бы изучать свойства всех 112 известных элементов. К счастью, периодическая таблица позволяет химикам работать, осваивая свойства горстки типичных элементов; все остальные попадают в так называемые группы или семейства со сходными химическими свойствами. (В современной периодической таблице группе или семейству соответствует один вертикальный столбец.)
Если бы не упрощение, обеспечиваемое этой таблицей, изучающим химию пришлось бы изучать свойства всех 112 известных элементов. К счастью, периодическая таблица позволяет химикам работать, осваивая свойства горстки типичных элементов; все остальные попадают в так называемые группы или семейства со сходными химическими свойствами. (В современной периодической таблице группе или семейству соответствует один вертикальный столбец.)
Открытие периодической системы классификации элементов представляет собой кульминацию ряда научных разработок, а не внезапный мозговой штурм со стороны одного человека. Тем не менее, историки обычно считают одно событие официальным рождением современной периодической таблицы: 17 февраля 1869 года русский профессор химии Дмитрий Иванович Менделеев завершил первую из своих многочисленных периодических таблиц. В него вошли 63 известных элемента, расположенных в порядке возрастания атомного веса; Менделеев также оставил место для еще не открытых элементов, для которых он предсказал атомный вес.
Однако до открытия Менделеева другие ученые активно разрабатывали какую-то организующую систему для описания элементов. Например, в 1787 году французский химик Антуан Лавуазье вместе с Антуаном Фуркруа, Луи-Бернаром Гитоном де Морво и Клодом-Луи Бертолле составил список из 33 элементов, известных в то время. Однако такие списки являются просто одномерными представлениями. Сила современной таблицы заключается в ее двух- или даже трехмерном отображении всех известных элементов (и даже тех, которые еще предстоит открыть) в логической системе точно упорядоченных строк и столбцов.
В ранней попытке организовать элементы в осмысленный ряд немецкий химик Иоганн Доберейнер указал в 1817 году, что многие из известных элементов могут быть организованы по их сходству в группы по три, которые он назвал триадами. Доберейнер выделил триады элементов лития, натрия и калия, а также хлора, брома и йода. Он заметил, что если три члена триады расположить в порядке их атомного веса, то свойства среднего элемента окажутся между свойствами первого и третьего элементов.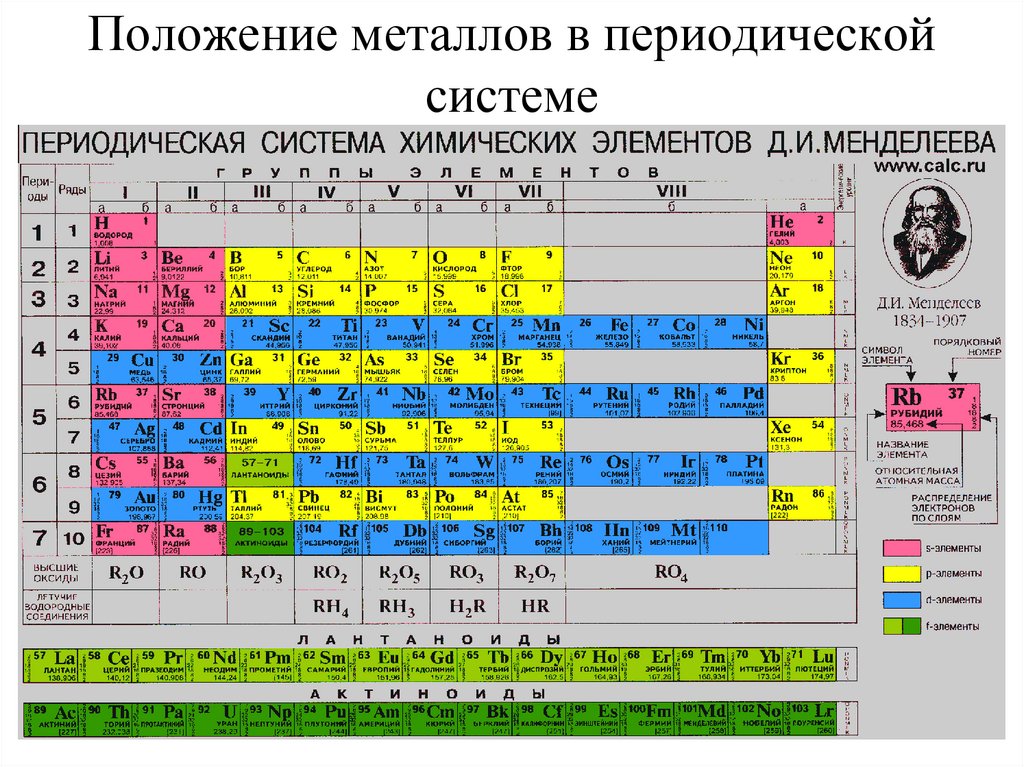 Например, литий, натрий и калий энергично реагируют с водой. Но литий, самый легкий из триады, реагирует мягче, чем два других, тогда как самый тяжелый из трех, калий, взрывается бурно. Кроме того, Доберейнер показал, что атомный вес среднего элемента близок к среднему значению весов первого и третьего членов триады. Работа Доберейнера вдохновила других на поиск корреляций между химическими свойствами элементов и их атомными весами. Один из тех, кто продолжил триадный подход в XIX веке.19-м веке был Петер Кремерс из Кёльна, который предположил, что некоторые элементы могут принадлежать двум триадам, расположенным перпендикулярно. Кремерс, таким образом, открыл новые горизонты, сравнивая элементы в двух направлениях, что позже оказалось существенным аспектом системы Менделеева.
Например, литий, натрий и калий энергично реагируют с водой. Но литий, самый легкий из триады, реагирует мягче, чем два других, тогда как самый тяжелый из трех, калий, взрывается бурно. Кроме того, Доберейнер показал, что атомный вес среднего элемента близок к среднему значению весов первого и третьего членов триады. Работа Доберейнера вдохновила других на поиск корреляций между химическими свойствами элементов и их атомными весами. Один из тех, кто продолжил триадный подход в XIX веке.19-м веке был Петер Кремерс из Кёльна, который предположил, что некоторые элементы могут принадлежать двум триадам, расположенным перпендикулярно. Кремерс, таким образом, открыл новые горизонты, сравнивая элементы в двух направлениях, что позже оказалось существенным аспектом системы Менделеева.
В 1857 году французский химик Жан-Батист-Андре Дюма отказался от идеи триад и вместо этого сосредоточился на разработке набора математических уравнений, которые могли бы объяснить увеличение атомного веса между несколькими группами химически сходных элементов. Но, как теперь признают химики, любая попытка установить организующий паттерн, основанный на атомном весе элемента, не увенчается успехом, потому что атомный вес не является фундаментальным свойством, характеризующим каждый из элементов.
Но, как теперь признают химики, любая попытка установить организующий паттерн, основанный на атомном весе элемента, не увенчается успехом, потому что атомный вес не является фундаментальным свойством, характеризующим каждый из элементов.
Периодические свойства
Важнейшей характеристикой системы Менделеева было то, что она иллюстрировала периодичность или повторение свойств элементов через определенные регулярные интервалы. Эта особенность наблюдалась ранее в расположении элементов по атомному весу, разработанном в 1862 году французским геологом Александром-Эмилем Бегуйе де Шанкуртуа. Система опиралась на довольно сложную геометрическую конфигурацию: де Шанкуртуа располагал элементы в порядке возрастания атомного веса вдоль спирали, вписанной в поверхность цилиндра и наклоненной под углом 45 градусов к основанию.
Первый полный виток спирали совпал с элементом кислорода, а второй полный виток пришелся на серу. Элементы, расположенные вертикально на поверхности цилиндра, как правило, обладали схожими свойствами, поэтому такое расположение позволило зафиксировать некоторые закономерности, которые впоследствии стали центральными в системе Менделеева. Тем не менее по ряду причин система де Шанкуртуа не оказала большого влияния на ученых того времени: в его исходной статье не было диаграммы таблицы, система была довольно сложной, а химическое сходство между элементами отображалось не очень убедительно. .
Тем не менее по ряду причин система де Шанкуртуа не оказала большого влияния на ученых того времени: в его исходной статье не было диаграммы таблицы, система была довольно сложной, а химическое сходство между элементами отображалось не очень убедительно. .
В 1860-х годах несколько других исследователей выдвинули свои версии периодической таблицы. Используя недавно стандартизированные значения атомного веса, английский химик Джон Ньюлендс предположил в 1864 году, что, когда элементы расположены в порядке атомного веса, любой из элементов проявляет свойства, аналогичные свойствам элементов, находящихся на восемь позиций впереди и на восемь позиций позади в списке. — особенность, которую Ньюлендс назвал «законом октав».
В своей первоначальной таблице Ньюлендс оставил пустые места для отсутствующих элементов, но его более известная версия 1866 года не включала эти открытые места. Другие химики сразу же высказали возражения против таблицы, потому что она не сможет вместить какие-либо новые элементы, которые могут быть обнаружены.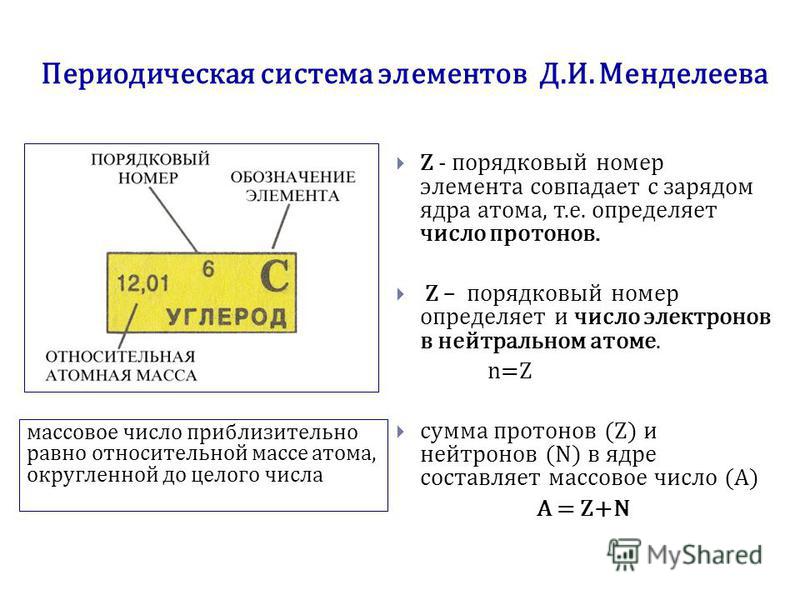 Более того, некоторые исследователи открыто высмеивали идеи Ньюлендса. На собрании Химического общества в Лондоне в 1866 году Джордж Кэри Фостер из Университетского колледжа Лондона спросил Ньюлендса, рассматривал ли он упорядочение элементов в алфавитном порядке, потому что любое расположение может привести к случайным совпадениям. По итогам собрания Химическое общество отказалось опубликовать статью Ньюлендса.
Более того, некоторые исследователи открыто высмеивали идеи Ньюлендса. На собрании Химического общества в Лондоне в 1866 году Джордж Кэри Фостер из Университетского колледжа Лондона спросил Ньюлендса, рассматривал ли он упорядочение элементов в алфавитном порядке, потому что любое расположение может привести к случайным совпадениям. По итогам собрания Химическое общество отказалось опубликовать статью Ньюлендса.
Однако, несмотря на плохой прием, работа Ньюлендса представляет собой первый случай, когда кто-либо использовал последовательность порядковых чисел (в данном случае основанную на последовательности атомных весов) для организации элементов. В этом отношении Ньюлендс предвосхитил современную организацию периодической таблицы, основанную на последовательности так называемых атомных чисел. (Понятие атомного номера, которое указывает количество протонов, присутствующих в ядре атома, не было установлено до начала 20-го века.)
Современная периодическая таблица
Химик Юлиус Лотар Мейер из Бреслауского университета в Германии в процессе пересмотра своего учебника по химии в 1868 году составил периодическую таблицу, которая оказалась удивительно похожей на знаменитую версию Менделеева 1869 года, хотя Лотару Мейеру не удалось правильно классифицировать все элементы. Но таблица не появлялась в печати до 1870 года из-за задержки издателя — фактора, который способствовал ожесточённому спору о приоритете между Лотаром Мейером и Менделеевым.
Но таблица не появлялась в печати до 1870 года из-за задержки издателя — фактора, который способствовал ожесточённому спору о приоритете между Лотаром Мейером и Менделеевым.
Примерно в то же время Менделеев составил свою таблицу Менделеева, когда тоже писал учебник по химии. В отличие от своих предшественников, Менделеев был достаточно уверен в своей периодической таблице, чтобы использовать ее для предсказания нескольких новых элементов и свойств их соединений. Он также скорректировал атомные веса некоторых уже известных элементов. Интересно, что Менделеев признался, что видел некоторые более ранние таблицы, такие как таблицы Ньюлендса, но утверждал, что не знал о работе Лотара Мейера при разработке своей диаграммы.
Хотя прогностический аспект таблицы Менделеева был большим достижением, историки, похоже, слишком придавали ему значение, которые обычно предполагали, что таблица Менделеева была принята именно из-за этой особенности. Эти ученые не заметили, что цитата Лондонского королевского общества, сопровождавшая медаль Дэви (которую Менделеев получил в 1882 г. ), вообще не упоминает о его предсказаниях. Вместо этого способность Менделеева учитывать уже известные элементы, возможно, способствовала принятию периодической системы не меньше, чем его поразительные предсказания. Хотя многие ученые помогли разработать периодическую систему, Менделеев получает большую часть заслуг в открытии химической периодичности, потому что он возвысил это открытие до закона природы и провел остаток своей жизни, смело исследуя его последствия и защищая его справедливость.
), вообще не упоминает о его предсказаниях. Вместо этого способность Менделеева учитывать уже известные элементы, возможно, способствовала принятию периодической системы не меньше, чем его поразительные предсказания. Хотя многие ученые помогли разработать периодическую систему, Менделеев получает большую часть заслуг в открытии химической периодичности, потому что он возвысил это открытие до закона природы и провел остаток своей жизни, смело исследуя его последствия и защищая его справедливость.
Защита периодической таблицы была непростой задачей — ее точность часто подвергалась сомнению последующими открытиями. Один примечательный случай произошел в 1894 году, когда Уильям Рамзи из Университетского колледжа Лондона и лорд Рэлей (Джон Уильям Струтт) из Королевского института в Лондоне открыли элемент аргон; в течение следующих нескольких лет Рамзи объявил об идентификации четырех других элементов — гелия, неона, криптона и ксенона, известных как благородные газы. (Последний из известных благородных газов радон был открыт в 1900 немецкого физика Фридриха Эрнста Дорна. )
)
Название «благородный» происходит от того факта, что все эти газы как бы стоят особняком от других элементов, редко взаимодействуя с ними с образованием соединений. В результате некоторые химики предположили, что благородным газам даже не место в периодической таблице. Эти элементы не были предсказаны Менделеевым или кем-либо еще, и только после шести лет интенсивных усилий химики и физики смогли успешно включить благородные газы в таблицу. В новом расположении была введена дополнительная колонка между галогенами (газообразные элементы фтор, хлор, бром, йод и астат) и щелочными металлами (литий, натрий, калий, рубидий, цезий и франций).
Второй пункт разногласий связан с точным порядком элементов. В исходной таблице Менделеева элементы располагались в соответствии с атомным весом, но в 1913 году голландский физик-любитель Антон ван ден Брук предположил, что принцип упорядочения периодической таблицы заключается в ядерном заряде каждого атома. Физик Генри Мозли, работавший в Манчестерском университете, проверил эту гипотезу также в 1913 году, незадолго до своей трагической гибели в Первой мировой войне. Мозли начал с фотографирования рентгеновского спектра 12 элементов, 10 из которых занимали последовательные места в спектре. периодическая таблица. Он обнаружил, что частоты признаков, называемых K-линиями, в спектре каждого элемента прямо пропорциональны квадратам целых чисел, представляющих положение каждого последующего элемента в таблице. Как
Мозли начал с фотографирования рентгеновского спектра 12 элементов, 10 из которых занимали последовательные места в спектре. периодическая таблица. Он обнаружил, что частоты признаков, называемых K-линиями, в спектре каждого элемента прямо пропорциональны квадратам целых чисел, представляющих положение каждого последующего элемента в таблице. Как
Мозли, это было доказательством того, что «в атоме есть фундаментальная величина, которая увеличивается регулярными шагами по мере того, как мы переходим от одного элемента к другому». Эта фундаментальная величина, впервые названная атомным числом в 1920 году Эрнестом Резерфордом, который тогда работал в Кембриджском университете, теперь определяется как число протонов в ядре.
Работа Мозли предоставила метод, который можно было использовать для точного определения того, сколько пустых мест осталось в периодической таблице. После этого открытия химики обратились к использованию атомного номера в качестве фундаментального принципа упорядочения периодической таблицы вместо атомного веса.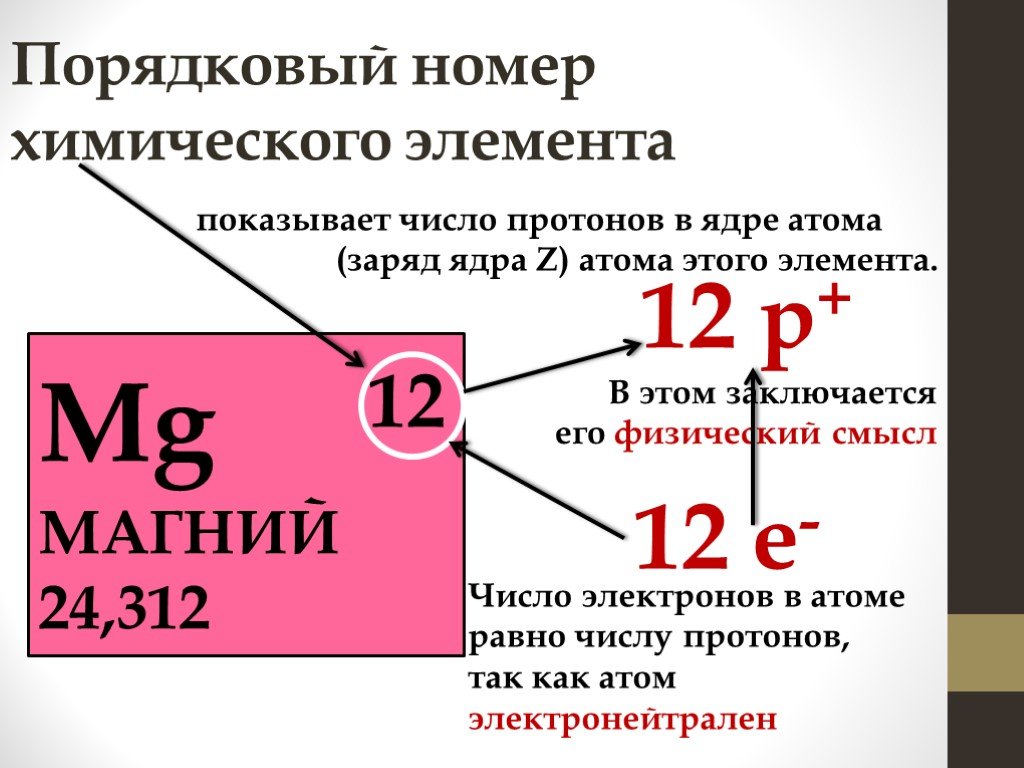 Это изменение решило многие застарелые проблемы с расположением элементов. Например, когда йод и теллур были упорядочены по атомному весу (с йодом первым), два элемента оказались неправильно расположены с точки зрения их химического поведения. Однако при упорядочении по атомному номеру (сначала теллура) два элемента находились на своих правильных позициях.
Это изменение решило многие застарелые проблемы с расположением элементов. Например, когда йод и теллур были упорядочены по атомному весу (с йодом первым), два элемента оказались неправильно расположены с точки зрения их химического поведения. Однако при упорядочении по атомному номеру (сначала теллура) два элемента находились на своих правильных позициях.
Понимание атома
Периодическая таблица вдохновила на работу не только химиков, но и физиков-атомщиков, пытавшихся понять структуру атома. В 1904 г., работая в Кембридже, физик Дж. Дж. Томсон (открывший также электрон) разработал модель атома, уделив пристальное внимание периодичности элементов. Он предположил, что атомы определенного элемента содержат определенное количество электронов, расположенных концентрическими кольцами. Более того, согласно Томсону, элементы с аналогичной конфигурацией электронов будут иметь аналогичные свойства; Таким образом, работа Томсона дала первое физическое объяснение периодичности элементов. Хотя Томсон представлял, что кольца электронов лежат внутри основного тела атома, а не циркулируют вокруг ядра, как считается сегодня, его модель действительно представляет собой первый случай, когда кто-либо обратился к расположению электронов в атоме, концепция, которая пронизывает всю науку. вся современная химия.
Хотя Томсон представлял, что кольца электронов лежат внутри основного тела атома, а не циркулируют вокруг ядра, как считается сегодня, его модель действительно представляет собой первый случай, когда кто-либо обратился к расположению электронов в атоме, концепция, которая пронизывает всю науку. вся современная химия.
Датский физик Нильс Бор, первым применивший квантовую теорию к строению атома, также руководствовался расположением элементов в периодической системе. В модели атома Бора, разработанной в 1913 году, электроны обитают в ряде концентрических оболочек, окружающих ядро. Бор пришел к выводу, что элементы в одной и той же группе периодической таблицы могут иметь одинаковую конфигурацию электронов на внешней оболочке и что химические свойства элемента будут в значительной степени зависеть от расположения электронов на внешней оболочке его атома.
Модель атома Бора также служила для объяснения того, почему благородные газы не обладают реакционной способностью: благородные газы обладают полными внешними электронными оболочками, что делает их необычайно стабильными и маловероятными для образования соединений.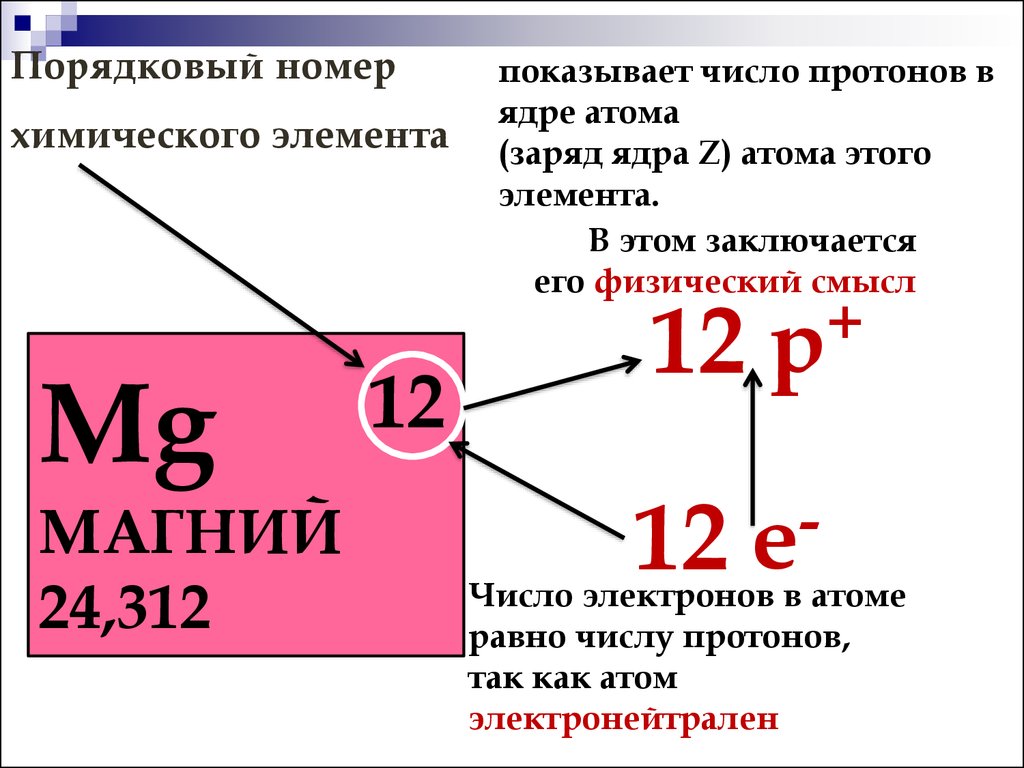 Действительно, большинство других элементов образуют соединения, чтобы получить полные внешние электронные оболочки. Более поздний анализ того, как Бор пришел к этим электронным конфигурациям, предполагает, что он действовал больше как химик, чем принято считать. Бор вывел электронные конфигурации не из квантовой теории, а из известных химических и спектроскопических свойств элементов.
Действительно, большинство других элементов образуют соединения, чтобы получить полные внешние электронные оболочки. Более поздний анализ того, как Бор пришел к этим электронным конфигурациям, предполагает, что он действовал больше как химик, чем принято считать. Бор вывел электронные конфигурации не из квантовой теории, а из известных химических и спектроскопических свойств элементов.
В 1924 году другой физик, уроженец Австрии Вольфганг Паули, решил объяснить длину каждой строки или периода в таблице. В результате он разработал принцип исключения Паули, который гласит, что никакие два электрона не могут находиться в точно таком же квантовом состоянии, которое определяется тем, что ученые называют квантовыми числами. Длины различных периодов вытекают из экспериментальных данных о порядке заполнения электронных оболочек и из квантово-механических ограничений на четыре квантовых числа, которые могут принимать электроны.
Модификации квантовой теории, сделанные Вернером Гейзенбергом и Эрвином Шредингером в середине 1920-х годов, привели к появлению квантовой механики в том виде, в котором она используется по сей день. Но влияние этих изменений на периодическую таблицу было довольно минимальным. Несмотря на усилия многих физиков и химиков, квантовая механика не может больше объяснить периодическую таблицу. Например, он не может объяснить из первых принципов порядок, в котором электроны заполняют различные электронные оболочки. Электронные конфигурации атомов, на которых основано наше современное понимание периодической таблицы, не могут быть получены с помощью квантовой механики (это потому, что фундаментальное уравнение квантовой механики, уравнение Шредингера, не может быть точно решено для атомов, отличных от водорода). В результате квантовая механика может воспроизвести оригинальное открытие Менделеева только с помощью математических приближений — она не может предсказать периодическую систему.
Но влияние этих изменений на периодическую таблицу было довольно минимальным. Несмотря на усилия многих физиков и химиков, квантовая механика не может больше объяснить периодическую таблицу. Например, он не может объяснить из первых принципов порядок, в котором электроны заполняют различные электронные оболочки. Электронные конфигурации атомов, на которых основано наше современное понимание периодической таблицы, не могут быть получены с помощью квантовой механики (это потому, что фундаментальное уравнение квантовой механики, уравнение Шредингера, не может быть точно решено для атомов, отличных от водорода). В результате квантовая механика может воспроизвести оригинальное открытие Менделеева только с помощью математических приближений — она не может предсказать периодическую систему.
Вариации на тему
В последнее время исследователи предложили различные подходы к отображению периодической системы. Например, Фернандо Дюфур, профессор химии на пенсии из колледжа Ахунцик в Монреале, разработал трехмерную периодическую таблицу, которая отображает фундаментальную симметрию периодического закона, в отличие от общепринятой двухмерной формы таблицы. То же достоинство можно увидеть и в версии таблицы Менделеева в форме пирамиды, форме, предложенной во многих случаях, но совсем недавно уточненной Уильямом Б. Дженсеном из Университета Цинциннати.
То же достоинство можно увидеть и в версии таблицы Менделеева в форме пирамиды, форме, предложенной во многих случаях, но совсем недавно уточненной Уильямом Б. Дженсеном из Университета Цинциннати.
Другим отклонением стало изобретение периодических систем, направленных на обобщение свойств соединений, а не элементов. В 1980 году Рэй Хефферлин из Южного адвентистского университета в Колледждейле, штат Теннеси, разработал периодическую систему для всех мыслимых двухатомных молекул, которые могли образоваться между первыми 118 элементами (на сегодняшний день открыто только 112).
Диаграмма Хефферлина показывает, что определенные свойства молекул — например, расстояние между атомами и энергия, необходимая для ионизации молекулы — проявляются в регулярных закономерностях. Эта таблица позволила ученым успешно предсказать свойства двухатомных молекул.
Аналогичным образом Джерри Р. Диас из Университета Миссури в Канзас-Сити разработал периодическую классификацию типа органических молекул, называемых бензоидными ароматическими углеводородами. Соединение нафталин (C10H8), обнаруженное в нафталиновых шариках, является простейшим примером. Система классификации Диаса аналогична триаде элементов Доберейнера: любая центральная молекула триады имеет общее число атомов углерода и водорода, которое является средним значением фланговых элементов как вниз, так и по таблице. Эта схема применялась для систематического изучения свойств бензоидных ароматических углеводородов и с использованием теории графов позволила предсказать стабильность и реакционную способность некоторых из этих соединений.
Соединение нафталин (C10H8), обнаруженное в нафталиновых шариках, является простейшим примером. Система классификации Диаса аналогична триаде элементов Доберейнера: любая центральная молекула триады имеет общее число атомов углерода и водорода, которое является средним значением фланговых элементов как вниз, так и по таблице. Эта схема применялась для систематического изучения свойств бензоидных ароматических углеводородов и с использованием теории графов позволила предсказать стабильность и реакционную способность некоторых из этих соединений.
Тем не менее, периодическая таблица элементов оказала самое широкое и продолжительное влияние. После более чем 200-летнего развития благодаря работе многих людей периодическая таблица остается в центре изучения химии. Она считается одной из самых плодотворных идей в современной науке, возможно, сравнимой с теорией эволюции Чарльза Дарвина. В отличие от таких теорий, как ньютоновская механика, она не была фальсифицирована или революционизирована современной физикой, но адаптировалась и совершенствовалась, оставаясь по существу невредимой.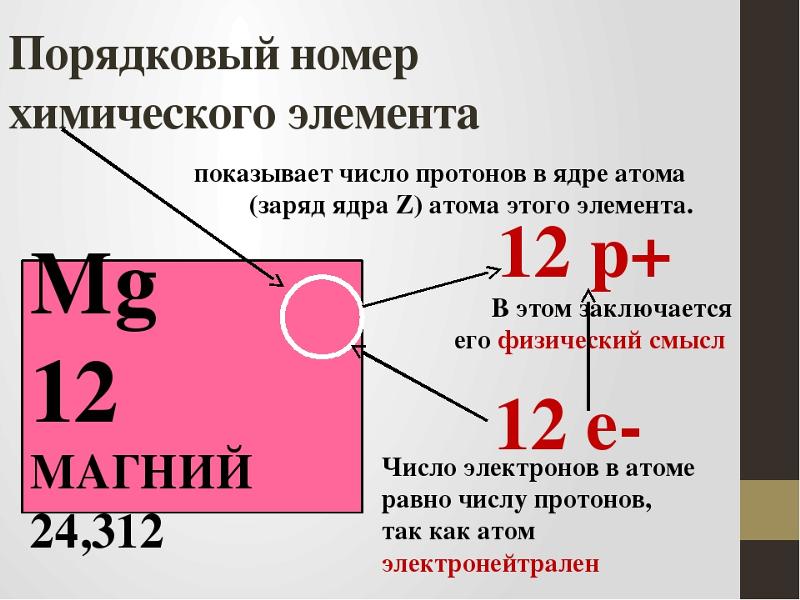

Leave A Comment