Полярность — молекула — вода
Cтраница 3
| Расположение атомов водорода и кислорода в молекуле.| Полярность молекулы воды. [31] |
На положение таких центров оказывают влияние в основном величина зарядов и равномерность их распределения. Именно полярностью молекул воды в основном можно объяснить способность ее растворять многие вещества. [32]
Благодаря этой полярности молекулы воды стремятся сблизиться; возникающие между ними притяжения называют водородными связями. [33]
Согласно этим представлениям на ионы диссоциируют молекулы с ионной и полярной химической связью. Диссоциация обусловлена полярностью молекул воды. В целом молекула воды не заряжена. [34]
Принцип действия микроволновой печи заключается в использовании воды, содержащейся в самой пище В печи магнетроном ( I) испускаются микроволны.
Силы связи этой воды с поверхностью обусловлены поверхностной энергией твердого тела и полярностью молекул воды. Эта вода не растворяет солей, не передает гидростатического давления, не замерзает и не движется. [36]
Такие воздействия вследствие теплового движения частиц не сохраняются постоянными во времени, но постоянно меняются по интенсивности и по знаку. Под действием внешнего электрического поля ( создаваемого, например, соседним ионом) полярность молекул воды может существенно изменяться, в частности возрастать. Происходит дополнительная поляризация молекул.
[37]
Происходит дополнительная поляризация молекул.
[37]
| Правиль — [ IMAGE ] Распределение электронов в. [38] |
По экспериментальным определе-нйям дйг1ол — ьный момент молекул воды равен 1.86 D, что доказывает их высокую полярность. Под действием внешнего электрического поля ( создаваемого, например, соседним ионом) указанная полярность молекул воды может существенно изменяться, в частности, возрастать. Происходит дополнительная поляризация молекул. [39]
Объяснение представленных данных основано на следующих моментах. Во-первых, скорость нуклеации / на ионах ( любого знака) в определенных условиях превосходит величину / в паровой смеси без ионов. Во-вторых, в силу полярности молекул воды, на поверхности капель-зародышей, вне зависимости от знака их заряда Qs, образуется двойной электрический слой с внешним поверхностным отрицательным зарядом.
| Строение молекулы воды.| Схема взаимодействия полярных молекул. [41] |
Кислород является очень сильным электроотрицательным элементом и поэтому электроны, принадлежащие атомам водорода, смещены в молекуле воды к атому кислорода. В результате атомы водорода приобретают положительный заряд, а атом кислорода — отрицательный. Такие молекулы, у которых в одной части сконцентрирован отрицательный заряд, а в другой — положительный, называются полярными. Однако полярность молекул воды не является основной причиной их ассоциации. [42]
[42]
Ввиду широкой распространенности воды в природе вопрос о ее воздействии на прочность твердых тел имеет большое практическое значение. Молекула воды состоит из ядра атома кислорода, двух протЬнов и десяти электронов. Две вершины тетраэдра ( в которых находятся протоны) несут положительный заряд, а двум другим вершинам можно приписать отрицательный заряд. Ковалентная связь О — Н весьма прочна, ее энергия равна 109 ккал / моль. 
Согласно современным представлениям, жидкая вода имеет постоянно изменяющуюся систему водородных связей между отдельными молекулами. Кислород — водородная связь очень полярна, и поэтому между отдельными молекулами спирта становится возможным образование водородной связи. Однако эта водородная связь не может образовываться в трех направлениях от одной молекулы, как это имеет место в молекуле воды ( фиг. Поэтому молекулы спирта связаны друг с другом не так прочно, как молекулы воды. И хотя молекулы спирта довольно полярны, их полярность меньше
Страницы: 1 2 3
Дистанционный репетитор — онлайн-репетиторы России и зарубежья
КАК ПРОХОДЯТ
ОНЛАЙН-ЗАНЯТИЯ?
Ученик и учитель видят и слышат
друг друга, совместно пишут на
виртуальной доске, не выходя из
дома!
КАК ВЫБРАТЬ репетитора
Выбрать репетитора самостоятельноИЛИ
Позвонить и Вам поможет специалист
8 (800) 333 58 91
* Звонок является бесплатным на территории РФ
** Время приема звонков с 10 до 22 по МСК
ПОДАТЬ ЗАЯВКУ
Россия +7Украина +380Австралия +61Белоруссия +375Великобритания +44Израиль +972Канада, США +1Китай +86Швейцария +41Выбранные репетиторы
Заполните форму, и мы быстро и бесплатно подберем Вам дистанционного репетитора по Вашим пожеланиям.
Менеджер свяжется с Вами в течение 15 минут и порекомендует специалиста.
Отправляя форму, Вы принимаете Условия использования и даёте Согласие на обработку персональных данных
Вы также можете воспользоваться
расширенной формой подачи заявки
Как оплачивать и СКОЛЬКО ЭТО СТОИТ
от
800 до 5000 ₽
за 60 мин.
и зависит
ОТ ОПЫТА и
квалификации
репетитора
ОТ ПОСТАВЛЕННЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
(например, подготовка к олимпиадам, ДВИ стоит дороже, чем подготовка к ЕГЭ)
ОТ ПРЕДМЕТА (например, услуги репетиторовиностранных языков дороже)
Оплата непосредственно репетитору, удобным для Вас способом
Почему я выбираю DisTTutor
БЫСТРЫЙ ПОДБОР
РЕПЕТИТОРА И
ИНДИВИДУАЛЬНЫЙ ПОДХОД
ОПТИМАЛЬНОЕ
СООТНОШЕНИЕ ЦЕНЫ И
КАЧЕСТВА
ПРОВЕРЕНЫ ДОКУМЕНТЫ ОБ ОБРАЗОВАНИИ У ВСЕХ РЕПЕТИТОРОВ
НАДЕЖНОСТЬ И ОПЫТ.
DisTTutor на рынке с 2008 года.
ПРОВЕДЕНИЕ БЕСПЛАТНОГО, ПРОБНОГО УРОКА
ЗАМЕНА РЕПЕТИТОРА, ЕСЛИ ЭТО НЕОБХОДИМО
376878 УЧЕНИКОВ ИЗ РАЗНЫХ СТРАН МИРА
И вот, что УЧЕНИКИ ГОВОРЯТ
о наших репетиторах
Чулпан Равилевна Насырова
«
Я очень довольна репетитором по химии. Очень хороший подход к ученику,внятно объясняет. У меня появились сдвиги, стала получать хорошие оценки по химии. Очень хороший преподаватель. Всем , кто хочет изучать химию, советую только её !!!
«
Алина Крякина
Надежда Васильевна Токарева
«
Мы занимались с Надеждой Васильевной по математике 5 класса. Занятия проходили в удобное для обоих сторон время. Если необходимо было дополнительно позаниматься во внеурочное время, Надежда Васильевна всегда шла навстречу. Ей можно было позванить, чтобы просто задать вопрос по непонятной задачке из домашнего задания. Моя дочь существенно подняла свой уровень знаний по математике и начала демонстрировать хорошие оценки.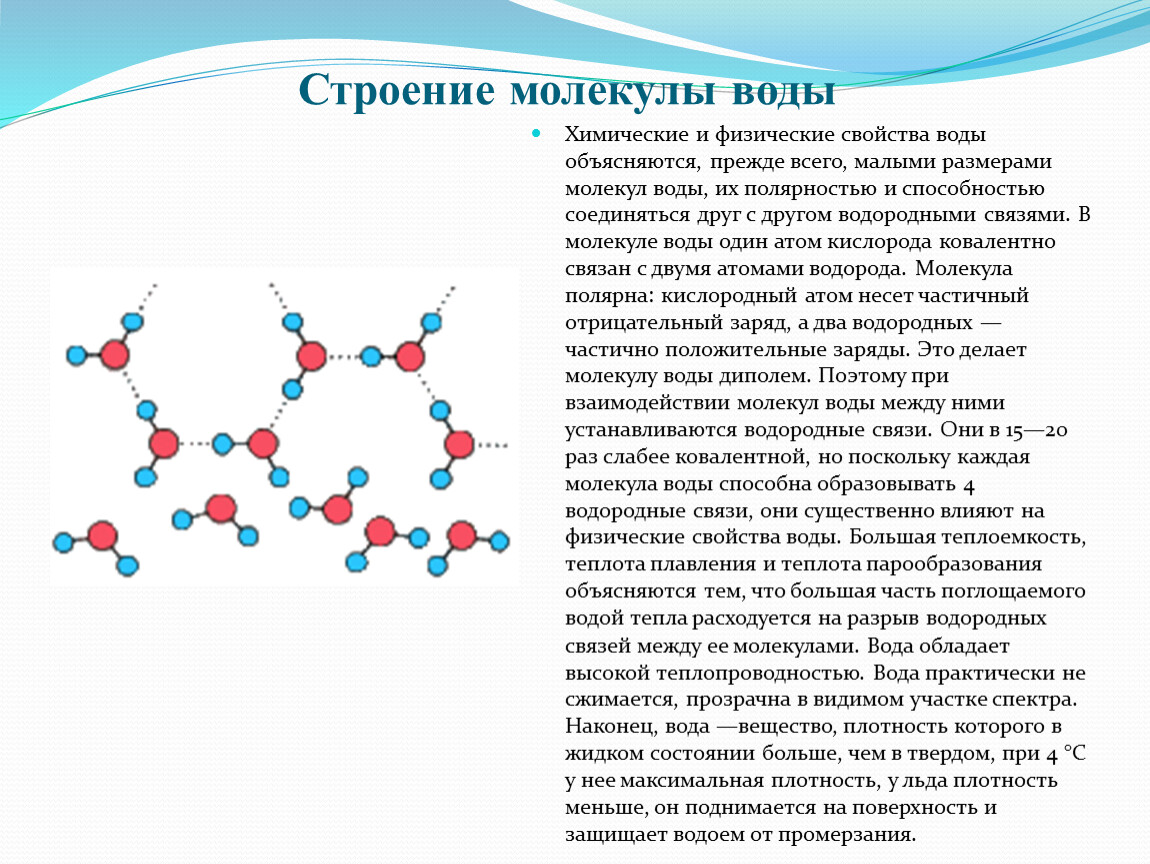
«
Эльмира Есеноманова
Ольга Александровна Мухаметзянова
«
Подготовку к ЕГЭ по русскому языку мой сын начал с 10 класса. Ольга Александровна грамотный педагог, пунктуальный, ответственный человек. Она всегда старается построить занятие так, чтобы оно прошло максимально плодотворно и интересно. Нас абсолютно все устраивает в работе педагога. Сотрудничество приносит отличные результаты, и мы его продолжаем. Спасибо.
«
Оксана Александровна
Наталья Борисовна Карасева
«
Мы восторге от репетитора. Наталья Борисовна грамотный педагог, она любит свою профессию, любит учеников. Занятия с сыном (2 класс), он находится на домашнем обучении, проходят по скайпу в комфортной обстановке. Репетитор умеет заинтересовать ребенка и выстраивает занятие с учетом его способностей, доступно объясняя предметы русский язык и математику. По результатам занятий можно сразу заметить повышение уровня успеваемости ученика. Наталья Борисовна хороший педагог, умеет быстро найти общий язык с ребенком, внимательная, легко передающая знания ученику. С большим удовольствием будем продолжать наши занятия, т.к. мы всем довольны.
По результатам занятий можно сразу заметить повышение уровня успеваемости ученика. Наталья Борисовна хороший педагог, умеет быстро найти общий язык с ребенком, внимательная, легко передающая знания ученику. С большим удовольствием будем продолжать наши занятия, т.к. мы всем довольны.
«
Елена Васильевна
Клиентам
- Репетиторы по математике
- Репетиторы по русскому языку
- Репетиторы по химии
- Репетиторы по биологии
- Репетиторы английского языка
- Репетиторы немецкого языка
Репетиторам
- Регистрация
- Публичная оферта
- Библиотека
- Бан-лист репетиторов
Партнеры
- ChemSchool
-
PREPY.
 RU
RU
- Class
2.2 Вода – Концепции биологии – 1-е канадское издание
Перейти к содержаниюГлава 2: Введение в химию жизни
К концу этого раздела вы сможете:
- Описывать свойства воды, которые имеют решающее значение для поддержания жизни
Посмотрите видео о том, зачем нам нужен кислород и как он создает проблемы для живых существ.
Вы когда-нибудь задумывались, почему ученые тратят время на поиски воды на других планетах? Это потому, что вода необходима для жизни; даже мельчайшие следы его на другой планете могут указывать на то, что жизнь могла существовать или существовала на этой планете. Вода — одна из наиболее распространенных молекул в живых клетках и наиболее важная для жизни, какой мы ее знаем. Примерно 60–70 процентов вашего тела состоит из воды. Без него жизни просто не было бы.
Атомы водорода и кислорода в молекулах воды образуют полярные ковалентные связи. Общие электроны проводят больше времени, связанного с атомом кислорода, чем с атомами водорода. У молекулы воды нет общего заряда, но есть небольшой положительный заряд на каждом атоме водорода и небольшой отрицательный заряд на атоме кислорода. Из-за этих зарядов слегка положительные атомы водорода отталкиваются друг от друга и образуют уникальную форму. Каждая молекула воды притягивает другие молекулы воды из-за положительных и отрицательных зарядов в разных частях молекулы. Вода также притягивает другие полярные молекулы (например, сахара), образуя водородные связи. Когда вещество легко образует водородные связи с водой, оно может растворяться в воде и называется гидрофильный («водолюбивый»). Водородные связи нелегко образуются с неполярными веществами, такими как масла и жиры. Эти неполярные соединения являются гидрофобными («водобоязненными») и не растворяются в воде.
Водородные связи в воде позволяют ей поглощать и выделять тепловую энергию медленнее, чем многие другие вещества. Температура является мерой движения (кинетической энергии) молекул. Чем больше движение, тем выше энергия и, следовательно, выше температура. Вода поглощает большое количество энергии, прежде чем ее температура повысится. Повышенная энергия разрушает водородные связи между молекулами воды. Поскольку эти связи могут создаваться и разрушаться быстро, вода поглощает увеличение энергии и изменения температуры лишь в минимальной степени. Это означает, что вода смягчает изменения температуры внутри организмов и в окружающей их среде. По мере поступления энергии баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Больше связей разрывается, чем образуется. Этот процесс приводит к высвобождению отдельных молекул воды на поверхность жидкости (такой как водоем, листья растения или кожа организма) в процессе, называемом 9.0019 испарение . Испарение пота, состоящего на 90 процентов из воды, позволяет охлаждать организм, так как разрыв водородных связей требует затрат энергии и отводит тепло от тела.
Этот процесс приводит к высвобождению отдельных молекул воды на поверхность жидкости (такой как водоем, листья растения или кожа организма) в процессе, называемом 9.0019 испарение . Испарение пота, состоящего на 90 процентов из воды, позволяет охлаждать организм, так как разрыв водородных связей требует затрат энергии и отводит тепло от тела.
Наоборот, по мере уменьшения молекулярного движения и снижения температуры выделяется меньше энергии для разрыва водородных связей между молекулами воды. Эти связи остаются неповрежденными и начинают формировать жесткую решетчатую структуру (например, лед) (рис. 2.8 a ). В замороженном виде лед менее плотный, чем жидкая вода (молекулы находятся дальше друг от друга). Это означает, что лед плавает на поверхности водоема (рис. 2.8 9).0019 б ). В озерах, прудах и океанах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения от замерзания в воде. Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах затруднительной или невозможной.
Поскольку вода полярна, имеет небольшие положительные и отрицательные заряды, ионные соединения и полярные молекулы могут легко растворяться в ней. Таким образом, вода — это то, что называют растворителем — веществом, способным растворять другое вещество. Заряженные частицы будут образовывать водородные связи с окружающим слоем молекул воды. Это называется сферой гидратации и служит для разделения или диспергирования частиц в воде. В случае поваренной соли (NaCl), смешанной с водой, ионы натрия и хлорида разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательно заряженными атомами кислорода в молекулах воды. Отрицательно заряженный ион хлора окружен частично положительными зарядами атомов водорода в молекулах воды. Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных ролях в живых системах.
Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных ролях в живых системах.
Вы когда-нибудь наполняли стакан водой до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем перелиться через край, вода на самом деле образует куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству сцепления и . При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Сплоченность дает начало поверхностное натяжение , способность вещества выдерживать разрыв при растяжении или напряжении. Когда вы бросаете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли воды, хотя объект плотнее (тяжелее), чем вода. Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Когезия и поверхностное натяжение удерживают молекулы воды неповрежденными, а предмет плавает на поверхности. Можно даже «поплавать» стальной иглой поверх стакана с водой, если поместить ее осторожно, не нарушая поверхностного натяжения.
Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Когезия и поверхностное натяжение удерживают молекулы воды неповрежденными, а предмет плавает на поверхности. Можно даже «поплавать» стальной иглой поверх стакана с водой, если поместить ее осторожно, не нарушая поверхностного натяжения.
Эти когезионные силы также связаны со свойством воды адгезии или притяжением между молекулами воды и другими молекулами. Это наблюдается, когда вода «поднимается» по соломинке, помещенной в стакан с водой. Вы заметите, что вода кажется выше по бокам соломинки, чем в середине. Это происходит потому, что молекулы воды притягиваются к соломинке и поэтому прилипают к ней.
Силы сцепления и сцепления важны для поддержания жизни. Например, из-за этих сил вода может течь от корней к верхушкам растений, чтобы питать растение.
Например, из-за этих сил вода может течь от корней к верхушкам растений, чтобы питать растение.
Концепция в действии
Чтобы узнать больше о воде, посетите Геологическую службу США «Наука о воде для школ: все о воде»! Веб-сайт.
pH раствора является мерой его кислотности или щелочности. Вы, вероятно, использовали лакмусовую бумагу , бумагу, обработанную натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH, чтобы проверить, сколько кислоты или основания (щелочность) существует в растворе. Возможно, вы даже использовали его, чтобы убедиться, что вода в открытом бассейне правильно очищена. В обоих случаях этот тест pH измеряет количество ионов водорода, присутствующих в данном растворе. Высокие концентрации ионов водорода приводят к низкому pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Общая концентрация ионов водорода обратно пропорциональна его рН и может быть измерена на Шкала pH (рисунок 2. 11). Следовательно, чем больше ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше рН.
11). Следовательно, чем больше ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше рН.
Шкала рН колеблется от 0 до 14. Изменение на одну единицу по шкале рН соответствует изменению концентрации ионов водорода в 10 раз, изменение на две единицы соответствует изменению концентрации ионов водорода в коэффициент 100. Таким образом, небольшие изменения pH представляют большие изменения концентрации ионов водорода. Чистая вода нейтральна. Он не является ни кислым, ни основным, и имеет рН 7,0. Все, что ниже 7,0 (в диапазоне от 0,0 до 6,9) является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Кровь в ваших венах слабощелочная (pH = 7,4). Среда в желудке очень кислая (pH = 1–2). Апельсиновый сок слабокислый (pH = примерно 3,5), тогда как пищевая сода имеет щелочную реакцию (pH = 9,0).
Рис. 2.11 Шкала pH измеряет количество ионов водорода (H+) в веществе. Кислоты представляют собой вещества, которые обеспечивают ионы водорода (H + ) и более низкий уровень pH, тогда как основания обеспечивают ионы гидроксида (OH – ) и повышают pH. Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота и лимонный сок очень кислые и легко отдают H + при добавлении к воде. И наоборот, основания — это те вещества, которые легко отдают OH — . Ионы OH – объединяются с H + с образованием воды, которая повышает pH вещества. Гидроксид натрия и многие бытовые чистящие средства очень щелочные и выделяют OH 9.0069 – быстро при помещении в воду, тем самым повышая рН.
Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота и лимонный сок очень кислые и легко отдают H + при добавлении к воде. И наоборот, основания — это те вещества, которые легко отдают OH — . Ионы OH – объединяются с H + с образованием воды, которая повышает pH вещества. Гидроксид натрия и многие бытовые чистящие средства очень щелочные и выделяют OH 9.0069 – быстро при помещении в воду, тем самым повышая рН.
Большинство клеток в нашем организме функционируют в очень узком интервале шкалы pH, обычно в диапазоне от 7,2 до 7,6. Если pH тела выходит за пределы этого диапазона, дыхательная система работает со сбоями, как и другие органы тела. Клетки больше не функционируют должным образом, а белки разрушаются. Отклонение за пределы диапазона pH может вызвать кому или даже смерть.
Так как же мы можем глотать или вдыхать кислотные или щелочные вещества и не умирать? Буферы — это ключ. Буферы легко поглощают излишки H + или OH – , тщательно поддерживая pH тела в вышеупомянутом узком диапазоне. Углекислый газ является частью важной буферной системы в организме человека; он поддерживает pH в нужном диапазоне. Эта буферная система включает анион угольной кислоты (H 2 CO 3 ) и бикарбоната (HCO 3 – ). Если в организм попадает слишком много H + , бикарбонат соединяется с H .+ для создания угольной кислоты и ограничения снижения pH. Точно так же, если в систему ввести слишком много ОН – , угольная кислота быстро диссоциирует на бикарбонат и ионы Н + . Ионы Н + могут соединяться с ионами ОН – , ограничивая увеличение рН. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, потому что угольная кислота высвобождается из организма в виде углекислого газа каждый раз, когда мы дышим.
Буферы легко поглощают излишки H + или OH – , тщательно поддерживая pH тела в вышеупомянутом узком диапазоне. Углекислый газ является частью важной буферной системы в организме человека; он поддерживает pH в нужном диапазоне. Эта буферная система включает анион угольной кислоты (H 2 CO 3 ) и бикарбоната (HCO 3 – ). Если в организм попадает слишком много H + , бикарбонат соединяется с H .+ для создания угольной кислоты и ограничения снижения pH. Точно так же, если в систему ввести слишком много ОН – , угольная кислота быстро диссоциирует на бикарбонат и ионы Н + . Ионы Н + могут соединяться с ионами ОН – , ограничивая увеличение рН. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, потому что угольная кислота высвобождается из организма в виде углекислого газа каждый раз, когда мы дышим. Без этой буферной системы рН в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Без этой буферной системы рН в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Вода обладает многими свойствами, которые имеют решающее значение для поддержания жизни. Он полярен, что позволяет образовывать водородные связи, которые позволяют ионам и другим полярным молекулам растворяться в воде. Таким образом, вода является отличным растворителем. Водородные связи между молекулами воды придают воде способность удерживать тепло лучше, чем многие другие вещества. По мере повышения температуры водородные связи между водой постоянно разрываются и восстанавливаются, что позволяет общей температуре оставаться стабильной, хотя в систему добавляется повышенная энергия. Силы сцепления воды учитывают свойство поверхностного натяжения. Все эти уникальные свойства воды важны в химии живых организмов.
рН раствора является мерой концентрации ионов водорода в растворе. Раствор с большим количеством ионов водорода является кислым и имеет низкое значение рН. Раствор с большим количеством гидроксид-ионов является основным и имеет высокое значение рН. Шкала рН колеблется от 0 до 14, при этом рН 7 является нейтральным. Буферы представляют собой растворы, которые смягчают изменения pH при добавлении в буферную систему кислоты или основания. Буферы важны в биологических системах из-за их способности поддерживать постоянный уровень рН.
Раствор с большим количеством гидроксид-ионов является основным и имеет высокое значение рН. Шкала рН колеблется от 0 до 14, при этом рН 7 является нейтральным. Буферы представляют собой растворы, которые смягчают изменения pH при добавлении в буферную систему кислоты или основания. Буферы важны в биологических системах из-за их способности поддерживать постоянный уровень рН.
кислота: вещество, которое отдает ионы водорода и поэтому снижает рН
адгезия: притяжение между молекулами воды и молекулами другого вещества
основание: вещество, которое поглощает ионы водорода и поэтому повышает рН
буфер: раствор, препятствующий изменению pH за счет поглощения или выделения ионов водорода или гидроксида
сцепление: межмолекулярные силы между молекулами воды, вызванные полярной природой воды; создает поверхностное натяжение
испарение: высвобождение молекул воды из жидкой воды с образованием водяного пара
гидрофильное: описывает вещество, которое растворяется в воде; водолюбивый
гидрофобный: описывает вещество, которое не растворяется в воде; боится воды
лакмусовая бумага: фильтровальная бумага, обработанная натуральным водорастворимым красителем для использования в качестве индикатора pH
шкала pH: шкала от 0 до 14, которая измеряет приблизительно концентрация ионов водорода вещества
растворитель: вещество, способное растворять другое вещество
поверхностное натяжение: сила сцепления на поверхности тела жидкости, которая предотвращает разделение молекул
температура: мера молекулярного движения
Ссылки
Humphrey, W. , Dalke, A. и Schulten, K., «VMD-Visual Molecular Dynamics», J. Molec. Графика , 1996, вып. 14, стр. 33-38. http://www.ks.uiuc.edu/Research/vmd/
, Dalke, A. и Schulten, K., «VMD-Visual Molecular Dynamics», J. Molec. Графика , 1996, вып. 14, стр. 33-38. http://www.ks.uiuc.edu/Research/vmd/
Атрибуция СМИ
- Рисунок 2.7 Гаутам Догра
- Рисунок 2.8
- ледяная решетка Джейн Уитни
- (б) Карлоса Понте
- Рисунок 2.10 Кори Занкера
- Рисунок 2.11 Эдварда Стивенса
License
Concepts of Biology — 1st Canadian Edition Чарльза Молнара и Джейн Гейр распространяется по лицензии Creative Commons Attribution 4.0 International License, если не указано иное.
Поделиться этой книгой
Поделиться в Твиттере
2.11: Вода – полярность воды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 12667
- Безграничный (теперь LumenLearning)
- Безграничный
Цели обучения
- Описать действия, происходящие из-за полярности воды
Одним из важных свойств воды является то, что она состоит из полярных молекул. Два атома водорода и один атом кислорода в молекулах воды (H 2 O) образуют полярные ковалентные связи. В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Заряды воды образуются из-за того, что кислород более электроотрицательный или любит электроны, чем водород. Таким образом, более вероятно, что общий электрон будет найден вблизи ядра кислорода, чем ядра водорода. Поскольку вода является нелинейной или изогнутой молекулой, разница в электроотрицательности между атомами кислорода и водорода создает частичный отрицательный заряд вблизи кислорода и частичные положительные заряды вблизи обоих атомов водорода.
Два атома водорода и один атом кислорода в молекулах воды (H 2 O) образуют полярные ковалентные связи. В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Заряды воды образуются из-за того, что кислород более электроотрицательный или любит электроны, чем водород. Таким образом, более вероятно, что общий электрон будет найден вблизи ядра кислорода, чем ядра водорода. Поскольку вода является нелинейной или изогнутой молекулой, разница в электроотрицательности между атомами кислорода и водорода создает частичный отрицательный заряд вблизи кислорода и частичные положительные заряды вблизи обоих атомов водорода.

В результате полярности воды каждая молекула воды притягивает другие молекулы воды из-за противоположных зарядов между ними, образуя водородные связи. Вода также притягивает или притягивается к другим полярным молекулам и ионам, включая многие биомолекулы, такие как сахара, нуклеиновые кислоты и некоторые аминокислоты. Полярное вещество, которое легко взаимодействует с водой или растворяется в ней, называется гидрофильным (гидро- = «вода»; -фильный = «любящий»). Напротив, неполярные молекулы, такие как масла и жиры, плохо взаимодействуют с водой, как показано на рис. . Эти неполярные соединения называются гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
Интерактивный элемент
Водородные связи : Этот интерактивный элемент показывает взаимодействие водородных связей между молекулами воды.
Ключевые моменты
- Разница в электроотрицательности между атомами кислорода и водорода создает на атомах частичные отрицательный и положительный заряд соответственно.


 RU
RU

Leave A Comment