Пропилен, химические свойства, получение, применение, C3H6, Ch3=CH-Ch4
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
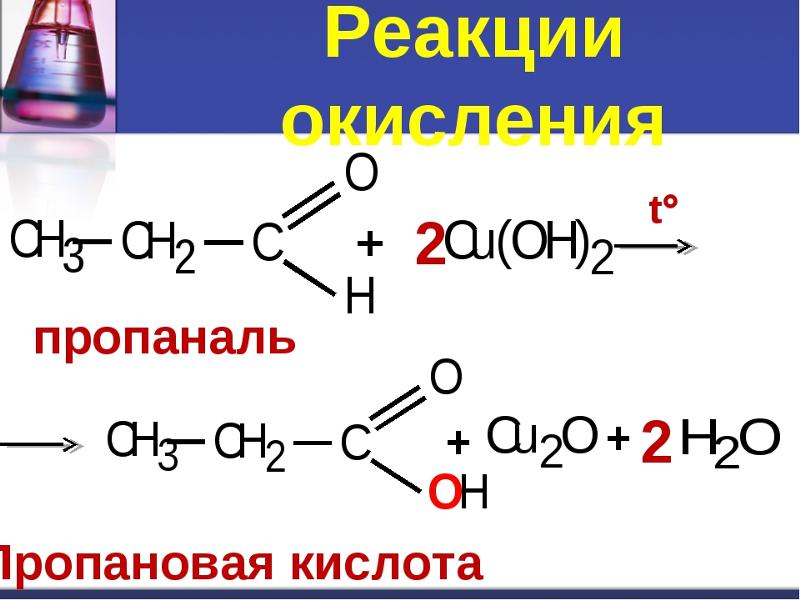
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Получение органических веществ
Основные способы получения органических веществ: углеводородов и кислородсодержащих производных(в лаборатории)
1. Непредельное соединение может образоваться при взаимодействии этанола с
1) натрием
2) водным раствором гидроксида натрия
3) бромоводородом
4) конц. серной кислотой
2. Толуол в одну стадию нельзя получить из
1) бензола
2) гептана
3) фенола
4) метилциклогексана
3. В схеме
ацетилен → А → поливинилхлорид
веществом А является
1) хлорметан
2) хлорэтан
3) хлорэтен
4) хлороформ
4. В схеме бромэтан → А→ 2-метилпропан
веществом А является
1) пропан
2) этан
3) бутан
4) 2,2-диметилпропан
5. В схеме н-гептан → А→ метилциклогексан
веществом А является
1) толуол
2) циклогексан
3) 1,2-диметилциклопентан
4) циклогептан
6. При действии спиртового раствора щелочи на 1-хлорбутан преимущественно образуется
При действии спиртового раствора щелочи на 1-хлорбутан преимущественно образуется
1) бутен-1 3) циклобутан
2) бутен-2 4) метилциклопропан
7. В схеме превращений веществом Х является
СН3СООН → Х → С2Н6
1) метан
2) ацетат натрия
3) этанол
4) этаналь
8 Метан не может быть получен в результате реакции
1) СН3COONa(тв.) + NaOH(тв.)
2) СаС2(тв.) + Н2О(ж) ®
3) С(тв) + Н2(г)
4) Li4C(тв) + Н2О(ж) ®
9. Количество органических соединений среди продуктов реакции хлорэтана и хлорметана с избытком металлического натрия равно
1) одному 2) двум 3) трём 4) четырём
10. Способ получения этилена, удобный в лабораторных условиях
1) СН3-СН2Сl + KOH(спирт. ) ® СН2=СН2 + KCl + H2O
) ® СН2=СН2 + KCl + H2O
2) СН3-СН3СН2=СН2 + Н2
3) СН3-СН2-СН3 СН2=СН2 + СН4
4) выделение из коксового газа
11. Наиболее удобным лабораторным способом получения пропилена
1) дегидрирование пропана
2) крекинг гексана
3) гидрирование пропина
4) дегидратация пропанола-2
12. Реакция дегидратации спиртов является обратимой реакцией
СН3-СН2-ОН СН2=СН2 + Н2О – Q.
Для повышения выхода этилена необходимо
1) повысить давление 3) добавить монооксид меди
2) добавить соляную кислоту 4) повысить температуру
13. Основной продукт реакции
1) бутен-1 3) бутанол-2
2) бутен-2 4) бутандиол-2,3
14.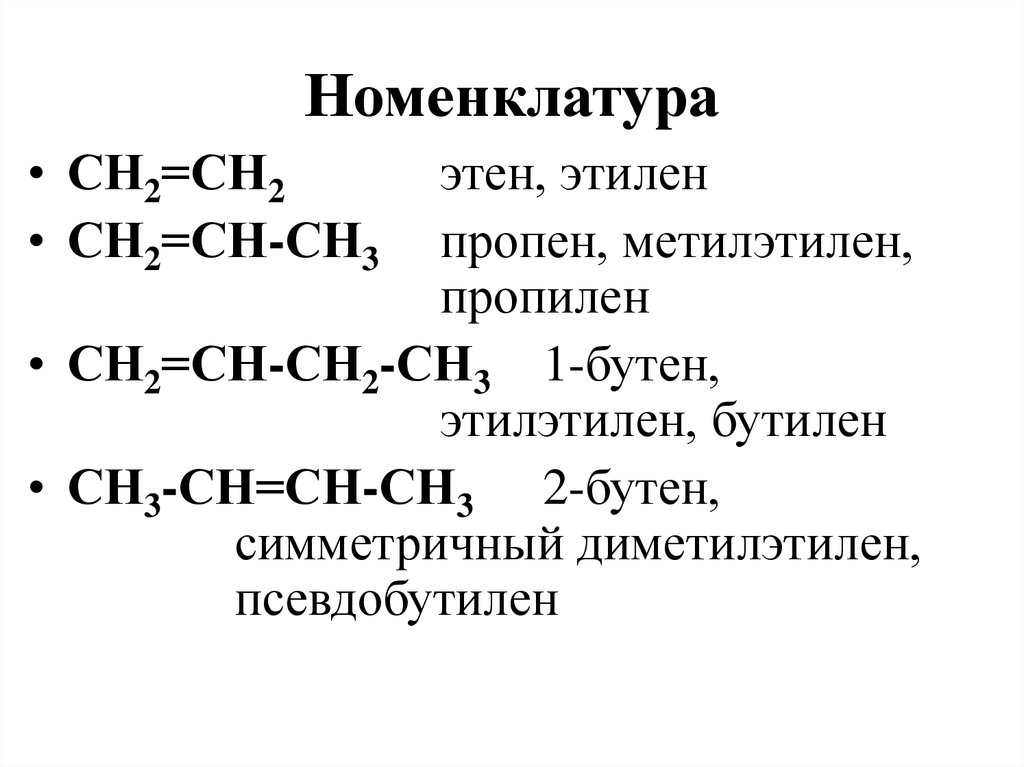 Основной продукт реакции
Основной продукт реакции
СН2Сl-CН2-СН(СН3)2 + KOH
является
1) 3-метилбутанол-1 3) 2-метилбутен-2
2) 3-метилбутен-1 4)
15. Реагент, необходимый для проведения следующей реакции
1) HBr 2) CH3COOH 3) HI 4) H2SO4
16. Формула вещества, из которого нельзя получить алкин действием спиртового раствора гидроксида калия 1) 3) Br2CH-CH3
2) СН2Сl-CHCl-CH(CH3)-CH3 4) CH2Cl-(CH2)2-CH2Cl
17. Бензол можно получить тримеризацией
1) этилена 3) этина
2) этана 4) циклопропана
18. От молекулы соответствующего алкана в результате реакции дегидроциклизации при получении толуола отщепится
От молекулы соответствующего алкана в результате реакции дегидроциклизации при получении толуола отщепится
1) 4 атома водорода 3) 8 атомов водорода
2) 6 атомов водорода 4) 2 атома водорода
19. При повышении давления равновесие реакции
сместится
1) в сторону образования этилциклогексана
2) в сторону образования этилбензола и водорода
3) смещения равновесия не произойдет
4) это необратимая реакция
20. Для получения 2,3-диметилбутана по реакции Вюрца, в качестве реагента необходим
1) 1-хлорбутан
2) 2-хлорбутан
3) 1-хлопропан
4) 2-хлорпропан
21. Конечным продуктом взаимодействия фенола с бромной водой
1) 2-бромфенол
2) 2,4-дибромфенол
3) 2,6-дибромфенол
4) 2,4,6-трибромфенол
22. Для получения уксусной кислоты в одну стадию используют
1) гидролиз карбида кальция
2) гидратацию этилена
3) окисление формальдегида
4) окисление ацетальдегида
23. Каталитической гидратацией алкинов получают
Каталитической гидратацией алкинов получают
1) многоатомные спирты .
2) фенолы
3) альдегиды и кетоны
4) предельные одноатомные спирты
24. Дана схема превращений
метан —> Х1 —> Х2
Веществами Х1 и Х2 могут быть соответственно
1) метанол и этановая кислота
2) этан и пропан
3) ацетилен и уксусный альдегид
4) этилен и этиленгликоль
25. Дана схема превращений
С2Н2 —> X1 —> Х2 —> Х 3
Веществами Х1, Х2 и Х3 могут быть соответственно
1) бензол, фенол, толуол
2) уксусный альдегид, уксусная кислота, хлоруксусная кислота
3) этанол, уксусный альдегид, этилацетат
4) этилбензол, стирол, полистирол
26. Схеме превращений
Х1 (окисление) —> Х2 —> Х3
может соответствовать ряд веществ
1) этиловый эфир уксусной кислоты, этанол, этилен
2) пропионовый альдегид, пропионовая кислота, пропионат кальц)
3) крахмал, глюкоза, этанол
4) сахароза, глюкоза, молочная кислота
27. Схеме превращений:
Схеме превращений:
Х1 присоединение —> Х2 —> Х3
может соответствовать ряд веществ
1) этанол, бромэтан, бутан
2) ацетилен, этан, бромэтан
3) этан, хлорэтан, этанол
4) бензол, нитробензол, анилин
28 . Схеме превращений
Х1 замещение —> Х2 замещение —> Х3
может соответствовать ряд веществ
1) метан, ацетилен, бензол
2) этан, хлорэтан, этанол
3) бутан, бутадиен-1,3, бутадиеновый каучук
4) этан, этилен, полиэтилен
29. Схеме превращений
Х1 окисление —> Х2 окисление —> Х3
может соответствовать ряд веществ
1) этанол, уксусная кислота, ацетат свинца
2) хлорметан, этан, углекислый газ
3) пропанол-1, пропионовый альдегид, пропионовая кислота
4) ацетилен, бензол, хлорбензол
30.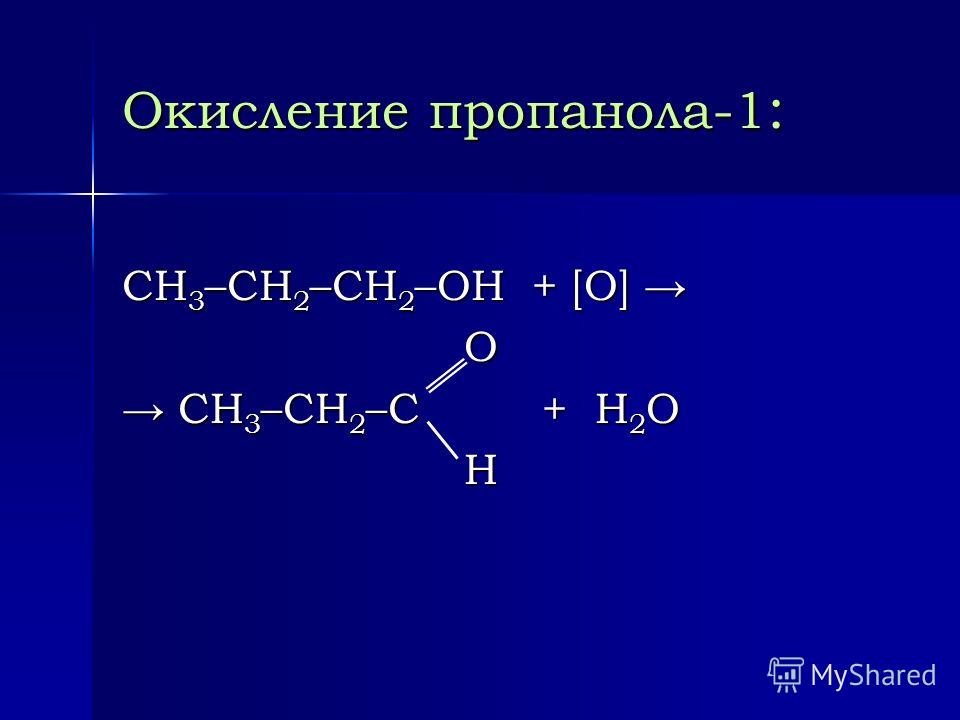 Схеме превращений
Схеме превращений
Х1 +Н2О(Н+) —> Х2
Х2+ HBr —> Х3
может соответствовать ряд веществ
1) пропен, пропанол-1, 1-бромпропан
2) пропен, пропанол-1, 2-бромпропан
3) пропен, пропанол-2, 2-бромпропан
4) пропин, пропандиол-1,2, 1,2-дибромпропан
31. Схеме превращений
Х1 FeCl 3 —> Х2 —> Х3
может соответствовать ряд веществ
1) фенол, 2,4,6-трихлорфенол, фенолят натрия
2) ацетилен, хлорвинил, поливинйлхлорид
3) бензол, хлорбензол, фенолят натрия
4) пропионовая кислота, 2-хлорпропановая кислота, молочная кислота
32. Возможна реакция между
1) этанолом и медью
2) уксусной кислотой и водородом
3) фенолом и бромной водой
4) ацетальдегидом и гидроксидом натрия
33.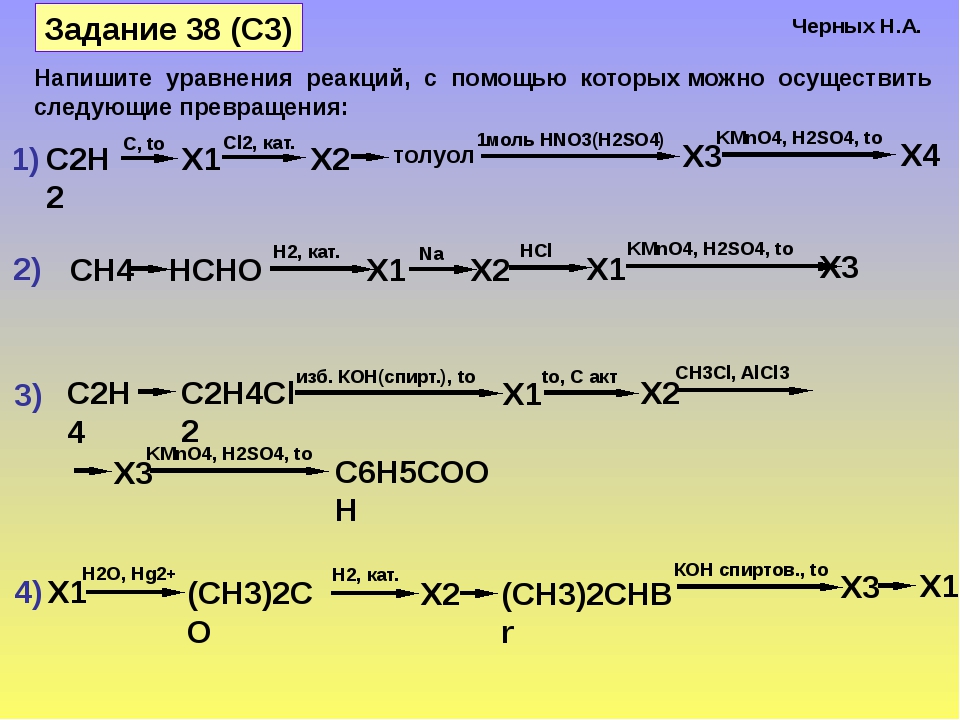 В лаборатории уксусную кислоту получают
В лаборатории уксусную кислоту получают
1) действием серной кислоты на ацетат натрия
2) восстановлением этанола
3) гидратацией уксусного альдегида
4) окислением этилена
34. В цепи превращений
CH3-CH=O Cu(OH)2 —> X1 Ch4OH —> X2
веществами X1 и X2 соответственно являются
1) этанол и метилэтиловый эфир
2) этилен и пропанол-1
3) уксусная кислота и метилацетат
4) уксусная кислота и пропановая кислота
35. Продуктом окисления ацетальдегида является
1) ацетилен
2) уксусная кислота
3) этанол
4) ацетон
36. Возможна реакция между
1) уксусной кислотой и хлоридом натрия
2) метанолом и водородом
3) этиленгликолем и сульфатом меди(II)
4) этаналем и гидроксидом меди (II)
37. Бромную воду обесцвечивает
1) фенол
2) уксуная кислота
3) этилацетат
4) бензол
38. С аммиачным раствором оксида серебра не взаимодействует
С аммиачным раствором оксида серебра не взаимодействует
1) этаналь
2) муравьиная кислота
3) глюкоза
4) этанол
39. Пропаналь можно получить
1) гидрированием пропановой кислоты
2) окислением пропанола-1
3) гидратацией пропина
4) гидролизом метилпропионата
40. Пропанол можно получить из пропена в результате реакции
1) гидратации
2) гидрирования
3) галогенирования
4) гидрогалогенирования
41. Сложный эфир образуется при взаимодействии глицина с
1) NaOH 3) НВг
2) С2Н5ОН 4) H2SО4
42. Между собой могут взаимодействовать
1) уксусная кислота и карбонат натрия
2) глицерин и сульфат меди(П)
3) фенол и гидроксид меди(И)
4) метанол и углекислый газ
43. Бутанол-2 и хлорид калия образуются при взаимодействии
1) 1-хлорбутана и водного раствора КОН
2) 2-хлорбутана и спиртового раствора КОН
3) 1-хлорбутана и спиртового раствора КОН
4) 2-хлорбутана и водного раствора КОН
44. 3,3-диметилбутаналь образуется при окислении
3,3-диметилбутаналь образуется при окислении
1) (СН3)3С-СН2-СН2ОН
2) СН3СН2С(СН3)2-СН2ОН
3) СН3СН(СН3)СН(СН3)-СН2ОН
4) CH3-CH2-CH(CH3)-CH2OH
45. Пропанол-2 образуется в результате взаимодействия
1) пропаналя с водой
2) 2-хлорпропана с гидроксидом меди (II)
3) 1-хлорпропана с гидроксидом меди (II)
4) пропилена с водой
46. Пропанол-1 образуется при взаимодействии
1) пропановой кислоты и воды
2) пропина и водорода
3) пропаналя и водорода
4) пропана и воды
47. Этиловый спирт образуется при восстановлении водородом
1) этана
2) уксусного альдегида
3) этилена
4) уксусной кислоты
48. Этанол можно получить из этилена в результате реакции
1) гидратации
2) гидрирования
3) галогенирования
4) гидрогалогенирования
49. При действии водного раствора щелочи на монобромалканы преимущественно образуются
При действии водного раствора щелочи на монобромалканы преимущественно образуются
1) алканы
2) алкены
3) спирты
4) альдегиды
50. Гидратацией алкинов по Кучерову можно получить
1) пропионовый альдегид
2) муравьиный альдегид
3) уксусный альдегид
4) масляный альдегид
51. Наиболее характерными продуктами для реакции
н-гексан являются
1) С4Н10 и С2Н6
2) С3Н8 и С3Н6
3) С3Н8
4) смесь изомеров гексана
52. Наиболее вероятными продуктами для реакции
являются
1) смесь изомеров по положению двойной связи
2) алканы – изомеры по углеродной цепи
3) карбоциклические углеводороды – арены
4) алканы и алкены с более короткими углеродными цепями, чем исходное вещество
53. Продуктом (продуктами) реакции этилена с бромной водой являются
1) СН2=СН-Br + HBr 3) CH3-CHBr2
2) BrCH2-CH2Br
54. Конечный продукт в цепочке превращений (Х3)
Конечный продукт в цепочке превращений (Х3)
:CH4 X1 X2 X3
1) нитрометан
2) хлорид метиламмония
3) хлорид фениламмония
4) хлороформ
55. Из 1,1-дибромбутана можно в одну стадию можно получить непредельный углеводород
1) бутин-1 3) бутадиен-1,3
2) пентин-1 4) бутин-2
56. В цепочке превращений
Al4C3X1X2X3
конечный продукт X3—это
1) этилат натрия 3) метилат натрия
2) этан 4) метан
57. Для получения изобутана сплавлением со щелочью нельзя использовать соль, формула которой
58. Для получения пропена дегидратацией пропанола
СН3-СН2-СН2-ОН СН3-СН=СН2 + Н2О
в реакционную смесь необходимо добавить
1) H2SO4 (конц.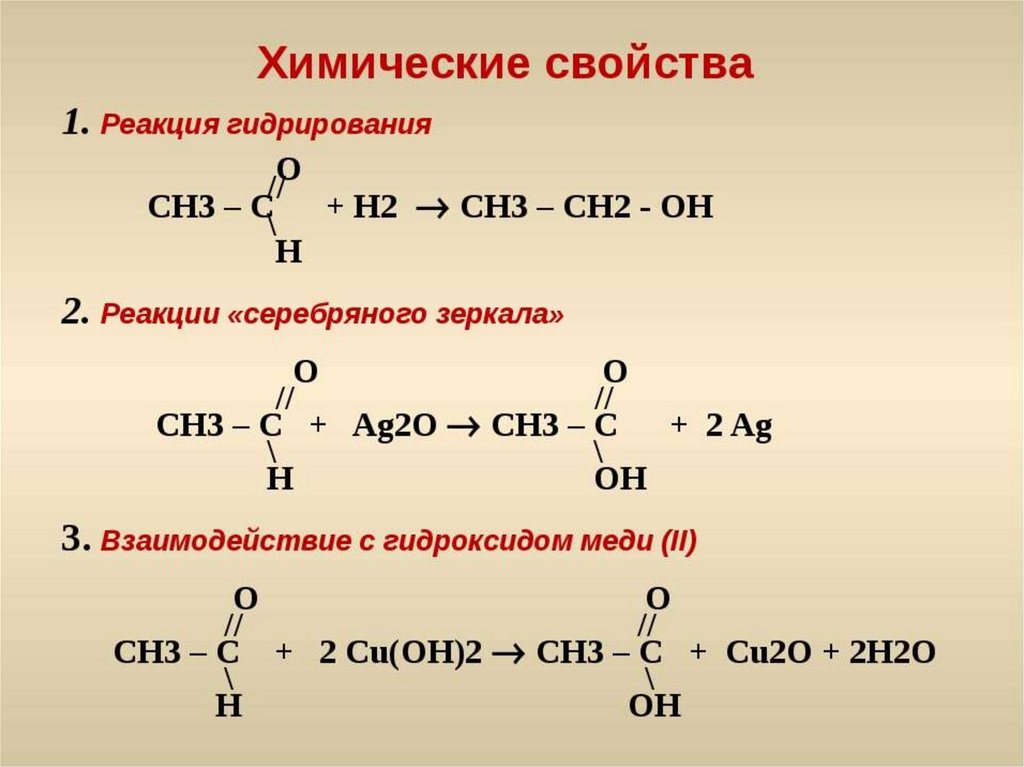 )
)
2) H2SO4 (раствор)
3) Н2О
4) Pt
59. Основным продуктом реакции хлорэтана с избытком водного раствора гидроксида калия является
1) этилен
2) этан
3) этиловый спирт
4) этилат калия
Ответы: 1-4, 2-3, 3-3, 4-3, 5-1, 6-1, 7-2, 8-2, 9-3, 10-1, 11-4, 12-4, 13-2, 14-2, 15-4, 16-4, 17-3, 18-3, 19-1, 20-4, 21-4. 22-4, 23-3, 24-3, 25-2, 26-2, 27-2, 28-2, 29-3, 30-3, 31-3, 32-3, 33-1, 34-3, 35-2, 36-4, 37-1, 38-4, 39-1, 40-1, 41-2, 42-1, 43-4, 44-1, 45-4, 46-3, 47-2, 48-1, 49-3, 50-3, 51-4, 52-1, 53-2, 54-2, 55-1, 56-2, 57-3, 58-1, 59-3.
Как вы конвертируете: (i) пропен в пропан-1-ол (ii) этаналь в пропан-2-ол
Дата последнего обновления: 20 апреля 2023 г. Просмотров сегодня: 3,84 тыс.
Ответить
Проверено
214,4 тыс.+ просмотров
Подсказка: — (i) При превращении пропилена в пропан-1-ол происходит реакция окисления.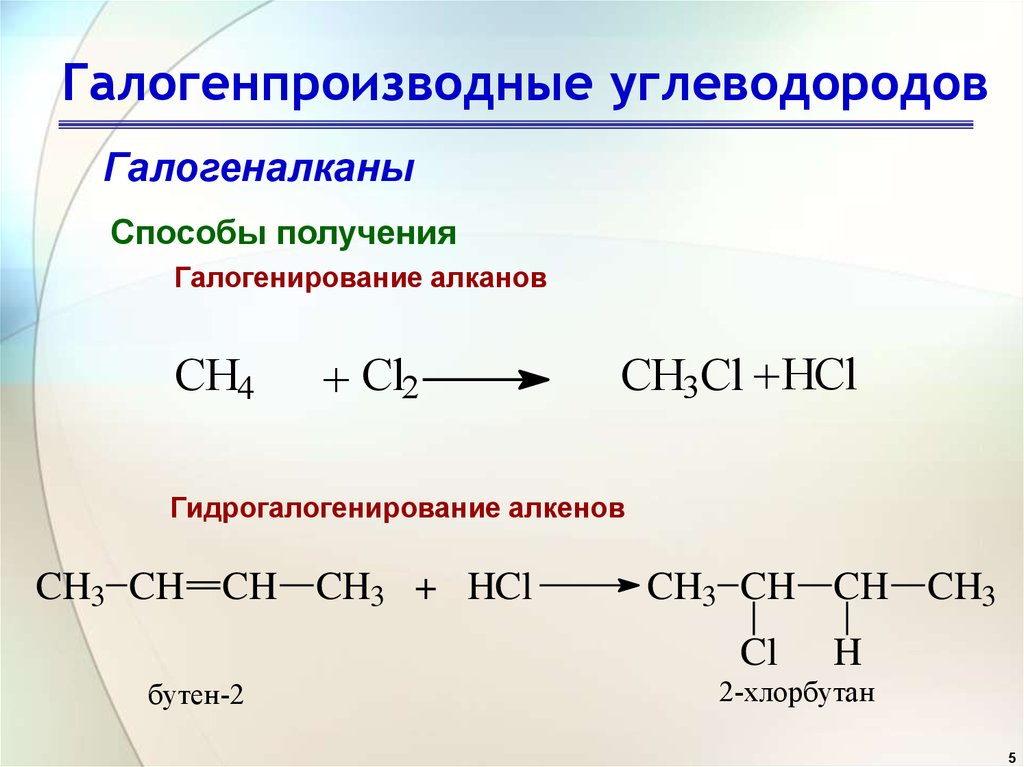 Реакция окисления – это реакция, при которой к соединению присоединяется кислород. Для превращения пропена в пропан-1-ол воспользуемся методом реакции пропена с перекисью.
Реакция окисления – это реакция, при которой к соединению присоединяется кислород. Для превращения пропена в пропан-1-ол воспользуемся методом реакции пропена с перекисью.
Полный пошаговый ответ:
Реакция алкена с галогеноводородом в присутствии пероксида приводит к присоединению Анти-Марковникова. Добавление Анти-Марковникова гласит, что в реакции алкена с галогеноводородом водород присоединяется к атому углерода двойной связи, который связан с наименьшим числом атомов водорода, а атом галогенида присоединяется к другому атому углерода двойной связи.
Полученный алкилгалогенид реагирует с КОН с последующим нагреванием с образованием пропан-1-ола.
Примечание:
Другим методом получения пропан-1-ола из пропилена является реакция окисления гидроборированием. В этой реакции реакция диборана $\left( {{\rm{B}}{{\rm{H}}_{\rm{3}}}} \right)$ с пропеном дает триалкилбораны (продукт присоединения) .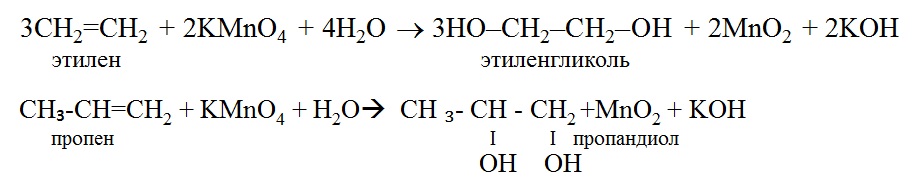 Затем происходит окисление триалкилборанов до спирта ${{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}$(пероксид) при наличии основания $\left( {{\rm{NaOH}}} \right)$.
Затем происходит окисление триалкилборанов до спирта ${{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}$(пероксид) при наличии основания $\left( {{\rm{NaOH}}} \right)$.
(ii)
Подсказка:
При превращении этаналя в пропан-2-ол число атомов углерода увеличивается на один. Итак, мы будем использовать реактив Гриньяра, чтобы материнская цепь могла быть увеличена на один атом углерода.
Полный пошаговый ответ:
Реакция реактива Гриньяра с карбонильными соединениями дает спирт. Нам нужно на один атом углерода больше, чем в исходном реагенте. Итак, мы должны использовать ${\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{MgI}}$ в качестве реактива Гриньяра.
Стадия 1: Нуклеофильная атака реактива Гриньяра на карбонильную группу приводит к образованию аддукта.
Стадия 2: Гидролиз аддукта дает спирт.
Примечание: Можно запутаться, принимая реактив Гриньяра для превращения этаналя в пропан-2-ол.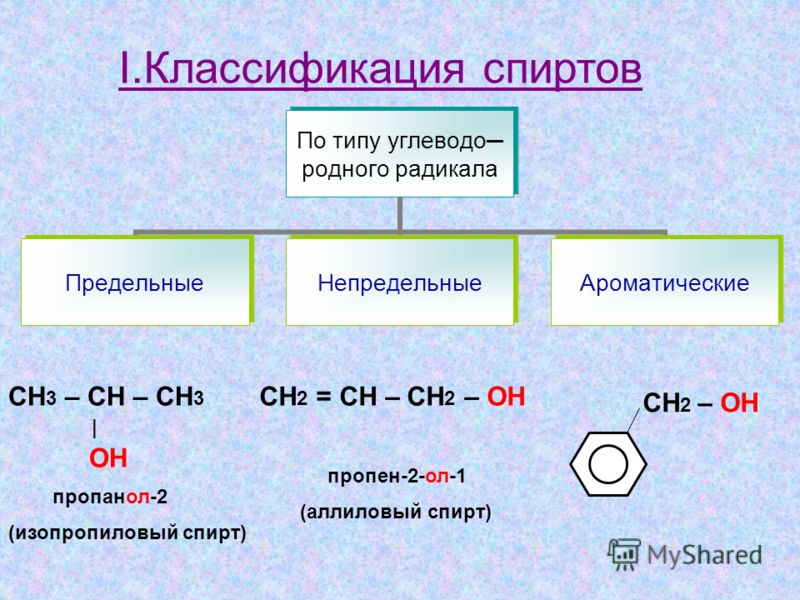 Вы должны наблюдать количество атомов углерода в реагенте и продукте. В данном вопросе в продукте присутствует на один атом углерода больше, чем в реагенте. Итак, реактив Гриньяра имеет только один атом углерода.
Вы должны наблюдать количество атомов углерода в реагенте и продукте. В данном вопросе в продукте присутствует на один атом углерода больше, чем в реагенте. Итак, реактив Гриньяра имеет только один атом углерода.
Недавно обновленные страницы
Рассчитать изменение энтропии, связанное с конверсией класса 11 химии JEE_Main
Закон, сформулированный доктором Нернстом, является первым законом термодинамики класса 11 химии JEE_Main
Для реакции при rm0rm0rmC и нормальном давлении класса A 11 химия JEE_Main
Двигатель, работающий между rm15rm0rm0rmC и rm2rm5rm0rmC класс 11 химия JEE_Main
Для реакции rm2Clg в rmCrmlrm2rmg признаки 11 класса химии JEE_Main
Изменение энтальпии перехода жидкой воды в химический класс 11 JEE_Main
Рассчитайте изменение энтропии при переходе в химический класс 11 JEE_Main
Закон, сформулированный доктором Нернстом, представляет собой Первый закон термодинамики 11-го класса химии JEE_Main
Для реакция при rm0rm0rmC и нормальном давлении А химический класс 11 JEE_Main
Двигатель, работающий между rm15rm0rm0rmC и rm2rm5rm0rmC химический класс 11 JEE_Main
0003
Изменение энтальпии перехода жидкой воды 11 класс химии JEE_Main
Актуальные сомнения
Студенты также читают

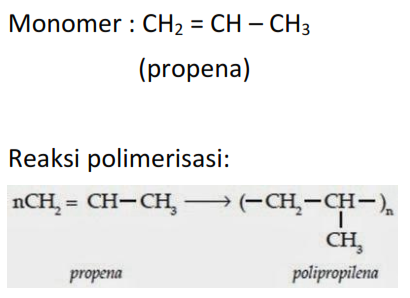
 Если хотите, вы можете написать, например, «конц H 2 SO 4 » поверх стрелки.
Если хотите, вы можете написать, например, «конц H 2 SO 4 » поверх стрелки.

Leave A Comment