Амины — формула, способы получения, номенклатура
Поможем понять и полюбить химию
Начать учитьсяАмины и их особенности — одна из самых интересных тем в школьном курсе химии за 10‑й класс. И если раньше вам было трудно ее понять, то сегодня мы это исправим. В этом статье мы расскажем, что такое амины и на какие виды они делятся, научим правильно называть их и разберем свойства этих веществ. Без примеров тоже не обойдется — к концу статьи вы узнаете, с чем амины могут вступать в реакцию и какими методами их можно получить.
Что такое амины
Аминами называют органические производные аммиака (Nh4), в молекулах которых один, два или все три атома водорода замещены на углеводородные радикалы.
Примем во внимание, что амины — производные аммиака, значит, они должны либо быть очень схожи по строению, либо повторять его полностью. Ниже на картинке можно рассмотреть строение аммиака и первичного амина:
Обратим внимание на то, что в строении обеих молекул есть азот с неподеленной электронной парой, из-за чего амины обладают осно́вными свойствами. Теперь обратимся к пространственной формуле аммиака и представителя первичных аминов — метиламина.
Теперь обратимся к пространственной формуле аммиака и представителя первичных аминов — метиламина.
На основе пространственной формулы можно сделать вывод, что обе эти молекулы имеют форму тетраэдра, что подтверждает нам sp3-гибридизацию атома азота.
Узнай, какие профессии будущего тебе подойдут
Пройди тест — и мы покажем, кем ты можешь стать, а ещё пришлём подробный гайд, как реализовать себя уже сейчас
Классификация аминов
Амины разделяют по двум основным категориям:
число углеводородных групп у атома азота;
природа углеводородных заместителей.
Рассмотрим каждую более подробно.
По числу углеводородных групп
По числу углеводородных групп, которые заместили водород в молекуле аммиака, амины делятся на первичные, вторичные и третичные. Тут возникает аналогия с классификацией одноатомных спиртов. Она четко дает понять, что в других классах органических веществ такая классификация означает положение функциональной группы у атомов углерода. Но в случае аминов все иначе. Если на какой-либо радикал замещен один водород, то это первичный амин. При замещении двух водородов амин становится
Тут возникает аналогия с классификацией одноатомных спиртов. Она четко дает понять, что в других классах органических веществ такая классификация означает положение функциональной группы у атомов углерода. Но в случае аминов все иначе. Если на какой-либо радикал замещен один водород, то это первичный амин. При замещении двух водородов амин становится
Сравним две молекулы:
Единственное, чем они отличаются, это наличие разных функциональных групп: у молекулы слева имеется гидроксогруппа, а у молекулы справа — аминогруппа. Спирт будет третичным, так как функциональная группа находится у третичного атома углерода. В то же время амин будет первичным, так как у него замещен один атом водорода на довольно разветвленный углеводородный радикал.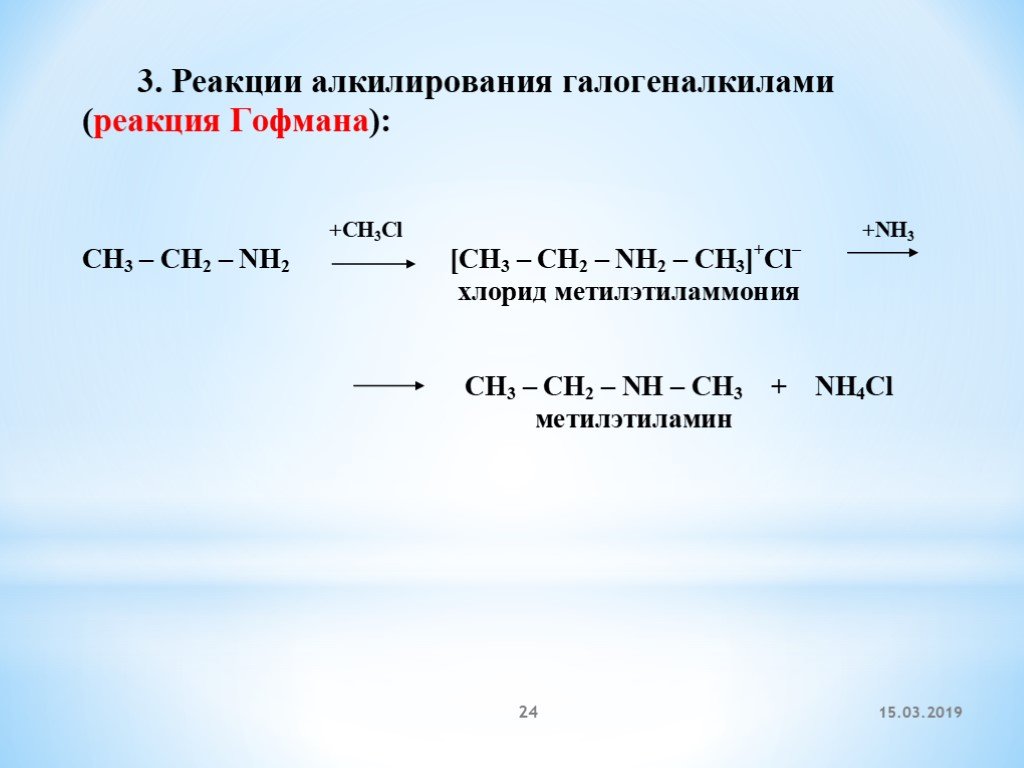
По природе углеводородных заместителей
По природе углеводородных заместителей амины бывают алифатическими, ароматическими, смешанными, алициклическими и гетероциклическими. В последних двух пока что будет сложно разобраться. Давайте пропустим их и рассмотрим в другой раз.
Теперь разберемся, чем первые три отличаются друг от друга. У алифатических аминов в составе есть заместитель, атомы углерода которого соединены между собой в прямые или разветвленные цепи. Ароматический амин содержит ароматическую систему связей. Смешанный амин представляет собой комбинацию из нескольких видов углеводородных заместителей.
Природа углеводородных заместителей | Структурная формула | Название |
|---|---|---|
Алифатические | Этиламин | |
Ароматические | Анилин | |
Смешанные | N, N-диметиланилин |
Ниже в таблице мы собрали все, что можем сказать о классификации аминов.
Амины | Первичные | Вторичные | Третичные |
|---|---|---|---|
Алифатические (жиры) | CH3 Метиламин | (CH3)2NH Диметиламин | (CH3)3N Триметиламин |
Ароматические | C6H5NH2 Фениламин (анилин) | (C6H5)2NH Дифениламин | (C6H5)3N Трифениламин |
— | C6H5–NH–CH3 Метилфениламин | C6H5–N(CH3)2 Диметилфениламин |
Номенклатура аминов
Различать амины мы уже умеем, но называть — еще нет. Давайте это исправим! Так как видов аминов несколько, то и называют их по-разному.
Давайте это исправим! Так как видов аминов несколько, то и называют их по-разному.
Номенклатура первичных аминов
Укажите название углеводородного радикала, исходя из его количества углерода в цепи.
Добавьте к вышеназванному корню суффикс, который укажет на наличие или отсутствие кратных связей.
Обозначьте наличие аминогруппы, добавив к уже имеющемуся названию корень «амин».
После указанного названия поставьте дефис и укажите порядковый атом углерода, который связан с аминогруппой.
Как следовать всем этим пунктам, мы показали на рисунке ниже.
Но первичные амины можно назвать проще с помощью радикально-функциональной номенклатуры. Здесь за основу берут аминогруппу, а углеводородные радикалы являются заместителями: название радикала + «амин». Бутанамин-2 по радикально-функциональной номенклатуре будет называться бутиламином.
Здесь за основу берут аминогруппу, а углеводородные радикалы являются заместителями: название радикала + «амин». Бутанамин-2 по радикально-функциональной номенклатуре будет называться бутиламином.
Номенклатура вторичных и третичных аминов
Эта номенклатура отличается только в радикально-функциональной номенклатуре. В основе лежит атом азота, углеводородные заместители указываются как радикалы в алфавитном порядке, либо с греческой приставкой при условии, что заместители одинаковы. Прилагаем пример на картинке ниже.
Важно
Для ароматических аминов используют тривиальные названия. Например, анилин.
Изомерия аминов
Для аминов характерна:
- изомерия углеродного скелета;
- изомерия положения функциональной группы;
- изомерия между типами аминов.

Важно
Общая формула предельных аминов: CnH2n+3N или CnH2n+1NH2.
Физические свойства аминов
У аминов можно выделить такие физические свойства:
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи, что объясняет более высокие температуры кипения аминов относительно неполярных соединений с похожей молярной массой.
Амины способны образовывать межмолекулярные связи с водой, из-за чего низшие амины хорошо растворяются в воде При увеличении количества радикалов и их разветвленности растворимость в воде заметно снижается. Что касается ароматических аминов, то они в воде практически не растворяются.
Низшие алифатические амины (метиламин, диметиламин и триметиламин) — это газы с характерным запахом аммиака.
 Средние гомологи — это жидкости с резким рыбным запахом, а высшие амины — твердые вещества, у которых запаха нет.
Средние гомологи — это жидкости с резким рыбным запахом, а высшие амины — твердые вещества, у которых запаха нет.Ароматические амины — это бесцветные жидкости с высокими температурами кипения или же твердые вещества.
Химические свойства аминов
Наличие у атома азота неподеленной электронной пары в значительной степени определяет химические свойства аминов. Алифатические амины — это более сильные основания, чем аммиак, из-за влияния алкильных групп. В свою очередь ароматические амины имеют более низкую основность, чем у аммиака, из-за своей стабильности.
1. Взаимодействие с водой.
При растворении аминов в воде образуется катион аммония и гидроксид-анион аналогично растворению аммиака в воде.
NH3 + H2O ⇌ NH4+ + OH–.
C3H7 – NH2 + H2O ⇌ (C3

2. Взаимодействие аминов с кислотами.
Так как амины обладают оснóвными свойствами, то способны вступать в реакцию с кислотами с образованием солей.
H3C – CH2 – NH2 + HBr → [H3N+ – CH2 – CH3] Br –.
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей.
CH3 – NH – CH3 + H2SO4 → [H3C – N+H2 – CH3] HSO4–.
3. Алкилирование аминов.
Из первичного амина можно получить вторичный, а затем и третичный амин. Эта реакция проходит в две стадии:
Амины алкилируют галогеналканом с образованием соли:
CH3 – NH2 + CH3 – CL → [H3C – N+H2 – CH3] CL– .

Затем высвобождаем новый амин с помощью более сильного основания (щелочи):
[H3C – N+H2 – CH3] Cl– + NaOH → CH3 – NH – CH3 + NaCl + H2O.
4. Взаимодействие с азотистой кислотой.
Качественная реакция на первичные амины:
H3C – CH2 – NH2 + NaNO2 + HCl → H3C – CH2 – OH + N2 + NaCl + H2O.
5. Горение аминов.
Все амины горят с образованием углекислого газа, газообразного азота и воды, независимо от состава и структуры амина.
4C2H5 – NH2 + 15O2 → 8CO2 + 2N2 + 14H2O.
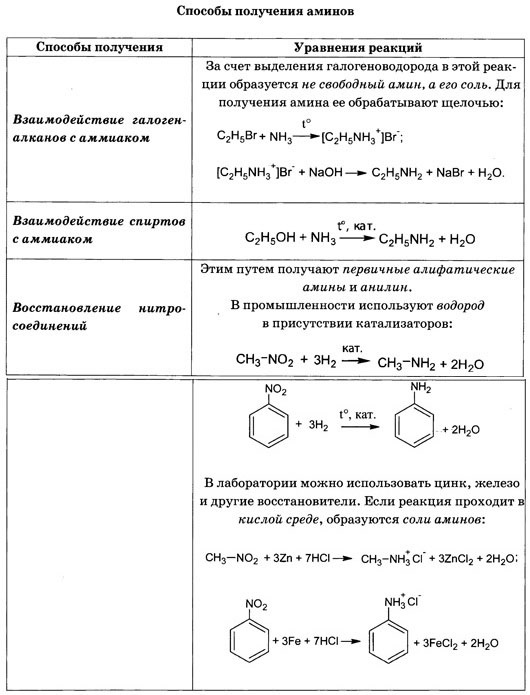
Способы получения аминов
Существует несколько способов получить амины в ходе химических реакций.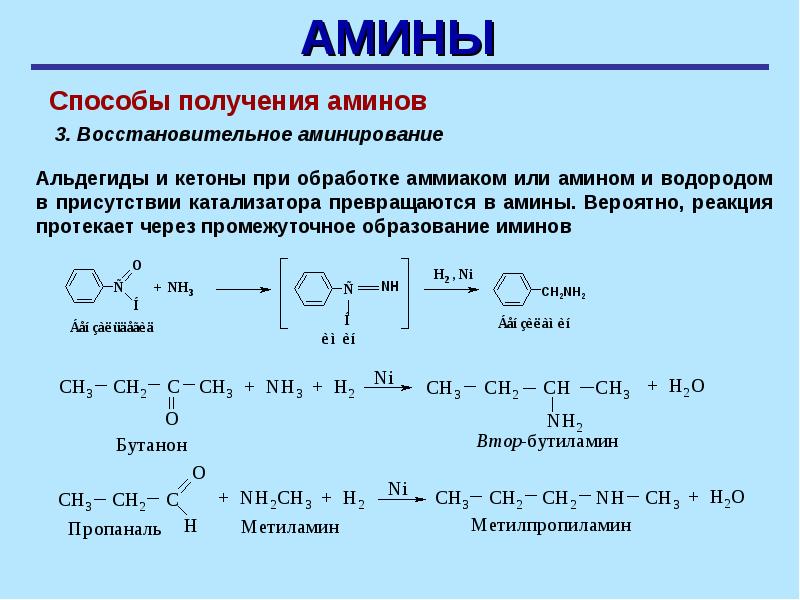 Сегодня мы рассмотрим два из них. Остальные вы подробно разберете в 11-м классе.
Сегодня мы рассмотрим два из них. Остальные вы подробно разберете в 11-м классе.
- Гидрирование нитросоединений.
Общий вид протекания реакции:
Частный случай гидрирования нитросоединения — промышленное получение анилина:
- Получение из галогеналканов.
Реакция идет в две стадии: сначала получение соли алкиламмония, а затем вытеснение амина более сильным основанием:
Если вы хотите еще глубже изучить свойства аминов и закрепить знания на практике, подумайте о дополнительных занятиях. На уроках онлайн-курсов химии в Skysmart вы сможете разобрать любую тему — даже ту, что, казалось бы, никогда не получится осилить. Например, свойства анилина и другие. Наши преподаватели объяснят ее простым языком, а интерактивные задания и опыты расскажут, как работает химия на самом деле. Начните с бесплатного вводного занятия — там мы познакомим вас с онлайн-платформой и поможем определить уровень знаний.
Начните с бесплатного вводного занятия — там мы познакомим вас с онлайн-платформой и поможем определить уровень знаний.
Ксения Боброва
К предыдущей статье
Химическое равновесие
К следующей статье
Как подготовиться к ОГЭ по химии
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Амины: способы получения, строение и свойства
!!! Друзья! Приглашаю вас на экспресс-курс подготовки к ЕГЭ по химии: «За 30 дней вокруг ЕГЭ по химии». С 27 апреля по 26 мая в ускоренном формате повторим все темы курса химии. Формат занятий — онлайн вебинары, записи вебинаров, вся теория и тесты.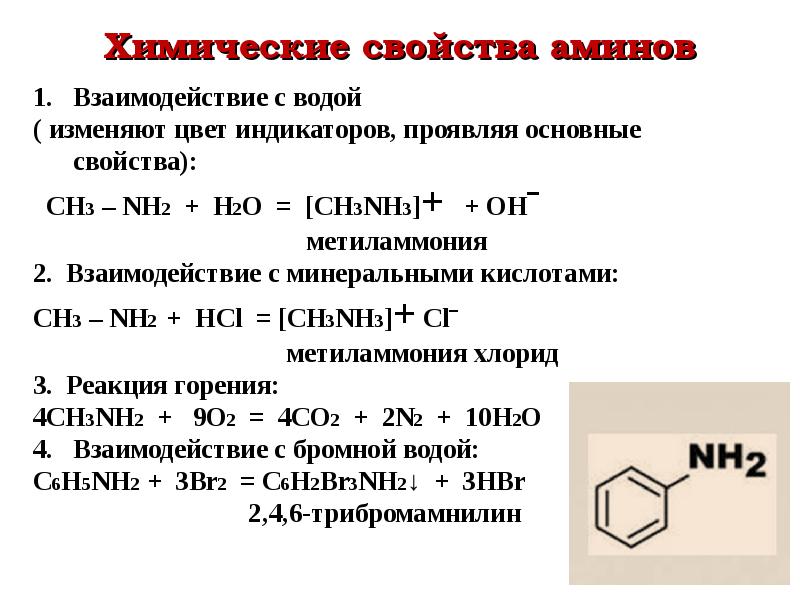 Запись через форму по ссылке !!! |
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
R-NH2, R1-NH-R2, R1-N(R2)-R3
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму треугольной пирамиды.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин CH3-NH2 | Диметиламин CH3-NH-CH3 | Триметиламин (CH3)3N |
| Ароматические | Фениламин C6H5-NH2 | Дифениламин (C6H5)2NH | Трифениламин (C6H5)3N |
| Смешанные | Метилфениламин CH3-NH-C6H5 | Диметилфениламин (CH3)2N-C6H5 |
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин.
 Различные радикалы перечисляются в алфавитном порядке.
Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин
СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин
(CH3)2NH Диметиламин
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.

Например, N-метиланилин:
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
| Например. Формуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета. |
| н-Бутиламин (1-аминобутан) | Изобутиламин (1-амин-2-метилпропан) |
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
| Например.Формуле С4Н11N соответствуют амины положения аминогруппы. |
| 1-Аминобутан (н-бутиламин) | 2-Аминобутан (втор-бутиламин) |
Изомерия между типами аминов
| Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины. |
| Пропиламин (первичный амин) | Метилэтиламин (вторичный амин) | Триметиламин (третичный амин) |
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
| Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства. Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов: |
Аммиак :NH3 | Первичный амин R–:NH2 |
Поэтому амины и аммиак обладают свойствами оснований.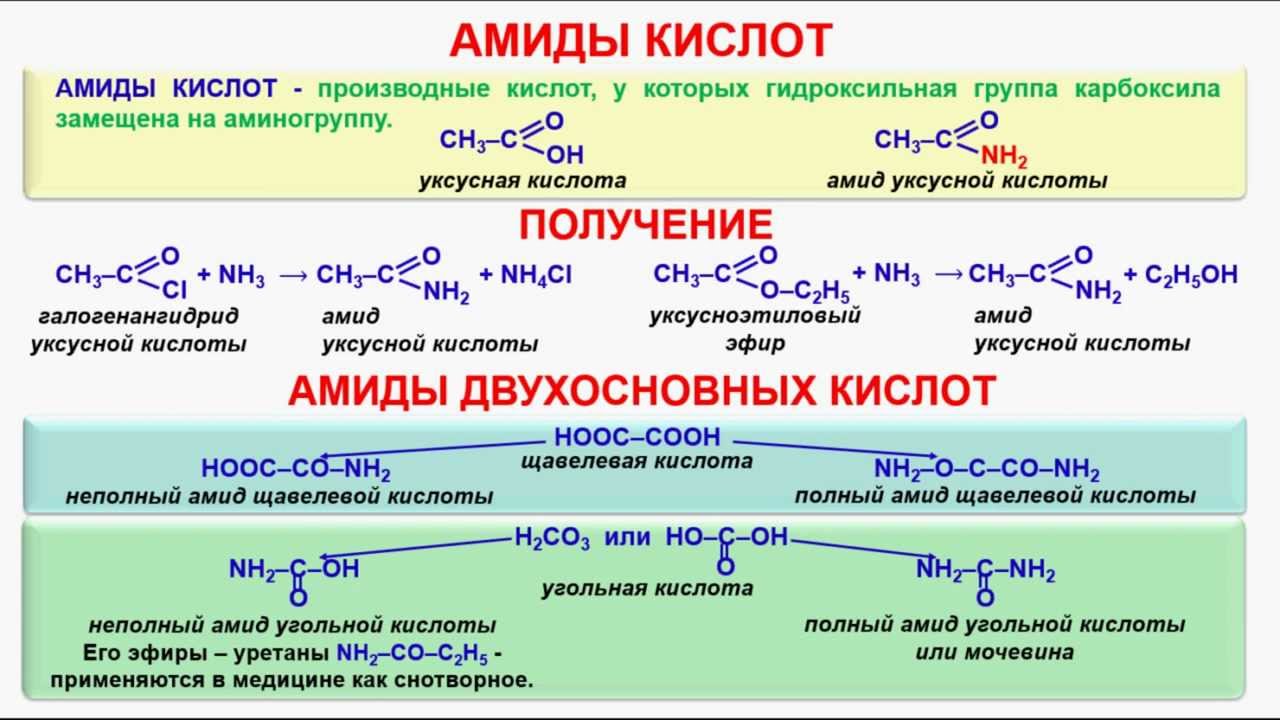 |
1. Основные свойства аминов
| Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. |
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
| Основные свойства аминов возрастают в ряду: |
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.
 3. Взаимодействие с солями
3. Взаимодействие с солямиАмины способны осаждать гидроксиды тяжелых металлов из водных растворов.
| Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II): |
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
| Это качественная реакция на первичные амины – выделение азота. |
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Анилин С6H5-NH2 – это ароматический амин.
| Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется. |
При 18 оС в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Видеоопыт изучения среды раствора анилина можно посмотреть здесь.
| Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. |
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.

Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
| Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓). |
Видеоопыт бромирования анилина можно посмотреть здесь.
Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
- Гидрирование водородом:
- Восстановление сульфидом аммония:
- Алюминий в щелочной среде.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.

При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
Видеоопыт взаимодействия хлорида диметиламмония с щелочью с образованием диметиламина можно посмотреть здесь.
- Соли аминов вступают в обменные реакции в растворе:
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
Понравилось это:
Нравится Загрузка…
Получение аминов1 — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3953
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице рассматривается получение аминов из галогеналканов (также известных как галогеналканы или алкилгалогениды) и из нитрилов.
Получение аминов из галогеналканов
Галогеналкан нагревают с концентрированным раствором аммиака в этаноле. Реакцию проводят в запаянной пробирке. Вы не могли нагреть эту смесь с обратным холодильником, потому что аммиак просто улетучится через конденсатор в виде газа. Мы поговорим о реакции с использованием 1-бромэтана в качестве типичного галогеналкана. Вы получаете смесь аминов, образованных вместе с их солями. Реакции идут одна за другой. 9-\]
Аммиак удаляет ион водорода из иона этиламмония, оставляя первичный амин — этиламин. Чем больше аммиака в смеси, тем более благоприятна прямая реакция.
Получение вторичного амина
Реакция не останавливается на первичном амине. Этиламин также реагирует с бромэтаном — в те же две стадии, что и раньше. На первом этапе образуется соль — на этот раз бромид диэтиламмония. Думайте об этом как о бромиде аммония, в котором два атома водорода заменены этильными группами.
Снова существует возможность обратимой реакции между этой солью и избытком аммиака в смеси.
Аммиак удаляет ион водорода из иона диэтиламмония, оставляя вторичный амин — диэтиламин. Вторичный амин — это амин, который имеет две алкильные группы, присоединенные к атому азота.
Получение третичного амина
Реакция не останавливается! Диэтиламин также реагирует с бромэтаном — в те же две стадии, что и раньше. На первом этапе вы получаете бромид триэтиламмония.
Снова существует возможность обратимой реакции между этой солью и избытком аммиака в смеси.
Аммиак удаляет ион водорода из иона триэтиламмония, оставляя третичный амин — триэтиламин. Третичный амин — это амин, который имеет три алкильные группы, присоединенные к атому азота.
Получение соли четвертичного аммония
Завершающий этап! Триэтиламин реагирует с бромэтаном с образованием бромида тетраэтиламмония — соли четвертичного аммония (в которой все четыре атома водорода заменены алкильными группами).
На этот раз в азоте не осталось водорода, который нужно удалить. Здесь реакция останавливается.
Здесь реакция останавливается.
Реакция бромэтана с аммиаком
Что бы вы ни делали, вы получите смесь всех продуктов (включая различные амины и их соли), показанных на этой странице. Чтобы получить преимущественно четвертичную аммониевую соль, можно использовать большой избыток бромэтана. Если вы посмотрите на происходящие реакции, каждая из них нуждается в дополнительном количестве бромэтана. Если вы предоставите достаточно, то, скорее всего, реакция завершится, если будет достаточно времени.
С другой стороны, если вы используете очень большой избыток аммиака, всегда велика вероятность того, что молекула бромэтана столкнется с молекулой аммиака, а не с одним из образующихся аминов. Это поможет предотвратить образование вторичных (и т. д.) аминов, хотя и не остановит его полностью.
Получение первичных аминов из нитрилов
Нитрилы представляют собой соединения, содержащие группу -CN, и их можно восстановить различными способами. Здесь описаны два возможных метода.
- Восстановление нитрилов с помощью LiAlH 4 . Одним из возможных восстанавливающих агентов является тетрагидридоалюминат(III) лития, который часто называют просто тетрагидридоалюминат лития или алюмогидрид лития. Нитрил реагирует с тетрагидридоалюминатом лития в растворе в этоксиэтане (диэтиловом эфире или просто «эфире») с последующей обработкой продукта этой реакции разбавленной кислотой. В целом тройная связь углерод-азот восстанавливается с образованием первичного амина. Например, с этанитрилом получается этиламин: \[ CH_3CN + 4[H] \rightarrow CH_3CH_2NH_2\]
- Восстановление нитрилов с использованием водорода и металлического катализатора. Тройная связь углерод-азот в нитриле также может быть восстановлена реакцией с газообразным водородом в присутствии различных металлических катализаторов. Обычно цитируемыми катализаторами являются палладий, платина или никель. Реакция будет проходить при повышенных температуре и давлении. Невозможно дать точную информацию, потому что она будет варьироваться от катализатора к катализатору.
 Например, этаннитрил можно восстановить до этиламина реакцией с водородом в присутствии палладиевого катализатора.
Например, этаннитрил можно восстановить до этиламина реакцией с водородом в присутствии палладиевого катализатора.
Авторы
Эта страница под названием «Подготовка аминов1» распространяется под лицензией CC BY-NC 4.0, автором, ремиксом и/или куратором этой страницы является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги


 Средние гомологи — это жидкости с резким рыбным запахом, а высшие амины — твердые вещества, у которых запаха нет.
Средние гомологи — это жидкости с резким рыбным запахом, а высшие амины — твердые вещества, у которых запаха нет.
 Различные радикалы перечисляются в алфавитном порядке.
Различные радикалы перечисляются в алфавитном порядке.

 Например, этаннитрил можно восстановить до этиламина реакцией с водородом в присутствии палладиевого катализатора.
Например, этаннитрил можно восстановить до этиламина реакцией с водородом в присутствии палладиевого катализатора.








 Европейское агентство по лекарственным средствам (EMA) рекомендовало…
Европейское агентство по лекарственным средствам (EMA) рекомендовало…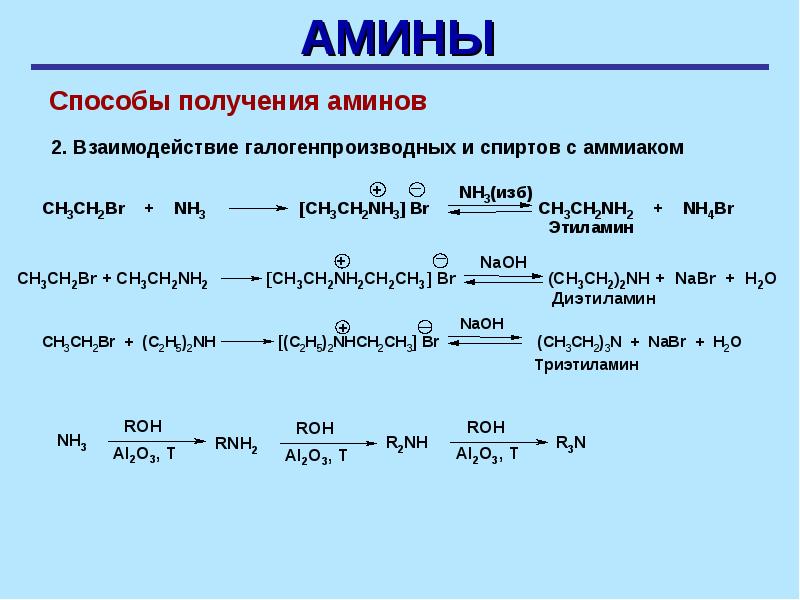

Leave A Comment