Окисление сульфата железа (II) в кислой среде | Задачи 646
Задача 646.
Какую массу сульфата железа (II) можно окислить в кислой среде с помощью 20 мл 0,1 н. раствора перманганата калия?
Решение:
Уравнения полуреакций окисления-восстановления:
Из чего следует, что fЭ(FeSO4) = 1/1, a fЭ(KMnO4) = 1/5 молей.
Тогда
МЭ(FeSO4) = M(FeSO4)/1 = 151,911/1 = 151,911 г/моль.
МЭ(KMnO4) = M(KMnO4)/5 = 158,036/5 = 31,6072 г/моль.
Находим количество молей, содержащихся в 20 мл 01н раствора KMnO4:
1000 : 0,1 = 20 : х; х = (20 . 1)/1000 = 0,002 моля.
Согласно закону эквивалентов вещества взаимодействуют друг с другом в эквивалентных количествах.
Теперь рассчитаем массу сульфата железа (II), которую можно окислить перманганатом калия:
m(FeSO4) = MЭ(FeSO n(FeSO4) = 151,911 .0,002 = 0,304 г.
n(FeSO4) = 151,911 .0,002 = 0,304 г.
Ответ: 0,304г.
Задача 647.
Вычислить массу йода и измеренный при нормальных условиях объем монооксида азота, выделившихся при добавлении 30 мл 0,2 н. раствора КNO2 к избытку подкисленного раствора КI.
Решение:
M(I2) = 253,808г/моль; VM = 22,4л/моль.
Уравнения полуреакций окисления-восстановления:
Из уравнения следует, что fЭ(NO) = 1/1, a fЭ(I2) = 1/2 молей.
Тогда
МЭ(I2) = M(I2)/2 = 253,808/2 = 126,904 г/моль.
В 1 л раствора содержится 0,2 эквивалента КNO2, а в 30 мл раствора: 0,2 . 0,03 = 0,006 эквивалента. Согласно закону эквивалентов, при восстановлении этого количества КNO2 будет окислено такое же количество KI, и будет получено такое же количество эквивалентов I2 и NO.
Найдём массу йода:
m(I2) = M(I2) . n(I2) =126,904 . 0,006 = 0,7614 г.
Находим объём монооксида азота:
V(NO) = VM.n(NO) = 22,4
Ответ: 0,7614 г I2; 0,1344 л NO.
Задача 648.
Чему равна нормальность 10%-ного (по массе) раствора КIО3 (р = 1,052 г/мл), если он восстанавливается до свободного йода?
Решение:
Находим массу 1 л раствора по формуле:
m(р-ра) = V . p = 1000 . 1,052 = 1052 г.
Теперь определим массу KClO3, содержащегося в 1л 10%-ного (по массе) его раствора:
m(KClO3) = 0,1 .1052 = 105,2 г.
Из уравнения полуреакции восстановления KIO3
IO3— + 6H+ + 5е = I20 + 3H2O
следует, что fЭ(КIO3 ) = 1/5; МЭ(КIO3) = M(KIO3) = 214/5 = 42,8г/моль.
Рассчитаем количество эквивалентов KClO3 в 1л раствора его:
n(КClO3) = 105,2/42,8 = 2,46 молей.
Нормальность раствора – это количество эквивалентов, содержащихся в 1 л раствора. тогда получим СN = 2,46 N.
Ответ: 2,46 N.
Задача 649.
Железная пластинка погружена в раствор CuSO
Решение:
Согласно закону эквивалентов при окислении железа выделяется эквивалентное количество меди.
Найдём эквивалентные массы железа и меди при реакции:
Fe + CuSO4 = FeSO4 + Cu
Из уравнений полуреакций окисления-восстановления:
следует, что fЭ(Fe) = 1/2; fЭ(Cu) = 1/2; МЭ(Fe) = M(Fe)/2 = 27,9225г/моль; МЭ(Cu) = M(Cu) = 63,546/2 = 31,773г/моль.
Исходя из этого, определим увеличение массы железной пластинки при выделении из раствора меди, получим:
31,773 – 27, 9225 = 3,8505 г.
Таким образом, при взаимодействии 1 моля железа с 1 молем медного купороса выделяется 31,773 г меди, и при этом железная пластинка увеличивается на 3,8505 г.
Массу меди, выделившейся из раствора, если масса железной пластинки увеличилась на 2 г, рассчитаем из пропорции:
31,773 : 3,8505 = х : 2; х = (2 .31,773)/3,8505 = 16,5033 г.
Ответ: 16,5033 г.
ОглавлениеПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ ВВЕДЕНИЕ § 1. Понятие о количественном анализе § 2. Классификация методов количественного анализа § 3. Характеристика методов количественного анализа § 4. Анализ больших и малых количеств вещества § 6. Подготовка вещества для взвешивания § 7. Взвешивание § 8. Техника взвешивания на аналитических весах § 9. Правила обращения с аналитическими весами § 10.  Приготовление раствора для анализа Приготовление раствора для анализа§ 11. Запись результатов анализа Часть первая. Объемный анализ § 1. Сущность объемного анализа § 2. Общее уравнение реакции титрования и выводы из него Б. ТЕХНИКА ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА В ОБЪЕМНОМ АНАЛИЗЕ § 3. Измерение объемов растворов § 4. Посуда, применяемая для измерения объемов растворов § 5. Работа с мерными колбами § 7. Работа с бюретками § 8. Приготовление стандартных растворов В. ВЫЧИСЛЕНИЯ В ОБЪЕМНОМ АНАЛИЗЕ § 9. Концентрация растворов и способы ее выражения § 10. Способы вычисления в объемном анализе § 11. Связь между точностью измерений и точностью вычислений § 12. Краткие сведения о статистической обработке экспериментальных данных Г. ПОЛУМИКРООБЪЕМНЫЙ МЕТОД АНАЛИЗА § 13. Понятие о полумикрообъемном анализе § 14. Особенности техники измерения объемов растворов в полумикрометоде Д. БЕЗБЮРЕТОЧНЫЕ МЕТОДЫ ТИТРОВАНИЯ § 15. Понятие о безбюреточных методах титрования § 16.  Е. АВТОМАТИЧЕСКИЕ МЕТОДЫ § 17. Химико-аналитический контроль производства § 18. Автоматические методы титрования ГЛАВА II. МЕТОДЫ НЕЙТРАЛИЗАЦИИ, ИЛИ МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ § 1. Характеристика метода § 2. Установление точки эквивалентности § 3. Графический метод изображения процесса нейтрализации § 4. Вычисление концентрации ионов водорода в водных растворах сильных кислот и оснований § 5. Вычисление активности ионов водорода в водных растворах сильных кислот и оснований § 6. Титрование сильной кислоты сильным основанием § 7. Вычисление концентрации ионов водорода в растворах слабых кислот и оснований § 8. Вычисление активности ионов водорода в водных растворах слабых кислот и оснований § 10. Равновесия в водных буферных растворах слабых оснований в присутствии солей этих оснований § 11.  Вычисление концентрации ионов водорода в водных буферных растворах Вычисление концентрации ионов водорода в водных буферных растворах§ 12. Вычисление активности ионов водорода в водных буферных растворах § 13. Вычисление концентрации ионов водорода и степени гидролиза в водных растворах гидролизующихся бинарных солей § 14. Вычисление активности ионов водорода в водных растворах гидролизующихся бинарных солей § 16. Титрование слабого основания сильной кислотой § 17. Титрование многоосновных кислот § 18. Титрование солей, образованных катионами сильных оснований и анионами слабых многоосновных кислот § 19. Изменение активности и показателя активности ионов водорода в процессе титрования водных растворов кислот и оснований § 20. Выводы, вытекающие из рассмотрения кривых нейтрализации § 21. Индикаторы § 22. Интервал перехода индикатора § 23. Выбор индикатора § 24. Ошибки титрования Б. ПРАКТИЧЕСКАЯ ЧАСТЬ § 25. Организация рабочего места § 26. 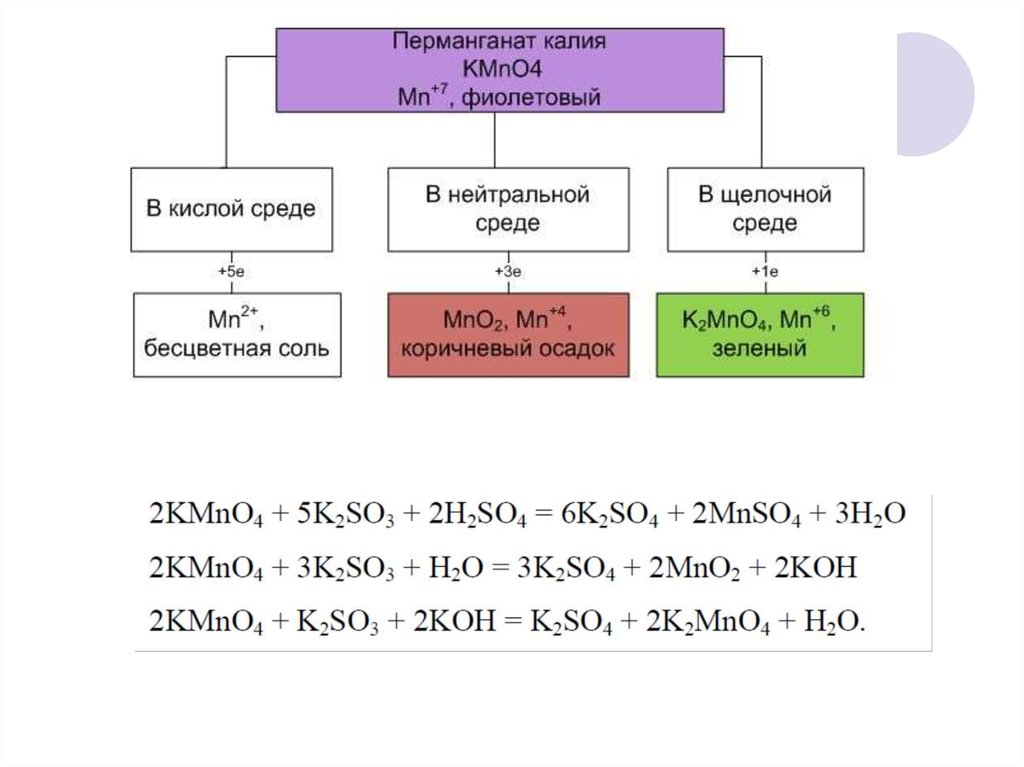 Приготовление стандартных (титрованных) растворов Приготовление стандартных (титрованных) растворов§ 27. Приготовление 0,1 н. раствора хлористоводородной кислоты § 28. Установка титра 0,1 н. раствора хлористоводородной кислоты § 29. Приготовление 0,1 н. раствора едкого натра § 30. Установка титра 0,1 н. раствора едкого натра § 31. Определение карбонатов § 32. Определение содержания h3SO4 в технической серной кислоте § 33. Определение содержания уксусной кислоты § 34. Определение содержания Na2CO3 и NaOH при их совместном присутствии § 35. Определение содержания Na2CO3 и NaHCO3 при их совместном присутствии § 36. Определение жесткости воды § 37. Определение аммонийного азота в солях аммония § 38. Определение содержания фосфорной кислоты В. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ § 39. Неводные растворы § 40. Современные представления о кислотах и основаниях § 41. Диссоциация электролитов в неводных растворах § 42. Влияние неводных растворителей на силу кислот и оснований § 43. 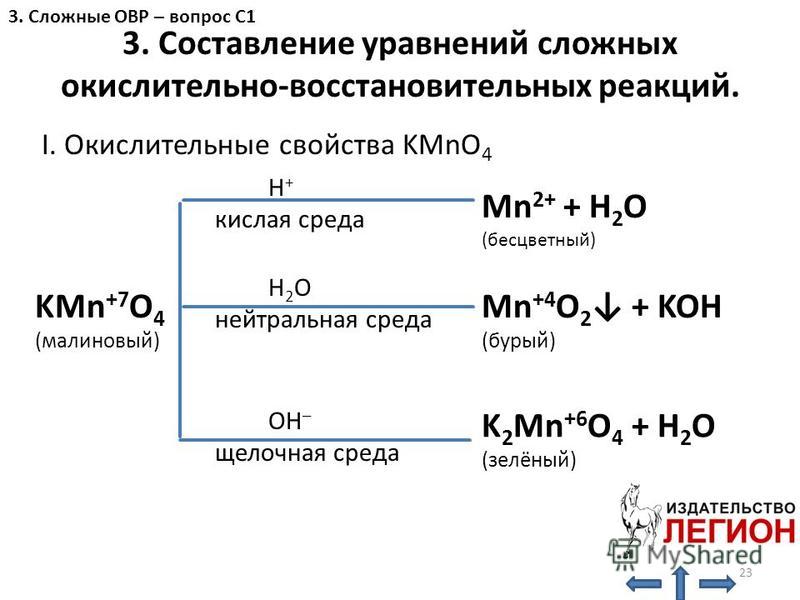 Применение закона действия масс к растворам сильных электролитов Применение закона действия масс к растворам сильных электролитов§ 44. Титрование кислот и оснований в неводных растворах § 45. Методы кислотно-основного титрования в неводных средах § 46. Примеры практических определений в неводных растворах ГЛАВА III. МЕТОДЫ ОКИСЛЕНИЯ—ВОССТАНОВЛЕНИЯ (ОКСИДИМЕТРИЯ, ОКСРЕДМЕТРИЯ, РЕД-ОКС-МЕТОДЫ) § 1. Значение окислительно-восстановительных потенциалов § 2. Реакции окисления—восстановления и комплексообразования § 3. Примеры окислительно-восстановительного титрования § 4. Константы равновесия окислительно-восстановительных реакций § 5. Связь между константами равновесия окислительно-восстановительных реакций и нормальными потенциалами § 6. Вычисление констант равновесия окислительно-восстановительных реакций § 8. Зависимость скорости реакций окисления—восстановления от различных факторов § 9. Графический метод изображения процесса окисления—восстановления § 10. Фиксирование точки эквивалентности в методах окисления—восстановления § 11.  Окислительно-восстановительные индикаторы (ред-окс-индикаторы) Окислительно-восстановительные индикаторы (ред-окс-индикаторы)Б. ПЕРМАНГАНАТОМЕТРИЯ § 12. Основы перманганатометрии § 13. Титрование перманганатом в кислой среде § 14. Титрование перманганатом в щелочной среде § 15. Приготовление стандартного (титрованного) раствора перманганата калия § 16. Установка титра стандартного раствора перманганата калия § 17. Установка титра и нормальности раствора перманганата калия по оксалату аммония § 18. Вещества, определяемые методом перманганатометрии ОПРЕДЕЛЕНИЕ ВОССТАНОВИТЕЛЕЙ § 19. Определение щавелевой кислоты и оксалатов § 20. Определение соединений железа (II) § 21. Определение содержания металлического железа в присутствии окислов железа § 22. Определение азотистой кислоты и нитритов § 23. Определение содержания марганца (II) в рудах ОПРЕДЕЛЕНИЕ ОКИСЛИТЕЛЕЙ § 24. Определение соединений железа (III) § 25. Определение нитратов § 26. Определение бихроматов § 27. Определение содержания MnO2 в пиролюзите ОПРЕДЕЛЕНИЕ ДРУГИХ ВЕЩЕСТВ § 28.  Определение ионов кальция Определение ионов кальцияВ. ИОДОМЕТРИЯ § 29. Основы иодометрии § 30. Методы иодометрического титрования § 31. Преимущества и недостатки иодометрического метода § 32. Приготовление стандартного (титрованного) раствора тиосульфата и установка его титра § 33. Приготовление стандартного (титрованного) раствора иода и установка его титра МЕТОДЫ ПРЯМОГО ТИТРОВАНИЯ § 34. Определение мышьяка (III) МЕТОДЫ ОБРАТНОГО ТИТРОВАНИЯ § 35. Определение сульфита натрия § 36. Определение содержания формальдегида в формалине МЕТОДЫ КОСВЕННОГО ОПРЕДЕЛЕНИЯ § 37. Определение ионов меди (II) § 38. Определение двуокиси свинца в сурике МЕТОД ТИТРОВАНИЯ ЗАМЕСТИТЕЛЕЙ § 39. Определение содержания двуокиси марганца в пиролюзите МЕТОД ОПРЕДЕЛЕНИЯ КИСЛОТ § 40. Определение хлористоводородной кислоты § 41. Определение воды по Фишеру Г. ПОНЯТИЕ О ДРУГИХ МЕТОДАХ ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯ § 42. Хроматометрия § 43. Определение содержания железа (II) § 44. 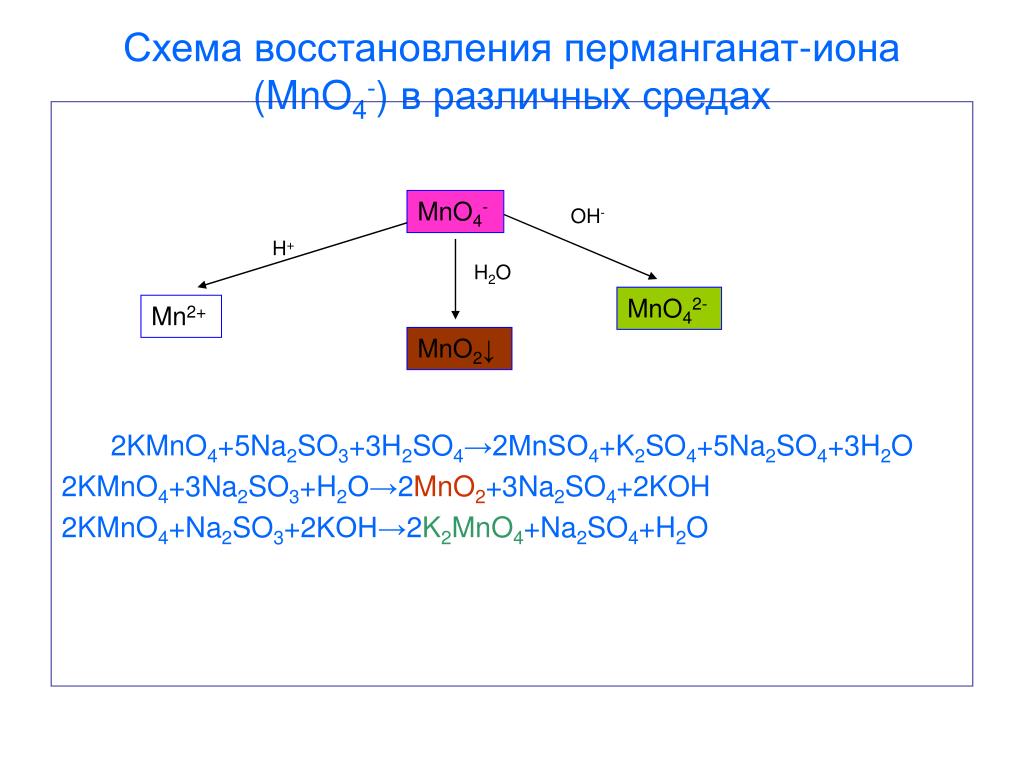 Цериметрия Цериметрия§ 45. Броматометрия § 46. Ванадатометрия § 47. Аскорбинометрия § 48. Титанометрия ГЛАВА IV. МЕТОДЫ ОСАЖДЕНИЯ И КОМПЛЕКСООБРАЗОВАНИЯ § 1. Общая характеристика методов § 2. Классификация методов осаждения и комплексообразования § 3. Применение теории осаждения к объемному анализу § 4. Вычисление растворимости электролитов в воде с учетом коэффициентов активности § 5. Влияние одноименных ионов на растворимость малорастворимого электролита § 6. Солевой эффект § 7. Влияние концентрации ионов водорода на растворимость малорастворимых соединений § 8. Кривые титрования в методе осаждения § 9. Общие выводы, вытекающие из рассмотрения кривых осаждения § 10. Адсорбционные явления, наблюдаемые при титровании по методу осаждения Б. АРГЕНТОМЕТРИЯ § 11. Характеристика метода § 12. Приготовление 0,1 н. раствора нитрата серебра § 13. Приготовление стандартного раствора хлорида натрия § 14. Установка титра 0,1 н. раствора нитрата серебра по точной навеске хлорида натрия §15.  Определение ионов хлора в техническом хлориде натрия по методу Мора Определение ионов хлора в техническом хлориде натрия по методу Мора§ 16. Определение хлоридов по методу Фаянса В. РОДАНОМЕТРИЯ § 17. Характеристика метода § 18. Приготовление 0,1 н. раствора роданида аммония § 19. Определение ионов хлора в растворимых хлоридах по методу Фольгарда § 20. Определение серебра в сплавах Г. МЕРКУРИМЕТРИЯ § 21. Характеристика метода § 22. Приготовление 0,1 н. раствора нитрата ртути (II) § 23. Установка титра раствора нитрата ртути (II) § 24. Определение ионов хлора в воде меркуриметрическим методом Д. МЕРКУРОМЕТРИЯ § 25. Краткая характеристика метода Е. КОМПЛЕКСОНОМЕТРИЯ (ХЕЛАТОМЕТРИЯ) § 26. Характеристика метода § 27. Теоретические основы комплексонометрического титрования § 28. Классификация методов комплексонометрического титрования § 29. Установка титра раствора комплексона III § 30. Определение содержания кальция § 31. Определение жесткости воды комплексонометрическим методом § 32. 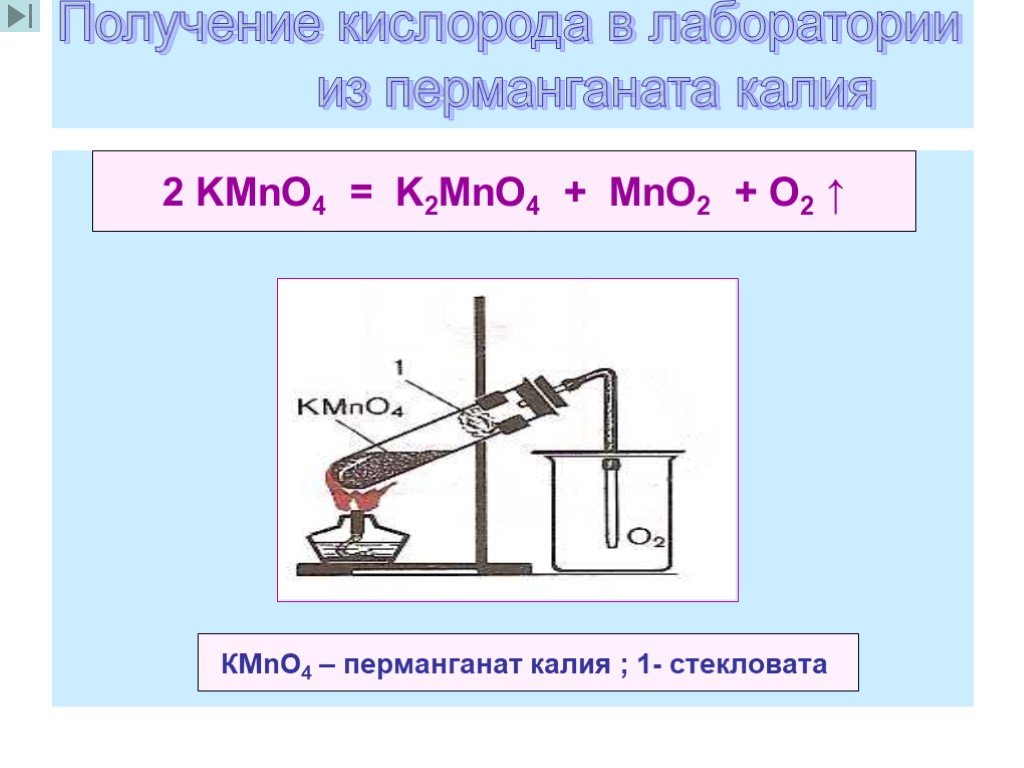 Анализ смеси ионов кальция и магния Анализ смеси ионов кальция и магния§ 33. Определение содержания алюминия § 34. Раздельное определение ионов кальция и алюминия § 35. Раздельное определение ионов алюминия и железа Часть вторая. Весовой анализ § 1. Сущность весового анализа § 2. Классификация методов весового анализа § 3. Расчеты в весовом анализе Б. ТЕХНИКА ВЕСОВОГО АНАЛИЗА § 4. Взятие и растворение навески § 5. Техника осаждения § 6. Фильтрование и промывание осадков § 7. Получение весовой формы § 8. Взвешивание весовой формы В. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ § 9. Теоретические основы выделения осадков из растворов с помощью специфических неорганических и органических реактивов § 10. Требования, предъявляемые к осадкам § 11. Методы повышения точности весовых определений § 12. Теоретические обоснования выбора оптимальных условий для весового определения Г. ПРАКТИЧЕСКАЯ ЧАСТЬ § 13. Определение кристаллизационной воды в BaCl2 2h3O § 14. Определение сульфат-ионов или серы § 15.  Определение ионов железа (III) Определение ионов железа (III)§ 16. Определение содержания кальция в карбонате кальция § 17. Определение содержания магния § 18. Определение ионов хлора в растворимых хлоридах или в хлористоводородной кислоте § 19. Анализ силикатов § 20. Анализ доломита § 21. Анализ бронзы и латуни Д. МЕТОДЫ ВЕСОВЫХ ОПРЕДЕЛЕНИЙ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ОРГАНИЧЕСКИХ РЕАКТИВОВ § 22. Определение никеля § 23. Определение алюминия Часть третья. Понятие о физических и физико-химических (инструментальных) методах анализа § 1. Электрохимические методы § 2. Спектральные (оптические) методы § 3. Хроматографические методы § 4. Радиометрические методы § 5. Масс-спектрометрические методы ГЛАВА VII ЭЛЕКТРОВЕСОВЫЕ МЕТОДЫ АНАЛИЗА § 1. Характеристика методов электроанализа § 2. Химические процессы, протекающие при электролизе § 3. Методы электроанализа § 4. Электровесовой анализ § 5. Метод внутреннего электролиза § 6. Определение меди в растворе сульфата меди с применением платиновых сетчатых электродов § 7.  Определение меди и свинца в латуни с применением платиновых сетчатых электродов Определение меди и свинца в латуни с применением платиновых сетчатых электродов§ 8. Определение малых количеств меди методом внутреннего электролиза ГЛАВА VIII. ОБЪЕМНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА § 1. Особенности объемных электрохимических методов анализа § 2. Кондуктометрическое титрование § 3. Высокочастотное титрование § 4. Потенциометрическое титрование § 5. Полярографический метод анализа § 6. Амперометрическоб титрование § 7. Кулонометрическое титрование ГЛАВА IX. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА § 1. Понятие об эмиссионном спектральном анализе Б. КОЛОРИМЕТРИЯ § 2. Особенности колориметрических методов анализа § 3. Характеристика колориметрических методов анализа В. ОПТИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ § 4. Спектрофотометрическое титрование § 5. Фототурбидиметрическое и фотонефелометрическое титрование Г. ЛАБОРАТОРНЫЕ РАБОТЫ § 6. Определение содержания ионов железа методом колориметрического титрования § 7. 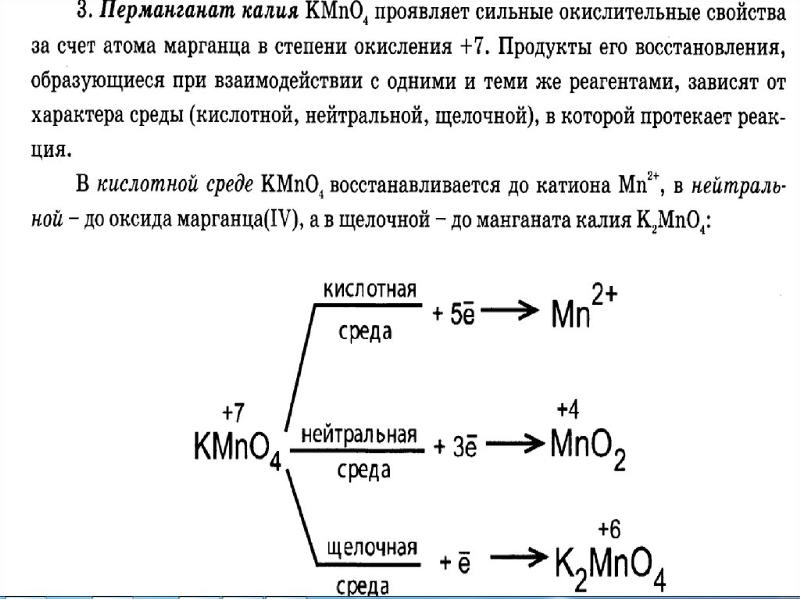 Определение содержания титана Определение содержания титанаГЛАВА X. МЕТОДЫ РАЗДЕЛЕНИЯ, ВЫДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ ОТДЕЛЬНЫХ КОМПОНЕНТОВ АНАЛИЗИРУЕМЫХ СМЕСЕЙ § 1. Определение следов элементов (микропримесей) § 2. Метод осаждения малорастворимых соединений § 3. Электрохимические методы разделения § 4. Метод экстрагирования § 5. Методы отгонки летучих соединений § 6. Хроматографические методы разделения § 7. Метод флотации |
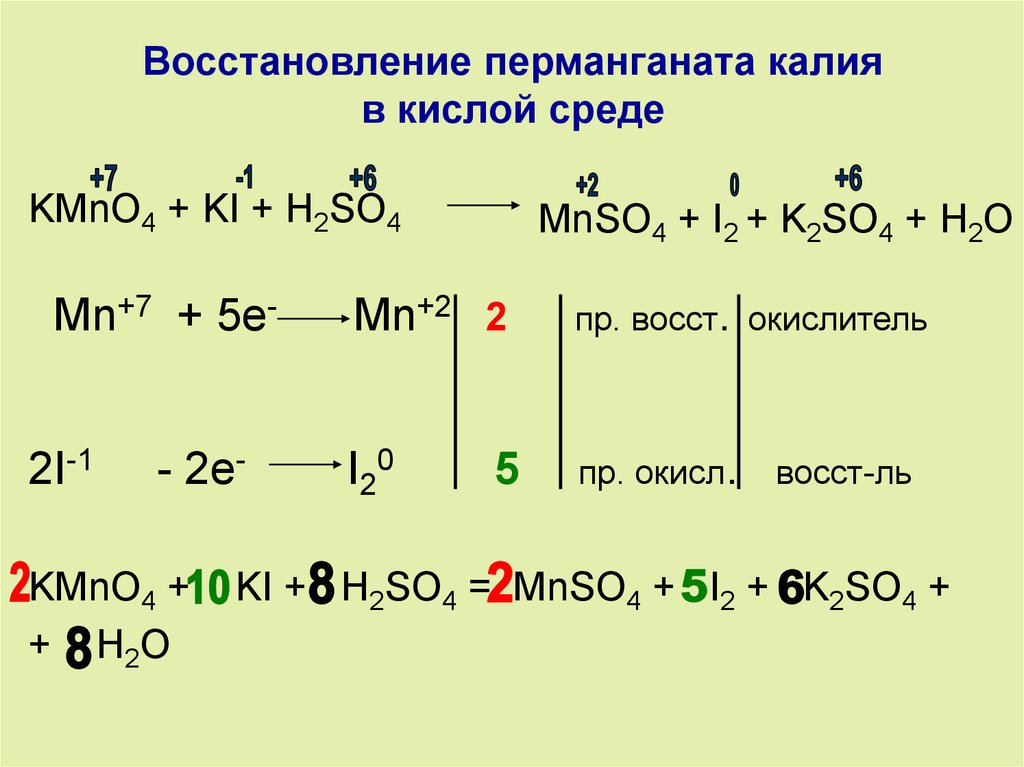
Титрование перманганата
Титрование перманганата Окислительно-восстановительное титрование. Перманганат калия.я . Введение.
| В этом эксперименте вы будете использовать стандартный раствор перманганата калия
(KMnO 4 ) для определения железа (как Fe 2+ )
в неизвестном растворе. Ион перманганата восстанавливается до иона марганца(II) в кислом растворе. Для этой реакции требуется 5 электронов и 8 (!) ионов водорода:  II. Экспериментальная процедура. A. Приготовление раствора KMnO 4 Примечание. Это решение подготовить на складе и передать учащимся. B. Титрование неизвестного раствора Fe(II) Вы получаете раствор неизвестной концентрации в 100 мл волюм.  колба. Аккуратно разбавьте до метки. колба. Аккуратно разбавьте до метки. 1. С помощью пипетки на 10 мл перенесите ровно 10,00 мл неизвестного раствора. в колбу Эрленмейера. 2. С помощью мерного цилиндра добавьте 10 мл 1 M H 2 SO 4 к колбе. 3. Наполните бюретку раствором KMnO 4 и слейте достаточно, чтобы уровень жидкости был чуть ниже верхней калибровочной отметки отметка и наконечник бюретки заполнен. Считайте начальный объем из калибровки шкала на бюретке. Это показание и все другие показания по бюретке должны быть оценивается с точностью до 0,01 мл. Перманганат калия имеет цвет так глубоко, что едва виден нижний мениск. Используйте верхний, чтобы читать тома. 4. Оттитровать раствор железа в колбе. Образуется розоватый цвет по первой капле избытка KMnO 4 сигнализирует о конечной точке для титрования. Получите окончательные показания объема при калибровке. шкала на бюретке.  5. Повторите шаг 4 дважды. Объем KMnO 4 раствор используемый должен совпадать с первым титрованием в пределах 0,20 мл. III. Расчеты. Во всех расчетах предполагается, что 5 молей Fe(NH 4 ) 2 (SO 4 ) 2 являются эквивалентно 1 молю KMnO 4 . 1. Зная молярность вашего KMnO 4 и объем используется в каждом титровании, вы можете рассчитать молярность вашего раствора Fe(II) как молярность (Fe(II)) = 5-кратная молярность ( MnO 4 )×объем ( MnO 4 )/объем (Fe(II)) 2. Зная молярность вашего раствора Fe(II), вы сможете рассчитайте количество молей железа (как Fe 2+ ) в вашем неизвестном пробы и масса Fe в г: Учтите, что ваш общий объем составляет 100 мл, а атомный вес Fe составляет 55,85.  5. Повторите приведенные выше расчеты для каждого титруемого образца и определите среднее значение и стандартное отклонение. |
Имя:________________________________Дата:___________________
Определение содержания железа неизвестно.
Молярность перманганата калия: _______ М
Объем используемой пипетки (объем (Fe): ______ мл
Титрование 1 __________________мл
Титрование 2 __________________мл
Титрование 3 __________________мл
масса Fe
#1 __________ # 2 ____________ # 3_____________
Среднее значение m (Fe)________________Стандартное отклонение_______________
Эксперимент 16 Помогите!!!
Эксперимент 16 Помогите!!!
|
Обзор
В этом эксперименте вы использовали окислительно-восстановительную (окислительно-восстановительную) реакцию
как средство анализа неизвестного образца на предмет содержания железа (II) в образце.
Эксперимент проводился в течение двух недель, чтобы дать вам возможность ваше время и получить хорошие результаты. В течение первой недели эксперимента вы давали раствор перманганата калия, KMnO 4 , из примерная концентрация, которая должна была использоваться в качестве титранта (раствор в бюретке). Перманганат калия обладает высокой реакционной способностью и не доступен в чистом виде. Таким образом, решение, которое вам было дано, могло только быть доведена до концентрации приблизительно . Затем в первую неделю эксперимента, ваша цель состояла в том, чтобы определить точную концентрацию раствора KMnO 4 путем взаимодействия его с чистым стабильным железом соединение известного состава, железо-аммонийсульфат (ФАС).
Перманганат калия реагирует с солями железа(II) по схеме следующее уравнение окисления-восстановления
5 Х (Fe 2+ Fe 3+ + e — ) окисление |
MnO 4 — + 8H + + 5e — Mn 2+ + 4H 2 O снижение |
_____________________________________________________________________________ |
MnO 4 — + 5Fe 2+ + 8H + Mn 2+ + 5Fe 15 + 40013 15 + 3+ 900 общий процесс |
Путем определения точной массы взятых проб ФАС и объема
раствора KMnO 4 , необходимого для титрования этих образцов, точное
можно рассчитать молярность растворов KMnO 4 .
На второй неделе эксперимента вы титровали образцы «неизвестная» соль железа(II) с тем же KMnO 4 раствор, чтобы определить, какой % по массе содержащегося Fe. Зная объем КМнО 4 решение, необходимое для достижения конечной точки, позволяет вычислить число молей железа, присутствующего в каждом образце, и массы железа (II), присутствующего в каждый образец. Тогда от массы железа(II) в пробе и от массы самого образца можно рассчитать % Fe в образце.
Перманганат калия в растворах имеет ярко-фиолетовый цвет, тогда как продукты реакция практически бесцветна при используемых концентрациях, поэтому «конечная точка» Об окончании титрования свидетельствовало появление розовой окраски пробы. титруют, как одну лишнюю каплю KMnO 4 (сверх того, что необходимо для реакции с Fe 2+ присутствует) был добавлен.
Данные
Вот некоторые примеры данных, которые мы будем использовать для примеров расчетов:
Страница 159, Часть I A: Стандартизация KMnO
4 В первой части эксперимента вы взвешиваете три образца известных, чистых,
стандартное соединение железа(II), гексагидрат сульфата двухвалентного железа. Затем вы титруете
три образца ФАС с раствором KMnO 4 .
Затем вы титруете
три образца ФАС с раствором KMnO 4 .
Часть I, Раздел A, Часть 1: Масса стакана + двухвалентный сульфат аммония
Вы как-то необычно взвесили эти образцы. Колбы Эрленмейера в титрования, которые вы выполняете, весят слишком много, чтобы их можно было точно взвесить на электронном балансы. Вместо этого вы применили метод под названием «взвешивание по разнице». поместили достаточное количество FAS в небольшой химический стакан, чтобы покрыть все три ваших образца, а затем взвесили стакан. Затем вы перенесли часть ФАС в свою первую колбу Эрленмейера и повторно взвесили химический стакан, содержащий остаток FAS. Разница в массе для химический стакан представляет собой массу образца, перенесенного в колбу Эрленмейера. Ты тогда повторил процесс еще дважды (взвешивание стакана до и после извлечения образца) подготовить дополнительные образцы FAS.
Перед переносом | После переноса | Масса образца | |
Образец 1 | 15,1249 г | 14,1157 г | 1,0092 г |
Образец 2 | 14,1157 г | 13. | 1,0178 г |
Образец 3 | 13,0979 г | 12,0052 г | 1,0927 г |
2.
 Бюретные показания
Бюретные показания
Начальный | Финал | Том. КМnО 4 | |
Образец 1 | 0,25 мл | 25,36 мл | 25,11 мл |
Образец 2 | 1,24 мл | 26,58 мл | 25,34 мл |
Образец 3 | 1,09 мл | 28,30 мл | 27,21 мл |
Страница 162, Часть I: Определение Fe(II) в неизвестном
Из данных, приведенных выше в части I A, можно рассчитать молярность, M ,
раствор KMnO 4 (см. расчеты ниже) для титрования образцов
неизвестное соединение железа.
расчеты ниже) для титрования образцов
неизвестное соединение железа.
Часть B, Раздел 2. Масса неизвестных проб
Неизвестное соединение железа также взвешивали «по разнице» непосредственно из контейнер (тюбик или флакон), в котором он был выдан.
Перед переносом | После переноса | Масса образца | |
Неизвестный образец 1 | 35,2453 г | 34,0101 г | 1,2352 г |
Неизвестный образец 2 | 34,0101 г | 32,7524 г | 1,2577 г |
Неизвестный образец 3 | 32,7524 г | 31,5031 г | 1,2493 г |
Часть B, Раздел 3.
 Показания бюретки
Показания бюретки
Начальный | Финал | Том. КМnО 4 | |
Образец 1 | 0,29 мл | 26,30 мл | 26,01 мл |
Образец 2 | 1,04 мл | 27,51 мл | 26,47 мл |
Образец 3 | 2,10 мл | 28,40 мл | 26,30 мл |
Расчеты
Страница 159, часть II A
- Сбалансированное уравнение приведено в обзоре выше.
 Вы должны будете показать, как половина
реакции объединены, чтобы дать это в вашем лабораторном отчете.
Вы должны будете показать, как половина
реакции объединены, чтобы дать это в вашем лабораторном отчете. - Коэффициент пять
Страница 160, часть II B
1. Моли гексагидрата двухвалентного сульфата аммония в образце 1
Число молей чего-либо вычисляется из массы образца и молярная масса . Молярная масса Fe(NH 4 ) 2 (СО 4 ) 2 . 6Н 2 О составляет 392,2 г. Для пробы 1, в которой взята масса ФАС 1,0092 г, рассчитайте число из молей присутствует ФАС, затем нажмите здесь, чтобы проверить свой ответ.
2. Моль KMnO
4 Требуется для реакции с Fe 2+ в образце 1 Требуется пять моль Fe 2+ для реакции с один моль KMnO 4 согласно сбалансированному химическому уравнению реакции.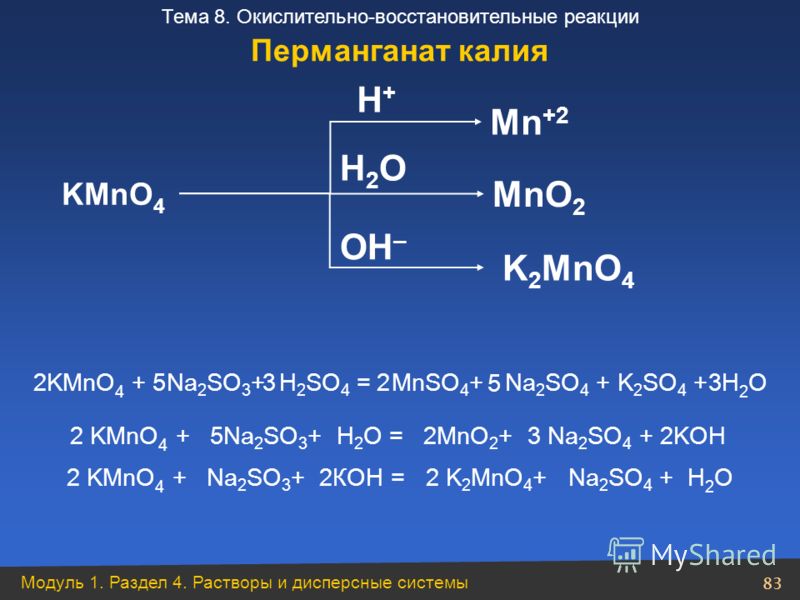 Каждая формульная единица FAS
содержит один Fe 2+ . Для образца 1 рассчитайте количество молей
KMnO 4 требуется для реакции с присутствующим железом (II), затем нажмите здесь, чтобы проверить свой ответ.
Каждая формульная единица FAS
содержит один Fe 2+ . Для образца 1 рассчитайте количество молей
KMnO 4 требуется для реакции с присутствующим железом (II), затем нажмите здесь, чтобы проверить свой ответ.
3. Молярность KMnO
4 На основе образца 1В ответе на вопрос 2 мы подсчитали, что должно было потребоваться 0,0005146 моль KMnO 4 прореагировать с железом(II), содержащимся в образце 1. Это количество молей содержалось в объем 25,11 мл (0,02511 л). Поскольку молярность раствора определяется как число молей растворенного вещества, содержащихся на литр раствора, используйте информацию для образца 1, чтобы рассчитать его молярность. Затем нажмите здесь чтобы проверить свой ответ.
4. Молярность KMnO
4 На основании всех результатов – средняя молярность и отклонение Если вам нужна помощь в расчете отклонений и среднего отклонения , пожалуйста
см. справку по эксперименту 1 (или нажмите здесь).
справку по эксперименту 1 (или нажмите здесь).
Используя приведенные выше данные образца и те же методы расчета, что и для образца 1, индивидуальная и средняя молярность перманганата калия:
Результаты | Молярность KMnO 4 | Отклонение |
Образец 1 | 0,02049 М | 0,00001 М |
Образец 2 | 0,02048 М | 0,00000 М |
Образец 3 | 0,02047 М | -0,00001 М |
Средний | 0,02048 М | 0,0000067 М 0,00001 М |
Страница 162, Часть II А
1.
 Моли KMnO 4 прореагировали в неизвестном образце 1
Моли KMnO 4 прореагировали в неизвестном образце 1Для раствора, молярность которого известна, число молей, содержащихся в порции, равно объем порции в литрах, умноженный на молярность (моль/л). Для неизвестного Образец 1, нам потребовалось 26,01 мл (0,02601 л) 0,02048 M KMnO 4 для достижения конечная точка::
2. Моли Fe
2+ в неизвестном образце 1Согласно сбалансированному химическому уравнению реакции железа(II) с перманганата, железа должно быть в пять раз больше, чем перманганата. конечная точка. Если бы мы использовали 0,0005327 молей KMnO 4 для достижения конечной точки количество Fe 2+ в образце 1 определяется как:
3.
 Масса Fe в неизвестном образце 1
Масса Fe в неизвестном образце 1Если у нас есть 0,002634 моля Fe 2+ , нам просто нужна атомная молярная масса Fe (55,85 г), чтобы рассчитать, сколько весит это железо (II):
4. %Fe по массе в неизвестном образце 1
Процентное содержание железа в Неизвестном образце 1 представляет собой долю общего это Фе. Неизвестный образец 1 имел общую массу 1,2352 г. Мы только что определили, что 0,1488 г это Fe. Таким образом, % Fe
5.


 Наряду с объемным и весовым методами в книге описаны основы электрохимических, спектральных, радиометрических и хроматографических методов конечного определения, а также методы разделения, выделения и концентрирования отдельных компонентов анализируемых смесей.
Наряду с объемным и весовым методами в книге описаны основы электрохимических, спектральных, радиометрических и хроматографических методов конечного определения, а также методы разделения, выделения и концентрирования отдельных компонентов анализируемых смесей.
 0979 г
0979 г Вы должны будете показать, как половина
реакции объединены, чтобы дать это в вашем лабораторном отчете.
Вы должны будете показать, как половина
реакции объединены, чтобы дать это в вашем лабораторном отчете.
Leave A Comment