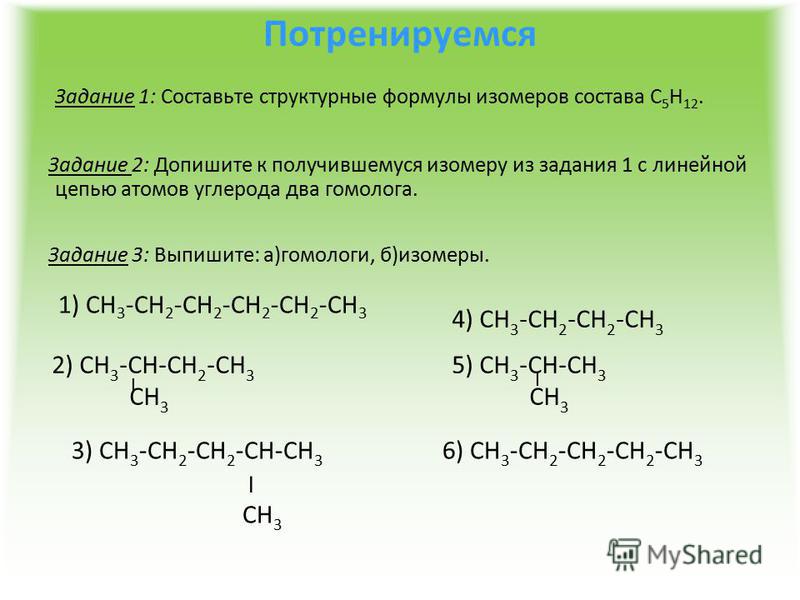
строение и свойства. Получение и применение пентенов
Пентен – ненасыщенный углеводород ациклического строения, четвертый член гомологического ряда алкенов. Пентен содержится в продуктах нефтепереработки. Вследствие структурных и геометрических отличий в строении молекул одинакового состава пентену присуще свойство изомерии. Изомеры пентена находят применение в производстве топлива и в органическом синтезе.
Строение пентена
Химическая формула пентена – . До полного насыщения валентностей углерода молекуле пентена не хватает двух атомов водорода. Гибридизация орбиталей у двух из пяти углеродных атомов принадлежит к типу , то есть затрагивает не все валентные электроны.
Гибридные электронные облака, расположенные в одной плоскости с центрами взаимодействующих атомов, вступают в прочную -связь. -орбитали этих атомов остаются негибридными и путем бокового перекрывания образуют -связь, которая менее устойчива, так как находится вне оси, соединяющей атомные ядра.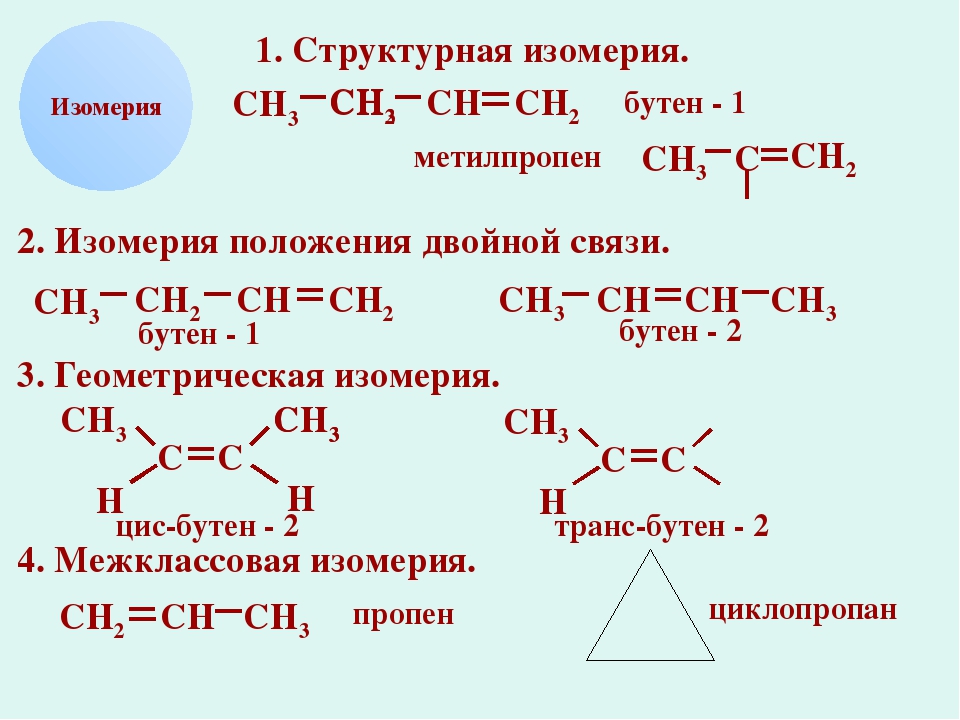
Сочетание представляет собой двойную связь , на которую углеродные атомы затрачивают по две свободных валентности из четырех. Поэтому пентен, подобно всем углеводородам ряда алкенов, имеет в молекуле на два водородных атома меньше, чем соответствующие предельные соединения – алканы.
Электронная, структурная и скелетная формулы пентена с простейшей неразветвленной углеродной цепью имеют вид:
Изомерия пентена
Количественный состав молекулы и присутствие в ней двойной связи обусловливают существование различных вариантов порядка соединения и взаимного расположения атомов.
Структурные изомеры
Структура молекулы определяется позицией, которую занимает в молекуле двойная связь, и формой (ветвлением) углеродного скелета. По этим признакам соединения состава насчитывают пять изомерных форм:
Межклассовые изомеры пентена
Соединения состава существуют в классе циклоалканов:
Перечисленные в таблице алициклические углеводороды также изомерны пентену.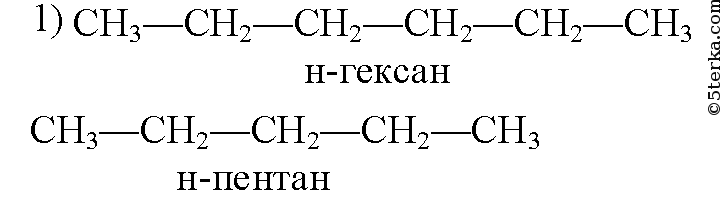
Это интересно:
Общая формула циклоалканов
Окисление алкенов перманганатом калия
Пространственные изомеры
Цис- и транс-изомеры с химической формулой возникают у пентена-2. Они различаются расположением алкильных и водородных заместителей относительно связи :
Таким образом, у пентена существует шесть изомеров, относящихся к ряду алкенов, и четыре межклассовых изомера из ряда циклоалканов.
Физические свойства
Пентены представляют собой бесцветные, легкие, подвижные жидкости, кипящие при низких температурах. Пары пентенов тяжелее воздуха, в смеси с ним способны образовывать взрывоопасные смеси. Все изомеры, принадлежащие к классу алкенов, имеют общие физические свойства:
Различия в свойствах, обусловленные особенностями строения изомеров, представлены в таблице:
Химические свойства
Пентены проявляют в химических взаимодействиях все свойства, присущие алкенам.
- Электрофильное (ионное) присоединение:
- Радикальное присоединение с разрывом -связи:
- Радикальное замещение с сохранением -связи:
- Окисление:
- Изомеризация:
- Полимеризация:
- Разложение:
Получение пентенов
- Промышленный способ:
- Лабораторные методы (общая схема):
Применение пентенов
В промышленности используются все изомеры пентена:
- пентен-1 в составе смеси углеводородов применяется в производстве бензина;
- пентен-1 и пентен-2 используются в синтезе амиловых (пентанолы) и гексиловых (гексанолы) спиртов и соответствующих альдегидов – пентаналя и гексаналя;
- 2-метилбутен-1 и 2-метилбутен-2 применяются в органическом синтезе: получении сложных эфиров, спиртов и изопрена;
- 3-метилбутен-1 находит применение в производстве пластических масс, а также добавляется в состав топлива с целью повышения октанового числа.
Продукты полимеризации пентенов используются в качестве компонентов смазочных масел и типографской краски.
Изомеры пентена в смеси с добавлением изопентана (так называемый технический пентен) служит сырьем для синтеза бутадиена.
При работе с пентенами необходимо использовать средства защиты дыхательных путей и перчатки, так эти соединения оказывают раздражающее воздействие. Поскольку смесь паров пентеновых углеводородов взрывоопасна, следует соблюдать правила техники безопасности.
Тренажер «Изомеры и гомологи углеводородов»
Модуль включает 2 задания, в которых предлагается рассортировать по ячейкам структурные формулы изомеров и гомологов пентана, пентена и бутена путём перемещения.
Категория пользователей
Обучаемый, Преподаватель
15 минут
Интерактивность
Высокая
Дисциплины
Химия
/ Органическая химия
/ Углеводороды и их производные
Уровень образования
Профессионально-техническая подготовка, повышение квалификации
Статус
Завершенный вариант (готовый, окончательный)
Тип ИР сферы образования
информационный модуль
Место издания
Москва
Ключевые слова
номенклатура углеводородов
Автор
Морозов Михаил Николаевич
Марийский государственный технический университет
Издатель
Марийский государственный технический университет ГОУВПО
ГОУВПО «Марийский государственный технический университет»
Россия, 424000, Республика Марий Эл, Йошкар-Ола, Ленина пл. , 3,
, 3,
Сайт —
http://www.mmlab.ru
Эл. почта —
[email protected]
Правообладатель
Федеральное агентство по образованию России
Федеральное агентство по образованию России
Россия, 115998, Москва, Люсиновская ул., 51
Внимание! Для воспроизведения модуля необходимо установить на компьютере проигрыватель ресурсов.
Характеристики информационного ресурса
Тип используемых данных:
application/xml, image/jpeg, image/png, application/x-shockwave-flash, audio/mpeg, text/html
Объем цифрового ИР
2 412 883 байт
Проигрыватель
OMS-player версии от 2.0
Категория модифицируемости компьютерного ИР
открытый
бесплатный
Наличие ограничений по использованию
есть ограничения
Рубрикация
Ступени образования
Основное общее образование
Целевое назначение
Учебное
Тип ресурса
Открытая образовательная модульная мультимедийная система (ОМС)
Классы общеобразовательной школы
9
Уровень образовательного стандарта
Федеральный
Характер обучения
Базовое
Из сборника задач для подготовки учащихся к сдаче ЕГЭ по химии
Цис-
Углеводородные Углеводородные
радикалы по одну радикалы по разные
стороны двойной стороны двойной
связи связи
Задания
1. Толуол и бензол – это
Толуол и бензол – это
1) гомологи 3) геометрические изомеры
2) структурные изомеры 4) одно и то же вещество
2. Ацетилен и этин – это
1) гомологи 3) геометрические изомеры
2) структурные изомеры 4) одно и то же вещество
3. Геометрических изомеров не имеет
1) 2-
2) бутен-
4. Для вещества Ch4-
1) Ch4CH=CH-
2) Ch4-
5. Гомологами являются
1) этанол и толуол 3) пропанон и метанол
2) этан и декан 4) ацетилен и этилен
6. Гомологами являются
Гомологами являются
1) C2H6 и C2h5 3) Ch4-
2) Ch3=O и Ch4COOH 4) Ch4-
7. Гомологом Ch4-
1) пентин-
2) гексин-
8. Гомологом ацетилена не является
1) бутин-
2) пропен 4) пентин-
9. Изомерами являются
1) формальдегид и муравьиная кислота
2) этанол и уксусная кислота
3) бензол и фенол
4) пентин-
10. Состав Cnh3n+2О имеют:
1) одноатомный спирт и простой эфир
2) простой эфир и сложный эфир
3) сложный эфир и карбоновая кислота
4) карбоновая кислота и альдегид
11. Состав Cnh3nО имеют:
Состав Cnh3nО имеют:
1) карбоновые кислоты и сложные эфиры
2) сложные эфиры и простые эфиры
3) простые эфиры и альдегиды
4) альдегиды и кетоны
12. Состав Cnh3nО2 имеют
1) альдегиды и кетоны
2) кетоны и простые эфиры
3) простые эфиры и сложные эфиры
4) сложные эфиры и карбоновые кислоты
13. Установите соответствие между структурной формулой углеводорода и общей формулой его гомологического ряда.
ФОРМУЛА УГЛЕВОДОРОДА ОБЩАЯ ФОРМУЛА
1) СН2=С=СН-
2) СН3-
3)
4)
тест по теме «Гомология и изомерия» | Материал для подготовки к ЕГЭ (ГИА) по химии (10, 11 класс) на тему:
Тест по теме : Изомеры и гомологи»
Вариант 1
Часть А
1. Изомерия для указанных соединений
Изомерия для указанных соединений
Ch4 – Ch3 – Ch3 – Ch3 – OH и Ch4 — CH(OH) – Ch3 – Ch4
Относится к
а) изомерия углеродной цепи в) изомерия положения функциональной группы
б) изомерия положения кратной связи г) пространственная изомерия
2.Выберите гомологическую разность
а)-Ch3 б)-Ch3- в)-CH= г)Ch5
3.Изомером нормального пентана является
а) 2-метилбутан в) 2-метилпентан
б) 2,2диметилбутан г) 2,3-диметилпентан
4.Гомологом ацетилена является
а) пропин в) этилен
б) анилин г) аланин
5.Изомерия для
Цис-Ch4-CH=CH-Ch4 и транс-Ch4-CH=CH-Ch4 относится к
а) изомерия углеродной цепи в) изомерия положения функциональной группы
б) изомерия кратной связи г) пространственная изомерия
6.Не является изомером 2,3 диметилбутаналя
а) 1-гексанол в)3-гесаналь
б) 2-гексанол г) 3,3диметилбутаналь
7.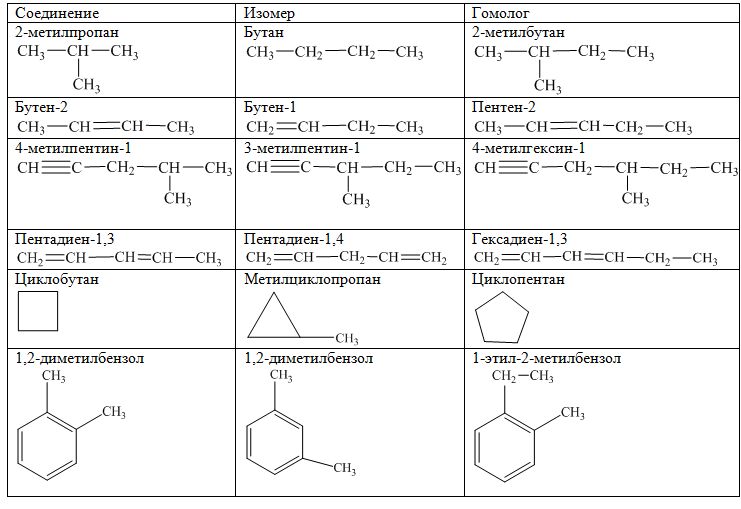 Гомологами являются
Гомологами являются
а) бензол и фенол в) толуол и этилбензол
б) бензол и стирол г) толуол и метилбензол
8).Структурные изомеры различаются
А) по строению углеродной цепи
Б) по взаимному расположению функциональных групп
1.верно А 3) верны оба утверждения
2.верно Б 4)неверны оба утвеждения
9.Для алкина, формула которого C4H6 ,характерна
а) изомерия углеродной цепи в) изомерия положения функциональной группы
б) изомерия положения кратной связи г) пространственная изомерия
10.Существование изомеров возможно для
а) Ch5 б)С2h3Cl2 в) C2H6 г) C3H8
Часть В
1.Установите соответствие между названиями вещества и типом изомерии
Название веществ | Тип изомерии |
А) 2-аминопропановая кислота и3-аминопропановая кислота Б) изопентан и н-пентан В) цис-пентен-2 и транс-пентен-2 Г)пропанол и изопропанол | 1. 2.изомерия углеродной цепи 3.изомерия положения функциональной группы 4.пространственная изомерия 5.оптическая изомерия 6. межклассовая |
Вариант 2
Часть В
1.Изомерия для соединений
Ch4-Ch3-Ch3-OH и Ch4-CH(OH)-Ch4 относится к
а) изомерия углеродной цепи б) изомерия положения кратной связи
в) изомерия положения функциональной группы г) пространственная изомерия
2.Гомологом пропена является
а) бутан б) пропановая кислота в) пропаналь г) пентен-2
3.Изомером для 3-этилгептана является
а) 3-этилгептен б) 2,3диметилгептан в) 2-метилбутанол-2 г) гептен-3
4.Изомерия для cоединений
Ch4=CH-Ch3-Ch4 и Ch4-CH=CH-Ch4 относится к
а) изомерия положения функциональной группы б) пространственная изомерия
б)оптическая изомерия г) изомерия положения кратной связи
5.Гомологом N(Ch4)3 является
а) метилэтиламин б) пропиламин в) диметиламин г)тризтиламин
6. Какие из веществ могут образовывать цис- и транс-изомеры
Какие из веществ могут образовывать цис- и транс-изомеры
А) h3C=CH-Ch4 б) Сh4-C(Ch4)=CH-Ch4 в) h4C-CH=CH-Ch4 г) Ch4-Ch3-Ch3-Ch4
7.Не являются изомером 2-метилпентановой кислоты
а) гексановая кислота б) пропановая кислота
в)2.2диметилбутановаяовая кислота г) 3метилпентановая
8.Укажите гомолог алканов с которого начинается явление изомерии
а) пропан б) бутан в) пентан г) гептан
9) Сколько изомеров положения кратной связи у бутена
а) один б) два в) три г) четыре
10) Соединения гексан и 2-метилпентан – это
а) гомологи б) структурные изомеры
в) пространственные изомеры г) одно и то же вещество
Часть 2
1.Установите соответствие между названиями веществ и типом изомерии
Название веществ | Тип изомерии |
А) 2-метипропановая кислота и бутановая кислота Б) бутин-1 и бутин-2 В) цис-бутен-2 и трас-бутен-2 Г) бутанол-1 и бутанол-2 | 1. 2.изомерия углеродной цепи 3.изомерия положения функциональной группы 4. пространственная изомерия 5. оптическая изомерия 6.межклассовая изомерия |
Источники:
1.ЕГЭ. Химия. Универсальный справочник/ О.В.Машкова.-Москва.ЭКСМО.2016
2.Химия: 50 типовых вариантов для подготовки к ЕГЭ/ Е.В.Савинкина,О.Г.Жинейнова.-М.АСТ,Астрель.2014
А14 Теория строения органических соединений. Изомерия – структурная и пространственная. Гомология
А14 Теория строения органических соединений. Изомерия – структурная и пространственная. Гомология.
1. Бутен-1 и 2-метилпропен являются
1) одним и тем же веществом
2) гомологами
3) структурными изомерами
4) геометрическими изомерами
2. Из приведённых утверждений:
А. Атомы и
группы атомов в молекулах оказывают
друг на друга взаимное влияние.
Атомы и
группы атомов в молекулах оказывают
друг на друга взаимное влияние.
Б. Изомеры — это вещества с разным строением, но одинаковыми свойствами.
1) верно только А
2) верно только Б
3) верно А и Б
4) неверны оба утверждения
3. Из приведённых утверждений:
А. Свойства веществ определяются не только составом, но и строением их молекул.
Б. Изомеры имеют одинаковый состав, но разное строение.
1) верно только А
2) верно только Б
3) верно А и Б
4) неверны оба утверждения
4. Геометрические (цис-транс-) изомеры имеет
1) 2-хлорбутен-2
2) бутин-2
3) пропен
4) гексан
5. Пентен-1 и гексен-1 являются
1) одним и тем же веществом
2) структурными изомерами
3) геометрическими изомерами
4) гомологами
6. Циклобутан и транс-бутен-2 являются
1) геометрическими изомерами
2) одним и тем же веществом
3) гомологами
4) структурными изомерами
7. Геометрические
(цис-транс-) изомеры имеет
Геометрические
(цис-транс-) изомеры имеет
1) 2-метилбутен-1
2) пентен-2
3) пропин
4) бутан
8. Для пентанола не характерна изомерия
1) геометрическая
2) углеродного скелета
3) положения гидроксильной группы
4) межклассовая
9. Для этанола характерна изомерия
1) углеродного скелета
2) геометрическая
3) положения гидроксильной группы
4) межклассовая
10. Гомолог бутаналя — это
1) бутандиол-1,2
2) бутанол-1
3) 2-метилпропаналь
4) гексаналь
11. Гомологами являются
1) глицерин и этиленгликоль
2) уксусная кислота и уксусный альдегид
3) бутен и бутадиен
4) пропаналь и бутаналь
12. Изомерами являются
1) метилацетат и пропановая кислота
2) пропанол и пропанон
3) бутен-1 и пропен-1
4) пентан и циклопентан
13. Ацетальдегид
и этаналь — это
Ацетальдегид
и этаналь — это
1) гомологи
2) структурные изомеры
3) геометрические изомеры
4) одно и то же вещество
14. Гомологом уксусной кислоты является
1) CH3COOH
2) CH2=CH — COOH
3) HOOC — COOH
4) C17H35COOH
15. Изомером циклопентана является
1) циклобутан
2) пентен-1
3) пентанон
4) пентин
16. Этилацетат и бутановая кислота — это
1) гомологи
2) структурные изомеры
3) геометрические изомеры
4) одно и то же вещество
17. Гомологами являются
1) пропанол-1 и пропанол-2
2) формальдегид и ацетальдегид
3) пропановая кислота пропеновая кислота
4) бутан и циклобутан
18. Изомерами являются
1) олеиновая кислота и стеариновая кислота
2) пропанон и ацетон
3) диэтиловый эфир и этиловый спирт
4) циклобутан и бутен-1
19. Метилформиат
и метиловый эфир муравьиной кислоты —
это
Метилформиат
и метиловый эфир муравьиной кислоты —
это
1)гомологи
2) структурные изомеры
3) геометрические изомеры
4) одно и тоже вещество
20. Изомером пропаналя является
1) CH2=CH — CH2OH
2) CH3 — CH2 — CH=O
3) CH3 — CH=O
4) CH3 — CH2 — CH2OH
21. Этановая кислота и уксусная кислота являются
1) гомологами
2) структурными изомерами
3) геометрическими изомерами
4) одним и тем же веществом
22. Соединения бутанол-1 и 2-метилпропанол-2 являются
1) гомологами
2) структурными изомерами
3) геометрическими изомерами
4) одним и тем же веществом
23. Пропеновая кислота метилацетат являются
1) гомологами
2) структурными изомерами
3) пространственными изомерами
4) одним и тем же веществом
24. Толуол и
этилбензол являются
Толуол и
этилбензол являются
1) гомологами
2) структурными изомерами
3) геометрическими изомерами
4) одним и тем же веществом
25. Структурный изомер нормального гексана имеет название
1) 3-этилпентан
2) 2-метилпропан
3) 2,2-диметилпропан
4) 2,2-диметилбутан
26. Метаналь и формальдегид являются
1) гомологами
2) структурными изомерами
3) геометрическими изомерами
4) одним и тем же веществом
27. Структурным изомером бутена-1 является
1) бутин-1
2) 2-метилпропан
3) 2-метилпропен
4) 3-метилбутен-1
28. К соединениям, имеющим общую формулу CnH2n
1) бензол
2) циклогексан
3) гексан
4) гексин
29. Изомером метилциклопентана является
1) пентан
2) гексан
3) гексен
4) гексин
30. Изомерами
являются
Изомерами
являются
1) метилциклопропан и метилпропен
2) бутен-1 и пентен-1
3) метан и этан
4) метилпропан и бутан
Ответы: 1-1, 2-1, 3-3, 4-1, 5-4, 6-4, 7-2, 8-1, 9-4, 10-4, 11-4, 12-1, 13-4, 14-4, 15-2, 16-2, 17-2, 18-4, 19-4, 20-1, 21-4, 22-2, 23-2, 24-1, 25-4, 26-4, 27-3, 28-2, 29-3, 30-1.
10 класс. Химия. Алкены. Строение, номенклатура, изомерия и физические свойства — Алкены. Строение, номенклатура, изомерия и физические свойства
НЕПРЕДЕЛЬНЫЕ, ИЛИ НЕНАСЫЩЕННЫЕ, УГЛЕВОДОРОДЫ РЯДА ЭТИЛЕНА (АЛКЕНЫ, ИЛИ ОЛЕФИНЫ)
Алкены, или олефины (от лат. olefiant — масло — старое название, но широко используемое в химической литературе. Поводом к такому названию послужил хлористый этилен, полученный в XVIII столетии, — жидкое маслянист вещество.) — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь.
Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными.
Алкены образуют гомологический ряд с общей формулой Cnh3n
1. Гомологический ряд алкенов
|
Сnh3n алкен |
Названия, суффикс ЕН, ИЛЕН |
|
C2Н4 |
этен, этилен |
|
C3H6 |
пропен |
|
C4H8 |
бутен |
|
C5h20 |
пентен |
|
C6h22 |
гексен |
Гомологи:
СH2=CH2 этен
СH2=CH—CH3 пропен
Сh3=CH-Ch3-Ch4 бутен-1
Сh3=CH-Ch3-Ch3-СН3 пентен-1
2. Физические свойства
Физические свойства
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
С2 – С4 (газы)
С5 – С17 (жидкости)
С18 – ( твёрдые)
· Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.)
· Легче воды
· С увеличением Mr температуры плавления и кипения увеличиваются
3. Простейшим алкеном является этилен — C2h5
Структурная и электронная формулы этилена имеют вид:
В молекуле этилена подвергаются гибридизации одна s— и две p-орбитали атомов C (sp2-гибридизация).
Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p-орбитали. Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C
Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C
σ — связь. Остальные четыре гибридных орбитали атомов C перекрываются в той же плоскости с четырьмя s-орбиталями атомов H и также образуют четыре σ — связь. Две негибридные p-орбитали атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости σ — связь, т.е. образуется одна П — связь.
По своей природе П — связь резко отличается от σ — связь; П — связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы. Под действием реагентов П — связь легко разрывается.
Молекула этилена симметрична; ядра всех атомов расположены в одной плоскости и валентные углы близки к 120°; расстояние между центрами атомов C равно 0,134 нм.
|
Запомните! SP2 –гибридизация: 1) Плоское тригональное строение 2) Угол – HCH — 120° 3) Длина (-С=С-) связи – 0,134 нм 4) Связи — σ, П 5) Невозможно вращение относительно (-С=С-) связи |
Если атомы соединены двойной связью, то их вращение невозможно без того, чтобы электронные облака П — связь не разомкнулись.
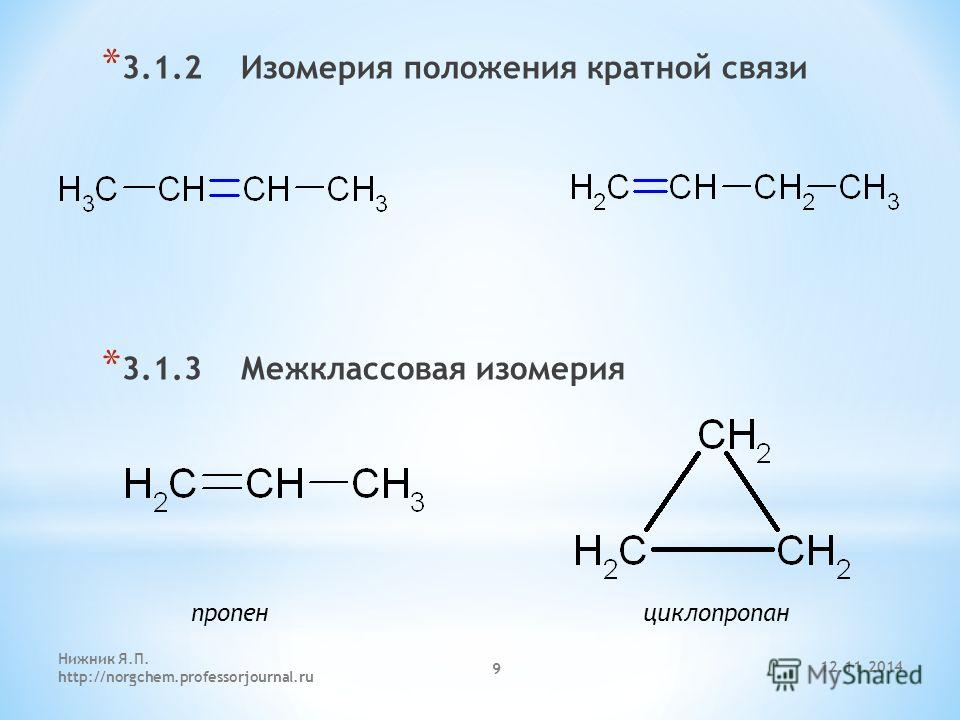
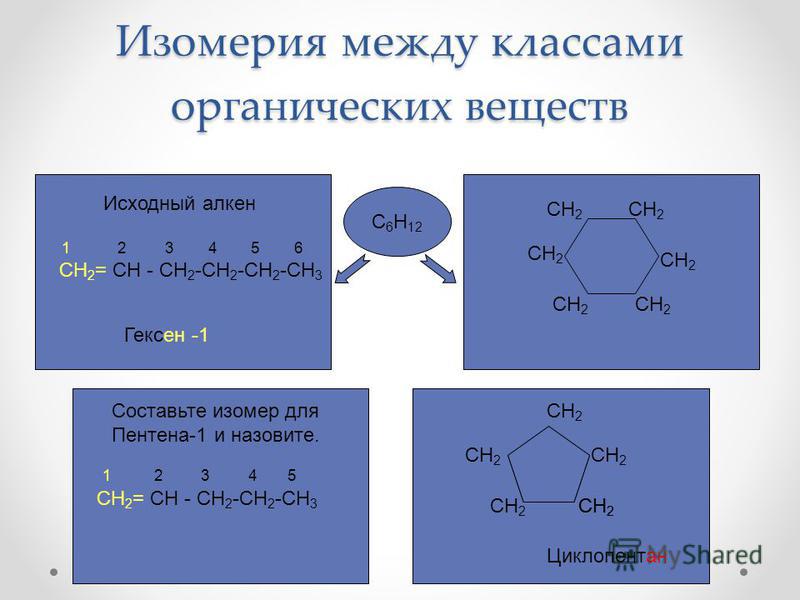
4. Изомерия алкенов
Наряду со структурной изомерией углеродного скелета для алкенов характерны, во-первых, другие разновидности структурной изомерии — изомерия положения кратной связи и межклассовая изомерия.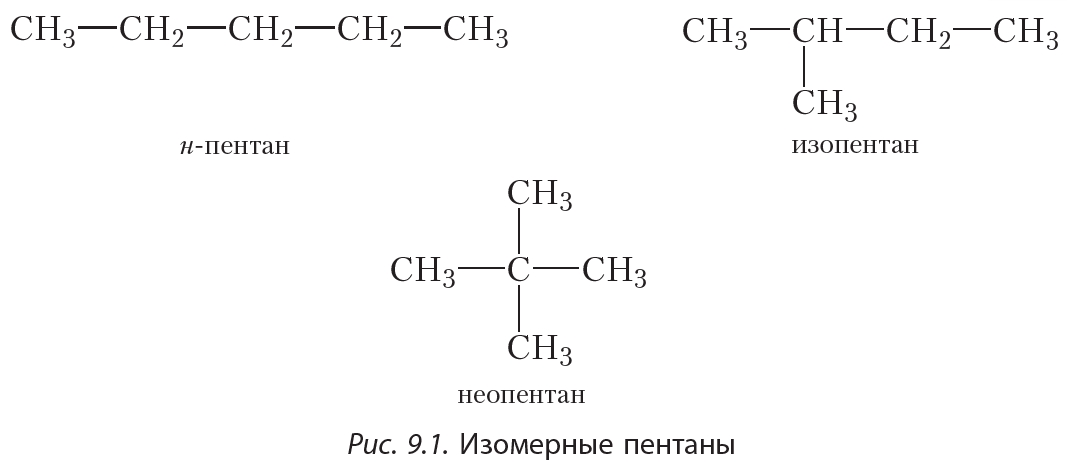
Во-вторых, в ряду алкенов проявляется пространственная изомерия, связанная с различным положением заместителей относительно двойной связи, вокруг которой невозможно внутримолекулярное вращение.
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8):
2. Изомерия положения двойной связи (начиная с С4Н8):
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:
Пространственная изомерия алкенов
Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения p-связи (p-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится возможной цис—транс-изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости p-связи. Так, в молекуле бутена-2СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи вцис -изомере, либо по разные стороны в транс-изомере.
ВНИМАНИЕ! цис-транс— Изомерия не проявляется, если хотя бы один из атомов С при двойной связи имеет 2 одинаковых заместителя.
Например,
бутен-1 СН2=СН–СН2–СН3 не имеет цис— и транс-изомеров, т.к. 1-й атом С связан с двумя одинаковыми атомами Н.
Изомеры цис— и транс— отличаются не только физическими
,
но и химическими свойствами, т. к. сближение или удаление частей молекулы друг от друга в пространстве способствует или препятствует химическому взаимодействию.
к. сближение или удаление частей молекулы друг от друга в пространстве способствует или препятствует химическому взаимодействию.
Иногда цис-транс-изомерию не совсем точно называют геометрической изомерией. Неточность состоит в том, что все пространственные изомеры различаются своей геометрией, а не только цис— и транс-.
5. Номенклатура
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен: этан — этилен, пропан — пропилен и т.д.
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:
Например:
Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
(Н2С=СН— ) винил или этенил
(Н2С=CН—СН2 ) аллил
Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тесты с выбором ответа с решениями
1. Нормальный пентан и 2,2-диметилпропан отличаются
1) порядком соединения атомов в молекуле
2) количественным составом
3) молекулярной массой
4) качественным составом
2. Изомерами являются
1) этилацетат и этиловый эфир муравьиной кислоты
2) пропилацетат и изопропиловый эфир уксусной кислоты
3) ацетат натрия и этилат натрия
4) диэтиловый эфир и этилформиат
3. Может быть гомологом ацетилена
1) С4Н10
2) С2Н4
3) С3Н6
4) С5Н8
4. Видом структурной изомерии не является
Видом структурной изомерии не является
1) изомерия углеродного скелета
2) изомерия положения заместителя
3) цис-транс-изомерия
4) межклассовая изомерия
5. Видом пространственной изомерии является
1) межклассовая изомерия
2) оптическая изомерия
3) изомерия положения заместителя
4) изомерия углеродного скелета
6. Межклассовыми изомерами сложных эфиров являются
1) карбоновые кислоты
2) двухатомные спирты
3) кетоны
4) простые эфиры
7. Соединения метаналь и формальдегид представляют собой
1) гомологи
2) изомеры
3) разные вещества
4) одно и то же вещество
8. Цис-транс-изомерия возможна для
1) бутена-1
2) бутина-2
3) бутена-2
4) бутадиена-1,3
9. Оптическая изомерия возможна для
1) аминоэтановой кислоты
2) 2-аминопропановой кислоты
3) 2,2-дихлорпропановой кислоты
4) 2,2-диметилпропана
10. Укажите число структурных изомеров алкенов состава С5Н10.
Укажите число структурных изомеров алкенов состава С5Н10.
1) 3
2) 4
3) 5
4) 6
Тесты с выбором ответа для самостоятельного решения
11. Ацетилен C2H2 и бензол С6Н6 отличаются
1) качественным составом
2) количественным составом
3) молекулярной массой
4) всеми перечисленными факторами
12. Изомерами являются
1) пропилформиат и пропиловый эфир муравьиной кислоты
2) метилацетат и этилацетат
3) метилэтиловый эфир и метилацетат
4) этиловый эфир пропионовой кислоты и пропиловый эфир уксусной кислоты
13. Является гомологом пентана С5Н12
1) С6Н14
2) С5Н10
3) С4Н8
4) С3Н6
14. Видом структурной изомерии не является
1) изомерия положения заместителя
2) геометрическая изомерия
3) изомерия углеродного скелета
4) межклассовая изомерия
15. Видом пространственной изомерии не является
Видом пространственной изомерии не является
1) геометрическая изомерия
2) изомерия углеродного скелета
3) цис-транс-изомерия
4) оптическая изомерия
16. Межклассовыми изомерами нитроалканов могут быть
1) нитроалкены
2) карбоновые кислоты
3) сложные эфиры
4) аминокислоты
17. Соединения глюкоза и фруктоза представляют собой
1) изомеры
2) гомологи
3) разные вещества
4) одно и то же вещество
18. Соединения этанол и диметиловый эфир представляют собой
1) гомологи
2) структурные изомеры
3) геометрические изомеры
4) одно и то же вещество
19. Цис-бутен-2 и транс-бутен-2 являются изомерами, для которых характерна
1) оптическая изомерия
2) изомерия углеродного скелета
3) геометрическая изомерия
4) изомерия положения заместителя
20. Число вторичных аминов, соответствующих формуле C4H9NH2, равно
1) 2
2) 3
3) 4
4) 5
Ответы на тесты раздела 3. 1
1
1. 1 2. 2 3. 4 4. 3 5. 2 6. 1 7. 4 8. 3 9. 2 10. 3 11. 3 12. 4 13. 1 14. 2 15. 2 16. 4 17. 1 18. 2 19. 3 20. 2
Решения тестов раздела 3.1
Решение 1. Нормальный пентан СН3-СН2-СН2-СН2-СН3 и 2,2-диметилпропан СН3-С(СН3)2-СН3 имеют одинаковую общую формулу С5Н12. Поэтому их молярная масса, а также качественный и количественный составы одинаковы. Различаются эти вещества порядком соединения атомов в молекуле.
Ответ: 1.
Решение 2. Изомеры — это соединения, имеющие одинаковые качественный и количественный составы, но различное строение и потому различные свойства. Запишем формулы перечисленных в задании соединений. Этилацетат СН3СООС2Н5 и этиловый эфир муравьиной кислоты НСООС2Н5 не являются изомерами. Пропилацетат СН3СООСН2СН2СН3 и изопропиловый эфир уксусной кислоты СН3СООСН(СН3)2 являются изомерами. Ацетат натрия CH3COONa и этилат натрия C2H5ONa не являются изомерами. Диэтиловый эфир С2Н5ОС2Н5 и этилформиат НСООС2Н5 не являются изомерами.
Ацетат натрия CH3COONa и этилат натрия C2H5ONa не являются изомерами. Диэтиловый эфир С2Н5ОС2Н5 и этилформиат НСООС2Н5 не являются изомерами.
Ответ: 2.
Решение 3. Гомологи — это соединения, имеющие сходное строение и близкие свойства, но различные составы и молярную массу. Состав ближайших членов гомологического ряда отличается на гомологическую разность СН2. Углеводороды образуют гомологические ряды с общими формулами: СnН2n+2 — алканы, СлН2n — алкены и циклоалкены, СnН2n-2 — алкины, алкадиены, циклоалкены, СnН2n-6 — производные бензола. Кислородсодержащие соединения образуют гомологические ряды с общими формулами: СnН2n+2O — одноатомные спирты и простые эфиры, СnН2nО — альдегиды и кетоны, СnН2nO2 — одноосновные кислоты и сложные эфиры. Общая формула предельных гомологического ряда аминов — CnH2n+3N. Общая формула гомологического ряда аминокислот и нитроалканов — CnH2n+1O2N.
Общая формула предельных гомологического ряда аминов — CnH2n+3N. Общая формула гомологического ряда аминокислот и нитроалканов — CnH2n+1O2N.
Ацетилен является алкином с общей формулой СnН2n-2. Определим общие формулы предлагаемых в задании углеводородов и установим, какой углеводород имеет такую же общую формулу, что и ацетилен. Соединение С4Н10 имеет формулу СNН2n+2 И является алканом. Соединения С2Н4 и С3Н6 имеют формулу СnН2n и являются алкенами или циклоалканами. Соединение С5Н8 имеет формулу СnН2n-2 и может относиться к ал кинам, как и ацетилен.
Ответ: 4.
Решение 4. Виды изомерии: структурная изомерия и пространственная изомерия.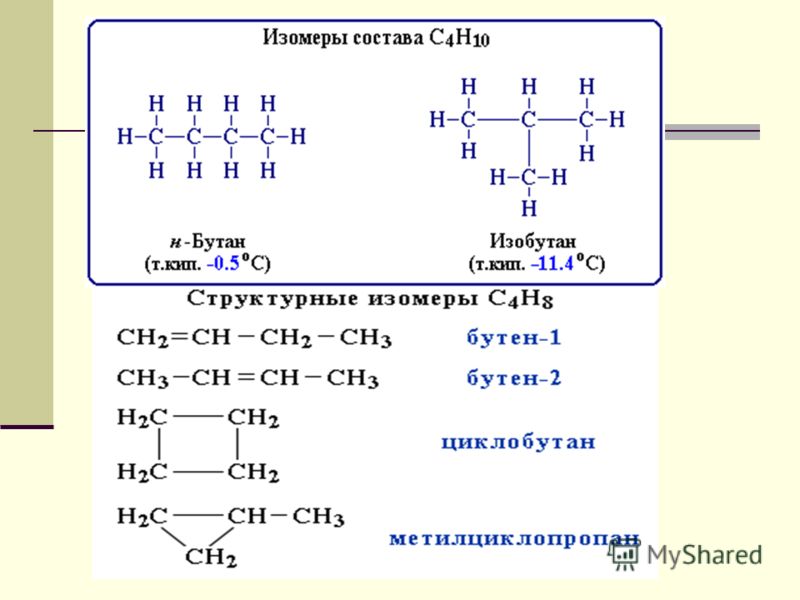 Виды структурной изомерии: изомерия углеродного скелета, изомерия положения заместителя или кратной связи, межклассовая изомерия. Виды пространственной изомерии: геометрическая (цис-, транс-) изомерия и оптическая изомерия. Видно, что из перечисленных в задании видов изомерии к структурной изомерии не относится геометрическая цис-транс-изомерия.
Виды структурной изомерии: изомерия углеродного скелета, изомерия положения заместителя или кратной связи, межклассовая изомерия. Виды пространственной изомерии: геометрическая (цис-, транс-) изомерия и оптическая изомерия. Видно, что из перечисленных в задании видов изомерии к структурной изомерии не относится геометрическая цис-транс-изомерия.
Ответ: 3.
Решение 5. Виды пространственной изомерии: геометрическая (цис-, транс-) изомерия и оптическая изомерия. Оптическая изомерия предполагает наличие в молекуле асси- метрического атома углерода — атома, имеющего четыре различных заместителя.
Ответ: 2.
Решение 6. Межклассовыми изомерами сложных эфиров являются предельные одноосновные карбоновые кислоты, поскольку эти классы соединений имеют одну и ту же общую формулу — CnH2nO2. Так, изомером уксусной кислоты СН3СООН является сложный эфир метилформиат НСООСН3. Межклассовыми изомерами спиртов могут быть простые эфиры.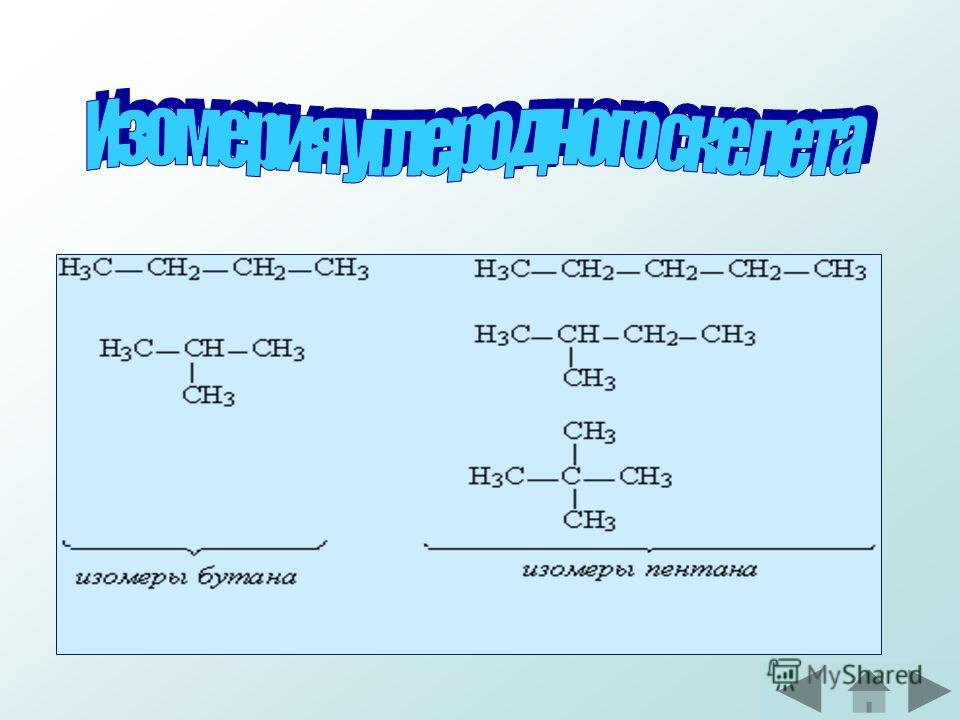 Межклассовыми изомерами альдегидов могут быть кетоны.
Межклассовыми изомерами альдегидов могут быть кетоны.
Ответ: 1.
Решение 7. Метаналь и формальдегид — это соответственно систематическое и традиционное названия одного и того же вещества — НСНО.
Ответ: 4.
Решение 8. Цис-транс-изомерия возможна для алкенов, имеющих на каждом конце двойной связи разные заместители. Для цис-изомера старшие заместители при двойной связи располагаются по одну сторону от двойной связи. Для транс-изомера старшие заместители при двойной связи располагаются по разные стороны от двойной связи. В бутене-1 в положении 1 и в бутадиене-1,3 в положениях 1 и 4 имеются одинаковые заместители — атомы водорода, и цис-транс-изомерия невозможна. В бутине-2 нет двойной связи, и цис-транс-изомерия невозможна. В бутене-2 на каждом конце двойной связи имеются разные заместители: водород и метил. Расположение метильных групп относительно двойной связи определяет цис-транс-изомерию. Цис-транс-изомерия возможна также для замещенных циклоалканов, например для 1,2-диметилциклопентана. В цис-изомере этого соединения обе метильные группы находятся по одну сторону от плоскости цикла, а в траке-изомере — по разные стороны от плоскости цикла.
В цис-изомере этого соединения обе метильные группы находятся по одну сторону от плоскости цикла, а в траке-изомере — по разные стороны от плоскости цикла.
Ответ: 3.
Решение 9. Оптическая изомерия предполагает наличие в молекуле ассиметрического атома углерода — атома, имеющего четыре различных заместителя. В аминоэтановой кислоте CH2(NH2)COOH у атома углерода в положении 2 есть четыре заместителя: -NH2, -СООН и два атома водорода, поэтому оптическая изомерия невозможна. Оптическая изомерия невозможна также для 2,2-дихлорпропановой кислоты (два хлора) и 2,2-диметилпропана (четыре метильные группы). Оптическая изомерия возможна для 2-аминопропановой кислоты СН3СН(NН2)СООН, поскольку у атома углерода в положении 2 имеются четыре разных заместителя: -СН3, -Н, -NH2, -СООН.
Ответ: 2.
Решение 10. В задании предлагается найти число структурных изомеров алкенов состава С5Н10. Это значит, что не следует учитывать межклассовые изомеры (циклопентан и др.) и геометрические изомеры (цис- и транс-пентен-2 и др.). Для поиска числа алкенов следует вначале найти число соответствующих алканов состава С5Н12. Таких соединений три: н-пентан СН3СН2СН2СН2СН3, 2-метилбутан СН3СН(СН3)СН2СН3 и 2,2-диметилпропан СН3С(СН3)2СН3. Затем следует найти число возможных алкенов для каждого алкана. Для н-пентана имеем два алкена: пентен-1 СН2=СНСН2СН2СН3 и пентен-2 СН3СН=СНСН2СН3. Для 2-метилбутана имеем три алкена: 2-метилбутен-1 СН2=С(СН3)СН2СН3, 2-метилбутен-2 СН3С(СН3)=СНСН3, 3-метилбутен-1 СН3СН(СН3)СН=СН2. Для 2,2-диметилпропана алкенов нет.
Это значит, что не следует учитывать межклассовые изомеры (циклопентан и др.) и геометрические изомеры (цис- и транс-пентен-2 и др.). Для поиска числа алкенов следует вначале найти число соответствующих алканов состава С5Н12. Таких соединений три: н-пентан СН3СН2СН2СН2СН3, 2-метилбутан СН3СН(СН3)СН2СН3 и 2,2-диметилпропан СН3С(СН3)2СН3. Затем следует найти число возможных алкенов для каждого алкана. Для н-пентана имеем два алкена: пентен-1 СН2=СНСН2СН2СН3 и пентен-2 СН3СН=СНСН2СН3. Для 2-метилбутана имеем три алкена: 2-метилбутен-1 СН2=С(СН3)СН2СН3, 2-метилбутен-2 СН3С(СН3)=СНСН3, 3-метилбутен-1 СН3СН(СН3)СН=СН2. Для 2,2-диметилпропана алкенов нет. Всего имеется пять алкенов.
Всего имеется пять алкенов.
Ответ: 3.
3,4. Изомеры | Органическая химия 1: Открытый учебник
Геометрическая или цис-транс-изомерия
Мы определили изомеры в очень общем виде как неидентичные молекулы, которые обладают одинаковым числом и типом атомов. Однако есть несколько способов, по которым изомеры могут быть неидентичными. Среди алкенов 1- и 2-бутен являются изомерами положения, поскольку в этих соединениях двойная связь имеет другое положение в углеродной цепи
Большинство, но не все алкены, имеют стереоизомеры, которые не идентичны из-за различного пространственного расположения составляющих атомов.Таким образом, существуют два стереоизомера 2-бутена, которые различаются геометрическим расположением групп, присоединенных к двойной связи. В одном изомере обе метильные группы находятся на одной и той же стороне двойной связи ( цис -2-бутен), а в другом метильные группы находятся на противоположных сторонах двойной связи ( транс — 2-бутен):
Два изомера явно имеют одинаковый структурный каркас, но они различаются расположением этого каркаса в пространстве — отсюда и обозначение стереоизомеров . Они обязаны своим раздельным существованием тому факту, что двойная связь является жесткой, и части молекулы не могут свободно вращаться относительно друг друга вокруг этой связи. Следовательно, изомеры не превращаются друг в друга без разрыва двойной связи, и они существуют как разные соединения, каждое со своими химическими и физическими свойствами. Шариковые модели цис- и транс -2-бутен показаны ниже, а жесткость двойной связи моделируется в модели парой жестких пружин или изогнутых стержней, соединяющих два атома углерода двойная связь.
Они обязаны своим раздельным существованием тому факту, что двойная связь является жесткой, и части молекулы не могут свободно вращаться относительно друг друга вокруг этой связи. Следовательно, изомеры не превращаются друг в друга без разрыва двойной связи, и они существуют как разные соединения, каждое со своими химическими и физическими свойствами. Шариковые модели цис- и транс -2-бутен показаны ниже, а жесткость двойной связи моделируется в модели парой жестких пружин или изогнутых стержней, соединяющих два атома углерода двойная связь.
Вам должно быть ясно, что не будет цис-транс-изомеров алкенов, в которых один конец двойной связи несет идентичные группы. Таким образом, мы не ожидаем наличия цис-транс-изомеров 1-бутена или 2-метилпропена и
Шариковые модели цис- и транс-2-бутена
действительно никто не известен:
Вы можете проверить это, сделав свои собственные модели этих веществ.
Образование кольца также придает жесткость молекулярной структуре, предотвращая вращение вокруг кольцевых связей. В результате возможна стереоизомерия цис-транс-типа. Например, 1,2-диметилциклопропан существует в двух формах, которые различаются расположением двух метильных групп по отношению к кольцу.
В результате возможна стереоизомерия цис-транс-типа. Например, 1,2-диметилциклопропан существует в двух формах, которые различаются расположением двух метильных групп по отношению к кольцу.
Шаровидные модели цис- и транс-изомеров 1,2-диметилциклопропана
В изомере цис обе метильные группы расположены выше (или ниже) плоскости кольца, а в изомере транс они расположены на одну вверху и одну внизу, как показано на рисунке.Взаимное превращение этих изомеров не происходит без разрыва одной или нескольких химических связей.
Стереоизомеры, которые не преобразуются быстро при нормальных условиях и поэтому достаточно стабильны для разделения, в частности, называются изомерами конфигурации . Таким образом, цис — и транс -2-бутен являются конфигурационными изомерами, как цис — и транс -1,2-диметилциклопропан. Термины цис-транс-изомерия или геометрическая изомерия обычно используются для описания конфигурационной изомерии в соединениях с двойными связями и кольцами. Говоря о конфигурации конкретного изомера, мы имеем в виду указать его геометрию. Например, изомер 1,2-дихлорэтена, показанный ниже, имеет транс-конфигурацию; изомер 1,3-дихлорциклобутана имеет цис-конфигурацию:
Говоря о конфигурации конкретного изомера, мы имеем в виду указать его геометрию. Например, изомер 1,2-дихлорэтена, показанный ниже, имеет транс-конфигурацию; изомер 1,3-дихлорциклобутана имеет цис-конфигурацию:
Цис-транс-изомерия встречается очень часто. Согласно одному соглашению, конфигурация сложного алкена принимается соответствующей конфигурации самой длинной непрерывной цепи, когда она проходит через двойную связь .Таким образом, следующее соединение представляет собой транс -4-этил-3-метил-3-гептен, несмотря на то, что две идентичные группы находятся в цис-положении по отношению друг к другу, поскольку самая длинная непрерывная цепь является транс-цепочкой, поскольку она проходит через двойную связь. :
Обратите внимание, что цис-транс-изомерия невозможна при тройной связи углерод-углерод, как для 2-бутина, потому что расположение связей на трехсвязанных атомах углерода является линейным:
Многие соединения имеют более одной двойной связи, и каждое из них может иметь цис- или транс-расположение. Например, 2,4-гексадиен имеет трех различных конфигураций, которые обозначаются как транс-транс, цис-цис и транс-цис. Поскольку два конца этой молекулы одинаково замещены, транс-цис становится идентичным цис-транс:
Например, 2,4-гексадиен имеет трех различных конфигураций, которые обозначаются как транс-транс, цис-цис и транс-цис. Поскольку два конца этой молекулы одинаково замещены, транс-цис становится идентичным цис-транс:
СТРУКТУРНЫЙ ИЗОМЕРИЗМ На этой странице объясняется, что такое структурная изомерия, и рассматриваются некоторые из различных способов возникновения структурных изомеров. Что такое структурная изомерия? Что такое изомеры? Изомеры — это молекулы, которые имеют одну и ту же молекулярную формулу, но имеют другое расположение атомов в пространстве. Это исключает любые другие устройства, которые возникают просто из-за вращения молекулы как целого или вращения вокруг определенных связей. Например, обе следующие молекулы являются одной и той же молекулой. Они не изомеры. Есть также бесконечное количество других возможных способов, которыми эта молекула может скручиваться. Вокруг всех одинарных углерод-углеродных связей происходит полностью свободное вращение. | |
Примечание: Изомерию намного легче понять, если у вас действительно есть несколько моделей, с которыми можно поиграть. Если ваша школа или колледж не дали вам возможности поиграть с молекулярными моделями на ранних этапах курса органической химии, вы можете подумать о приобретении дешевого набора.Модели из Molymod и дешевы, и удобны. Вводного органического набора более чем достаточно. Google molymod , чтобы найти поставщика и больше о них, или взгляните на этот набор, или этот набор, или что-то подобное от Amazon. Поделитесь стоимостью с друзьями, поддерживайте ее в хорошем состоянии и не теряйте ни единой детали и перепродайте ее через eBay или Amazon по окончании курса. Как вариант, возьмите цветной пластилин (или другую пластилин для лепки для детей), использованные спички и сделайте свои собственные.Это дешевле, но получить правильные углы связи труднее. | |
Если бы перед вами была модель молекулы, вам пришлось бы разобрать ее на части и перестроить, если вы хотите сделать изомер этой молекулы. Если вы можете создать явно другую молекулу, просто вращая одинарные связи, это не будет отличаться — это все та же молекула. | |
Примечание: Очень важно, чтобы вы это понимали.Если вы не уверены, то должны приобрести (или изготовить) некоторые модели. | |
Что такое структурные изомеры? При структурной изомерии атомы располагаются совершенно в другом порядке. В этом легче убедиться на конкретных примерах. Далее рассматриваются некоторые пути возникновения структурных изомеров. Типы структурной изомерии Изомерия цепи Эти изомеры возникают из-за возможности разветвления углеродных цепей. Например, есть два изомера бутана, C 4 H 10 . В одном из них атомы углерода образуют «прямую цепь», а в другом — разветвленную. | |
Примечание: Хотя цепь нарисована как прямая, на самом деле она совсем не прямая.Если вам не нравятся способы рисования органических молекул, перейдите по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |
Будьте осторожны, чтобы не нарисовать «ложные» изомеры, которые являются просто скрученными версиями исходной молекулы. В этом легко убедиться на модели. Это пример, который мы уже использовали в верхней части этой страницы. Пентан, C 5 H 12 , имеет три цепных изомера. Если вы думаете, что можете найти какие-то другие, это просто искаженные версии приведенных ниже. Если сомневаетесь, сделайте несколько моделей. Позиционная изомерия При позиционной изомерии основной углеродный скелет остается неизменным, но важные группы перемещаются по нему. Например, есть два структурных изомера с молекулярной формулой C 3 H 7 Br.В одном из них атом брома находится на конце цепи, а в другом — в середине. Если вы создали модель, вы не сможете повернуть одну молекулу, чтобы превратить ее в другую. Другой аналогичный пример встречается в спиртах, таких как C 4 H 9 OH Это единственные две возможности, при условии, что вы придерживаетесь четырехуглеродной цепи, но нет причин, по которым вам следует это делать.Вы легко можете получить смесь изомерии цепи и изомерии положения — вы не ограничены ни одним, ни другим. Итак, два других изомера бутанола: | |
Примечание: Если вас просят нарисовать изомеры на экзамене, важно не ограничиваться цепными изомерами или изомерами положения. Вы должны знать обо всех возможностях. | |
Также можно получить изомеры положения на бензольных кольцах.Рассмотрим молекулярную формулу C 7 H 7 Cl. Изомерия функциональных групп В этом разнообразии структурной изомерии изомеры содержат разные функциональные группы, то есть они принадлежат к разным семействам соединений (разным гомологическим рядам). Например, молекулярная формула C 3 H 6 O может представлять собой пропаналь (альдегид) или пропанон (кетон). Есть и другие возможности для этой же молекулярной формулы — например, у вас может быть двойная связь углерод-углерод (алкен) и группа -ОН (спирт) в одной и той же молекуле. Другой распространенный пример иллюстрируется молекулярной формулой C 3 H 6 O 2 . | |
Примечание: Чтобы повторить предупреждение, данное ранее: если вас просят вывести структурные изомеры из данной молекулярной формулы, не забудьте подумать обо всех возможностях. Можете ли вы разветвить углеродную цепь? Можете ли вы перемещать группу по этой цепочке? Можно ли изготовить более одного типа компаунда? Но будьте осторожны! Если вас попросят изобразить структуры сложных эфиров с молекулярной формулой C 3 H 6 O 2 , вы не получите большого признания за рисование пропановой кислоты, даже если это действительный изомер. . | |
© Джим Кларк 2000 (изменено в ноябре 2012 г.) | |
Алкены: молекулярные и структурные формулы
Алкены: молекулярные и структурные формулы
Алкены включают ряд соединений, которые состоят из атомов углерода и водорода с по крайней мере одной двойной связью в углеродной цепи.Эта группа соединений включает гомологический ряд с общей молекулярной формулой C n H 2 n , где n равно любому целому числу больше единицы.
Простейший алкен, этен, имеет два атома углерода и молекулярную формулу C 2 H 4 . Структурная формула этена
В более длинных алкеновых цепях дополнительные атомы углерода связаны друг с другом одинарными ковалентными связями.Каждый атом углерода также присоединен к достаточному количеству атомов водорода, чтобы образовать в общей сложности четыре одиночные ковалентные связи вокруг себя. В цепях с четырьмя или более атомами углерода двойная связь может находиться в разных положениях, что приводит к образованию структурных изомеров. Например, алкен с молекулярной формулой C 4 H 8 имеет два изомера.
В цепях с четырьмя или более атомами углерода двойная связь может находиться в разных положениях, что приводит к образованию структурных изомеров. Например, алкен с молекулярной формулой C 4 H 8 имеет два изомера.
Стереоизомеры. Помимо структурных изомеров, алкены также образуют стереоизомеры . Поскольку вращение вокруг кратной связи ограничено, группы, присоединенные к атомам углерода с двойной связью, всегда остаются в одних и тех же относительных положениях. Эти «заблокированные» положения позволяют химикам идентифицировать различные изомеры по расположению заместителей. Например, один структурный изомер C 5 H 10 имеет следующие стереоизомеры.
Изомер слева, в котором два заместителя (метильная и этильная группы) находятся на одной и той же стороне двойной связи, называется цис-изомером , а изомер справа с двумя безводородные заместители на противоположных сторонах двойной связи, называются транс-изомером .
Если к атомам углерода двойной связи присоединено более двух заместителей, нельзя использовать систему цис и транс . Для таких химикатов используется обозначение E ‐ Z . В системе E-Z молекула сначала делится пополам по вертикали через двойную связь. Во-вторых, два атома или группы на каждом атоме углерода ранжируются по атомной массе. Более высокий атомный вес имеет приоритет. Например, на рисунке ранжированы атомы углерода и хлора в левой части биссектрисы.Хлор имеет приоритет, потому что он тяжелее. С правой стороны бром превосходит углерод. В-третьих, определяются положения двух атомов более высокого ранга. Если два атома находятся в позиции цис , расположение будет Z (для немецкого zusammen , что означает «вместе»). Если атомы или группы находятся в положении trans , расположение будет E (для немецкого entgegen , что означает «противоположное»).
Название химического вещества на рисунке ( E ) -2-бром-3-хлор-2-бутен.
Выявление различий в окислении высокоэффективных α- и β-диизобутиленовых биотоплив с помощью синхротронной фотоионизационной масс-спектрометрии
Перальта-Яхья, П. П., Чжан Ф., Кардайр, SBd. И Кизлинг, Дж. Д. Микробная инженерия для производства передового биотоплива. Природа 488 , 320–328. https://doi.org/10.1038/nature11478 (2012).
ADS CAS Статья PubMed Google ученый
Чу, С. и Маджумдар, А. Возможности и проблемы для устойчивого энергетического будущего. Природа 488 , 294–303. https://doi.org/10.1038/nature11475 (2012).
ADS CAS Статья PubMed Google ученый
Маурья Р. К. и Агарвал А. К. Экспериментальные исследования рабочих характеристик, характеристик сгорания и выбросов двигателя HCCI, работающего на этаноле и метаноле. Топливный процесс.Technol. 126 , 30–48 (2014).
CAS Статья Google ученый
Foong, T. M. et al. Октановое число этанола, смешанного с бензином и его заменителями. Топливо 115 , 727–739 (2014).
CAS Статья Google ученый
Моради, Ф., Амири, Х., Сулейманян-Зад, С., Эхсани, М. Р.И Карими, К. Улучшение производства ацетона, бутанола и этанола из рисовой соломы путем предварительной обработки кислотой и щелочью. Топливо 112 , 8–13. https://doi.org/10.1016/j.fuel.2013.05.011 (2013).
https://doi.org/10.1016/j.fuel.2013.05.011 (2013).
CAS Статья Google ученый
Лопес-Апарисио, С. и Хак, К. Оценка использования автобусов, работающих на биоэтаноле, на основе проверки загрязнения атмосферного воздуха и измерений на дорогах. Sci. Total Environ. 452–453 , 40–49. https://doi.org/10.1016/j.scitotenv.2013.02.046 (2013).
ADS CAS Статья PubMed Google ученый
Джакумис, Э. Г., Ракопулос, К. Д., Димаратос, А. М. и Ракопулос, Д. С. Выбросы выхлопных газов с этанолом или смесями дизельного топлива с н-бутанолом во время переходного режима: обзор. Обновить. Поддерживать. Energy Rev. 17 , 170–190. https://doi.org/10.1016/j. rser.2012.09.017 (2013).
rser.2012.09.017 (2013).
CAS Статья Google ученый
Chang, Y.-C., Lee, W.-J., Lin, S.-L. И Ван, Л.-К. Зеленая энергия: водосодержащие дизельные смеси ацетон-бутанол-этанол, используемые в дизельных двигателях. Заявл. Энергетика 109 , 182–191. https://doi.org/10.1016/j.apenergy.2013.03.086 (2013).
CAS Статья Google ученый
Van Geem, K. M. et al. Экспериментальное и кинетическое моделирование пиролиза и горения смесей ацетон-бутанол-этанол (ABE). Сжигание. Sci. Technol. 184 , 942–955. https://doi.org/10.1080/00102202.2012.663987 (2012).
CAS Статья Google ученый
Матти-Марик, М. Образование сажи в диффузионном пламени топливной смеси этанол / бензин. Сжигание. Пламя 159 , 170–180 (2012).
CAS Статья Google ученый
Lee, C. et al. О химической кинетике окисления этанола: ударная труба, машина быстрого сжатия и подробное моделирование. Z Phys. Chem. 226 , 1–27. https://doi.org/10.1524/zpch.2012.0185 (2012).
CAS Статья Google ученый
Veloo, P. S., Wang, Y.Л., Эгольфопулос, Ф. Н. и Вестбрук, К. К. Сравнительное экспериментальное и вычислительное исследование пламени метанола, этанола и н-бутанола. Сжигание. Пламя 157 , 1989–2004 гг. https://doi. org/10.1016/j.combustflame.2010.04.001 (2010).
org/10.1016/j.combustflame.2010.04.001 (2010).
CAS Статья Google ученый
Kohse-Hoinghaus, K. et al. Химия сжигания биотоплива: от этанола до биодизеля. Angew. Chem. Int.Эд. 49 , 3572–3597. https://doi.org/10.1002/anie.200
5 (2010).
CAS Статья Google ученый
Якобсон, М. З. Влияние этанола (E85) и бензиновых транспортных средств на рак и смертность в США. Environ. Sci. Technol. 41 , 4150–4157 (2007).
ADS CAS PubMed Статья Google ученый
Маринов Н.М. Подробная химико-кинетическая модель высокотемпературного окисления этанола. Внутр. J. Chem. Кинет. 31 , 183–220. https://doi.org/10.1002/(sici)1097-4601(1999)31:3%3c183::aid-kin3%3e3.0.co;2-x (1999).
Подробная химико-кинетическая модель высокотемпературного окисления этанола. Внутр. J. Chem. Кинет. 31 , 183–220. https://doi.org/10.1002/(sici)1097-4601(1999)31:3%3c183::aid-kin3%3e3.0.co;2-x (1999).
CAS Статья Google ученый
Barak, S. et al. Измерение эффективности высокоэффективного биотоплива Co-Optima по подавлению образования сажи при высокой температуре. Proc. Natl. Акад. Sci. 117 , 3451–3460 (2020).
ADS CAS PubMed Статья Google ученый
Фаррелл Дж. Совместная оптимизация топлива и двигателей. (Национальная лаборатория возобновляемых источников энергии (NREL), Голден, Колорадо (США), 2016 г.).
Хабиб, С., Камран, М. и Рашид, У. Анализ воздействия технологии передачи данных между транспортными средствами и стратегий зарядки электромобилей в распределительных сетях — обзор. J. Источники энергии 277 , 205–214. https://doi.org/10.1016/j.jpowsour.2014.12.020 (2015).
ADS CAS Статья Google ученый
Росс, Д. К. Хранение водорода: главный технологический барьер на пути развития автомобилей на водородных топливных элементах. Вакуум 80 , 1084–1089. https://doi.org/10.1016/j.vacuum.2006.03.030 (2006).
ADS CAS Статья Google ученый
Худибург, Т. У., Ло, Б. Э., Вирт, К., Луйссарт, С. Региональные последствия производства биоэнергетики в лесах для углекислого газа. Nat. Клим. Смена 1 , 419 (2011).
Nat. Клим. Смена 1 , 419 (2011).
ADS CAS Статья Google ученый
Wess, J., Brinek, M. & Boles, E. Улучшение продукции изобутанола дрожжами Saccharomyces cerevisiae путем последовательного блокирования конкурирующих метаболических путей, а также образования этанола и глицерина. Biotechnol. Биотопливо 12 , 173 (2019).
PubMed PubMed Central Статья CAS Google ученый
Исикгор, Ф. Х. и Бесер, К. Р. Лигноцеллюлозная биомасса: устойчивая платформа для производства химикатов и полимеров на биологической основе. Polym. Chem. 6 , 4497–4559 (2015).
CAS Статья Google ученый
Колодзей Р. и Дж., С. Био-изобутанол: биотопливо нового поколения. Переработка углеводородов Сентябрь , 79–85 (2012).
Ниномия Дж. И Головой А. Влияние воздушно-топливного отношения на состав углеводородных выхлопных газов изооктана, диизобутилена, толуола и смеси толуол-н-гептан. Транзакции SAE , 1817–1827 (1969).
Whitmore, F.C. & Wrenn, S. Изомеры в «диизобутилене». I. J.Являюсь. Chem. Soc. 53 , 3136–3142 (1931).
CAS Статья Google ученый
Катерина Л. Чагоя и Блэр, Р. Г. Анализ совместимости обычных материалов уплотнительных колец с биотопливом Co-Optima (2018).
Malde, A. K. et al. Автоматическое построение топологии силового поля (ATB) и репозиторий: версия 1.0. J. Chem. Теория вычисл. 7 , 4026–4037 (2011).
CAS PubMed Статья Google ученый
Каринен Р. С., Лиликангас М. С. и Краузе А. О. Равновесие реакции при изомеризации 2, 4, 4-триметилпентенов. Ind. Eng. Chem. Res. 40 , 1011–1015 (2001).
CAS Статья Google ученый
Джон П.С., Гуан Ю., Ким Ю., Ким С. и Патон Р.S. Прогнозирование энтальпий гомолитической диссоциации связей для органических молекул с почти химической точностью с подсекундными вычислительными затратами. ChemRxiv , 1–18 (2019).
ChemRxiv , 1–18 (2019).
Кондо, Дж. Н., Йода, Э., Исикава, Х., Вакабаяши, Ф. и Домен, К. Кислотные свойства силанольных групп цеолитов оценивали с помощью ИК-исследования реакционного зонда. J. Catal. 191 , 275–281 (2000).
CAS Статья Google ученый
Li, Y., Zhou, C.-W., Somers, KP, Zhang, K. & Curran, HJ Окисление 2-бутена: задержка воспламенения при высоком давлении, исследование кинетического моделирования и сравнение реакционной способности с изобутеном и 1- бутен. Proc. Гореть. Inst. 36 , 403–411 (2017).
CAS Статья Google ученый

Меткалф, В. К., Питц, В. Дж., Карран, Х. Дж., Симми, Дж. М. и Вестбрук, К. К. Разработка подробного химического кинетического механизма для диизобутилена и сравнение времени зажигания ударной трубки. Proc. Гореть. Inst. 31 , 377–384 (2007).
Артикул CAS Google ученый
Taatjes, C.A. et al. «Визуализация» химии горения с помощью мультиплексной синхротронно-фотоионизационной масс-спектрометрии. Phys. Chem. Chem. Phys. 10 , 20–34 (2008).
CAS PubMed Статья Google ученый
Moshammer, K. et al. Обнаружение и идентификация кетогидропероксида (HOOCH 2 OCHO) и других промежуточных продуктов во время низкотемпературного окисления диметилового эфира. J. Phys. Chem. А 119 , 7361–7374 (2015).
J. Phys. Chem. А 119 , 7361–7374 (2015).
CAS PubMed Статья Google ученый
Moshammer, K. et al. Количественное определение кетогидропероксида (HOOCH 2 OCHO) и других неуловимых промежуточных продуктов во время низкотемпературного окисления диметилового эфира. J. Phys. Chem. А 120 , 7890–7901 (2016).
CAS PubMed Статья Google ученый
Шмидт В. Фотоионизация атомов с помощью синхротронного излучения. Rep. Prog. Phys. 55 , 1483 (1992).
ADS CAS Статья Google ученый
Радлер К. и Берковиц Дж. Фотоионизация аргона с высоким разрешением: столкновительные процессы, приводящие к образованию Ar 2 + и Ar + . J. Chem. Phys. 70 , 221–227 (1979).
ADS CAS Статья Google ученый
Battin-Leclerc, F. et al. Экспериментальное подтверждение схемы низкотемпературного окисления алканов. Angew. Chem. Int. Эд. 49 , 3169–3172 (2010).
CAS Статья Google ученый
Шеер А.М., Эскола, А. Дж., Осборн, Д. Л., Шепс, Л. и Таатйес, К. А. Эффекты резонансной стабилизации на автоокисление кетонов: образование изомер-специфичного циклического эфира и кетогидропероксида при низкотемпературном (400–625 К) окислении диэтилкетона. J. Phys. Chem. А 120 , 8625–8636 (2016).
J. Phys. Chem. А 120 , 8625–8636 (2016).
CAS PubMed Статья Google ученый
Vasu, S. S., Welz, O., Osborn, D. L. & Taatjes, C.A.Синхротронные фотоионизационные измерения химии самовоспламенения биотоплива. (Национальная лаборатория Сандии (SNL-CA), Ливермор, Калифорния (США), 2011 г.).
Лэмптон, М., Зигмунд, О. и Раффанти, Р. Планарный метод считывания с двойной линией задержки для микроканальных пластинчатых детекторов. IEEE Trans. Nucl. Sci. 37 , 1548–1549 (1990).
ADS Статья Google ученый
Лэмптон, М., Зигмунд, О. и Раффанти, Р. Аноды линии задержки для микроканальных пластинчатых спектрометров. Rev. Sci. Instrum. 58 , 2298–2305 (1987).
и Раффанти, Р. Аноды линии задержки для микроканальных пластинчатых спектрометров. Rev. Sci. Instrum. 58 , 2298–2305 (1987).
ADS CAS Статья Google ученый
Yang, B. et al. Абсолютные сечения фотоионизации некоторых интермедиатов горения. Внутр. J. Mass Spectrom. 309 , 118–128 (2012).
CAS Статья Google ученый
Хейнс, В. М. Справочник CRC по химии и физике . (CRC Press, 2014).
Чжоу, З., Се, М., Ван, З. и Ци, Ф. Определение абсолютных сечений фотоионизации ароматических соединений и ароматических производных. Rapid Commun. Масс-спектрометрия. Int. J. Посвященный Rapid Dissem. Актуальные исследования в масс-спектрометрии 23 , 3994–4002 (2009).
CAS Google ученый
Кирк Р. и Отмер Д. (John Wiley & Sons, 1992).
Ван, Дж., Янг, Б., Кул, Т. А., Хансен, Н. и Каспер, Т. Около пороговые абсолютные сечения фотоионизации некоторых промежуточных продуктов реакции при горении. Внутр. J. Mass Spectrom. 269 , 210–220 (2008).
CAS Статья Google ученый
Виберг, К. Б., Крокер, Л. С. и Морган, К. М. Термохимические исследования карбонильных соединений 5.Энтальпии восстановления карбонильных групп. J. Am. Chem. Soc. 113 , 3447–3450 (1991).
CAS Статья Google ученый
Li. Расчетное сечение фотоионизации пропен-2-ола (2011).
Джобак К.Г. и Рид Р.С. Оценка свойств чистых компонентов на основе групповых вкладов. Chem. Англ. Commun. 57 , 233–243 (1987).
CAS Статья Google ученый
Сави, Дж. Д., Велц, О., Таатйес, К. А. и Осборн, Д. Л. Новые механистические открытия реакции O ( 3 P) + пропен, полученные с помощью масс-спектрометрии с мультиплексной фотоионизацией. Phys. Chem. Chem. Phys. 14 , 10410–10423 (2012).
CAS PubMed Статья Google ученый
Синке Г. и Хильденбранд Д. Теплота образования оксида пропилена. J. Chem. Англ. Данные 7 , 74–74 (1962).
CAS Статья Google ученый
Стил В., Кирико Р., Нгуен А., Хоссенлопп И. и Смит Н. Определение энтальпий образования некоторых чистых соединений идеального газа (Национальный институт нефти и Energy Research, Bartlesville, OK (США), 1989).
Google ученый
Ольшлегер М. А., Дэвидсон Д. Ф. и Джеффрис Дж. Б. Измерение температуры с использованием поглощения углекислого газа ультрафиолетовым лазером за ударными волнами. Заявл. Опт. 44 , 6599–6605 (2005).
ADS CAS PubMed Статья Google ученый
Fathi, Y., Price, C. & Meloni, G. Исследование низкотемпературной синхротронной фотоионизации окисления 2-метил-3-бутен-2-ола (MBO), инициированного O ( 3 P ) атомов в интервале 298–650 К. J. Phys. Chem. А 121 , 2936–2950 (2017).
CAS PubMed Статья Google ученый
Трифель Б., Смирнов В., Глориозов И., Курбанов Н. и Мамедов Ф. Механизм взаимодействия трихлоруксусной кислоты и ненасыщенных китонов. Вестн. Моск. Ун-т, сер. 2: Хим. 33 , 547–550 (1992).
CAS Google ученый
Персон, Дж. К. и Николь, П. П. Изотопные эффекты в выходах фотоионизации и сечениях поглощения ацетилена, пропина и пропена. J. Chem. Phys. 53 , 1767–1774 (1970).
ADS CAS Статья Google ученый
Lacher, J., Walden, C., Lea, K. & Park, J. Теплоты паровой фазы гидробромирования циклопропана и пропилена. J. Am. Chem. Soc. 72 , 331–333 (1950).
CAS Статья Google ученый
Просен, Э. Дж., Фрэнсис В. Марон и Россини, Ф. Д. Теплота сгорания, образования и изомеризации Ten C 4 углеводородов. Журнал исследований Национального бюро стандартов 46 , 106–112 (1951).
Прайс, К., Фати, Ю. и Мелони, Г. Абсолютные сечения фотоионизации двух циклических кетонов: циклопентанона и циклогексанона. J. Mass Spectrom. 52 , 259–270 (2017).
ADS CAS PubMed Статья Google ученый
Пелл, А. и Пилчер, Г. Измерение теплоты сгорания с помощью калориметрии пламени. Часть 3 — этиленоксид, триметиленоксид, тетрагидрофуран и тетрагидропия. Пер. Faraday Soc. 61 , 71–77 (1965).
CAS Статья Google ученый
Коидзуми, Х. Преобладающий канал распада сверхвозбужденных органических молекул. J. Chem. Phys. 95 , 5846–5852 (1991).
ADS CAS Статья Google ученый
Просен, Э., Марон, Ф. и Россини, Ф. Теплоты сгорания, образования и инсомеризации 10 C-4 углеводородов. J. Res. Natl. Стандарты бюро 46 , 106–112 (1951).
CAS Статья Google ученый
Lossing, F. P. Свободные радикалы методом масс-спектрометрии. XLV. Потенциалы ионизации и теплоты образования радикалов и ионов C3h4, C3H5, C4H7. Банка. J. Chem. 50 , 3973–3981 (1972).
CAS Статья Google ученый
Гуд У., Мур Р., Осборн А. и Дуслин Д. Энтальпии образования этилциклобутана, метиленциклобутана и 1,1-диметилциклопропана. J. Chem.Термодин. 6 , 303–310 (1974).
Артикул Google ученый
Lemmon, E., McLinden, M., Friend, D., Linstrom, P. & Mallard, W. Веб-книга по химии NIST, стандартная справочная база данных Nist номер 69 (Национальный институт стандартов и технологий, Гейтерсбург, 2011).
Google ученый
Good, W. & Smith, N.Энтальпии сгорания изомерных пентенов в жидком состоянии. Предупреждение калориметрам горения о сушке образца. J. Chem. Термодин. 11 , 111–118 (1979).
CAS Статья Google ученый
McCullough, J., Pennington, R., Smith, J., Hossenlopp, I. & Waddington, G. Термодинамика циклопентана, метилциклопентана и 1, цис-3-диметилциклопентана: проверка концепции псевдовращения . J. Am. Chem. Soc. 81 , 5880–5883 (1959).
CAS Статья Google ученый
Cool, T. A., Wang, J., Nakajima, K., Taatjes, C. A. & Mcllroy, A. Сечения фотоионизации промежуточных продуктов реакции при горении углеводородов. Внутр. J. Mass Spectrom. 247 , 18–27 (2005).
CAS Статья Google ученый
Виберг, К. Б. и Хао, С. Энтальпии гидратации алкенов. 4. Образование ациклических трет-спиртов. J. Org. Chem. 56 , 5108–5110 (1991).
CAS Статья Google ученый
Прозен, Э., Джонсон, В. и Россини, Ф. Теплоты образования и горения нормальных алкилциклопентанов и циклогексанов и приращение на группу CH 2 для нескольких гомологических рядов углеводородов. J. Res. Natl. Стандарты бюро 37 , 51–56 (1946).
CAS Статья Google ученый
Гуд, У. Д. и Смит, Н. К. Энтальпии сгорания толуола, бензола, циклогексана, циклогексена, метилциклопентана, 1-метилциклопентена и н-гексана. J. Chem. Англ. Данные 14 , 102–106 (1969).
CAS Статья Google ученый
Роджерс Д., Крукс Э. и Дейрунгруанг К. Энтальпии гидрирования гексенов. J. Chem. Термодин. 19 , 1209–1215 (1987).
CAS Статья Google ученый
Van-Chin-Syan, Y. et al. Термодинамические свойства некоторых кислот и альдегидов акрилового ряда. Русс. J. Phys. Chem. 70 , 1789–1794 (1996).
Google ученый
Goulay, F. et al. Образование диметилкетена и метакролеина реакцией радикала CH с ацетоном. Phys. Chem. Chem. Phys. 15 , 4049–4058 (2013).
CAS PubMed Статья Google ученый
Sumathi, R. & Green, W.H. Термодинамические свойства кетенов: значения групповой аддитивности из квантово-химических расчетов. J. Phys. Chem. А 106 , 7937–7949 (2002).
CAS Статья Google ученый
Oehlschlaeger, M. A., Davidson, D. F. & Jeffries, J. B. Appl. Опт. 44 , 6599 (2005).
ADS CAS PubMed Статья Google ученый
Welz, O. et al. Химия низкотемпературного горения биотоплива: пути в исходной химии низкотемпературного (550 K – 750 K) окисления изопентанола. Phys. Chem. Chem. Phys. 14 , 3112–3127 (2012).
CAS PubMed Статья Google ученый
Гатри, Дж. П. Константы равновесия для ряда простых альдольных конденсаций и линейные отношения свободной энергии с другими реакциями присоединения карбонила. Банка. J. Chem. 56 , 962–973 (1978).
CAS Статья Google ученый
Wang, Z. et al. Дополнительные пути разветвления цепи при низкотемпературном окислении разветвленных алканов. Сжигание. Пламя 164 , 386–396 (2016).
CAS Статья Google ученый
Murray, K. K. et al. Определения терминов, относящихся к масс-спектрометрии (Рекомендации ИЮПАК 2013 г.). Pure Appl. Chem. 85 , 1515–1609 (2013).
CAS Статья Google ученый
Парр, Г. Р. и Тейлор, Дж. У. Фотоионизационный масс-спектрометр, использующий систему отбора проб молекулярным пучком высокой интенсивности и синхротронное излучение. Rev. Sci. Instrum. 44 , 1578–1583 (1973).
ADS CAS Статья Google ученый
Egolfopoulos, F. N. et al. Достижения и проблемы в экспериментах с ламинарным пламенем и их значение для химии горения. Prog.Энергия сгорания. Sci. 43 , 36–67 (2014).
Артикул Google ученый
Turecek, F. & Havlas, Z. Термохимия нестабильных енолов: эквивалент группы O- (Cd) (H). J. Org. Chem. 51 , 4066–4067 (1986).
CAS Статья Google ученый
Саве, Дж. Д., Велц, О., Таатес, К. А., Осборн, Д.L. Новое понимание механизма реакции O ( 3 P) + пропен на основе масс-спектрометрии с мультиплексной фотоионизацией. Phys. Chem. Chem. Phys. 14 , 10410–10423 (2012).
CAS PubMed Статья Google ученый
Фрейтас, В. Л., да Силва, М. Д. Р. и Либман, Дж. Ф. Энтальпия образования изомерных 2, 3- и 2,5-дигидрофурана. J. Chem. Термодин. 97 , 135–136 (2016).
CAS Статья Google ученый
Fathi, Y., Price, C. & Meloni, G. Исследование низкотемпературной синхротронной фотоионизации окисления 2-метил-3-бутен-2-ола (mbo), инициированного атомами o (3p) в диапазон 298–650 К. J. Phys. Chem. А 121 , 2936–2950 (2017).
CAS PubMed Статья Google ученый
Дас, А., Френкель, М., Гадалла, Н., Марш, К. и Уилхойт, Р. Термодинамические таблицы TRC; Центр термодинамических исследований, Техасский университет A&M: College Station, TX, 1994. Для этой ссылки нет соответствующей записи [Google Scholar] .
Zhu, L., Cronin, T. & Narang, A. Зависимый от длины волны фотолиз i-пентаналя и t-пентаналя от 280 до 330 нм. J. Phys. Chem. А 103 , 7248–7253 (1999).
CAS Статья Google ученый
Зайцау, Д. Х. и др. Соотношения структура – свойство в ионных жидкостях: влияние разветвленных и циклических групп на энтальпии испарения илс на основе имидазолия. J. Chem. Термодин. 93 , 151–156 (2016).
CAS Статья Google ученый
Good, W. Энтальпии сгорания и образования некоторых алкилциклопропанов. J. Chem. Термодин. 3 , 539–546 (1971).
CAS Статья Google ученый
Duchowicz, P. & Castro, E. Энтальпии образования углеводородов по расчетам ab initio улучшены за счет параметров связи. J. Korean Chem. Soc. 43 , 621–627 (1999).
CAS Google ученый
Бейкер Р., Болдуин Р. и Уокер Р. В симпозиуме (международном) по горению. 291–299 (Elsevier).
Цанг У. База химических кинетических данных для химии горения. Часть 4. Изобутан. J. Phys. Chem. Справочные данные 19 , 1–68 (1990).
ADS CAS Статья Google ученый
Park, S. et al. Комплексное экспериментальное и модельное исследование горения 2-метилбутанола. Сжигание. Пламя 162 , 2166–2176 (2015).
CAS Статья Google ученый
Lamprecht, A., Atakan, B. & Kohse-Höö, K. Обогащенное топливом пламя пропена и ацетилена: сравнение химического состава пламени. Сжигание. Пламя 122 , 483–491 (2000).
CAS Статья Google ученый
Сантос, Р. К., Леал, Дж. П. и Симоес, Дж. А. М. Аддитивные методы для прогнозирования термохимических свойств.Возвращение к методу Лайдлера. 2. Углеводороды, включая замещенные циклические соединения. J. Chem. Термодин. 41 , 1356–1373 (2009).
CAS Статья Google ученый
Эстиллор, А. Д., Висгер, Л. М. и Сьюитс, А. Г. Срезы постоянного тока с перекрестным лучом для получения изображений реакций атома хлора с изомерами пентана. J. Chem. Phys. 132 , 164313 (2010).
ADS PubMed Статья CAS Google ученый
Tsang, W. База химических кинетических данных для раздела химии горения V. Propene. J. Phys. Chem. Справочные данные 20 , 221–273 (1991).
ADS CAS Статья Google ученый
Лифшиц А. и Бидани М. Термические реакции циклических эфиров при высоких температурах. 5. Пиролиз 2,3-дигидрофурана за отраженными ударами. J. Phys. Chem. 93 , 1139–1144 (1989).
CAS Статья Google ученый
Yasunaga, K. et al. Подробные химические кинетические механизмы этилметилового, метил-трет-бутилового и этил-трет-бутилового эфиров: важность реакций одномолекулярного элиминирования. Сжигание. Пламя 158 , 1032–1036 (2011).
CAS Статья Google ученый
Де Брюйкер Р., Herbinet, O., Carstensen, H.-H., Battin-Leclerc, F. & Van Geem, KM Понимание реакционной способности ненасыщенных спиртов: экспериментальное и кинетическое моделирование пиролиза и окисления 3-метил-2-бутенола и 3-метил-3-бутенол. Сжигание. Пламя 171 , 237–251 (2016).
Артикул CAS Google ученый
Цанг, В. и Хэмпсон, Р. База химических кинетических данных для горения.Часть I. Метан и родственные соединения. J. Phys. Chem. Справочные данные 15 , 1087–1279 (1986).
ADS CAS Статья Google ученый
Варнац Дж. В Химия горения 197–360 (Springer, 1984).
Sirjean, B., Glaude, P.-A., Ruiz-Lopez, M. & Fournet, R. Подробное кинетическое исследование раскрытия цикла циклоалканов с помощью расчетов CBS-QB3. Дж.Phys. Chem. А 110 , 12693–12704 (2006).
CAS PubMed Статья Google ученый
Калра Б. Л. и Льюис Д. К. Кинетика термической изомеризации 1,1-диметилциклопропана. Внутр. J. Chem. Кинет. 33 , 853–858 (2001).
CAS Статья Google ученый
Флауэрс, М.С. Кинетика термического газофазного разложения 1,2-эпоксипропана. J. Chem. Soc. Faraday Trans. Phys. Chem. Конденс. Фазы 73 , 1927–1935 (1977).
CAS Google ученый
Fenard, Y., Boumehdi, M. A. & Vanhove, G. Экспериментальное и кинетическое моделирование окисления 2-метилтетрагидрофурана в условиях, соответствующих двигателю. Сжигание. Пламя 178 , 168–181 (2017).
CAS Статья Google ученый
Пользовательский поиск назад к ORGANIC links Уровень 1-Алканы Уровень 2-Алкены Уровень 3 Алкины Уровень 4 Бензены Уровень 5 Диены Циклические уровни 6 Триены Соединения
За прошедшие годы я обнаружил, что простое приведение правил является непосильной задачей для наименования органических соединений.Если вам просто нужны правила, нажмите здесь ===> ПРАВИЛА. Я собираюсь провести вас через все изомеры метана через октан. Алканы — насыщенные (все одинарные связи) углеводороды (только водород и углерод). Правило именования — все они заканчиваются на «-ane». Общая формула: C n H 2n + 2 , n — количество атомов углерода, используемое для определения количества атомов водорода. Пример n = 5, поэтому H = (2 (5) +2) = 12 C 5 H 12
Гомологическая серия — Вы заметили, что по мере того, как вы спускаетесь от CH 4 к C 2 H 6 (и так далее), следующий член отличается на 1 углерод и 2 водорода? Теперь у молекулярных формул есть ограничения.Вы никогда не знаете, как устроена молекула. Итак, давайте посмотрим на структурные формулы и назовем каждую. Первые 3 алкана не имеют изомеров (их можно получить только в одном направлении). Хороший вопрос с несколькими вариантами ответов. Именование соединений — игнорируйте все водороды. Мы беспокоимся только об атомах углерода. Изомеры бутана C 4 H 10 Правило № 1 — Назовите самую длинную непрерывную цепочку атомов углерода и завершите ее -аном .
Правило № 2- Остальным боковым цепям будет присвоено окончание -yl . При именовании они размещаются перед самой длинной цепочкой.
Изомеры пентана C 5 H 12 Правило № 3- Множественные боковые цепи будут использовать префиксы 2 — ди-, 3 — три-, 4 — тетра- и так далее.
Изомеры 184 6184 9018 гексана C 14
21 Вы заметили, что мы должны нумеровать справа? Если бы мы назвали слева, это был бы 3,3-диметилбутан. 2 + 2 против 3 + 3 всегда используются самые низкие числа.
Изомеры гептана С 7 H 16
|
| 3-метилгексан |
| 2,2-диметилпентан |
| 3,385 диметилпентан |
| 2,2,3-триметилбутан |
И снова каждой боковой цепи присваивается номер.Так как у нас 3, одна углеродная боковая цепь, он называется «триметил». Вам лучше иметь 3 #, когда у вас есть префикс tri.
| этилпентан |
Имеет 1 (2-углеродную) боковую цепь. Это НЕ диметил. Диметил представляет собой 2 (1-углеродные) боковые цепи. Это «этильная» группа.
Обратите внимание, что я не использовал номер. Если переместить один атом углерода влево …
| 3-метилгексан |
Самая длинная цепь становится гексаном.
Изомеры октана С 8 H 18
| н-октан |
| 2-метилгептан |
| 4-метилгептан |
| 2,2-диметилгексан |
| 2,3-диметилгексан |
| диметил-гексан |
| 2,5-диметилгексан |
| 3,3-диметилгексан |
| 3,4-диметилгексан |
(номер не требуется)
| 2,2,3-триметилпентан |
| 2,2,4-триметилпентан |
| 2,3,3-триметилпентан (пронумеровать справа) |
| 2,3,4 -триметилпентан |
Правило № 5- Если есть 2 разные боковые цепи, назовите их в алфавитном порядке, используя префикс углерода (мет, эт..).
| этил-2-метилпентан (этил не нуждается в #, он может работать только на угле 3) |
| этил-3-метилпентан |
| тетраметилбутан (не требуется # 4 атома углерода должны занимать 2,2,3,3) |
Алканы 1-го уровня Алкены 2-го уровня Алкины 3-го уровня Бензены 4-го уровня Диены 6-го уровня Триены 7-го уровня Циклические соединения
назад к ОРГАНИЧЕСКИМ ссылкам
Демонстрационные химические видео
Органические молекулярные структуры | Органические молекулы
4.2 Органические молекулярные структуры (ESCK4)
Особые свойства углерода (ESCK5)
Углерод обладает рядом уникальных свойств, которые влияют на его поведение и связь с другими атомами:
Углерод (рис. 4.2) имеет четырех валентных электронов , что означает, что каждый атом углерода может образовывать максимум четыре связи с другими атомами. Из-за количества связей, которые углерод может образовывать с другими атомами, органические соединения могут быть очень сложными.
Углерод может образовывать связи с другими атомами углерода с образованием одинарных, двойных или тройных ковалентных связей.
Углерод также может образовывать связи с другими атомами, такими как водород, кислород, азот и галогены.
Углерод может связываться с образованием молекул с прямой, разветвленной и циклической цепью.
Рис. 4.2: Углерод (a) в периодической таблице Менделеева и (b) в виде точек Льюиса.
Из-за этого могут образовываться длинные цепочечные структуры . Это известно как цепочка , — соединение атомов одного и того же элемента в более длинные цепочки. Эти цепи могут быть неразветвленными (рис. 4.3) или разветвленными (имеют разветвленную группу, рис. 4.4) и могут содержать только одинарные углерод-углеродные связи, а также двойные и тройные углерод-углеродные связи.
Рисунок 4.3: Неразветвленные углеродные цепи с (a), одинарными углерод-углеродными связями, (b) одинарными и двойными углерод-углеродными связями и (c) одинарными и тройными углерод-углеродными связями.
Рис. 4.4: Разветвленные углеродные цепи с (a), одинарными углерод-углеродными связями, (b) одинарными и двойными углерод-углеродными связями и (c) одинарными и тройными углерод-углеродными связями.
Из-за своего положения в периодической таблице, большинство связей, которые углерод образует с другими атомами, являются ковалентными . Подумайте, например, о связке \ (\ text {C} — \ text {C} \). Разница в электроотрицательности между двумя атомами равна нулю, так что это чистая ковалентная связь.В случае связи \ (\ text {C} — \ text {H} \), разница в электроотрицательности между углеродом (\ (\ text {2,5} \)) и водородом (\ (\ text {2 , 2} \)) настолько мал, что связи \ (\ text {C} — \ text {H} \) почти чисто ковалентны. В результате большинство органических соединений неполярны. Это влияет на некоторые свойства органических соединений.
Источники углерода
Основным источником углерода в органических соединениях является двуокиси углерода в атмосфере.Растения используют солнечный свет для преобразования углекислого газа и воды (неорганических соединений) в сахар (органическое соединение) в процессе фотосинтеза .
\ (6 \ text {CO} _ {2} (\ text {g}) + 6 \ text {H} _ {2} \ text {O} (\ text {l}) \) \ (\ to \ ) \ (\ text {C} _ {6} \ text {H} _ {12} \ text {O} _ {6} (\ text {aq}) + 6 \ text {O} _ {2} (\ текст {g}) \)
Таким образом, растения могут производить свои собственные органические соединения посредством фотосинтеза, в то время как животные питаются растениями или растительными продуктами, чтобы получить органические соединения, необходимые им для выживания.
Другими важными источниками углерода являются ископаемых видов топлива , таких как уголь, нефть и природный газ. Это связано с тем, что ископаемое топливо само формируется из разлагающихся останков мертвых организмов (дополнительную информацию об ископаемом топливе см. В классе 11).
Представляющие органические молекулы (ESCK6)
Есть несколько способов представления органических соединений. Полезно знать все это, чтобы вы могли распознать молекулу независимо от того, как она изображена.Существует четыре основных способа представления двухмерного соединения (на вашей странице). Мы будем использовать примеры двух молекул, называемых 2-метилпропаном и бутаном, чтобы объяснить разницу между ними.
Структурная формула
Структурная формула органического соединения показывает каждую связь между каждым атомом в молекуле. Каждая облигация представлена линией. Структурные формулы 2-метилпропана и бутана показаны на рисунке 4.5.
Рисунок 4.5. Структурная формула (а), 2-метилпропана и (б), бутана.
Рис. 4.6: Различные способы представления связи атома углерода с четырьмя атомами водорода.
Полуструктурная формула
Можно понять структуру органической молекулы, не выписывая все углерод-водородные связи. Такой способ написания структуры называется полуструктурной формулой и показан на рисунке 4.7.
Рисунок 4.7. Полуструктурные формулы (а), 2-метилпропана и (b), бутана.
Сравните эти полуструктурные представления со структурными представлениями, показанными на рис: organic: структурная формула.
Заместитель — это атом или группа атомов, которые заменяют атом водорода в основной цепи органической молекулы. Следовательно, разветвленная группа является заместителем. Атом галогена также может быть заместителем.
Сводная структурная формула
Также возможно изобразить молекулу, вообще не показывая никаких связей между атомами.Это называется сжатой структурной формулой (рис. 4.8). Что касается полуструктурного представления, атомы углерода сгруппированы с атомами водорода, непосредственно связанными с ним. Связи между этими группами не показаны. Разветвленные или замещающие группы показаны в скобках после атома углерода, с которым они связаны.
Рис. 4.8: Сводные структурные формулы (a), 2-метилпропана и (b), бутана.
Обратите внимание, что на Рисунке 4.8 (b) две группы \ (\ text {CH} _ {2} \) могут быть сокращены до \ ((\ text {CH} _ {2}) _ {2} \). Сравните эти сжатые структурные представления со структурными (рис: органическое: структурная формула) и полуструктурными представлениями (рис. 4.7).
Молекулярная формула
Молекулярная формула соединения показывает, сколько атомов каждого типа находится в молекуле. Номер каждого атома записывается нижним индексом после атомного символа. Молекулярная формула 2-метилпропана:
\ (\ text {C} _ {4} \ text {H} _ {10} \)
Это означает, что каждая молекула 2-метилпропана состоит из четырех атомов углерода и десяти атомов водорода.Молекулярная формула бутана также \ (\ text {C} _ {4} \ text {H} _ {10} \). Молекулярная формула не дает структурной информации о соединении.
Конечно, молекулы не двумерны, поэтому ниже показано несколько примеров различных способов представления метана (\ (\ text {CH} _ {4} \), рис. 4.9) и этана (\ (\ text {C}) _ {2} \ text {H} _ {6} \), рисунок 4.10).
Рисунок 4.9: Различные способы представления метана.
Рисунок 4.10: Различные способы представления этана.
Это означает, что бутан можно представить в двух измерениях, как показано на рисунке 4.11 (a), но на самом деле это больше похоже на трехмерное представление, показанное на рисунке 4.11 (b).
(a) Двумерное и (b) трехмерное изображения бутана.
Siyavula Practice дает вам доступ к неограниченному количеству вопросов с ответами, которые помогут вам в обучении. Тренируйтесь где угодно, когда угодно и на любом устройстве!
Зарегистрируйтесь сейчасПредставление органических соединений
Упражнение 4.1\ (\ text {CH} _ {3} \ text {CH} _ {2} \ text {CH} _ {3} \)
Структурная формула:
Молекулярная формула: \ (\ text {C} _ {3} \ text {H} _ {8} \)
\ (\ text {CH} _ {3} \ text {CH} _ {2} \ text {CH} (\ text {CH} _ {3}) \ text {CH} _ {3} \)
Структурная формула:
Хотя конденсированная формула была написана с метильной группой, присоединенной к третьему атому углерода, если мы посмотрим на формулу справа налево, вы увидите, что она присоединена ко второму атому углерода, и поэтому любое из представленных выше представлений приемлемо.
Молекулярная формула: \ (\ text {C} _ {5} \ text {H} _ {12} \)
\ (\ text {CH} _ {3} \ text {CH} _ {3} \)
Структурная формула:
Молекулярная формула: \ (\ text {C} _ {2} \ text {H} _ {6} \)
Концентрированный структурный: \ (\ text {CH} _ {3} \ text {CHCHCH} _ {3} \)
Молекулярный: \ (\ text {C} _ {4} \ text {H} _ {8} \)
Концентрированный структурный: \ (\ text {CH} _ {2} \ text {CHCH} (\ text {CH} _ {3}) \ text {CH} _ {3} \)
Молекулярный: \ (\ text {C} _ {5} \ text {H} _ {10} \)
Приведите две возможные структурные формулы соединения с молекулярной формулой \ (\ text {C} _ {4} \ text {H} _ {10} \).
Возможны только два варианта:
Функциональные группы (ESCK7)
Способ, которым соединение будет реагировать, определяется конкретной характеристикой группы атомов и тем, как они связаны (например, двойная связь C \ (- \) C, группа C \ (- \) OH). Это называется функциональной группой . Эта группа важна для определения того, как соединение будет реагировать. Одна и та же функциональная группа будет подвергаться одной и той же или подобной химической реакции (ям) независимо от размера молекулы, частью которой она является.Молекулы могут иметь более одной функциональной группы.
- Функциональная группа
В органической химии функциональная группа — это определенная группа атомов (и связи между ними), которые отвечают за характерные химические реакции этих молекул.
В одной группе органических соединений, называемой углеводородами , одинарная, двойная и тройная связи между атомами углерода дают алканы, алкены и алкины соответственно.Двойные углерод-углеродные связи (в алкенах) и тройные углерод-углеродные связи (в алкинах) являются примерами функциональных групп.
В другой группе органических соединений, называемой спиртами , кислород и атом водорода связаны друг с другом, образуя функциональную группу (другими словами, спирт имеет в себе \ (\ text {OH} \)) . Все спирты будут содержать атомы кислорода и водорода, связанные вместе в какой-то части молекулы.
В таблице 4.1 приведены некоторые общие функциональные группы.Мы рассмотрим их более подробно позже в этой главе.
Название группы | Функциональная группа | Пример | Структурная формула | e 9117 Eth ane |
Alk ene | Eth ene | ||
| ин | |||
Галогеналкан / Алкилгалогенид | Хлорметан | ||
ol7 ol7 ol7 ol7 Alcoh ol7 Метан ол 90 008 | |||
Карбоновая кислота | Метан оевая кислота |
Таблица 4.1: Некоторые функциональные группы органических соединений.
При обсуждении функциональных групп следует отметить несколько важных моментов:
Начало составного имени (префикса) происходит от количества атомов углерода в самой длинной цепочке:
мет-
1 атом углерода
eth-
2 атома углерода
prop-
9011
9011 3 атомов углерода —
4 атома углерода
Окончание составного имени (суффикса) происходит от функциональной группы, например.грамм. алкан имеет суффикс -ан. См. Примеры в таблице 4.1.
Для получения дополнительной информации о наименовании органических молекул см. Раздел 4.3.
Насыщенные и ненасыщенные структуры (ESCK8)
Углеводороды, содержащие только одинарные связи, называются насыщенными углеводородами , потому что каждый атом углерода связан с максимально возможным количеством атомов водорода. На рис. 4.12 показана молекула этана, который представляет собой насыщенный углеводород.
Рисунок 4.12: Насыщенный углеводород, этан.
- Насыщенные соединения
Насыщенное соединение не имеет двойных или тройных связей (т. Е. Они имеют только одинарные связи). Все атомы углерода связаны с четырьмя другими атомами.
Углеводороды, содержащие двойные или тройные связи, называются ненасыщенными углеводородами, потому что они не содержат максимально возможное количество атомов водорода.
- Ненасыщенные соединения
Ненасыщенное соединение содержит двойные или тройные связи.Следовательно, атом углерода может быть связан только с двумя или тремя другими атомами.
На рис. 4.13 показаны молекулы этена и этина, которые являются ненасыщенными углеводородами. Если вы сравните количество атомов углерода и водорода в молекуле этана и молекуле этена, вы увидите, что количество атомов водорода в этене на меньше , чем количество атомов водорода в этане, несмотря на то, что они оба содержат два атома углерода. Чтобы ненасыщенное углеводородное соединение стало насыщенным, необходимо разорвать одну из двух (или трех) связей в двойной (или тройной) связи и добавить дополнительные атомы.
Рисунок 4.13: Ненасыщенные углеводороды: (a) этин и (b) этин.
Углеводороды (ESCK9)
Давайте сначала посмотрим на группу органических соединений, известных как углеводороды .
- Углеводород
Органическая молекула, содержащая только атомы углерода и водорода без каких-либо других функциональных групп, кроме одинарных, двойных или тройных углерод-углеродных связей.
Углеводороды, которые мы собираемся рассмотреть, называются алифатическими соединениями .Алифатические соединения делятся на ациклических соединений (цепные структуры) и циклических соединений (кольцевые структуры). Цепные структуры далее делятся на структуры, которые содержат только одинарных связей ( алканов ), те, которые содержат как минимум одну двойную связь ( алкенов ), и те, которые содержат как минимум одну тройную связь ( алкинов ).
Циклические соединения(которые не будут рассматриваться в этой книге) включают такие структуры, как циклопентановое кольцо , которое встречается в изоляционной пене и в таких приборах, как холодильники и морозильники.Рисунок 4.14 обобщает классификацию углеводородов.
Рисунок 4.14: Классификация алифатических углеводородов.
Алифатическое соединение — это соединение, не содержащее ароматического кольца:
Простейшее ароматическое соединение — бензол. Существуют алифатические циклические соединения, но если соединение содержит ароматическое кольцо, это ароматическое соединение, а не алифатическое.
Теперь мы рассмотрим каждую из ациклических алифатических углеводородных групп более подробно.
Алканы
Алканы — это углеводороды, которые содержат только одинарных ковалентных связей между своими атомами углерода. Это означает, что они представляют собой насыщенных соединений и совершенно инертны. Самый простой алкан имеет только один атом углерода и называется метаном . Эта молекула изображена на рисунке 4.15.
Рисунок 4.15: Представление метана по структурной формуле (a) и молекулярной формуле (b) .
Второй алкан в серии имеет два атома углерода и называется этан .Это показано на рисунке 4.16.
Рис. 4.16: (а) структурная, (б) конденсированная структурная и (в) молекулярная формула этана. (г) Атомная модель этана.
Третий алкан в ряду имеет три атома углерода и называется пропан (рис. 4.17).
Рис. 4.17. Представление пропана в структурной формуле (а) , конденсированной структурной формуле (b) и молекулярной формуле (в) . (d) Трехмерная компьютерная модель пропана.
Если вы посмотрите на молекулярную формулу каждого из алканов, вы должны заметить, что развивается закономерность. Для каждого атома углерода, который добавляется к молекуле, добавляются два атома водорода. Другими словами, каждая молекула отличается от предыдущей на \ (\ text {CH} _ {2} \). Это называется гомологической серией .
- Гомологическая серия
Гомологическая серия — это серия соединений с одинаковой общей формулой.Все молекулы этой серии будут содержать одинаковые функциональные группы.
Некоторые грибы используют алканы в качестве источника углерода и энергии. Один гриб amorphotheca resinae (также известный как керосиновый гриб) предпочитает алканы, используемые в авиационном топливе, и это может вызвать проблемы для самолетов в тропических регионах.
Общая формула аналогична как молекулярной формуле, так и сжатой структурной формуле. Функциональная группа записана так, как если бы она была в сжатой структурной формуле (чтобы сделать ее более очевидной), в то время как остальные атомы в соединении записаны в том же стиле, что и молекулярная формула.Алканы имеют общую формулу : \ (\ color {red} {\ textbf {C} _ {\ textbf {n}} \ textbf {H} _ {\ textbf {2n + 2}}} \).
Алканы являются наиболее важным источником топлива в мире и широко используются в химической промышленности.
Алканы, содержащие четыре или менее атомов углерода, являются газами (например, метаном и этаном).
(a) горящих пузырьков метана и (b) пропана (под высоким давлением), перевозимого на грузовиках.
Другие виды топлива представляют собой жидкое топливо (например, октан, важный компонент бензина).
Рис. 4.19: Жидкое топливо с октановым числом хранится в резервуарах на заправочных станциях.
Алкены
В алкенах должна быть по крайней мере одна двойная связь между двумя атомами углерода. Это означает, что они представляют собой ненасыщенных и на более реакционноспособны на , чем алканы. Простейшим алкеном является этен (также известный как этилен), который показан на рисунке 4.20.
Рис. 4.20. Представление этена по формуле (a), , структурной формуле (b), конденсированной структуры, (c), . (d) Атомная модель этена.
Как и алканы, алкены также образуют гомологичный ряд. У них есть общая формула : \ (\ color {red} {\ textbf {C} _ {\ textbf {n}} \ textbf {H} _ {\ textbf {2n}}} \). Таким образом, вторым алкеном в серии будет \ (\ text {C} _ {3} \ text {H} _ {6} \). Эта молекула известна как пропен (Рисунок 4.21).
Рис. 4.21. Представление пропена в виде структурных формул (а), , конденсированных структурных формул (б) и (в), (в).
В алкене может быть более одной двойной связи, как показано на рис. 4.22. Названия этих соединений описаны в разделе 4.3 «Обозначение и формулы IUPAC».
Обратите внимание, что если алкен имеет две двойные связи, он называется диеном .
Если вы не понимаете названия соединений, не волнуйтесь.Мы рассмотрим это более подробно позже в этой главе.
Рис. 4.22: Структурные представления (a), пент-1-ена и (b), пен-1,3-диена.
Алкены более реакционноспособны, чем алканы, поскольку они ненасыщены. Как и алканы, соединения с четырьмя или менее атомами углерода при комнатной температуре являются газами. Те, у кого пять или более атомов углерода, являются жидкостями.
Алкены имеют множество применений:
Например, этен — это химическое соединение, используемое в растениях для стимуляции созревания плодов и раскрытия цветов.
(а) незрелые (зеленые) и спелые (желтые) бананы и (б) цветущее растение.
Пропен — важное соединение в нефтехимической промышленности. Он используется для производства полипропилена (дополнительную информацию см. В разделе 4.7), а также в качестве топливного газа для других промышленных процессов.
Рисунок 4.24: Лампа из полипропилена. Пропен используется для производства полипропилена.
Алкины
В алкинах должна быть по крайней мере одна тройная связь между двумя атомами углерода.Они являются ненасыщенными соединениями и поэтому обладают большей реакционной способностью, чем алканы. Их общая формула : \ (\ color {red} {\ textbf {C} _ {\ textbf {n}} \ textbf {H} _ {\ textbf {2n-2}}} \). Например, бут-1-ин имеет молекулярную формулу \ ({\ textbf {C} _ {4} {\ textbf {H} _ {6}}} \). Самый простой алкин — это этин (рис. 4.25), также известный как ацетилен. Многие из алкинов используются для синтеза других химических продуктов.
Ацетилен — это промышленное название органического соединения этина.Сырьем для производства ацетилена является карбонат кальция и уголь. Ацетилен используется в газовой сварке с ацетиленом. Топливный газ горит кислородом в горелке. Поскольку горение алкенов и алкинов является экзотермическим, выделяется невероятно высокое тепло, достаточно горячее, чтобы расплавить металл.
Рисунок 4.25: (а) структурный, (б) конденсированный структурный и (в) молекулярный представления этина (ацетилена). (d) Атомная модель этина.
Помните, что органические молекулы не обязательно должны быть прямыми цепями. У них также могут быть разветвленные группы, как показано на рис. 4.26.
Рис. 4.26: Метильная разветвленная группа на углероде 2 бутана (2-метилбутана).
Сводная информация об относительной реакционной способности и гомологических рядах, встречающихся в углеводородах, приведена в таблице 4.2.
Функциональная группа | Однородная серия | Реакционная способность |
alk ane цвет текста {красный} C} _ {\ textbf {n}} \ textbf {H} _ {\ textbf {2n + 2}}} \) | низкая реактивность | |
alk ene | \ (\ color {red} {\ textbf {C} _ {\ textbf {n}} \ textbf {H} _ {\ textbf {2n}}} \) | высокая реакционная способность |
алк yne | \ (\ color {red} {\ textbf {C} _ {\ textbf {n}} \ textbf {H} _ {\ textbf {2n-2}}} \) | высокая реактивность |
Таблица 4.2: Краткое изложение гомологического ряда углеводородов.
Жидкий бром очень агрессивен и токсичен. Обращайтесь с ним с особой осторожностью!
Для экспериментов с насыщенными и ненасыщенными соединениями, если циклогексан и циклогексен недоступны, приемлемы любые алканы / алкены, которые являются жидкими при комнатной температуре. Их должно быть относительно легко найти.
Жидкий бром едок и токсичен, включая пары. Если вам нужно приготовить бромную воду из жидкого брома, не позволяйте учащимся работать с жидким бромом.Надевайте полную защитную экипировку и не вдыхайте пары. Работайте в хорошо вентилируемом помещении (желательно с вытяжным шкафом) и будьте осторожны.
Для производства \ (\ text {50} \) \ (\ text {ml} \) бромной воды:
Возьмите бутылку вместимостью не менее \ (\ text {100} \) \ (\ text {ml} \) и надежно закрывающуюся крышку (завинчивающаяся крышка).
Наклейте этикетку на бутылку и налейте в нее \ (\ text {50} \) \ (\ text {ml} \) воды.
Слейте пары из баллона с жидким бромом (с соответствующими мерами предосторожности) в бутылку с этикеткой до тех пор, пока воздушное пространство над водой не будет полностью заполнено красновато-коричневым газом.
Закройте обе бутылки крышкой и осторожно покрутите бутылку с бромной водой, чтобы газообразный бром растворился в воде.
Повторите процесс как минимум еще раз, пока вода не приобретет оранжевый цвет.
Насыщенные и ненасыщенные соединения
Цель
Изучить влияние бромной воды и перманганата калия на насыщенные и ненасыщенные соединения.
Аппарат
Жидкий бром (необходим для производства бромной воды) — это очень летучие, коррозионные и токсичные соединения. Пожалуйста, обращайтесь осторожно: надевайте соответствующую защитную одежду, включая перчатки, лабораторный халат, защитные очки и маску. Работайте в дыму. Если у вас нет устройства для безопасного обращения с жидким бромом, используйте только перманганат калия.
циклогексан, циклогексен, бромная вода (\ (\ text {Br} _ {2} (\ text {aq}) \)), перманганат калия (\ (\ text {KMnO} _ {4} \)) в кислой раствор
4 стеклянных контейнера (пробирки / химические стаканы / мелкие емкости), два листа бумаги А4
2 пластиковые пипетки
Метод
Обозначьте один лист бумаги A , а другой лист бумаги B .
Поместите \ (\ text {20} \) \ (\ text {ml} \) циклогексана в емкость и поместите емкость на бумагу A.
Поместите \ (\ text {20} \) \ (\ text {ml} \) циклогексана в емкость и поместите емкость на бумагу B.
Повторите шаги 2 и 3 с циклогексеном.
Возьмите \ (\ text {12} \) \ (\ text {ml} \) бромную воду и добавьте ее в стакан с циклогексаном на бумаге A.Обратите внимание на любые изменения цвета.
Повторите шаг 5 со стаканом циклогексена на бумаге A.
Возьмите \ (\ text {12} \) \ (\ text {ml} \) of \ (\ text {KMnO} _ {4} \) и добавьте его в стакан с циклогексаном на бумаге B. Обратите внимание на любые изменения цвета. .
Повторите шаг 7 со стаканом с циклогексеном на бумаге B.
Результаты
Запишите результаты в приведенную ниже таблицу.
Состав | Начальный цвет | Добавлен раствор | Окончательный цвет | |
циклогексан 05 | циклогексан | \ (\ text {KMnO} _ {4} \) | ||
циклогексен | бромная вода 21 | бромная вода (\ text {KMnO} _ {4} \) |
Циклогексан представляет собой алкан , циклогексен представляет собой алкен .
вопросов
Какое из этих соединений (циклогексан, циклогексен) является насыщенным, а какое ненасыщенным?
Какие изменения цвета вы наблюдали у алканового соединения?
Какие изменения цвета вы наблюдали у алкенового соединения?
Можете ли вы предложить причину различий?
Обсуждение и заключение
Бромная вода и \ (\ text {KMnO} _ {4} \) имеют интенсивные цвета.Циклогексан — насыщенная бесцветная жидкость. Когда бромная вода и \ (\ text {KMnO} _ {4} \) добавляются к циклогексану, реакции не происходит, и раствор приобретает цвет бромной воды или \ (\ text {KMnO} _ {4} \) .
Циклогексен — тоже бесцветная жидкость, но ненасыщенная. Это приводит к реакции с бромной водой и \ (\ text {KMnO} _ {4} \). Циклогексен образует бромалкан с бромной водой. Бромалканы — это бесцветные жидкости, и раствор будет бесцветным — жидкий бром обесцвечивается циклогексеном.Аналогично \ (\ text {KMnO} _ {4} \) обесцветится циклогексеном.
Siyavula Practice дает вам доступ к неограниченному количеству вопросов с ответами, которые помогут вам в обучении. Тренируйтесь где угодно, когда угодно и на любом устройстве!
Зарегистрируйтесь сейчасУглеводороды
Упражнение 4.2В чем разница между алканами, алкенами и алкинами?
Алканы имеют только одинарные связи между атомами углерода, алкены имеют по крайней мере одну двойную связь между атомами углерода, а алкины имеют по крайней мере одну тройную связь между атомами углерода.
Приведите общую формулу алкинов
\ (\ text {C} _ {\ text {n}} \ text {H} _ {2 \ text {n} -2} \)
Какая серия наименее реактивна? Объяснить, почему.
Алканы наименее активны. Насыщенные связи более реакционноспособны, чем ненасыщенные двойные или тройные связи, обнаруженные в алкенах и алкинах.
\ (\ text {CH} _ {3} \ text {CH} _ {2} \ text {CH} _ {3} \)
\ (\ text {CH} _ {2} \ text {CHCH} _ {3} \)
Заполните таблицу ниже:
Соединение | Насыщенный или ненасыщенный? |
\ (\ text {CH} _ {3} \ text {CH} _ {2} \ text {CH} _ {3} \) | |
\ (\ text {CH} _ {3} \ text {CH} _ {2} \ text {CHCHCH} _ {2} \ text {CH} _ {2} \ text {CH} _ {2} \ text { CH} _ {3} \) | |
гептан | |

 изомерия положения кратной связи
изомерия положения кратной связи изомерия положения кратной связи
изомерия положения кратной связи Оба бутана.
Оба бутана.
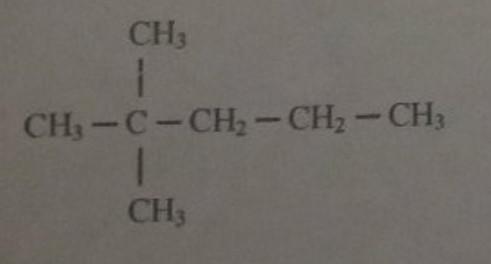 Названия различных форм структурной изомерии, вероятно, не имеют большого значения, но вы должны знать о различных возможностях, когда приступаете к рисованию изомеров.
Названия различных форм структурной изомерии, вероятно, не имеют большого значения, но вы должны знать о различных возможностях, когда приступаете к рисованию изомеров. Например, эта структура представляет собой версию бутана с прямой цепью, вращающуюся вокруг центральной углерод-углеродной связи.
Например, эта структура представляет собой версию бутана с прямой цепью, вращающуюся вокруг центральной углерод-углеродной связи. Вам придется отломать бром от конца и снова прикрепить его посередине. В то же время вам придется переместить водород из середины в конец.
Вам придется отломать бром от конца и снова прикрепить его посередине. В то же время вам придется переместить водород из середины в конец. В зависимости от положения атома хлора вы можете получить четыре разных изомера. В одном случае он присоединен к атому углерода боковой группы, а затем есть три других возможных положения, которые он может иметь вокруг кольца — рядом с группой CH 3 , следующее за одной группой с группой CH 3 . , или напротив группы CH 3 .
В зависимости от положения атома хлора вы можете получить четыре разных изомера. В одном случае он присоединен к атому углерода боковой группы, а затем есть три других возможных положения, которые он может иметь вокруг кольца — рядом с группой CH 3 , следующее за одной группой с группой CH 3 . , или напротив группы CH 3 . Среди нескольких структурных изомеров этого — пропановая кислота (карбоновая кислота) и метилэтаноат (сложный эфир).
Среди нескольких структурных изомеров этого — пропановая кислота (карбоновая кислота) и метилэтаноат (сложный эфир). . .
. .
Leave A Comment