1. Атомы металлов, отдавая внешние электроны, превращаются в положительные ионы:

где n — число электронов внешнего слоя атома, соответствующее номеру группы химического элемента.
2. Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя, превращаются в отрицательные ионы:

3. Между разноимённо заряженными ионами возникает связь, которая называется ионной.
4. Дополните таблицу «Ионная связь».

1. Дополните схемы образования положительно заряженных ионов. Из букв, соответствующих правильным ответам, вы составите название одного из древнейших природных красителей: индиго.

2. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы веществ с ионной химической связью.

3. Верны ли следующие утверждения?

3) верно только Б
4. Подчеркните пары химических элементов, между которыми образуется ионная химическая связь.
1) калий и кислород
2) водород и фосфор
3) алюминий и фтор
4) водород и азот
Составьте схемы образования химической связи между выбранными элементами.

5. Придумайте рисунок в стиле комиксов, отражающий процесс образования ионной химической связи.
6. Составьте схему образования двух химических соединений с ионной связью по условной записи:

Выберите химические элементы «А» и «Б» из следующего списка: кальций, хлор, калий, кислород, азот, алюминий, магний, углерод, бром.
Подходят для данной схемы кальций и хлор, магний и хлор, кальций и бром, магний и бром.

7. Напишите небольшое литературное произведение (эссе, новеллу или стихотворение) об одном из веществ с ионной связью, которое человек применяет в быту или на производстве. Для выполнения задания используйте возможности Интернета.
Хлорид натрия – вещество с ионной связью, без него нет жизни, хотя, когда его много – это тоже нехорошо. Даже есть такая народная сказка, где рассказывается о том, что принцесса любила своего отца короля так сильно, как соль, за что была изгнана из королевства. Но, когда король однажды попробовал еду без соли и понял, что есть невозможно, он тогда понял, что дочь его очень сильно любила. Значит, соль – есть жизнь, но её потребление должно быть в меру. Потому что чрезмерное потребление соли сильно вредит здоровью. Избыток соли в организме приводит к заболеванию почек, меняет цвет кожи, задерживает излишнюю жидкость в организме, что приводит к отёкам и нагрузке на сердце. Поэтому, надо контролировать потребление соли. 0,9% раствор хлорида натрия – это физиологический раствор, используется для вливания лекарств в организм. Поэтому, очень трудно ответить на вопрос: полезна или вредна соль? Она нам нужна в меру.
Образование ионной связи — урок. Химия, 8–9 класс.
Представим, что встретились два атома: атом щелочного металла и атом галогена. У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень.
Атом металла легко отдаст свой слабо связанный с ядром валентный электрон атому неметалла, который предоставит ему свободное место на внешнем энергетическом уровне. Оба в результате получат заполненные внешние уровни.
Атом металла при этом приобретёт положительный заряд, а атом галогена превратится в отрицательно заряженную частицу. Такие частицы называются ионами.
Ионы — заряженные частицы, в которые превращаются атомы в результате отдачи или принятия электронов.
Образовавшиеся разноимённо заряженные ионы притягиваются друг к другу, и возникает химическая связь, которая называется ионной.
Ионная связь — связь между положительно и отрицательно заряженными ионами.
Рассмотрим механизм образования ионной связи на примере взаимодействия натрия и хлора.
Na0+Cl0→Na++Cl−→Na+Cl−
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов, электроотрицательности которых резко различаются.
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов.
Рассмотрим другие примеры образования ионной связи.Пример:
Взаимодействие кальция и фтора
1. Кальций — элемент главной подгруппы второй группы. Ему легче отдать два внешних электрона, чем принять недостающие.

2. Фтор — элемент главной подгруппы седьмой группы. Ему легче принять один электрон, чем отдать семь.

3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно \(2\). Определим число атомов фтора, которые примут два электрона от атома кальция: \(2\) \(:\) \(1\) \(=\) \(2\).
4. Составим схему образования ионной связи:
Ca0+2F0→Ca2+F2−.
Пример:
Взаимодействие натрия и кислорода
1. Натрий — элемент главной подгруппы первой группы. Он легко отдаёт один внешний электрон.

2. Кислород — элемент главной подгруппы шестой группы. Ему легче принять два электрона, чем отдать шесть.

3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно \(2\) \(:\) \(1\) \(=\) \(2\). Определим число атомов натрия, которые отдадут два электрона атому кислорода: \(2\).
4. Составим схему образования ионной связи:
2Na0+O0→Na2+O2−.
С помощью ионной связи образуются также соединения, в которых имеются сложные ионы:
Nh5+,NO3−,OH−,SO42−,PO43−,CO32−.
Значит, ионная связь существует также в солях и основаниях.
Обрати внимание!
Соли аммония Nh5NO3,Nh5Cl,Nh5SO42 не содержат металла, но образованы ионной связью.
Ионы создают вокруг себя электрическое поле, действующее во всех направлениях. Поэтому каждый ион окружён ионами противоположного знака. Такое соединение представляет собой огромную группу положительных и отрицательных частиц, расположенных в определённом порядке.

Притяжение между ионами довольно сильное, поэтому ионные вещества имеют высокие температуры кипения и плавления.
Обрати внимание!
Все ионные соединения при обычных условиях — твёрдые вещества.
Примеры веществ с ионной связью:

Питьевая сода

Железный купорос

Поваренная соль
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 63 с.
Cs->K->Li->Mg->Al->Si->B->H->P->C->S->O->F
3. Как связана электроотрицательность с атомным радиусом?Чем меньше радиус атома, тем больше его электроотрицательность.
4. Подчеркните схему электронного строения наиболее электроотрицательного из приведенных химических элементов. 5. Ковалентная связь — это связь, которая образуется при взаимодействии атомов с образованием общей электр.р.
5. Ковалентная связь — это связь, которая образуется при взаимодействии атомов с образованием общей электр.р.Неполярной называют ковалентную связь, которая образуется между атомами с одинаковой электроотрицательностью.
Полярной называют ковалентную связь, которая образуется между атомами, которых электроотрицательность отличается, не незначительно.
6. Какие электроны называют «валентными»? Почему?Валентные электроны — электроны, находящиеся на внешней, или валентной оболочке атома.
7. Определите число валентных электронов в атомах.а) натрия 1
б) магния 2
в) кислорода 6
г) фосфора 5
д) хлора 7
е) алюминия 3
ж) кальция 2
з) бора 3
8. Ионная связь — это химическая связь, возникающая между ионами в результате действия электростатических сил притяжения.
9. Приведите примеры соединений, где один химический элемент участвует в образовании различных видов химической связи: ковалентной полярной, неполярной, ионной.Cl2 — ковалентно неполярная, НCl — полярная, NaСl — ионная.
10. Приведите примеры молекул, в которых связь между двумя атомами осуществляется:а) одной парой электронов Н2;
б) двумя парами электронов Н2О;
в) тремя парами электронов NН3.
 12. К атомам какого элемента смещена общая электронная пара в соединениях, формулы которых
12. К атомам какого элемента смещена общая электронная пара в соединениях, формулы которых  13. В молекулах какого соединения полярность связи наименьшая (подчеркните), наибольшая (обведите в кружок):
13. В молекулах какого соединения полярность связи наименьшая (подчеркните), наибольшая (обведите в кружок):  14. Атом серы образует химические связи с калием, водородом, бромом и углеродом. Какие связи наиболее и наименьшее полярны? Укажите, в сторону какого атома происходит смещение электронной плотности в каждом случае.
14. Атом серы образует химические связи с калием, водородом, бромом и углеродом. Какие связи наиболее и наименьшее полярны? Укажите, в сторону какого атома происходит смещение электронной плотности в каждом случае.  15. Распределите на группы следующие вещества в соответствии с типом химической связи в этих соединениях.
15. Распределите на группы следующие вещества в соответствии с типом химической связи в этих соединениях.  16. Составьте схему образования ионной связи для следующих соединений:
16. Составьте схему образования ионной связи для следующих соединений: 
Урок 48. Значение Периодического закона. Жизнь и деятельность Д.И.Менделеева — стр. 125-126Урок 53. Кристаллические решетки — стр. 130-131
Сохраните или поделитесь с одноклассниками:
Классификация химических связей.
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов. Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь.
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
E(XY) < E(X) + E(Y)
По этой причине при образовании химических связей между отдельными атомами выделятся энергия.
Упрощенно можно считать, что в основе химических связей лежат электростатические силы, обусловленные взаимодействиями положительно заряженных ядер и отрицательно заряженных электронов.
В образовании химических связей элементов главных подгрупп принимают участие электроны внешнего электронного слоя с наименьшей энергией связи с ядром, называемые валентными. Например, у бора таковыми являются электроны 2 энергетического уровня – 2 электрона на 2s-орбитали и 1 на 2p-орбитали:

При образовании химической связи каждый атом стремится получить электронную конфигурацию атомов благородных газов, т.е. чтобы в его внешнем электронном слое было 8 электронов (2 для элементов первого периода). Это явление получило название правила октета.
Достижение атомами электронной конфигурации благородного газа возможно, если изначально одиночные атомы сделают часть своих валентных электронов общими для других атомов. При этом образуются общие электронные пары.
В зависимости от степени обобществления электронов можно выделить ковалентную, ионную и металлическую связи.
Ковалентная связь
Ковалентная связь возникает чаще всего между атомами элементов неметаллов. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия кроется в том, что атомы разных элементов имеют и различную способность притягивать к себе общую электронную пару. Очевидно, что это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. В свою очередь, на другом атоме формируется частичный положительный заряд. Например, в молекуле хлороводорода электронная пара смещена от атома водорода к атому хлора:

Примеры веществ с ковалентной полярной связью:
СCl4, H2S, CO2, NH3, SiO2 и т.д.
Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента. Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:

Вышеописанный механизм образования ковалентной связи, когда оба атома предоставляют электроны для образования общих электронных пар, называется обменным.
Также существует и донорно-акцепторный механизм.
При образовании ковалентной связи по донорно-акцепторному механизму общая электронная пара образуется за счет заполненной орбитали одного атома (с двумя электронами) и пустой орбитали другого атома. Атом, предоставляющий неподеленную электронную пару, называют донором, а атом со свободной орбиталью – акцептором. В качестве доноров электронных пар выступают атомы, имеющие спаренные электроны, например N, O, P, S.
Например, по донорно-акцепторному механизму происходит образование четвертой ковалентной связи N-H в катионе аммония NH4+:

Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
HI < HBr < HCl < HF
Также энергия связи зависит от ее кратности – чем больше кратность связи, тем больше ее энергия. Под кратностью связи понимается количество общих электронных пар между двумя атомами.
Ионная связь
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи. Если в ковалентной-полярной связи общая электронная пара смещена частично к одному из пары атомов, то в ионной она практически полностью «отдана» одному из атомов. Атом, отдавший электрон(ы), приобретает положительный заряд и становится катионом, а атом, забравший у него электроны, приобретает отрицательный заряд и становится анионом.
Таким образом, ионная связь — это связь, образованная за счет электростатического притяжения катионов к анионам.
Образование такого типа связи характерно при взаимодействии атомов типичных металлов и типичных неметаллов.
Например, фторид калия. Катион калия получается в результате отрыва от нейтрального атома одного электрона, а ион фтора образуется при присоединении к атому фтора одного электрона:
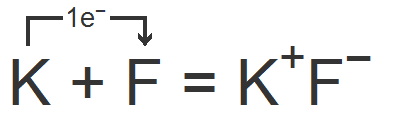
Между получившимися ионами возникает сила электростатического притяжения, в результате чего образуется ионное соединение.
При образовании химической связи электроны от атома натрия перешли к атому хлора и образовались противоположно заряженные ионы, которые имеют завершенный внешний энергетический уровень.
Установлено, что электроны от атома металла не отрываются полностью, а лишь смещаются в сторону атома хлора, как в ковалентной связи.
Большинство бинарных соединений, которые содержат атомы металлов, являются ионными. Например, оксиды, галогениды, сульфиды, нитриды.
Ионная связь возникает также между простыми катионами и простыми анионами (F−, Cl−, S2-), а также между простыми катионами и сложными анионами (NO3−, SO42-, PO43-, OH−). Поэтому к ионным соединениям относят соли и основания (Na2SO4, Cu(NO3)2, (NH4)2SO4), Ca(OH)2, NaOH).
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М0 — ne− = Mn+ , где М0 – нейтральный атом металла, а Mn+ катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.

То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например водородная связь наблюдается для молекул воды:

Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.
Ионная связь , также называемая электровалентная связь , тип связи, образованный в результате электростатического притяжения между противоположно заряженными ионами в химическом соединении. Такая связь образуется, когда валентные (внешние) электроны одного атома постоянно переносятся на другой атом. Атом, который теряет электроны, становится положительно заряженным ионом (катионом), а атом, который их приобретает, становится отрицательно заряженным ионом (анионом).Краткая обработка ионных связей следует. Для полной обработки см. химическая связь: образование ионных связей.
Ионная связь : хлорид натрия или поваренная соль Ионная связь в хлориде натрия. Атом натрия (Na) отдает один из своих электронов атому хлора (Cl) в химической реакции, и полученный положительный ион (Na + ) и отрицательный ион (Cl — ) образуют стабильное ионное соединение (хлорид натрия; обычная столовая соль) на основе этой ионной связи. Encyclopædia Britannica, Inc.Подробнее на эту тему
кристалл: ионные связи
Хлорид натрия проявляет ионную связь. Атом натрия имеет один электрон в своей внешней оболочке, в то время как хлору нужен один электрон …
Ионное связывание приводит к соединениям, известным как ионные или одновалентные, соединения, которые лучше всего иллюстрируются соединениями, образованными между неметаллами и щелочными и щелочноземельными металлами.В ионно-кристаллических твердых телах такого типа электростатические силы притяжения между противоположными зарядами и отталкивания между одинаковыми зарядами ориентируют ионы таким образом, что каждый положительный ион оказывается окруженным отрицательными ионами, и наоборот. Короче говоря, ионы расположены так, что положительные и отрицательные заряды чередуются и уравновешивают друг друга, при этом общий заряд всего вещества равен нулю. Величина электростатических сил в ионных кристаллах значительна. Соответственно, эти вещества имеют тенденцию быть твердыми и нелетучими.
Ионная связь на самом деле является крайним случаем полярной ковалентной связи, последняя в результате неравного совместного использования электронов, а не полного переноса электронов. Ионные связи обычно образуются, когда разница в электроотрицательности двух атомов велика, в то время как ковалентные связи образуются, когда электроотрицательность сходна. Сравните ковалентной связи.
.8.2: ионное соединение — химия LibreTexts
Цели обучения
- Для описания характеристик ионной связи.
- Для количественного описания энергетических факторов, участвующих в образовании ионной связи.
Ионы — это атомы или молекулы, которые электрически заряжены. Катионы заряжены положительно, а анионы несут отрицательный заряд. Ионы образуются, когда атомы приобретают или теряют электроны.Поскольку электроны заряжены отрицательно, атом, который теряет один или несколько электронов, станет положительно заряженным; атом, который получает один или несколько электронов, становится отрицательно заряженным. Ионная связь — это притяжение между положительно и отрицательно заряженными ионами. Эти противоположно заряженные ионы притягивают друг друга, образуя ионные сети (или решеток ). Электростатика объясняет, почему это происходит: противоположные заряды притягиваются и как заряды отталкиваются. Когда многие ионы притягивают друг друга, они образуют большие упорядоченные кристаллические решетки, в которых каждый ион окружен ионами противоположного заряда.Как правило, когда металлы реагируют с неметаллами, электроны переходят от металлов к неметаллам. Металлы образуют положительно заряженные ионы, а неметаллы образуют отрицательно заряженные ионы.
Генерация ионных связей
Ионные связи образуются, когда металлы и неметаллы химически реагируют. По определению, металл относительно стабилен, если он теряет электроны, образуя полную валентную оболочку, и становится положительно заряженным. Аналогично, неметалл становится стабильным, приобретая электроны, чтобы завершить свою валентную оболочку и стать отрицательно заряженным.Когда металлы и неметаллы реагируют, металлы теряют электроны, передавая их неметаллам, которые их получают. Следовательно, образуются ионы, которые мгновенно притягивают друг друга — ионная связь.
В общем ионном соединении положительные и отрицательные заряды должны быть сбалансированы, потому что электроны не могут быть созданы или разрушены, только перенесены. Таким образом, общее количество электронов, потерянных катионными компонентами, должно равняться общему количеству электронов, полученных анионными компонентами.
Пример\ (\ PageIndex {1} \): хлорид натрия
Например, в реакции Na (натрия) и Cl (хлора) каждый атом Cl берет один электрон от атома Na.Следовательно, каждый Na становится катионом Na + , а каждый атом Cl становится анионом Cl — . Из-за своих противоположных зарядов они притягивают друг друга, образуя ионную решетку. Формула (отношение положительных и отрицательных ионов) в решетке имеет вид \ (\ ce {NaCl} \).
\ [\ ce {2Na (s) + Cl 2 (г) \ rightarrow 2NaCl (s)} \ nonumber \]
Эти ионы расположены в твердом NaCl в правильном трехмерном расположении (или решетке):
Решетка NaCl.(слева) 3-D структура и (справа) простой 2D разрез через латте. Изображения использованы с разрешения Википедии и Майка Блейбера.
Хлор обладает высоким сродством к электронам, а натрий обладает низкой энергией ионизации. Таким образом, хлор получает электрон от атома натрия. Это можно представить с помощью символов точки ewis (здесь мы рассмотрим один атом хлора, а не Cl 2 ):
Стрелка указывает на перенос электрона от натрия к хлору с образованием иона металла Na + и иона хлорида Cl — .Каждый ион теперь имеет октетов электронов в своей валентной оболочке:
Энергетика образования ионных связей
Ионные связи образуются, когда положительно и отрицательно заряженные ионы удерживаются вместе электростатическими силами. Рассмотрим одну пару ионов, один катион и один анион. Насколько сильна будет сила их притяжения? Согласно закону Кулона , энергия электростатического притяжения (\ (E \)) между двумя заряженными частицами пропорциональна величине зарядов и обратно пропорциональна межъядерному расстоянию между частицами (\ (r \)):
\ [E \ propto \ dfrac {Q_ {1} Q_ {2}} {r} \ label {Eq1a} \]
\ [E = k \ dfrac {Q_ {1} Q_ {2}} {r} \ label {Eq1b} \]
, где заряд каждого иона представлен символом Q .Константа пропорциональности k равна 2,31 × 10 -28 Дж · м. Если Q 1 и Q 2 имеют противоположные знаки (как, например, в NaCl, где Q 1 равно +1 для Na + и Q 2 равно -1 для Cl — ), тогда E является отрицательным, что означает, что энергия высвобождается , когда противоположно заряженные ионы объединяются с бесконечным расстоянием, чтобы сформировать изолированную ионную пару.
Энергия всегда высвобождается при образовании связи и, соответственно, ей всегда требуется энергия, чтобы разорвать связь.
Как показано зеленой кривой в нижней половине рисунка \ (\ PageIndex {1} \), максимальная энергия будет выделяться, когда ионы находятся бесконечно близко друг к другу, при r, = 0. Поскольку ионы занимают пространство и имеют структуру с положительным ядром, окруженным электронами, однако они не могут быть бесконечно близко друг к другу. На очень коротких расстояниях отталкивающие электрон-электронные взаимодействия между электронами на соседних ионах становятся сильнее, чем привлекательные взаимодействия между ионами с противоположными зарядами, как показано красной кривой в верхней части рисунка \ (\ PageIndex {1} \).Полная энергия системы представляет собой баланс между притягивающим и отталкивающим взаимодействиями. Фиолетовая кривая на рисунке \ (\ PageIndex {1} \) показывает, что полная энергия системы достигает минимума при r 0 , точке, где электростатические отталкивания и притяжения точно сбалансированы. Это расстояние такое же, как экспериментально измеренное расстояние связи .
Рисунок \ (\ PageIndex {1} \): График зависимости потенциальной энергии от межъядерного расстояния для взаимодействия газообразного иона Na + и газообразного иона Cl — .{23} \; \ Отменить {ион \; пара} / моль \ вправо) = — 589 \; кДж / моль \ этикетка {Eq3} \]Это энергия, выделяемая при образовании 1 моль пар газообразных ионов, , а не , когда 1 моль положительных и отрицательных ионов конденсируется с образованием кристаллической решетки. Из-за дальнодействующих взаимодействий в структуре решетки эта энергия не соответствует непосредственно энергии решетки кристаллического твердого тела. Однако большое отрицательное значение указывает на то, что объединение положительных и отрицательных ионов энергетически очень выгодно, независимо от того, образуется ли ионная пара или кристаллическая решетка.
Мы суммируем важные моменты об ионной связи:
- При r 0 ионы более стабильны (имеют меньшую потенциальную энергию), чем на бесконечном межъядерном расстоянии. Когда противоположно заряженные ионы сближаются от r = ∞ до r = r 0 , энергия системы уменьшается (энергия выделяется).
- Из-за низкой потенциальной энергии при r 0 в систему необходимо добавить энергию для разделения ионов.Количество необходимой энергии — энергия связи.
- Энергия системы достигает минимума на определенном межъядерном расстоянии (расстоянии связи).
Пример \ (\ PageIndex {2} \): LiF
Рассчитайте количество энергии, выделяемой при образовании 1 моль газообразных ионных пар Li + F — из разделенных ионов. Наблюдаемое межъядерное расстояние в газовой фазе составляет 156 пм.
Дано: катионов и анионов, количество и межъядерное расстояние
Запрашивается: энергии, выделяющейся при образовании пар газообразных ионов
Стратегия:
Подставьте соответствующие значения в уравнение \ (\ ref {Eq1b} \), чтобы получить энергию, выделяющуюся при образовании одной пары ионов, и затем умножьте это значение на число Авогадро, чтобы получить энергию, выделяемую на моль.{23} \ cancel {\ text {ионная пара}} / моль \ вправо) \\ [4pt] & −891 \; кДж / моль \ end {align *} \]
Поскольку Li + и F — меньше, чем Na + и Cl — (см. Раздел 7.3), межъядерное расстояние в LiF короче, чем в NaCl. Следовательно, в соответствии с уравнением \ (\ ref {Eq1b} \), гораздо больше энергии выделяется при образовании 1 моль газообразных ионных пар Li + F — (-891 кДж / моль), чем при 1 моль образуется газообразный Na + Cl — ионные пары (−589 кДж / моль).
Упражнение\ (\ PageIndex {2} \): оксид магния
Рассчитайте количество энергии, выделяемой при образовании 1 моль пар газообразных \ (\ ce {MgO} \) из разделенных ионов. Межъядерное расстояние в газовой фазе составляет 175 ч.
- Ответ
−3180 кДж / моль = −3,18 × 10 3 кДж / моль
Электронная конфигурация ионов
Как энергия, выделяемая при образовании решетки, сравнивается с энергией, необходимой для отделения второго электрона от иона Na + ? Поскольку ион Na + имеет электронную конфигурацию благородного газа, удаление следующего электрона из этого стабильного устройства потребует больше энергии, чем выделяется при формировании решетки (натрий I 2 = 4560 кДж / моль).Таким образом, натрий присутствует в ионных соединениях в виде Na + , а не Na 2+ . Аналогично, добавление электрона для заполнения валентной оболочки (и достижения конфигурации электронов благородного газа) является экзотермическим или только слегка эндотермическим. Для добавления дополнительного электрона в новой подоболочке требуется огромная энергия — больше энергии решетки. Таким образом, мы находим Cl — в ионных соединениях, но не Cl 2 — .
| Соединение | Энергия решетки (кДж / моль) |
|---|---|
| LiF | 1024 |
| LiI | 744 |
| NaF | 911 |
| NaCl | 788 |
| NaI | 693 |
| KF | 815 |
| KBr | 682 |
| KI | 641 |
| MgF 2 | 2910 |
| SrCl 2 | 2130 |
| MgO | 3938 |
Это количество энергии может компенсировать такие большие значения, как I 3 для валентных электронов (т.е.е. может удалить до 3 валентных электронов). Поскольку большинство переходных металлов потребует удаления более 3 электронов, чтобы получить ядро из благородного газа, они не обнаруживаются в ионных соединениях с ядром из благородного газа. Переходный металл всегда теряет электроны в первую очередь из более высокой «s» подоболочки, а затем теряет из основной «d» подоболочки. (Оставшиеся электроны в незаполненной d-оболочке являются причиной ярких цветов, наблюдаемых во многих соединениях переходных металлов!) Например, ионы железа , а не , образуют ядро из благородного газа:
- Fe: [Ar] 4s 2 3d 6
- Fe 2+ : [Ar] 3d 6
- Fe 3+ : [Ar] 3d 5
Некоторые ионы металлов могут образовывать ядро из псевдо-благородных газов (и быть бесцветными), например:
- Ag: [Kr] 5s 1 4d 10 Ag + [Kr] 4d 10 Соединение: AgCl
- Cd: [Kr] 5s 2 4d 10 Cd 2+ [Kr] 4d 10 Состав: CdS
Валентные электроны в этом случае не придерживаются «правила октетов» (ограничение полезности этого правила).Примечание: атомы серебра и кадмия потеряли 5s электроны в достижении ионного состояния.
Когда положительный ион образуется из атома, электроны всегда теряются первыми из подоболочки с наибольшим основным квантовым числом
многоатомных ионов
Не все ионные соединения образуются только из двух элементов. Существует много многоатомных ионов , в которых два или более атомов связаны друг с другом ковалентными связями. Они образуют стабильную группу, которая несет заряд (положительный или отрицательный).Группа атомов в целом действует как заряженный элемент при образовании ионного соединения с противоположно заряженным ионом. Многоатомные ионы могут быть положительными или отрицательными, например:
- NH 4 + (аммоний) = катион
- SO 4 2- (сульфат) = анион
Принципы ионной связи с многоатомными ионами такие же, как и с одноатомными ионами. Противоположно заряженные ионы собираются вместе, образуя кристаллическую решетку, высвобождая энергию решетки.Исходя из форм и зарядов многоатомных ионов, эти соединения могут образовывать кристаллические решетки с интересными и сложными структурами.
Резюме
Количество энергии, необходимое для разделения пары газообразных ионов, — это энергия ее связи. Образование ионных соединений обычно , , чрезвычайно экзотермическое, , . Сила электростатического притяжения между ионами с противоположными зарядами прямо пропорциональна величине зарядов на ионах и обратно пропорциональна межъядерному расстоянию.Полная энергия системы представляет собой баланс между отталкивающими взаимодействиями между электронами на соседних ионах и привлекательными взаимодействиями между ионами с противоположными зарядами.

Leave A Comment