свойства, получение, применение :: SYL.ru
Как вам известно, в химии существует четыре класса неорганических соединений. Веществ, представляющих каждый из них, очень много, но лидирующее положение, несомненно, занимают оксиды. У одного химического элемента может быть сразу несколько разных бинарных соединений с кислородом. Такое свойство имеет и медь. У нее существует три оксида. Давайте рассмотрим их детальнее.

Оксид меди (I)
Его формула — Cu2O. В некоторых источниках данное соединение могут называть гемиоксидом меди, оксидом димеди или закисью меди.
Свойства
Является кристаллическим веществом, имеющим коричнево-красный цвет. Этот оксид не растворяется в воде и этиловом спирте. Может плавиться, не разлагаясь, при температуре чуть больше 1240оС. Данное вещество не взаимодействует с водой, но может переводиться в раствор, если участниками реакции с ним будут концентрированные хлоровородная кислота, щелочь, азотная кислота, гидрат аммиака, соли аммония, серная кислота.
Получение оксида меди (I)
Его можно получить, нагрев металлическую медь, или в такой среде, где кислород имеет малую концентрацию, а также в токе некоторых оксидов азота и вместе с оксидом меди (II). Кроме того, он может стать продуктом реакции термического разложения последнего. Оксид меди (I) получится и в том случае, если нагреть сульфид меди (I) в токе кислорода. Есть и другие, более сложные способы его получения (например, восстановление одного из гидроксидов меди, ионный обмен любой соли одновалентной меди с щелочью и т.п.), но их практикуют только в лабораториях.
Применение
Нужен в качестве пигмента, когда окрашивают керамику, стекло; компонента красок, которые защищают подводную часть судна от обрастания. Используется также как фунгицид. Без него не обходятся и меднозакисные вентили.

Оксид меди (II)
Его формула — CuO. Во многих источниках может встречаться под названием окиси меди.
Свойства
Это высший оксид меди. Вещество имеет вид черных кристаллов, которые почти не растворяются в воде. Взаимодействует с кислотой и при этой реакции образует соответствующую соль двухвалентной меди, а также воду. При его сплавлении с щелочью продукты реакции представлены купратами. Разложение оксида меди (II) происходит при температуре около 1100оС. Аммиак, монооксид углерода, водород и уголь способны извлекать из этого соединения металлическую медь.
Получение
Его можно получить при нагревании металлической меди в воздушной среде при одном условии — температура нагревания должна быть ниже 1100оС. Также оксид меди (II) может получиться, если нагреть карбонат, нитрат, двухвалентный гидроксид меди.
Применение
С помощью данного оксида окрашивают в зеленый или синий цвет эмаль и стекло, а также производят медно-рубиновую разновидность последнего. В лаборатории этим оксидом обнаруживают восстановительные свойства веществ.

Оксид меди (III)
Его формула — Cu2O3. Имеет традиционное название, которое звучит, наверное, немного необычно — окисел медь.
Свойства
Имеет вид красных кристаллов, не растворяющихся в воде. Разложение этого вещества происходит при температуре 400оС, продукты данной реакции — оксид меди (II) и кислород.
Получение
Его можно получить, окисляя двухвалентный гидроксид меди с помощью пероксидисульфата калия. Необходимое условие реакции — щелочная среда, в которой она должна происходить.
Применение
Данное вещество само по себе не используется. В науке и промышленности более широкое распространение находят продукты его разложения — оксид меди (II) и кислород.
Заключение
Вот и все оксиды меди. Их несколько из-за того, что медь имеет переменную валентность. Существуют и другие элементы, у которых есть по несколько оксидов, но о них поговорим в другой раз.
Оксид меди
Cuprum (Cu) относится к числу малоактивных металлов. Для него характерно образование химических соединений со степенями окисления +1 и +2. Так, например, два окисла, представляющих собой соединение из двух элементов Cu и кислорода O: со степенью окисления +1 — закись меди Cu2O и степенью окисления +2 — окись меди CuO. Несмотря на то, что состоят они из одинаковых химических элементов, но каждый из них имеет свои особые характеристики. На холоде металл очень слабо взаимодействует с кислородом воздуха, покрываясь пленкой, представляющей собой оксид меди, который препятствует дельнейшему окислению cuprum. При нагревании это простое вещество с порядковым номером 29 в таблице Менделеева полностью окисляется. При этом образуется также оксид меди (II): 2Cu + O2 → 2CuO.
Закись представляет собой коричневато-красное твердое вещество с молярной массой 143,1 г/моль. Соединение имеет температуру плавления 1235°С, температуру кипения 1800°С. Оно не растворяется в воде, но растворяется в кислотах. Разводится оксид меди (I) в растворе аммиака (концентрированном), при этом образуется бесцветный комплекс [Cu (Nh4)2]+, который легко окисляется на воздухе до аммиачного комплекса сине-фиолетового цвета [Cu (Nh4)4(h3O)2]2+, растворяющегося в соляной кислоте с образованием CuCl2. В истории полупроводниковой физики Cu2O является одним из наиболее изученных материалов.
Оксид меди (I), известный также как гемиоксид, обладает основными свойствами. Он может быть получен окислением металла: 4Cu + O2 → 2 Cu2O. Примеси, такие как вода и кислоты, влияют на скорость этого процесса, а также дальнейшее окисление до двухвалентного оксида. Закись меди может растворяться в серной кислоте, при этом образуется чистый металл и соль: h3SO4 + Cu2O → Cu + CuSO4 + h3O. По аналогичной схеме происходит взаимодействие окисла со степенью окисления металла +1 с другими кислородосодержащими кислотами. При взаимодействии гемиоксида с галогенсодержащими кислотами образуются соли одновалентного металла: 2HCl + Cu2O → 2CuCl + h3O.
Встречается оксид меди (I) в природе в виде красной руды (это устаревшее название, наряду с таким как рубиновая Cu), называемой минералом «Куприт». На его образование требуется длительное время. Он может быть получен искусственно при высоких температурах или под высоким давлением кислорода. Гемиоксид обычно используется как фунгицид, как пигмент, как противообрастающее средство в подводной или морской краске, и применяется также в качестве катализатора.
Однако воздействие этого вещества с химической формулой Cu2O на организм может быть опасным. При вдыхании вызывает одышку, кашель, а также изъязвление и перфорацию дыхательных путей. При попадании внутрь раздражает желудочно-кишечный тракт, что сопровождается рвотой, болью и диареей.
Высший оксид меди по внешнему виду представляет собой порошок от коричневого до черного цвета. В природе в чистом виде встречается как минерал «Тенорит». Температура его плавления 1326°С, температура кипения 2000°С. Он нерастворим в воде, спирте, гидроксиде аммония, растворе карбоната аммония. Растворим в водных растворах хлорида аммония и цианистого калия. Это черное твердое вещество может быть получено при нагревании Cu на воздухе. Однако в данном случае образуется также закись Cu. Получение оксида меди CuO возможно при нагревании соединений:
меди (II) нитрата 2Cu(NO3)2 → 4 NO2+ O2 + 2CuO;
меди (II) гидроксида Cu(OH)2 → h3O + CuO;
меди (II) карбоната CuCO3 → CO2 + CuO.
Cuprum (II) оксид является основным, поэтому он растворяется в минеральных кислотах (соляной, серной и азотной) с получением соответствующей соли двухвалентной Cu:
2HCl + CuO → CuCl2 + h3O;
h3SO4 + CuO → CuSO4 + h3O;
2HNO3 + CuO → Cu(NO3)2 + h3O.
Реагирует оксид меди (II) с концентрированной щелочью с образованием соли: 2 KOH + CuO + h3O → K2[Cu (OH)4].
Окисел также может быть восстановлен до металлической Cu при взаимодействии с водородом или окисью углерода:
h3 + CuO → Cu + h3O;
CO + CuO → Cu + CO2.
Используется оксид меди (II) в керамике (как пигмент) для получения глазури (синей, зеленой и красной, а иногда и розовой, серой или черной). Он также применяется в качестве пищевой добавки у животных с целью уменьшения дефицита cuprum в организме. Это абразивный материал, который необходим для полировки оптического оборудования. Он используется для производства сухих батарей, для получения других солей Cu. Соединение CuO также применяется при сварке медных сплавов.
Воздействие химического соединения CuO также может быть опасным для организма человека. При вдыхании вызывает раздражение легких. Оксид меди (II) может вызвать лихорадку металлических паров (MFF). Окись Cu провоцирует изменение цвета кожи, могут появиться проблемы со зрением. При попадании в организм, как и гемиоксид, приводит к отравлению, которое сопровождается симптомами в виде рвоты и болевых ощущений.
Окись меди — это… Что такое Окись меди?

Оксид меди(II)
Окси́д ме́ди(II) (окись меди) CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди относится к типу моноклинных решёток, с симметрией группы C2h и параметрами решётки a = 4.6837(5), b = 3.4226(5), c = 5.1288(6), α = 90° , β = 99.54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Получение
Получить оксид меди(II) можно:
- нагревая металлическую медь на воздухе (при температурах выше 1100 °C получается оксид меди(II)):
2Cu + O2 → 2CuO.
2Cu(NO3
Cu(OH)2·CuCO3 → 2CuO + H2O + CO2↑.
Химические свойства
Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
CuO + 2HNO3 → Cu(NO3)2 + H2O.
При сплавлении CuO со щелочами образуются купраты:
CuO + 2KOH → K2CuO2 + H2O.
При нагревании до 1100 °C разлагается:
4CuO → 2Cu2O + O2↑.
Оксиду меди(II) соответствует гидроксид меди(II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4] (гидроксокупрат(II) натрия).
Оксид меди(II) может быть восстановлен до металлической меди при помощи аммиака, монооксидом углерода или водородом:
H2 + CuO → Cu + H2O.
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом цвет становится розовым.
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- The effect of hydrostatic pressure on the ambient temperature structure of CuO, Forsyth J.B., Hull S., J. Phys.: Condens. Matter 3 (1991) 5257-5261
Примечания
- ↑ под давлением О2
Wikimedia Foundation. 2010.
Оксид меди 2, химическая формула и свойства
Оксиды — широко распространённый в природе тип соединений, который можно наблюдать даже в повседневной жизни, в быту. Примером могут служить песок, вода, ржавчина, известь, углекислый газ, ряд природных красителей. Руда многих ценных металлов по своей природе является оксидом, вследствие чего представляет большой интерес для научных и производственных исследований.
Соединение химических элементов с кислородом называют оксидами. Как правило, образуются они при накаливании каких-либо веществ на воздухе. Различают кислотные и основные оксиды. Металлы образуют основные оксиды, в то время как неметаллы — кислотные. За исключением оксидов хрома и марганца, которые также являются кислотными. В данной статье рассматривается представитель основных оксидов — CuO (II).
CuO (II)
Медь, нагреваясь на воздухе при температуре 400–500 °C, постепенно покрывается налётом чёрного цвета, который химики называют оксид двухвалентной меди, или CuO(II). Описанное явление представлено в следующем уравнении:
2 Cu + О 2 → 2 CuO
Термин «двухвалентный» указывает на способность атома вступать в реакцию взаимодействия с другими элементами посредством двух химических связей.
Интересный факт! Медь, находясь в различных соединениях, может быть с разной валентностью и другим цветом. Например: оксиды меди имеют ярко-красную (Cu2O) и коричнево-чёрную (CuO) окраску. А гидроксиды меди приобретают жёлтый (CuOH) и синий (Cu(OH)2) цвета. Классический пример явления, когда количество переходит в качество.
Cu2O ещё иногда называют закись, оксид меди (I), а CuO — окись, оксид меди (II). Существует также оксид меди (III) — Cu2O3.
В геологии оксид двухвалентной (или бивалентной) меди принято называть тенорит, другое его название — мелаконит. Название тенорит произошло от фамилии выдающегося итальянского профессора ботаники Michele Tenore, (1780—1861). Мелаконит считается синонимом названия тенорит и переводится на русский язык, как медная чернь либо чёрная медная руда. В том или ином случае речь идёт о кристаллическом минерале коричнево-чёрного цвета, разлагающемся при прокаливании и плавящемся только при избыточном давлении кислорода, в воде нерастворимом, и не реагирующем с ней.
Акцентируем основные параметры названного минерала.

Химическая формула: CuO
Молекула его состоит из атома Cu с молекулярной массой 64 а. е. м. и атома O, молекулярная масса 16 а. е. м., где а. е. м. — атомная единица массы, она же дальтон, 1 а. е. м. = 1,660 540 2(10) × 10−27 кг = 1,660 540 2(10) × 10–24 г. Соответственно молекулярная масса соединения равняется: 64 + 16 = 80 а. е. м.
Кристаллическая решётка: моноклинная сингония. Что обозначает такой тип осей симметрии кристалла, когда две оси пересекаются под косым углом и имеют различную длину, а третья ось расположена по отношению к ним под углом 90°.
Плотность – 6,51 г/см3. Для сопоставления, плотность чистого золота равна 19,32 г/см³, а плотность поваренной соли составляет 2,16 г /см
Плавится при температуре 1447 °C, под давлением кислорода.
Разлагается при накаливании до 1100 °C и преобразуется в оксид меди (I):
4CuO = 2Cu2O + O 2.
С водой не реагирует и не растворяется в ней.
Зато вступает в реакцию с водным раствором аммиака, с образованием гидроксида тетраамминмеди (II): CuO + 4Nh4 + h3O = [Cu (Nh4)4](OH) 2.
В кислотной среде образует сульфат и воду: CuO + h3SO4 = CuSO4 + h3O.
Реагируя со щёлочью, создаёт купрат: CuO + 2 NaOH → Na2CuO2 + h3O.
Реакция CuO NaOH
- путём прокаливания гидроксида меди (II) при температуре 200 °C: Cu(OH)2 = CuO + h3O;
- при окислении металлической меди на воздухе при температуре 400–500 °C: 2Cu + O2 = 2CuO;
- при высокотемпературной обработке малахита: (CuOH)₂CO₃ —> 2CuO + CO₂ + H₂O.
Восстанавливается до металлической меди —
- в реакции с водородом: CuO + h3 = Cu + h3O;
- с угарным газом (монооксид углерода): CuO + CO = Cu + CO2;
- с активным металлом: CuO + Mg = Cu + MgO.
Токсичен. По степени неблагоприятного воздействия на человеческий организм причисляется к веществам второго класса опасности. Вызывает раздражение слизистых оболочек глаз, кожных покровов, дыхательных путей и желудочно-кишечной системы. При взаимодействии с ним обязательно использование таких средств защиты, как резиновые перчатки, респираторы, защитные очки, спецодежду.
Вещество взрывоопасно и легко воспламеняется.
Применяется в промышленности, как минеральная составляющая комбикормов, в пиротехнике, при получении катализаторов химических реакций, как красящий пигмент для стекла, эмалей, керамики.
Окислительные свойства оксида меди (II) наиболее часто применяются в лабораторных исследованиях, когда необходим элементарный анализ, связанный с изучением органических материалов на предмет наличия в них водорода и углерода.
Немаловажно, что CuO (II) достаточно широко распространён в природе, как минерал тенерит, другими словами — это природное соединение руды, из которого можно получить медь.

Латинское наименование Cuprum и соответствующий ему символ Cu происходит от названия острова Кипр. Именно оттуда, через Средиземное море вывозили этот ценный металл древние римляне и греки.
Медь входит в число семи наиболее распространённых в мире металлов и состоит на службе у человека с древних времён. Однако в первозданном, металлическом состоянии встречается довольно редко. Это мягкий, легко поддающийся обработке металл, отличающийся высокой плотностью, очень качественный проводник тока и тепла. По электрической проводимости уступает только серебру, в то время как является более дешёвым материалом. Широко используется в виде проволоки и тонкого листового проката.
Химические соединения меди отличаются повышенной биологической активностью. В животных и растительных организмах они участвуют в процессах синтеза хлорофилла, поэтому считаются очень ценным компонентом в составе минеральных удобрений.

Необходима медь и в рационе человека. Недостаток её в организме может привести к различным заболеваниям крови.
Видео
Из видео вы узнаете, что такое оксид меди.
.
Оксид меди (II) — это… Что такое Оксид меди (II)?

Оксид меди(II)
Окси́д ме́ди(II) (окись меди) CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди относится к типу моноклинных решёток, с симметрией группы C2h и параметрами решётки a = 4.6837(5), b = 3.4226(5), c = 5.1288(6), α = 90° , β = 99.54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Получение
Получить оксид меди(II) можно:
- нагревая металлическую медь на воздухе (при температурах выше 1100 °C получается оксид меди(II)):
2Cu + O2 → 2CuO.
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑;
Cu(OH)2·CuCO3 → 2CuO + H2O + CO2↑.
Химические свойства
Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
CuO + 2HNO3 → Cu(NO3)2 + H2O.
При сплавлении CuO со щелочами образуются купраты:
CuO + 2KOH → K2CuO2 + H2O.
При нагревании до 1100 °C разлагается:
4CuO → 2Cu2O + O2↑.
Оксиду меди(II) соответствует гидроксид меди(II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4] (гидроксокупрат(II) натрия).
Оксид меди(II) может быть восстановлен до металлической меди при помощи аммиака, монооксидом углерода или водородом:
H2 + CuO → Cu + H2O.
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом цвет становится розовым.
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- The effect of hydrostatic pressure on the ambient temperature structure of CuO, Forsyth J.B., Hull S., J. Phys.: Condens. Matter 3 (1991) 5257-5261
Примечания
- ↑ под давлением О2
Wikimedia Foundation. 2010.
Оксид меди (I), — Copper(I) oxide
 | |
| имена | |
|---|---|
| название IUPAC Оксид меди (I), | |
| Другие имена
Оксид меди оксида Dicopper куприта Красный оксид меди | |
| Идентификаторы | |
| 3D модель ( JSmol ) | |
| ChemSpider | |
| ИКГВ InfoCard | 100.013.883 |
| Номер EC | 215-270-7 |
| KEGG | |
| номер RTECS | GL8050000 |
| UNII | |
| |
| |
| свойства | |
| Cu 2 O | |
| Молярная масса | 143,09 г / моль |
| Внешность | коричневато-красная твердое вещество |
| плотность | 6,0 г / см 3 |
| Температура плавления | 1232 ° С (2250 ° F; 1505 К) |
| Точка кипения | 1800 ° С (3270 ° F; 2070 К) |
| нерастворимый | |
| Растворимость в кислоте | растворимый |
| Ширина запрещенной зоны | 2,137 эВ |
| -20 · 10 -6 см 3 / моль | |
| Состав | |
| кубический | |
| термохимия | |
| 93 Дж · моль -1 · К -1 | |
| -170 кДж · моль -1 | |
| опасности | |
| Паспорт безопасности | SIRI.org |
| Вредный ( Xn ) опасность для окружающей среды ( N ) | |
| R-фразы (устаревшее) | R22 , R50 / 53 |
| S-фразы (устаревший) | (S2) , S22 , S60 , S61 |
| NFPA 704 |  |
| Пределы воздействия здоровья США ( NIOSH ): | |
| PEL (допустимый) | TWA 1 мг / м 3 (как Cu) |
| REL (рекомендуется) | TWA 1 мг / м 3 (как Cu) |
| IDLH (Непосредственная опасность) | TWA 100 мг / м 3 (как Cu) |
| Родственные соединения | |
| Медь (I) сульфид меди (II) сульфид меди (I) селенида | |
| Меди (II) оксида серебра (I) оксид никеля (II) , оксид цинка оксид | |
| За исключением случаев, когда указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
 Y проверить ( что ?) Y проверить ( что ?)  Y Y N N | |
| ссылки Infobox | |
Оксид меди (I) , или оксид меди представляет собой неорганическое соединение с формулой Cu 2 O. Это является одной из основных оксидов из меди , другой CuO или оксид меди . Этот красный цвета твердым веществом является компонентом некоторых противообрастающих красок. Соединение может появляться либо желтым или красным цветом, в зависимости от размера частиц. Оксид меди (I) находится как красновато минеральный куприт .
подготовка
оксид меди (I) могут быть получены несколькими способами. Наиболее прямолинейно, она возникает через окисление металлической меди:
- 4 Cu + O 2 → 2 Cu 2 O
Добавки , такие как вода и кислоты влияют на скорость этого процесса, а также дальнейшее окисление меди до оксидов (II). Он также производится на коммерческой основе путем восстановления растворов меди (II) с диоксидом серы . Водные растворы хлорида одновалентной меди реагирует с основанием , чтобы дать один и тот же материал. Во всех случаях, цвет очень чувствителен к процедурным деталям.
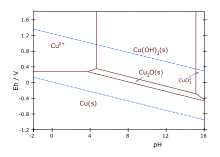 Диаграмма Пурб для меди в незакомплексованных медиа (кроме ОНА — анионов — не учитывается). Концентрация ионов 0,001 м (моль / кг воды). Температура 25 ° С.
Диаграмма Пурб для меди в незакомплексованных медиа (кроме ОНА — анионов — не учитывается). Концентрация ионов 0,001 м (моль / кг воды). Температура 25 ° С.Формирование оксида меди (I) , является основой из теста Фелинга и тест Бенедикта для снижения сахара . Эти сахара уменьшить щелочной раствор соли меди (II), что дает ярко — красный осадок из Cu 2 O.
Он образует на серебряном -plated медных деталей , подверженных воздействию влаги , когда слой серебра является пористым или поврежден. Этот вид коррозии известен как красная чума .
Мало доказательств существует для гидроксида одновалентной меди, которая, как ожидается, быстро пройти обезвоживание. Аналогичная ситуация применяется к гидроксидам золота (I) и серебро (I).
свойства
Твердое вещество диамагнитная . С точки зрения их координационных сфер, центры меди являются 2-скоординированы и оксиды четырехгранные. Таким образом , структура напоминает в некотором смысле основные полиморфов SiO 2 , и обе структуры имеет взаимопроникающие решетки.
Оксид меди (I) растворяется в концентрированной аммиачной растворе с образованием бесцветного сложного [Cu (NH 3 ) 2 ] + , который легко окисляется на воздухе до синего цвета [Cu (NH 3 ) 4 (H 2 O) 2 ] 2+ , Он растворяется в соляной кислоте с получением растворов CuCl 2 — . Развести серной кислоты и азотной кислоты производят сульфат меди (II) и меди нитрата (II) , соответственно.
Cu 2 O разлагается до оксида меди (II) во влажном воздухе.
Состав
Cu 2 O кристаллизуется в кубической структуре с постоянной решетки а л = 4,2696 Å. Атомы Cu расположить в ГЦК подрешетке атомы O в ОЦК подрешетке. Одна подрешетки сдвинуты на четверть диагонали. Пространственная группа является , которая включает в себя группу точек с полной симметрией октаэдра. п N 3 ¯ м {\ Displaystyle \ scriptstyle Рп {\ бар {3}}} м
полупроводниковые свойства
В истории полупроводниковой физики, Cu 2 O является одним из наиболее изученных материалов, и многие экспериментальные полупроводниковые приложения были продемонстрированы первые в этом материале:
Самые низкие экситоны в Cu — O чрезвычайно долго жили; форма линии поглощения были продемонстрированы с NEV ширин, которая является самым узким объемным экситонным резонансом когда — либо наблюдал. Связанные квадрупольные поляритонов имеют низкую групповую скорость приближающейся к скорости звука. Таким образом, свет двигается почти так же медленно , как и звук в этой среде, что приводит к высокой плотности поляритонной. Еще одна необычная особенность состояния подземных экситонов , что все механизмы рассеяния первичных известны количественно. Cu 2 O был первым веществом , в котором параметр полностью свободный от модели поглощения ширины линии уширения температуры может быть установлена, что позволяет соответствующий коэффициент поглощения выводиться. Это можно показать , используя Cu — O , что отношения Kramers-Кронига не применяются к поляритонам.
Приложения
Оксид меди обычно используются в качестве пигмента , в фунгициде и анти обрастания агента для морских красок. Выпрямительные диоды на основе этого материала были использованы в промышленности уже в 1924 году, задолго до того, кремний стал стандартом. Оксид меди (I) также несет ответственность за розовый цвет в положительном тесте Бенедикта .
Смотрите также
Рекомендации
- ^ Б с «NIOSH Карманный справочник по источникам химической опасности # 0150» . Национальный институт по охране труда и здоровья (NIOSH).
- ^ Н. Гринвуд, А. Эрншо, химия элементов , 2е изд., Butterworth-Heinemann, Оксфорд, Великобритания, 1997.
- ^ H. Wayne Richardson «Соединение меди в энциклопедии Ульмана промышленной химии 2002, Wiley-VCH, Weinheim. Дои : 10.1002 / 14356007.a07_567
- ^ Д. Николс, Комплексы и первого ряда переходных элементов , Macmillan Press, London, 1973.
- ^ ЛО Grondahl, однонаправленный ток несущее устройство, патент, 1927
- ^ Л. Ханке, Д. Фрелиха, А. Л. Иванов, ПБ Литтлвуд и H. Штольц «LA-Phonoritons в Cu 2 O» , Phys. Rev. Lett. 83 (1999), 4365.
- ^ Л. Бриллюэна: Распространение волн и групповая скорости , Academic Press , Нью — Йорк , 1960.
- ^ J. Брандт, Д. Фрелиха, С. Sandfort, М. Байер, Г. Штольц, и Н. Нака, поглощение сверхкоротких и двухфононный возбуждения спектроскопия Cu 2 O paraexcitons в сильном магнитном поле , Phys. Rev. Lett. 99, 217403 (2007). DOI : 10,1103 / PhysRevLett.99.217403
- ^ JP Вольф и А. Mysyrowicz: Экситонное вещество, Scientific American 250 (одна тысяча девятьсот восемьдесят-четырь), № 3, 98.
- ^ Хопфилда, JJ (1958). «Теория Вклад экситонов в комплексной диэлектрической проницаемости кристаллов». Physical Review . 112 (5): 1555-1567. DOI : 10,1103 / PhysRev.112.1555 . ISSN 0031-899X .
внешняя ссылка
<img src=»https://en.wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>Оксид меди(II) — это… Что такое Оксид меди(II)?
Окси́д ме́ди(II) (окись меди) CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди относится к типу моноклинных решёток, с симметрией группы C2h и параметрами решётки a = 4.6837(5), b = 3.4226(5), c = 5.1288(6), α = 90° , β = 99.54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Получение
Получить оксид меди(II) можно:
- нагревая металлическую медь на воздухе (при температурах ниже 1100 °C получается оксид меди(II):
Химические свойства
Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
При сплавлении CuO со щелочами образуются купраты:
При нагревании до 1100 °C разлагается:
Оксиду меди(II) соответствует гидроксид меди(II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
- (тетрагидроксокупрат(II) натрия).
Оксид меди(II) восстанавливается до металлической меди аммиаком, монооксидом углерода, водородом, углем:
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом чёрный цвет оксида меди переходит в розовую окраску меди.
Примечания
- ↑ под давлением О2
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- The effect of hydrostatic pressure on the ambient temperature structure of CuO, Forsyth J.B., Hull S., J. Phys.: Condens. Matter 3 (1991) 5257-5261
Оксид меди Формула
Формула и структура: Химическая формула оксида меди — CuO. Его масса молы составляет 79,545 г / моль -1 . Молекула образована двухвалентным катионом меди Cu +2 и анионом кислорода O -2 . Молекулы образуют моноклинную кристаллическую систему, в которой каждый атом меди координирован 4 атомами кислорода. Он тесно связан с другим оксидом меди: оксидом меди Cu 2 O. Его химическая структура может быть записана, как показано ниже, в общих представлениях, используемых для органических молекул.
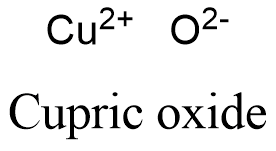
Происхождение: Оксид меди встречается в природе как один из компонентов минералов, таких как тенорит и парамелаконит. Его добывают из руд по всему миру, в основном в Южной Америке, в таких странах, как Перу, Боливия. Некоторые химические соединения, такие как карбонат аммония и аммиак, используются для ускорения извлечения из руд.
Приготовление: Оксид меди в основном получают путем извлечения из руды, однако существуют некоторые способы его получения в промышленных масштабах.В промышленности оксид меди получают реакцией воспламенения тригидрата нитрата меди (100-20 ° C), гидроксида меди (100 ° C) или карбоната меди (250 ° C):
2 Cu (NO 3 ) 2 → 2 CuO + 4 NO 2 + O 2
Cu (OH) 2 (т) → CuO (т) + H 2 O (л)
CuCO 3 → CuO + CO 2
Физические свойства: Оксид меди представляет собой мелкодисперсный аморфный твердый или кристаллический порошок от коричневого до черного цвета.Частицы легко диспергируются в воздухе. Его температуры плавления и кипения составляют 1326 ºC и 2000 ºC соответственно. Он не растворим в воде, в разбавленных растворах кислоты и растворим в хлориде аммония и цианиде калия.
Химические свойства: Оксид меди амфотный, поэтому может растворяться в кислотах и щелочных растворах. В щелочном растворе реагирует с другими солями меди:
2 МеталлOH + CuO + H 2 O → Металл 2 [Cu (OH) 4 ]
В растворах кислот он также реагирует до других солей меди:
CuO + 2 HNO 3 → Cu (NO 3 ) 2 + H 2 O
CuO + 2 HCl → CuCl 2 + H 2 O
Применение: Оксид меди широко используется в сельскохозяйственной химической и химической промышленности для получения промежуточных продуктов в некоторых процессах.Это широко используемый окислитель / восстановитель и регулятор процесса химической реакции, особенно при добыче нефти. Оксид меди используется для производства красок и покрытий, а также является ингредиентом некоторых продуктов для ухода за воздухом.
Воздействие на здоровье / безопасность: Оксид меди вызывает раздражение глаз, горла и носа. Он взрывается при нагревании в контакте с алюминием, водородом или марганцем. При нагревании выделяет токсичные пары. Не горюч.
.Какова химическая формула оксида меди?
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
- Геометрия
- Prealgebra
- тригонометрия и алгебра
WebElements Periodic Table »Медь» оксид меди
-

Ni Cu Zn Pd Ag Кд -

- Актиний ☢
- Алюминий
- Алюминий
- Америций ☢
- Сурьма
- Аргон
- Мышьяк
- Астатин ☢
- Барий
- Берклиум ☢
- Бериллий
- висмут
- Бориум ☢
- Бор
- Бром
- Кадмий
- Цезий
- Кальций
- Калифорний ☢
- Углерод
- Церий
- Цезий
- Хлор
- Хром
- Кобальт
- Copernicium ☢
- Медь
- Кюрий ☢
- Дармштадтиум ☢
- Дубний ☢
- Диспрозий
- Эйнштейний ☢
- Эрбий
- Европий
- Фермий ☢
- Флеровий ☢
- Фтор
- Франций
- Гадолиний
- Галлий
- Германий
- Золото
- Гафний
- Калий ☢
- Гелий
- Гольмий
- Водород
- Индий
- Йод
- Иридий
- Утюг
- Криптон
- Лантан
- Лоуренсий ☢
- Свинец
- Литий
- Ливерморий ☢
- Лютеций
- Магний
- Марганец
- Мейтнерий ☢
- Менделевий ☢
- Меркурий
- Молибден
- Московиум ☢
- Неодим
- Неон
- Нептуний
- Никель
- Нихоний ☢
- Ниобий
- Азот
- Нобелий
- Оганессон ☢
- Осмий
- Кислород
- Палладий
- фосфор
- Платина
- Плутоний ☢
- Полоний
- Калий
- Празеодим
- Прометий ☢
- Протактиний ☢
- Радий ☢
- Радон ☢
- Рений
- Родий
- Рентген ☢
- Рубидий
- Рутений
- Резерфорд ☢
- Самарий
- Скандий
- Сиборгий ☢
- Селен
- Кремний
- Серебро
- Натрий
- Стронций
- Сера
- Сера
- Тантал
- Технеций
- Теллур
- Теннессин
- Тербий
- Таллий
- Торий ☢
- Тулий
- Олово
- Титан
- Вольфрам
- Уран ☢
- Ванадий
- Ксенон
- Иттербий
- Иттрий
- Цинк
- Цирконий
медь
Диспропорционирование ионов меди (I) в растворе
Химический состав меди (I) ограничен реакцией, которая происходит с участием простых ионов меди (I) в растворе. Это хороший пример диспропорционирования — реакции, в которой что-то окисляется и восстанавливается.
Ионы меди (I) в растворе диспропорционируют с образованием ионов меди (II) и осадка меди.
Реакция:
Любая попытка получить простое соединение меди (I) в растворе приводит к этому.
Например, если вы прореагируете оксид меди (I) с горячей разбавленной серной кислотой, вы можете ожидать получения раствора сульфата меди (I) и воды. Фактически вы получаете коричневый осадок меди и синий раствор сульфата меди (II) из-за реакции диспропорционирования.
Стабилизация степени окисления меди (I)
Нерастворимые соединения меди (I)
Мы уже видели, что йодид меди (I) образуется в виде грязно-белого осадка, если вы добавляете раствор йодида калия к раствору, содержащему ионы меди (II).Иодид меди (I) практически не растворяется в воде, поэтому реакции диспропорционирования не происходит.
Аналогичным образом хлорид меди (I) может быть получен в виде белого осадка (реакция описана ниже). Если его отделить от раствора и как можно быстрее высушить, он останется белым. Однако при контакте с водой она медленно становится синей по мере образования ионов меди (II).
Реакция диспропорционирования происходит только с простыми ионами меди (I) в растворе.
Комплексы меди (I)
Образование комплексов меди (I) (кроме комплекса с водой в качестве лиганда) также стабилизирует степень окисления меди (I).
Например, оба [Cu (NH 3 ) 2 ] + и [CuCl 2 ] — представляют собой комплексы меди (I), которые не являются диспропорционирующими.
Хлорсодержащий комплекс образуется при растворении оксида меди (I) в концентрированной соляной кислоте.
Вы можете представить себе это в двух стадиях. Сначала получается хлорид меди (I):
Но в присутствии избытка хлорид-ионов из HCl он реагирует с образованием стабильного растворимого комплекса меди (I).
Вы можете получить белый осадок хлорида меди (I) (упомянутый выше), добавив к этому раствору воду. Это полностью изменяет последнюю реакцию, удаляя лишний хлорид-ион.
,
Leave A Comment