Оксид кремния – формула, кристаллическая решетка
4.5
Средняя оценка: 4.5
Всего получено оценок: 103.
4.5
Средняя оценка: 4.5
Всего получено оценок: 103.
Кремний проявляет переменную валентность (II, IV), поэтому может образовывать два оксида кремния – монооксид и диоксид. Они отличаются физическими и химическими свойствами. Подробнее об оксидах кремния говорим в этой статье.
Монооксид
Формула оксид кремния (II) – SiO. Это вязкое, похожее на смолу вещество. Сохраняет аморфное состояние и не окисляется при обычных условиях. Не образует соли, не проводит электричество.
Рис. 1. Монооксид кремния.Монооксид получают двумя способами:
- нагреванием (температура выше 400°C) кремния при недостатке кислорода:
2Si + O2 → 2SiO;
- методом Чохральского при восстановлении диоксида при высоких температурах:
SiO2 + Si → 2SiO.
В твёрдом состоянии монооксид представляет собой тёмно-коричневый порошок.
Химические свойства монооксида кремния:
- разлагается при нагревании:
2SiO → 2Si + O2;
- реагирует с парами воды при нагревании до 500°C:
SiO + H2O → SiO2 + H2;
- взаимодействует с углекислым газом при нагревании:
SiO + СО2 → SiO2 + CO;
- реагирует с хлором при температуре 800°C, образуя жидкий хлорид кремния:
2SiO + 4Cl2 → 2SiCl4 + O2.
Монооксид не встречается на Земле в естественной среде. Однако газообразный монооксид входит в состав межзвёздных пылевых облаков.
Диоксид
Оксид кремния (IV) – SiO2. Это твёрдое кристаллическое тугоплавкое вещество, нерастворимое в воде. Не проводит электрический ток.
Формулу диоксида имеют песок, кварц, горный хрусталь, яшма, агат, аметист и другие горные породы. Диоксид входит в состав 87 % литосферы.
Диоксид входит в состав 87 % литосферы.
Диоксид кремния имеет немолекулярное строение. Кристаллическая решётка состоит из атомов кремния и кислорода, связанных ковалентными связями. К каждому атому кремния присоединено четыре атома кислорода, а каждый атом кислорода связан с двумя атомами кремния.
Диоксид можно получить в лаборатории, нагрев кремний до 400-500°C в присутствии кислорода:
Si + O2 → SiO2.
Диоксид образуется при действии кислот на растворимые силикаты. В результате образующаяся кремниевая кислота распадается на воду и диоксид:
- Na2SiO3 + 2CH3COOH → 2CH3COONa + H2SiO3↓;
- H2SiO3 → H2O + SiO2.
При нормальных условиях реагирует только с плавиковой кислотой. Со щелочами и основными оксидами реагирует при нагревании.
Взаимодействие | Описание | Уравнение |
С неметаллами | Реагирует с водородом и углеродом с образованием кремния и карборунда соответственно | – SiO2 + 2Н2 → Si + 2H2O; – SiO2 + 3С → SiC + 2CO |
С активными металлами | Реагирует при температуре выше 1000°С с образованием кремния. При избытке металла образуются силициды | – SiO2 + 2Mg → Si + 2MgO; – SiO2 + 4Mg → Mg2Si + 2MgO |
С фтороводородом | Реагирует с газом и плавиковой кислотой при нормальных условиях | – SiO2 + 4HF → SiF4 + 2H2O; – SiO2 + 6HF → H2[SiF6] + 2H2O |
Со щелочами | Сплавляется с образованием силикатов | SiO2 + 4NaOH → Na4SiO4 + 2H2O |
С оксидами | Реагирует при высоких температурах | SiO2 + MgO → MgSiO3 |
С карбонатами щелочных металлов | Взаимодействует при нагревании | SiO2 + K2CO3 → K2SiO3 + CO2 |
Диоксид кремния используется для производства стекла, силикагеля, бетона.
Что мы узнали?
Кремний образует два оксида – монооксид и диоксид. Монооксид – аморфное вещество, не образующее соли. Взаимодействует при нагревании с водяным паром, углекислым газом, хлором. Разлагается на простые вещества при нагревании. Диоксид – песок и его производные. Это кристаллическое вещество с немолекулярным строением. Не реагирует с водой, кислотами (исключение – плавиковая кислота). Взаимодействует с неметаллами, металлами, фтороводородом, щелочами, оксидами, карбонатами. Оксиды кремния – диэлектрики.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
5/5
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 103.
А какая ваша оценка?
химические и физические свойства, строение, формула соединения
Оксид кремния (IV) или диоксид — что это такое
ОпределениеОксид кремния (IV) является твердым веществом с атомной кристаллической решеткой.
Оксид кремния (IV) или диоксид можно встретить в природе в виде следующих минералов:
- кварц;
- речной песок;
- кремнезем;
- прочие модификации.
Источник: chemege.ru
Каждый из атомов кремния в кристаллической решетке образует ковалентные связи с четырьмя атомами кислорода. Каждый атом кислорода связан с двумя атомами кремния. В результате формируется кристаллическая решетка атомного (не молекулярного) типа. Формула соединения отражает наименьшее соотношение количества атомов кремния и кислорода в кристалле.
Источник: yaklass.ru
В основном состоянии кремний характеризуется следующей электронной конфигурацией:
+14Si 1s22s22p63s23p2
В возбужденном состоянии электронная конфигурация кремния имеет следующий вид:
+14Si* 1s22s22p63s13p3
Внешний энергетический уровень атома кремния в основном состоянии содержит 2 неспаренных электрона и 1 неподеленную электронную пару. При переходе атома в возбужденное состояние пара электронов распаривается, и количество неспаренных электронов становится равным 4. Степени окисления атома кремния соответствуют интервалу от -4 до +4. Характерными степенями окисления являются -4, 0, +4.
Степени окисления атома кремния соответствуют интервалу от -4 до +4. Характерными степенями окисления являются -4, 0, +4.
Физические и химические свойства
СвойствоФизические свойства кремния:
- твердое, тугоплавкое вещество;
- плавится при температуре 1728 °C;
- температура кипения равна 2590 °C;
- атомная кристаллическая решетка.
Оксид кремния относят к типичным кислотным оксидам. Окислительные свойства вещества проявляются в слабой степени.
СвойствоБудучи кислотным оксидом, диоксид кремния (IV) вступает в химические реакции с растворами и расплавами щелочей, с расплавами основных оксидов. В результате взаимодействия образуются силикаты.
Реакция 1Взаимодействие диоксида кремния и гидроксида калия:
SiO2+2KOH→K2SiO33+h3O
Реакция 2Реакция диоксида кремния с оксидом кальция:
SiO2+CaO→CaSiO3
СвойствоОксид кремния (IV) не вступает в химическую реакцию с водой. Это объясняется нерастворимостью кремниевой кислоты.
Оксид кремния (IV) взаимодействует в процессе сплавления с карбонатами щелочных металлов. Данный процесс протекает по правилу, согласно которому при сплавлении происходит вытеснение более летучего оксида (оксида углерода (IV)) из солей менее летучим оксидом (оксидом кремния (IV)).
Реакция 3Взаимодействие оксида кремния (IV) и карбоната калия сопровождается образованием силиката калия и углекислого газа (оксида углерода IV):
SiO2+K2CO3→K2SiO3+CO2
СвойствоЕсли рассматривать кислоты, то возможна реакция диоксида кремния только с плавиковой кислотой или фтороводородом в газообразном состоянии.
Реакция 4В качестве примера можно записать уравнение реакции:
SiO2+6HF(г)=SiF4+h3O
SiO2+6HF(р-р)→h3[SiF6]+2h3O
СвойствоВ условиях нагрева до 1000 °C протекает реакция оксида кремния с активными металлами, что сопровождается образованием кремния.
Реакция 5Взаимодействие оксида кремния и магния приводит к образованию кремния и оксида магния:
SiO2+2Mg→Si+2MgO
Если восстановитель имеется в избытке, то реакция приведет к образованию силицидов:
SiO2+4Mg→Mg2Si+2MgO
СвойствоОксид кремния (IV) взаимодействует с неметаллами.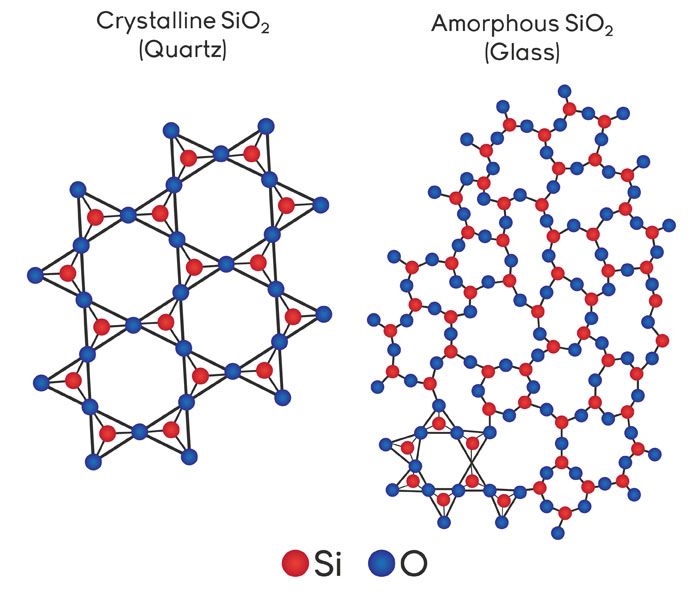
Реакция оксида кремния (IV) и водорода в жестких условиях сопровождается проявлением окислительных свойств со стороны оксида кремния:
SiO2+2Н2→Si+2Н2O
Реакция 7Взаимодействие оксида кремния с углеродом с образованием карборунда и угарного газа:
SiO2+3С→SiС+2СО
Реакция 8В процессе сплавления оксид кремния вступает в химическую реакцию с фосфатом кальция и углем (эта реакция используется в промышленном процессе получения фосфора):
3SiO2+Ca3(PO4)2+5C→3CaSiO3+5CO+2P
Получение и применение
Диоксид кремния широко распространен в земной коре, поэтому в промышленности в качестве его источника используют природные минералы.
Для получения аморфного кремния в лабораторных условиях прокаливают смесь из металлического магния и диоксида кремния. Перед постановкой опыта диоксид кремния тщательно измельчают. Когда смесь нагревается, начинает протекать активная химическая реакция. В результате образуется аморфный кремний как один из продуктов этого процесса.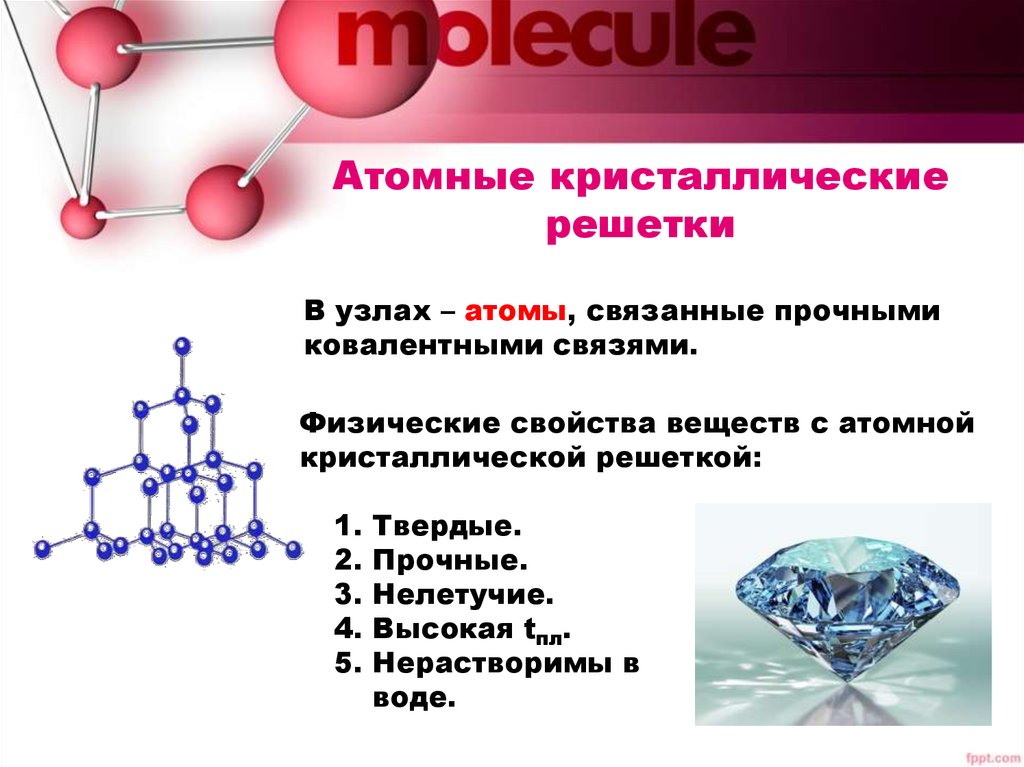
SiO2+2Mg→Si+2MgO
ПримечаниеВпервые кремний в свободном состоянии получил Я. Берцелиус в 1822 году. Латинское слово «силиций» является производным от латинского понятия «sileх», значение которого — «кремень».
Еще одним методом синтеза кремния в лабораторных условиях является восстановление с помощью алюминия.
Реакция 103SiO2+4Al→3Si+2Al2O3
Перечисленные способы получения кремния не являются эффективными в промышленных масштабах. Это связано с высокой ценой на алюминий и магний. По этой причине были разработаны другие способы синтеза вещества.
Вещество восстанавливают из оксида коксом, используя электрические печи. В результате получают кремний, насыщенный примесями карбидов кремния. Данный материал имеет ограниченные сферы применения. К примеру, такой продукт не подходит для производства микросхем.
SiO2+2C→Si+2CO
Получить более чистый материал можно с помощью восстановления тетрахлорида кремния цинком или водородом при нагревании до 1200 °C.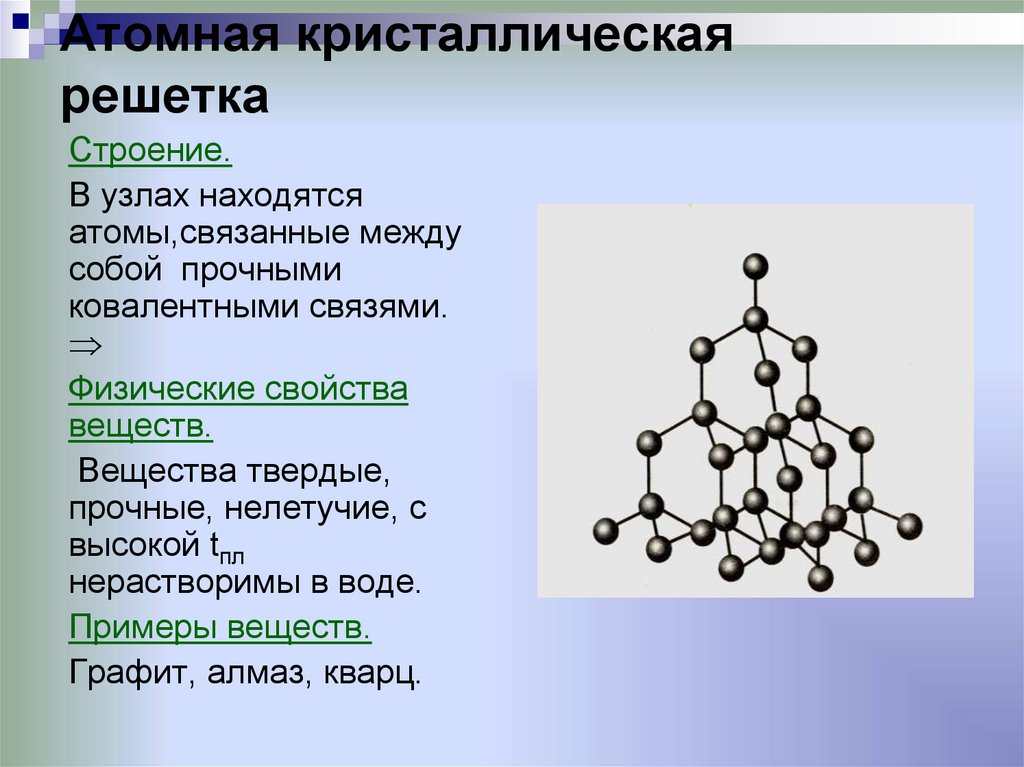

Leave A Comment