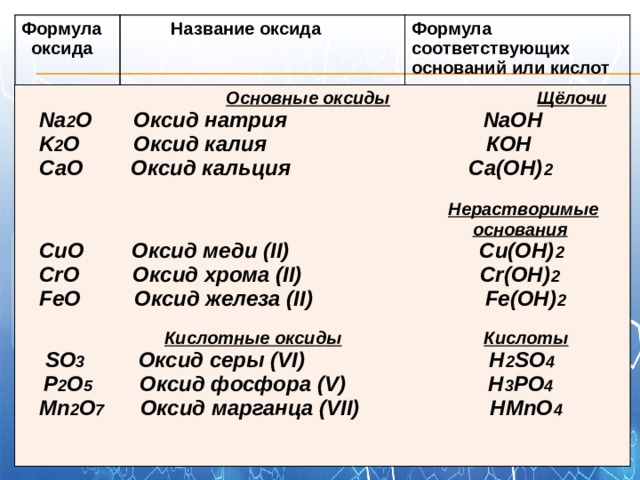
Оксид калия, характеристика, свойства и получение, химические реакции
Оксид калия, характеристика, свойства и получение, химические реакции.
Поделиться в:
Оксид калия – неорганическое вещество, имеет химическую формулу K2O.
Краткая характеристика оксида калия
Физические свойства оксида калия
Получение оксида калия
Химические свойства оксида калия
Химические реакции оксида калия
Применение и использование оксида калия
Краткая характеристика оксида калия:
Оксид калия – неорганическое вещество бесцветного либо бледно-желтого цвета.
Так как валентность калия равна одному, то оксид калия содержит один атом кислорода и два атома калия.
Химическая формула оксида калия K2O.
В воде не растворяется, а вступает в реакцию с ней.
Растворим в органических растворителях.
Обладает высокой гигроскопичностью.
Физические свойства оксида калия:
| Наименование параметра: | Значение: |
| Химическая формула | K2O |
| Синонимы и названия иностранном языке | potassium oxide (англ.) калия окись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные (иногда бледно-желтый) кубические кристаллы |
| Цвет | бесцветный, иногда – бледно-желтый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2320 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,32 |
| Температура кипения, °C | — |
| Температура плавления, °C | 740 |
| Температура разложения, °C | 300 |
| Гигроскопичность | высокая гигроскопичность |
| Молярная масса, г/моль | 94,196 |
* Примечание:
— нет данных.
Получение оксида калия:
Оксид калия получается в результате следующих химических реакций:
- 1. из пероксида калия:
Вначале получают пероксид калия.
2К + О2 → К2О2.
Затем пероксид калия обогащают калием.
К2О2 + 2К → 2К2О.
Напрямую оксид калия путем окисления самого калия не получается.
Химические свойства оксида калия. Химические реакции оксида калия:
Химически активное вещество.
Химические свойства оксида калия аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида калия с галогенами:
К2О + СІ2 → КСІ + КСІО;
К2О + Br2 → КBr + КBrО;
К2О + I2 → КI + КIО.
Оксид калия бурно реагирует с галогенами, образуя соответственно две соли:
– хлорид калия и гипохлорит калия,
– бромид калия и гипобромит калия,
– йодид калия и гипойодит калия.
2. реакция оксида калия с водой:
К2О + Н2О → 2КОН.
Оксид калия бурно реагирует с водой, образуя гидроксид калия.
3. реакция оксида калия с оксидом углерода (углекислым газом):
К2О + СО2 → К2СО3.
Оксид калия на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат калия.
4. реакция оксида калия с оксидом серы:
К2О + SО2 → К2SО3;
К2О + SО3 → К2SО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит калия, во втором случае – сульфат калия.
5. реакция оксида калия с оксидом кремния:
К2О + SiО2 → К2SiО3.
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат калия.
В результате реакции образуется соль – силикат калия.
Аналогично проходят реакции оксида калия и с другими кислотными оксидами.
6. реакция оксида калия с оксидом цинка:
К2О + ZnО → К2ZnО2.
Оксид цинка является амфотерным оксидом. Это значит, что как амфотерный оксид оксид цинка проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – цинкат калия.
Аналогично проходят реакции оксида калия и с другими амфотерными оксидами.
7. реакция оксида калия с плавиковой кислотой:
K2O + 2HF → 2KF + H2O.
В результате химической реакции получается соль – фторид калия и вода.
Аналогично проходят реакции оксида калия и с другими кислотами.
8. реакция оксида калия с бромистым водородом (бромоводородом):
K2O + 2HBr → 2KBr + H2O.
В результате химической реакции получается соль – бромид калия и вода.
9. реакция оксида калия с йодоводородом:
K2O + 2HI → 2KI + H2O.
В результате химической реакции получается соль – йодид калия и вода.
10. реакция оксида калия с жидким аммиаком:
K2O + NH3 → КОН + KNH2 (t = -50 oC).
В результате химической реакции получается гидроксид калия и амид калия.
Применение и использование оксида калия:
Оксид калия используется в сельском хозяйстве в качестве компонента минеральных удобрений, в строительстве в составе цемента, а также в химической промышленности для получения других соединений калия.
оксид калия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида калия
реакции с оксидом калия
Коэффициент востребованности 9 793
Оксид калия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Структура, формула, свойства и использование
Знаете ли вы, что натрий является наиболее активным металлом? Нет? Это калий! Калий подобен натрию, т. е. очень реактивен, мягок и энергичен. Из-за своей реакционной способности его держат в керосине. Подобно натрию, калий также реагирует с кислородом и образует оксид калия. Но можете ли вы ответить, является ли оксид калия ионным или ковалентным? Является ли это соединение кислотным или основным? Каковы области применения оксида калия?
Этот раздел позволит вам ответить на все подобные вопросы об оксиде калия.
Что такое оксид калия?
Это соединение, образованное связью между кислородом и калием. Он также известен как дикалийоксид или монооксид калия. Это неорганическое соединение. Как и оксид натрия, это также очень реакционноспособное и редко встречающееся соединение.
Легко догадаться, ионная она или ковалентная. Во-первых, калий — это металл, а металлы электроположительны, а кислород — один из сильно электроотрицательных элементов. Итак, происходит поляризация, и образующееся соединение является ионным.
Во-первых, калий — это металл, а металлы электроположительны, а кислород — один из сильно электроотрицательных элементов. Итак, происходит поляризация, и образующееся соединение является ионным.
Во-вторых, это объясняется структурой Льюиса оксида калия, которая объясняется далее.
Структура и формула оксида калия
Молекулярная формула K₂O. В общих чертах его называют оксидом щелочного металла. Это простейшее соединение калия, обладающее высокой реакционной способностью.
Это соединение является ионным соединением. Это связано с тем, что калий имеет только один электрон на внешней оболочке, а кислороду не хватает двух электронов, чтобы получить заполненный октет. Следовательно, два атома калия будут отдавать свои электроны атому кислорода и образовывать ионные связи. В результате форма соединения также является ионной.
Структура оксида калия по Льюису приведена ниже:
Ион калия имеет заряд +1, тогда как ион кислорода имеет заряд -2. Для электрически нейтрального соединения заряды должны уравновешивать друг друга. Следовательно, два атома К необходимы, чтобы уравновесить заряд -2 на атоме О. В результате формула для него K₂O.
Для электрически нейтрального соединения заряды должны уравновешивать друг друга. Следовательно, два атома К необходимы, чтобы уравновесить заряд -2 на атоме О. В результате формула для него K₂O.
Получение оксида калия
Некоторые методы его получения
1. С помощью пероксида калия:
- Полученный продукт представляет собой оксид калия при взаимодействии пероксида калия, т.е. K2O2, с металлическим калием.
K₂O₂ + 2K → 2K₂O
- При нагревании пероксида калия при 500°C он разлагается на чистый оксид калия и молекулы кислорода.
2K₂O₂ → 2K₂O + O₂ ↑
2. С помощью нитрата калия:
При обработке нитрата калия металлическим калием образуется оксид калия с выделением газообразного азота. Этот способ более выгоден, чем первый.
2KNO₃ + 10K → 6K₂O + N₂ ↑
3. С помощью гидроксида калия:
Гидроксид калия невозможно дегидратировать до оксида. Но он может реагировать с расплавленным калием с образованием оксида калия и выделением водорода в качестве побочного продукта.
Но он может реагировать с расплавленным калием с образованием оксида калия и выделением водорода в качестве побочного продукта.
2KOH + 2K ⇌ 2K₂O + H₂ ↑
4. С помощью металлического калия:
При взаимодействии металлического калия с кислородом образуется оксид калия. Эта реакция представлена как
4K + O₂ → 2K₂O
Физические свойства оксида калия
Калий относится к семейству натрия, т. е. к группе I периодической таблицы. Он имеет тенденцию завершать свой октет, высвобождая электроны. Поэтому он очень реактивен в свободной форме. Когда он обрабатывается кислородом, он легко образует связь с атомом О и образует оксид калия. Некоторые физические свойства оксида калия:
- Это бледно-желтое или белое кристаллическое и твердое соединение.
- Эта молярная масса составляет 94,2 г/моль.
- Широко используется в качестве удобрения.
- Плотнее воды. А плотность его 2,35 г/см³.

- Это соединение без запаха.
- Разлагается при 740°C.
- Растворим в этаноле и диэтиловом эфире.
- Его теплоемкость составляет 83,62 Дж/моль·К.
- Его молекулы образуют антифлюоритовую структуру.
Химические свойства оксида калия
Химические свойства соединения — это свойства, которые изменяют химический состав соединения. Поскольку калий является высокореактивным металлом, он является реакционноспособным соединением и может бурно реагировать.
- Реакция с избытком воды становится сильно коррозионной, и соединение образует гидроксид калия.
K₂O + H₂O → KOH
- Это оксид металла, и обычно оксиды металлов являются основными. Следовательно, он является основным или щелочным и очень агрессивным.
- При взаимодействии с сильными кислотами дает соль и воду. Эта реакция показывает, что это основное соединение.
K2O + HCl → KCl + H2O
K2O + H2SO4 → K2SO4 + H2O
K2O + HNO3 → 2KNO3 + H2O
Эти реакции являются примерами реакций нейтрализации.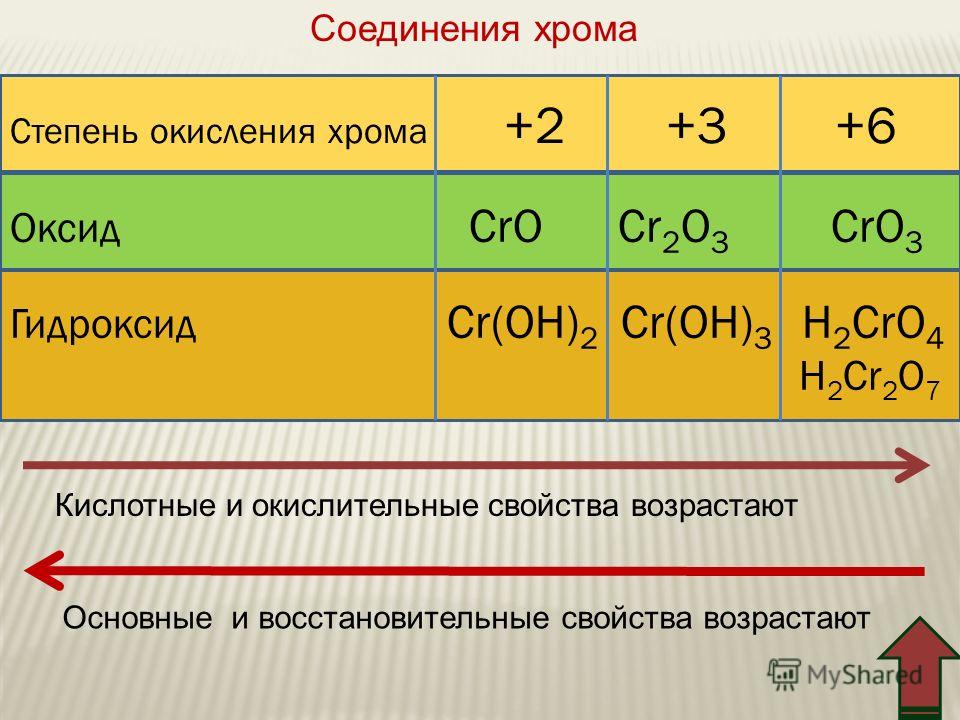
- При нагревании выше 300°C превращается в пероксид калия и металлический калий.
2K₂O → K₂O₂ + 2K
Использование и применение оксида калия
Он очень активен и легко реагирует с влагой. Он используется для различных целей. Некоторые из них
- В сельском хозяйстве широко используется в качестве удобрения.
- Он также используется в рецептурах для производства стекла и в цементной промышленности.
- Он нерастворим в воде и является очень стабильным соединением. Это свойство делает его удобным в керамической промышленности.
- Используется врачами-зоотехниками при лечении болезней животных.
- Как правило, он известен как чистый калий и используется для изготовления очков и мыла.
- В аэрокосмической промышленности используется для изготовления конструкционных компаундов и облегченных чаш.
- Подобно зигомицетам и др., грибковым инфекциям, он используется для лечения таких инфекций.

- В небольших количествах он также используется в некоторых лекарствах.
Меры безопасности при использовании оксида калия
Он полезен для различных целей, но его высокая реакционная способность делает его опасным химическим веществом. Поэтому при работе с ним необходимо соблюдать меры предосторожности. Однако, если вы каким-либо образом соприкоснулись с оксидом калия, необходимо немедленно принять меры по оказанию первой помощи. это
1. При попадании в глаза оксида калия:
- Немедленно промыть глаза большим количеством воды в течение не менее 30 минут.
- Промойте глаза, поднимая и опуская веки.
- Во время промывания глаз, если вы носили контактные линзы, снимите их.
- Немедленно обратитесь за медицинской помощью.
2. При попадании на кожу оксида калия:
- Как можно быстрее снимите всю загрязненную одежду.
- Немедленно промойте зараженный участок большим количеством воды.

- Немедленно обратитесь за медицинской помощью.
3. Если вы вдохнули оксид калия:
- Удалите человека, подвергшегося воздействию оксида калия, с его места.
- Начните оказание первой помощи, обеспечив ему искусственное дыхание, если его дыхание остановилось.
- Если его сердце перестало работать, сделайте ему сердечно-легочную реанимацию.
- Срочно доставить в медицинское учреждение.
Заключение
Прочитав вышеизложенную статью, вы теперь хорошо осведомлены об оксиде калия. Это неорганическая кислота с высокой реакционной способностью. Формула оксида калия K₂O. Он имеет основную или щелочную природу. Дает реакции нейтрализации при обработке сильными кислотами. Из-за своих различных свойств он используется в основном в качестве удобрения в сельском хозяйстве. Это полезно в стекольной, керамической и оптической промышленности. Он становится токсичным при проглатывании и вдыхании. Из-за его токсичности необходимо соблюдать меры предосторожности при работе с ним.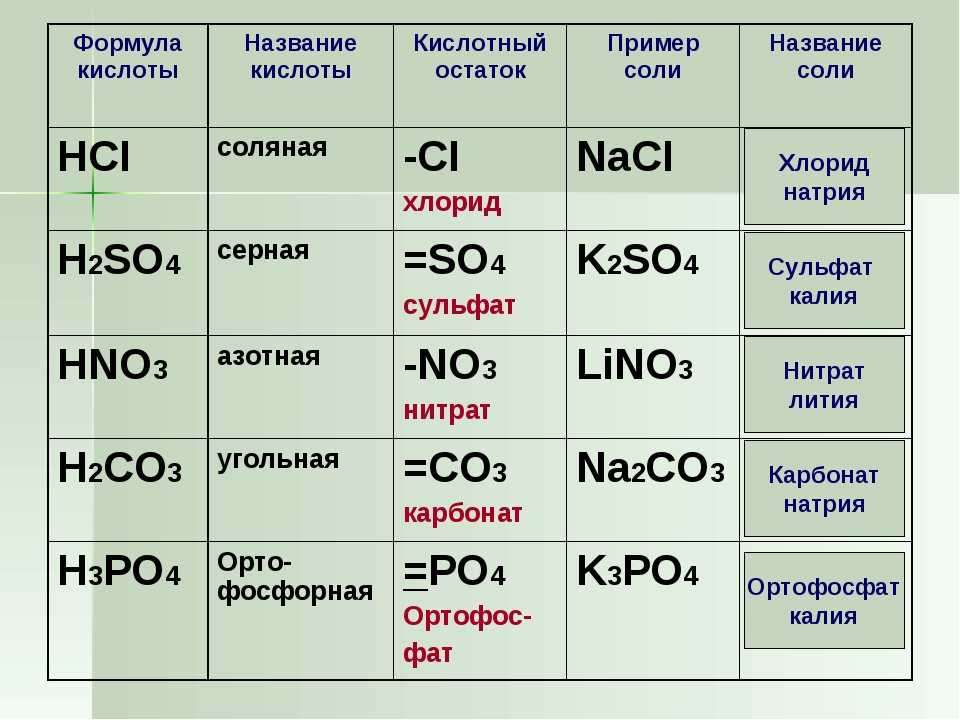
Часто задаваемые вопросы
1. Сколько типов оксидов образует калий на воздухе?A. Когда калий подвергается воздействию воздуха (то есть кислорода), он образует три типа оксидов. Образование оксида зависит от наличия кислорода во время реакции.
- Окись калия, K₂O
- Пероксид калия, K₂O₂
- Супероксид калия, KO₂
Реакция протекает как
8K + 4O₂ → 2K2O+ 2KO₂ + K₂O₂
2. Что такое супероксид калия?A. Супероксид калия представляет собой неорганическое соединение с химической формулой KO₂. Степень окисления кислорода в KO₂, супероксиде калия, равна -1. Это парамагнитное твердое вещество желтого цвета, которое разлагается во влажном воздухе. Он имеет другие химические и физические свойства, чем оксид калия или пероксид калия.
3. Опасен ли оксид калия для здоровья? A. Это неорганическое соединение с химической формулой K₂O.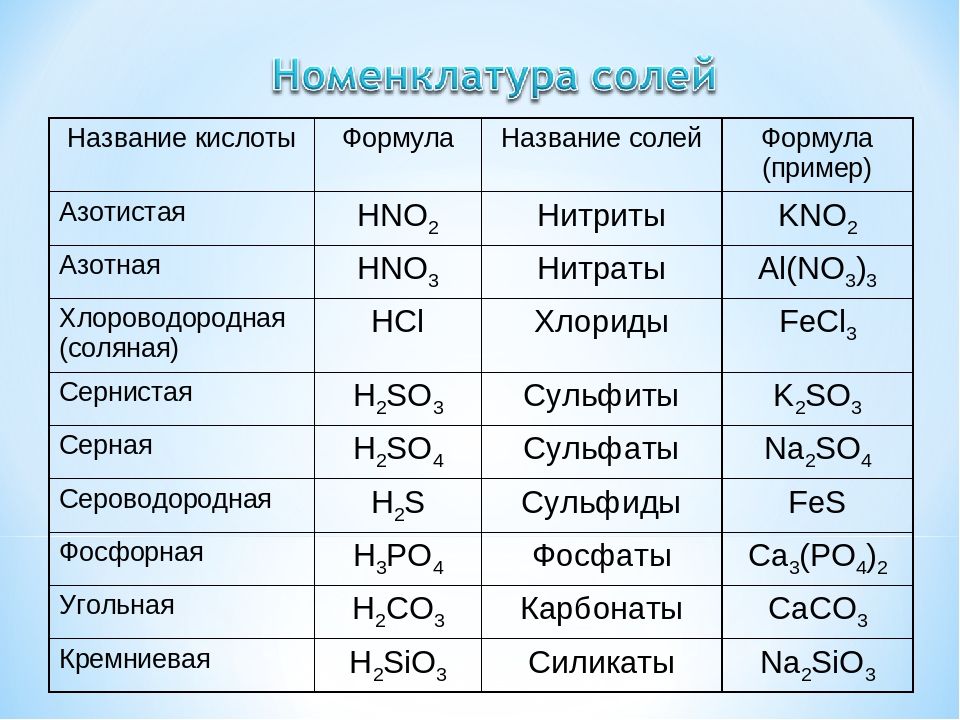 Он очень коррозионно-активен во влаге и воздухе. Таким образом, во время химических реакций или при работе с ним необходимо обращаться с ним осторожно и безопасно. Некоторые опасности для здоровья, вызванные оксидом калия,
Он очень коррозионно-активен во влаге и воздухе. Таким образом, во время химических реакций или при работе с ним необходимо обращаться с ним осторожно и безопасно. Некоторые опасности для здоровья, вызванные оксидом калия,
- При попадании на кожу может вызвать раздражение кожи.
- Попадание в глаза может серьезно их повредить.
- При вдыхании может вызывать кашель и одышку.
- При вдыхании может раздражать нос, горло и легкие.
Поэтому при работе в лаборатории с этим необходимо носить перчатки, лабораторные халаты и защитные очки.
4. При растворении оксида калия в воде какой рН образующегося раствора?A. Это ионное соединение, имеющее основную природу. При растворении в воде полностью распадается на ионы K⁺ и OH⁻. Концентрация ионов [OH⁻] используется для расчета рН раствора.
pH = 14 – pOH
pH = 14 – 1,48 = 12,52
Следовательно, pH образовавшегося раствора будет 12,52.
ICSC 0769 — ОКСИД КАЛИЯ
ICSC 0769 — ОКСИД КАЛИЯ« вернуться к списку результатов поиска
Китайский — ZHАнглийский — ENФинский — FIFФранцузский — FRНемецкий — DEИврит — HEВенгерский — HUIИтальянский — ITЯпонский — JAKКорейский — KOPПерсидский — FAПольский — PLПортугальский — PTРусский — RUSиспанский — ES
| КАЛИЯ ОКСИДА | ICSC: 0769 (октябрь 2006 г.) |
| Монооксид калия Диоксид калия | |
| Номер CAS: 12136-45-7 |
| № ООН: 2033 |
| Номер ЕС: 235-227-6 |
| ОСТРЫЕ ОПАСНОСТИ | ПРЕДУПРЕЖДЕНИЕ | ПОЖАРОТУШЕНИЕ | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючий. | Использовать порошок, двуокись углерода. НЕТ водосодержащих агентов. |
| ПРЕДОТВРАТИТЬ РАССЕЯНИЕ ПЫЛИ! ИЗБЕГАЙТЕ ВСЕХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАЩАЙТЕСЬ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРЕДУПРЕЖДЕНИЕ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Боль в горле. Кашель. Обжигающее ощущение. Затрудненное дыхание. Одышка. | Используйте местную вытяжку. Используйте защиту органов дыхания. | Свежий воздух, отдых. Полупрямое положение. Может потребоваться искусственное дыхание. Немедленно обратитесь за медицинской помощью. |
| Кожа | Покраснение. Боль. Серьезные ожоги кожи. | Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промойте кожу большим количеством воды или примите душ. Немедленно обратитесь за медицинской помощью. Немедленно обратитесь за медицинской помощью. |
| Глаза | Покраснение. Боль. Бернс. | Носите защитную маску или защиту для глаз в сочетании с защитой органов дыхания. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно). Немедленно обратитесь за медицинской помощью. |
| Проглатывание | Боль в горле. Ощущение жжения в горле и груди. Шок или коллапс. | Не ешьте, не пейте и не курите во время работы. | Прополоскать рот. Не вызывает рвоту. Немедленно обратитесь за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Средства индивидуальной защиты: костюм химической защиты, включая автономный дыхательный аппарат. Смести просыпанное вещество в закрытые сухие пластиковые контейнеры. Смойте остатки большим количеством воды. Смести просыпанное вещество в закрытые сухие пластиковые контейнеры. Смойте остатки большим количеством воды. | В соответствии с критериями СГС ООН ОПАСНОСТЬ Вызывает серьезные ожоги кожи и повреждение глаз Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от сильных кислот, пищевых продуктов и кормов. Сухой. | |
| УПАКОВКА | |
| Герметичный. Не перевозить с пищевыми продуктами и кормами. |
| КАЛИЯ ОКСИД | КМГС: 0769 |
| ФИЗИЧЕСКАЯ И ХИМИЧЕСКАЯ ИНФОРМАЦИЯ | |
|---|---|
Физическое состояние; Внешний вид Физические опасности Химическая опасность | Формула: К 2 О |
| ВОЗДЕЙСТВИЕ И ВЛИЯНИЕ НА ЗДОРОВЬЕ | |
|---|---|
Пути воздействия Последствия кратковременного воздействия | Опасность при вдыхании Последствия длительного или многократного воздействия |
| ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ НА РАБОЧЕМ МЕСТЕ |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|





Leave A Comment