Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
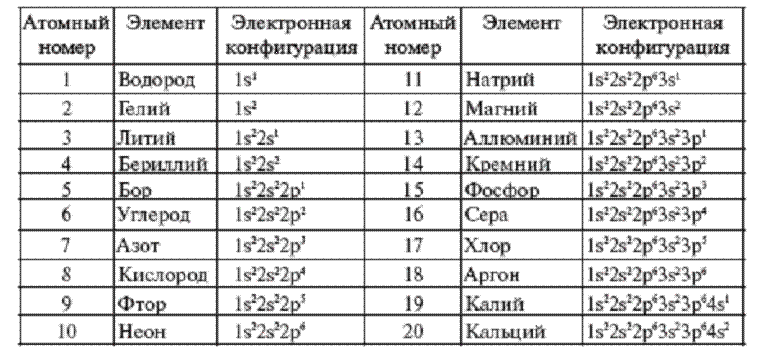
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную
электронную конфигурацию.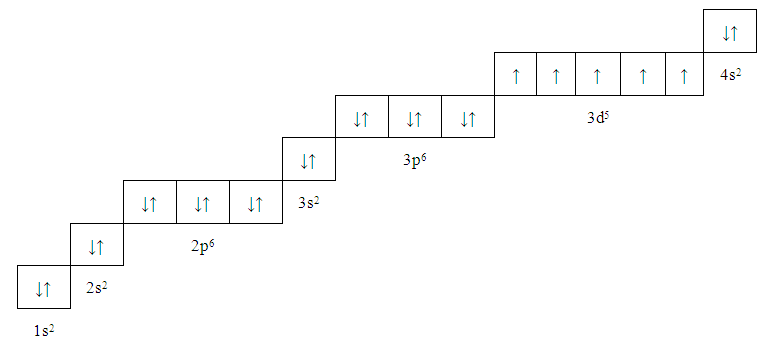
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
13 быстрых фактов, которые нужно знать —
В этой статье мы собираемся обсудить структуру Бао-Льюиса и 13 важных фактов, касающихся ее структуры и характеристик.
Оксид бария образуется при сжигании бария в присутствии кислорода. Это белое кристаллическое твердое вещество кубической структуры, негорючее и гигроскопичное по своей природе. Электронно-лучевая трубка состоит из бао. Он также используется при изготовлении коронных стекол и в качестве катализатора.
Bao состоит из двух элементов, т.е. бария (Ba) и кислорода (O). Ba является членом группы щелочноземельных металлов, то есть группы (II), а кислород является членом группы 16. Барий имеет атомный номер 56. Его электронная конфигурация [Xe] 6s2. Когда он теряет два электрона с 6s-орбитали, он приобретает ближайшую конфигурацию благородного газа, то есть Xe (Z=54).
Когда атом Ва теряет 2 электрона, образуется ион Ва+2. В случае кислорода он имеет атомный номер 8. Его электронная конфигурация — [He]2s.22p4. Когда он получает 2 электрона, он получает ближайшую конфигурацию благородного газа Ne, в которой выполняется октет. Затем ионы Ba+2 и O2- присоединяются электростатической силой притяжения, которая является сильной силой, и образуется bao.
Резонанс структуры Льюиса BaOРезонанс — это эмпирический процесс, в котором электроны перемещаются от одного атома к другому, теряя и приобретая электроны. Оксид бария представляет собой нейтральную молекулу, имеющую нулевой формальный заряд (fc). При резонансе BaO распадается на Ba+2 ион и О2- ион.
Оксид бария представляет собой нейтральную молекулу, имеющую нулевой формальный заряд (fc). При резонансе BaO распадается на Ba+2 ион и О2- ион.
И барий, и оксидный ион стабилизированы, потому что оба обладают стабильной ближайшей конфигурацией благородного газа после резонанса, то есть ион бария приобретает благородную электронную конфигурацию ксенона (Xe), а оксидный ион приобретает конфигурацию благородного газа неона (Ne), оба иона выполняют свой октет после резонанса.
Форма структуры Бао ЛьюисаСогласно теории ВСЕПР, бао имеет октаэдрическую координационную геометрию. В кристаллической структуре bao 6 ионов Ba2+ окружены 6 ионами O2- и 6 ионов O2- окружены 6 ионами Ba2+.
По этой причине ионы Ba2+ и O2- имеют координационное число равное 6. Так как bao имеет октаэдрический форма обладает гибридизацией d2sp3.
Формальные обвинения структуры Бао ЛьюисаВ оксиде бария общий формальный заряд соединения равен нулю. Bao ионизируется с образованием ионов Ba2+ и O2-. Барий имеет +2 формальных заряда, которые нейтрализуются кислородом 2- формальный заряд.
Bao ионизируется с образованием ионов Ba2+ и O2-. Барий имеет +2 формальных заряда, которые нейтрализуются кислородом 2- формальный заряд.
В кубической кристаллической решетке оксида бария 6 ионов Ba2+ окружены 6 ионами O2-, а 6 ионов O2- окружены 6 ионами Ba2+, что делает все соединение нейтральным.
Структурный угол Бао-ЛьюисаКак мы видели, форма Бао структура льюиса, Бао имеет октаэдрическую форму с гибридизацией d2sp3 и согласно октаэдрической геометрии угол должен быть 900. Бао также обладают таким же валентным углом, равным 900.
Правило октета структуры Бао ЛьюисаВ Бао структура льюиса и барий, и атом кислорода выполнили свой октет. Когда образуется bao, барий теряет два своих электрона и приобретает ближайшую конфигурацию благородного газа Xe, которая имеет 8 электронов в валентной оболочке (5s25p6). Т.е. выполняется октет.
Атом кислорода получает два электрона, которые отбрасываются атомом бария, чтобы иметь ближайшую конфигурацию благородного газа неона, который также имеет 8 валентных электронов (2s22p6). Следовательно, и барий, и атом кислорода выполнили свой октет.
Следовательно, и барий, и атом кислорода выполнили свой октет.
Когда мы видим Бао структура льюиса ноль неподеленных пар присутствует на Ba и 2 неподеленные пары электронов присутствуют на ионе оксида.
Это связано с тем, что барий теряет два своих электрона, образуя ион Ba2+, на котором нет ни одной неподеленной пары электронов. Но атом кислорода получает два электрона, которые отторгаются атомом Ba и превращаются в ион O2-, в котором присутствуют две неподеленные пары электронов.
Бао Валанс ЭлектронсВо-первых, чтобы узнать общее количество валентных электронов в Bao, необходимо знать электронную конфигурацию атомов Ba и O. Электронная конфигурация Ba — [Xe] 6s2, и из электронной конфигурации мы видим, что в валентной оболочке атома Ba имеется 2 электрона.
Электронная конфигурация атома O: [He]2s2 2p4. На валентной оболочке атома О находится 6 электронов. Общее количество валентных электронов, существующих на бао, будет равно (сумме валентных электронов атома Ва и О), т.е. равно (1*2)+(6*1)=8. В бао 8 валентных электронов.
Общее количество валентных электронов, существующих на бао, будет равно (сумме валентных электронов атома Ва и О), т.е. равно (1*2)+(6*1)=8. В бао 8 валентных электронов.
При распаде бао образуется ион Ва+2 и О2-. Оксид бария существует в кубической кристаллической решетке. структура. И барий, и кислород обладают гибридизацией d2sp3. т.е. бао имеет октаэдрическую координационную геометрию.
В структуре кристаллической решетки оксида бария каждый ион Ва+2 окружен шестью ионами О2-, а каждый ион О2 — шестью ионами Ва+2. Следовательно, и ион бария, и оксид-ион имеют одинаковое координационное число, равное 6.
Бао РастворимостьВ bao из-за более высокой электроотрицательности O и меньшей электроотрицательности атома Ba он существует в ионах Ba2+ и O2-, т.е. образуются противоположные диполи. Поскольку различные диполи создаются на ионах Ba2+ и O2-, он полярен по своей природе и растворим в полярных растворителях.
Он растворим в этанол (C2H5OH), разбавленные минеральные кислоты, такие как HCl, HBr, HI и т. д., а также растворимы в щелочах, таких как NaOH, KOH и т. д. Но нерастворимы в неполярных растворителях, таких как ацетон, эфир, жидкий аммиак. При взаимодействии оксида бария с водой образуется гидроксид бария [Ba(OH)2], имеющий щелочную природу.
Реакция BaO с водойЯвляется ли BaO ионным?Бао представляет собой ионное соединение. Это связано с тем, что бао диссоциирует с образованием ионов Ba2+ и O2- при растворении в водном растворе или в расплавленном состоянии. Это важная характеристика ионного соединения.
Он также проводит электричество в водном или расплавленном состоянии. Это связано с наличием Ba2+ и O2- ионы в обоих состояниях, и мы знаем что ионы переносят ток. Подобно ионным соединениям, бао растворяется в полярных растворителях, например в воде, этаноле и т. д.
Бао полярный или неполярный?Оксид бария является полярным соединением. Это связано с тем, что в оксиде бария и барий, и кислород имеют разную электроотрицательность, и, следовательно, на барии и кислороде создается противоположный диполь.
Это связано с тем, что в оксиде бария и барий, и кислород имеют разную электроотрицательность, и, следовательно, на барии и кислороде создается противоположный диполь.
Из-за меньшей электроотрицательности бария он размещает на себе положительный диполь, а из-за большей электроотрицательности атома О имеет отрицательный диполь. Поскольку в оксиде бария образуется противоположный диполь, это ионное соединение с высоким дипольным моментом. Следовательно, бао является полярным соединением.
BaO кислотный или основной?Ba имеет тенденцию к потере электронов, т.е. он является металлическим по своей природе. Это связано с тем, что Ba имеет более низкую электроотрицательность, а также приобретает стабильную электронную конфигурацию благородного газа Xe, теряя 2 электрона.
We известно, что оксид металла является основным по своей природе, т.е. когда основной оксид реагирует с водой, он образует щелочи. Аналогичным образом, когда bao реагирует с водой, он образует основной гидроксид, т. е. гидроксид бария, который имеет щелочную природу. Это потому, что он дает ионы ОН- в растворе.
е. гидроксид бария, который имеет щелочную природу. Это потому, что он дает ионы ОН- в растворе.
Учитывая вышеизложенные факты, можно заключить, что бао является стабильным ионным соединением. Поскольку это ионное соединение, оно полярно по своей природе, а также растворимо в полярных растворителях, а bao является основным оксидом, поскольку это оксид металла, т.е. Ba.
{Последняя обновленная Дата: 16 марта 2023 г.
•
Общее представление: 276,9K
•
Просмотры сегодня: 7,56K
Ответ
Проверено
276,9K+ виды
Hint:
20202 276,9K+ Eview
Hint: 2020202 276,9K+ Eviding
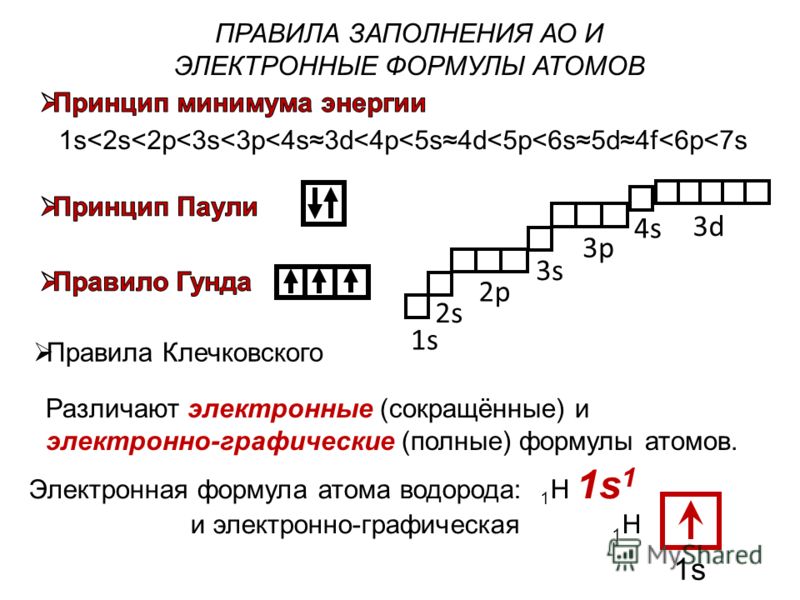
. атом/ион – это расположение в пространстве электронов вокруг центра массы (ядра) атома или иона среди орбит или оболочек. Это электронное распределение определяет химические свойства атомов.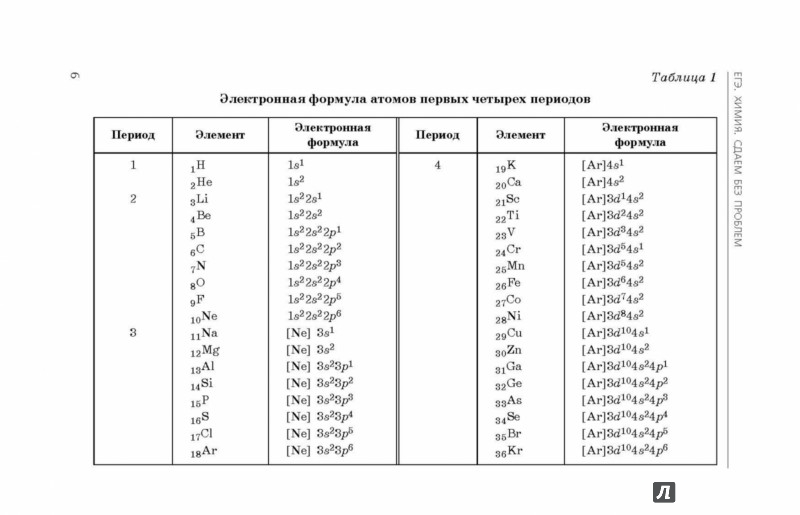
Полное пошаговое решение:
Существуют некоторые правила или принципы, по которым может быть написан электронный дистрибутив. Эти правила таковы:
А. Принцип Ауфбау: Этот принцип гласит, что электроны занимают более низкий энергетический уровень, прежде чем занять более высокий энергетический уровень. Например: оболочка 2s заполняется до оболочки 2p. Согласно принципу Ауфбау, энергия орбиталей зависит от значения \[{\text{(L + S)}}\]. Чем выше значение \[{\text{(L + S)}}\], тем выше будет энергия орбитали и наоборот. 96}\].
Правильный вариант A.
Примечание: Это электронное распределение определяет химические свойства атомов. Чем выше значение \[{\text{(L + S)}}\], тем выше будет энергия орбитали и наоборот. Запомните эти три правила электронного распределения атома/иона.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Какой из следующих элементов имеет самый высокий электродный потенциал 12-го класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 12-го класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11-го класса химии JEE_Main
Получен фосфин из следующей руды А Кальций класс 12 химии JEE_Main
В Индии по случаю бракосочетания фейерверк класс 12 химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы класс 12 химии JEE_Main
Какой из следующих элементов имеет самый высокий электродный потенциал 12-го класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 12-го класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11-го класса химии JEE_Main
Получен фосфин из следующей руды A Кальций класс 12 химия JEE_Main
Тенденции сомнений
9.
 6: Электронные конфигурации ионов
6: Электронные конфигурации ионов- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 372227
Цели обучения
- Предсказать заряд обычных металлических и неметаллических элементов и записать их электронные конфигурации
Электронная конфигурация катионов
При образовании катиона атом элемента главной группы имеет тенденцию терять все свои валентные электроны, принимая таким образом электронную структуру благородного газа, предшествующего ему в периодической таблице. Для групп 1 (щелочные металлы) и 2 (щелочноземельные металлы) номера групп равны числам электронов валентной оболочки и, следовательно, зарядам катионов, образующихся из атомов этих элементов, когда все электроны валентной оболочки удаляются. Например, кальций является элементом группы 2, нейтральные атомы которого имеют 20 электронов и электронную конфигурацию в основном состоянии 1,9.0108 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 . Когда атом Ca теряет оба своих валентных электрона, получается катион с 18 электронами, зарядом 2+ и электронной конфигурацией 1 s 2 2 s 2 2 p 6 3 с 2 3 р 6 . Са 2 9Таким образом, ион 0110 + изоэлектронен благородному газу Ar.
Например, кальций является элементом группы 2, нейтральные атомы которого имеют 20 электронов и электронную конфигурацию в основном состоянии 1,9.0108 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 . Когда атом Ca теряет оба своих валентных электрона, получается катион с 18 электронами, зарядом 2+ и электронной конфигурацией 1 s 2 2 s 2 2 p 6 3 с 2 3 р 6 . Са 2 9Таким образом, ион 0110 + изоэлектронен благородному газу Ar.
Для групп 12–17 номера групп превышают число валентных электронов на 10 (с учетом возможности полных d подоболочек в атомах элементов четвертого и более высоких периодов). Так, заряд катиона, образованного потерей всех валентных электронов, равен номеру группы минус 10. Например, алюминий (в 13-й группе) образует ионы 3+ (Al 3 + ).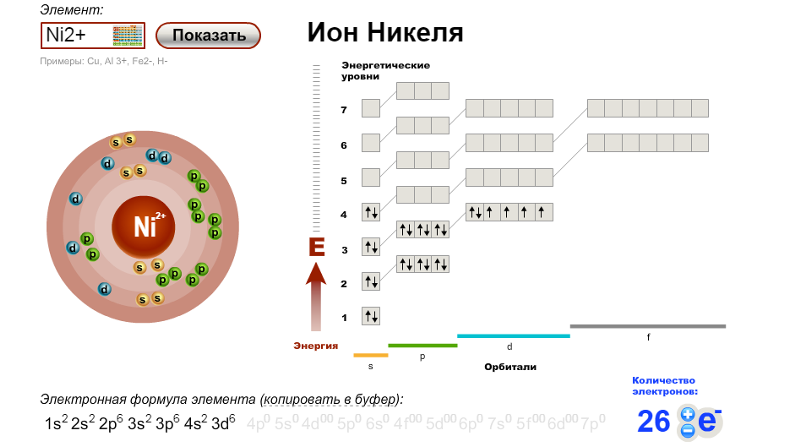
Исключения из ожидаемого поведения включают элементы в нижней части групп. Помимо ожидаемых ионов Tl 3 + , Sn 4 + , Pb 4 + , Bi 5 + и Bi 5 + , а также частичная потеря валентности этих атомов электронов оболочки + , Sn 2 + , Pb 2 + , Bi 3 + ионы. Образование этих катионов 1+, 2+ и 3+ связывают с эффектом инертной пары, отражающим относительно низкую энергию валентности s 92+}\) (ион, образованный из двух атомов ртути, со связью Hg-Hg), в дополнение к ожидаемому одноатомному иону Hg 2 + (образован только из одного атома ртути).
Переходные и внутренние переходные металлы ведут себя иначе, чем элементы основной группы. Большинство катионов переходных металлов имеют 2+ или 3+ заряда, которые возникают в результате потери их самого внешнего s электрона (ов), а иногда с последующей потерей одного или двух d электронов из ближайшей к самой внешней оболочке. Например, железо (1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 6 4 s 2 ) forms the ion Fe 2 + (1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 6 ) за счет потери 4 с электронов и иона Fe 3 + (1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 5 ) потерей 4 s электронов и одного из 3 d электронов. Хотя d орбиталей переходных элементов — в соответствии с принципом Ауфбау — заполняются последними при построении электронных конфигураций, самые внешние s электронов теряются первыми при ионизации этих атомов.
Например, железо (1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 6 4 s 2 ) forms the ion Fe 2 + (1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 6 ) за счет потери 4 с электронов и иона Fe 3 + (1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 5 ) потерей 4 s электронов и одного из 3 d электронов. Хотя d орбиталей переходных элементов — в соответствии с принципом Ауфбау — заполняются последними при построении электронных конфигураций, самые внешние s электронов теряются первыми при ионизации этих атомов. Когда внутренние переходные металлы образуют ионы, они обычно имеют заряд 3+ в результате потери своих самых внешних s электронов и d или f электронов.
Когда внутренние переходные металлы образуют ионы, они обычно имеют заряд 3+ в результате потери своих самых внешних s электронов и d или f электронов.
Пример \(\PageIndex{1}\): Определение электронной структуры катионов
Существует не менее 14 элементов, отнесенных к категории «необходимых микроэлементов» для человеческого организма. Их называют «незаменимыми», потому что они необходимы для здоровых функций организма, «следовыми», потому что они требуются только в небольших количествах, и «элементами», несмотря на то, что на самом деле они являются ионами. Два из этих основных микроэлементов, хром и цинк, необходимы как Cr 9.0110 3
Раствор
Сначала напишите электронную конфигурацию нейтральных атомов:
- Zn: [Ar]3 d 10 4 s 4 2
- Cr: [Ar]3 d 5 4 s 1
Затем удалите электроны с самой высокой энергетической орбитали.
- Zn 2 + : [Ar]3 d 10
- Cr 3 + : [Ar]3 d 3
Упражнения \(\PageIndex{1}\)
В нашем рационе необходимы калий и магний. Напишите электронные конфигурации ионов, ожидаемых от этих элементов.
- Ответить
К + : [Ar], Mg 2 + : [Ne]
Электронные конфигурации катионов: https://youtu.be/Y—6wNGD5Hk
Электронные конфигурации анионов
Большинство одноатомных анионов образуются, когда нейтральный атом неметалла получает достаточное количество электронов, чтобы полностью заполнить свою внешнюю s и p орбиталей, тем самым достигая электронной конфигурации следующего благородного газа. Таким образом, определить заряд такого отрицательного иона несложно: заряд равен числу электронов, которые необходимо получить, чтобы заполнить s и p орбитали родительского атома. Кислород, например, имеет электронную конфигурацию 1 s 2 2 s 2 2 p 4 , тогда как анион кислорода имеет электронную конфигурацию благородного газа неона (Ne1), 80 1 900 с 2 2 с 2 2 р 6 . Два дополнительных электрона, необходимые для заполнения валентных орбиталей, придают иону оксида заряд 2– (O 2–).
Два дополнительных электрона, необходимые для заполнения валентных орбиталей, придают иону оксида заряд 2– (O 2–).
Пример \(\PageIndex{2}\): определение электронной структуры анионов
Селен и йод являются двумя важными микроэлементами, образующими анионы. Напишите электронные конфигурации анионов.
Solution
Se 2 – : [Ar]3 d 10 4 s 2 4 p 6
I – : [Kr]4 д 10 5 с 2 5 p 6
Упражнение \(\PageIndex{2}\)
Напишите электронные конфигурации атома фосфора и его отрицательного иона. Назовите заряд аниона.
- Ответить
P: [Ne]3 с 2 3 p 3
P 3– : [Ne]3 s 2 3 p 6
Электронные конфигурации анионов: https://youtu.be/Eg6ZwdNCQrM
Резюме
Атомы приобретают или теряют электроны, образуя ионы с особенно стабильной электронной конфигурацией. Заряды катионов, образованных репрезентативными металлами, могут быть легко определены, поскольку, за немногими исключениями, электронные структуры этих ионов имеют либо конфигурацию инертного газа, либо полностью заполненную электронную оболочку. Заряды анионов, образованных неметаллами, также можно легко определить, поскольку эти ионы образуются, когда атомы неметаллов приобретают достаточно электронов, чтобы заполнить свои валентные оболочки.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Метки



Leave A Comment