Что объединяет нервную систему, кишечные микробы и пресноводную гидру
Биология
Гидра (Hydra vulgaris)
: 13.07.2020
Собственная независимая нервная сеть есть не только у сердца, но и у кишечника. Именно она заставляет его сокращаться. И судя по недавнему исследованию на древних водных беспозвоночных (пресноводных гидрах), у этого процесса нашелся неожиданный «кукловод» – кишечный микробиом. Новые результаты открывают и новые возможности в терапии болезней, связанных с нарушениями кишечной перистальтики
Кажется очевидным, что нервная система с самого начала своего возникновения у многоклеточного организма в ходе эволюции отвечала за его чувствительные и двигательные функции. Но, судя по недавним исследованиям ученых из Кильского университета (Германия), она с самого начала решала задачу налаживания взаимодействия между самим организмом и населяющими его симбиотическими микробами (микробиомом). Причем посредником в этом случае выступал «предшественник» еще одной важнейшей системы – иммунной.
В качестве объекта исследований ученые выбрали пресноводную гидру (Hydra vulgaris) – представителя древнего типа кишечнополостных организмов. Это крошечное создание, обитающее на нашей планете уже более 600 млн лет, обладает удивительной способностью к регенерации: даже разрезанная пополам, гидра быстро восстанавливает нервную, мышечную и другие ткани.
Основная, более тонкая и длинная часть тела этого просто устроенного сидячего организма представлена пищеварительной трубкой, которая начинает сокращаться, когда гидра своими щупальцами захватывает проплывающую мимо мелкую добычу. И-за таких ритмичных перистальтических движений тело гидры может служить неплохой моделью (прототипом) кишечника высших животных. Кстати сказать, у гидр есть и свой «микробиом», представленный симбиотическими одноклеточными водорослями.
Как известно, стенки нашего кишечника волнообразно сокращаются, что способствует продвижению его содержимого. Как и биение сердца, правильную перистальтику кишечника обеспечивает сеть пейсмекерных нейронов («водителей ритма»), способных самостоятельно генерировать ритмические электрические потенциалы. Их работа очень важна: нарушения перистальтики вызывают крайне неприятные желудочно-кишечные расстройства, такие как синдром раздраженного кишечника или хронический запор.
Их работа очень важна: нарушения перистальтики вызывают крайне неприятные желудочно-кишечные расстройства, такие как синдром раздраженного кишечника или хронический запор.
Изучая в нейронах пресноводной гидры совокупности молекул РНК, по которой можно судить об активности тех или иных генов, немецкие ученые обнаружили у нее нервные клетки, подобные нейронам – «водителям ритма» человека, участвующим в контроле моторики кишечника. В этих прототипах пейсмейкерных нейронов активировались те же гены, что и у людей с синдромом разраженного кишечника.
Ранее ученые выяснили, что все нейроны гидры секретируют антимикробные белки, а в водителях ритма дополнительно активируются гены, кодирующие иммунные молекулы, которые могут взаимодействовать с микробами. Из этого следовало, что перистальтика у гидр зависит не только от работы пейсмейкерных нейронов, но и, каким-то образом, от микробиоты. Что и было подтверждено в эксперименте, в ходе которого изменение симбиотической микрофлоры привело к изменению активности генов-водителей ритма и, соответственно, к нарушению перистальтики тела гидр.
Возможно ли, что перистальтика желудочно-кишечного тракта человека также зависит от населяющего его микробного сообщества? Если это так, и наши нейроны-водители ритма, как и у гидры, умеют «общаться» с кишечной микробиотой, то это открывает новые перспективы для разработки способов терапии болезней человека.
Что касается теоретической биологии, то полученные результаты заставляют переосмыслить совместную эволюцию иммунной и нервной систем, учитывая возможные коммуникации между нейронами и микробиомом через иммунные рецепторы. Сама ось «микробиота–кишечник–мозг», возможно, возникла еще на заре эволюции многоклеточных существ, и это было важным приобретением, что и доказывают результаты сравнительных исследований нейронов-пейсмейкеров у гидры, круглого червя (Caenorhabditis elegans) и обычной мыши. Эти три очень разных и эволюционно далеких организма оказались очень схожи по профилю активности генов, кодирующих иммунные рецепторы, и путям, позволяющим этим нейронам взаимодействовать с микроорганизмами.
Фото: https://uk.m.wikipedia.org и https://commons.wikimedia.org
: 13.07.2020
Открытый урок по биологии в 7-м классе по теме «Тип Кишечнополостные. Общая характеристика. Пресноводная гидра»
Категория: Биология.
Учебник В.М. Константинова, В.Г. Бабенко, B.С. Кучменко. «Биология – животных 7 класс». (Концентрическая программа)
Цели урока:
- раскрыть особенности внешнего и внутреннего строения пресноводной гидры в связи со средой обитания,
- показать особенности строения, внутреннего слоя клеток тела гидры и их функциональное значение,
- дать представление о рефлексе и его роли в установлении целостности организма и его взаимосвязи со средой,
- показать родство многоклеточных и одноклеточных животных.
Задачи урока:
- добиваться усвоения учащимися знаний об особенностях строения и жизнедеятельности кишечнополостных, как низших многоклеточных животных, их приспособленность к среде обитания,
- продолжить формирование научного мировоззрения на основе знаний о взаимосвязях кишечнополостных и одноклеточных организмов,
- продолжать обучать учащихся умениям распознавать и сравнивать различные клетки тела гидры одноклеточные и многоклеточные организмы, составлять общую характеристику типа;
- в работе с учебником находить главные мысли в тексте параграфа, составлять план рассказа.

Оборудование: влажные препараты «Актиния» и «Медуза», таблицы: «Тип Кишечнополостные», «Тип Простейшие», кинофильм «Кишечнополостные», презентация урока «Тип Кишечнополостные. Гидра».
I. Актуализация знаний.Урок начинается с повторения пройденного материала: фронтальный опрос по таблице «Тип простейшие».
- Какое строение имеет клетка простейших? Почему она является самостоятельным организмом?
- Назовите органеллы простейших. Какие функции они выполняют?
- Какими способами размножаются простейшие? Кратко охарактеризуйте эти способы.
- Назовите известные вам заболевания, вызываемые простейшими, и меры предупреждения этих заболеваний?
Учитель подводит итог, повторению отмечая, что на примере изучения простейших учащиеся узнали об одноклеточных микроскопических животных, имеющих большое значение в природе и жизни человека.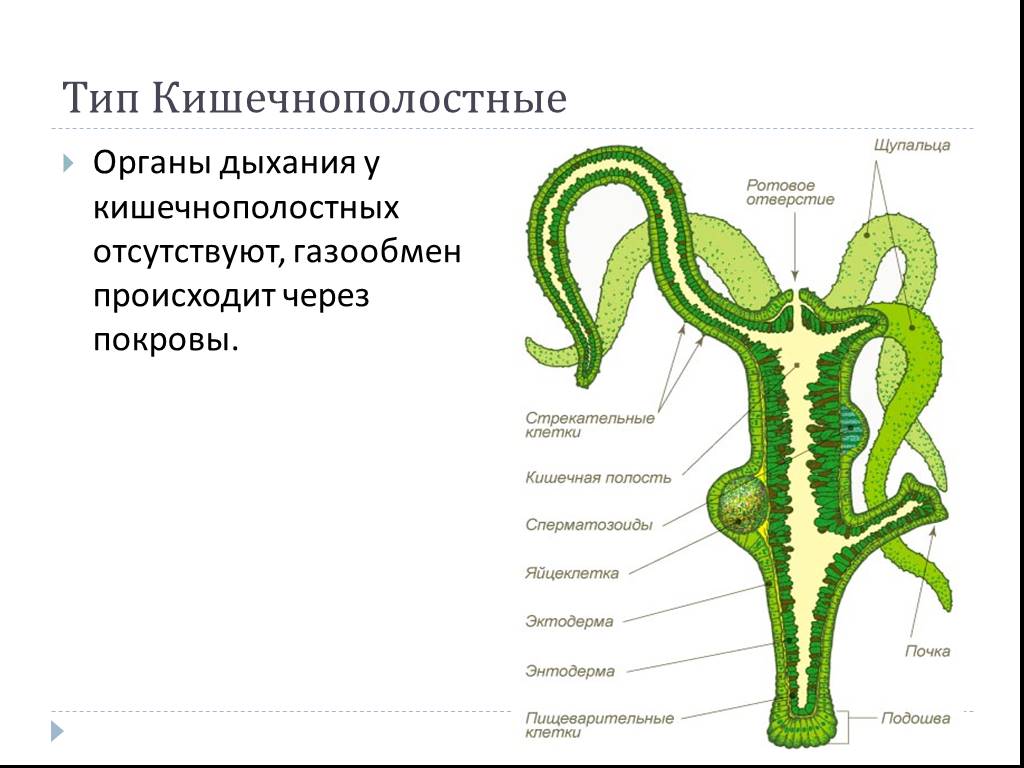
Затем учитель демонстрирует влажные препараты медузы и актинии.
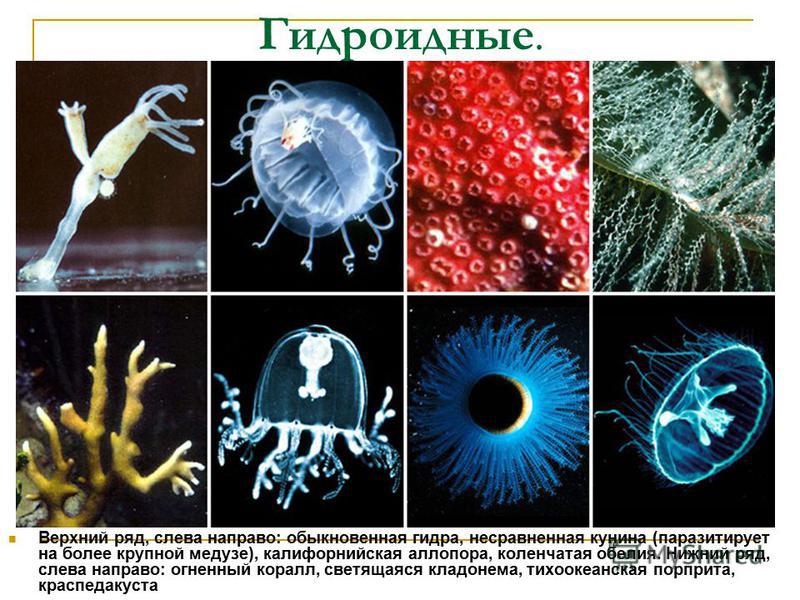
Учитель сообщает, что на сегодня на уроке ребята будут проходить новую тему «Тип Кишечнополостные». Записывают ее на доске. Обращается внимание учеников, на строение слова. Слово состоит из двух частей (кишечник и полость), объясняет названия, используя сведения из древнегреческой мифологии. Демонстрируются кадры из фильма «Кишечнополостные» — представителей этого типа. Ребята видят, что к этому типу относятся не только актиния и медуза, но и кораллы, гидры, полипы. Учитель уточняет, что кишечнополостные, это двухслойные многоклеточные животные (слайд 1).
Также этот тип делится на три класса:
- Класс Гидроидные.
- Класс Коралловые полипы.
- Класс Сцифоидные медузы.
Заполните таблицу №1 , используя $ 13 учебника (схема таблицы дается на карточках, чтобы сэкономить время).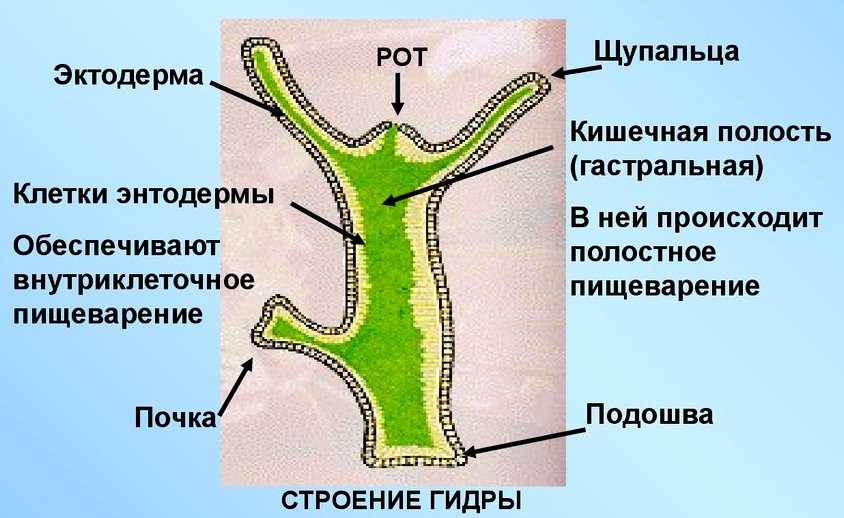
| Тип | ||
| Класс | Класс | Класс |
| Представители | Представители | Представители |
На сегодняшнем уроке мы познакомимся с представителем, типа Кишечнополостных, класса Гидроидных пресноводным полипом гидрой.
Важно раскрыть понятие «лучевая симметрия
Учитель объясняет, что полип, в переводе с греческого – многоног, т.е. имеет много щупалец (слайд 3, схема лучевой симметрии слайд 4). Эти щупальца как лучи расходятся во все стороны. Такая симметрия тела называется «лучевой». Она характерна для малоподвижных форм животных.
В учебнике на странице 57 прочитайте и запишите, какова среда обитания и величина пресноводной гидры (ребята находят, зачитывают и записывают в тетрадь.)
Далее учитель на слайдах показывает внешнее строение пресноводной гидры. Вместе с учащимися зарисовывает на доске, обозначая части тела гидры (слайд 3).
Для выяснения внутреннего строения гидры учитель и ученики рассматривают слайд 5, 6.
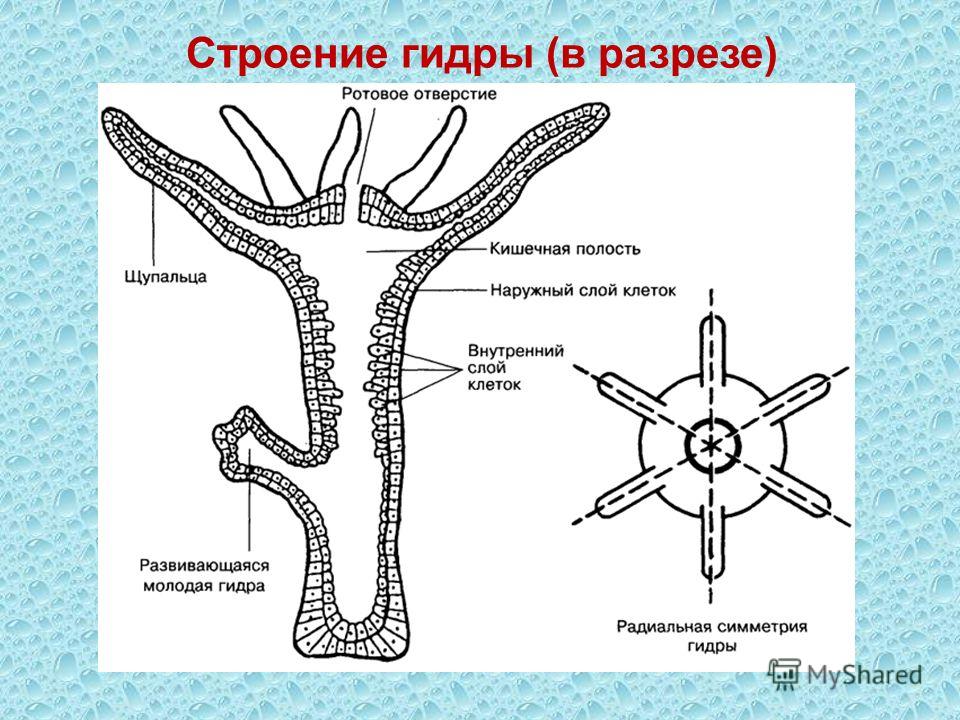
Вопрос к классу: из скольких слоев клеток состоит тело гидры? Как они называются? (слайд 6)
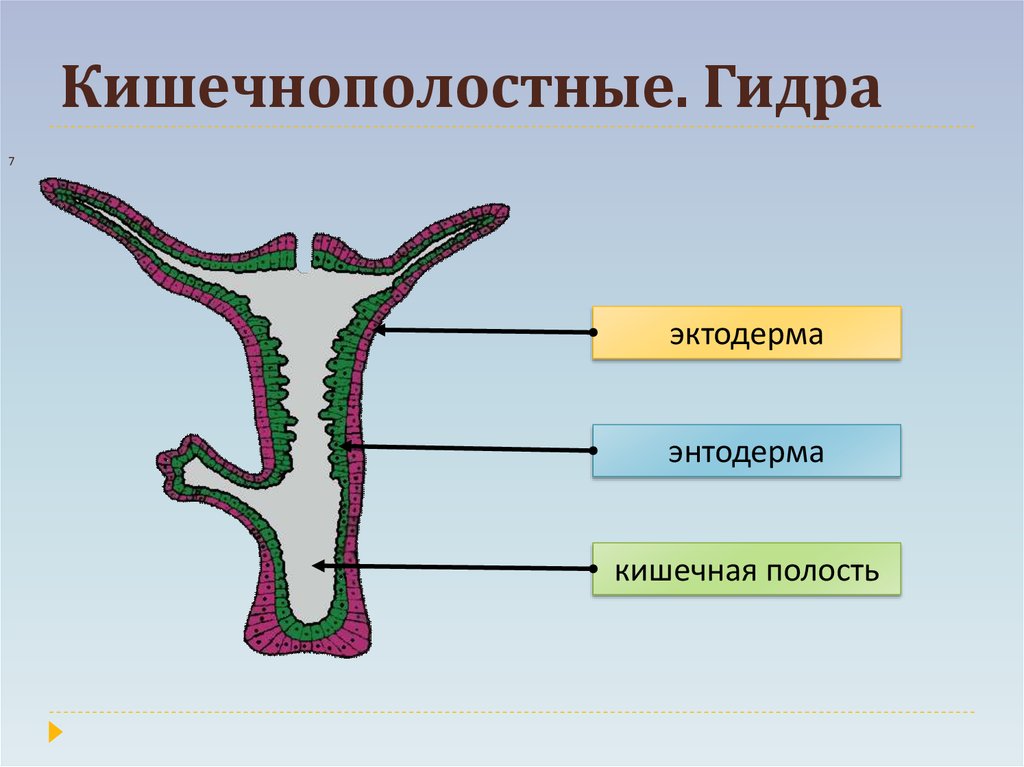
Учитель обобщает ответы учащихся, отметив, что гидра – двухслойное животное многоклеточное животное, тело гидры имеет наружный — эктодермальный и внутренний – энтодермальный слои.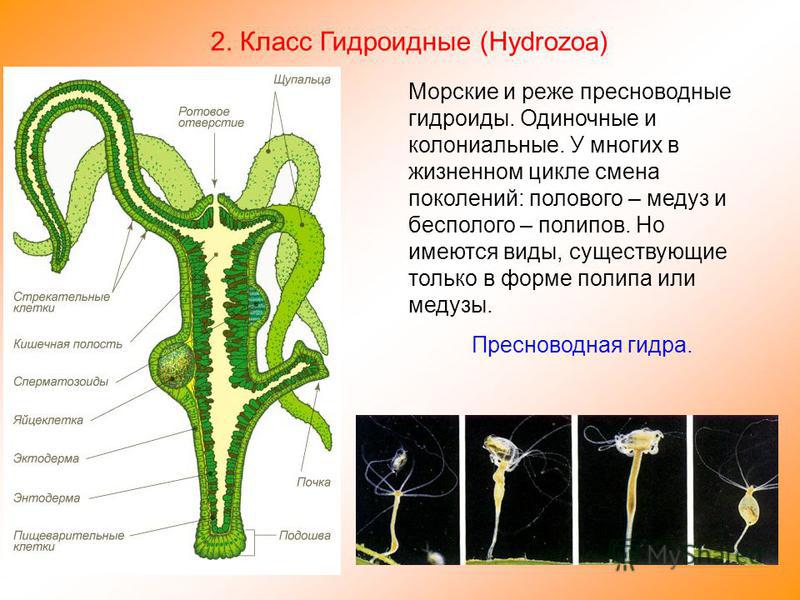 На доске выполняется таблица учителем, а ребята – делают ее в тетради.
На доске выполняется таблица учителем, а ребята – делают ее в тетради.
| Эктодерма (наружный слой) | Энтодерма (внутренний слой) |
| Кожно-мускульные (покровы тела, сокращение). | Пищеварительные клетки (пищеварение внутри клетки, образование пищеварительных вакуолей). |
| Стрекательные (нападение, защита) | Железистые клетки (выделение пищеварительного сока). |
| Половые (размножение). | |
| Нервные (образование диффузной нервной системы). | |
| Промежуточные клетки (регенерация) |
Одновременно с заполнением таблицы учитель продолжает объяснение о строении клеток эктодермы и энтодермы.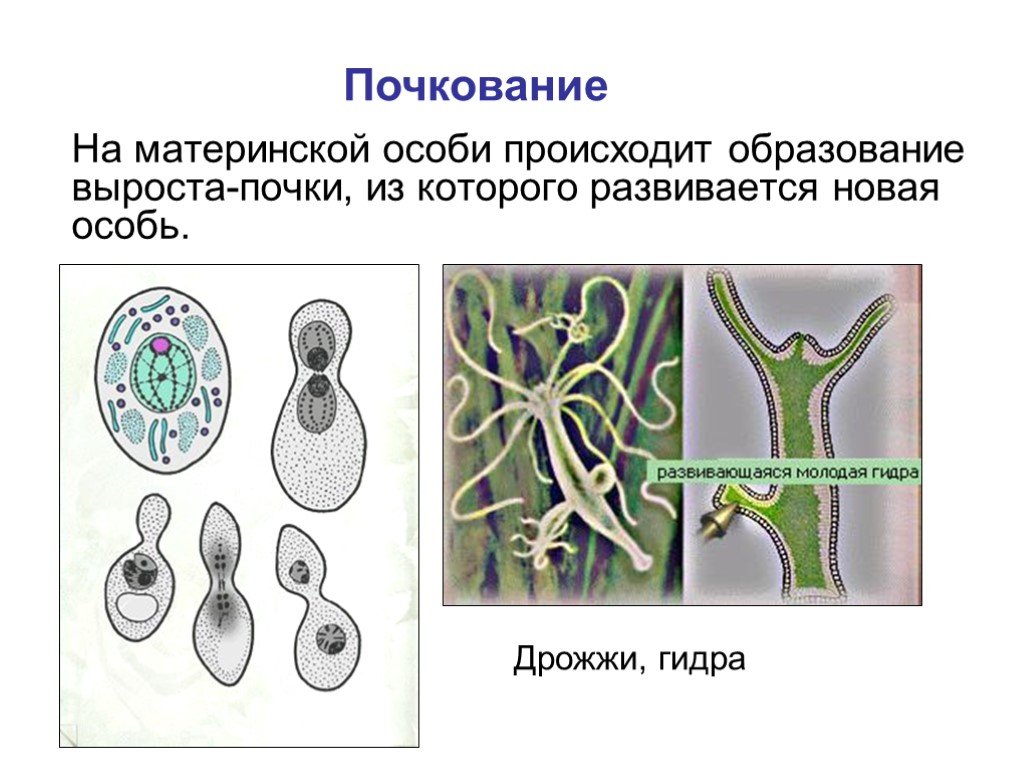
Кожно-мускульные клетки имеют внутреннее мышечное волоконце. При помощи него они хорошо сокращаются (слайд 8).
Нервные клетки имеют необычную форму – звездчатую с несколькими отростками (слайд 9). Отростки соседних нервных клеток соприкасаются между собой и образуют нервные сплетения или нервную сеть. Нервные отростки способны воспринимать различные раздражения (свет, тепло, механические воздействия), в результате чего в нервных клетках развивается возбуждение, которое передается по ним ко всем частям тела, а также к кожно – мускульным, вызывая ответную реакцию – сокращение гидры. Т.о. мы рассмотрели такое явление как рефлекс (слайд 10,11; рисунок в учебнике 40).
Если гидру часто тревожат, то она уйдет со своего места, кувыркаясь через голову. Движение происходит медленно (слайд13, показывающий движение гидры ).Далее рассматриваются стрекательные клетки или крапивные.

Вопрос к классу: почему стрекательных клеток больше всего на щупальцах? (защита).
Кроме того, стрекательные клетки служат средством нападения на добычу. Стрекательные клетки имеют стрекательную капсулу, стрекательную нить, чувствительный волосок (слайд 14).Промежуточные клетки самые мелкие в эктодерме, но играют значительную роль в жизни гидры (слайд 15), т.к. восстанавливают утраченные части тела. Это явление называют регенерация. Запишите определение в тетрадь. На стр.61 прочитайте более подробно, что такое регенерация.
Половые клетки формируются на теле гидры с приближением холодов.
Вопрос к классу: вспомните, как называются половые клетки? (гаметы)
Обозначаются значками:
Гаметы формируются на одной гидре (слайд 5). Половые клетки, содержащие мужские гаметы разрываются они выходят в воду.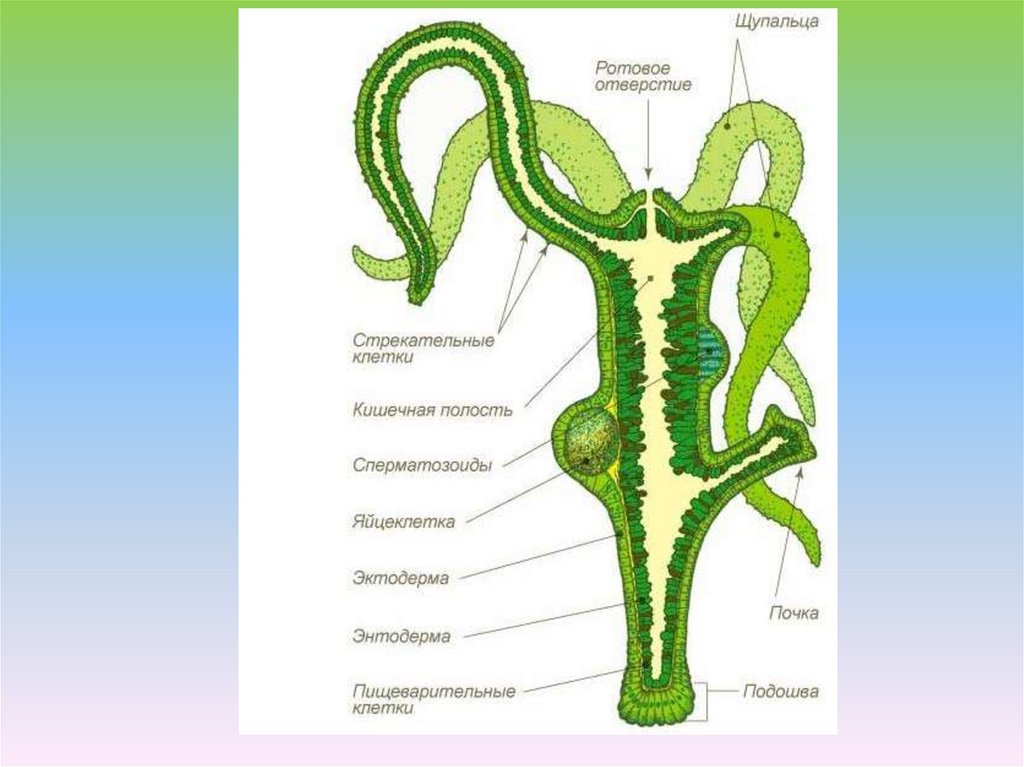 Мужские гаметы подплывают к женской гамете, которая находится на теле гидры и формируется зигота. Когда гидра погибает, зигота, покрывается плотной оболочкой, остается на дне водоема и зимует. На следующий год появляется новая гидра. Если гаметы формируются на теле одного организма, то такие организмы называются
Мужские гаметы подплывают к женской гамете, которая находится на теле гидры и формируется зигота. Когда гидра погибает, зигота, покрывается плотной оболочкой, остается на дне водоема и зимует. На следующий год появляется новая гидра. Если гаметы формируются на теле одного организма, то такие организмы называются
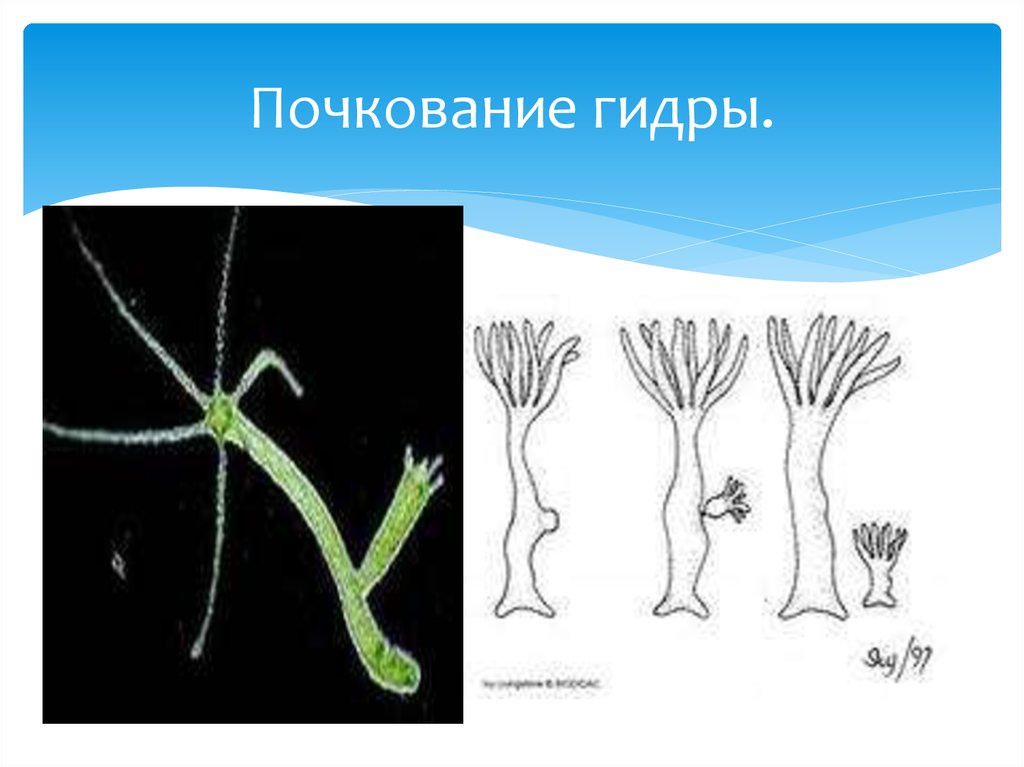
Летом гидра размножается почкованием. Это бесполый путь размножения. Давайте посмотрим кадры фильма.
Учитель подводит школьников к частичному обобщению материала по вопросам.
- Из каких клеток состоит эктодерма? Каковы их функции?
- Что такое рефлекс? Какова роль нервной системы в жизни гидры?
- Что такое регенерация?
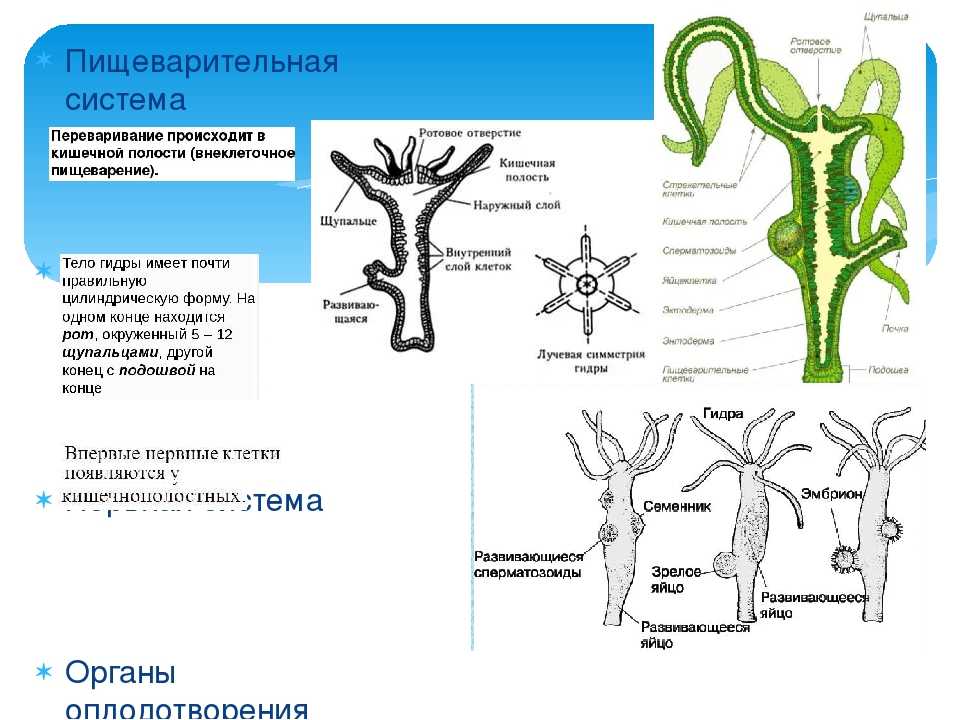
Переходим к внутреннему – энтодермальному слою. Он состоит всего из двух видов клеток: (слайд 18)
А) Железистые (выделяющие пищеварительные соки в кишечную полость).
Б) Пищеварительные (имеющие ложноножки и жгутики, осуществляющие внутриклеточное пищеварение).
Таким образом, переваривание пищи осуществляется как внутри клеток, так и в кишечной полости под влиянием пищеварительного сока железистых клеток. Такое полостное и внутриклеточное пищеварение характерно для всех кишечнополостных. Следует также отметить, что не переваренные остатки пищи удаляются через ротовое отверстие.
При рассмотрении дыхания гидры, следует предложить школьникам прочитать абзац учебника в $13 «дыхание и выделение».
На основе полученных знаний, следует продолжить развитие понятия о взаимосвязи организма и среды, начатое при изучении одноклеточных животных. Полезно предложить учащимся еще раз вспомнить, что поступает в организм гидры из внешней среды (пища, кислород, вода) что происходит с этими веществами в организме (пищеварение, образование питательных веществ, их усвоение, т.е. построение из них клеток тела гидры, образование ненужных веществ, их удаление из организма вместе с избытком воды).
Далее надо предложить учащимся найти черты сходства в питании гидры и амебы. На основании сходных признаков они должны быть подведены к выводу о родстве одноклеточных и многоклеточных животных.
На основании сходных признаков они должны быть подведены к выводу о родстве одноклеточных и многоклеточных животных.
В итоге изучения материала о пресноводной гидре учащиеся под руководством учителя должны сделать вывод: гидра – двухслойный многоклеточный организм, имеющий кишечную полость, лучевую симметрию, обладающий безусловными рефлексами.
III. Закрепление знаний проводится по таблице №2.| Особенности строения и процессов жизнедеятельности амебы и пресноводной гидры | ||
| Сравниваемый признак | Амеба | Пресноводная гидра |
| Строение тела | ||
| Питание | ||
| Дыхание | ||
| Выделение | ||
Можно использовать текст учебника для заполнения следующей карточки №3.
Заполните пропуски в тексте.
Стенки гидры состоят из _____________ слоёв клеток. Внутри тела имеется________ полость. В ____________ слое располагаются различные клетки. Благодаря наличию мускульных волоконец в основании каждой такой клетки гидра может передвигаться и _______________ длину своего тела. На поверхности тела гидры, особенно на её щупальцах, много _______________ клеток. В этих клетках, в особой ________________ находятся тонкие нити с зазубринками. Когда добыча, проплывающая мимо, коснется чувствительного волоска, ______________ выбрасываются наружу и вонзаются в тело жертвы. Яд _________________ в добычу. Стрекательные клетки ______________ гидру от рыб и крупных водных насекомых.
Домашнее задание: $13, задание 2, 4 страница 39 в рабочей тетради.
Для просмотра на уроке можно использовать следующий дидактический материал.
23.05.2010
Траектории дифференцировки стволовых клеток в Hydra, разрешенные при разрешении одной клетки Лейден, 1744 г.
 ). [Google Scholar]
). [Google Scholar]2. Вейсман А., Die Entstehung der Sexualzellen bei den Hydromedusen: Zugleich ein Beitrag zur Kenntniss des Baues und der Lebenserscheinungen dieser Gruppe (Gustav Fischer Verlag, Jena, 1883). [Академия Google]
3. Кэмпбелл Р.Д., Развитие гидры, лишенной интерстициальных и нервных клеток («эпителиальная гидра») в книге «Детерминанты пространственной организации» (Elsevier, 1979), стр. 267–293. [Google Scholar]
4. Сугияма Т., Фудзисава Т. Генетический анализ механизмов развития гидры. II. Выделение и характеристика штамма с дефицитом интерстициальных клеток. Дж. Селл. наука 29, 35–52 (1978). [PubMed] [Google Scholar]
5. Дэвид К.Н., Мерфи С., Характеристика интерстициальных стволовых клеток Hydra путем клонирования. Дев. Биол 58, 372–383 (1977). [PubMed] [Google Scholar]
6. Bosch TCG, David CN, Стволовые клетки Hydra magnipapillata могут дифференцироваться в соматические клетки и клетки зародышевой линии. 121, 182–191 (1987).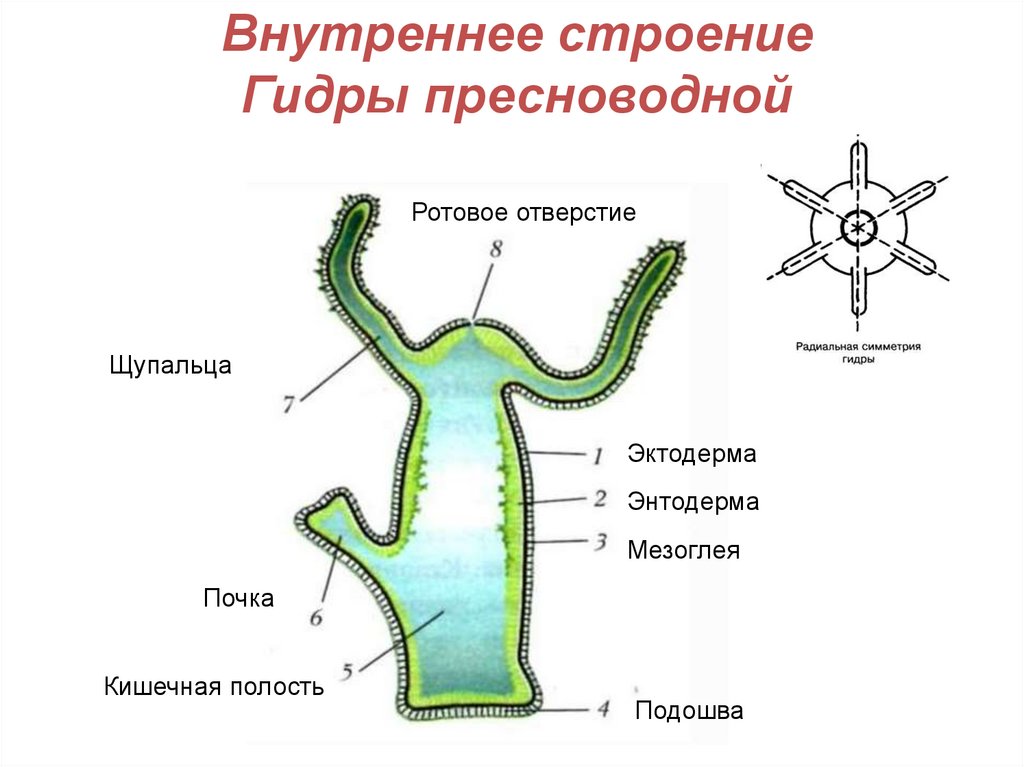 [Google Scholar]
[Google Scholar]
7. Bode HR, Heimfeld S, Chow MA, Huang LW, Клетки железы возникают путем дифференцировки интерстициальных клеток у Hydra attenuata. Дев. Биол 122, 577–585 (1987). [PubMed] [Google Scholar]
8. Кэмпбелл Р.Д., Динамика тканей устойчивого роста Hydra littoralis. II. Закономерности движения тканей. Дж. Морфол 121, 19–28 (1967). [PubMed] [Google Scholar]
9. Bosch TCG, Anton-Erxleben F, Hemmrich G, Khalturin K, The Hydra polyp: Ничего, кроме активного сообщества стволовых клеток. Дев. Рост отличается 52, 15–25 (2009). [PubMed] [Google Scholar]
10. Гольштейн Т.В., Хобмайер Э., Дэвид К.Н., Схема циклов эпителиальных клеток у гидры. Дев. Биол 148, 602–611 (1991). [PubMed] [Google Scholar]
11. Нисимия-Фудзисава С., Кобаяши С. Стволовые клетки зародышевой линии и определение пола у гидры. Междунар. Дж. Дев. Биол 56, 499–508 (2012). [PubMed] [Google Scholar]
12. Дэвид К.Н., Интерстициальные стволовые клетки гидры: мультипотентность и принятие решений. Междунар. Дж. Дев. Биол
56, 489–497 (2012). [PubMed] [Google Scholar]
Междунар. Дж. Дев. Биол
56, 489–497 (2012). [PubMed] [Google Scholar]
13. Кэмпбелл Р.Д., Движения клеток в гидре. интегр. Комп. Биол 14, 523–535 (1974). [Google Scholar]
14. Koizumi O, Bode HR, Пластичность нервной системы взрослой гидры. I. Позиционно-зависимая экспрессия FMRFамидоподобной иммунореактивности. Дев. Био 116, 407–421 (1986). [PubMed] [Академия Google]
15. Siebert S, Anton-Erxleben F, Bosch TCG, Сложность типов клеток у базальных метазоа Hydra поддерживается как механизмами, основанными на стволовых клетках, так и трансдифференцировкой. Дев. Биол 313, 13–24 (2008). [PubMed] [Google Scholar]
16. Dunn CW, Giribet G, Edgecombe GD, Hejnol A, Филогения животных и ее эволюционные последствия. Анну. Преподобный Экол. Эвол. Сист 45, 371–395 (2014). [Google Scholar]
17. Эрвин Д. Х., Раннее происхождение двухстороннего инструментария развития. Филос. Транс. Р. Соц. Lond., B, Biol. наука 364, 2253–2261 (2009 г.)). [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Технау У
и др., Сохранение наследственной сложности и неметазоанских генов у двух основных книдарий. Тенденции Жене. 21, 633–639 (2005). [PubMed] [Google Scholar]
Технау У
и др., Сохранение наследственной сложности и неметазоанских генов у двух основных книдарий. Тенденции Жене. 21, 633–639 (2005). [PubMed] [Google Scholar]
19. Kortschak RD, Samuel G, Saint R, Miller DJ, EST Анализ книдарии Acropora millepora выявил значительную потерю генов и быстрое расхождение последовательностей у модельных беспозвоночных. Курс. Биол 13, 2190–2195 (2003). [PubMed] [Google Scholar]
20. Себе-Педрос А. et al., Разнообразие и регуляция типов клеток книдарий, выявленные с помощью одноклеточной РНК всего организма-Seq. Клетка. 173, 1520–1534.e20 (2018). [PubMed] [Академия Google]
21. Fincher CT, Wurtzel O, de Hoog T, Kravarik KM, Reddien PW, Атлас транскриптома клеточных типов планарии Schmidtea mediterranea. Наука. 360, eaaq1736 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Plass M
и др., Атлас клеточных типов и генеалогическое дерево всего сложного животного с помощью транскриптомики одиночных клеток. Наука. 360, eaaq1723 (2018). [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
23. Брюне Дж. П., Тамайо П., Голуб Т. Р., Месиров Дж. П., Метагены и обнаружение молекулярных паттернов с использованием матричной факторизации. проц. Натл. акад. науч. США 101, 4164–4169(2004). [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Farrell JA и др., Одноклеточная реконструкция траекторий развития во время эмбриогенеза рыбок данио. Наука. 360, eaar3131 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Hemmrich G и др., Молекулярные признаки трех линий стволовых клеток у Hydra и появление функции стволовых клеток в основе многоклеточности. Мол. биол. Эвол 29, 3267–3280 (2012). [PubMed] [Google Scholar]
26. Хобмайер Б. и др., Stemness in Hydra — текущая перспектива. Междунар. Дж. Дев. Биол 56, 509–517 (2012). [PubMed] [Google Scholar]
27. Огюстен Р. et al., Секретируемый антибактериальный нейропептид формирует микробиом Hydra. Нац. Сообщество 8, 698 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Bode HR, Линия интерстициальных клеток Hydra: система стволовых клеток, возникшая на ранней стадии эволюции. Дж. Селл. наука
109 (часть 6), 1155–1164 (1996). [PubMed] [Google Scholar]
Bode HR, Линия интерстициальных клеток Hydra: система стволовых клеток, возникшая на ранней стадии эволюции. Дж. Селл. наука
109 (часть 6), 1155–1164 (1996). [PubMed] [Google Scholar]
29. Озбек С. Книдариевая нематоциста: миниатюрный внеклеточный матрикс внутри секреторного пузырька. Протоплазма. 248, 635–640 (2010). [PubMed] [Академия Google]
30. Боде Х.Р., Флик К.М., Распределение и динамика популяций нематоцитов у Hydra attenuata. Дж. Селл. наука 21, 15–34 (1976). [PubMed] [Google Scholar]
31. Гольштейн Т. Морфогенез нематоцитов гидры и форсколии: ультраструктурное исследование. Дж. Ультраструктур. Рез 75, 276–290 (1981). [PubMed] [Google Scholar]
32. Grapin-Botton A, Constam D, Эволюция механизмов и молекулярный контроль образования энтодермы. мех. Дев 124, 253–278 (2007). [PubMed] [Академия Google]
33. Babonis LS, Martindale MQ, PaxA, но не PaxC, необходим для развития книдоцитов у актиний Nematostella vectensis. Еводево. 8, 431 (2017).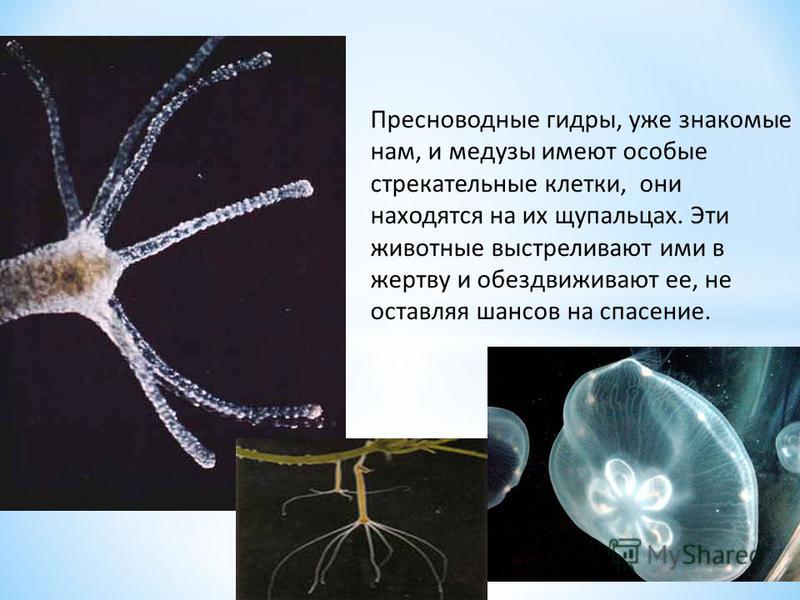 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Smith KM, Gee L, Bode HR, HyAlx, ген, связанный с aristalless, участвует в формировании щупалец у гидры. Разработка. 127, 4743–4752 (2000). [PubMed] [Google Scholar]
35. Bode H и др., Количественный анализ типов клеток во время роста и морфогенеза Hydra. Ру. Арка Дев. Биол 171, 269–285 (1973). [PubMed] [Google Scholar]
36. Ломан Б.К., Вебер Дж.Н., Болник Д.И., Оценка TagSeq, надежной недорогой альтернативы RNAseq. Мол. Экол. Ресурс 16, 1315–1321 (2016). [PubMed] [Google Scholar]
37. Караискос Н. и др., Эмбрион дрозофилы при разрешении одноклеточного транскриптома. Наука. 358, 194–199 (2017). [PubMed] [Google Scholar]
38. Бриггс Дж. А. и др., Динамика экспрессии генов в эмбриогенезе позвоночных при разрешении одной клетки. Наука. 360, eaar5780 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Вагнер Д.Е.
и др., Одноклеточное картирование ландшафтов экспрессии генов и родословных у эмбрионов рыбок данио. Наука. 360, 981–987 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Наука. 360, 981–987 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Мариони Дж. К., Арендт Д., Как геномика одноклеточных меняет эволюционную биологию и биологию развития. Анну. Преподобный Cell Dev. Биол 33, 537–553 (2017). [PubMed] [Google Scholar]
41. Кэмпбелл Р.Д., Устранение Hydra интерстициальными и нервными клетками с помощью колхицина. Дж. Селл. наука 21, 1–13 (1976). [PubMed] [Google Scholar]
42. Шафер Д.П. et al., Микроглия формирует постнатальные нейронные цепи в зависимости от активности и комплемента. Нейрон. 74, 691–705 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Lu Z и др., Фагоцитарная активность предшественников нейронов регулирует нейрогенез у взрослых. Нац. Клетка. Биол 13, 1076–1083 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Nakanishi Y, Shiratsuchi A, Фагоцитарное удаление апоптотических сперматогенных клеток клетками Сертоли: механизмы и последствия. биол. фарм. Бык
27, 13–16 (2004).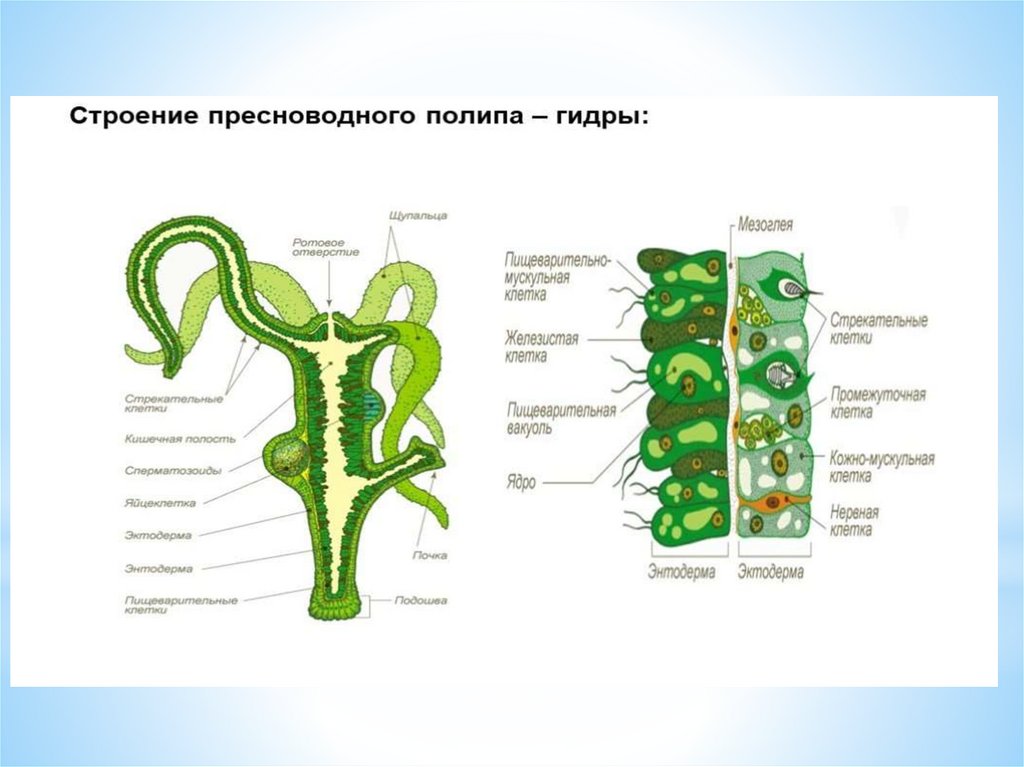 [PubMed] [Академия Google]
[PubMed] [Академия Google]
45. Dupre C, Yuste R, Непересекающиеся нейронные сети в Hydra vulgaris. Курс. Биол 27, 1085–1097 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Бадхивала К.Н., Гонсалес Д.Л., Веркоса Д.Г., Авантс Б.В., Робинсон Дж.Т., Микрофлюидика для электрофизиологии, визуализации и анализа поведения Гидры. Лабораторный чип. 18, 2523–2539 (2018). [PubMed] [Google Scholar]
47. Miljkovic-Licina M, Chera S, Ghila L, Galliot B, Регенерация головы у гидры дикого типа требует нейрогенеза de novo. Разработка. 134, 1191–1201 (2007). [PubMed] [Google Scholar]
48. Харланд Р.М. Новый взгляд на развитие и регенерацию эмбрионов. Наука. 360, 967–968 (2018). [PubMed] [Google Scholar]
49. Macosko EZ и др., Высокопараллельное профилирование полногеномной экспрессии отдельных клеток с использованием нанолитровых капель. Клетка. 161, 1202–1214 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Зиберт С., Линии клеток Hydra (http://commons.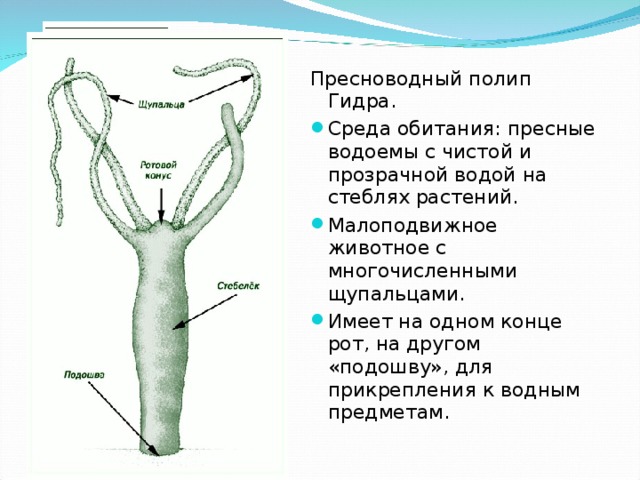 wikimedia.org/wiki/File:Hydra_cell_lineages.svg) (2018). [Академия Google]
wikimedia.org/wiki/File:Hydra_cell_lineages.svg) (2018). [Академия Google]
51. Гудер С и др., Древний антагонизм Wnt-Dickkopf в Hydra. Разработка. 133, 901–911 (2006). [PubMed] [Google Scholar]
52. Огюстен Р. et al., гены, родственные Dickkopf, являются компонентами градиента позиционных значений у Hydra. Дев. Биол 296, 62–70 (2006). [PubMed] [Google Scholar]
53. Ленгфельд Т. et al., Множественные Wnts участвуют в формировании и регенерации организаторов Hydra. Дев. Био 330, 186–199 (2009). [PubMed] [Google Scholar]
54. Хобмайер Б. et al., сигнальные молекулы WNT участвуют в формировании оси у диплобластных метазоа Hydra. Природа. 407, 186–189(2000). [PubMed] [Google Scholar]
55. Technau U, Bode HR, HyBra1, гомолог Brachyury, действует во время формирования головы у Гидры. Разработка. 126, 999–1010 (1999). [PubMed] [Google Scholar]
56. Билен Х.
et al., Дивергентные функции двух древних паралогов Hydra Brachyury указывают на специфическую роль их С-концевых доменов в индукции тканевых судеб. Разработка. 134, 4187–4197 (2007). [PubMed] [Google Scholar]
Разработка. 134, 4187–4197 (2007). [PubMed] [Google Scholar]
57. Greber MJ, David CN, Holstein TW, Количественный метод разделения живых клеток Hydra. Ру. Арка Дев. Биол 201, 296–300 (1992). [PubMed] [Google Scholar]
58. Гиерер А. и др., Регенерация Hydra из реагрегированных клеток. Нац. Новая биол. 239, 98–101 (1972). [PubMed] [Google Scholar]
59. Dunn CW, Howison M, Zapata F, Agalma: автоматизированный рабочий процесс филогеномики. Биоинформатика BMC. 14, 330 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Gnerre S и др., Высококачественные черновые сборки геномов млекопитающих на основе массивно параллельных данных о последовательностях. проц. Натл. акад. науч. США 108, 1513–1518 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Грабхерр М.Г. et al., Сборка полноразмерного транскриптома из данных RNA-Seq без эталонного генома. Нац. Биотехнология 29, 644–652 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Хансен К.Д., Бреннер С.Е., Дудойт С., Смещения в секвенировании транскриптома Illumina, вызванные случайным гексамерным праймированием. Нуклеиновый. Кислоты. Рез
38, e131–e131 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Хансен К.Д., Бреннер С.Е., Дудойт С., Смещения в секвенировании транскриптома Illumina, вызванные случайным гексамерным праймированием. Нуклеиновый. Кислоты. Рез
38, e131–e131 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Гилберт Д., Геномы, построенные из последовательностей мРНК, а не ДНК генома. В: 7-й ежегодный симпозиум по геномике членистоногих. Нотр-Дам (2013). [Академия Google]
64. Симао Ф.А., Уотерхаус Р.М., Иоаннидис П., Кривенцева Э.В., Здобнов Э.М., BUSCO: оценка сборки генома и полноты аннотации с помощью однокопийных ортологов. Биоинформатика. 31, 3210–3212 (2015). [PubMed] [Google Scholar]
65. Стовер Н.А., Стил Р.Э. Добавление транс-сплайсированного лидера к мРНК у книдарии. проц. Натл. акад. науч. США 98, 5693–5698 (2001). [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Martin M, Cutadapt удаляет последовательности адаптеров из считываний высокопроизводительного секвенирования. EMBnet.journal 17, 10 (2011). [Академия Google]
67. Финн РД
и др., База данных семейств белков Pfam: к более устойчивому будущему. Нуклеиновый. Кислоты. Рез
44, Д279–85 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Финн РД
и др., База данных семейств белков Pfam: к более устойчивому будущему. Нуклеиновый. Кислоты. Рез
44, Д279–85 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Voigt O, Erpenbeck D, Wörheide G, Фрагментированный многоклеточный органелларный геном: две митохондриальные хромосомы Hydra magnipapillata. Геномика BMC 9, 350 (2008). [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Langmead B, Salzberg SL, Быстрое выравнивание с промежутками чтения с Bowtie 2. Nat. Методы 9, 357–359 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Чепмен Дж. А. и др., Динамический геном гидры. Природа. 464, 592–596 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Ю. С. М., Вестфолл Дж. А., Данн Дж. Ф., Световая и электронно-микроскопическая локализация моноклонального антитела в нейронах in situ в области головы гидры. Дж. Морфол 184, 183–193 (1985). [PubMed] [Google Scholar]
72. Hufnagel LA, Kass-Simon G, Lyon MK, Функциональная организация аккумуляторных клеточных комплексов в щупальцах Hydra attenuata. Дж. Морфол
184, 323–341 (1985). [PubMed] [Google Scholar]
Дж. Морфол
184, 323–341 (1985). [PubMed] [Google Scholar]
73. Hobmayer E, David CN, Дифференциация комплекса нервных клеток и аккумуляторных клеток у гидры в эволюции первых нервных систем (Springer US, Boston, MA, 1989), стр. 71– 80. [Google Scholar]
74. Дюбель С., Дифференцировка клеток в голове гидры. Дифференциация. 41, 99–109 (1989). [Google Scholar]
75. Lyon MK, Kass-Simon G, Hufnagel LA, Ультраструктурный анализ удаления нематоцитов у Hydra. Тканевая клетка. 14, 415–424 (1982). [PubMed] [Академия Google]
76. McNeil PL, Механизмы пищевого эндоцитоза. I. Фагоцитарная универсальность и клеточное распознавание в пищеварительных клетках Chlorohydra, исследование с помощью сканирующего электронного микроскопа. Дж. Селл. наука 49, 311–339 (1981). [PubMed] [Google Scholar]
77. Сейболд А., Сальвенмозер В., Хобмайер Б. Последовательное развитие апикально-базальной и планарной полярностей в агрегирующих эпителиомускулярных клетках гидры. Дев. Био
412, 148–159 (2016).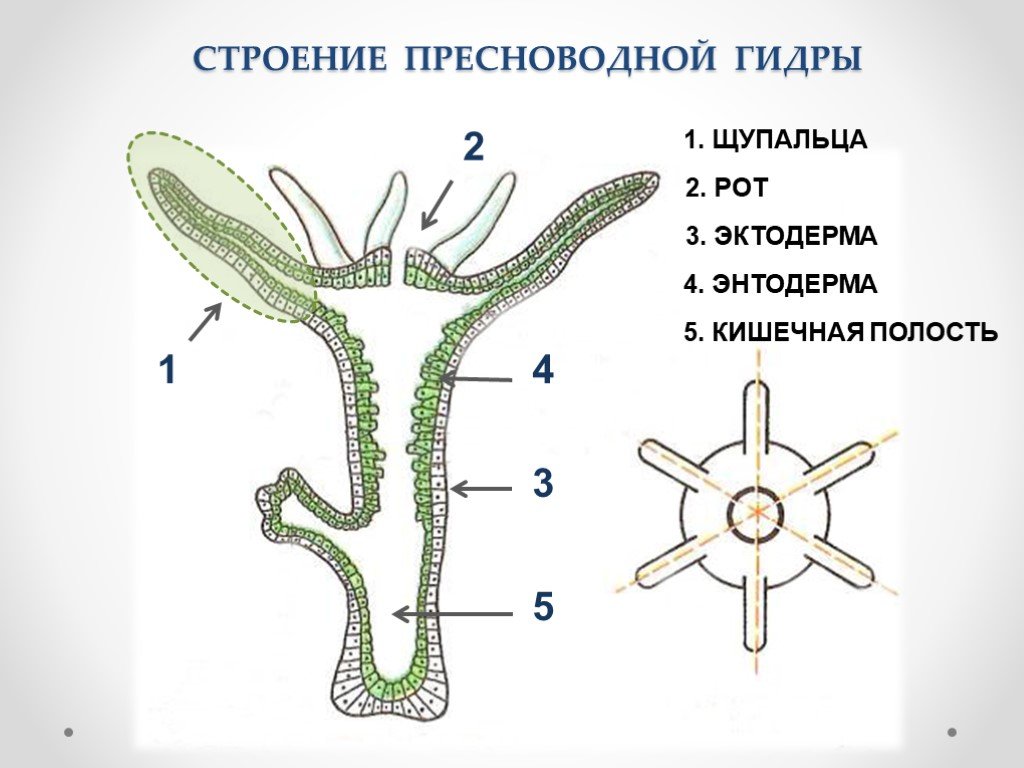 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
78. Сатия Р., Фаррелл Дж. А., Геннерт Д., Шир А. Ф., Регев А., Пространственная реконструкция данных экспрессии генов одноклеточных. Нац. Биотехнология 33, 495–502 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Mitgutsch C, Hauser F, Grimmelikhuizen CJP, Экспрессия и регуляция развития генов препрогормонов Hydra-RFamide и Hydra-LWamide у Hydra: доказательства переходных фаз формирования головы . Дев. Биол 207, 189–203 (1999). [PubMed] [Google Scholar]
80. Батлер А., Хоффман П., Смиберт П., Папалекси Э., Сатия Р. Интеграция транскриптомных данных отдельных клеток в различных условиях, технологиях и видах. Нац. Биотехнология 36, 411–420 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Корсес М.Р. и др., Улучшенный протокол ATAC-seq уменьшает фон и позволяет исследовать замороженные ткани. Нац. Методы 14, 959–962 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Buenrostro JD, Wu B, Chang HY, Greenleaf WJ, ATAC-seq: метод анализа доступности хроматина по всему геному. Курс. протокол Мол. Биол
109, 21.29.1–9 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Курс. протокол Мол. Биол
109, 21.29.1–9 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Bolger AM, Lohse M, Usadel B, Trimmomatic: гибкий триммер для данных последовательности Illumina. Биоинформатика. 30, 2114–2120 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Чжан Ю. и др., Модельный анализ ChIP-Seq (MACS). Геном биол. 9, Р.137 (2008). [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Li Q, Brown JB, Huang H, Bickel PJ, Измерение воспроизводимости высокопроизводительных экспериментов. Анналы прикладной статистики. 5, 1752–1779 (2011). [Google Scholar]
86. де Мендоса А. и др., Эволюция фактора транскрипции у эукариот и сборка регуляторного инструментария в многоклеточных линиях. проц. Натл. акад. науч. США 110, E4858–66 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Khan A, Mathelier A, JASPAR RESTful API: доступ к данным JASPAR с любого языка программирования. Биоинформатика. 34, 1612–1614 (2017).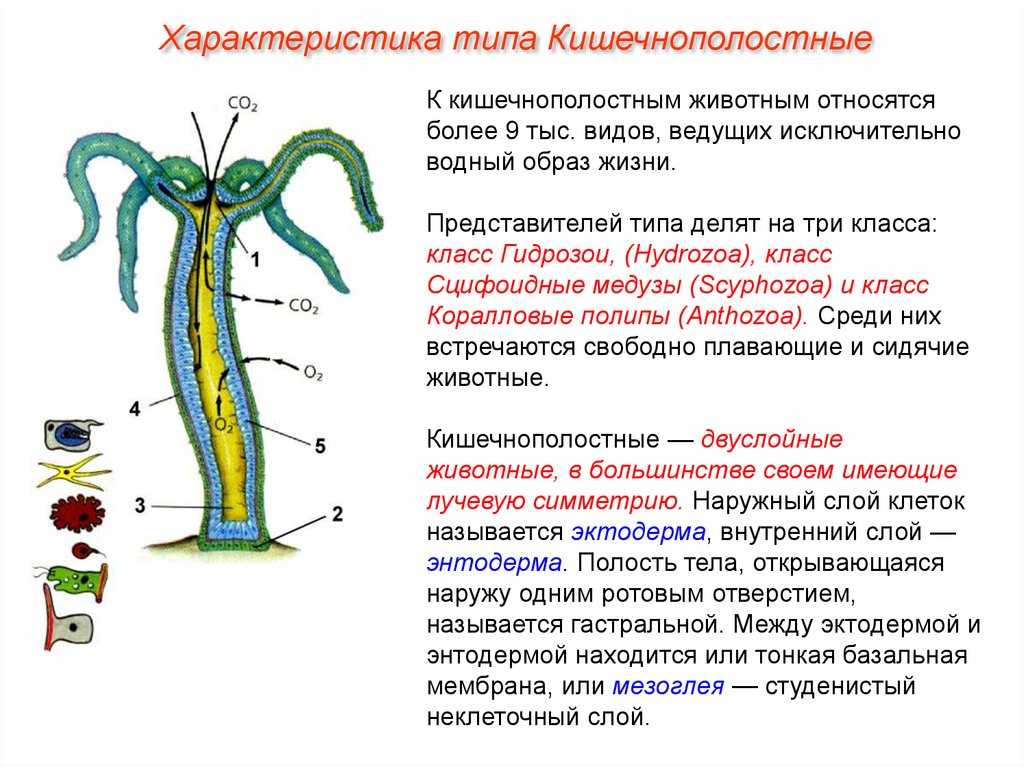 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
88. Хан А. и др., JASPAR 2018: обновление базы данных открытого доступа профилей связывания факторов транскрипции и ее веб-структуры. Нуклеиновый. Кислоты. Рез 46, Д260–Д266 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Хайнц С. et al., Простые комбинации транскрипционных факторов, определяющих происхождение, инициируют цис-регуляторные элементы, необходимые для идентичности макрофагов и В-клеток. Мол. Клетка 38, 576–589(2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
90. Haghverdi L, Buettner F, Theis FJ, Диффузионные карты для многомерного одноклеточного анализа данных дифференцировки. Биоинформатика. 31, 2989–2998 (2015). [PubMed] [Google Scholar]
91. Хагверди Л., Бюттнер М., Вольф Ф.А., Бюттнер Ф., Тейс Ф.Дж., Псевдовремя диффузии надежно реконструирует ветвление линии. Нац. Методы 13, 845–848 (2016). [PubMed] [Google Scholar]
92. Hartigan JA, Hartigan PM, The Dip Test of Unimodality. Анна.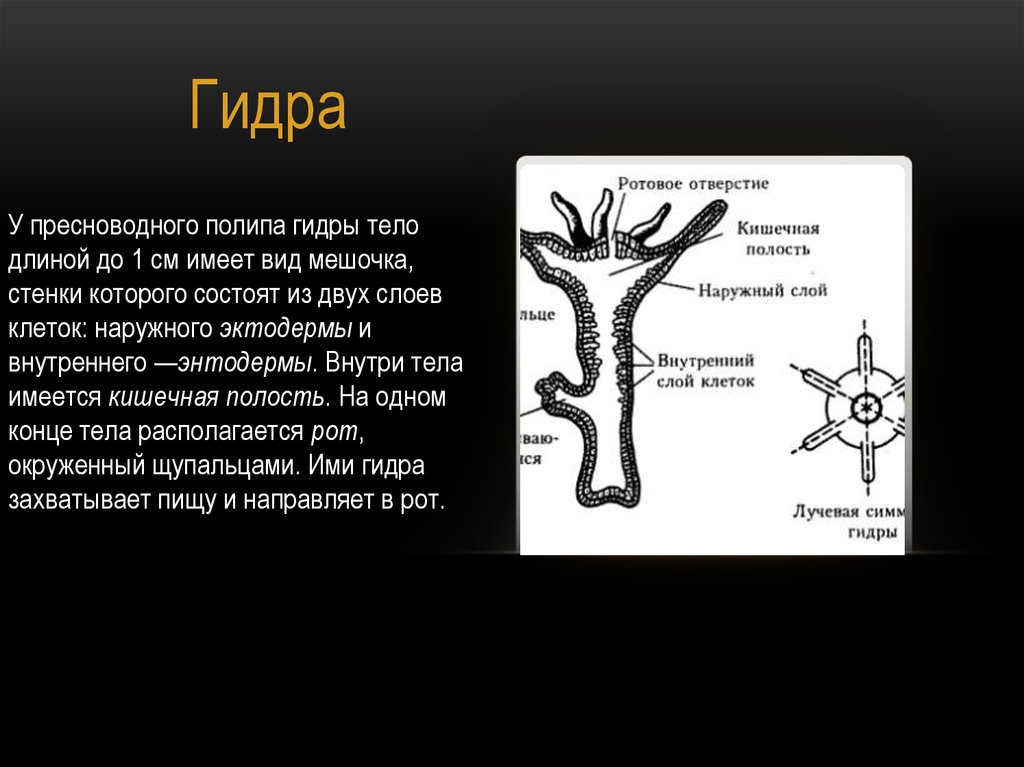 Стат
13, 70–84 (1985). [Google Scholar]
Стат
13, 70–84 (1985). [Google Scholar]
93. Grens A, Gee L, Fisher DA, Bode HR, CnNK-2, ген гомеобокса NK-2, играет роль в формировании паттерна базального конца оси у Hydra. Дев. Биол 180, 473–488 (1996). [PubMed] [Google Scholar]
94. Леш-Лори GE, Разделение слоев жизнеспособных тканей у гидры: методы исследования (Springer US, Boston, MA, 1983), стр. 267–271. [Google Scholar]
95. Глаубер К.М. et al., Скрининг малых молекул идентифицирует новое соединение, которое вызывает гомеозисную трансформацию у Hydra. Разработка. 140, 4788–4796 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Muscatine L, in The Biology of Hydra, Lenhoff HM, Loomis WF, Eds. (Корал-Гейблс, Флорида:), стр. 255–268. [Google Scholar]
97. Дэвис Л.Э., Бернетт А.Л., Хейнс Дж.Ф., Мумав В.Р. Гистологическое и ультраструктурное исследование дедифференцировки и редифференцировки пищеварительных и железистых клеток Hydra viridis. Дев. Биол 14, 307–329 (1966). [Google Scholar]
98. Li B, Dewey CN, RSEM: точная количественная оценка транскриптов по данным RNA-Seq с эталонным геномом или без него. Биоинформатика BMC. 12, 323 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Li B, Dewey CN, RSEM: точная количественная оценка транскриптов по данным RNA-Seq с эталонным геномом или без него. Биоинформатика BMC. 12, 323 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Лангмид Б., Трапнелл С., Поп М., Зальцберг С.Л. Сверхбыстрое и эффективное с точки зрения памяти выравнивание коротких последовательностей ДНК с геномом человека. Геном биол. 10, С. 25 (2009). [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Robinson MD, McCarthy DJ, Smyth GK, edgeR: пакет Bioconductor для дифференциального анализа экспрессии цифровых данных экспрессии генов. Биоинформатика. 26, 139–140 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Джулиано К.Э., Лин Х., Стил Р.Е. Создание трансгенной гидры путем микроинъекции эмбриона. Дж. Вис. Опыт, 51888 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
102. Wittlieb J, Khalturin K, Lohmann JU, Anton-Erxleben F, Bosch TCG, Transgenic Hydra позволяют отслеживать in vivo отдельные стволовые клетки во время морфогенеза. проц. Натл. акад. науч. США
103, 6208–6211 (2006). [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США
103, 6208–6211 (2006). [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Schindelin J и др., Фиджи: платформа с открытым исходным кодом для анализа биологических изображений. Нац. Методы 9, 676–682 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Thomsen S, Bosch TCG, Дифференцировка стопы и пластичность генома у Hydra: уроки семейства генов PPOD. Дев. Гены Эвол. 216, 57–68 (2006). [PubMed] [Академия Google]
105. Endl I, Lohmann JU, Bosch TCG, Специфическая для головы экспрессия генов у Hydra: сложность ДНК-белковых взаимодействий на промоторе ks1 обратно коррелирует с потенциалом активации головы. проц. Натл. акад. науч. США 96, 1445–1450 (1999). [Бесплатная статья PMC] [PubMed] [Google Scholar]
106. Mochizuki K, Sano H, Kobayashi S, Nishimiya-Fujisawa C, Fujisawa T, Экспрессия и эволюционное сохранение генов, связанных с нано, у Hydra. Ру. Арка Дев. Биол 210, 591–602 (2000). [PubMed] [Академия Google]
107. Хван Дж. С.
et al., Nematogalectin, белок нематоцист с доменами GlyXY и galectin, демонстрирует специфический для нематоцитов альтернативный сплайсинг у Hydra. проц. Натл. акад. науч. США
107, 18539–18544 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Хван Дж. С.
et al., Nematogalectin, белок нематоцист с доменами GlyXY и galectin, демонстрирует специфический для нематоцитов альтернативный сплайсинг у Hydra. проц. Натл. акад. науч. США
107, 18539–18544 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
108. Hwang JS и др., Эволюция ресничек: идентификация нового белка, нематоцилина, в механосенсорных ресничках нематоцитов Hydra. Мол. биол. Эвол 25, 2009–2017 (2008). [PubMed] [Google Scholar]
109. Fraune S et al., У многоклеточных животных с ранним ветвлением бактериальная колонизация эмбриона контролируется материнскими антимикробными пептидами. проц. Натл. акад. науч. США 107, 18067–18072 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
110. Алексопулос Х. и др., Эволюция щелевых контактов: недостающее звено? Курс. Биол 14, Р. 879–80 (2004). [PubMed] [Google Scholar]
111. Дармер Д.
et al., Три различных прогормона дают различные нейропептиды Hydra-RFamide (Arg-Phe-Nh3) в Hydra magnipapillata. Биохим. Дж
332 (часть 2), 403–412 (1998). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Биохим. Дж
332 (часть 2), 403–412 (1998). [Бесплатная статья PMC] [PubMed] [Google Scholar]
112. Noro Y и др., Регионализованная нервная система гидры и механизм ее развития. Джин Экспр. Узоры 31, 42–59(2019). [PubMed] [Google Scholar]
113. Yum S et al., Новый нейропептид Hym-176 индуцирует сокращение эктодермальной мышцы у Hydra. Биохим. Биофиз. Рез. Сообщество 248, 584–590 (1998). [PubMed] [Google Scholar]
114. Такахаши Т. et al., Hym-301, новый пептид, регулирует количество щупалец, образующихся у гидры. Разработка. 132, 2225–2234 (2005). [PubMed] [Google Scholar]
115. Ломмель М. et al., протеом Hydra mesoglea идентифицирует тромбоспондин как консервативный компонент, активный при рестрикции головного организатора. Научный отчет 8, 11753 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
116. Weinziger R, Salgado LM, David CN, Bosch TCG, Ks1, ген, специфичный для эпителиальных клеток, отвечает на ранние сигналы формирования головы у Hydra. Разработка. 120, 2511–2517 (1994). [PubMed] [Google Scholar]
Разработка. 120, 2511–2517 (1994). [PubMed] [Google Scholar]
117. Smith KM, Gee L, Blitz IL, Bode HR, CnOtx, член семейства генов Otx, играет роль в движении клеток Hydra. Дев. Биол 212, 392–404 (1999). [PubMed] [Google Scholar]
118. Martinez DE et al., Budhead, гомолог Fork Head/HNF-3, экспрессируется во время формирования оси и спецификации головы у Hydra. Дев. Биол 192, 523–536 (1997). [PubMed] [Google Scholar]
119. Ватанабэ Х. et al., Передача сигналов Nodal определяет бирадиальную асимметрию у Hydra. Природа. 515, 112–115 (2014). [PubMed] [Google Scholar]
120. Филипп I et al., Wnt/beta-catenin и неканоническая передача сигналов Wnt взаимодействуют при выпячивании тканей у простых эвметазойных гидр. проц. Натл. акад. науч. США 106, 4290–4295 (2009). [Бесплатная статья PMC] [PubMed] [Google Scholar]
121. Bosch TCG
и др., Раскрытие эволюционной истории врожденного иммунитета: простая многоклеточная гидра использует эпителиальные клетки для защиты хозяина. Дев. Комп. Иммунол
33 559–569 (2009 г.). [PubMed] [Google Scholar]
Дев. Комп. Иммунол
33 559–569 (2009 г.). [PubMed] [Google Scholar]
122. Джулиано CE et al., Белки PIWI и взаимодействующие с PIWI РНК функционируют в соматических стволовых клетках Hydra. проц. Натл. акад. науч. США 111, 337–342 (2014). [Статья бесплатно PMC] [PubMed] [Google Scholar]
123. Lim RSM, Anand A, Nishimiya-Fujisawa C, Kobayashi S, Kai T, Анализ белков Hydra PIWI и piRNAs раскрывают раннее эволюционное происхождение пути piRNA. Дев. Биол 386, 237–251 (2014). [PubMed] [Google Scholar]
124. Engel U et al., Nowa, новый белок с доменами, богатыми миниколлагеном Cys, участвует в образовании нематоцист у Hydra. Дж. Селл. наука 115, 3923–3934 (2002). [PubMed] [Google Scholar]
125. Fedders H, Augustin R, Bosch TCG, Связанный с Dickkopf-3 ген экспрессируется в дифференцирующихся нематоцитах у базальных многоклеточных гидр. Ру. Арка Дев. Биол 214, 72–80 (2004). [PubMed] [Google Scholar]
126. Fujisawa T, David CN, Обязательства во время дифференцировки нематоцитов у Hydra. Дж. Селл. наука
48, 207–222 (1981). [PubMed] [Google Scholar]
Дж. Селл. наука
48, 207–222 (1981). [PubMed] [Google Scholar]
127. Fraune J et al., Hydra meiosis обнаруживает неожиданное сохранение белков структурных синаптонемных комплексов у многоклеточных животных. проц. Натл. акад. науч. США 109, 16588–16593 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
128. Хаякава Э., Фудзисава С., Фудзисава Т. Участие гена CnASH-щитка гидры в пути дифференцировки сенсорных нейронов щупалец. Ру. Арка Дев. Биол (2004). [PubMed] [Google Scholar]
129. Такаку Ю. et al., Иннексиновые щелевые контакты в нервных клетках координируют спонтанное сократительное поведение полипов Hydra. Научный отчет 4, 3573 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
130. Такахаши Т. et al., Новый нейропептид Hym-355 положительно регулирует дифференцировку нейронов у Hydra. Комп. Биохим. Физиол. А. Мол. интегр. Физиол 124, С93 (1999). [Google Scholar]
131. Галлиот Б.
и др., Происхождение нейрогенеза, книдарский взгляд. Дев. Биол
332, 2–24 (2009). [PubMed] [Google Scholar]
Дев. Биол
332, 2–24 (2009). [PubMed] [Google Scholar]
132. Miljkovic-Licina M, Gauchat D, Galliot B, Нейрональная эволюция: анализ регуляторных генов в первичной нервной системе, нервной системе Hydra. Биосистемы. 76, 75–87 (2004). [PubMed] [Академия Google]
Рассмотрение клеток Hydra по одной за раз
Секвенирование отдельных клеток Hydra дает ресурс для изучения траекторий дифференцировки, регенерации и развития нервной системы.
Как дифференцируются стволовые клетки и как их потомство заселяет развивающуюся или регенерирующую ткань или организм, является активной областью исследований в области биологии развития. Хотя Hydra vulgaris изучен не так широко, как, например, Drosophila или мышь, этот организм особенно подходит для решения таких вопросов. Hydra обладает действительно интересной особенностью, заключающейся в том, что она постоянно обновляется», — говорит Селина Джулиано из Калифорнийского университета в Дэвисе, что позволяет легко фиксировать процессы дифференциации.
Организмы Hydra диссоциируют, подготавливают для Drop-seq, а затем данные группируют. Рисунок адаптирован из Siebert, S. et al. Наука 365 , 341 (2019).
Джулиано и ее сотрудники, в том числе первый автор Стефан Зиберт, использовали Drop-seq для получения транскриптомов 25 000 отдельных клеток из Гидра . «Мы просто хотим иметь более полный каталог типов клеток в Hydra и понять гены, которые экспрессируются в этих дифференцированных типах клеток, включая нервную систему», — объясняет Джулиано, мотивируя их исследование. Кроме того, Джек Казе из команды Джулиано выполнил ATAC-seq для идентификации предполагаемых регуляторных последовательностей.
Клетки, проанализированные с помощью Drop-seq, сгруппированы в несколько типов клеток, включая двенадцать типов нейронов, четыре типа нематоцитов, клетки железы и зародышевые клетки, а также мультипотентные интерстициальные стволовые клетки. Однако многие клетки находились на промежуточной или переходной стадии, и Джулиано упомянул, что одни клетки также могут трансдифференцироваться в другие. Следовательно, Джулиано на самом деле неудобно говорить о типах клеток. Она отмечает, что «нам, вероятно, следует подумать о том, что мы имеем в виду, когда говорим «тип клетки», как мы на самом деле подсчитываем количество типов клеток, находящихся в ткани или организме. Я думаю, что это на самом деле очень сложно. Линии очень размыты». Вместо этого она и ее коллеги предпочитают термин «клеточное состояние».
Следовательно, Джулиано на самом деле неудобно говорить о типах клеток. Она отмечает, что «нам, вероятно, следует подумать о том, что мы имеем в виду, когда говорим «тип клетки», как мы на самом деле подсчитываем количество типов клеток, находящихся в ткани или организме. Я думаю, что это на самом деле очень сложно. Линии очень размыты». Вместо этого она и ее коллеги предпочитают термин «клеточное состояние».
Подход к секвенированию отдельных клеток предоставил Джулиано и ее сотрудникам доступ к тем клеткам, которые переходят из стволовых клеток в дифференцированные клетки. «Вы не можете получить их с помощью объемного секвенирования РНК», — говорит Джулиано. Hydra особенно удобна здесь, поскольку клеточные переходы «происходят постоянно, нам нужно только секвенировать взрослый полип, и мы можем получить много информации», — говорит Джулиано.
Основываясь на наборе данных Drop-seq, команда смогла вывести траектории родословных для всех Гидра кл. Следует отметить, что для вычислительного аспекта работы над траекториями родословных решающее значение имело сотрудничество с Джеффри Фарреллом из Гарвардского университета. Фаррелл, с которым Джулиано познакомился на конференции по биологии развития несколько лет назад, разработал алгоритм поиска клеточных траекторий, основанный на отслеживании экспрессии генов на разных стадиях эмбриона рыбки данио. Для приложения Hydra им пришлось изменить алгоритм, чтобы учесть отсутствие предварительных знаний о временной последовательности в экспрессии генов.
Фаррелл, с которым Джулиано познакомился на конференции по биологии развития несколько лет назад, разработал алгоритм поиска клеточных траекторий, основанный на отслеживании экспрессии генов на разных стадиях эмбриона рыбки данио. Для приложения Hydra им пришлось изменить алгоритм, чтобы учесть отсутствие предварительных знаний о временной последовательности в экспрессии генов.
Важно отметить, что хотя стволовые клетки и их линии хорошо изучены в Гидре, молекулярные основы еще предстоит определить. «Теперь мы действительно можем лучше понять, как происходят эти процессы», — говорит Джулиано. Она была особенно рада тому, что более ранняя работа над клеточными траекториями в 1980-х и 1990-х годах, которая не полагалась на сложные инструменты, доступные сейчас, полностью выдержала испытания. Поскольку Джулиано и ее коллеги получили данные ATAC-seq в дополнение к данным Drop-seq, они также могли изучить регуляторные отношения генов, которые, по их мнению, были вовлечены в процессы дифференцировки.
С современными инструментами команда может выйти за рамки этой предыдущей работы. Особый интерес для Джулиано и ее команды представляет ранее неизвестная бипотенциальная клетка-предшественник. Они обнаружили, что нейроны и клетки желез могут иметь общее состояние предшественников, отличное от предшественников нематоцитов. Они предполагают, что популяция предшественников нейронов-желез располагается в эктодерме и генерирует там нейроны. Другая популяция этих клеток-предшественников может переходить в энтодерму и давать начало нейронам или железистым клеткам. В будущем Джулиано и ее коллеги планируют развить это наблюдение.
В дополнение к описанию промежуточных состояний клеток подход к секвенированию отдельных клеток также помог Джулиано и ее коллегам составить молекулярную карту нервной системы. «Мы хотим понять, как развивается нервная система, как она поддерживается у этого гомеостатического животного [и] как вы восстанавливаете нервную систему», — говорит Джулиано.


Leave A Comment