Нитрат железа (II)
Нитрат железа (II) — соль азотной кислоты и двухвалентного железа.
Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
Физические свойства
Фазовая диаграмма системы нитрат железа(II) — вода |
Нитрат железа (II) существует в основном в виде кристаллогидратов Fe(NO3)2·6H2O и Fe(NO3)2·9H2O.
Гексагидрат нитрата железа (II) Fe(NO3)2·6H2O — светло-зелёные кристаллы с ромбической кристаллической решеткой. Хорошо растворяется в воде, причем растворимость растёт вместе с повышением температуры. В равновесии с насыщенным водным раствором существует в интервале от -12 до 60,5 °C и концентрации раствора в пределах 39-69,5%. При более низких температурах и концентрациях растворов устойчив нонагидрат нитрата железа (II) Fe(NO3)2·9H2O.
График растворимости представлен на рисунке.
Особые точки:
| Состояние | Температура, °С | Концентрация, % |
| Лед+Fe(NO3)2·9H2O | -28 | (35) |
| Fe(NO3)2·9H2O+Fe(NO3)2·6H2O | ~-12 | (39) |
| Fe(NO3)2·6H2O | 60,5 | 62,5 |
Безводный нитрат железа (II) и его кристаллогидраты неустойчивы, поэтому легко окисляются на воздухе.
Получение
Нитрат железа (II) образуется при растворении железа в разбавленной азотной кислоте на холоде:
- 4Fe + 10HNO3 → 4Fe(NO3)2 + NH4NO3 + 3H2O
В чистом состоянии его лучше получать обменной реакцией сульфата железа (II) с нитратом свинца (II):
- FeSO4 + Pb(NO3)2 → PbSO4↓ + Fe(NO3)2
Химические свойства
Проявляет восстановительные свойства.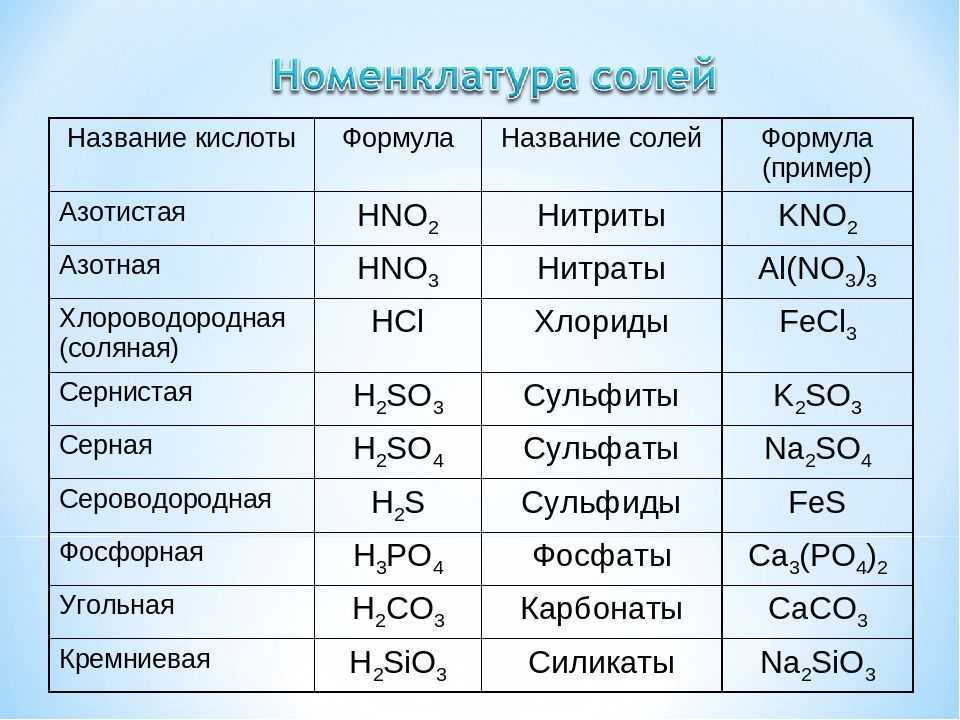 Гидролиз практически не проявляется.
Гидролиз практически не проявляется.
- Водный раствор нитрата железа (II) разлагается при кипячении с образованием основного нитрата железа (III):
- 4Fe(NO3)2 + O2 + 2H2O →t 4Fe(OH)(NO3)2
- Реагирует с щелочами с образованием гидроксида железа (II):
- Fe(NO3)2 + 2NaOH → Fe(OH)2↓ + 2NaNO3
- С растворимыми карбонатами дает белый карбонат железа (II):
- Fe(NO3)2 + K2CO3 → FeCO3↓ + 2KNO3
- Восстанавливается до металлического железа при действии более активного металла
- Fe(NO3)2 + Mg → Fe + Mg(NO3)2
- Взаимодействует с гексацианоферратом (III) калия (красной кровяной солью) с образованием тёмно-синего осадка гексацианоферрата (II) железа (III)-калия (берлинская лазурь):
- Fe(NO3)2 + K3[Fe(CN)6] → KFe[Fe(CN)6]↓ + 2KNO3
- При термическом разложении образуется оксид железа (III), а не оксид железа (II):
- 4Fe(NO3)2 →t 2Fe2O3 + 8NO2↑ + O2↑
Формула Нитрата железа II структурная химическая
- Неорганическая соль
Структурная формула
Истинная, эмпирическая, или брутто-формула: FeN2O6
Химический состав Нитрата железа II
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Fe | Железо | 55,849 | 1 | 31,1% |
| N | Азот | 14,007 | 2 | 15,6% |
| O | Кислород | 15,999 | 6 | 53,4% |
Молекулярная масса: 179,857
Нитрат железа(II) — неорганическое химическое соединение, соль азотной кислоты и двухвалентного железа.
Физические свойства
Нитрат железа (II) существует в основном в виде кристаллогидратов Fe(NO3)2·6H2O и Fe(NO3)2·9H2O.
Гексагидрат нитрата железа (II) Fe(NO3)2·6H2O — светло-зелёные кристаллы с ромбической кристаллической решеткой. Хорошо растворяется в воде, причем растворимость растёт вместе с повышением температуры. В равновесии с насыщенным водным раствором существует в интервале от -12 до 60,5 °C и концентрации раствора в пределах 39-69,5%. При более низких температурах и концентрациях растворов устойчив нонагидрат нитрата железа (II) Fe(NO
Особые точки:
| Состояние | Температура, °С | Концентрация, % |
|---|---|---|
| Лед+Fe(NO3)2·9H2O | -28 | (35) |
| Fe(NO3)2·9H2O + Fe(NO3)2·6H2O | ~-12 | (39) |
| Fe(NO3)2·6H2O | 60,5 | 62,5 |

Получение
Нитрат железа (II) образуется при растворении железа в разбавленной азотной кислоте на холоде:
4Fe + 10HNO3 → 4Fe(NO3)2 + NH4NO3 + 3H2O
В чистом состоянии его лучше получать обменной реакцией сульфата железа (II) с нитратом свинца (II):
FeSO4 + Pb(NO3
Химические свойства
Проявляет восстановительные свойства. Гидролиз практически не проявляется.
- Водный раствор нитрата железа (II) разлагается при кипячении с образованием основного нитрата железа (III):
4Fe(NO3)2 + O2 + 2H2O t→ 4Fe(OH)(NO3)2 - Реагирует с щелочами с образованием гидроксида железа (II):
Fe(NO3)2 + 2NaOH → Fe(OH)2 + 2NaNO3 - С растворимыми карбонатами дает белый карбонат железа(II):
- Восстанавливается до металлического железа при действии более активного металла:
Fe(NO3)2 + Mg → Fe + Mg(NO3)2 - Взаимодействует с гексацианоферратом (III) калия (красной кровяной солью) с образованием тёмно-синего осадка гексацианоферрата (II) железа(III)-калия (берлинская лазурь):
Fe(NO3)2 + K3[Fe(CN)6] → KFe[Fe(CN)6] + 2KNO3
Формула нитрата железа III – структура, свойства, применение и часто задаваемые вопросы
(или) FeN 3 O 9 . Это неорганическое соединение, которое выглядит как кристаллическое твердое вещество фиолетового цвета. Нонагидрат является наиболее распространенной гидратной формой с химической формулой Fe(NO 3 ) 3 .(H 2 O) 9 . Он полностью растворим в воде, спирте и ацетоне, мало растворим в холодной концентрированной азотной кислоте. Это сильный окислитель и негорючее химическое соединение. Хотя он негорючий, он увеличивает интенсивность пожара при контакте с горючими материалами. Растворы нитрата железа вызывают коррозию большинства металлов. Он используется в качестве протравы при окрашивании, утяжелении шелка, дублении и подавлении коррозии, а также в качестве удобрения и пищевой добавки.
Это неорганическое соединение, которое выглядит как кристаллическое твердое вещество фиолетового цвета. Нонагидрат является наиболее распространенной гидратной формой с химической формулой Fe(NO 3 ) 3 .(H 2 O) 9 . Он полностью растворим в воде, спирте и ацетоне, мало растворим в холодной концентрированной азотной кислоте. Это сильный окислитель и негорючее химическое соединение. Хотя он негорючий, он увеличивает интенсивность пожара при контакте с горючими материалами. Растворы нитрата железа вызывают коррозию большинства металлов. Он используется в качестве протравы при окрашивании, утяжелении шелка, дублении и подавлении коррозии, а также в качестве удобрения и пищевой добавки.Структура нитрата железа (III)
Химическая или химическая (или) молекулярная формула нитрата железа (III) Fe(NO 3 ) 3 (или) FeN 3 O 9 .
Нитрат железа (III) Формула
Получение нитрата железа (III)
- Нитрат железа (III) также может быть получен обработкой гематита (Fe 2 O 3 ) азотной кислотой.

Fe 2 O 3 + 6HNO 3 → 2Fe(NO 3 ) 3 + 3H 2 O
- Действие азотной кислоты на порошок металлического железа может привести к образованию нитрата железа(III).
Fe + 4HNO 3 → Fe(NO 3 ) 3 + NO + 2H 2 O
9006 1Свойства нитрата железа (III)
Химическая формула Fe(NO 3 ) 3 (или) FeN 3 O 9 Название IUPAC Нитрат железа (III) Другие химические названия Нитрат железа, азотная кислота, соль железа (3+), тринитрат железа Внешний вид Бледно-фиолетовые кристаллы Молекулярная масса 241,857 г/моль (безводный)
403,999 г/моль (нонагидрат)Плотность 1,68 г/см3 (гексагидрат) 9 0120 1,6429 г/см3 (нонагидрат) Температура плавления 47,2 °C Температура кипения 125 °C Растворимость Растворим в воде, спирте и ацетоне.
Мало растворим в холодной концентрированной азотной кислоте.
Химические свойства нитрата железа (III)
- При растворении нитрата железа (III) он образует желтый раствор из-за гидролиза.
- Оксид железа(III), диоксид азота и кислород образуются при термическом разложении нитрата железа(III).
4Fe(NO 3 ) 3 → 2Fe 2 O 3 + 12NO 2 + 3O 9 0003 2
- При растворении в расплавленной стеариновой кислоте соединение разлагается при температуре около 120°C с образованием оксида-гидроксида железа(III) FeO(OH).
- При нагревании до температуры, близкой к температуре кипения, азотная кислота испарится из раствора, а все железо выпадет в осадок в виде оксида железа(III) (Fe 2 О 3 ).
- Нитрат железа (III) реагирует с гидроксидом натрия (NaOH) с образованием нитрата натрия (NaNO 3 ) и гидроксида железа (III) Fe(OH) 3 .
3NaOH + Fe(NO 3 ) 3 → 3NaNO 3 + Fe(OH) 3
9 0061
- Нитрат железа (III) реагирует с медью с образованием нитрата меди (II) (Cu(NO 3 ) 2 ) и нитрат железа (Fe(NO 3 ) 2 ).
Cu + 2Fe(NO 3 ) 3 → Cu(NO 3 ) 2 + 2Fe(NO 3 ) 2
Использование нитрата железа (III)
- Поскольку нитрат железа (III) не имеет широкомасштабного применения, он действует как катализатор в производстве амида натрия из раствора натрия в аммиаке.
2NH 3 + 2Na → 2NaNH 2 + H 2
- Ювелиры и слесари травят серебро и серебряные сплавы растворами азотнокислого железа (III).
- В органическом синтезе некоторые глины, пропитанные нитратом железа (III), используются в качестве окислителей.
- Используется в качестве протравы при окрашивании, утяжелении шелка, дублении и подавлении коррозии, а также в качестве удобрения и пищевой добавки.
- Он также используется в качестве реагента в аналитической химии.
Опасности
- Вдыхание пыли нитрата трехвалентного железа раздражает нос и горло.
- Попадание внутрь нитрата железа (III) может вызывать раздражение полости рта и желудка.
- Длительный контакт с ним может вызвать раздражение кожи и глаз. Хроническое воздействие может повлиять на печень.
- Это сильный окислитель, и при контакте с органическим материалом существует опасность пожара. При пожарах могут образовываться токсичные оксиды азота и пары азотной кислоты.
Часто задаваемые вопросы о формуле нитрата железа (III)
Вопрос 1: Какова химическая формула нитрата железа (III)?
Ответ:
Нитрат железа (III) также называют нитратом железа или тринитратом железа, чья химическая (или) молекулярная формула Fe(NO 3 ) 3 (или) FeN 3 О 9 .
Это неорганическое соединение, которое выглядит как кристаллическое твердое вещество фиолетового цвета. Нонагидрат является наиболее распространенной формой гидрата с химической формулой Fe(NO 3 ) 3 . (Н 2 О) 9 .
Вопрос 2: Как получают нитрат железа (III)?
Ответ:
- Нитрат железа (III) также можно получить обработкой гематита (Fe 2 O 3 ) азотной кислотой.
Fe 2 O 3 + 6HNO 3 → 2Fe(NO 3 ) 3 + 3H 2 O
- Действие азотной кислоты на порошок металлического железа может привести к образованию железа (III) нитрат.
Fe + 4HNO 3 → Fe(NO 3 ) 3 + NO + 2H 2 O
Вопрос 3: Каково применение нитрата железа (III)?
Ответ:
Поскольку нитрат железа (III) не имеет широкомасштабного применения, он действует как катализатор в производстве амида натрия из раствора натрия в аммиаке.
Ювелиры и мастера по металлу травят серебро и серебряные сплавы растворами азотнокислого железа (III). Он используется в качестве протравы при окрашивании, утяжелении шелка, дублении и подавлении коррозии, а также в качестве реагента в аналитической химии.
Вопрос 4: Назовите некоторые свойства нитрата железа (III).
Ответ:
Нитрат железа (III) также называют нитратом железа или тринитратом железа, молекулярная формула которого FeN3O9. Он выглядит как кристаллическое твердое вещество фиолетового цвета, полностью растворим в воде, спирте и ацетоне, а также слабо растворим в холодной концентрированной азотной кислоте. Хотя он негорючий, он увеличивает интенсивность пожара при контакте с горючими материалами. Его температура плавления составляет 47,2 ° C, тогда как его температура кипения составляет 125 ° C.
Вопрос 5: Назовите некоторые опасности нитрата железа (III).
Ответ:
Вдыхание пыли нитрата железа раздражает нос и горло.
Проглатывание нитрата железа (III) может раздражать рот и желудок. Длительный контакт с ним может раздражать кожу, а также раздражать глаза. Хроническое воздействие может повлиять на печень. Это сильный окислитель, и существует вероятность опасного пожара, поскольку он вступает в контакт с органическим материалом. При пожарах могут образовываться токсичные оксиды азота и пары азотной кислоты.
Вопрос 6: Что происходит, когда нитрат железа (III) реагирует с медью?
Ответ:
Нитрат железа (III) реагирует с медью с образованием нитрата меди (II) (Cu(NO 3 ) 2 ) и нитрата железа (Fe(NO 900 03 3 ) 2 ).
Cu + 2Fe(NO 3 ) 3 → Cu(NO 3 ) 2 + 2Fe(NO 3 ) 2 90 004
ЖЕЛЕЗА НИТРАТ | Камео Кемикалс
Добавить в MyChemicals Страница для печати
Химический паспорт
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора включают общие идентификационные номера, алмаз NFPA Знаки опасности Министерства транспорта США и общий описание хим.
Информация в CAMEO Chemicals поступает из множества источники данных.
Номер CAS Номер ООН/НА Знак опасности DOT Береговая охрана США КРИС Код
- 10421-48-4
- 1466
- Окислитель
- ФНТ
Карманный справочник NIOSH Международная карта химической безопасности никто никто NFPA 704
данные недоступны
Общее описание
Кристаллическое твердое вещество фиолетового цвета.
Негорючий, но ускорит горение горючих материалов. Если в огонь вовлечены большие количества или горючий материал мелко измельчен, может произойти взрыв. Длительное воздействие огня или тепла на материал может привести к взрыву. Токсичные оксиды азота образуются при пожарах с участием этого материала. Он используется для окрашивания и дубления, в химическом анализе и в медицине.
Опасности
Что это за информация?
Опасные поля включать специальные предупреждения об опасности воздух и вода реакции, пожароопасность, опасность для здоровья, профиль реактивности и подробности о задания реактивных групп и потенциально несовместимые абсорбенты. Информация в CAMEO Chemicals поступает из различных источников. источники данных.
Предупреждения о реактивности
- Сильный окислитель
Реакции с воздухом и водой
Растворим в воде.
Пожароопасность
Особая опасность продуктов горения: При пожаре могут образовываться токсичные оксиды азота и пары азотной кислоты.
Поведение при пожаре: При контакте с горючими материалами интенсивность пожара увеличивается. Нанесите воду на прохладные контейнеры или пролитый материал. (Геологическая служба США, 1999 г.)
Опасность для здоровья
Вдыхание пыли вызывает раздражение носа и горла. Проглатывание вызывает раздражение рта и желудка. Пыль раздражает глаза и может раздражать кожу при длительном контакте. (USCG, 1999)
Профиль реакционной способности
ЖЕЛЕЗА НИТРАТ является окислителем. Смеси с алкиловыми эфирами могут взрываться из-за образования алкилнитратов. Смеси с фосфором, хлоридом олова (II) или другими восстановителями могут реагировать со взрывом [Bretherick, 1979, с. 108-109].
Принадлежит к следующей реакционной группе(ам):
- Соединения нитратов и нитритов, неорганические
Потенциально несовместимые абсорбенты
Соблюдайте осторожность: жидкости с этой классификацией реактивной группы были Известно, что он реагирует с абсорбенты перечислено ниже.
Больше информации о абсорбентах, в том числе о ситуациях, на которые следует обратить внимание…
- Абсорбенты на основе целлюлозы
- Вспененные полимерные абсорбенты
Рекомендации по ответу
Что это за информация?
Поля рекомендации ответа включают в себя расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, пожарное реагирование, защитная одежда и первая помощь. информация в CAMEO Chemicals поступает из различных источники данных.
Изоляция и эвакуация
Выдержка из Руководства ERG 140 [Окислители]:
НЕМЕДЛЕННЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ: Изолируйте зону разлива или утечки во всех направлениях на расстоянии не менее 50 метров (150 футов) для жидкостей и не менее 25 метров (75 футов) для твердых веществ.
КРУПНЫЙ РАЗЛИВ: Рассмотрите начальную эвакуацию по ветру на расстояние не менее 100 метров (330 футов).
ПОЖАР: Если цистерна, железнодорожная цистерна или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях. Если аммиачная селитра находится в цистерне, железнодорожном вагоне или автоцистерне и попала в зону пожара, ИЗОЛИРОВАТЬ на расстоянии 1600 метров (1 милю) во всех направлениях; также инициировать эвакуацию, включая аварийно-спасательных служб, на 1600 метров (1 милю) во всех направлениях. (ЭРГ, 2020)
Пожарное дело
Выдержка из Руководства ERG 140 [Окислители]:
НЕБОЛЬШОЙ ПОЖАР: Используйте воду. Не используйте сухие химикаты или пены. CO2 или Halon® могут обеспечить ограниченный контроль.
БОЛЬШОЙ ПОЖАР: Залейте зону пожара водой с расстояния. Не перемещайте груз или транспортное средство, если груз подвергся воздействию тепла. Если это можно сделать безопасно, уберите неповрежденные контейнеры из зоны вокруг огня.
ПОЖАР, ВКЛЮЧАЮЩИЙ РЕЗЕРВУАРЫ ИЛИ АВТОМОБИЛЬНЫЕ/ТРЕЙЛЕРНЫЕ НАГРУЗКИ: Тушить огонь с максимального расстояния или использовать беспилотные устройства основного потока или контрольные насадки. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. ВСЕГДА держитесь подальше от танков, охваченных огнем. При массовом возгорании используйте беспилотные устройства управления потоком или стволы-мониторы; если это невозможно, отойдите от зоны и дайте огню гореть. (ЭРГ, 2020)
Непожарное реагирование
Выдержка из Руководства ERG 140 [Окислители]:
Держите горючие материалы (дерево, бумагу, масло и т. д.) вдали от пролитого материала. Не прикасайтесь к поврежденным контейнерам или пролитому материалу, если вы не надели соответствующую защитную одежду. Остановите утечку, если вы можете сделать это без риска. Не допускайте попадания воды внутрь контейнеров.
МАЛЕНЬКИЙ СУХОЙ РАЗЛИВ: Чистой лопатой поместите материал в чистый сухой контейнер и неплотно накройте крышкой; Уберите контейнеры с загрязненной зоны.
НЕБОЛЬШОЙ ПРОЛИВ ЖИДКОСТИ: Используйте негорючий материал, такой как вермикулит или песок, чтобы впитать продукт и поместить в контейнер для последующей утилизации.
БОЛЬШОЙ РАЗЛИВ: Оборудуйте дамбу далеко перед местом разлива жидкости для последующего удаления. (ЭРГ, 2020)
Защитная одежда
Респиратор; защитные очки или лицевой щиток; защитные перчатки (USCG, 1999)
DuPont Tychem® Suit Fabrics
Информация отсутствует.
Первая помощь
Вдыхание: выйти на свежий воздух.
ПРОГЛАТЫВАНИЕ: дать большое количество воды; вызвать рвоту, если было проглочено большое количество.
ГЛАЗА: промыть водой; обратитесь за медицинской помощью, если раздражение не проходит.
КОЖА: промыть водой. (Геологическая служба США, 1999 г.)
Физические свойства
Что это за информация?
Поля физических свойств включают в себя такие свойства, как давление пара и температура кипения, а также пределы взрываемости и пороги токсического воздействия Информация в CAMEO Chemicals поступает из различных источников.
источники данных.
Химическая формула:
- Fe(NO3)3
Температура вспышки: данные отсутствуют
Нижний предел взрываемости (НПВ): данные отсутствуют
Верхний предел взрываемости (ВПВ): данные отсутствуют
Температура самовоспламенения: данные отсутствуют
Температура плавления: 117°F (USCG, 1999)
Давление пара: данные отсутствуют
Плотность пара (относительно воздуха): данные отсутствуют
Удельный вес: 1,7 при 68°F (USCG, 1999)
Температура кипения: данные отсутствуют
Молекулярная масса: 404.02 (USCG, 1999)
Растворимость в воде: данные отсутствуют
Энергия/потенциал ионизации: данные отсутствуют
IDLH: данные отсутствуют
AEGL (рекомендательные уровни острого воздействия)
Информация об AEGL отсутствует.ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.PAC (критерии защитного действия)
Химические вещества ПАК-1 ПАК-2 ПАК-3 Нитрат железа (10421-48-4) 13 мг/м3 140 мг/м3 850 мг/м3 (DOE, 2018)
Нормативная информация
Что это за информация?
Поля нормативной информации включить информацию из Сводный список III Агентства по охране окружающей среды США списки, Химический завод Агентства кибербезопасности и безопасности инфраструктуры США антитеррористические стандарты, и Управление по охране труда и здоровья США Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами (подробнее об этих источники данных).
Сводный перечень списков EPA
Нормативное наименование Номер CAS/
313 Код категорииEPCRA 302
EHS TPQEPCRA 304
EHS RQCERCLA RQ ЭПКРА 313
ТРИRCRA
КодCAA 112(r)
RMP TQНитрат железа 10421-48-4 1000 фунтов (Список списков Агентства по охране окружающей среды, 2022 г.




 Это неорганическое соединение, которое выглядит как кристаллическое твердое вещество фиолетового цвета. Нонагидрат является наиболее распространенной формой гидрата с химической формулой Fe(NO 3 ) 3 . (Н 2 О) 9 .
Это неорганическое соединение, которое выглядит как кристаллическое твердое вещество фиолетового цвета. Нонагидрат является наиболее распространенной формой гидрата с химической формулой Fe(NO 3 ) 3 . (Н 2 О) 9 . Ювелиры и мастера по металлу травят серебро и серебряные сплавы растворами азотнокислого железа (III). Он используется в качестве протравы при окрашивании, утяжелении шелка, дублении и подавлении коррозии, а также в качестве реагента в аналитической химии.
Ювелиры и мастера по металлу травят серебро и серебряные сплавы растворами азотнокислого железа (III). Он используется в качестве протравы при окрашивании, утяжелении шелка, дублении и подавлении коррозии, а также в качестве реагента в аналитической химии. Проглатывание нитрата железа (III) может раздражать рот и желудок. Длительный контакт с ним может раздражать кожу, а также раздражать глаза. Хроническое воздействие может повлиять на печень. Это сильный окислитель, и существует вероятность опасного пожара, поскольку он вступает в контакт с органическим материалом. При пожарах могут образовываться токсичные оксиды азота и пары азотной кислоты.
Проглатывание нитрата железа (III) может раздражать рот и желудок. Длительный контакт с ним может раздражать кожу, а также раздражать глаза. Хроническое воздействие может повлиять на печень. Это сильный окислитель, и существует вероятность опасного пожара, поскольку он вступает в контакт с органическим материалом. При пожарах могут образовываться токсичные оксиды азота и пары азотной кислоты. Информация в CAMEO Chemicals поступает
из множества
источники данных.
Информация в CAMEO Chemicals поступает
из множества
источники данных. Негорючий, но ускорит горение горючих материалов. Если в огонь вовлечены большие количества или горючий материал мелко измельчен, может произойти взрыв. Длительное воздействие огня или тепла на материал может привести к взрыву. Токсичные оксиды азота образуются при пожарах с участием этого материала. Он используется для окрашивания и дубления, в химическом анализе и в медицине.
Негорючий, но ускорит горение горючих материалов. Если в огонь вовлечены большие количества или горючий материал мелко измельчен, может произойти взрыв. Длительное воздействие огня или тепла на материал может привести к взрыву. Токсичные оксиды азота образуются при пожарах с участием этого материала. Он используется для окрашивания и дубления, в химическом анализе и в медицине.




 источники данных.
источники данных.


Leave A Comment