Структура и характеристики Nh5Cl Льюиса: 19 полных фактов —
Расположение валентных электронов в виде линий и точек известно как структура Льюиса или электронная точечная структура. Взгляните на структуру Льюиса Nh5Cl ниже.
Структура Льюиса Nh5Cl содержит всего три элемента: азот, водород и хлор. Это комбинация всех неметаллов (N, H и Cl). Он состоит из двух ионов Nh5+ и Cl-. Ион Nh5 имеет положительный заряд, так как отдает один электрон атому хлора.
Ион Cl- имеет отрицательный заряд, так как принимает 1 электрон от иона Nh5+. В Nh5+ ионы N и H связаны одинарными ковалентными связями. Ионы Nh5+ и Cl- могут образовывать ионную связь. Ионы Cl- заключены в квадратные скобки из-за заряда (-1) на них. Nh5+ заряд (+1) находится на атоме N, поэтому он не в скобках. Давайте обсудим структуру Льюиса Nh5Cl, характеристики и различные факты.
Как нарисовать структуру Льюиса Nh5Cl?
Структура Льюиса рисунок имеет некоторые правила или шаги для рисования. Здесь мы обсуждаем шаги по рисованию структуры Льюиса Nh5Cl ниже.
Здесь мы обсуждаем шаги по рисованию структуры Льюиса Nh5Cl ниже.
Валентные электроны:
Nh5Cl структура льюиса необходимо считать валентные электроны. Делая суммирование валентных электронов каждого атома, присутствующего в молекуле. Он имеет положительный заряд на ионе Nh5 из-за потери 1 валентного электрона иону Cl, поэтому создает на нем отрицательный заряд.
Связывание, одинокие пары и правило октетов:
Сделайте связь внутри всех атомов, поставив валентные электроны. Оставшиеся валентные электроны являются неподеленными электронами, которые представляют собой неподеленные электронные пары Nh5Cl. Неподеленная пара электронов присутствует только у ионов Cl-. Проверьте, имеют ли все атомы N, H и Cl полные или неполные октеты, применяя правило октетов.
Формальный заряд и форма:
Формальный заряд присутствует на Nh5Cl Структура Льюиса должна быть рассчитана по данной формуле. После этого предусмотрите форму, гибридизацию и валентный угол структуры Льюиса Nh5Cl.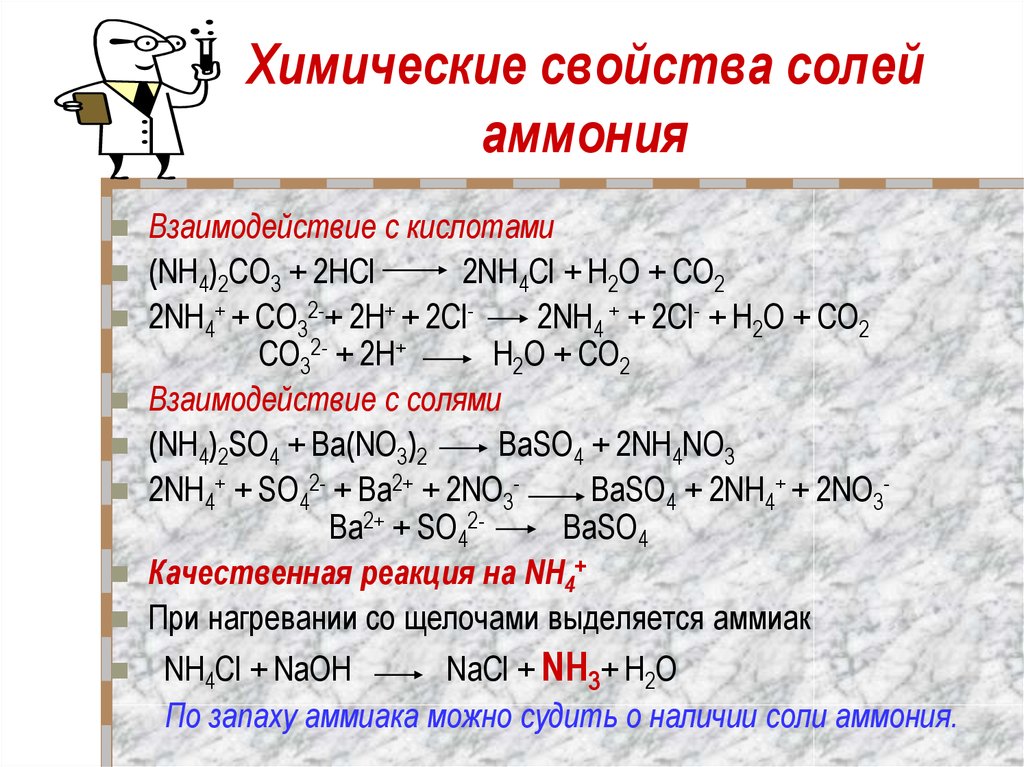 Структура Льюиса Nh5Cl
Структура Льюиса Nh5Cl
валентные электроны Nh5Cl
Известно, что число электронов, присутствующих на внешней валентной оболочке атома элемента, является валентными электронами. Краткий обзор валентных электронов Nh5Cl приведен ниже.
Структура Льюиса Nh5Cl имеет всего 16 электронов. Атом N имеет 5 электронов, так как он принадлежит 15th Группа периодической таблицы. Водород относится к 1st Таким образом, группа периодической таблицы имеет 1 валентный электрон. Скорее хлор относится к 17th группу периодической таблицы и имеющий 7 валентных электронов.
Ниже приведена пошаговая оценка валентных электронов структуры Льюиса Nh5Cl.
- Валентные электроны в Nh5 (валентный электрон N + валентный электрон H) = 5 (N) + 1 x 4 (H) = 09
- Вычтите один валентный электрон из валентного электрона Nh5 из-за +1 заряда или потери электрона на ионе Nh5+ = 09 – 01 = 08
- Всего валентных электронов на ионе Nh5+ = 08
- Валентные электроны на атоме Cl (добавьте 1 электрон за -1 заряд или прирост электрона) = 07 + 01 = 08
- Сумма валентных электронов Nh5+ и иона Cl- = 08 (Nh5+) + 08 (Cl-) = 16.

- Следовательно, сумма валентных электронов на хлориде аммония Nh5Cl структура льюиса шестнадцать.
Неподеленные пары структуры Льюиса Nh5Cl
Несвязывающие электроны, присутствующие на атомах любой молекулы, когда образуют пару, известны как электроны неподеленной пары. Ниже приводится обсуждение неподеленной пары электронов Nh5Cl.
Nh5Cl структура льюиса содержит 4 неподеленные пары электронов. Он имеет всего 16 валентных электронов и 8 несвязывающих электронов. Таким образом, эти восемь несвязывающих электронов спариваются и образуют четыре электрона неподеленной пары на Nh5Cl.
Эти 4 неподеленные пары электронов Nh5Cl присутствуют только на ионе Cl-. Ион Nh5+ не имеет неподеленной пары электронов, так как все связывающие электроны образуют связь NH, а один электрон уже передан иону Cl-.
Правило октета структуры Льюиса Nh5Cl
Стабильность является соединением или молекулой, если она имеет восемь электронов в своей валентной оболочке, что соответствует правилу октета. У нас есть глубокая дискуссия о Nh5Cl структура льюиса Правило октета.
У нас есть глубокая дискуссия о Nh5Cl структура льюиса Правило октета.
В Nh5Cl ионы Nh5+ и Cl- имеют полные октеты. Оба они окружены восемью – восемью электронами. Ион Nh5+ имеет восемь связывающих электронов, так как они образуют четыре одинарные ковалентные связи NH внутри атома азота и водорода. Ион Cl- имеет восемь несвязывающих электронов вокруг себя.
Формальный заряд структуры Льюиса Nh5Cl
Положительный или отрицательный заряд атома, иона или молекулы любого соединения известен как формальный заряд. Обсудим расчетную часть формальных затрат Nh5Cl.
Формальный заряд структуры Льюиса Nh5Cl = (валентные электроны – несвязывающие электроны – ½ связывающих электронов)
Используя приведенную выше формулу, мы должны рассчитать формальный заряд структуры Льюиса Nh5Cl.
| Атомы Nh5Cl структура льюиса | Валентные электроны на N, H и Cl | Несвязывающие электроны на N, H и Cl | Связывание электронов на N, H и Cl | Формальный заряд N, H и Cl |
| Атом азота (N) | 05 | 00 | 08 | ( 5 – 0 – 8 / 2 ) = +1 |
| Атомы водорода (H) | 01 | 00 | 02 | ( 1 – 0 – 2 / 2 ) = 0 |
| Атом хлора (Cl) | 07 | 08 | 00 | ( 7 – 8 – 0 / 2 ) = – 1 |
Резонанс структуры Льюиса Nh5Cl
Несколько форм структуры имеют одинаковое атомное положение, но другое положение связи одного и того же соединения — это резонансная структура. Посмотрите краткую информацию о резонансной структуре Nh5Cl.
Посмотрите краткую информацию о резонансной структуре Nh5Cl.
Структура Льюиса Nh5Cl не может образовывать резонансную структуру. Это ионное соединение, не образующее ковалентных связей между ионами Nh5+ и Cl-. Также не подпадает под правила рисование резонансной структуры из-за отсутствия множественных связей и движения электронов для образования множественных связей.
Nh5Cl форма структуры Льюиса
Расположение атомов определенным образом, образующее определенную геометрию и форму молекулы, известно как молекулярная форма. Взгляните на форму структуры Льюиса Nh5Cl.
Форма структуры Nh5Cl имеет кристаллическую форму объемно-центрированной кубической структуры. Согласно теории VSEPR, он не имеет молекулярной формы. Но ион Nh5+ структуры Льюиса Nh5Cl следует теории VSEPR и имеет тетраэдрическую форму.
Структурный угол Льюиса Nh5Cl
Угол между двумя одновременными связями в структуре любой молекулы называется валентным углом. Давайте кратко рассмотрим валентный угол структуры Льюиса Nh5Cl.
Давайте кратко рассмотрим валентный угол структуры Льюиса Nh5Cl.
Структура Льюиса Nh5Cl может иметь два валентных угла:
- 900 валентный угол в его объемно-центрированной кубической кристаллической структуре.
- 109.50 валентный угол в градусах для тетраэдрической геометрии Nh5+.
гибридизация Nh5Cl
Атомные орбитали, когда они смешиваются и переделываются, образуют новую гибридную орбиталь с эквивалентной энергией, известную как гибридизация. Вот краткий обзор гибридизации Nh5Cl.
Структура Льюиса Nh5Cl демонстрирует sp3-гибридизацию. Это ионное соединение, состоящее из ионов Nh5+ и Cl-. Ион Nh5+ имеет тетраэдрическую молекулярную форму и геометрию, благодаря чему атом N проявляет в нем sp3-гибридизацию. 1′-орбиталь H и 3’p’-орбиталь N перекрываются, образуя sp3-гибридные орбитали.
Является ли Nh5Cl твердым веществом?
Материал имеет очень близко или плотно упакованные атомы, которые очень трудно разрушить, и являются твердыми соединениями. Давайте обсудим, является ли Nh5Cl твердым или нет.
Давайте обсудим, является ли Nh5Cl твердым или нет.
Nh5Cl представляет собой кристаллическое твердое соединение. Он имеет плотно упакованные ионы, связанные друг с другом в объемно-центрированной кубической форме его кристаллической решетки. Между ионами Nh5+ и Cl- существует сильная электростатическая сила притяжения. Благодаря чему они скрепляются прочной ионной связью.
Как Nh5Cl является твердым?
Кристаллические твердые тела имеют определенное расположение в зависимости от их связи. См. ниже, как Nh5Cl является твердым.
Nh5Cl представляет собой твердое соединение из-за его объемно-центрированной кубической (ОЦК) структуры. В структуре Nh5Cl BCC ион Nh5+ расположен в центре куба, окруженного 8 Cl- вокруг него. Центральный ион Nh5+ связан с ионом 4 Cl-. Каждый атом структуры ОЦК соединен с 4 другими атомами.
Растворяется ли Nh5Cl в воде?
Максимальная способность растворенного вещества растворяться в растворителе (воде) при определенной температуре называется растворимостью. Обсудим растворимость Nh5Cl в воде.
Обсудим растворимость Nh5Cl в воде.
Nh5Cl полностью растворяется в воде. Он может легко диссоциировать или ионизироваться на ионы Nh5+ и Cl- в водном растворе при реакции с водой. Nh5Cl является солью, а все соли легко растворяются в воде. Из-за реакции диссоциации происходит между Nh5Cl и водой.
Почему Nh5Cl растворяется в воде?
Растворимость зависит от диссоциации частиц растворенного вещества. Посмотрите, почему Nh5Cl растворим в воде.
Nh5Cl полностью растворим в воде. Потому что при добавлении Nh5Cl в воду происходит разделение ионов Nh5+ и Cl- за счет ее ионизации. Эти ионы Nh5+ и Cl- присоединяются к молекулам воды с противоположно заряженными ионами.
Как Nh5Cl растворяется в воде?
Растворимость зависит от присоединения противоположных ионов к молекуле воды.
Ион Nh5+ связывается с ионами OH- и образует Nh5OH в воде. С другой стороны, ионы Cl- присоединяются к ионам H+ и образуют молекулы HCl в водном растворе. Nh5Cl, будучи ионизируемым и способным связываться с противоположно заряженными молекулами воды, показывает его способность растворяться в воде.
Nh5Cl, будучи ионизируемым и способным связываться с противоположно заряженными молекулами воды, показывает его способность растворяться в воде.
Реакция Nh5Cl с водой дает Nh5OH, а также HCl, что обозначает Nh5Cl + h3O → Nh5OH + HCl.
Является ли Nh5Cl полярным или неполярным?
Соединения, содержащие два электрических диполя с частичными положительными или отрицательными зарядами, являются полярными соединениями. Ниже приведено описание полярности Nh5Cl.
Nh5Cl является полярным соединением. Между атомами азота и водорода ионов Nh5+ существует огромная разница в электроотрицательности. Благодаря чему в молекулах Nh5Cl создаются диполи. Кроме того, он имеет асимметричное расположение атомов в своей структуре, что делает молекулу Nh5Cl полярной.
Почему Nh5Cl полярен?
Полярные соединения реагируют только с другими полярными соединениями. Здесь мы обсуждаем, почему Nh5Cl полярен по своей природе.
Nh5Cl полярен по своей природе.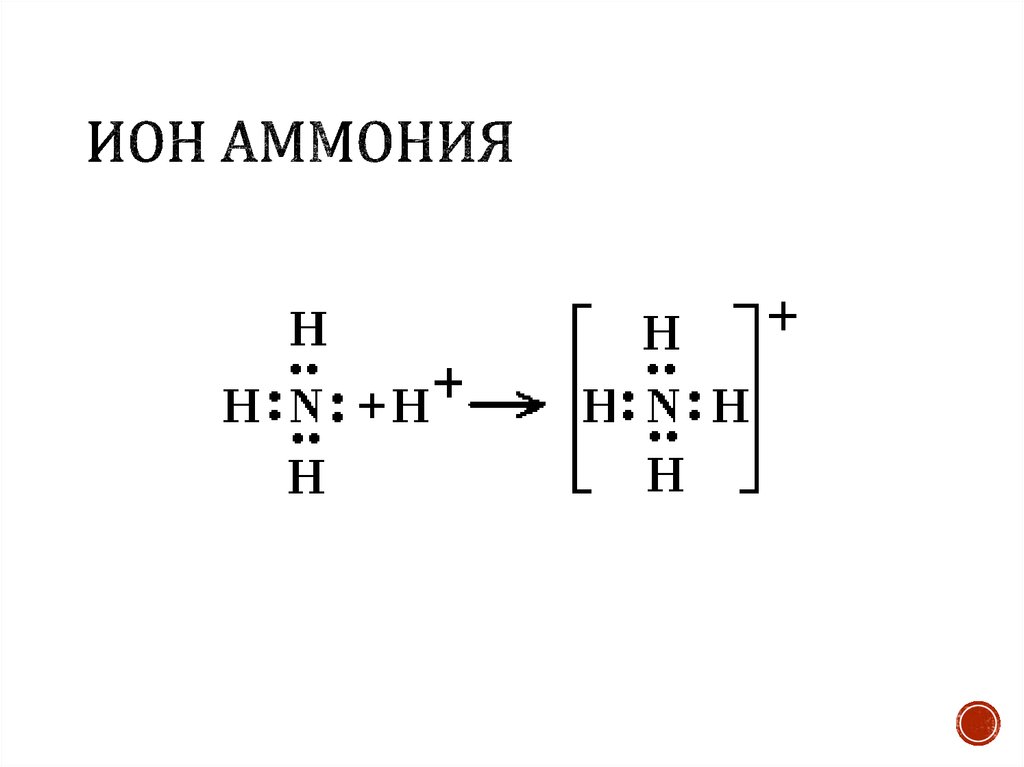 Из-за того, что атом азота имеет более высокую электроотрицательность, чем атом водорода в ионе Nh5+ молекулы Nh5Cl. Значение разности электроотрицательностей водорода и азота составляет 0.83, что больше значения 0.5, предлагаемого правилом Полинга.
Из-за того, что атом азота имеет более высокую электроотрицательность, чем атом водорода в ионе Nh5+ молекулы Nh5Cl. Значение разности электроотрицательностей водорода и азота составляет 0.83, что больше значения 0.5, предлагаемого правилом Полинга.
Насколько полярен Nh5Cl?
В дальнейшем мы узнаем, почему Nh5Cl является полярным соединением.
Ион Nh5+ имеет неравномерное распределение электронов на атомах H и N. Электронная плотность стягивается к атому азота. Следовательно, на атоме водорода возникает частичный положительный заряд, а на атоме азота иона Nh5+ возникает частичный отрицательный заряд. Таким образом, Nh5Cl проявляет полярную природу из-за присутствия полярного иона NH+.
Является ли Nh5Cl молекулярным соединением?
Соединение состоит из небольших молекул, ковалентно связанных друг с другом, и известно как молекулярное или ковалентное соединение. Обсудим, молекулярный Nh5Cl или нет.
Nh5Cl не является молекулярным, так как имеет ионную природу. Он может ионизироваться в два разных иона Nh5+ и ионы OH-, что показывает его ионную природу. В его структуре отсутствуют ковалентно связанные малые молекулы. Также его молекулярная формула не представляет количество молекул в нем.
Он может ионизироваться в два разных иона Nh5+ и ионы OH-, что показывает его ионную природу. В его структуре отсутствуют ковалентно связанные малые молекулы. Также его молекулярная формула не представляет количество молекул в нем.
Почему Nh5Cl является ионным?
Соединения, содержащие ионы, имеющие некоторый заряд, являются ионными соединениями. Ниже приводится описание ионной природы Nh5Cl.
Nh5Cl представляет собой ионную соль. В связи с этим обладает способностью ионизироваться в виде ионов Nh5+ и Cl-. Эти ионы Nh5+ и Cl- связаны друг с другом электростатической силой притяжения, которая представляет собой сильную ионную связь. Благодаря этим прочным ионным связям ионы Nh5+ и Cl- прочно держались вместе.
Как Nh5Cl является ионным?Ниже представлена ионная природа Nh5Cl, показывающая, как она работает.
Ион Nh5+ имеет ковалентные связи между атомами N и H, образуя связи NH. Но Nh5+ и Cl- не связаны в нем ковалентной связью. Nh5Cl содержит как ковалентные связи (в ионе NH+), так и ионные связи (в ионе NH+ и Cl-). Таким образом, Nh5Cl считают ионным, а не ковалентным или молекулярным.
Nh5Cl содержит как ковалентные связи (в ионе NH+), так и ионные связи (в ионе NH+ и Cl-). Таким образом, Nh5Cl считают ионным, а не ковалентным или молекулярным.
Nh5Cl — это кислота или основание?
Соединения, которые отдают или отдают протоны, являются кислотами, а соединения, которые принимают или отдают протоны, являются основаниями. Давайте обсудим кислотную или основную природу Nh5Cl.
Nh5Cl по своей природе является кислой солью. Значение pH Nh5Cl равно 5.35. Его получают в виде соли в результате кислотно-щелочной реакции между очень слабым основанием аммиака (Nh4) и сильной кислотой (HCl). Nh5Cl также образуется как побочный продукт реакции Сольвари образования карбоната натрия.
Является ли Nh5Cl электролитом?
Соединения, которые ионизируются при добавлении к воде и проводят электрический ток, известны как электролиты. Посмотрите краткое обсуждение электролитического поведения Nh5Cl.
Nh5Cl может выступать в качестве электролита. Так как он имеет способность образовывать ионы в воде. Если в водный раствор добавить некоторое количество Nh5Cl, то он полностью диссоциирует в воду в виде ионов NH+ и Cl-. Таким образом, эти ионы Nh5+ и Cl- могут свободно перемещаться в растворе электролита.
Так как он имеет способность образовывать ионы в воде. Если в водный раствор добавить некоторое количество Nh5Cl, то он полностью диссоциирует в воду в виде ионов NH+ и Cl-. Таким образом, эти ионы Nh5+ и Cl- могут свободно перемещаться в растворе электролита.
При приложении внешнего поля к этому электролитическому раствору Nh5Cl и h3O ионы начинают двигаться в растворе и начинают проводить электричество в этом растворе. Таким образом, Nh5Cl проявляет электролитические свойства.
Nh5Cl — это соль?
Известно, что вещества, которые образуются в результате реакции с кислотами и основаниями, являются солями. Давайте обсудим, является ли Nh5Cl солью или нет.
Nh5Cl в основном соль. Скорее это кристаллическая кислая соль. Он образуется в результате кислотно-щелочной реакции между HCl, которая является сильной кислотой, и Nh4, который является слабым основанием. Из-за присутствия сильной кислоты HCl Nh5Cl является кислой солью. Итак, Nh5Cl считается солью.
Почему Nh5Cl является солью?
Ионные соединения обычно ведут себя как бесцветные кристаллические соли. Давайте рассмотрим ниже.
Nh5Cl является кислой солью. Так как Nh5Cl имеет ионную природу. Он проявляет все свойства солей, таких как Nh5Cl, растворяется в воде и может диссоциировать на ионы. Соли являются продуктом кислотно-щелочной реакции, поэтому Nh5Cl также является продуктом кислотно-основной реакции Nh4 и HCl.
Как Nh5Cl является солью?
Природа соли Nh5Cl, как она работает, обсуждается ниже.
Соль Nh5Cl содержит катион аммония (Nh5+) в своей структуре или молекуле. Соли обычно содержат катионы металлов или могут образовываться из катионов Nh5+ (аммония). Таким образом, все характеристики Nh5Cl демонстрируют свойства солей и подпадают под категорию солей.
Реакция Nh4 и HCl приводит к образованию соли Nh5Cl, которая обозначает Nh4 + HCl → Nh5Cl.
Вывод:
Структура Льюиса Nh5Cl имеет шестнадцать валентных электронов. В его структуре 8 неподеленных пар электронов. Ионы Nh5+ и Cl- связаны сильной ионной связью и имеют полные октеты. Атом N иона Nh5+ имеет формальный заряд +1, а ион Cl имеет формальный заряд -1. Это твердая, ионная, полярная, кислая соль, растворимая в воде и электролите в природе.
В его структуре 8 неподеленных пар электронов. Ионы Nh5+ и Cl- связаны сильной ионной связью и имеют полные октеты. Атом N иона Nh5+ имеет формальный заряд +1, а ион Cl имеет формальный заряд -1. Это твердая, ионная, полярная, кислая соль, растворимая в воде и электролите в природе.
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Допоможіть, будь ласка, розв’язати задачу.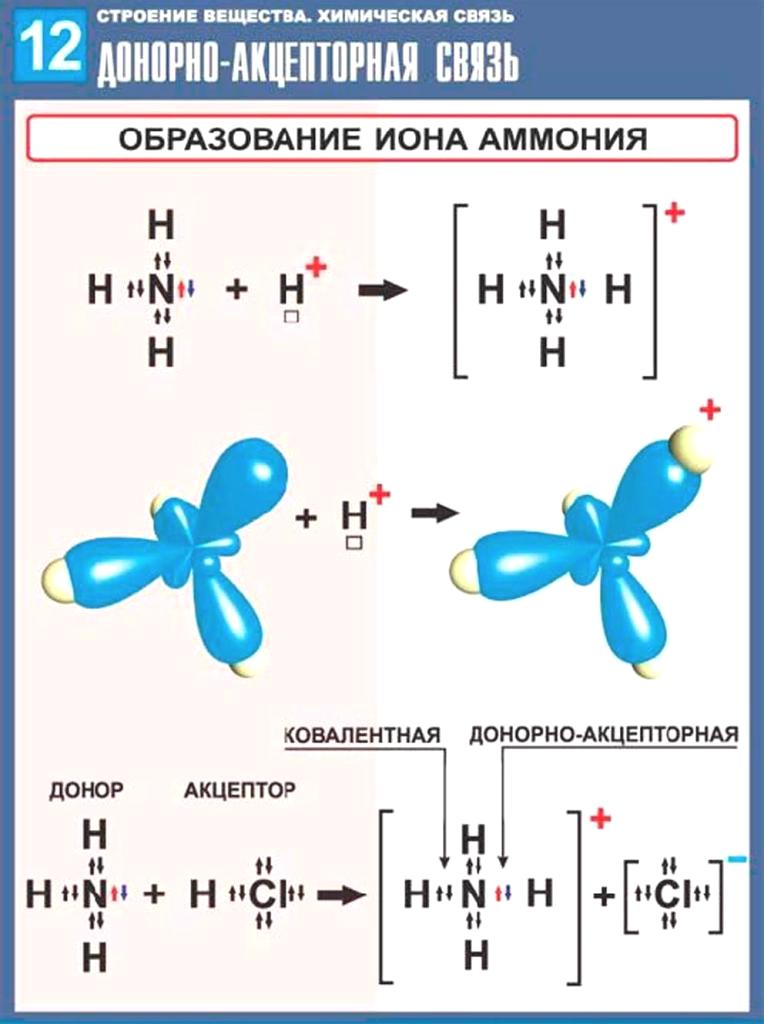
определить возможность протекания реакции
Решено
1,2-диметилбензол +KMnO4 ->? уравнение реакции
Составьте уравнение реакции по следующей схеме: Cu-CuSo4-Cu(NO3)2-CuO-X-Cu(OH)2
Пользуйтесь нашим приложением
Кислотные и основные компоненты хлорида аммония
••• kirisa99/iStock/GettyImages
Обновлено 04 июня 2018 г. и хлор (Cl). Он обозначается символом Nh5Cl и в природе находится в твердой кристаллической форме. Это соединение представляет собой водорастворимую соль аммиака, а водный раствор хлорида аммония имеет слабокислую реакцию. Хлорид аммония производится в промышленных масштабах путем взаимодействия аммиака (Nh4) с соляной кислотой (HCl): Nh4 + HCl = Nh5Cl.
TL;DR (слишком длинный; не читал)
Хлорид аммония, водорастворимая соль аммиака, имеет слегка кислую реакцию в виде раствора на водной основе. Кислотный компонент хлорида аммония (Cl-) образует ионы водорода (H+) при растворении в воде. Основной компонент (Nh5+) образует ионы гидроксида (OH-) при растворении в воде.
Кислотный компонент хлорида аммония (Cl-) образует ионы водорода (H+) при растворении в воде. Основной компонент (Nh5+) образует ионы гидроксида (OH-) при растворении в воде.
Водный раствор хлорида аммония
При растворении кристаллов хлорида аммония в воде (h3O) соединение хлорида аммония разлагается на составляющие его ионы: Nh5+ и Cl-. Химическая реакция диссоциации: Nh5Cl(твердый) = Nh5+(водный) + Cl-(водный). Nh5+(водный) +h3O(жидкий) = Nh4(водный) +h4O+(водный) h4O+ +OH- = 2h3O. Эта конкретная реакция молекул воды является обратимой, поскольку такие молекулы h3O диссоциируют с образованием h4O+ и OH- и объединяются с образованием молекул h3O. Хлорид аммония возвращается в твердую форму путем кристаллизации.
Кислотный компонент
Кислотный или основной компоненты хлорида аммония можно определить только в его водной форме путем растворения соединения в воде. Кислотный компонент образует ионы водорода (H+) при растворении в воде. Cl- является кислотным компонентом хлорида аммония. Nh5Cl + h3O = Nh5+ + HCl (уравнение 1). Cl- + h3O = H+ Cl- +h3O (уравнение 2). Хлорид (Cl-) сначала связывается с водой (h3O) с образованием соляной кислоты (HCl), а при диссоциации HCl образуются ионы водорода (H+).
Cl- является кислотным компонентом хлорида аммония. Nh5Cl + h3O = Nh5+ + HCl (уравнение 1). Cl- + h3O = H+ Cl- +h3O (уравнение 2). Хлорид (Cl-) сначала связывается с водой (h3O) с образованием соляной кислоты (HCl), а при диссоциации HCl образуются ионы водорода (H+).
Основной компонент
Основной компонент образует ионы гидроксида (ОН-) при растворении в воде. В водном растворе хлорида аммония ионы аммония (Nh5+) сначала связываются с h3O и образуют ионы аммиака и гидроксида. Nh5+ + h3O = Nh4 + OH- (уравнение 3). Поскольку ионы аммония образуют гидроксид-ионы, основными компонентами являются Nh5+.
Кислотная природа и применение
Слабокислая природа хлорида аммония обусловлена образованием соляной кислоты (HCl), поскольку HCl является сильной кислотой и ее действие является доминирующим. Определите кислотную или основную природу с помощью рН-метра. Хлорид аммония используется в качестве удобрения для выращивания таких культур, как кукуруза, пшеница, сельдерей и рис из-за более высокого содержания аммиака. Он также используется для обработки снега на горнолыжных склонах при температуре выше нуля градусов по Цельсию/32 градуса по Фаренгейту для укрепления снега.
Он также используется для обработки снега на горнолыжных склонах при температуре выше нуля градусов по Цельсию/32 градуса по Фаренгейту для укрепления снега.
Статьи по теме
Ссылки
- PubChem: Хлорид аммония
- Laney College: Buffer Solutions
Об авторе
Сушил Хадка пишет бизнес-концепции в кампусе также с 2010 года. Академические исследовательские работы Сушила были опубликованы в «Американском химическом обществе» и «Журнале физической химии». Сушил любит походы, длительные путешествия и текущие дела. Он получил степень бакалавра наук в области биологической инженерии в Университете штата Мэн.
Хлорид аммония: использование и советы по безопасности
Руководство для начинающих по хлориду аммония: использование и советы по безопасности
Хлорид аммония является распространенным ингредиентом в герметиках, косметике, удобрениях и других продуктах. В медицине он используется для лечения кашля и тяжелого метаболического алкалоза.
В медицине он используется для лечения кашля и тяжелого метаболического алкалоза.
Это белое кристаллическое вещество помогает сбалансировать рН организма и обладает легким мочегонным действием. Однако использование хлорида аммония выходит за рамки его роли в медицинской промышленности.
Производители используют это соединение для изготовления чистящих средств, шампуней и пищевых добавок.
Например, салмиак — разновидность соленой солодки, используемая в Балтийском регионе и странах Северной Европы, — производится на основе хлорида аммония. Другие темные сладости также содержат эту пищевую добавку.
Небольшие дозы хлорида аммония вряд ли повлияют на здоровье человека. Проблема с этим соединением заключается в том, что оно представляет опасность для окружающей среды. Длительное воздействие паров хлорида аммония может вызвать проблемы с дыханием, головные боли и раздражение глаз.
Если вы или ваши сотрудники используете это соединение, убедитесь, что вы осведомлены о его риске для здоровья. Вот что вы должны знать о безопасности хлорида аммония, чтобы защитить свой персонал!
Вот что вы должны знать о безопасности хлорида аммония, чтобы защитить свой персонал!
Что такое хлорид аммония?
Хлорид аммония представляет собой белый кристаллический химикат с молекулярной формулой Nh5Cl. Он доступен в порошковой, жидкой и твердой форме и обладает высокой растворимостью в воде.
В отличие от других химических веществ, это неорганическое соединение негорюче. Однако он может выделять токсичные пары, вызывающие раздражение глаз, затрудненное дыхание и кашель.
Под воздействием тепла хлорид аммония разлагается и выделяет токсичные пары, которые могут вызвать пожар или взрыв. Более того, это вещество представляет опасность для пресноводных рыб и морской среды в целом.
Хлорид аммония Применение
В основном это соединение используется в качестве источника азота в удобрениях. Фармацевтические компании используют его в качестве ингредиента в лекарствах от кашля. Другие виды использования хлорида аммония могут включать:
- Подкислитель в пищевых продуктах
- Ароматизатор
- Фотоконтраст в археологии
- Входит в состав флюсов для лужения и гальваники
- Мочегонное средство
- Клей для фанеры
- Добавка в безалкогольные тонеры,6 Хлорид не следует использовать в сочетании с хлорат калия, соли свинца или щелочи.
 В качестве лекарства он может взаимодействовать с дихлорфенамидом, декстроамфетамином и спиронолактоном.
В качестве лекарства он может взаимодействовать с дихлорфенамидом, декстроамфетамином и спиронолактоном.Как безопасно обращаться с хлоридом аммония
Воздействие паров хлорида аммония может повлиять на кожу, глаза и дыхательную систему. Вот почему важно обучать свой персонал и использовать соответствующее оборудование при работе с этим веществом.
Попросите своих сотрудников носить респираторы, защитные очки и защитные перчатки. Если они проглотят это соединение по ошибке, им следует прополоскать рот и выпить стакан воды. При попадании в глаза промыть большим количеством воды и как можно скорее обратиться к врачу.
Всегда стирайте одежду после работы с этим соединением. Используйте его только в местах с достаточной вентиляцией и примите надлежащие меры для предотвращения его замерзания или перегрева.



 Ковалентная полярная между азотом и каждым водородом, ионная между ионом аммония и хлорид-ионом.
Ковалентная полярная между азотом и каждым водородом, ионная между ионом аммония и хлорид-ионом.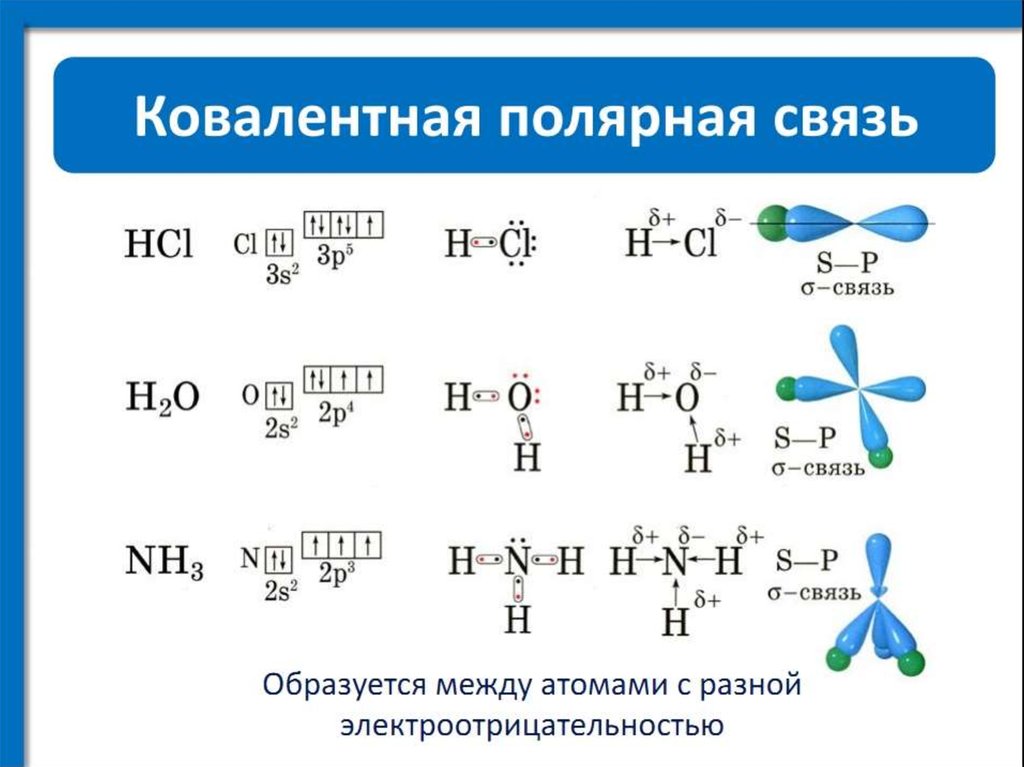 В качестве лекарства он может взаимодействовать с дихлорфенамидом, декстроамфетамином и спиронолактоном.
В качестве лекарства он может взаимодействовать с дихлорфенамидом, декстроамфетамином и спиронолактоном.
Leave A Comment