Найти степень окисления: (Nh5)2CO3, Ca(HCO3)2 — Знания.site
Последние вопросы
Русский язык
15 секунд назад
Помогите русский язык пожалуйстаГеография
22 секунд назад
Скласти таблицю на основі пар. 25, мал.108. Назви колонок: — назва с\г зони — кліматичний пояс та природна зона — особливості клімату — с\г культури — найбільші країниМатематика
22 секунд назад
2 доби 6 год 35 хв заміни складені іменові числа простимиГеометрия
22 секунд назад
1.
Английский язык
22 секунд назад
A. Give the definitions for the following legal terms: a. Criminal law is … b. Crime is … c. Conspiracy is … d. Attempt is …Химия
22 секунд назад
Визначте масу бензолу, отриманого при пропусканні 210 кг циклогексану над платиновим каталізатором при 350-450°С, Якщо масова частка виходу бензолу складає 0,85 від теоретично можливого.Қазақ тiлi
22 секунд назад
Америка Ұлыбритания елдерінде сақталған кітапханалардын басты ерекшеліктері недеМатематика
22 секунд назад
Срочно ПРОШУ ВАС ❤️❤️❤️Раціональна функція 50 баллов Математика
23 секунд назад
Розв’яжи систему рівнянь методом підстановки: -2-2v+1= 5, z = -8 — v Даю 17 балов!!!!Українська мова
23 секунд назад
Знайдіть правильну характеристику речення: Немає магії сильнішої, ніж магія слів.
Биология
5 минут назад
Вибрати кілька правильних відповідей 8. Вкажіть рослини, у яких утворюються супліддя: А) шовковиця; Б) малина; В) ананас; Г) слива.Математика
5 минут назад
Розв’яжи систему рівнянь: k J -0,1k = 12 k+m = -4. Даю 19балов!!!!!!География
5 минут назад
скласти доповідь на тему вплив людини на кліматМатематика
5 минут назад
8. Контрольное списывание. Раздели текст на предложения.
Спиши, вставляя пропущенные буквы. Расставь знаки пре-
пинания.
заяц
Чудесное спасение
В…сной р…ка разлилась за…ц попал в б…ду он
сидел на мален…ком острове и др…жал в…да уже
подбиралась к его лапкам Марат и Саят сп… сли зай-
ца ребята принесли его в избушку л…сникаcuuuuuuuuu
Контрольное списывание. Раздели текст на предложения.
Спиши, вставляя пропущенные буквы. Расставь знаки пре-
пинания.
заяц
Чудесное спасение
В…сной р…ка разлилась за…ц попал в б…ду он
сидел на мален…ком острове и др…жал в…да уже
подбиралась к его лапкам Марат и Саят сп… сли зай-
ца ребята принесли его в избушку л…сникаcuuuuuuuuuМатематика
5 минут назад
Розвяжіть рівняння 4(x-1)-3(1+x)=12 СРОЧНО
Все предметы
Выберите язык и регион
English
United States
Polska
Português
Brasil
English
India
Türkçe
Türkiye
English
Philippines
Español
España
Bahasa Indonesia
Indonesia
Русский
Россия
How much to ban the user?
1 hour 1 day 100 years
V.
 Какие реакции протекают на поверхности кадмия в процессе коррозии следующих гальванических пар:
Какие реакции протекают на поверхности кадмия в процессе коррозии следующих гальванических пар:1 | А) O2 + 2H2O + 4ē = 4OH– | Б) Cd – 2ē = Cd2+ | |
2 | А) O2 + 2H2O + 4ē = 4OH– | Б) Cd – 2ē = Cd2+ | В) 2H+ + 2ē = H2 |
3 | А) Cd – 2ē = Cd2+ | Б) O2 + 2H2O + 4ē = 4OH– | В) 2Н+ + 2ē = Н2 |
4 | А) Cd2+ + 2ē = Cd | Б) 2Н+ + 2ē = Н2 | В) 2Н+ + 2ē = Н |
5 | А) O2 + 2H2O + 4ē = 4OH– | Б) 2Н+ + 2ē = Н2 | В) Cd – 2ē = Cd2+ |
Вариант 11
I.
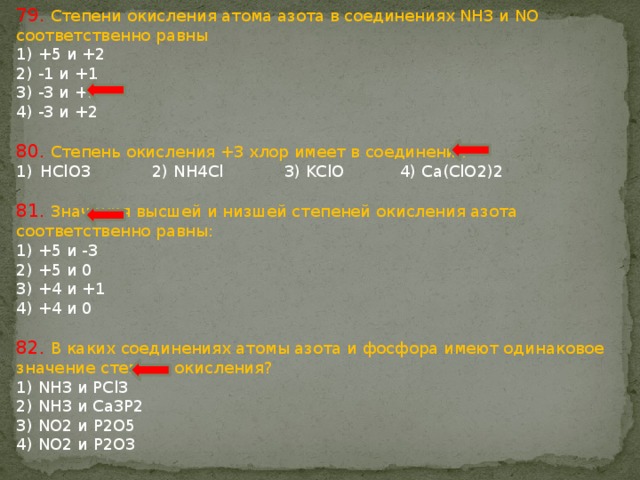
 Рассчитайте степень окисления углерода в соединениях: нсоон, coCl2, CaC2o4, CaC2, (nh5)2co3 и укажите правильный ответ.
Рассчитайте степень окисления углерода в соединениях: нсоон, coCl2, CaC2o4, CaC2, (nh5)2co3 и укажите правильный ответ.1) +2, +4, +4, +1, +5; 2) +2, +4, +3, –1, +4; 3) +3, +2, +2, –1, +6;
4) +4, +2, +4, +2, +4; 5) +4, +3, +3, +1, +6.
II. Используя метод ионно-электронного баланса, расставьте коэффициенты в уравнении реакции
H2S + K2Cr2O7 + H2SO4 S + Cr2(SO4)3 + K2SO4 + H2O.
III.
Вычислите потенциал хромового электрода
в растворе, содержа-щем 0,001 моль/дм3CrCl3.
1) –0,92 B; 2) –0,68 В; 3) –0,74 В; 4) –0,56 В; 5) –0,80 В.
IV. При пропускании тока через последовательно соединенные электролизеры с растворами солей CuCl2 и Na2SO4 на аноде второго выделилось 5,6 дм3 газа (нормальные условия). Чему равна масса вещества, выделившегося на катоде первого электролизера?
1) 64 г; 2) 1 г; 3) 16 г; 4) 2 г; 5) 32 г.
V. Какие реакции протекают на поверхности металла, находящегося в паре с железом, в процессе коррозии следующих гальванических пар:
А) Zn – Fe при pH=7; Б) Cu – Fe при pH=9; В) Al – Fe при pH=5?
1 | А) 2Н+ + 2ē = Н2 | Б) Cu – 2ē = Cu2+ | В) 2H+ + 2ē = H2 |
2 | А) Zn – 2ē = Zn2+ | Б) O2 + 2H2O + 4ē = 4OH– | В) Al – 3ē = Al3+ |
3 | А) O2 + 2H2O + 4ē = 4OH– | Б) Cu – 2ē = Cu2+ | В) 2Н+ + 2ē = Н2 |
4 | А) Zn – 2ē = Zn2+ | Б) 2H+ + 2ē = H2 | В) Al – 3ē = Al3+ |
5 | А) Zn2+ + 2ē = Zn | Б) Cu – 2ē = Cu2+ | В) Al3+ + 3ē = Al |
Серия неорганических источников твердого азота для синтеза кластерных фуллеренов нитридов металлов: зависимость выхода продукции от степени окисления азота и противоиона
. 2013 1 апреля; 52 (7): 3814-22.
2013 1 апреля; 52 (7): 3814-22.
дои: 10.1021/ic302436k. Epub 2013 12 марта.
Фупин Лю 1 , Цзянь Гуань, Тао Вэй, Сун Ван, Минчжи Цзяо, Шанфэн Ян
Принадлежности
принадлежность
- 1 Хэфэй Национальная лаборатория физических наук в микромасштабе и Департамент материаловедения и инженерии Китайского университета науки и технологий, Хэфэй 230026, Китай.
- PMID: 23480680
- DOI: 10.1021/ic302436k
Фупин Лю и др.
Неорг хим. .
.
. 2013 1 апреля; 52 (7): 3814-22.
дои: 10.1021/ic302436k. Epub 2013 12 марта.
Авторы
Фупин Лю 1 , Цзянь Гуань, Тао Вэй, Сун Ван, Минчжи Цзяо, Шанфэн Ян
принадлежность
- 1 Хэфэй Национальная лаборатория физических наук в микромасштабе и Департамент материаловедения и инженерии Китайского университета науки и технологий, Хэфэй 230026, Китай.
- PMID: 23480680
- DOI:
10.
 1021/ic302436k
1021/ic302436k
Абстрактный
Ряд азотсодержащих неорганических твердых соединений с различными степенями окисления азота и противоионов был успешно применен в качестве новых неорганических источников твердого азота для синтеза кластерных фуллеренов нитридов металлов на основе Sc (Sc-NCF), включая соли аммония [(Nh5 )xH(3-x)PO4 (x = 0-2), (Nh5)2SO4, (Nh5)2CO3, Nh5X (X = F, Cl), Nh5SCN], тиоцианат (KSCN), нитраты (Cu(NO3)2 , NaNO3) и нитрит (NaNO2). Среди них фосфаты аммония ((Nh5)xH(3-x)PO4, x = 1-3) и тиоцианат аммония (Nh5SCN) проявляют себя как лучшие источники азота, чем другие, и достигается наибольший выход Sc-NCF. при использовании Nh5SCN в качестве источника азота. Определено оптимальное молярное соотношение Sc2O3:(Nh5)3PO4·3h3O:C и Sc2O3:Nh5SCN:C 1:2:15 и 1:3:15 соответственно. Продукты термического разложения этих 12 неорганических соединений были обсуждены, чтобы понять их различные характеристики в отношении синтеза Sc-NCF, и, соответственно, интерпретирована зависимость выхода продукции Sc-NCF от степени окисления азота и противоиона. . Выход Sc3N@C80 (I(h) + D(5h)) на грамм Sc2O3 при использовании группы источников азота на основе N2 (тиоцианат, нитраты и нитрит) в целом намного ниже, чем при использовании газообразных N2 и Nh5SCN. , что указывает на сильную зависимость выхода Sc-NCF от степени окисления азота, что связано с окислительно-восстановительной реакцией «in-situ», происходящей для группы источников азота на основе N2 во время разряда. Было обнаружено, что для группы источников азота на основе Nh4 (соли аммония), которые проявляют степени окисления азота (-3), их эффективность в качестве источников азота чувствительно зависит от аниона, и это можно понять, учитывая их различие в термической стабильность и/или скорость разложения. Напротив, для группы источников азота на основе N2 образование Sc-NCF не зависит как от степени окисления азота (+3 или +5), так и от катиона.
. Выход Sc3N@C80 (I(h) + D(5h)) на грамм Sc2O3 при использовании группы источников азота на основе N2 (тиоцианат, нитраты и нитрит) в целом намного ниже, чем при использовании газообразных N2 и Nh5SCN. , что указывает на сильную зависимость выхода Sc-NCF от степени окисления азота, что связано с окислительно-восстановительной реакцией «in-situ», происходящей для группы источников азота на основе N2 во время разряда. Было обнаружено, что для группы источников азота на основе Nh4 (соли аммония), которые проявляют степени окисления азота (-3), их эффективность в качестве источников азота чувствительно зависит от аниона, и это можно понять, учитывая их различие в термической стабильность и/или скорость разложения. Напротив, для группы источников азота на основе N2 образование Sc-NCF не зависит как от степени окисления азота (+3 или +5), так и от катиона.
Похожие статьи
Мочевина как новый и дешевый источник азота для синтеза кластерных фуллеренов нитридов металлов: роль продуктов разложения в селективности образования фуллеренов.

Цзяо М., Чжан В., Сюй Ю., Вэй Т., Чен С., Лю Ф., Ян С. Цзяо М. и др. Химия. 2012 27 февраля; 18 (9): 2666-73. doi: 10.1002/chem.201101040. Epub 2012 24 января. Химия. 2012. PMID: 22275191
Простой путь к кластерным фуллеренам из нитридов металлов с использованием солей гуанидиния: селективное органическое твердое вещество в качестве источника азота.
Ян С., Чжан Л., Чжан В., Данш Л. Ян С. и др. Химия. 2010 2 ноября; 16 (41): 12398-405. doi: 10.1002/chem.201001252. Химия. 2010. PMID: 20859965
Новые трифторметилированные производные кластерных фуллеренов нитридов металлов: Sc3N@I(h)-C₈₀ (CF3)₁₄ и Sc3N@D(5h)-C₈₀ (CF3)₁₆.
Вэй Т., Тамм Н.
 Б., Ян С., Троянов С.И.
Вэй Т и др.
Chem Asian J. 2014 Sep;9(9):2449-52. doi: 10.1002/asia.201402573. Epub 2014 8 июля.
Химический Азиат Дж. 2014.
PMID: 25044462
Б., Ян С., Троянов С.И.
Вэй Т и др.
Chem Asian J. 2014 Sep;9(9):2449-52. doi: 10.1002/asia.201402573. Epub 2014 8 июля.
Химический Азиат Дж. 2014.
PMID: 25044462Кластерные фуллерены нитридов металлов: их современное состояние и перспективы.
Данш Л., Ян С. Данш Л. и соавт. Маленький. 2007 авг.; 3(8):1298-320. doi: 10.1002/smll.200700036. Маленький. 2007. PMID: 17657757 Обзор.
Экологические и токсикологические последствия загрязнения неорганическим азотом водных экосистем: глобальная оценка.
Камарго Х.А., Алонсо А. Камарго Дж.А. и соавт. Окружающая среда Интерн. 2006 авг; 32 (6): 831-49. doi: 10.1016/j.envint.2006.
 05.002. Epub 2006 16 июня.
Окружающая среда Интерн. 2006.
PMID: 16781774
Обзор.
05.002. Epub 2006 16 июня.
Окружающая среда Интерн. 2006.
PMID: 16781774
Обзор.
Посмотреть все похожие статьи
Цитируется
Селективный дуговой синтез Dy 2 S-кластерфуллеренов и их изомер-зависимый магнетизм одиночных молекул.
Чен Ч., Крылов Д.С., Авдошенко С.М., Лю Ф., Шпрее Л., Ядав Р., Альвертис А., Хозой Л., Ненков К., Костанян А., Гребер Т., Вольтер А.У.Б., Попов А.А. Чен Ч. и соавт. хим. наук. 2017 сен 1;8(9)):6451-6465. DOI: 10.1039/C7SC02395B. Epub 2017 30 июня. хим. наук. 2017. PMID: 29263779 Бесплатная статья ЧВК.
Sc3CH@C80: селективное обогащение (13)C центрального атома углерода.
Юнгханс К.
 , Розенкранц М., Попов А.А.
Юнгханс К. и др.
Химическая коммуна (Кэмб). 2016 5 мая; 52 (39): 6561-4. дои: 10.1039/c5cc10025a.
Химическая коммуна (Кэмб). 2016.
PMID: 27109443
Бесплатная статья ЧВК.
, Розенкранц М., Попов А.А.
Юнгханс К. и др.
Химическая коммуна (Кэмб). 2016 5 мая; 52 (39): 6561-4. дои: 10.1039/c5cc10025a.
Химическая коммуна (Кэмб). 2016.
PMID: 27109443
Бесплатная статья ЧВК.
What, How to Balance & FAQs —
By Seemi Siddiqui
Карбонат аммония представляет собой бесцветное порошкообразное соединение с запахом аммиака. Хлороводород — бесцветный раствор с резким запахом. Рассмотрим детально реакцию между ними.
(NH 4 ) 2 CO 3 состоят из ионов аммония и карбоната, также известных как аммиак Бейкера, и горючи по своей природе. HCl очень кислая, и ее также называют соляной кислотой.
Мы обсудим некоторые характеристики этой реакции соляной кислоты и карбоната аммония, такие как межмолекулярные силы, уравнение баланса, окислительно-восстановительная реакция и продукт, образующийся во время реакции.
Реакция HCl + (NH 4 ) 2 CO 3 дает хлорид аммония (NH 4 Cl), диоксид углерода (CO 2 ) и молекула воды в качестве продуктов.
(NH 4 ) 2 CO 3 + 2HCL → 2NH 4 CL + CO 2 + H 2 O
3333. What of HA OS 90233333333333333333333333333333333333333333333333333333 гг. 4 ) 2 CO 3 ?Реакция HCl + (NH 4 ) 2 CO 3 представляет собой реакцию двойного замещения.
Реакция двойного вытеснения Как сбалансировать HCl + (NH 4 ) 2 CO 3 Реакция HCl + (NH 4 ) 2 CO 3 уравновешивается методом проб и ошибок. Ниже приведены шаги:
Ниже приведены шаги:
- Запишите количество присутствующих родинок, как показано .
- Ионы водорода, кислорода и аммония не равны с обеих сторон, они уравновешиваются путем умножения 2 на HCl и хлорид аммония.
| Elements | R.H.S | L.H.S |
|---|---|---|
| Hydrogen | 1 | 2 |
| Oxygen | 3 | 3 |
| Ammonium ion | 2 | 1 |
| Хлорид | 1 | 1 |
- 0019
- (NH 4 ) 2 CO 3 + 2HCl → 2NH 4 Cl + CO 2 + H 2 O
HCl + (NH 4 ) 2 CO 3 титрование сильной кислотой по сравнению со слабым основанием.
Прибор
Бюретка, пипетка, коническая колба, круглодонная колба, подставка для бюретки.
ИндикаторВ качестве индикатора используется фенолфталеин.
Процедура- Наполнить бюретку стандартизированным раствором соляной кислоты и карбонатом аммония в конической колбе с последующим добавлением индикатора фенолфталеина.
- При титровании соляной кислотой окраска раствора в колбе исчезнет.
- Эта точка смены цвета является конечной точкой.
- Тогда объем NH 4 Cl находится по формуле V 1 S 1 =V 2 S 2 .
Ионическое уравнение .
 2 CO 3 получается с помощью следующих шагов.
2 CO 3 получается с помощью следующих шагов. (водн.) 2 O(l)
- Напишите сбалансированное молекулярное уравнение.
- (NH 4 ) 2 CO 3 + 2HCl → 2NH 4 Cl + CO 2 + H 2 O
- Write the states for each substance .
- (NH 4 ) 2 CO 3 (т) + 2HCl(водн.) → 2NH 4 Cl(т) + CO 2 (г) )
- Сильные электролиты, которые уже распались на ионы, далее пересекаются как ионы-спектаторы, присутствующие по обе стороны полного ионного уравнения.
- 2H + (водн.) + 2Cl – (водн.) + 2NH 4+ (водн.) + CO 3 08-0007 4+ (водн.) + 2Cl – (водн.
 )+ CO 2 (г) + H 2 O(ж)
)+ CO 2 (г) + H 2 O(ж)
- После этого результирующее ионное уравнение записывается с остальными ионами .
- 2H + (aq) + 2nh 4+ (aq) + co 3 2- (aq) = 2nh 4+ (aq) + co 2 (g). ) + H 2 O(l)
Пары конъюгатов для HCl + (NH 4 ) 2 CO 3 —
- Cl — — это соединение CL — — это соединение Cl — — это соединение Cl — — Cl — 9008- CL — 9008- Cl — 9008 .
 после отдавая протон .
после отдавая протон .
- Карбонат аммония представляет собой сопряженную кислотно-основную пару, где кислота представляет собой NH 4 OH, а основание представляет собой H 2 CO 3 . Сопряженные пары кислоты и основания образуются после его ионизации, как показано ниже.
- (NH 4 ) 2 CO 3 (s) = NH 4+ (aq) + HCO 3 – (aq)
The intermolecular forces between HCl and (NH 4 ) 2 CO 3 are-
- Dipole-dipole and London dispersion силы, присутствующие в HCl.
- Карбонат аммония содержит все типы связей, т. е. ионные, ковалентные, а также координационные связи.

Энтальпия реакции для HCL + (NH 4 ) 2 0410301010101010101010101010101010 100403. реакция между хлористым водородом и карбонатом аммония является равновесной реакцией.
Is HCl + (NH 4 ) 2 CO 3 буферный растворHCl + (NH 4 ) 2 CO 3 не может полностью диссоциировать в сильнокислом буферном растворе, т.к.
IS HCL + (NH 4 ) 2 CO 3 Полная реакцияHCL + (NH 4 ) 2 CO 3 . Здесь равные моли (NH 4 ) 2 CO 3 (слабое основание) и HCl (сильная кислота) полностью нейтрализуют друг друга и образуют ион аммония NH 4+ .
IS Hcl + (NH 4 ) 2 CO 3 Экзотермическая или эндотермическая реакция
HCL + (NH 4 ) 2 11044110441044104410441041104. высвобождается в ходе реакции.
Is HCl + (NH 4 ) 2 CO 3 окислительно-восстановительная реакцияHCl + (NH 4 ) 2 CO 3 не является окислительно-восстановительной реакцией. Здесь степени окисления нескольких атомов не изменились в ходе реакции.
IS HCl + (NH 4 ) 2 CO 3 Реакция осажденияHCL + (NH 4 ) 2 CO 3 3 3 3 3 3 . образуется в этой реакции.
IS HCL + (NH 4 ) 2 CO 3 Обратимая или необратимая реакцияHCL + (NH 4 ) 2 9044 CO 3 3 3 3 3 3 3 3 .



 Контрольное списывание. Раздели текст на предложения.
Спиши, вставляя пропущенные буквы. Расставь знаки пре-
пинания.
заяц
Чудесное спасение
В…сной р…ка разлилась за…ц попал в б…ду он
сидел на мален…ком острове и др…жал в…да уже
подбиралась к его лапкам Марат и Саят сп… сли зай-
ца ребята принесли его в избушку л…сникаcuuuuuuuuu
Контрольное списывание. Раздели текст на предложения.
Спиши, вставляя пропущенные буквы. Расставь знаки пре-
пинания.
заяц
Чудесное спасение
В…сной р…ка разлилась за…ц попал в б…ду он
сидел на мален…ком острове и др…жал в…да уже
подбиралась к его лапкам Марат и Саят сп… сли зай-
ца ребята принесли его в избушку л…сникаcuuuuuuuuu 1021/ic302436k
1021/ic302436k
 Б., Ян С., Троянов С.И.
Вэй Т и др.
Chem Asian J. 2014 Sep;9(9):2449-52. doi: 10.1002/asia.201402573. Epub 2014 8 июля.
Химический Азиат Дж. 2014.
PMID: 25044462
Б., Ян С., Троянов С.И.
Вэй Т и др.
Chem Asian J. 2014 Sep;9(9):2449-52. doi: 10.1002/asia.201402573. Epub 2014 8 июля.
Химический Азиат Дж. 2014.
PMID: 25044462 05.002. Epub 2006 16 июня.
Окружающая среда Интерн. 2006.
PMID: 16781774
Обзор.
05.002. Epub 2006 16 июня.
Окружающая среда Интерн. 2006.
PMID: 16781774
Обзор. , Розенкранц М., Попов А.А.
Юнгханс К. и др.
Химическая коммуна (Кэмб). 2016 5 мая; 52 (39): 6561-4. дои: 10.1039/c5cc10025a.
Химическая коммуна (Кэмб). 2016.
PMID: 27109443
Бесплатная статья ЧВК.
, Розенкранц М., Попов А.А.
Юнгханс К. и др.
Химическая коммуна (Кэмб). 2016 5 мая; 52 (39): 6561-4. дои: 10.1039/c5cc10025a.
Химическая коммуна (Кэмб). 2016.
PMID: 27109443
Бесплатная статья ЧВК.
 2 CO 3 получается с помощью следующих шагов.
2 CO 3 получается с помощью следующих шагов.  )+ CO 2 (г) + H 2 O(ж)
)+ CO 2 (г) + H 2 O(ж)  после отдавая протон .
после отдавая протон . 


Leave A Comment