Контрольная работа №1 по химии 9 класс | Рабочая программа по химии (9 класс) на тему:
Контрольная работа №1
Электролитическая диссоциация
(Радецкий А.М. Дидактический материал по химии стр 42-43)
Вариант 1
- Напишите уравнения электролитической диссоциации:
А) хлорида калия
Б) серной кислоты
В) гидроксида кальция
Г) нитрата меди
Д) сульфата алюминия
- Напишите молеулярные и ионные уравнения реакций, протекающих при сливании растворов:
А) хлорида натрия и нитрата серебра
Б) азотной кислоты и гидроксида кальция
В) соляной кислоты и карбоната калия
- С какими из перечисленных веществ будет реагировать соляная кислота:
А) цинк
Б) оксид кальция
В) ртуть
Г) гидроксид меди (II)
Д) нитрат натрия
Напишите молекулярные и сокращенные ионные уравнения возможных реакций.
- К раствору, содержащему 32 г сульфата меди (II) прибавили 21 г железных опилок.
 Какая масса меди выделится при этом.
Какая масса меди выделится при этом.
Контрольная работа №1
Электролитическая диссоциация
(Радецкий А.М. Дидактический материал по химии стр 42-43)
Вариант 2
- Напишите уравнения электролитической диссоциации:
А) гидроксида натрия
Б) азотной кислоты
В) хлорида магния
Г) карбоната калия
Д) нитрата железа (III)
- Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов:
А) гидроксида калия и нитрата меди
Б) соляной кислоты и гидроксида бария
В) сульфата натрия и нитрата бария
- С какими из перечисленных веществ будет реагировать гидроксида кальция:
А) сульфат меди (II)
Б) хлорид бария
В) ртуть
Г) фосфат калия
Д) оксид углерода (IV)
Напишите молекулярные и сокращенные ионные уравнения возможных реакций.
- 5г оксида магния обработали раствором содержащим 40 г азотной кислоты.
 Какая масса соли образовалось при этом.
Какая масса соли образовалось при этом.
Контрольная работа №1
Электролитическая диссоциация
(Радецкий А.М. Дидактический материал по химии стр 42-43)
Вариант 3
- Напишите уравнения электролитической диссоциации:
А) фосфорной кислоты
Б) гидроксида бария
В) сульфата железа (II)
Г) хлорида алюминия
Д) нитрата меди (II)
- Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов:
А) хлорида железа (III) и гидроксида натрия
Б) серной кислоты и гидроксида лития
В) азотной кислоты и карбоната натрия
- С какими из перечисленных веществ будет реагировать разбавленная серная кислота:
А) алюминий
Б) нитрат натрия
В) золото
Г) гидроксид калия
Д) нитрат бария
Напишите молекулярные и сокращенные ионные уравнения возможных реакций.
- К раствору содержащему 20 г гидроксида натрия прилили раствор содержащий 33 г хлораводорода.
 Какая масса соли образовалось?
Какая масса соли образовалось?
Контрольная работа №1
Электролитическая диссоциация
(Радецкий А.М. Дидактический материал по химии стр 42-43)
Вариант 4
- Напишите уравнения электролитической диссоциации:
А) хлорида кальция
Б) гидроксида калия
В) соляной кислоты
Г) сульфата железа (III)
Д) фосфата натрия
- Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов:
А) сульффата меди (II) и хлорида бария
Б) бромоводородной кислоты и гидроксида кальция
В) сульфата цинка и фосфата калия
- С какими из перечисленных веществ будет реагировать раствор сульфата меди (II):
А) гидроксид натрия
Б) алюминий
В) ртуть
Г) фосфат натрия
Д) нитрат калия
Напишите молекулярные и сокращенные ионные уравнения возможных реакций.
- 6,5 г цинка поместили в раствор содержащий 20 г серной кислоты.
 Рассчитайте массу выделившегося водорода?
Рассчитайте массу выделившегося водорода?
Задания | Баллы |
1 | 0,5 |
2 | 1,5 |
3 | 1,5 |
4 | 1,5 |
Отметка | 2 | 3 | 4 | 5 |
Баллы | 0-2,4 | 2,5-3,4 | 3,5-4,4 | 4,5-5 |
Контрольная работа №2 «Электролитическая диссоциация»
1 вариант
Задание №1 Напишите уравнения электролитической диссоциации следующих веществ:
1. Гидроксид натрия
Гидроксид натрия
2. Азотная кислота
3. Хлорид магния
4. Карбонат калия
5. Нитрат железа (III)
Задание №2 Составьте молекулярные и полные ионные уравнения химических реакций:
1. Fe(OH)3 +3H1+ = Fe3+ +3H2O
2. NH41+ + OH1- = NH3 + H2O
3. CO32- +2H1+ = H2O + CO2
Задание №3 Расставьте коэффициенты в ОВР методом электронного баланса. Укажите окислитель и восстановитель:
KClO3 + Fe2O3 + KOH = K2FeO4 + KCl + H2O
Задание №4 Какие из перечисленных солей подвергаются гидролизу:
1. Нитрат калия
2. Сульфид натрия
3. Хлорид железа
Напишите уравнения гидролиза. Определите среду.
Задание №5 К 60г 10% раствора хлорида бария прилили избыток раствора сульфата цинка. Рассчитайте массу образовавшегося осадка.
Рассчитайте массу образовавшегося осадка.
Задание №5 (профиль)
Определите массу осадка, который образуется при сливании 15г 5% раствора хлорида бария и 10г 8% раствора сульфата натрия.
2 вариант
Задание №1 Напишите уравнения электролитической диссоциации следующих веществ:
1. Борная кислота
2. Гидроксид бария
3. Хлорид алюминия
4. Нитрат меди(II)
5. Сульфат железа(II)
Задание №2 Составьте молекулярные и полные ионные уравнения химических реакций:
1. СаО +2H1+ = Са2+ +H2O
2. Al3+ + 3OH1- = Al(OH)3
3. Cu2+ +S2- = CuS
Задание №3 Расставьте коэффициенты в ОВР методом электронного баланса. Укажите окислитель и восстановитель:
KNO2 + Na2S + H2SO4 = K2SO4 + NO + Na2SO4 + S + H2O
Задание №4 Какие из перечисленных солей подвергаются гидролизу:
1. Фосфат натрия
Фосфат натрия
2. Сульфат натрия
3. Хлорид алюминия
Напишите уравнения гидролиза. Определите среду.
Задание №5 К 80г 15% раствора хлорида меди(II) прилили избыток раствора гидроксида калия. Рассчитайте массу образовавшегося осадка.
Задание №5 (профиль):
Какой объем газа выделится, если к раствору, содержащему 53г карбоната натрия, прилить 400г 20% азотной кислоты.
[Решено] -Напишите сбалансированное уравнение для диссоциации каждого из ваших… ваши ионные соединения в воде. Включите физические состояния
— напишите сбалансированные химические уравнения для предполагаемой полной диссоциации каждой из ваших кислот I. Вода. на данный момент не обращайте внимания на ваши данные по электропроводности и предположите полную диссоциацию с водными кислотами в качестве реагента. включить физические состояния
Текст расшифровки изображения
Lab3 Электролиты PostLabReport. 161sp22scv2
+
2
3 1 1
5
6
Вставьте сюда сводную таблицу.
Сложный
проводимость
Тип
Количество
Родственник
(нас/см)
Сложный
Частицы
проводимость
Накл
6578
ионический
Na*+Cl-=2
Сильный
HaPO4
7084
Кислота
3Н*+РО=4
Сильный
HC2h402
401
Кислота
С2h402+Н*=2
Слабый
Н,БО3
7
Кислота
В(ОН),+Н*=2
Слабый
C2.H602
2
молекулярный
Не электролит
CaClz
12 554
ионический
Са2*+КИ=3
Сильный
CHJOH
молекулярный
Не электролит
ХКИ
21 340
Кислота
Н*+КИ=2
Сильный
AlCl3
16 340
ионический
А13+ + 3CI=4
Сильный
h3O (Нажмите)
110
молекулярный
Н*+ОН=2
Слабый
h3O (ДИ)
3
молекулярный
Неэлектролит…
161sp22scv2
+
2
3 1 1
5
6
Вставьте сюда сводную таблицу.
Сложный
проводимость
Тип
Количество
Родственник
(нас/см)
Сложный
Частицы
проводимость
Накл
6578
ионический
Na*+Cl-=2
Сильный
HaPO4
7084
Кислота
3Н*+РО=4
Сильный
HC2h402
401
Кислота
С2h402+Н*=2
Слабый
Н,БО3
7
Кислота
В(ОН),+Н*=2
Слабый
C2.H602
2
молекулярный
Не электролит
CaClz
12 554
ионический
Са2*+КИ=3
Сильный
CHJOH
молекулярный
Не электролит
ХКИ
21 340
Кислота
Н*+КИ=2
Сильный
AlCl3
16 340
ионический
А13+ + 3CI=4
Сильный
h3O (Нажмите)
110
молекулярный
Н*+ОН=2
Слабый
h3O (ДИ)
3
молекулярный
Неэлектролит…
SCIENCECHEMISTRYCHEM 161
Ответ и объяснение
Решено проверенным экспертомОтветил SargentCrownDragon33
sectetur adipiscing e
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ipsum dolor sit amet, consectetur adipiscing elРазблокируйте полный доступ к Course Hero
Изучите более 16 миллионов пошаговых ответов из нашей библиотеки
Подпишитесь, чтобы просмотреть ответПошаговое объяснение
sectetur adipiscing elit. Nam lacinia pulvinar tortor
Nam lacinia pulvinar tortor
sectesecsectetur adipiscing el
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet
sectetsecsectetur adipiscing eli
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapib
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ipsum dolor sit
sectetsecsectetur adipiscing eli
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ip
Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ip
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molesti
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus a
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque
sectetur adipiscing elit. Nam lacinia pulvinar to
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque da
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae
sectetur adipiscing elit. Nam lacinia pulvinar tort
Nam lacinia pulvinar tort
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Nam lacinia pulvi
sectetur adipiscing elit. Nam lacini
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac,
sectetur adipiscing elit.
sectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ipsum dolor sit amet, consectetur adipisci
Кислотно-щелочная реакция | Определение, примеры, формулы и факты
сульфат натрия
См. все материалы
- Связанные темы:
- буфер кислотно-щелочной катализ ион водорода кислотно-щелочное равновесие нейтрализация
Просмотреть весь связанный контент →
Популярные вопросы
Что такое кислоты и основания?
Кислоты представляют собой вещества, содержащие один или несколько атомов водорода, которые в растворе выделяются в виде положительно заряженных ионов водорода. Кислота в водном растворе имеет кислый вкус, изменяет цвет синей лакмусовой бумажки на красный, реагирует с некоторыми металлами (например, железом) с выделением водорода, реагирует с основаниями с образованием солей и способствует некоторым химическим реакциям (кислотный катализ).
химическая реакция
Узнайте больше о химических реакциях.Как измеряют кислоты и основания?
Кислотам и основаниям присваивается значение от 0 до 14, значение pH, в соответствии с их относительной силой. Чистая вода, которая является нейтральной, имеет рН 7. Раствор с рН менее 7 считается кислым, а раствор с рН более 7 считается щелочным или щелочным. Сильные кислоты имеют более высокую концентрацию ионов водорода, и им присваиваются значения ближе к 0. И наоборот, сильные основания имеют более высокие концентрации гидроксид-ионов, и им присваиваются значения ближе к 14. Более слабые кислоты и основания ближе к значению рН 7, чем их более сильные аналоги.
pH
Узнайте больше о pH.Что происходит при кислотно-щелочной реакции?
 Он также включает аналогичные процессы, которые происходят в молекулах и ионах, которые являются кислыми, но не отдают ионы водорода.
Он также включает аналогичные процессы, которые происходят в молекулах и ионах, которые являются кислыми, но не отдают ионы водорода.Как кислоты и основания нейтрализуют друг друга (или компенсируют друг друга)?
Различные реакции дают разные результаты. Реакции между сильными кислотами и сильными основаниями более полно распадаются на ионы водорода (протоны, положительно заряженные ионы) и анионы (отрицательно заряженные ионы) в воде. Для слабой кислоты и слабого основания более уместно считать, что нейтрализация включает прямой перенос протона от кислоты к основанию. Если один из реагентов присутствует в большом избытке, в результате реакции может образоваться соль (или ее раствор), которая может быть кислой, основной или нейтральной в зависимости от силы кислот и оснований, реагирующих друг с другом.
соль
Узнайте больше о солях в кислотно-щелочной химии. кислота, CH 3 CO 2 H) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH − ; или карбонат, CO 3 900 75 2− ). Он также включает аналогичное поведение молекул и ионов, которые являются кислыми, но не отдают ионы водорода (хлорид алюминия, AlCl
кислота, CH 3 CO 2 H) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH − ; или карбонат, CO 3 900 75 2− ). Он также включает аналогичное поведение молекул и ионов, которые являются кислыми, но не отдают ионы водорода (хлорид алюминия, AlCl Кислоты представляют собой химические соединения, которые в водном растворе проявляют резкий вкус, коррозионное действие на металлы и способность окрашивать некоторые синие растительные красители в красный цвет. Основания представляют собой химические соединения, которые в растворе становятся мыльными на ощупь и окрашивают красные растительные красители в синий цвет. При смешивании кислоты и основания нейтрализуют друг друга и образуют соли, вещества с соленым вкусом и не имеющие характерных свойств ни кислот, ни оснований.
Идея о том, что некоторые вещества являются кислотами, тогда как другие являются основаниями, почти так же стара, как химия, и термины  Кислоты были, вероятно, первыми из них, которые были обнаружены, по-видимому, из-за их кислого вкуса. Английское слово acid , французское acide , немецкое Säure и русское kislota происходят от слов, означающих кислый (лат. 9).0127 acidus , немецкий sauer , древнескандинавский sūur и русский kisly ). Другими свойствами, связанными с кислотами на раннем этапе, были их растворяющее или коррозионное действие; их влияние на растительные красители; и вскипание, возникающее при нанесении их на мел (образование пузырьков углекислого газа). Основания (или щелочи) характеризовались, главным образом, способностью нейтрализовать кислоты и образовывать соли, причем последние довольно условно характеризовались как кристаллические вещества, растворимые в воде и имеющие солоноватый вкус.
Кислоты были, вероятно, первыми из них, которые были обнаружены, по-видимому, из-за их кислого вкуса. Английское слово acid , французское acide , немецкое Säure и русское kislota происходят от слов, означающих кислый (лат. 9).0127 acidus , немецкий sauer , древнескандинавский sūur и русский kisly ). Другими свойствами, связанными с кислотами на раннем этапе, были их растворяющее или коррозионное действие; их влияние на растительные красители; и вскипание, возникающее при нанесении их на мел (образование пузырьков углекислого газа). Основания (или щелочи) характеризовались, главным образом, способностью нейтрализовать кислоты и образовывать соли, причем последние довольно условно характеризовались как кристаллические вещества, растворимые в воде и имеющие солоноватый вкус.
Несмотря на их неточный характер, эти идеи служили для корреляции значительного диапазона качественных наблюдений, и многие из наиболее распространенных химических веществ, с которыми столкнулись ранние химики, могли быть классифицированы как кислоты (соляная, серная, азотная и угольная кислоты), основания (сода, калий, известь, аммиак) или соли (поваренная, нашатырная, селитра, квасцы, бура).


 Какая масса меди выделится при этом.
Какая масса меди выделится при этом.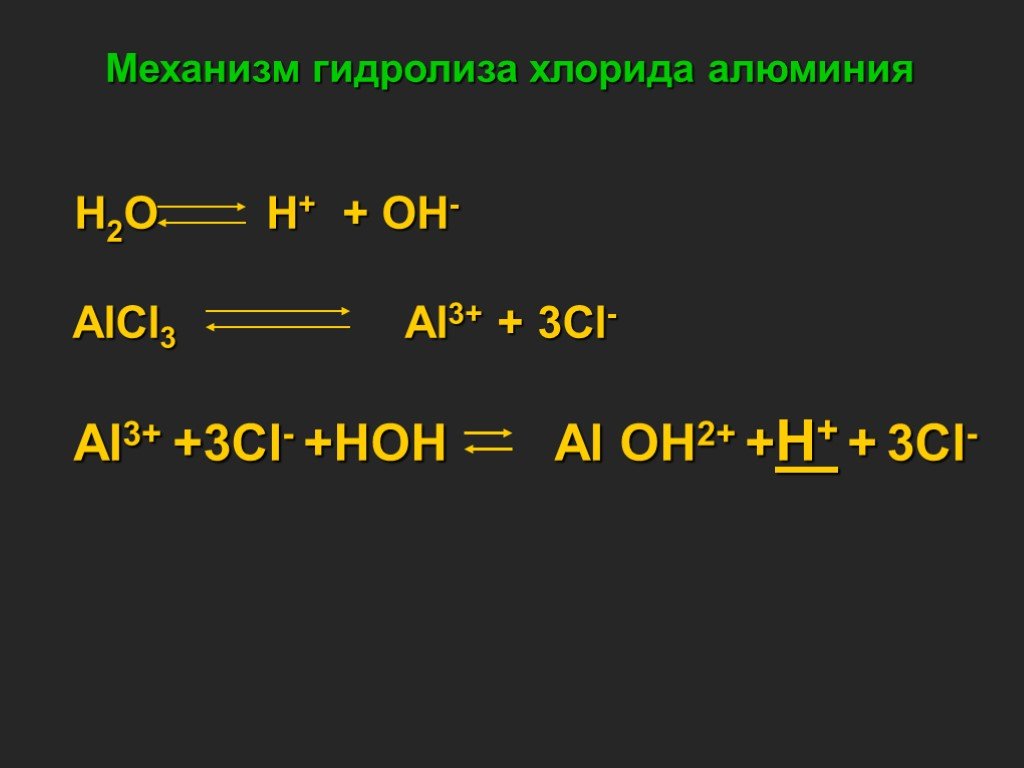 Какая масса соли образовалось при этом.
Какая масса соли образовалось при этом.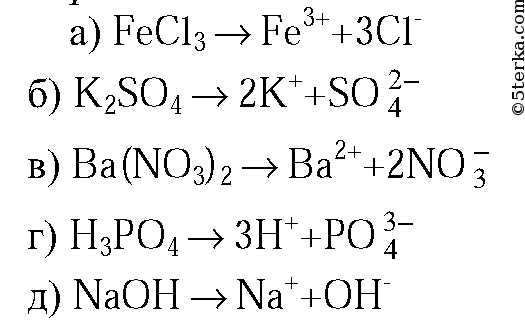 Какая масса соли образовалось?
Какая масса соли образовалось?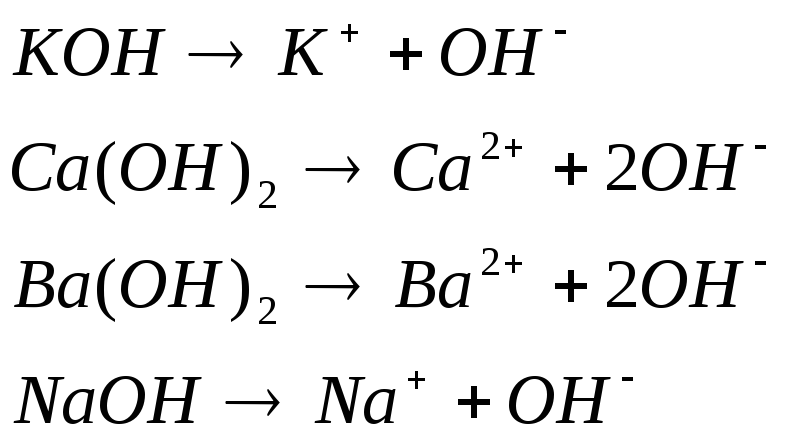 Рассчитайте массу выделившегося водорода?
Рассчитайте массу выделившегося водорода?
Leave A Comment