Теория электролитической диссоциации (ТЭД) — что это такое? Основные положения и примеры
Поможем понять и полюбить химию
Начать учиться
Раствор хлорида натрия хорошо проводит электрический ток, но в сухом виде кристаллики поваренной соли ток не проводят. Почему? На этот вопрос отвечает теория электролитической диссоциации, которую мы сейчас рассмотрим. Впервые ее описал шведский ученый Сванте Аррениус. Электролитическую диссоциацию изучают в рамках курса химии за 9 класс.
Что такое электролитическая диссоциация
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).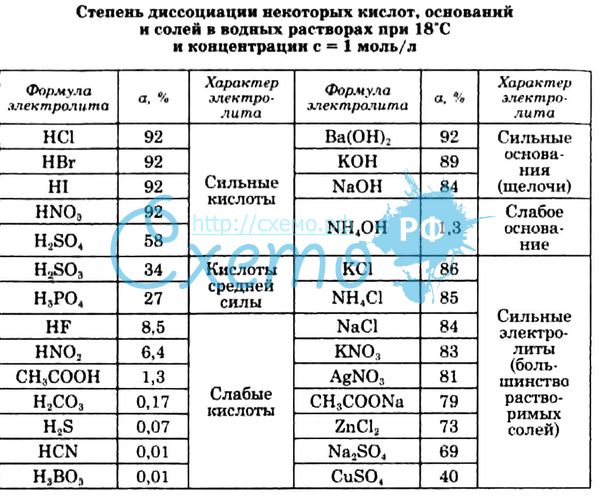
Схема электролитической диссоциации: KA ⇄ K+ (катион) + A— (анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na+ + Cl—.
Говорите правильно 🤓
Иногда можно встретить выражение «теория электрической диссоциации», но так говорить не стоит. В этом случае можно подумать, что распад молекул на ионы обусловлен действием электротока. На самом деле процесс диссоциации не зависит от того, проходит ток в данный момент через раствор или нет. Все, что нужно — это контакт электролита с водой (растворителем).
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Механизм электролитической диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na+ и анионами хлора Cl—, которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором. Вещество диссоциирует на ионы.
После распада хлорида натрия образовавшиеся ионы Na+ и Cl— окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
Электролиты и неэлектролиты
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
или .
Если в растворе на ионы распадаются все 100% электролита, .
По силе электролиты делятся на следующие группы:
слабые — ;
средние — ;
сильные — .
Важно!
Молекулы сильных электролитов необратимо распадаются на ионы, поэтому в уравнениях нужно ставить знак =.
Ступенчатая диссоциация
В отдельных случаях вещества расщепляются на ионы в несколько этапов или ступеней. Например, такая реакция характерна для основных и кислых солей, многоосновных кислот. Ступенчатая диссоциация может включать два этапа и более, при этом на первой ступени концентрация ионов всегда больше, чем на последующих.
Пример 1
Ортофосфорная кислота диссоциирует в 3 ступени. На первой из них наблюдается максимальная концентрация дигидрофосфат-ионов, а на последней остается минимальное количество фосфат-ионов (диссоциация почти не идет). Данная кислота не относится к сильным электролитам, поэтому реакция обратима.
H3PO4 ⇄ H+ + H2PO4—
H2PO4— ⇄ H+ + HPO42-
HPO42- ⇄ H+ + PO43-
Суммарное уравнение: H3PO4 ⇄ 3H+ + PO43-.
Пример 2
Кислая соль Ca(HCO3)2 диссоциирует в 3 ступени. Поскольку это сильный электролит, на первом этапе реакция необратима. На втором этапе распадается на ионы слабый кислотный остаток HCO3— и слабый электролит, поэтому реакция обратима.
Ca(HCO3)2 = Ca2+ + 2HCO3—
HCO3— ⇄ H+ + CO32-
Суммарное уравнение: Ca(HCO3)2 + 2H2O = Ca2+ + 2H3O+ + 2CO32-.
Как диссоциируют разные группы веществ
Диссоциация кислот
Приводит к образованию катионов водорода H+ и отрицательно заряженных кислотных остатков:
HCl = H+ + Cl—
H2SO4 = 2H+ + SO42-
HNO2 ⇄ H+ + NO2-
AlOHCl2 = AlOH2+ + 2Cl—
AlOH2+ ⇄ Al3+ + OH—
Диссоциация оснований
Происходит с образованием гидроксильных групп OH— и положительно заряженных ионов металла.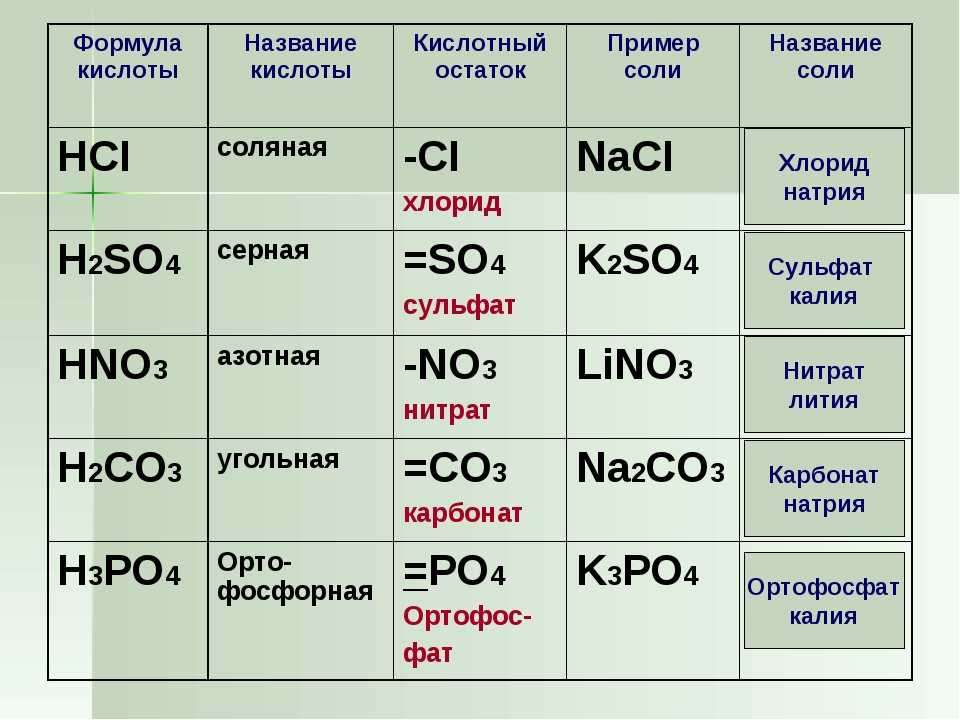 Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо.
Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо.
Сильные основания:
NaOH = Na+ + OH—
Слабые основания:
Cu(ON)2 ⇄ CuOH+ + OH—
CuOH+ ⇄ Cu2+ + OH—
Диссоциация солей
Ведет к образованию катионов металлов (или катиона аммония) и отрицательно заряженных кислотных остатков.
Средние соли в растворах полностью распадаются в одну ступень.
Na3PO4 = 3Na + PO43-
Кислые соли распадаются ступенчато. На первом этапе отделяются катионы металла, а на втором — катионы водорода.
KHSO4 = K+ + HSO4—
HSO4— ⇄ H
Основные соли также диссоциируют в две ступени. На первой отделяются кислотные остатки, а за ними — гидроксильные группы OH—.
MgOHBr = MgOH+ + Br—
MgOH+ ⇄ Mg2+ + OH—
Молекулярное, полное и сокращенное ионные уравнения
С помощью молекулярных уравнений можно показать состав вещества с разложением его на молекулы. Полные ионные уравнения отражают реакцию диссоциации, т. е. расщепление молекул на ионы. Но в таком виде расписывают только сильные электролиты.
Не раскладывают на ионы:
слабые электролиты;
осадки;
газы.

Рассмотрим это на примере взаимодействия между нитратом свинца и серной кислотой.
Молекулярное уравнение: Pb(NO3)2 + H2SO4
Сульфат свинца PbSO4 мы не будем раскладывать на ионы, поскольку это слабый электролит.
Полное ионное уравнение: Pb2+ + 2NO3— + 2H+ + SO42- → 2H+ + 2NO3— + PbSO4↓
Сократить это выражение очень просто — нужно убрать из обеих частей одинаковые ионы, которые не изменились в ходе реакции.
Сокращенное ионное уравнение: Pb2+ + SO42- → PbSO4↓
Как составить уравнение диссоциации
В левой части пишем молекулярную формулу вещества, а в правой — формулы образовавшихся катионов и анионов.
Основные положения теории электролитической диссоциации
Итак, мы разобрались, что такое диссоциация в химии, а сейчас повторим ключевые моменты:
При взаимодействии с водой или другими растворителями в электролитах разрывается химическая связь между частицами и они распадаются на ионы — происходит электролитическая диссоциация.
Под действием электротока катионы перемещаются к положительно заряженному электроду, анионы — к отрицательно заряженному. Раствор электролита обладает проводимостью.
Степень диссоциации зависит от типа электролита и от внешних условий. Для сильных электролитов она необратима, для слабых — это обратимая реакция.

Химические свойства электролитов соответствуют свойствам ионов, которые образовались при диссоциации.
Вопросы для самопроверки
Чем электролиты отличаются от неэлектролитов? Приведите примеры тех и других веществ.
Согласно теории диссоциации что является причиной распада электролитов на ионы?
Что такое степень диссоциации и как она измеряется?
В каких случаях электролитическая диссоциация кислот бывает ступенчатой?
При каких условиях в уравнении диссоциации ставится знак =, а при каких — знак ⇄?
Какие компоненты ионного уравнения не раскладываются на ионы?
Яна Кононенко
К предыдущей статье
Ионная связь
К следующей статье
Азот
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
404 Cтраница не найдена
Мы используем файлы cookies для улучшения работы сайта МГТУ и большего удобства его использования. Более подробную информацию об использовании файлов cookies можно найти здесь.
Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Более подробную информацию об использовании файлов cookies можно найти здесь.
Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
7.
 5: Водные растворы и растворимость соединений, растворенных в воде
5: Водные растворы и растворимость соединений, растворенных в воде- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98031
Цели обучения
- Дайте определение и приведите примеры электролитов.
Когда некоторые вещества растворяются в воде, они претерпевают физические или химические изменения, в результате которых в растворе образуются ионы. Эти вещества составляют важный класс соединений, называемых электролитами. Вещества, которые при растворении не выделяют ионов, называются неэлектролитами. Если физический или химический процесс, который генерирует ионы, эффективен практически на 100% (все растворенные соединения дают ионы), то это вещество известно как сильный электролит. Если только относительно небольшая часть растворенного вещества подвергается процессу образования ионов, его называют слабым электролитом.
Если только относительно небольшая часть растворенного вещества подвергается процессу образования ионов, его называют слабым электролитом.
Вещества могут быть идентифицированы как сильные, слабые или неэлектролиты путем измерения электропроводности водного раствора, содержащего это вещество. Чтобы проводить электричество, вещество должно содержать свободно подвижные заряженные частицы. Наиболее знакомым является проведение электричества по металлическим проводам, и в этом случае подвижными заряженными объектами являются электроны. Растворы также могут проводить электричество, если они содержат растворенные ионы, причем проводимость увеличивается по мере увеличения концентрации ионов. Приложение напряжения к электродам, погруженным в раствор, позволяет оценить относительную концентрацию растворенных ионов либо количественно, измеряя протекание электрического тока, либо качественно, наблюдая за яркостью включенной в цепь лампочки (рис. \(\PageIndex {1}\)).
Рисунок \(\PageIndex{1}\): Растворы неэлектролитов, таких как этанол, не содержат растворенных ионов и не могут проводить электричество.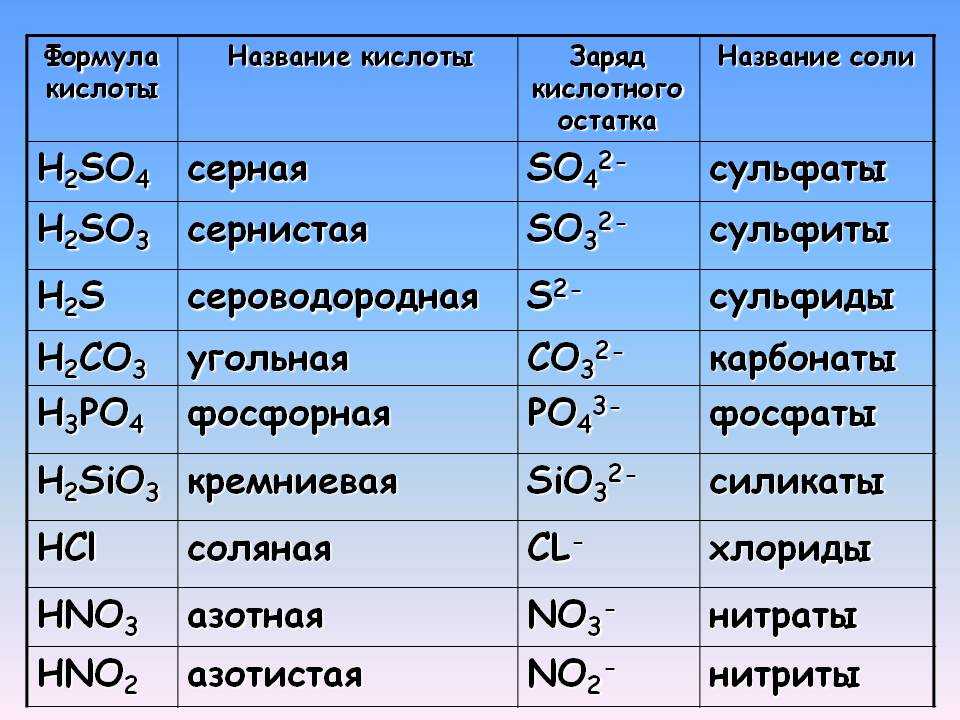 Растворы электролитов содержат ионы, обеспечивающие прохождение электричества. Электропроводность раствора электролита связана с прочностью электролита. На этой диаграмме показаны три отдельных стакана. У каждого есть провод, подключенный к розетке. В каждом случае проволока ведет от стены к стакану и разделяется на два конца. Один конец ведет к лампочке и переходит в прямоугольник, помеченный знаком плюс. Другой конец ведет к прямоугольнику, помеченному знаком минус. Прямоугольники находятся в растворе. В первом стакане с надписью «Этанол не проводит проводимость» четыре пары связанных между собой маленьких зеленых сфер подвешены в растворе между прямоугольниками. Во втором стакане с надписью «K C l Strong Conductivity» в растворе подвешены шесть отдельных зеленых сфер, три из которых отмечены плюсом, а три — минусом. От каждой из шести сфер отходит стрелка, указывающая на прямоугольник, помеченный противоположным знаком. В третьем стакане, обозначенном «Раствор уксусной кислоты, слабая проводимость», между двумя прямоугольниками подвешены две пары соединенных зеленых сфер и две отдельные сферы, одна с плюсом, а другая с минусом.
Растворы электролитов содержат ионы, обеспечивающие прохождение электричества. Электропроводность раствора электролита связана с прочностью электролита. На этой диаграмме показаны три отдельных стакана. У каждого есть провод, подключенный к розетке. В каждом случае проволока ведет от стены к стакану и разделяется на два конца. Один конец ведет к лампочке и переходит в прямоугольник, помеченный знаком плюс. Другой конец ведет к прямоугольнику, помеченному знаком минус. Прямоугольники находятся в растворе. В первом стакане с надписью «Этанол не проводит проводимость» четыре пары связанных между собой маленьких зеленых сфер подвешены в растворе между прямоугольниками. Во втором стакане с надписью «K C l Strong Conductivity» в растворе подвешены шесть отдельных зеленых сфер, три из которых отмечены плюсом, а три — минусом. От каждой из шести сфер отходит стрелка, указывающая на прямоугольник, помеченный противоположным знаком. В третьем стакане, обозначенном «Раствор уксусной кислоты, слабая проводимость», между двумя прямоугольниками подвешены две пары соединенных зеленых сфер и две отдельные сферы, одна с плюсом, а другая с минусом. Сфера с пометкой плюс имеет стрелку, указывающую на прямоугольник с пометкой минус, а сфера с пометкой минус имеет стрелку, указывающую на прямоугольник с пометкой плюс.
Сфера с пометкой плюс имеет стрелку, указывающую на прямоугольник с пометкой минус, а сфера с пометкой минус имеет стрелку, указывающую на прямоугольник с пометкой плюс.Ионные электролиты
Вода и другие полярные молекулы притягиваются к ионам, как показано на рисунке \(\PageIndex{2}\). Электростатическое притяжение между ионом и молекулой с диполем называется ионно-дипольным притяжением. Эти притяжения играют важную роль в растворении ионных соединений в воде.
Рисунок \(\PageIndex{2}\): Когда хлорид калия (KCl) растворяется в воде, ионы гидратируются. Полярные молекулы воды притягиваются зарядами на K + 9.0038 и Cl − ионов. Молекулы воды впереди и позади ионов не показаны. На диаграмме показаны восемь фиолетовых сфер, помеченных надстрочным индексом K плюс, и восемь зеленых сфер, помеченных надстрочным индексом C l минус, смешанные и соприкасающиеся рядом с центром диаграммы. За пределами этого скопления сфер находятся семнадцать скоплений из трех сфер, в том числе одна красная и две белые сферы. Красная сфера в одном из этих кластеров помечена O. Белая сфера помечена H. Две из зеленых сфер с верхним индексом C l окружены тремя красными и белыми кластерами, причем красные сферы расположены ближе к зеленым сферам, чем остальные. белые сферы. Одна из сфер с надстрочным индексом K плюс фиолетовая окружена четырьмя красными и белыми кластерами. Белые сферы этих кластеров ближе всего к фиолетовым сферам.
Красная сфера в одном из этих кластеров помечена O. Белая сфера помечена H. Две из зеленых сфер с верхним индексом C l окружены тремя красными и белыми кластерами, причем красные сферы расположены ближе к зеленым сферам, чем остальные. белые сферы. Одна из сфер с надстрочным индексом K плюс фиолетовая окружена четырьмя красными и белыми кластерами. Белые сферы этих кластеров ближе всего к фиолетовым сферам.Когда ионные соединения растворяются в воде, ионы в твердом веществе разделяются и равномерно распределяются по всему раствору, потому что молекулы воды окружают ионы и сольватируют их, уменьшая сильные электростатические силы между ними. Этот процесс представляет собой физическое изменение, известное как диссоциация. В большинстве случаев ионные соединения почти полностью диссоциируют при растворении, поэтому их относят к сильным электролитам.
Давайте рассмотрим, что происходит на микроскопическом уровне, когда мы добавляем твердый KCl в воду. Ионно-дипольные силы притягивают положительные (водородные) концы полярных молекул воды к отрицательным ионам хлора на поверхности твердого тела, а отрицательные (кислородные) концы – к положительным ионам калия. Молекулы воды проникают между отдельными K + и Cl — и окружают их, уменьшая сильные межионные силы, которые связывают ионы вместе, и позволяя им переходить в раствор в виде сольватированных ионов, как показано на рисунке \(\PageIndex{2}\). Уменьшение электростатического притяжения обеспечивает независимое движение каждого гидратированного иона в разбавленном растворе, что приводит к увеличению беспорядка в системе, поскольку ионы меняют свое фиксированное и упорядоченное положение в кристалле на подвижное и гораздо более неупорядоченное состояние. в растворе. Этот повышенный беспорядок ответственен за растворение многих ионных соединений, включая KCl, которые растворяются при поглощении тепла.
Молекулы воды проникают между отдельными K + и Cl — и окружают их, уменьшая сильные межионные силы, которые связывают ионы вместе, и позволяя им переходить в раствор в виде сольватированных ионов, как показано на рисунке \(\PageIndex{2}\). Уменьшение электростатического притяжения обеспечивает независимое движение каждого гидратированного иона в разбавленном растворе, что приводит к увеличению беспорядка в системе, поскольку ионы меняют свое фиксированное и упорядоченное положение в кристалле на подвижное и гораздо более неупорядоченное состояние. в растворе. Этот повышенный беспорядок ответственен за растворение многих ионных соединений, включая KCl, которые растворяются при поглощении тепла.
В других случаях электростатическое притяжение между ионами в кристалле настолько велико или ионно-дипольные силы притяжения между ионами и молекулами воды настолько слабы, что увеличение беспорядка не может компенсировать энергию, необходимую для разделения ионов, и кристалл нерастворим. Так обстоит дело с такими соединениями, как карбонат кальция (известняк), фосфат кальция (неорганический компонент кости) и оксид железа (ржавчина).
Так обстоит дело с такими соединениями, как карбонат кальция (известняк), фосфат кальция (неорганический компонент кости) и оксид железа (ржавчина).
Правила растворимости
Некоторые комбинации водных реагентов приводят к образованию твердого осадка в качестве продукта. Однако некоторые комбинации не дадут такой продукт. При смешивании растворов нитрата натрия и хлорида аммония реакции не происходит. Можно было бы написать молекулярное уравнение, показывающее реакцию двойного замещения, но оба продукта, хлорид натрия и нитрат аммония, растворимы и останутся в растворе в виде ионов. Каждый ион является ионом-наблюдателем, и никакого чистого ионного уравнения не существует. Полезно уметь предсказывать, когда в реакции образуется осадок. Для этого вы можете использовать набор рекомендаций, называемый правила разрешимости (таблицы \(\PageIndex{1}\) и \(\PageIndex{2}\)).
| Растворим в воде | Важные исключения (неразрешимые) |
|---|---|
| Все группы IA и NH 4 + соли | нет |
| Все нитраты, хлораты, перхлораты и ацетаты | нет |
| Все сульфаты | CaSO 4 , BaSO 4 , SrSO 4 , PbSO 4 |
| Все хлориды, бромиды и йодиды | AgX, Hg 2 X 2 , PbX 2 (X= Cl, Br или I) |
| Мало растворим в воде | Важные исключения (растворимые) | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Все карбонаты и фосфаты | Группа IA и NH 4 + соли | ||||||||||||||||||||||
| Все гидроксиды | Группа IA и NH 4 + соли; Ba 2 + , Sr 2 + , Ca 2 + малорастворимый | ||||||||||||||||||||||
| Все сульфиды | Группа IA, IIA и NH 4 + соли; MgS, CaS, BaS, умеренно растворимые | ||||||||||||||||||||||
| Все оксалаты | Группа IA и NH 4 + соли | ||||||||||||||||||||||
| Особое примечание: Следующие электролиты обладают лишь умеренной растворимостью в воде: CH 3 COOAg, Ag 2 SO 4 , KClO 9-} \left( aq \right) \rightarrow ? \номер\] Потенциальными осадками реакции двойного замещения являются нитрат цезия и бромид свинца (II). Пример \(\PageIndex{1}\): РастворимостьКлассифицируйте каждое соединение как растворимое или нерастворимое
Раствор
Упражнение \(\PageIndex{1}\): РастворимостьКлассифицируйте каждое соединение как растворимое или нерастворимое.
РезюмеВещества, которые растворяются в воде с образованием ионов, называются электролитами. Неэлектролиты – вещества, не образующие ионов при растворении в воде. Правила растворимости позволяют предсказать, какие продукты будут нерастворимы в воде. Взносы и ссылки
7.5: Водные растворы и растворимость – соединения, растворенные в воде
Цели обучения
Когда некоторые вещества растворяются в воде, они претерпевают физические или химические изменения, в результате которых в растворе образуются ионы. Эти вещества составляют важный класс соединений, называемых электролитами. Вещества, которые при растворении не выделяют ионов, называются неэлектролитами. Если физический или химический процесс, который генерирует ионы, эффективен практически на 100% (все растворенные соединения дают ионы), то это вещество известно как сильный электролит. Вещества могут быть идентифицированы как сильные, слабые или неэлектролиты путем измерения электропроводности водного раствора, содержащего это вещество. Чтобы проводить электричество, вещество должно содержать свободно подвижные заряженные частицы. Наиболее знакомым является проведение электричества по металлическим проводам, и в этом случае подвижными заряженными объектами являются электроны. Растворы также могут проводить электричество, если они содержат растворенные ионы, причем проводимость увеличивается по мере увеличения концентрации ионов. Приложение напряжения к электродам, погруженным в раствор, позволяет оценить относительную концентрацию растворенных ионов либо количественно, измеряя протекание электрического тока, либо качественно, наблюдая за яркостью включенной в цепь лампочки (рис. \(\PageIndex {1}\)). Рисунок \(\PageIndex{1}\): Растворы неэлектролитов, таких как этанол, не содержат растворенных ионов и не могут проводить электричество. Растворы электролитов содержат ионы, обеспечивающие прохождение электричества. Электропроводность раствора электролита связана с прочностью электролита. На этой диаграмме показаны три отдельных стакана. У каждого есть провод, подключенный к розетке. В каждом случае проволока ведет от стены к стакану и разделяется на два конца. Один конец ведет к лампочке и переходит в прямоугольник, помеченный знаком плюс. Другой конец ведет к прямоугольнику, помеченному знаком минус. Прямоугольники находятся в растворе. В первом стакане с надписью «Этанол не проводит проводимость» четыре пары связанных между собой маленьких зеленых сфер подвешены в растворе между прямоугольниками. Во втором стакане с надписью «K C l Strong Conductivity» в растворе подвешены шесть отдельных зеленых сфер, три из которых отмечены плюсом, а три — минусом. От каждой из шести сфер отходит стрелка, указывающая на прямоугольник, помеченный противоположным знаком. В третьем стакане, обозначенном «Раствор уксусной кислоты, слабая проводимость», между двумя прямоугольниками подвешены две пары соединенных зеленых сфер и две отдельные сферы, одна с плюсом, а другая с минусом. Растворы электролитов содержат ионы, обеспечивающие прохождение электричества. Электропроводность раствора электролита связана с прочностью электролита. На этой диаграмме показаны три отдельных стакана. У каждого есть провод, подключенный к розетке. В каждом случае проволока ведет от стены к стакану и разделяется на два конца. Один конец ведет к лампочке и переходит в прямоугольник, помеченный знаком плюс. Другой конец ведет к прямоугольнику, помеченному знаком минус. Прямоугольники находятся в растворе. В первом стакане с надписью «Этанол не проводит проводимость» четыре пары связанных между собой маленьких зеленых сфер подвешены в растворе между прямоугольниками. Во втором стакане с надписью «K C l Strong Conductivity» в растворе подвешены шесть отдельных зеленых сфер, три из которых отмечены плюсом, а три — минусом. От каждой из шести сфер отходит стрелка, указывающая на прямоугольник, помеченный противоположным знаком. В третьем стакане, обозначенном «Раствор уксусной кислоты, слабая проводимость», между двумя прямоугольниками подвешены две пары соединенных зеленых сфер и две отдельные сферы, одна с плюсом, а другая с минусом. Сфера с пометкой плюс имеет стрелку, указывающую на прямоугольник с пометкой минус, а сфера с пометкой минус имеет стрелку, указывающую на прямоугольник с пометкой плюс. Сфера с пометкой плюс имеет стрелку, указывающую на прямоугольник с пометкой минус, а сфера с пометкой минус имеет стрелку, указывающую на прямоугольник с пометкой плюс.Ионные электролитыВода и другие полярные молекулы притягиваются к ионам, как показано на рисунке \(\PageIndex{2}\). Электростатическое притяжение между ионом и молекулой с диполем называется ионно-дипольным притяжением. Эти притяжения играют важную роль в растворении ионных соединений в воде. Рисунок \(\PageIndex{2}\): Когда хлорид калия (KCl) растворяется в воде, ионы гидратируются. Полярные молекулы воды притягиваются зарядами на K + 9.0038 и Cl − ионов. Молекулы воды впереди и позади ионов не показаны. На диаграмме показаны восемь фиолетовых сфер, помеченных надстрочным индексом K плюс, и восемь зеленых сфер, помеченных надстрочным индексом C l минус, смешанные и соприкасающиеся рядом с центром диаграммы. За пределами этого скопления сфер находятся семнадцать скоплений из трех сфер, в том числе одна красная и две белые сферы. Красная сфера в одном из этих кластеров помечена O. Белая сфера помечена H. Две из зеленых сфер с верхним индексом C l окружены тремя красными и белыми кластерами, причем красные сферы расположены ближе к зеленым сферам, чем остальные. белые сферы. Одна из сфер с надстрочным индексом K плюс фиолетовая окружена четырьмя красными и белыми кластерами. Белые сферы этих кластеров ближе всего к фиолетовым сферам. Красная сфера в одном из этих кластеров помечена O. Белая сфера помечена H. Две из зеленых сфер с верхним индексом C l окружены тремя красными и белыми кластерами, причем красные сферы расположены ближе к зеленым сферам, чем остальные. белые сферы. Одна из сфер с надстрочным индексом K плюс фиолетовая окружена четырьмя красными и белыми кластерами. Белые сферы этих кластеров ближе всего к фиолетовым сферам.Когда ионные соединения растворяются в воде, ионы в твердом веществе разделяются и равномерно распределяются по всему раствору, потому что молекулы воды окружают ионы и сольватируют их, уменьшая сильные электростатические силы между ними. Этот процесс представляет собой физическое изменение, известное как диссоциация. В большинстве случаев ионные соединения почти полностью диссоциируют при растворении, поэтому их относят к сильным электролитам. Давайте рассмотрим, что происходит на микроскопическом уровне, когда мы добавляем твердый KCl в воду. Ионно-дипольные силы притягивают положительные (водородные) концы полярных молекул воды к отрицательным ионам хлора на поверхности твердого тела, а отрицательные (кислородные) концы – к положительным ионам калия. В других случаях электростатическое притяжение между ионами в кристалле настолько велико или ионно-дипольные силы притяжения между ионами и молекулами воды настолько слабы, что увеличение беспорядка не может компенсировать энергию, необходимую для разделения ионов, и кристалл нерастворим. Правила растворимостиНекоторые комбинации водных реагентов приводят к образованию твердого осадка в качестве продукта. Однако некоторые комбинации не дадут такой продукт. При смешивании растворов нитрата натрия и хлорида аммония реакции не происходит. Можно было бы написать молекулярное уравнение, показывающее реакцию двойного замещения, но оба продукта, хлорид натрия и нитрат аммония, растворимы и останутся в растворе в виде ионов. Каждый ион является ионом-наблюдателем, и никакого чистого ионного уравнения не существует. Полезно уметь предсказывать, когда в реакции образуется осадок. Для этого вы можете использовать набор рекомендаций, называемый правила разрешимости (таблицы \(\PageIndex{1}\) и \(\PageIndex{2}\)).
| |||||||||||||||||||||||



 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав Согласно таблице правил растворимости, нитрат цезия растворим, потому что растворимы все соединения, содержащие нитрат-ион, а также все соединения, содержащие ионы щелочных металлов. Большинство соединений, содержащих ион брома, растворимы, но свинец (II) является исключением. Следовательно, ионы цезия и нитрата являются ионами-спектаторами, а бромид свинца (II) — осадком. Сбалансированная чистая ионная реакция: 9-} \left( aq \right) \rightarrow \ce{PbBr_2} \left( s \right) \nonumber \]
Согласно таблице правил растворимости, нитрат цезия растворим, потому что растворимы все соединения, содержащие нитрат-ион, а также все соединения, содержащие ионы щелочных металлов. Большинство соединений, содержащих ион брома, растворимы, но свинец (II) является исключением. Следовательно, ионы цезия и нитрата являются ионами-спектаторами, а бромид свинца (II) — осадком. Сбалансированная чистая ионная реакция: 9-} \left( aq \right) \rightarrow \ce{PbBr_2} \left( s \right) \nonumber \]
 Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Загрузите бесплатно по адресу http://cnx.org/contents/85abf193-2bd…
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Загрузите бесплатно по адресу http://cnx.org/contents/85abf193-2bd…
 Если только относительно небольшая часть растворенного вещества подвергается процессу образования ионов, его называют слабым электролитом.
Если только относительно небольшая часть растворенного вещества подвергается процессу образования ионов, его называют слабым электролитом. Молекулы воды проникают между отдельными K + и Cl — и окружают их, уменьшая сильные межионные силы, которые связывают ионы вместе, и позволяя им переходить в раствор в виде сольватированных ионов, как показано на рисунке \(\PageIndex{2}\). Уменьшение электростатического притяжения обеспечивает независимое движение каждого гидратированного иона в разбавленном растворе, что приводит к увеличению беспорядка в системе, поскольку ионы меняют свое фиксированное и упорядоченное положение в кристалле на подвижное и гораздо более неупорядоченное состояние. в растворе. Этот повышенный беспорядок ответственен за растворение многих ионных соединений, включая KCl, которые растворяются при поглощении тепла.
Молекулы воды проникают между отдельными K + и Cl — и окружают их, уменьшая сильные межионные силы, которые связывают ионы вместе, и позволяя им переходить в раствор в виде сольватированных ионов, как показано на рисунке \(\PageIndex{2}\). Уменьшение электростатического притяжения обеспечивает независимое движение каждого гидратированного иона в разбавленном растворе, что приводит к увеличению беспорядка в системе, поскольку ионы меняют свое фиксированное и упорядоченное положение в кристалле на подвижное и гораздо более неупорядоченное состояние. в растворе. Этот повышенный беспорядок ответственен за растворение многих ионных соединений, включая KCl, которые растворяются при поглощении тепла. Так обстоит дело с такими соединениями, как карбонат кальция (известняк), фосфат кальция (неорганический компонент кости) и оксид железа (ржавчина).
Так обстоит дело с такими соединениями, как карбонат кальция (известняк), фосфат кальция (неорганический компонент кости) и оксид железа (ржавчина). Согласно таблице правил растворимости, нитрат цезия растворим, потому что растворимы все соединения, содержащие нитрат-ион, а также все соединения, содержащие ионы щелочных металлов. Большинство соединений, содержащих ион брома, растворимы, но свинец (II) является исключением. Следовательно, ионы цезия и нитрата являются ионами-спектаторами, а бромид свинца (II) — осадком. Сбалансированная чистая ионная реакция: 9-} \left( aq \right) \rightarrow \ce{PbBr_2} \left( s \right) \nonumber \]
Согласно таблице правил растворимости, нитрат цезия растворим, потому что растворимы все соединения, содержащие нитрат-ион, а также все соединения, содержащие ионы щелочных металлов. Большинство соединений, содержащих ион брома, растворимы, но свинец (II) является исключением. Следовательно, ионы цезия и нитрата являются ионами-спектаторами, а бромид свинца (II) — осадком. Сбалансированная чистая ионная реакция: 9-} \left( aq \right) \rightarrow \ce{PbBr_2} \left( s \right) \nonumber \]

Leave A Comment