Строение молекул. Химическая связь
Молекула — электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов.
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого.
Химическая связь может образовываться путем предоставления от каждого из атомов по одному или нескольким неспаренным электронам (кратные связи) с образованием электронных пар (ковалентная связь). В образовании химической связи участвуют только электроны внешней электронной оболочки, а внутренние электронные уровни не затрагиваются. В результате, при образовании химической связи у каждого атома образуется заполненная электронная оболочка внешнего электронного уровня, состоящая из двух (дуплет) или восьми (октет) электронов.
Химическая связь характеризуется длиной и энергией. Длина химической связи это расстояние между ядрами связанных атомов. Энергия химической связи показывает сколько необходимо затратить энергии на разведение двух атомов, между которыми существует химическая связь, на расстояние, при котором эта химическая связь будет разорвана.
Виды химической связи
Ионная химическая связь
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностьюэлектроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью.
Результатом этого является образование соединения противоположно заряженных ионов:
Это притяжение ионов как разноимённо заряженных тел. Ионная связь — крайний случай поляризации ковалентной полярной связи.
Образуется между типичными металлом и неметаллом (Me + неМе).
При этом электроны у металла полностью переходят к неметаллу, образуются ионы (частицы, имеющие заряд).
Например, типичные металлы литий (Li), натрий (Na), калий (K), кальций (Ca), стронций (Sr), барий (Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия (NaOH) и сульфате натрия (Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи — ковалентные полярные).
Например, в гидроксиде натрия (NaOH) и сульфате натрия (Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи — ковалентные полярные).
Ковалентная химическая связь
Ковалентная полярная химическая связь образуется при взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому.
Электроотрицательность (ЭО) — способность атома химических элемента смещать к себе общие электронные пары, участвующие в образовании химической связи.
Ковалентная полярная связь образуется между разными неметаллами (неМе + неMe).
Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
Такая связь существует в молекулах следующих сложных веществ: Н2О, h3S, Nh4 и др.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония (Н3О+) и аммония (Nh5+).
Металлическая химическая связь
Связь в металлах и сплавах между атом-ионами посредством обобществленных электронов называется металлической.
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т.е. электроны как бы цементируют положительные ионы кристаллической решетки металлов.
Металлическая кристаллическая решетка Металлическая связь существует в металлах в твердом в жидком состоянии.
В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные ионы, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ» , обеспечивающий связь между атомами металла.
Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью.
Металлическая связь возникает за счет обобществления атомами валентных электронов. Однако между этими видами связи есть существенное различие. Электроны, осуществляющие ковалентную связь, в основном пребывают в непосредственной близости от двух соединенных атомов.
В случае металлической связи электроны, осуществляющие связь, перемещаются по всему куску металла. Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д.
Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д.
Общим химическим свойством металлов является их относительно высокая восстановительная способность.
Обобщение материала
Типы химической связи
Полезные ссылки
Источник материала
Ионная связь и её характеристики (видео)
Ковалентная связь и её характеристики (видео)
Металлическая связь и её характеристики (видео)
Схемы образования веществ с различным типом связи (видео)
Разбор видов связи
Ионная химическая связь (видео)
Ковалентная неполярная химическая связь (видео)
Ковалентная полярная химическая связь (видео)
Металлическая химическая связь (видео)
Дополнительные материалы
Ковалентная и ионная химическая связь (видео)
Металлическая и водородная химические связи (видео)
Ионная связь (видео)
Ковалентная связь (видео)
Ковалентная полярная связь (видео)
7 типов ионных ковалентных связей: подробная информация и факты
By Смрути Бхосале
В этой статье мы рассмотрим примеры типов ионной ковалентной связи, факты и подробные сведения.
- Гидроксид натрия NaOH
- Нитрат натрия NaNO3
- Хлорид аммония NH4Cl
- Карбонат кальция CaCO3
- Цианид калия KCN
- Нитрит калия KNO2
- Сульфат калия К2SO4
- Цианид бария Ba(CN)2
Некоторые соединения содержат в своей молекулярной структуре как ионные, так и ковалентные связи. Их также называют многоатомными соединениями. Для достижения стабилизации некоторые молекулы образуют более одного типа связи. Здесь мы увидим некоторые молекулы, которые являются ионными. типы ковалентной связи Примеры .
Ионная связьAn Ионная связь определяется как два разных иона, катионы и анионы притягиваются друг к другу и образуют связь. Электровалентная связь — еще один термин, используемый для обозначения ионной связи. ионный соединения демонстрируют этот тип связи в своей атомной структуре. Этот тип связи образуется в металлах и неметаллах.
ионный соединения демонстрируют этот тип связи в своей атомной структуре. Этот тип связи образуется в металлах и неметаллах.
- Электровалентная связь — еще один термин, относящийся к ионной связи.
- Сильная электростатическая сила притяжения используется для объединения анионов и катионов вместе.
- Они имеют высокую температуру плавления.
- Они хорошо проводят электричество в расплавленном состоянии или растворены в растворителях, но в твердом состоянии плохо проводят электричество.
- Они могут растворяться в полярных растворителях и не растворяются в неполярных растворителях.
Подробнее о: 10 примеров ионной связи: объяснение и подробные факты
Ковалентная связьКовалентная связь определяется как два атома, разделяющих свои одинаковые валентные электроны для получения стабильной электронной конфигурации. Ковалентные соединения содержат такие связи в своей молекулярной структуре.
Ковалентные соединения содержат такие связи в своей молекулярной структуре.
- Связь образуется между одинаковыми или разными атомами.
- Далее он классифицируется на основе электроотрицательности атомов как полярная и неполярная ковалентная связь.
- Они обладают свойством низкой температуры плавления и кипения.
- Они не способны проводить электричество.
- Они могут растворяться в неполярных растворителях и не растворяются в воде, которая является полярным растворителем.
Подробнее о: 4 примера одинарных ковалентных связей: подробные сведения и факты
Ионные типы ковалентной связи ПримерыГидроксид натрия NaOHГидроксид натрия, атом кислорода и атом водорода показывают образование ковалентной связи путем обмена электронами. Ион гидроксида имеет отрицательный заряд, а ион натрия – положительный. Эти два иона ОН– и Na+ притягиваются друг к другу, образуя ионную связь.
Эти два иона ОН– и Na+ притягиваются друг к другу, образуя ионную связь.
В нитрате натрия атом азота образует связь с тремя атомами кислорода. Связь, образованная между азотом и кислородом, называется ковалентной связью. Нитрит-ион НЕТ3 имеет отрицательный заряд, а ион натрия Na имеет положительный заряд. На+ и нет3– ионы образуют ионные связи. Следовательно, это пример молекулы, имеющей ионные и ковалентные связь.
Рисунок 2: Структура нитрата натрия NaNO.3Хлорид аммония NH4ClВ молекуле хлорида аммония атом азота образует четыре ковалентные связи с четырьмя разными атомами водорода. Северная Каролина4 приобретает положительный заряд. Этот ион аммония соединяется с отрицательно заряженным ионом хлорида. Северная Каролина4+ и Cl– ионы образуют ионную связь.
В карбонате кальция ковалентные связи образуются между тремя атомами кислорода и атомом углерода. Ионы карбоната приобретают отрицательный заряд и соединяются с положительно заряженными ионами металлического кальция. Ca+ и СО3– образуют ионную связь.
Рисунок 4: Структура карбоната кальция CaCO.3Цианид калия KCNВ цианиде калия атом углерода ковалентно связан с атомом азота. Атом углерода и атом азота делят друг с другом три электрона. Цианид CN более электроотрицателен, чем калий. Он приобретает отрицательный заряд. Калий имеет положительный заряд. К+ и CN– образуют ионную связь.
Рисунок 5: Структура цианида калия KCNНитрит калия KNO2В молекуле нитрита калия атом азота образует две ковалентные связи с двумя разными атомами кислорода. Положительно заряженный ион калия K+ и отрицательно заряженный нитрат-ион NO2– образует ионную связь. КНО2 имеет как ионную, так и ковалентную связь.
КНО2 имеет как ионную, так и ковалентную связь.
В сульфате калия атом серы делит электроны с четырьмя атомами кислорода. Сера образует ионную связь с ионами калия. Отрицательно заряженный SO4-2 ион и положительно заряженный K+2 ион образует связь.
Рисунок 7: Структура сульфата калия K2SO4Цианид бария Ba(CN)2В цианиде бария атом углерода и атом азота делят друг с другом три электрона. Отрицательно заряженный ион цианида образует ионную связь с положительно заряженным ионом бария. CN– и Ба+2 образуют ионные связи.
Рисунок 8: Структура цианида бария Ba(CN)2Подробнее о: 15 примеров координационных ковалентных связей: подробные сведения и факты
Факты- Химическая связь состоит как из ионной, так и из ковалентной связи.

- Обе связи обеспечивают стабильность соединений.
- Некоторые соединения полностью растворимы в воде, а некоторые плохо растворимы в воде.
- Большинство этих соединений представляют собой соли.
- Они могут проводить электричество в расплавленном состоянии.
- В водном растворе они разделяются с образованием катионов и анионов.
Вопрос: Как KCN ионные и ковалентные?
Ответ: KCN имеет как ионные, так и ковалентные связи.
В цианиде калия атом углерода ковалентно связан с атомом азота. Атом углерода и атом азота делят друг с другом три электрона. Цианид CN более электроотрицателен, чем калий. Он приобретает отрицательный заряд. Калий имеет положительный заряд. К+ и CN– образуют ионную связь.
Вопрос: Nh5S имеет ионные и ковалентные облигации?
Ответ: NH4S имеет обе связи.
В сульфиде аммония азот ковалентно связан с четырьмя атомами водорода. Разница в электроотрицательности приводит к образованию ионной связи между ионом аммония и серой. Следовательно, NH4S имеют не только ионную, но и ковалентную связь.
Вопрос: CaCO3 ионный или ковалентный?
Ответ: СаСО3 считается ионным соединением.
В карбонате кальция три атома кислорода образуют три ковалентные связи с атомом углерода. Ионы карбоната приобретают отрицательный заряд и соединяются с положительно заряженными ионами металлического кальция. Ca+ и СО3– образуют ионную связь.
Обзор гидроксида натрия
Гидроксид натрия, иногда известный как щелочь или каустическая сода, представляет собой ионное соединение с высокой коррозионной активностью.
Что такое гидроксид натрия? Гидроксид натрия — это сильнодействующее химическое вещество, имеющее несколько названий, включая NaOH, щелочь и едкий натр.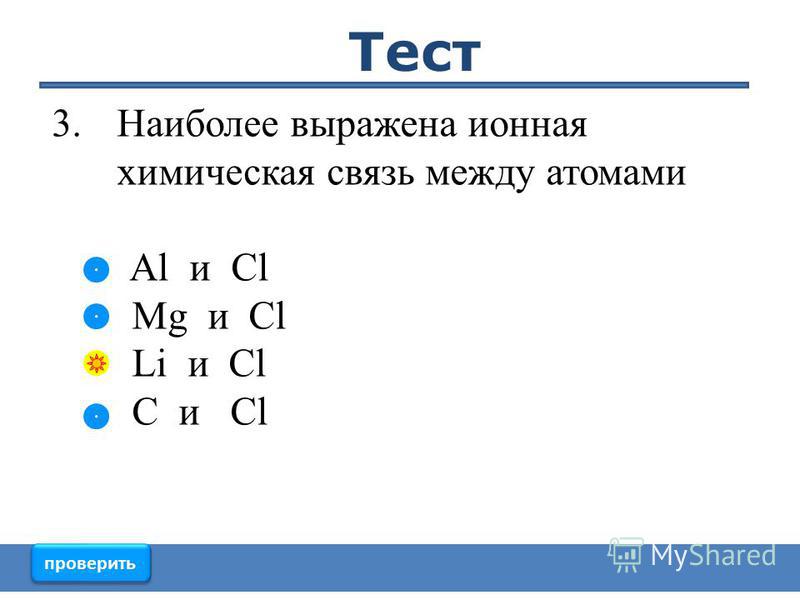 Гидроксид натрия часто используется в качестве активного агента в чистящих растворах, но он также используется в производстве текстиля, целлофана и бумаги. Это химическое вещество чрезвычайно опасно и может серьезно повредить материалы. Людям следует избегать незащищенного контакта с гидроксидом натрия, поскольку он может вызвать серьезные ожоги кожи и серьезное повреждение тканей при попадании в глаза или при вдыхании.
Гидроксид натрия часто используется в качестве активного агента в чистящих растворах, но он также используется в производстве текстиля, целлофана и бумаги. Это химическое вещество чрезвычайно опасно и может серьезно повредить материалы. Людям следует избегать незащищенного контакта с гидроксидом натрия, поскольку он может вызвать серьезные ожоги кожи и серьезное повреждение тканей при попадании в глаза или при вдыхании.
Химическая формула гидроксида натрия: NaOH. Это ионное соединение, потому что оно содержит ион металла, натрия (Na + ), который притягивается к иону неметалла, гидроксиду (OH — ). Он белый, но твердый и имеет высокую температуру плавления 604,4 градуса по Фаренгейту. Несмотря на высокую температуру плавления, гидроксид натрия достаточно эффективно растворяется в воде. Он прозрачен при растворении в воде.
Гидроксид натрия также является сильным основанием, представляющим собой химическое вещество, которое расщепляется в воде с образованием большого количества гидроксида (OH – ) ионов. Гидроксид натрия имеет очень высокий pH при растворении в воде и кажется довольно скользким. Когда гидроксид натрия растворяется в воде, он становится наиболее агрессивным.
Гидроксид натрия имеет очень высокий pH при растворении в воде и кажется довольно скользким. Когда гидроксид натрия растворяется в воде, он становится наиболее агрессивным.
Реакция растворения гидроксида натрия в воде
Гидроксид натрия полностью растворяется в воде с образованием одного иона натрия и одного гидроксид-иона. Уравнение, показанное выше, представляет эту процедуру. Несмотря на то, что это не химическая реакция, это очень важная особенность гидроксида натрия.
Реакции. гидроксида натрия с кислотами Когда гидроксид натрия реагирует с кислотами, он образует воду и ионную молекулу. Гидроксид из гидроксида натрия соединяется с ионом водорода в кислоте с образованием воды в этом типе реакции. Оставшаяся кислота реагирует с ионом натрия из гидроксида натрия с образованием ионной молекулы. Как реакция между гидроксидом натрия и соляной кислотой, а также реакция, показывающая, как гидроксид натрия реагирует с кислотами в целом.
NaOH + HCl → H 2 O + NaCl
NaOH + HX → H 2 O + NaX
Реакции с участием растворенных металлов Если растворенные металлы ядовиты или должны быть удалены из раствора, этот тип реакции весьма ценен. Существует несколько методов фильтрации твердых соединений из раствора. В этом процессе растворенная медь соединяется с гидроксидом натрия с образованием твердого гидроксида меди (II) и ионов натрия. Затем из раствора можно удалить синий гидроксид меди (II). Получение гидроксида натрияГидроксид натрия (NaOH) является одним из самых сильных оснований. В лабораториях и промышленности это один из наиболее часто используемых гидроксидов щелочных металлов. Электролиз солевого раствора в диафрагме или ртутной ячейке является наиболее частым методом производства. Получение NaOH и других соединений включает всего несколько ключевых операций.
Гидроксид натрия, содержащий хлор и водород, получают хлорно-щелочным процессом. Для этого подвергают электролизу водный раствор хлорида натрия. На катоде образуется гидроксид натрия, где вода превращается в газообразный водород и ионы гидроксида.
Для этого подвергают электролизу водный раствор хлорида натрия. На катоде образуется гидроксид натрия, где вода превращается в газообразный водород и ионы гидроксида.
2Na + 2H 2 O + 2e- → H 2 + 2NaOH
Чтобы получить NaOH, необходимо предотвратить взаимодействие NaOH с Cl 2 . Обычно это выполняется одним из трех способов, наиболее экономичным из которых является метод мембранных клеток.
- Благодаря использованию стального катода пористая диафрагма предотвращает взаимодействие Cl 2 с NaOH в ячейке с диафрагмой. В подходе с диафрагменной ячейкой проницаемая диафрагма разделяет поверхности анода и катода.
- Катодный и анодный процессы разделены мембраной Nafion в процессе с мембранной ячейкой. Эта процедура очень похожа на метод диафрагменной ячейки. Через барьер могут пройти только ионы натрия и небольшое количество воды. Он производит NaOH более высокой чистоты.
- Ртутный катод создает металлический натрий как амальгаму в процессе ртутного элемента.
 Затем натрию дают вступить в реакцию, в результате чего образуется NaOH.
Затем натрию дают вступить в реакцию, в результате чего образуется NaOH.
- Чрезмерное воздействие гидроксида натрия может привести к значительным ожогам пищеварительной системы, легких, глаз и кожи, что может привести к пожизненному повреждению или смерти.
- Кожа обожжена, глаза повреждены. Дыхательная система может воспаляться, вызывая раздражение слизистых оболочек носа.
- Даже небольшие дозы могут вызвать серьезные проблемы, такие как повреждение слизистых оболочек горла, носа, бронхов и легких.
- Соблюдайте безопасное расстояние между руками и глазами, кожей и одеждой. Не следует вдыхать туман, газы, аэрозоли, пары, пары и пыль. Наденьте защитные очки, перчатки и одежду.
- Поскольку это экзотермическая реакция, кислоты нельзя смешивать с NaOH.
- Не пейте, не ешьте, не курите и не используйте средства личной гигиены при работе с химическими веществами.

Гидроксид натрия является наиболее распространенным сильным основанием в химической промышленности. В результате он имеет множество применений в различных секторах.
[решено] Что из следующего содержит как ионную, так и ковалентную связь
Этот вопрос ранее задавался в
ACC 127 SER Official Paper (Held in Aug 2022)
View all ACC Exam Papers >
- H 2 O
- NaOH
- C 6 H 6
- CO 2
Вариант 2: NaOH
Бесплатно
Бумага ACC 124 GMAT (проведена в феврале 2021 г.)
4,7 тыс. пользователей
150 вопросов
300 марок
180 минут
Правильный ответ: NaOH.
Ключевые моменты:
- , в то время как кислород и Hydrode в Hydroxid форма NaOH.

- Образуется ионная связь между Na + и OH — и ковалентная связь между O и H в гидроксиде натрия (NaOH).
- Ионы с противоположными зарядами, объединяясь, создают ионную связь
- Отрицательные ионы притягиваются к положительным ионам , или мы можем сказать, что анионов и катионов притягиваются друг к другу электростатически.
- Когда два атома делят свои неспаренных электронов , в их химической структуре создается ковалентная связь.
Дополнительная информация:
- Когда один атом эффективно отдает валентный электрон другому атому , создается ионная связь.
- Атомы делят электроны в ковалентной связи.
- Это разделение равно

- электрон проводит больше времени с одним атомом, чем с другим в полярных ковалентных связях.
- Ниже приведены несколько соединений, которые содержат как ионная и ковалентная связь .
- KCN – цианид калия
- NH 4 Cl – хлорид аммония
- NaNO 3 – нитрат натрия
- (NH 4
- Ba(CN) 2 – цианид бария
- CaCO 3 – карбонат кальция
- КНО 2 – нитрит калия
- K2SO 4 – сульфат калия
- NaOH – гидроксид натрия
- CsI 3 – йодид цезия.
Поделиться в WhatsApp
Последние обновления экзамена ACC
Последнее обновление: 29 сентября 2022 г.


 Затем натрию дают вступить в реакцию, в результате чего образуется NaOH.
Затем натрию дают вступить в реакцию, в результате чего образуется NaOH.


Leave A Comment