Контрольная работа №1 по теме «Строение атома, химическая связь». 2 варианта с ответами и шкалой оценивания
Контрольная работа №1
по теме «Строение атома, химическая связь».
Фамилия ,имя ________________________
Дата______________________
Вариант I.
Часть А
1.Определите химический элемент по составу его атома — 18 p+, 20 n0, 18 e: а) F б) Ca в) Ar г) Sr |
2.Общее число электронов у хрома Cr: а) 21 б) 24 в) 27 г) 52 |
3. а) 14 б) 2 в) 10 г) 6 |
4.Число орбиталей на f — подуровне: а) 1 б) 3 в) 5 г) 7 |
5.Наименьший радиус атома среди приведённых элементов имеет: а) Mg б) Ca в) Si г) Cl |
6.Из приведённых элементов 3-го периода наиболее ярко выражены неметаллические свойства имеет: а) Al б) S в) Si г) Ar |
7.Ряд элементов, образующих оксиды с общей формулой RO: а) Ba, Sr, Ca б) P, As, N в) C, Si, Ge г) B, Al, Ga |
8.К р-элементам относится: а) кремний б) актиний в) гелий г) хром |
9. а)N :::N в) K+ (:Вr:)- б)H:Cl: Г) H:O:H |
10.Электронная формула атома 1s22s22p63s23p2. Формула его водородного соединения: а) PH3 б) H2S в) CH4 г) SiH4 |
Часть Б
1. Наиболее сходными химическими свойствами обладают простые вещества, образованные элементами, объясните выбор на основе периодического закона :
а) Ca и Si б) Pb и Ag в) Cl и Ar г) P и As
2 Какой тип кристаллических решёток соответствует веществам.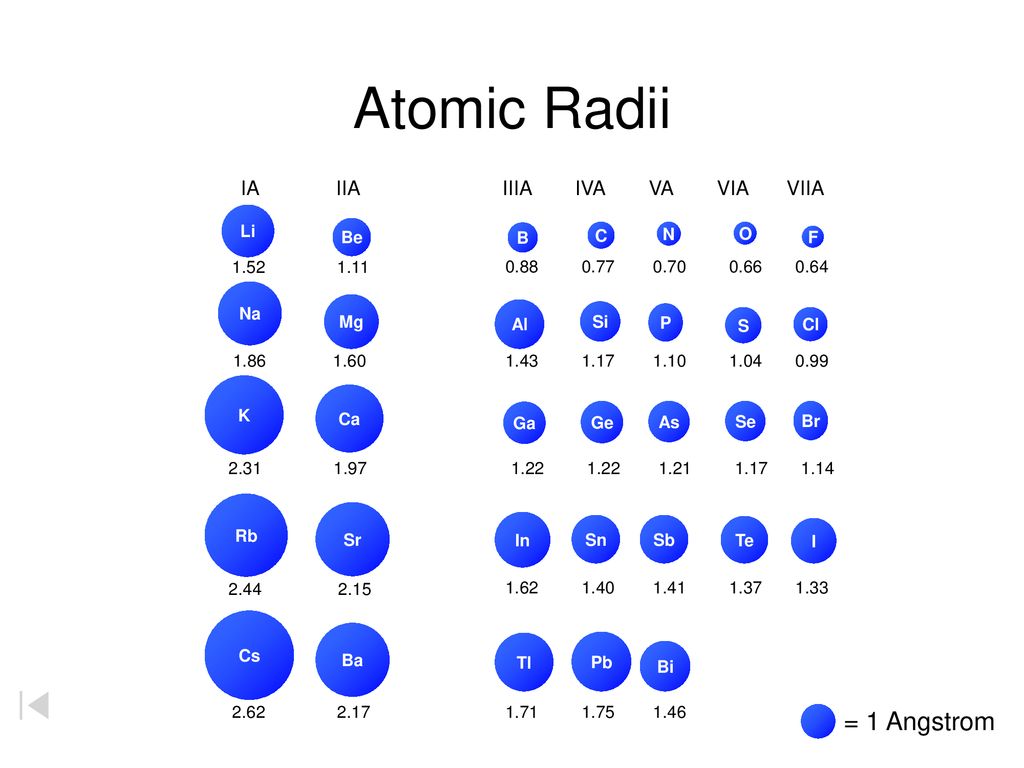
формулы | кристаллическая решётка | ОТВЕТЫ ( написать соответствия) |
а)Cu б)H2O в)KCl г)C | 1. ионная 2. молекулярная 3.атомная 4.металлическая |
ЧАСТЬ С
1.По электронной формуле химического элемента 1s22s22p63s1 определите его порядковый номер в Периодической системе, составьте формулу его высшего оксида и водородного соединения. Определите электронное семейство, к которому относят этот элемент ( s, p, d, f ), и характер его оксида.
2.Дайте характеристику химического элемента с порядковым номером 15 по его положению в Периодической системе.
ОТВЕТЫ
Контрольная работа №1
по теме «Строение атома, химическая связь».
Вариант I.
ЧАСТЬ А
за каждый правильный ответ 1 балл( всего 11 баллов)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
в) Ar | б) 24 | б) 2 | г) 7 | г) Cl | г) Ar | а) Ba, Sr, Ca | а) кремний | б) H:Cl: Г) H:O:H | г) SiH4 |
Часть Б (всего 7 баллов)
1. ( за каждый полный ответ 3 балла, неполный 1 балл)
( за каждый полный ответ 3 балла, неполный 1 балл)
Наиболее сходными химическими свойствами обладают:
г) P и As, расположены в одной группе – четвертой, неметаллы, S-элементы
2. Каждое соответствие 1 балл, всего 4 балла
1 | 2 | 3 | 4 |
в | б | Г | а |
ЧАСТЬ С
всего 8 баллов, (по 4 балла за каждый полный ответ,
2 балла не полный ответ)
Шкала оценивания
26-23 балла, 100 — 88% — 5( отлично)
22-18 баллов, 84 — 69% — 4(хорошо)
17-12 баллов, 65- 46% – 3(удовлетворительно)
11-8 баллов, 42 — 30% – 2(неуд. )
)
Контрольная работа №1
по теме по теме «Строение атома, химическая связь»
.Фамилия, имя ____________________________
Дата______________________
Вариант II.
Часть А
1.Определите химический элемент по условному обозначению его атомов 9 Э: а) K б) Ne в) F г) Ni |
2.Общее число электронов у иона Br— а) 35 б) 36 в) 80 г) 34 |
3.Максимальное число электронов, занимающих 4s — орбиталь: а) 14 б) 2 в) 10 г) 6 |
4. а) 14 б) 2 в) 6 г) 10 |
5.Наибольший радиус атома среди перечисленных элементов имеет: а) Na б) Mg в) Ba г) Ca |
6.К s-элементам относится: а) железо б) сера в) гелий г) медь |
7.Ряд элементов, образующих оксиды с общей формулой R2O: а) Mg, Ca, Be б) N, As, P в) C, Si, Ge г) Na, K, Li |
8.К р-элементам относится: а) кремний б) актиний в) гелий г) хром |
9. Указать группу веществ только с ионной связью а) KCl, H2O, N2 в)BaCl2,K2S, б) J2, NH3, CaO г) KCl, ZiF |
10. а) P б) As в) Si г) Ge |
Часть Б
1. Из приведенных элементов 4-го периода наиболее ярко выраженные металлические свойства имеет, объясните выбор на основе периодического закона :
а) Zn б) Cr в) K г) Cu
2. 2 Какой тип кристаллических решёток соответствует веществам.
формулы | кристаллическая решётка | ОТВЕТЫ( написать соответствия) |
а) Zn б) Cl2 в) NaCl г) Si | 1. 2. молекулярная 3.атомная 4.металлическая |
ЧАСТЬ С
1.По электронной формуле химического элемента 1s22s22p63s2 определите его порядковый номер в Периодической системе, составьте формулу его высшего оксида и водородного соединения. Определите электронное семейство, к которому относят этот элемент ( s, p, d, f ), и характер его оксида
2.Дайте характеристику химического элемента с порядковым номером 13 по его положению в Периодической системе.
ОТВЕТЫ
Контрольная работа №1
по теме «Строение атома, химическая связь».
Вариант II.
ЧАСТЬ А
за каждый правильный ответ 1 балл( всего 11 баллов)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
в) F | а) 35 | б) 2 | в) 6 | в) Ba | б) сера | г) Na, K, Li | а) кремний | в)BaCl2,K2S, г) KCl, ZiF | б) As |
Часть Б (всего 7 баллов)
1. ( за каждый полный ответ 3 балла, неполный 1 балл)
( за каждый полный ответ 3 балла, неполный 1 балл)
Наиболее сходными химическими свойствами обладают:
г) в) K , расположен в первой группе, щелочной металл, остальные элементы в побочной подгруппе.
2. Каждое соответствие 1 балл, всего 4 балла
1 | 2 | 3 | 4 |
в | б | Г | а |
ЧАСТЬ С
всего 8 баллов, (по 4 балла за каждый полный ответ,
2 балла не полный ответ)
Шкала оценивания
26-23 балла, 100 — 88% — 5( отлично)
22-18 баллов, 84 — 69% — 4(хорошо)
17-12 баллов, 65- 46% – 3(удовлетворительно)
11-8 баллов, 42 — 30% – 2(неуд. )
)
Тест 10 Строение атома | Материал для подготовки к ЕГЭ (ГИА) по химии (10 класс) на тему:
ТЕСТ №1.
10 КЛАСС
ПЕРИОДИЧЕСКИЙ ЗАКОН. СТРОЕНИЕ АТОМА.
ВАРИАНТ 1.
А.1. Сколько электронов находится на внешнем уровне в атоме фосфора?
а) 5 б)3 в)7 г)1
А.2. Определите химический элемент, атомное ядро которого содержит 33 протона и 42 нейтрона:
а) молибден б) мышьяк в) рений г) такого элемента нет.
А.3. Сколько всего орбиталей содержится на втором энергетическом уровне?
а) 3 б) 4 в) 7 г) 9.
А.4. Максимальное число электронов на р — орбитали:
а) 8
б) 6
в) 10
г) 2
А.5. По способу заполнения электронного слоя атомов элементы разделяют на:
а) три семейства
б) два семейства
в) четыре семейства
г) нет правильного ответа.
А.6. Какой из приведенных элементов имеет наиболее ярко выраженные металлические свойства?
а) K б) Аl в) Mg г) Са
А.7. Наименьший радиус имеет атом:
а)Nа б) Р в) Сl г) Аr
А.8. Высший оксид элемента с порядковым номером 19 соответствует общей формуле:
а) Э2О3 б) Э2О5 в) ЭО г) Э2О.
А.9. Среди следующих гидроксидов наиболее сильными основными свойствами обладает:
а) КОН б) Мg(OH)2 в) Ве(ОН)2 г) NaOH
Б.1. Составьте электронную и электронно-графическую формула атома серы, дать классификацию элементу по двум признакам, подчеркнуть валентные электроны.
ТЕСТ 1.
10 КЛАСС.
ПЕРИОДИЧЕСКИЙ ЗАКОН. СТРОЕНИЕ АТОМА.
ВАРИАНТ 2.
А.1. Атом какого элемента в основном состоянии содержит два электрона на внешнем слое?
а) бериллий б) фтор в) углерод г) сера
А. 2. Атомный номер элемента показывает:
2. Атомный номер элемента показывает:
а) число элементарных частиц в атоме
б) число нуклонов в атоме
в) число нейтронов в атоме
г) число протонов в атоме.
А.3.В каком ряду указаны символы элементов соответственно s-, p- и р- семейств?
а) Н, Не, Li б) Н, К, Аl в) Ве, С, F г) Мg, P, Н.
А.4. Максимальное число электронов на 3 энергетическом уровне:
а) 2
б) 18
в) 8
г) 32
А.5.Электронная формула внешнего слоя атома наиболее активного металла:
а) 2s1 б) 3s1 в) 3s2 г) 3s23p1.
А.6.Электроотрицательность элементов увеличивается в ряду:
а) С, Si, S б) Р, Сl, I в) Вr, Cl, S г) Se, S, Cl.
А.7. Наименьший радиус имеет атом:
а) S б) Аl в) Сl г) Аr .
А.8.Высший оксид элемента с порядковым номером 33 соответствует общей формуле:
а) Э2О5 б) Э2О3 в) ЭО г) Э2О.
А.9. Кислотные свойства высших оксидов элементов одного периода слева направо:
а) увеличиваются
б) уменьшаются
в) не изменяются
г) сначала увеличиваются, а потом уменьшаются.
Б.1. Построить электронную и электронно-графическую формулу атома с порядковым номером 27, дать классификацию элементу по двум признакам, подчеркнуть валентные электроны.
ТЕСТ 1.
10 КЛАСС.
ПЕРИОДИЧЕСКИЙ ЗАКОН. СТРОЕНИЕ АТОМА.
ВАРИАНТ 3.
А.1.Заряд ядра атома железа равен:
а) +8 б) +56 в) +26 г) +16.
А.2.Атомы углерода и кремния:
а) находятся в одном периоде
б) имеют одинаковое число электронов
в) имеют одинаковое число электронных слоёв
г) имеют одинаковое число электронов на внешнем энергетическом
А.3. Число р-электронов у атома азота:
а) 5 б) 10 в) 3 г) 8.
А.4. Максимальное число электронов на 2 энергетическом уровне:
а) 8
б) 14
в) 10
г) 2
А.5.Максимальное число электронов на р-орбитали:
а) 3 б) 6 в) 2 г) 10.
А.6. В порядке возрастания окислительных свойств расположены следующие элементы:
а) магний, калий, кремний, алюминий
б) калий, магний, кальций, кремний
в) калий, кальций, магний, кремний
г) кремний, алюминий, магний, натрий.
А.7. Основные свойства оксидов у элементов главных подгрупп сверху вниз:
а) уменьшаются
б) увеличиваются
в) сначала увеличиваются, а потом уменьшаются
г) не изменяются.
А.8.Число электронных слоёв у элементов одного периода
а) разное
б) одинаковое
в) совпадает с порядковым номером
г) нет правильного ответа.
А.19. Наибольший радиус атома имеет элемент с порядковым номером:
а) 12 б) 56 в) 4 г) 20
Б. 1. Написать электронную и электронно-графическую формулу атома с порядковым номером 13, дать классификацию элемента по двум признакам, подчеркнуть валентные электроны.
1. Написать электронную и электронно-графическую формулу атома с порядковым номером 13, дать классификацию элемента по двум признакам, подчеркнуть валентные электроны.
ТЕСТ 1.
10 КЛАСС.
ПЕРИОДИЧЕСКИЙ ЗАКОН. СТРОЕНИЕ АТОМА.
ВАРИАНТ 4.
А.1. Число электронов у атома брома:
а) 80 б) 18 в) 35 г) 45.
А.2. Максимальное число электронов на р — орбиталях:
а) 5 б) 2 в) 6 г) 10.
А.3. Число электронов у атома хлора на внешнем энергетическом уровне:
а) 3 б) 6 в) 5 г)7
А.4. Максимальное число электронов на внешнем энергетическом уровне:
а) 8
б) 6
в) 2
г) 10
А.5. Число неспаренных электронов в атоме фосфора:
а) 5 б) 7 в) 10 г) 3.
А.6. Неметаллические свойства по периоду слева направо:
а) увеличивается
б) уменьшается
в) не изменяется
г) вначале увеличивается, а потом уменьшается.
А.7. В каком ряду химические элементы расположены в порядке увеличения их атомных радиусов:
а) фосфор – сера – кремний
б) кремний – фосфор – сера
в) сера – фосфор – кремний
г) кремний – сера – фосфор.
А 8. Какова формула высшего оксида элемента 2 периода, в атоме которого в основном состоянии содержится три неспаренных электрона:
а ) Э2О3 б) Э2О5 в) ЭО2 г) Э2О7.
А.9. Основные свойства оксидов по группе А сверху вниз:
а) уменьшаются
б) не изменяются
в) увеличиваются
г) нет правильного ответа.
Б.1. Построить электронную и электронно-графическую формулу элемента с порядковым номером 22, дать классификацию элемента по двум признакам, подчеркнуть валентные электроны.
ТЕСТ 1.
10 КЛАСС.
ПЕРИОДИЧЕСКИЙ ЗАКОН. СТРОЕНИЕ АТОМА.
ВАРИАНТ 5.
А.1. Химические элементы, в атомах которых одинаковое число энергетических слоёв, расположены в ряду:
а ) К, Na, Li б) Са, Мg, Al в) Аl, Si, Р г) S, Cr, Se.
А.2. Число энергетических слоёв и число электронов во внешнем энергетическом слое атома алюминия равны соответственно:
а) 4, 6 б) 3, 3 в) 4, 5 г) 3, 7.
А.3. К s – элементам относится:
а) алюминий б) бериллий в) углерод г) бор.
А.4. Максимальное число электронов на одной орбитали:
а) 6 б) 10 в) 2 г) 1.
А.5. Наибольшее число протонов в атоме элемента:
а) алюминий
б) хлор
в) ванадий
г) бром
А.6. Наибольший радиус имеет атом:
а) азот б) висмут в) сурьма г) мышьяк.
А.7. Неметаллические свойства элементов А — групп усиливаются:
а) слева направо в периодах и в группах сверху вниз
б) справа налево в периодах и в группах сверху вниз
в) справа налево в периодах и в группах снизу вверх
г) слева направо в периодах и в группах снизу вверх.
А.8. Наибольшие кислотные свойства проявляет оксид:
а) SO3 б) SiO2 в) Р2О5 г) Сl2O7.
А.9. Электроотрицательность элементов по периоду слева направо:
а) увеличивается
б) уменьшается
в) не изменяется
г) сначала уменьшается, а затем увеличивается.
Б.1. Построить электронную и электронно-графическую формулу атома кремния, дать классификацию элементу по двум признакам, подчеркнуть валентные электроны.
ТЕСТ 1.
10 КЛАСС.
ПЕРИОДИЧЕСКИЙ ЗАКОН. СТРОЕНИЕ АТОМА.
ВАРИАНТ 6.
А.1. Число электронов у элемента 25:
а) 25 б) 2 в) 7 г) 1.
А.2. Элемент, в состав атома которого входят 42 нейтрона это:
а) титан б) алюминий в) молибден г) мышьяк.
А.3. Количество электронов на одной s — орбитали:
а) 10
б) 8
в) 6
г) 2
А. 4. В каком ряду указаны символы элементов соответственно s-, p- и р –семейств?
4. В каком ряду указаны символы элементов соответственно s-, p- и р –семейств?
а ) Na, Mg, Cl б) Н, О, Р в) Н, N, К г) В, С, О.
А.5. Число спаренных электронов у атома серы:
а) 2 б) 4 в) 10 г) 14.
А 6. Электронная формула внешнего слоя атомов наиболее активного металла:
а) 2s1 б) 3s1 в) 3s2 г) 3s23p1.
А.7. Восстановительные свойства элементов уменьшается в ряду:
а) литий, калий, цезий
б) калий, цезий, литий
в) цезий, калий, литий
г) литий, калий, кальций
А.8. Основные свойства оксидов по периоду слева направо:
а) увеличиваются
б) уменьшаются
в) не изменяются
г) нет правильного ответа.
А.9.Летучее водородное соединение элемента с порядковым номером 34 соответствует общей формуле:
а) Rh5 б) Н2R в) НR г) Rh4.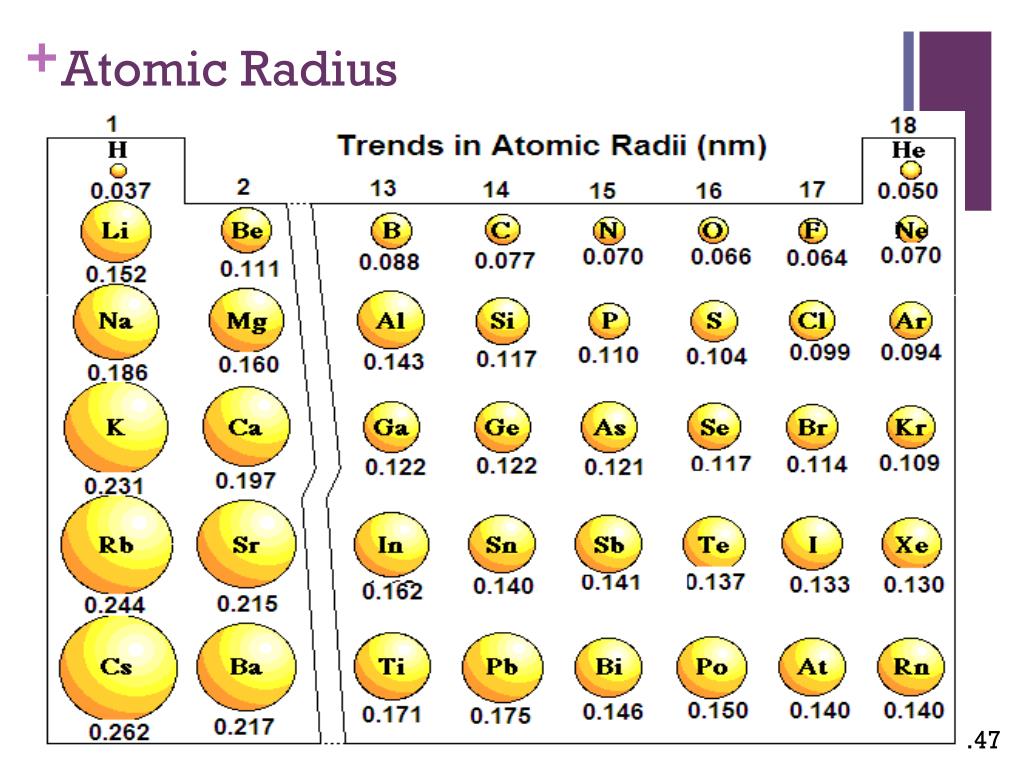
Б.1. Построить электронную и электронно-графическую формулу атома с порядковым номером 24, подчеркнуть валентные электроны, дать классификацию элементу по двум признакам.
ТЕСТ 1.
10 КЛАСС.
ПЕРИОДИЧЕСКИЙ ЗАКОН. СТРОЕНИЕ АТОМА.
ВАРИАНТ 7.
А.1. Число электронов на внешнем уровне атома цинка:
а ) 65 б) 30 в) 2 г) 4.
А.2. Сколько всего орбиталей содержится на третьем энергетическом уровне:
а) 2 б) 4 в) 5 г) 9.
А.3. Число нейтронов в атоме иода:
а) 73
б) 53
в) 74
г) 127
А.4. К р — элементам относятся элементы:
а) 1-2 групп главных подгрупп
б) 1-3 периода
в) 3-8 групп главных подгрупп
г) побочных подгрупп.
А.5. Число s-, р-орбиталей соответствуют ряду чисел:
а) 2, 6 б) 1, 3 в) 3, 2 г) 6, 10.
А.6. Металлические свойства наиболее ярко выражены у элемента с порядковым номером:
а) 20 б) 4 в) 56 г) 12.
А.7. Восстановительные свойства уменьшается в ряду:
а) Сl, P, Si б) N, O, F в) О, Se, S г) Cl, P, S.
А.8. Наибольший радиус атома имеет элемент с порядковым номером:
а) 18 б) 14 в) 11 г) 19.
А.9. Среди следующих оксидов наиболее сильными кислотными свойствами обладает:
а) Р2О5 б) Аs2O5 в) N2O5 г) Sb2O5.
Б.1. Построить электронную и электронно-графическую формулу атома с порядковым номером 29, дать характеристику элемента по двум признакам, подчеркнуть валентные электроны.
ТЕСТ 1.
10 КЛАССС.
ПЕРИОДИЧЕСКИЙ ЗАКОН. СТРОЕНИЕ ТОМА.
ВАРИАНТ 8.
А.1. Число протонов в ядре у атома бария:
а) 56 б) 137 в) 81 г) 57.
А.2. С увеличением номера энергетического уровня энергия электрона:
а) не изменяется
б) уменьшается
в) увеличивается
г) не знаю.
А.3. В каком ряду указаны символы элементов соответственно р -, s-, р-семейств:
а) К, V, Se б) Se, K, С в) Na, Al, Cl г) Se, V, K.
А.4. Число неспаренных электронов у атома с порядковым номером 17:
а) 1 б) 3 в) 7 г) 17.
А.5. Максимальное число электронов на одной р — орбитали:
а) 3
б) 8
в) 2
г) 6
А.6. Наибольшую электроотрицательность имеет атом:
а) германия б) углерода в) олова г) кремния.
А.7. Кислотные свойства оксидов элементов одного периода слева направо:
а) уменьшаются
б) увеличиваются
в) не изменяются
г) нет правильного ответа.
А.8. Формула высшего оксида элемента, имеющего электронную конфигурацию внешнего уровня 2s22р4 :
а) Э2О3 б) ЭО2 в) ЭО3 г) Э2О7.
А. 10. Основные свойства гидроксидов возрастают в ряду:
10. Основные свойства гидроксидов возрастают в ряду:
а ) Мg(OH)2, Ca(OH)2, Zn(OH)2
б) Mg(OH)2, Al(OH)3, Ca(OH)2
в) Са(ОН)2, КОН, Сu(OH)2
г) Mg(OH)2, NaOH, RbOH.
Б.1. Построить электронную формулу и электронно-графическую формулу атома с порядковым номером 32, дать характеристику элемента по двум признакам, подчеркнуть валентные электроны.
ТЕСТ 1.
10 КЛАСС.
ПЕРИОДИЧЕСКИЙ ЗАКОН. СТРОЕНИЕ АТОМА.
ВАРИАНТ 9.
А.1. Число протонов в ядре атома с порядковым номером 76:
а) 190 б) 76 в) 114 г)32.
А.2. Атом какого элемента в основном состоянии содержит два неспаренных электрона на внешнем слое:
а) магний б) фтор в) углерод г) фосфор.
А.3. Максимальное число электронов на s –орбитали:
а) 1 б) 2 в) 3 г) 4.
А.4. Наибольшее число нейтронов у атома:
а) фосфора
б) калия
в) хрома
г) брома
А. 5. К семейству р-элементов относится:
5. К семейству р-элементов относится:
а) водород б) магний в) железо г) мышьяк.
А.6. Металлические свойства элементов в ряду К – Na – Mg – Al :
а) увеличиваются
б) не изменяются
в) уменьшаются
г) сначало увеличиваются,а потом уменьшаются.
А.7. Элемент, высший оксид которого имеет формулу RO находится:
а) во втором периоде
б) во второй группе
в) имеет атомный номер два
г) в четвертом периоде.
А.8. В каком ряду элементы расположены в порядке увеличения их атомных радиусов:
а) кальций – магний – бериллий
б) сера – хлор – аргон
в) литий – натрий — калий
г) литий – бериллий – бор.
А.9. В одном периоде находятся элементы с одинаковым:
а) числом валентных электронов
б) числом энергетических уровней
в) зарядом ядер
г) числом электронов.
Б.1. Построить электронную и электронно-графическую формулу атома 20, дать характеристику атома по двум типам классификации, подчеркнуть валентные электроны.
ТЕСТ 1.
10 КЛАСС.
ПЕРИОДИЧЕСКИЙ ЗАКОН. СТРОЕНИЕ АТОМА.
ВАРИАНТ 10.
А.1. К электронному р-семейству относится элемент:
а) хром б) германий в) литий г) кальций.
А.2. Число электронов на внешнем энергетическом уровне у элемента с порядковым номером 33:
а) 4 б) 33 в) 5 г) 75.
А.3. Число протонов у атома бария:
а) 82
б) 81
в) 56
г) 137
А.4. Элемент, имеющий 30 нейтронов в ядре это:
а) аргон б) кальций в) германий г) марганец.
А.5. Максимальное число неспаренных электронов на р-орбитали:
а) 5 б) 6 в) 3 г) 10.
А.6. Электронная конфигурация внешнего энергетического уровня атома, имеющего наибольший радиус, — это:
а) 2s2 б) 3s23p4 в) 3s2 г) 2s22p2.
А.7. Способность атомов отдавать электроны увеличивается в ряду:
а ) Ве, Мg, Na б) Аl, Mg, В в) S, Se, Р г) Si, Al, C.
А.8. Основные свойства оксидов у элементов главных подгрупп сверху вниз:
а) не изменяются
б) уменьшаются
в) увеличиваются
г) не знаю.
А.9. Кислотные свойства гидроксидов возрастают в ряду:
а ) Аl(OH)3, h4BO3, Be(OH)2
б) h4PO4, HNO3, h3CO3
в) h3SiO3, h3CO3, HNO3
г) h4PO4, h3SiO3, h3CO3.
Б.1. Построить электронную и электронно-графическую формулу атома с порядковым номером 34, дать характеристику элемента по двум признакам, подчеркнуть валентные электроны.
размер атомов
размер атомовСамые большие и самые маленькие атомы.
Что значит измерить «размер» атома?
Атом не похож на бильярдный шар. Мы знаем, что у него есть положительно заряженный центр (ядро), окруженный движущимися электронами. Атом также не похож на миниатюрную солнечную систему, хотя иногда полезно думать об этом, что электроны в атомах не движутся по обычным орбитам. Они встречаются в облаках.
Расстояние между центральным зарядом и самым внешним электроном.
Атом также не похож на миниатюрную солнечную систему, хотя иногда полезно думать об этом, что электроны в атомах не движутся по обычным орбитам. Они встречаются в облаках.
Расстояние между центральным зарядом и самым внешним электроном.
заставить их сформировать кристалл. Атомы в кристалле расположены упорядоченно. Я пропускаю рентгеновские лучи через кристалл на датчик, такой как лист фотопленки, узор из пятен. По этому образцу ученые могут определить расстояние между атомами и от них,
| Элемент | Символ | Атомный номер | Атомный радиус в нанометрах |
|---|---|---|---|
| водород | Х | 1 | 0,037 |
| гелий | Он | 2 | 0,05 |
| литий | Ли | 3 | 0,152 |
| бериллий | Быть | 4 | 0,111 |
| бор | Б | 5 | 0,088 |
| уголь | С | 6 | 0,077 |
| азот | Н | 0,070 | |
| кислород | О | 8 | 0,066 |
| фтор | Ф | 9 | 0,064 |
| неон | Не | 10 | 0,070 |
| натрий | На | 11 | 0,186 |
| магний | Мг | 12 | 0,160 |
| алюминий | Ал | 13 | 0,143 |
| кремний | Си | 14 | |
| фосфор | Р | 15 | 0,110 |
| сера | С | 16 | 0,104 |
| хлор | Кл | 17 | 0,099 |
| аргон | Ар | 18 | 0,094 |
| калий | К | 19 | 0,231 |
| кальций | Са | 20 | 0,197 |
| скандий | Ск | 21 | |
| титан | Ти | 22 | 0,146 |
| ванадий | В | 23 | 0,134 |
| хром | Кр | 24 | 0,127 |
| марганец | Мн | 25 | 0,126 |
| железо | Фе | 26 | 0,126 |
| кобальт | Со | 27 | 0,125 |
| никель | Никель | 28 | |
| медь | Медь | 29 | 0,128 |
| цинк | Цин | 30 | 0,138 |
| галлий | Га | 31 | 0,122 |
| германий | Гэ | 32 | 0,122 |
| мышьяк | Как | 33 | 0,121 |
| селен | Se | 34 | 0,117 |
| бром | Бр | 35 | 0,114 |
| криптон | Кр | 36 | 0,109 |
| рубидий | руб | 37 | 0,244 |
| стронций | ул. | 38 | 0,215 |
| иттрий | Д | 39 | 0,180 |
| цирконий | Зр | 40 | 0,160 |
| ниобий | № | 41 | 0,146 |
| молибден | Мо | 42 | 0,139 |
| технеций | Тк | 43 | 0,136 |
| рутений | Ру | 44 | 0,134 |
| родий | Рх | 45 | 0,134 |
| палладий | ПД | 46 | 0,137 |
| серебро | Аг | 47 | 0,144 |
| кадмий | CD | 48 | 0,154 |
| индий | 49 | 0,162 | |
| банка | Сн | 50 | 0,140 |
| сурьма | Сб | 51 | 0,141 |
| теллур | Те | 52 | 0,137 |
| йод | я | 53 | 0,133 |
| ксенон | Хе | 54 | 0,130 |
| цезий | Cs | 55 | 0,262 |
| барий | 56 | 0,217 | |
| лантан | Ла | 57 | 0,187 |
| церий | Се | 58 | 0,182 |
| празеодим | Пр | 59 | 0,182 |
| неодимовый | Нд | 60 | 0,182 |
| прометий | вечера | 61 | |
| самарий | См | 62 | |
| европий | 63 | 0,204 | |
| гадолиний | Гд | 64 | 0,179 |
| тербий | Тб | 65 | 0,177 |
| диспрозий | Дай | 66 | 0,177 |
| гольмий | Хо | 67 | 0,176 |
| эрбий | Er | 68 | 0,175 |
| тулий | Тм | 69 | 0,174 |
| иттербий | Ыб | 70 | |
| лютеций | Лу | 71 | 0,174 |
| гафний | Хф | 72 | 0,158 |
| тантал | Та | 73 | 0,146 |
| вольфрам | Вт | 74 | 0,139 |
| рений | перед | 75 | 0,137 |
| осмий | ОС | 76 | 0,135 |
| иридий | Ир | 77 | 0,136 |
| платина | Пт | 78 | 0,138 |
| золото | Золото | 79 | 0,144 |
| ртуть | рт.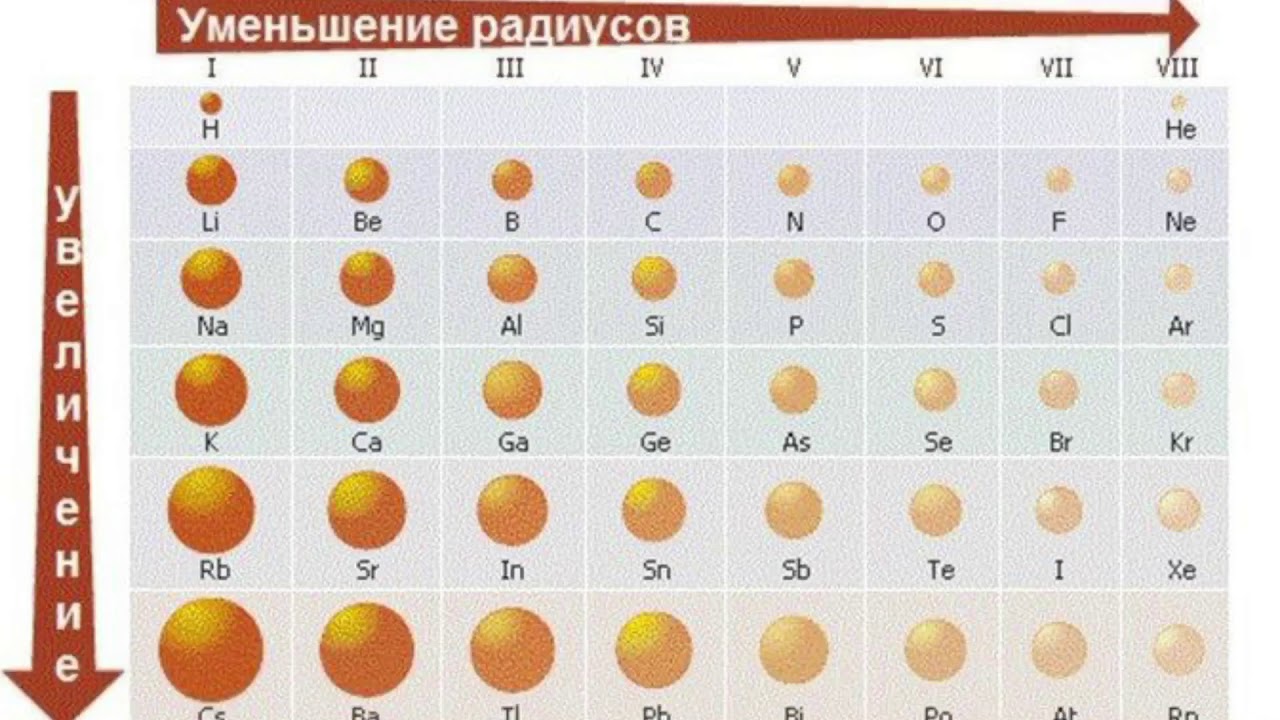 ст. ст. | 80 | 0,157 |
| таллий | Тл | 81 | 0,171 |
| свинец | Пб | 82 | 0,175 |
| висмут | Би | 83 | 0,146 |
| полоний | ПО | 84 | 0,15 |
| астат | В | 85 | 0,14 |
| радон | РН | 86 | 0,14 |
| франций | Пт | 87 | 0,27 |
| радий | Ра | 88 | 0,220 |
| актиний | Ас | 89 | 0,1065¹ |
| торий | Т | 90 | 0,180 |
| протактиний | Па | 91 | |
| уран | У | 92 | 0,14 |
| нептуний | Нп | 93 | |
| плутоний | Пу | 94 | |
| америций | Ам | 95 | |
| курий | См | 96 | |
| берклиум | Бк | 97 | |
| Калифорния | См.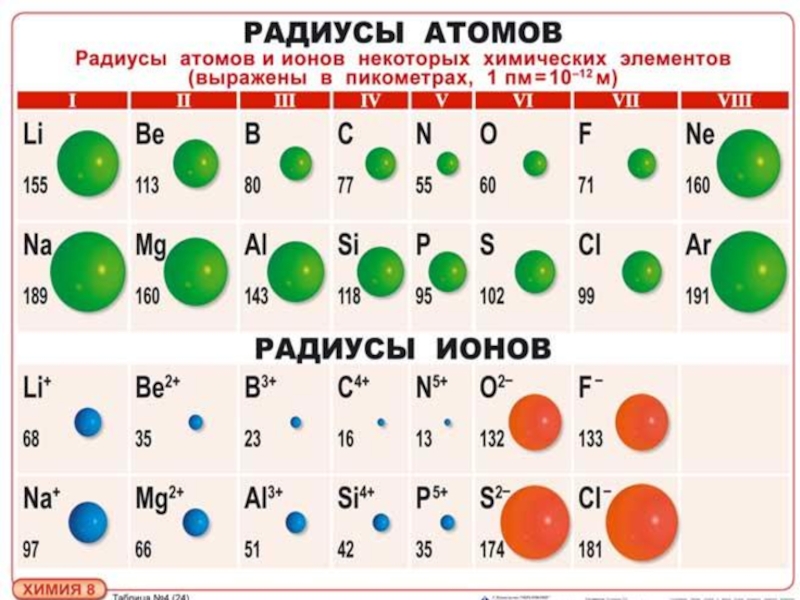 | 98 | |
| эйнштейний | Эс | 99 | |
| фермий | фм | 100 | |
| менделевий | Мд | 101 | |
| нобелий | № | 102 | |
| Лоуренсиум | Лр | 103 | |
| резерфордий | Рф | 104 | |
| дубний | Дб | 105 | |
| сиборгиум | Сг | 106 | |
| борий | Бх | 107 | |
| хассиум | Гс | 108 | |
| мейтнерий | Мт | 109 | |
| Дармштадциум | Дс | 110 | |
| рентгений | Рг | 111 | |
| коперниций | Сп | 112 | |
| нихоний | Нх | 113 | |
| флеровий | Фл | 114 | |
| московиум | Мк | 115 | |
| ливерморий | ур.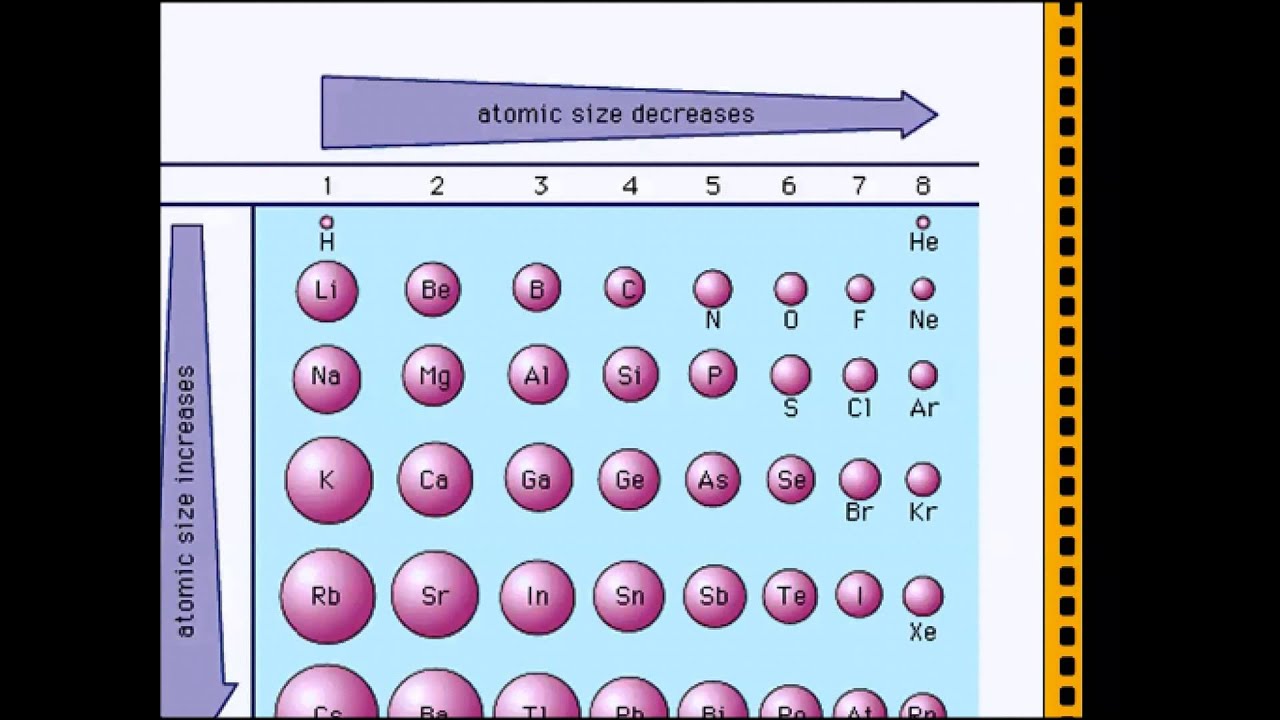 | 116 | |
| теннессин | Ц | 117 | |
| оганесон | Ог | 118 |
источники
1. Готье Ж.-П.Деблонд, Маврик Заварин и Энни Б. Керстинг.
Координационные свойства и ионный радиус актиния: загадка 120-летней давности.
Координационные обзоры по химии , vol. 446 , 1 ноября 2021 г., 214130
doi.org/10.1016/j.ccr.2021.214130
2. Р. Д. Шеннон.
Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах.
Acta Crystallographica , раздел A. 32 (5), стр. 751–767, (1976).
doi.org/10.1107/S0567739476001551.
ресурсов
www.rsc.org/periodic-table/
Содержание и дизайн этого сайта созданы Королевским
Химическое общество (Великобритания) действительно исключительны. Обязательно посмотрите видеоролики.
Обязательно посмотрите видеоролики.
Текущая версия как минимум вторая. Анимации в оригинале были огромными для того времени (водорода было около 12 мегабайт), поэтому их загрузка и сохранение были разумным использованием пропускной способности — или можно было купить компакт-диск за 37 долларов (20 фунтов). Теперь поток видео и компакт-диск больше не предлагаются. Нам жаль, что мы не сохранили одно из первых видео для сравнения.
Филип Болл.
Ингредиенты. Экскурсия по элементам.
Издательство Оксфордского университета, 2003 г.
Джон Эмсли.
Строительные блоки природы. Путеводитель по элементам от А до Я .
Издательство Оксфордского университета, 2002 г.
Извините. Для этой страницы нет информации об участниках.
Copyright © Sizes, Inc., 2000–2019. Все права защищены.
Последняя редакция: 27 мая 2019 г.
Какой элемент имеет наименьший атомный радиус?
Ответ
Проверено 245,4 тыс.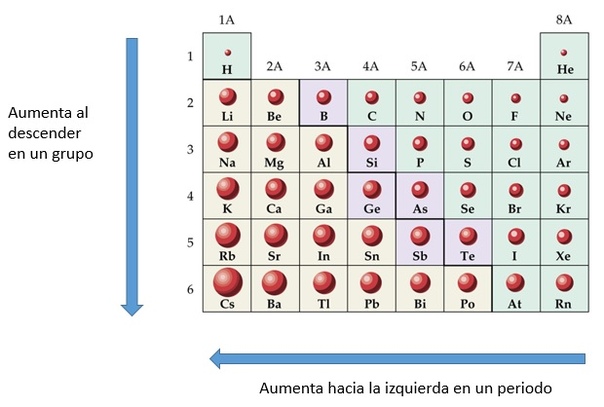 + просмотров
+ просмотров
Полный пошаговый ответ:
Атомные радиусы сильно различаются в зависимости от множества факторов.
Двигаясь снизу вверх по вертикали в группе атомный радиус увеличивается, так как происходит увеличение количества оболочек или орбиталей. Это означает, что количество оболочек увеличивается на единицу по мере того, как мы спускаемся на один шаг вниз, и, следовательно, увеличивается расстояние от радиуса, которое в основном является расстоянием между электроном и ядром. Из-за этого притяжение между ними также уменьшается, и, следовательно, легче удалять электроны, когда мы опускаемся.
Кроме того, когда мы движемся слева направо по горизонтали, атомные радиусы уменьшаются по мере увеличения числа электронов, из-за этого увеличивается притяжение между электронами и ядром, и это уменьшает радиус.

 Максимальное число электронов, занимающих 3s — орбиталь:
Максимальное число электронов, занимающих 3s — орбиталь: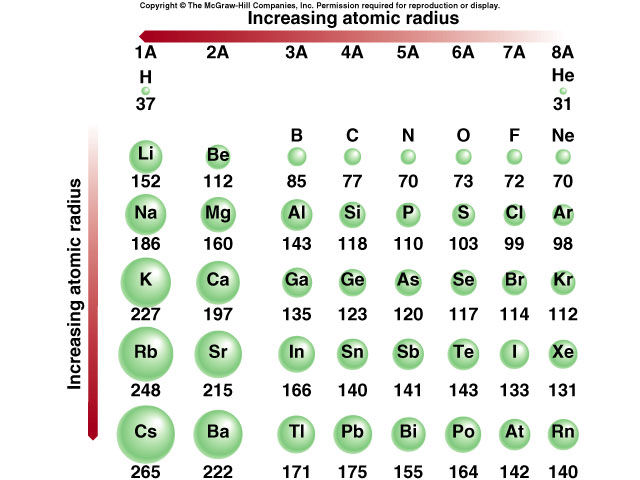 Из формул веществ, формулы которых приведены ниже, выпишите формулы веществ, молекулы которых образованы ковалентной полярной связью
Из формул веществ, формулы которых приведены ниже, выпишите формулы веществ, молекулы которых образованы ковалентной полярной связью Максимальное число электронов, занимающих p— подуровнь:
Максимальное число электронов, занимающих p— подуровнь: Электронная формула атома 1s22s22p63s23p63d104s24p3. Какому элементу она соответствует?
Электронная формула атома 1s22s22p63s23p63d104s24p3. Какому элементу она соответствует? ионная
ионная
Leave A Comment