Оксид азота(III) | ChemToday — химический портал
Оксид азота(III) — промежуточный оксид азота в степени окисления +3, формула которого — \(\ce{N2O3}\).
Внешне он представляет из себя жидкость тёмно-синего цвета, устойчивую при температурах менее 0°C:
Капли жидкого оксида азота(III) на стенках пробиркиN2O3 в U-образной трубкеПолучение
Получить данный оксид азота можно из двух газов — оксидов азота, имеющих соседние с +3 степени окисления: монооксид и диоксид азота при охлаждении льдом, сухим \(\ce{CO2}\) или жидким азотом:
$$\ce{NO (g) + NO2 (g) N2O3 (l)}$$
Данную операцию можно проводить в приборе, в котором смесь газов получается реакцией 50%-ной азотной кислоты \(\ce{HNO3}\) с кусочками меди. В результате выделяется как \(\ce{NO}\) (при понижении концентрации кислоты), так и \(\ce{NO2}\) (при более высокой концентрации азотной кислоты):
$$\ce{Cu + 4HNO_3 -> Cu(NO_3)_2 + 2NO_2 ^ + 2H_2O}$$ $$\ce{3Cu + 8HNO_3 -> 3Cu(NO_3)_2 + 2NO ^ + 4H_2O}$$
Также известен метод получения данной смеси при реакции 50%-ной азотной кислоты с крахмалом:
$$\ce{8HNO3 + C6h20O5 -> 8NO ^ + 6CO2 + 9h3O}$$
$$\ce{24HNO3 + C6h20O5 -> 24NO2 ^ + 6CO2 + 17h3O}$$
Выделяющуюся смесь газов осушают с помощью дегидратирующих агентов, таких как, например, безводный \(\ce{CaCl2}\) или \(\ce{Na2SO4}\). Далее, поступая в охлаждающуюся часть химической установки, газы реагируют между собой, конденсируясь в синюю жидкость — оксид азота(III):
Далее, поступая в охлаждающуюся часть химической установки, газы реагируют между собой, конденсируясь в синюю жидкость — оксид азота(III):
$$\ce{NO (g) + NO2 (g) -> N2O3 (l)}$$
В видео проекта ChemToday вы можете увидеть полный процесс получения этого соединения:
Химические свойства
Оксид азота(III) является ангидридом азотистой кислоты, так как при взаимодействии с водой образует данную кислоту:
$$\ce{N_2O_3 + H_2O -> 2HNO_2}$$
Азотистая кислота неустойчива в водном растворе, и постепенно разлагается, выделяя монооксид и диоксид азота, либо диспропорционируя на азотную кислоту и монооксид азота:
$$\ce{2HNO_2 -> H_2O + NO + NO_2}$$ $$\ce{3HNO_2 -> HNO_3 + 2NO + H_2O}$$
Как кислотный оксид, реагирует со щелочами:
$$\ce{N_2O_3 + 2KOH -> 2KNO_2 + H_2O}$$
Выше нуля градусов по Цельсию соединение подвержено разложению на оксиды азота близких степеней окисления:
$$\ce{N_2O_3 ->[t>0^oC] NO ^ + NO_2 ^}$$
Как и все соединения азота, высокотоксичен, поэтому для работы с ним необходимо соблюдать технику безопасности, в частности, не вдыхать пары соединения.
Чтобы оставить отзыв, обратитесь к разделу «Комментарии» на правой колонке страницы или внизу страницы при просмотре с мобильного телефона.
Спасибо за просмотр!
Степень окисления азота — учимся разбираться
Азот – едва ли не самый распространенный химический элемент во всей Солнечной Системе. Если быть конкретнее, то азот занимает 4 место по распространенности. Азот в природе – инертный газ.
Этот газ не имеет ни цвета, ни запаха, его очень трудно растворить в воде. Однако соли-нитраты имеют свойство очень хорошо реагировать с водой. Азот имеет малую плотность.
Азот – удивительный элемент. Есть предположение, что свое название он получил из древнегреческого языка, что в переводе с него значит «безжизненный, испорченный». Отчего же такое негативное отношение к азоту? Ведь нам известно, что он входит в состав белков, а дыхание без него практически невозможно. Азот играет важную роль в природе. Но в атмосфере этот газ инертен. Если его взять таким, какой он есть в первозданном виде, то возможно множество побочных эффектов. Пострадавший может даже умереть от удушья. Ведь азот оттого и называется безжизненным, что не поддерживает ни горения, ни дыхания.
Пострадавший может даже умереть от удушья. Ведь азот оттого и называется безжизненным, что не поддерживает ни горения, ни дыхания.
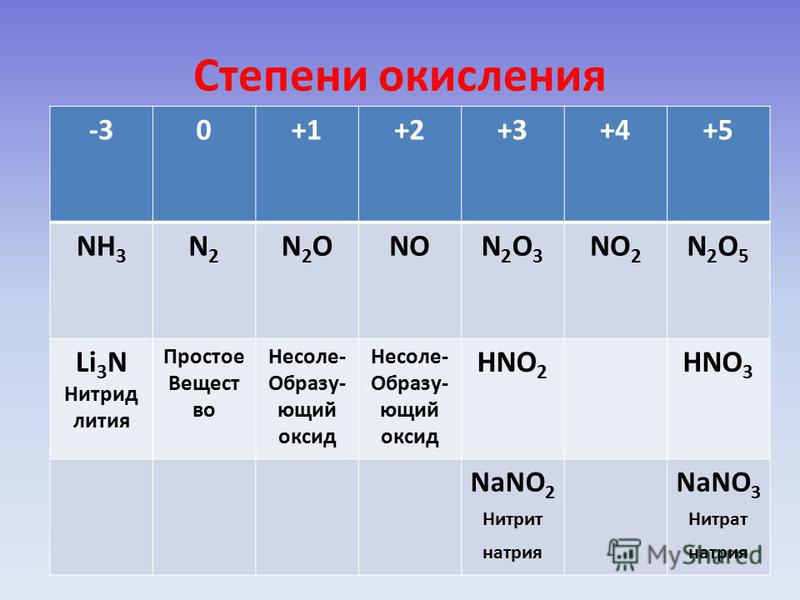
При обычных условиях такой газ реагирует только с литием, образовывая такое соединение, как нитрид лития Li3N. Как мы видим, степень окисления азота в таком соединении равна -3. С остальными металлами и веществами азот, конечно же, реагирует тоже, однако лишь при нагревании или при использовании различных катализаторов. К слову говоря, -3 – низшая степень окисления азота, так как только 3 электрона нужны для полного заполнения внешнего энергетического уровня.
Этот показатель имеет разнообразные значения. Каждая степень окисления азота имеет свое соединение. Такие соединения лучше просто запомнить.
Итак, степень окисления -3 может быть у нитридов. Степень окисления азота в аммиаке также равна -3, как бы это ни звучало парадоксально. Аммиак представляет собой бесцветный газ с очень резким запахом. Вспомните нашатырный спирт. В его состав также входит аммиак Nh4. Выпускают даже лекарственные препараты с содержанием аммиака. В основном они показаны при обмороках, головокружениях, сильных алкогольных опьянениях. Резкий запах быстро приводит в чувства в пострадавшего. Еще бы, ведь он готов сделать что угодно, лишь бы от него убрали эту «вонючку».
Выпускают даже лекарственные препараты с содержанием аммиака. В основном они показаны при обмороках, головокружениях, сильных алкогольных опьянениях. Резкий запах быстро приводит в чувства в пострадавшего. Еще бы, ведь он готов сделать что угодно, лишь бы от него убрали эту «вонючку».
Редко встречаются такие степени окисления азота, как -1 и -2. Первая встречается в так называемых пернитридах, среди которых особенно стоит отметить N2h3. Последняя степень окисления встречается в соединении Nh3OH. Такое сложное вещество представляет собой очень слабое неустойчивое основание. Применяется в основном в органическом синтезе.
Перейдем к высшим степеням окисления азота, коих тоже очень даже немало. Степень окисления азота +1 встречается в таком соединении, как веселящий газ (N2O). При малом количестве такого газа практически не наблюдается никаких побочных воздействий. Нередко он используется в малых дозах для наркоза. Однако если время вдыхания этого газа является достаточно длительным, то возможна смерть от удушения.
Степень окисления +2 встречается в соединении NO. Степень окисления +3 – в оксиде N2O3. Степень окисления +4 – в оксиде NO2. Такой газ имеет красно-бурый оттенок и острый запах. Является кислотным оксидом.
+5 – высшая степень окисления у азота. Встречается в азотной кислоте и во всех солях-нитратах.
A. \\[{{\\text{N}}_{\\text{2}}}{\\text{O}}\\]B. \\[{\\текст{НЕТ}}\\]С. \\[{{\\text{N}}_{\\text{2}}}{{\\text{O}}_{\\text{3}}}\\] Д. \\[{ {\\text{N}}_{\\text{2}}}{{\\text{O}}_{\\text{4}}}\\]
Дата последнего обновления: 07 марта 2023 г.
•
Всего просмотров: 250,5K
•
Просмотры сегодня: 6,32K
Ответ
Проверенные
250,5K+ виды
Подсказка: Рассчитайте количество окисления атт -атмос. оксиды азота. Затем найдите оксид азота, который имеет ту же степень окисления азота, что и азотистая кислота.
Полный ответ:
Вы можете записать химический символ азотистой кислоты как \[{\text{HN}}{{\text{O}}_{\text{2}}}\] .
Пусть X — степень окисления атомов азота в азотистой кислоте. Степени окисления водорода и кислорода равны +1 и -2 соответственно.
В нейтральной молекуле сумма степеней окисления всех элементов равна нулю.
Рассчитайте степень окисления атомов азота в азотной кислоте.
\[
\Rightarrow {\text{1 + X + 2}}\left( { — 2} \right) = 0 \\
\Стрелка вправо 1 + {\text{X}} — 4 = 0 \\
\Стрелка вправо {\text{X}} — 3 = 0 \\
\Стрелка вправо {\text{X}} = + 3
\]
Следовательно, степень окисления атомов азота в азотистой кислоте равна +3.
Пусть X будет степенью окисления атомов азота в \[{{\text{N}}_{\text{2}}}{\text{O}}\] . Степень окисления кислорода равна -2
Рассчитайте степень окисления атомов азота в \[{{\text{N}}_{\text{2}}}{\text{O}}\] .
\[
\Rightarrow {\text{2X + 2}}\left( { — 2} \right) = 0 \\
\Стрелка вправо 2{\text{X}} — 4 = 0 \\
\Стрелка вправо {\text{2X}} — 4 = 0 \\
\Стрелка вправо {\text{X}} = + 2
\]
Следовательно, степень окисления атомов азота в \[{{\text{N}}_{\text{2}}}{\text{O}}\] равна +2.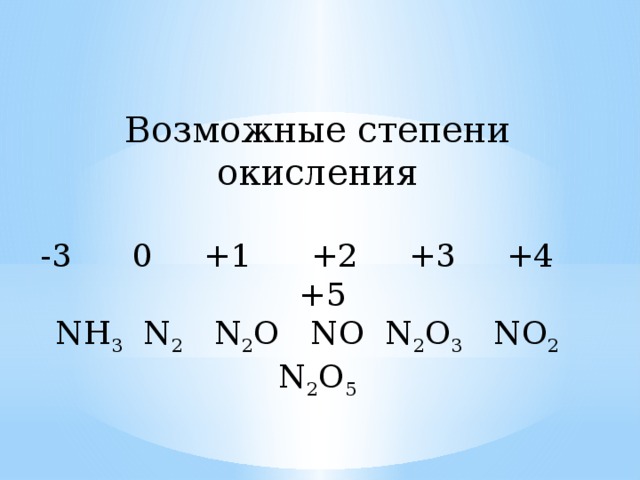
Пусть X — степень окисления атомов азота в \[{\text{NO}}\] . Степень окисления кислорода равна -2
. В нейтральной молекуле сумма степеней окисления всех элементов равна нулю.
Рассчитайте степень окисления атомов азота в \[{\text{NO}}\] .
\[
\Rightarrow {\text{X +}}\left({ — 2} \right) = 0 \\
\Rightarrow {\text{X}} — 2 = 0 \\
\Rightarrow {\text {X}} = + 2
\]
Следовательно, степень окисления атомов азота в \[{\text{NO}}\] равна +2.
Пусть X будет степенью окисления атома азота в \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{3}}}\] . Степень окисления кислорода равна -2
. В нейтральной молекуле сумма степеней окисления всех элементов равна нулю.
Рассчитайте степень окисления атома азота в \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{3}}}\] .
\[
\Rightarrow {\text{2X + 3}}\left( { — 2} \right) = 0 \\
\Rightarrow {\text{2X}} — 6 = 0 \\
\Rightarrow {\ text{2X}} = + 6 \\
\Rightarrow {\text{X}} = + 3
\]
Следовательно, степень окисления атома азота в \[{{\text{N}}_{\text {2}}}{{\text{O}}_{\text{3}}}\] равно +3.
\[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}\]
Пусть X — степень окисления атома азота в \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}\] . Степень окисления кислорода -2
В нейтральной молекуле сумма степеней окисления всех элементов равна нулю.
Рассчитайте степень окисления атома азота в \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}\] .
\[
\Rightarrow {\text{2X + 4}}\left( { — 2} \right) = 0 \\
\Rightarrow {\text{2X}} — 8 = 0 \\
\Rightarrow {\ text{2X}} = + 8 \\
\Rightarrow {\text{X}} = + 4
\]
Следовательно, степень окисления атома азота в \[{{\text{N}}_{\text {2}}}{{\text{O}}_{\text{4}}}\] равно +4.
Степень окисления азота одинакова в азотистой кислоте и в \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{3}}} \]
Следовательно, ангидрид азотистой кислоты равен \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{3}}}\]
Следовательно, правильным вариантом является вариант C.
Примечание:
Когда одна молекула \[{{\text{N}}_{\text{2}}}{{\text{O}}_ {\text{3}}}\] реагирует с одной молекулой воды, образуя две молекулы азотистой кислоты.
\[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{3}}} + {\text{ }}{{\text{H }}_2}{\text{O}} \to {\text{2 HN}}{{\text{O}}_{\text{2}}}\]
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды A Химический состав кальция класса 12 JEE_Main
Тенденции сомнения
Примечания по триоксиду азота, N2O3 2
). Для настоящего ангидрида можно ожидать другую структуру O=N–O–N=O, но этот изомер не найден. Азотистая кислота разлагается на окись азота и азотную кислоту, если ее не использовать немедленно. Когда N 2 O 3 добавляют в раствор основания, могут образовываться нитритные соли:
Для настоящего ангидрида можно ожидать другую структуру O=N–O–N=O, но этот изомер не найден. Азотистая кислота разлагается на окись азота и азотную кислоту, если ее не использовать немедленно. Когда N 2 O 3 добавляют в раствор основания, могут образовываться нитритные соли:2 NaNO 2 + H 2 O + N 2 O 3 One 90 азот 2 в степени окисления +3 здесь. Триоксид азота, как и другие оксиды азота, присутствует в природе как часть азотного биогеохимического цикла планеты. Азот может присутствовать в воздухе, океанах и реках, а также в почве.
Формула триоксида азотаN 2 O 3 — его химическая формула.
При смешивании воды и нестабильной азотистой кислоты образуется ангидрид. HNO 2 (азотистая кислота) можно разложить на азотную кислоту и оксид азота. Смешивание N 2 O 3 с растворами оснований может привести к образованию нитритных солей: Ниже приведен пример уравнения: О
Полуторная закись азота имеет моноизотопную массу 75,991 грамма на моль и точную массу 75,991 грамма на моль. Общее количество доноров водородной связи равно нулю, а общее количество акцепторов водородной связи равно четырем. Число ковалентно связанных звеньев равно единице в этом соединении, которое канонизировано.
Общее количество доноров водородной связи равно нулю, а общее количество акцепторов водородной связи равно четырем. Число ковалентно связанных звеньев равно единице в этом соединении, которое канонизировано.
Химические свойства — это распространенный негорючий окислитель, но он может вызывать пламя в сочетании с легковоспламеняющимися соединениями. Он выделяет тепло и продукты, такие как газы, когда реагирует с восстановителями. Продукты могут быть способны вступать в дальнейшие реакции, такие как сгорание в атмосфере. Он также катализирует воспламенение газообразного фосфина. Без надлежащего охлаждения смесь капролактама, растворенного в уксусной кислоте, очень взрывоопасна.
Физические свойства – Имеет темно-синий оттенок газа и легко растворяется в воде. Он имеет температуру кипения 3,5°C, температуру плавления -11,7°C и плотность 1,4 грамма на кубический сантиметр.
Производство триоксида азота Триоксид азота представляет собой темно-синее твердое вещество кислой природы, которое образуется при взаимодействии NO + NO 2 друг с другом. Когда происходит смешивание равных количеств оксида азота и диоксида азота, смесь затем охлаждают до температуры ниже -21°C для создания химического соединения.
Когда происходит смешивание равных количеств оксида азота и диоксида азота, смесь затем охлаждают до температуры ниже -21°C для создания химического соединения.
- Топливо специального назначения содержит N 2 O 3 .
- Это сильный окислитель, который можно использовать в качестве окислителя в сочетании с другими химическими веществами.
- Используется в химической промышленности для производства красок, нейлона и других материалов.
- Из-за своей высокой горючести триокись азота отлично подходит в качестве топлива специального назначения.
- Химикат только способствует горению и не горит сам по себе.


Leave A Comment