Способ получения муравьиной кислоты, свободной от метанола
Использование: получение муравьиной кислоты из метанола парофазным окислителем на гетерогенном катализаторе. Сущность изобретения: муравьиную кислоту получают последовательным окислением метанола кислородом воздуха сначала в присутствии оксидного железо-молибденового или железо-хром-молибденового катализатора до формальдегида при 260 — 380oС с использованием секционного реактора, сочетающего трубчатую и адиабатическую секции. Затем доокисление ведут в трубчатом секционном реакторе при 100 — 150oС в присутствии ванадий — титанового, или ванадий-титан-фосфорного, или олово-молибденового катализатора до муравьиной кислоты. Изотермичность слоя катализатора во втором реакторе достигают за счет съема тепла псевдоожиженным слоем дисперсного материала с использованием в качестве теплоносителя воздуха. 1 з. п. ф-лы, 1 ил., 1 табл.
Изобретение относится к способам получения муравьиной кислоты путем двухстадийного каталитического окисления метанола в паро-газовой фазе при атмосферном давлении.
Муравьиная кислота используется для производства лекарственных препаратов, душистых веществ, растворителей при изготовлении кино- и фотопленки, некоторых видов химических волокон. Она применяется при крашении шерстяной и хлопчатобумажной пряжи, при выделке, дублении, крашении и консервировании кожи. Быстрый рост потребления муравьиной кислоты в последние годы связан с ее применением в сельском хозяйстве для консервирования кормов [1, 2] В нашей стране большую часть муравьиной кислоты получают окислением бутана и светлой нафты [3] C4H10 __ CH3-CHH __ CH3CH2COOH+HCOOH однако по оценке зарубежных экспертов этот процесс неперспективен, поскольку используется дорогое сырье, выход муравьиной кислоты и степень ее извлечения недостаточно высоки. Наиболее перспективным представляется процесс получения муравьиной кислоты карбонилированием метанола с последующим гидролизом метилформиата [1] однако в нашей стране этот процесс не реализован.
Другим источником сырья для синтеза муравьиной кислоты через формиат натрия является оксид углерода, получаемый из природного газа [3] NaOH+CO HCOONa HCOOH Этот процесс реализован у нас в стране, недостатком способа является то, что наряду с образованием муравьиной кислоты образуется в большом количестве неорганическая соль, которая требует дальнейшей утилизации, в целом процесс является экологически неблагополучным.
Известно каталитическое превращение метанола в формальдегид [4] известно также, что формальдегид можно окислить в муравьиную кислоту [5] Однако превращение метанола в муравьиную кислоту как каталитический процесс нам не известен. Необходимо отметить, что в связи с использованием муравьиной кислоты в качестве консерванта кормов и, учитывая, что метанол ядовитое вещество, при получении муравьиной кислоты из метанола необходимо прежде всего обеспечить содержание метанола в продукте не более 1 мас. Вторым требованием к процессу является получение раствора муравьиной кислоты в воде с высокой концентрацией в связи со свойством кислоты образовывать с водой азеатропные смеси.
В качестве прототипа была выбрана работа японского ученого Mamoru Ai [6] в которой изучалось превращение формальдегида в муравьиную кислоту на оксидных системах. Источником формальдегида служил формалин. Выход муравьиной кислоты невысокий, наблюдается широкий набор продуктов, обусловленный возможностью протекания реакции по различным направлениям. Анализ результатов работы позволяет выделить как наиболее перспективные молибден и ванадий содержащие оксидные системы для получения муравьиной кислоты окислением формальдегида. Однако и на этих системах реакция протекает неселективно. Выход муравьиной кислоты не превышает 20% основными продуктами реакции являются метилформиат, диметиловый эфир и оксиды углерода.
Технологическая схема получения муравьиной кислоты, приведенная на чертеже, состоит из реактора, испарителя формальдегида и системы анализа. Загрузка катализатора составляет 15 г, расход реагентов формальдегида- кислорода- азота- пара составлял соответственно 7,510-4 410-2 9110-2 2510-2 моль/ч.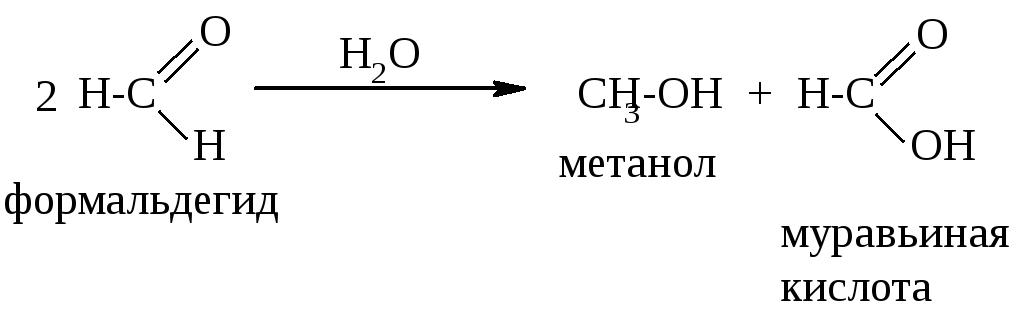 Процесс реализован в лабораторном масштабе.
Процесс реализован в лабораторном масштабе.
Недостатками прототипа являются: низкая селективность процесса по муравьиной кислоте; в работе не рассматривались проблемы теплосъема и масштабного перехода, а малый масштаб установки не позволяет сделать такую оценку.
Изобретение решает задачу разработки нового каталитического способа окисления метанола в муравьиную кислоту, обеспечивающего широкий выход целевого продукта. Эта задача решается путем осуществления процесса получения муравьиной кислоты в две стадии: окисления метанола до формальдегида, обеспечивая практически полное превращение метанола путем использования оксидного катализатора, и окисление формальдегида, образующегося на первой стадии, до муравьиной кислоты.
Предлагаемый процесс получения муравьиной кислоты из метанола осуществляется в паро- газовой фазе при атмосферном давлении и может быть представлен следующей схемой: окислениметанолае ___фоокислениермальдегида ___й Было бы неверным считать, что процесс можно рассматривать как сумму двух независимых стадий. Дело в том, что окислением формальдегида не может быть получена муравьиная кислота, практически не содержащая метанол и с достаточной концентрацией, поскольку формальдегид существует в качестве товарного продукта в виде формалина-37 раствора в воде, с содержанием метанола порядка 1% или 4-11% Кроме того, прямое превращение «свежей» реакционной смеси, содержащей формальдегид, обеспечивает наибольшую реакционную способность формальдегида. Получение муравьиной кислоты из метанола следует рассматривать как единый процесс, обе стадии которого взаимосвязаны.
Дело в том, что окислением формальдегида не может быть получена муравьиная кислота, практически не содержащая метанол и с достаточной концентрацией, поскольку формальдегид существует в качестве товарного продукта в виде формалина-37 раствора в воде, с содержанием метанола порядка 1% или 4-11% Кроме того, прямое превращение «свежей» реакционной смеси, содержащей формальдегид, обеспечивает наибольшую реакционную способность формальдегида. Получение муравьиной кислоты из метанола следует рассматривать как единый процесс, обе стадии которого взаимосвязаны.
Для решения поставленной задачи процесс осуществляют следующим образом.
Воздушно-метанольная смесь заданного состава поступает в первый реактор, загруженный оксидным железом-молибденовым или железо-хром-молибденовым катализатором. Железо-молибденовый катализатор состава Fe2(MoO4)3:MoO3=1:2 (отношения молярные) готовят известным способом соосаждения из растворов азотнокислой соли железа и парамолибдата аммония при постоянном рН=4 раствором аммиака с последующей отмывкой, фильтрацией, сушкой при 90-100оС, прокаливанием при 450оС и формованием.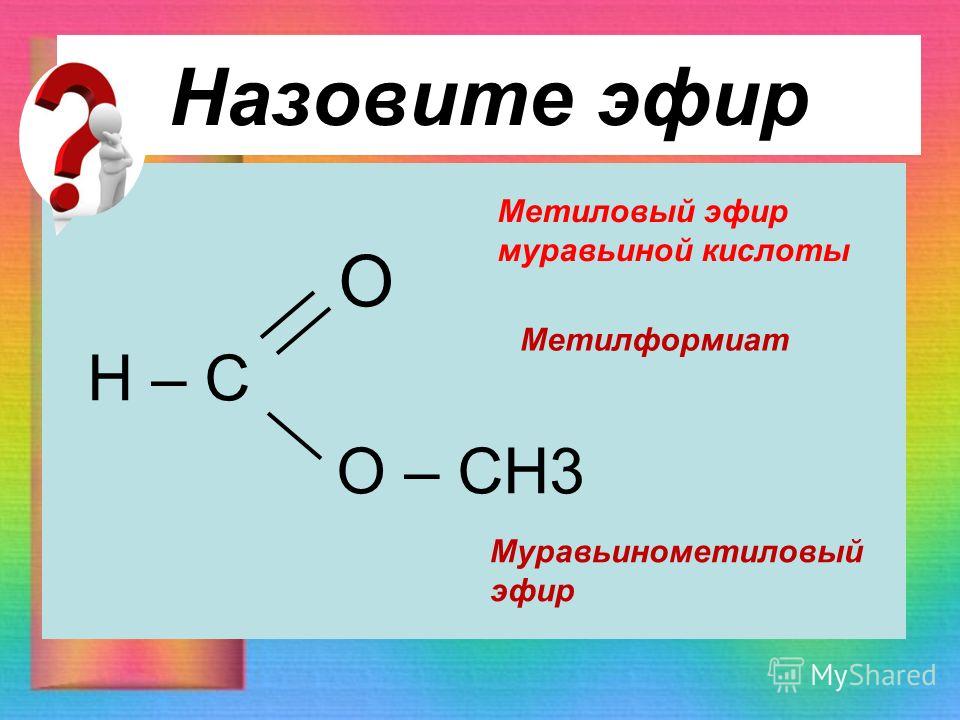 Железо-хром-молибденовый катализатор состава: (Fe1-x * Grx):Mo=1:(2,5-3), где х 0,05-0,5 (соотношения молярные) готовят соосаждением из растворов нитратов железа, хрома и парамолибдата аммония при тех же условиях, что и железо-молибденовый катализатор, и с теми же последующими стадиями. В первом реакторе происходит практически полное селективное окисление метанола в формальдегид.
Железо-хром-молибденовый катализатор состава: (Fe1-x * Grx):Mo=1:(2,5-3), где х 0,05-0,5 (соотношения молярные) готовят соосаждением из растворов нитратов железа, хрома и парамолибдата аммония при тех же условиях, что и железо-молибденовый катализатор, и с теми же последующими стадиями. В первом реакторе происходит практически полное селективное окисление метанола в формальдегид.
Образующаяся реакционная смесь поступает во второй реактор, загруженный одним из оксидных катализаторов, приведенных в таблице [1] Оксидный ванадиевый катализатор готовят пропиткой гидроокиси титана (анатаз) раствором метаванадата аммония. Далее массу сушат при 60-80оС, прокаливают по режиму 250оС 1 ч, 350оС 1 ч, 450оС 4 ч и таблетируют. Расчетные количества титанового и ванадиевого сырья берут такими, которые обеспечивают получение заданного состава катализатора. В случае модифицирования калием в катализаторную массу на стадии смешения добавляют расчетное количество карбоната калия.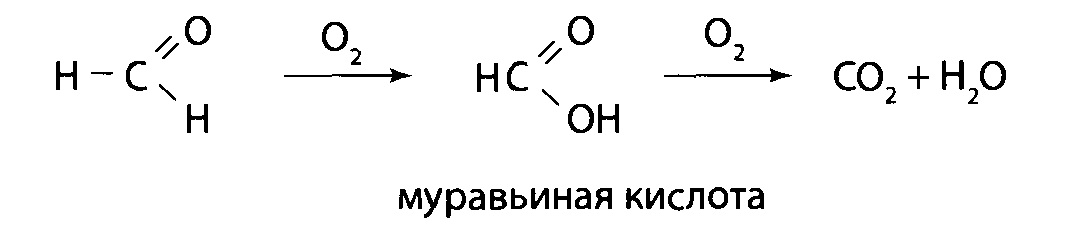 При модифицировании фосфором на стадии пропитки добавляют раствор о-фосфорной кислоты. Далее катализатор готовят пропиткой оксида олова раствором апармолибдата аммония, далее массу сушат при 80-100оС и прокаливают при 500оС.
При модифицировании фосфором на стадии пропитки добавляют раствор о-фосфорной кислоты. Далее катализатор готовят пропиткой оксида олова раствором апармолибдата аммония, далее массу сушат при 80-100оС и прокаливают при 500оС.
Во втором реакторе формальдегид окисляют в муравьиную кислоту. Затем реакционную смесь, содержащую муравьиную кислоту, оксиды углерода, водяной пар и небольшое количество формальдегида подают в конденсатор, где происходит последовательная конденсация формальдегида и муравьиной кислоты с водой.
Для достижения практически полной конверсии метанола в формальдегид первую стадию процесса проводят с использованием трубчатого реактора с адиабатической приставкой.
Вторую стадию процесса реализуют при низких температурах, причем в узком температурном интервале с большим выходом муравьиной кислоты. В связи с тем, что реакция протекает с большим выделением тепла, создаются значительные трудности при обеспечении изотермического режима, и также предъявляются жесткие требования к теплосъему.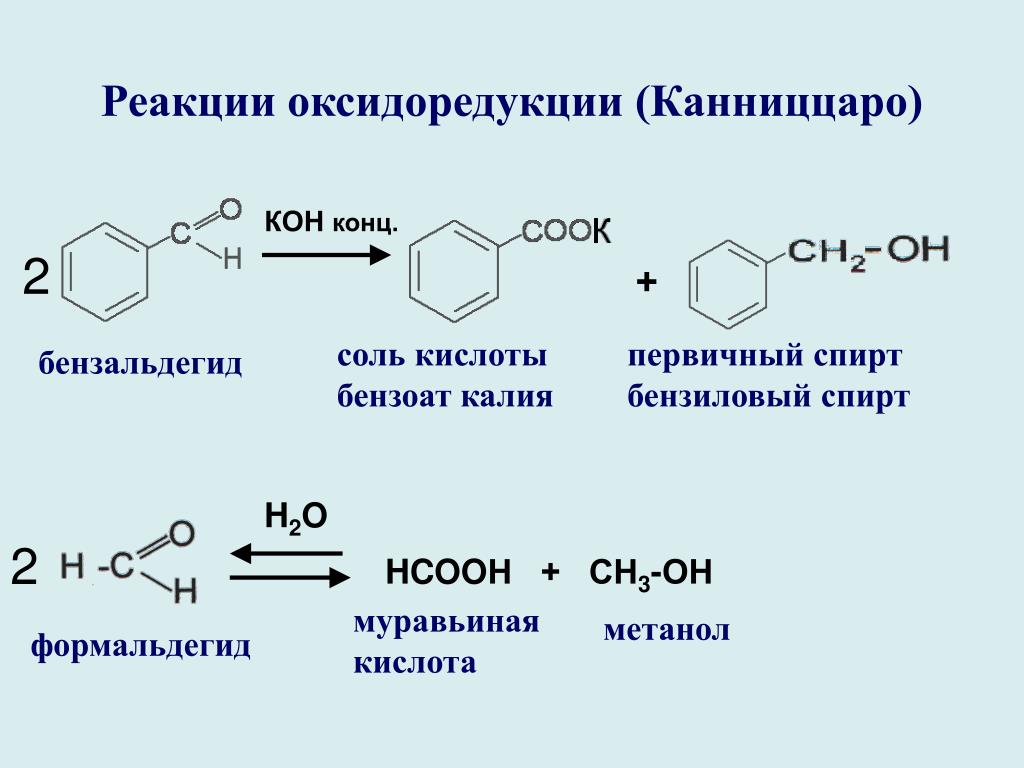 С целью решения этой проблемы процесс проводят при относительно низких концентрациях метанола и, соответственно, формальдегида и с использованием специальных методов теплосъема.
С целью решения этой проблемы процесс проводят при относительно низких концентрациях метанола и, соответственно, формальдегида и с использованием специальных методов теплосъема.
П р и м е р 1. Метанольно-воздушную смесь, содержащую 3,5 об. метанола, подают в реактор 1, в который загружают оксидный железо-молибденовый катализатор состава Fe2(MoO4)32MoO3 в количестве 2 мл (в данном примере и во всех последующих указан молярный состав катализаторов).
Скорость подачи реакционной смеси 5000 ч-1, что соответствует времени контакта 0,72 с. Температуру в 1 реакторе поддерживают 330оС. Продукты реакции после первой стадии поступают во второй реактор, в который загружают оксидный ванадий-титановый катализатор состава TiO20,09 V2O5 в количестве 5,6 мл, что обеспечивает время контакта 2 с. Температуру во втором реакторе поддерживают 120оС.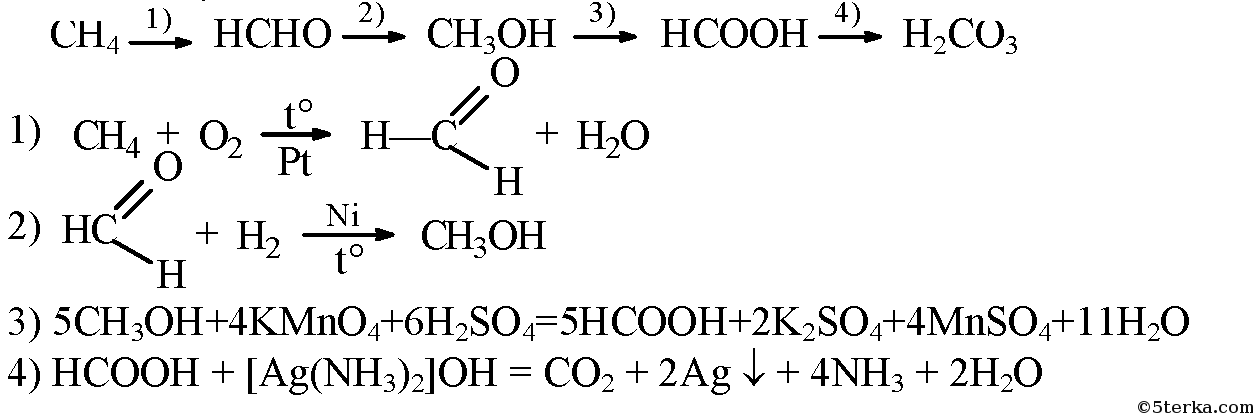 Эти условия обеспечивают конверсию метанола 98,5 селективность по муравьиной кислоте 59,5 Выход муравьиной кислоты в расчете на метанол составляет 58,6 мол. Реакционная смесь поступает в конденсатор, находящийся при 0оС. Изотермичность протекания реакции на второй стадии обеспечивают, используя печь с воздушным обдувом.
Эти условия обеспечивают конверсию метанола 98,5 селективность по муравьиной кислоте 59,5 Выход муравьиной кислоты в расчете на метанол составляет 58,6 мол. Реакционная смесь поступает в конденсатор, находящийся при 0оС. Изотермичность протекания реакции на второй стадии обеспечивают, используя печь с воздушным обдувом.
П р и м е р 2. Первую стадию проводят по примеру 1. Для проведения стадии 2 во второй реактор загружают ванадий-титановый катализатор состава TiO2 0,25 V2O5. Реакцию проводят при 130оС и времени контакта 2 с. Достигают конверсии метанола 98,5% селективность по муравьиной кислоте 64,7, выход муравьиной кислоты 63,7% мольных в расчете на метанол. Далее по примеру 1.
П р и м е р 3. Стадию 1 проводят по примеру 1. Для проведения стадии 2 во второй реактор загружают ванадий-титановый катализатор, состава TiO2 0,04 V2O5. Температура проведения реакции 140оС. При этм достигают конверсии метанола 98,8% селективность равна 55,7% Выход муравьиной кислоты составляет 55 мол. в расчете на метанол. Далее по примеру 1.
Температура проведения реакции 140оС. При этм достигают конверсии метанола 98,8% селективность равна 55,7% Выход муравьиной кислоты составляет 55 мол. в расчете на метанол. Далее по примеру 1.
П р и м е р 4. Стадию 1 проводят по примеру 1. Для проведения стадии 2 во второй реактор загружают ванадий-титановый катализатор, промотированный калием состава TiO2 0,06 V2O5 0,008 K2O. Реакцию проводят при 150оС. Достигают конверсии метанола 89,5% селективность по муравьиной кислоте 56,6% Выход муравьиной кислоты в расчете на метанол 56% мольных. Далее по примеру 1.
П р и м е р 5. Стадию 1 проводят по примеру 1. Для проведения стадии 2 во второй реактор загружают ванадий-титановый катализатор, промотированный фосфором, состава TiO2 0,04 V2O5 0,014 P2O5. Реакцию проводят при 110оС и времени контакта 2 с. Конверсия метанола 98,9% селективность по муравьиной кислоте 64,7 выход муравьиной кислоты в расчете на метанол 64% мольных. Далее по примеру 1.
Конверсия метанола 98,9% селективность по муравьиной кислоте 64,7 выход муравьиной кислоты в расчете на метанол 64% мольных. Далее по примеру 1.
П р и м е р 6. Первую стадию проводят по примеру 1. Для проведения 2 стадии в реактор 2 загружают олово-молибденовый катализатор состава SnO2 0,45 MoO3. Температура проведения реакции -130оС, время контакта 2 сек. Конверсия метанола 98,4% селективность по муравьиной кислоте 43,7% выход муравьиной кислоты 43 мол. в расчете на метанол. далее по примеру 1.
П р и м е р 7. Метанольно-воздушную смесь, содержащую 3,5-3,7% метанола подают в реактор 1, куда загружают 2 г оксидного железо-хром-молибденового катализатора состава (Fe0,75Cr0,25)2(MoO4)32MoO3. Превращение метанола в формальдегид проводят при 330оС. Скорость подачи метанола 5000 ч-1, что соответствует времени контакта 0,75 с. Далее процесс проводят по примеру 1. Достигают конверсии метанола 98% селективность по муравьиной кислоте 59,8% выход муравьиной кислоты в расчете на метанол 58,7% Далее по примеру 1.
Далее процесс проводят по примеру 1. Достигают конверсии метанола 98% селективность по муравьиной кислоте 59,8% выход муравьиной кислоты в расчете на метанол 58,7% Далее по примеру 1.
В таблице приведены каталитические данные, описанные в примерах 1-7.
Таким образом, как видно из полученных результатов, двухстадийное каталитическое окисление метанола в муравьиную кислоту протекает в паро-газовой фазе при атмосферном давлении, при этом достигают выход муравьиной кислоты 40-60 мол. в расчете на метанол. Процесс проводят на 1-й стадии при условиях, обеспечивающих полную конверсию метанола на оксидных железо-хром-молибденовых и железо-молибденовом катализаторах на второй стадии используются оксидный ванадий-титановый ванадий-титан-фосфорный и олово-молибденовый катализаторы. Вторую стадию проводят при 100-150оС. Для решения путей технологического оформления реакторного узла (1 и 2 стадии) и решения вопросов теплосъема на второй стадии процесса были проведены испытания на пилотной двухреакторной установке (рис. 1).
1).
Условия проведения I стадии: Реактор трубчатый реактор с адиабатической приставкой
Катализатор оксидный Fe-Mo,
Fe-Cr-Mo
Загрузка катализатора 2 кг
Состав исходной смеси 3-6
об. метанола, остальное воздух
Температура 260-380оС
Скорость подачи 10000 ч-1.
Условия проведения II стадии:
Реактор трубчатый двухсекционный реактор
Катализатор оксидный
Ti-V, Ti-V-P, Ti-V-K, Sn-Mo.
Загрузка катализатора 2 кг
Температура 100-150оС
Теплосъем кипящий слой частичек металла, теплоноситель-воздух
Скорость подачи 10000 ч-1.
Особенности проведения второй стадии процесса следующие. В существующих реакторах отвод тепла от трубок (термостатирование) осуществляют нагретым жидким теплоносителем (маслом), которое насосом подают в межтрубное пространство, нагревают до более высокой температуры выделяемым теплом реакции и выводят в теплообменник.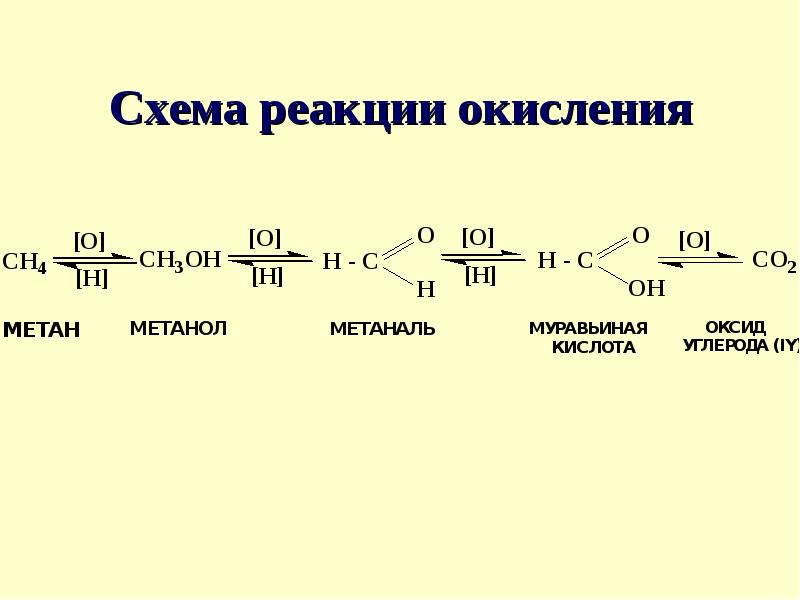
Способ надежен, но связан с необходимостью выбора дорогостоящего насосного оборудования и наличием опасности работы с сильно разогретым маслом.
Предлагаемый способ отвода избыточного тепла реакции связан с использованием псевдоожиженного слоя дисперсного материала. Высокие значения коэффициента теплоотдачи между псевдоожиженным слоем и поверхностью трубок, погруженных в слой (до 400 ккал/м2чг), позволяют эффективно отводить избыточное тепло реакции и исключить перегрев катализатора. Способ отвода тепла псевдоожиженным слоем позволяет легко управлять процессом теплопередачи путем регулирования расхода воздуха на псевдоожижение. Процесс термостатирования псевдоожиженным слоем значительно безопаснее термостатирования горячим маслом. Тепло псевдоожижающего воздуха может быть использовано для отапливания помещения в зимнее время или для других целей.
Пусковой режим (разогрев трубного пучка до рабочей температуры) осуществляют пусковым электронагревателем, который в процессе работы может быть отключен или переведен на минимальный режим.
Предлагаемый новый процесс характеризуется рядом преимуществ.
Экологическая чистота процесса обусловлена тем, что процесс закрыт, не содержит побочных неутилизируемых продуктов, кроме полезного продукта, образуются диоксид углерода и вода.
Достигается высокий выход муравьиной кислоты.
Исходное сырье метанол является доступным и дешевым сырьем химической промышленности.
Переход на парофазный каталитический процесс получения муравьиной кислоты позволит не только улучшить экологическую обстановку в местах ее производства, но и использование метанола в качестве исходного продукта дает возможность организовать новые производства в странах и регионах, не имеющих собственных разработок природного сырья.
Немаловажным является и тот факт, что появляется возможность организации малотоннажных производств непосредственно в местах потребления кислоты, тем самым не только снижается стоимость продукта благодаря уменьшению затрат на транспортировку, но и решается проблема хранения кислоты.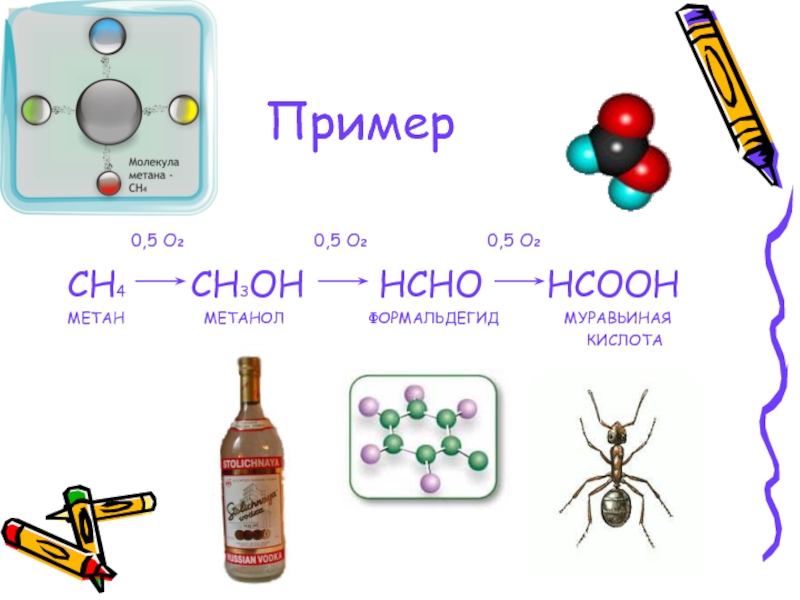
Формула изобретения
1. СПОСОБ ПОЛУЧЕНИЯ МУРАВЬИНОЙ КИСЛОТЫ, СВОБОДНОЙ ОТ МЕТАНОЛА, парофазным окислением кислородом воздуха при повышенных температурах на оксидных гетерогенных катализаторах с промежуточным образованием формальдегида, последующей конденсацией паров и разделением конечных продуктов процесса, отличающийся тем, что в качестве исходного реагента используют метанол, который окисляют в проточном режиме в первом реакторе до формальдегида, полученную реакционную смесь окисляют во втором реакторе до муравьиной кислоты, причем в первом секционном реакторе, содержащем трубчатую и адиабатическую секции, процесс ведут при 260-380oС и используют оксидный железомолибденовый катализатор состава Fe2(MoO4)3: MoO2 — 1:2(отношение молярное) или же оксидный хромжелезомолибденовый катализатор состава (Fe1—xCrx):Mo — 1:(2,5-3), где x= 0,05-0,5 (отношение молярное), а во втором трубчатом секционном реакторе окисление проводят при 100-150oС в присутствии ванадийтитанового оксидного катализатора состава TiO2:V2O5=1:(0,04-0,25) (отношение молярное) или ванадийтитанфосфорного оксидного катализатора при молярном отношении TiO2:V2O5: P2O5= 1: 0,004:0,014 или в присутствии оловомолибденового катализатора SnO2: MoO3=1:0,45 (отношение молярное).
2. Способ по 1, отличающийся тем, что изотермичность слоя катализатора в трубном пространстве обеспечивают путем съема теплоты реакции псевдоожиженным слоем дисперсного материала в межтрубном пространстве с помощью потока воздуха как теплоносителя.
РИСУНКИ
Рисунок 1, Рисунок 2
Анализ №AN987MET, Метанол: показатели, норма, цены
Метанол — это токсичный спирт, который используется в промышленности в качестве растворителя, пестицида и альтернативного источника топлива. Он также встречается в природе у людей, животных и растений.
- Подготовка пациента
- Показания и противопоказания
- Интерпретация и форма выдачи результата
Такие продукты, как свежие фрукты и овощи, фруктовые соки, ферментированные напитки и диетические безалкогольные напитки, содержащие аспартам, являются основными источниками метанола в организме человека и животных.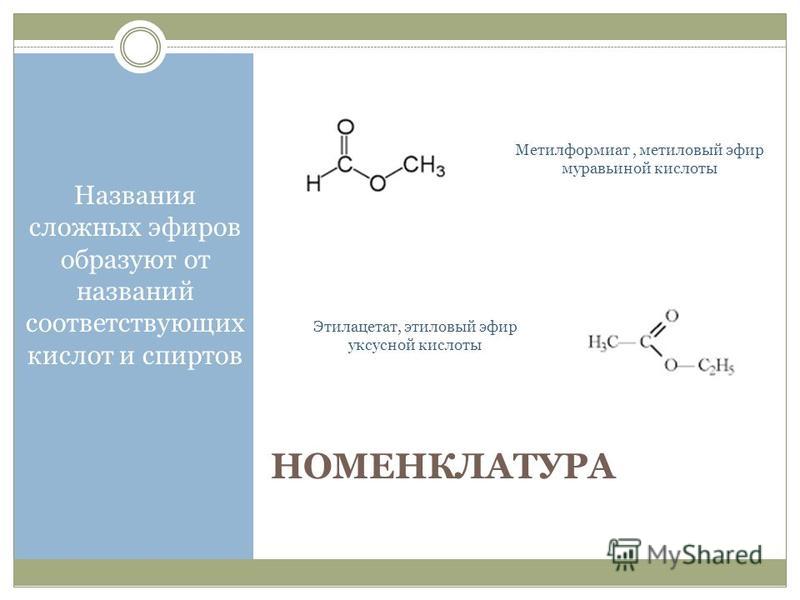 Большинство отравлений метанолом происходит в результате употребления напитков, загрязненных метанолом, или употребления продуктов, содержащих метанол. В промышленных условиях вдыхание высоких концентраций паров метанола и абсорбция метанола через кожу столь же эффективны, как и пероральный путь введения в токсические эффекты.
Большинство отравлений метанолом происходит в результате употребления напитков, загрязненных метанолом, или употребления продуктов, содержащих метанол. В промышленных условиях вдыхание высоких концентраций паров метанола и абсорбция метанола через кожу столь же эффективны, как и пероральный путь введения в токсические эффекты.
Отравление метанолом может возникнуть в результате проглатывания жидкости для омывателя ветрового стекла, добавок к бензину, дублирующих жидкостей, консервированного топлива для приготовления пищи и множества других продуктов, которые можно найти дома.
У животных, как и у людей проглатывание метанола более 100 мг / кг следует считать потенциально токсичным. Поэтому даже однократный глоток жидкости для омывателя ветрового стекла, содержащей 40% метанола, следует считать опасным. Поскольку метанол осмотически активен, увеличенный осмолярный разрыв иногда выявляется при первоначальных лабораторных испытаниях, но исчезает по мере метаболизма метанола.
Метанол медленно метаболизируется алкогольдегидрогеназой в формальдегид, который далее метаболизируется до муравьиной кислоты. Может возникнуть гипогликемия. Через несколько часов часто возникает глубокий метаболический ацидоз с широкой анионной пропастью. Муравьиная кислота напрямую токсична для сетчатки и может привести к слепоте. Осмотр глазного дна может выявить гиперемированный диск зрительного нерва. Тяжелое отравление может прогрессировать до судорог, комы и стойкой энцефалопатии.
Типичные признаки отравления метанолом включают тошноту, рвоту, боль в желудке, рефлекторную гипервозбудимость, опистотонус, судороги, фиксированный зрачок и острый периферический неврит.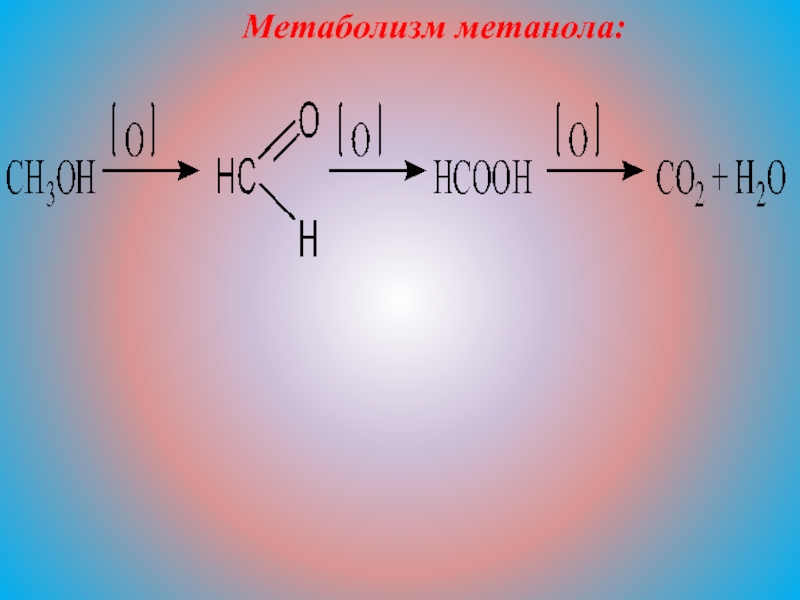 Большие передозировки могут привести к слепоте. Токсические эффекты частично связаны с самим спиртом, а частично с муравьиной кислотой, образующейся при его окислении.
Большие передозировки могут привести к слепоте. Токсические эффекты частично связаны с самим спиртом, а частично с муравьиной кислотой, образующейся при его окислении.
Сроки исполнения: 4 дня (плюс 1-2 дня для регионов).
Исследуемый аналит: плазма
Метод исследования: газовая хроматография
Показания:
- Острые отравления
- Подозрение на отравление метанолом
Противопоказания: не известны.
Подготовка пациента: Биоматериал отбирается до применения системных лекарственных препаратов, которые могут повлиять на результат
Метод отбора: венепункция
Преаналитика:
- Взятие крови – пробирка с сиреневой крышкой, 2 мл.
- Осторожно перевернуть пробирку 4-6 раз.
- Не позднее 15 минут после взятия центрифугировать при 3300 об/мин в течение 10 минут.

- Сразу отобрать плазму в сухую чистую пробирку (эппендорф).
- Минимальный объем плазмы для выполнения исследования – 1 мл.
- Контейнер маркировать Ф.И.О. владельца и кличкой животного, заполнить направительный бланк,указав код клиента.
Стабильность образца: 5 дней при +2°С…+8°С.
Температурный режим транспортировки в лабораторию +2°С …+8°С (синий пакет).
Референсные значения: Нижний уровень токсической концентрации 100.
Интерпретация: проводится ветеринарным специалистом
Форма выдачи результата: числовое значение
Список источников:
- Кевин К. Остерхоудт, MD, MSCE , педиатрическая неотложная медицина , 2008 г.
- Д. Якобсен , К. Э. Макмартин , в « Токсикология человека» , 1996 г.
- Бифф Ф. Палмер , Роберт Дж.
 Альперн , в Комплексной клинической нефрологии (четвертое издание) , 2010 г.
Альперн , в Комплексной клинической нефрологии (четвертое издание) , 2010 г. - The National Institute for Occupational Safety and Health (NIOSH)- Emergency Response Safety and Health Database — METHANOL : Systemic Agent
Метанол с 0,1% муравьиной кислотой | 34671
Riedel-de Haën
CHROMASOLV™ LC-MS, LabReady™ Solvent Blend, >=99,5%
Синоним(ы)
Метиловый спирт
9001 2Размер упаковки
Выберите вариант. ..
..
Тип контейнера
Выберите вариант…
Количество
Проверить наличие
Запросить цену
Перейти в конец галереи изображений
Перейти в начало галереи изображений
| Бренд Riedel-de Ha ën | Регистрационный номер Beilstein 1098229 | Номера CAS (все) 64-18-6 | Линейная формула CH 3 OH | лей Номер MFCD00004595 |
| Синонимы Метиловый спирт |
Документы
Данные по безопасности Лист (SDS)
Растворители Chromasolv для Северной Америки брошюра
Технические характеристики
| Собственность | Значение |
|---|---|
| Анализ (ГХ) | Мин. 99,5 % 99,5 % |
| Кальций (Ca) | Макс. 0,5 ppm |
| Калий (K) | Макс. 0,5 частей на миллион |
| Магний (Mg) | Макс. 0,5 ppm |
| Натрий (Na) | Макс. 2 ppm |
| Коэффициент пропускания при 254 нм | Мин. 90 % |
| Коэффициент пропускания при 230 нм | Мин. 10 % |
| Градиент ВЭЖХ при 254 нм | Макс. 10 mAU |
| Приложение ЖХ-МС | соответствует |

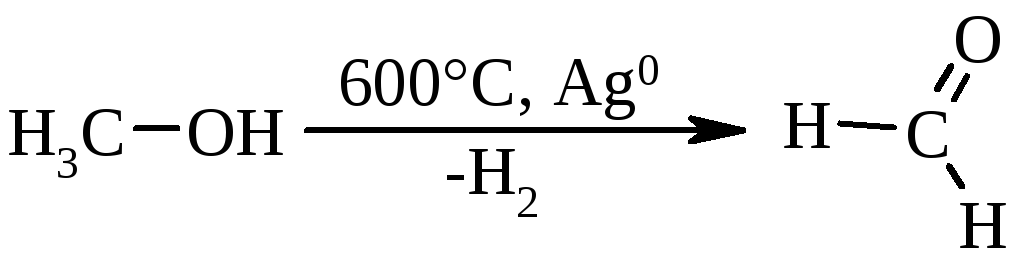 Альперн , в Комплексной клинической нефрологии (четвертое издание) , 2010 г.
Альперн , в Комплексной клинической нефрологии (четвертое издание) , 2010 г. 11
11 edu.cn
edu.cn
Leave A Comment