Мономерами белков являются какие вещества? Что это
Белки являются биологическими полимерами со сложнейшей структурой. Они имеют высокий молекулярный вес и состоят из аминокислот, простетических групп, представленных витаминами, липидных и углеводных включений. Белки, содержащие углеводы, витамины, металлы или липиды, называются сложными. Простые белки состоят только из аминокислот, соединенных между собой пептидной связью.
Пептиды
Независимо от того, какую структуру имеет вещество, мономерами белков являются аминокислоты. Они образуют базовую полипептидную цепочку, из которой затем формируется фибриллярная или глобулярная структура белка. При этом белок может синтезироваться только в живой ткани — в растительных, бактериальных, грибковых, животных и прочих клетках.
Какими бывают виды белков, их функции и структура
Виды белков в организме. Строение, функции и свойства полипептидных молекул. Денатурация и…
Единственными организмами, которые не могут соединять мономеры белков, являются вирусы и простейшие бактерии. Все остальные способны образовывать структурные белки. Но какие вещества являются мономерами белков, и как они образуются? Об этом и о биосинтезе белка, о полипептидах и образовании сложной белковой структуры, об аминокислотах и их свойствах читайте ниже.
Все остальные способны образовывать структурные белки. Но какие вещества являются мономерами белков, и как они образуются? Об этом и о биосинтезе белка, о полипептидах и образовании сложной белковой структуры, об аминокислотах и их свойствах читайте ниже.
Единственным мономером молекулы белка служит любая альфа-аминокислота. При этом белок — это полипептид, цепочка из соединенных аминокислот. В зависимости от количества аминокислот, участвующих в его образовании, выделяют дипептиды (2 остатка), трипептиды (3), олигопептиды (содержит от 2-10 аминокислот) и полипептиды (множество аминокислот).
Обзор структуры белков
Структура белка может быть первичной, чуть более сложной — вторичной, еще более сложной — третичной, и самой сложной — четвертичной.
Первичная структура — это простая цепь, в которую посредством пептидной связи (CO-NH) соединены мономеры белков (аминокислоты). Вторичная структура — это альфа-спираль или бета-складки. Третичная — это еще более усложненная трехмерная структура белка, которая образовалась из вторичной вследствие образования ковалентных, ионных и водородных связей, а также гидрофобных взаимодействий.
Макромолекула — это молекула с высокой молекулярной массой….
Макромолекула — это высокомолекулярное соединение, имеющее значение для жизнедеятельности…
Четвертичная структура является самой сложной и свойственна рецепторным белкам, расположенным на клеточных мембранах. Это надмолекулярная (доменная) структура, образованная вследствие объединения нескольких молекул с третичной структурой, дополненных углеводными, липидными или витаминными группами. В данном случае, как и при первичной, вторичной и третичной структурах, мономерами белков являются альфа-аминокислоты. Они также соединены пептидными связями. Отличие состоит лишь в сложности структуры.
Аминокислоты
Единственными мономерами молекул белков являются альфа-аминокислоты. Их всего 20, и они являются чуть ли не основой жизни. Благодаря появлению пептидной связи, синтез белка стал возможным. А сам белок после этого начал выполнять структурообразующую, рецепторную, ферментативную, транспортную, медиаторную и прочие функции. Благодаря этому живой организм функционирует и способен воспроизводиться.
Благодаря этому живой организм функционирует и способен воспроизводиться.
Сама альфа-аминокислота представляет собой органическую карбоновую кислоту с аминогруппой, соединенной с альфа-углеродным атомом. Последний расположен рядом с карбоксильной группой. При этом мономеры белков рассматриваются как органические вещества, у которых концевой углеродный атом несет и аминную, и карбоксильную группу.
Общая формула расчета аминокислот
Аминокислоты необходимы для полноценной жизни и деятельности человека. Проанализируем основные…
Соединение аминокислот в пептидах и белках
Аминокислоты соединяются в димеры, тримеры и полимеры посредством пептидной связи. Она образуется путем отщепления гидроксильной (-ОН) группы от карбоксильного участка одной альфа-аминокислоты и водорода (-Н) — от аминогруппы другой альфа-аминокислоты. В результате взаимодействия отщепляется вода, а на карбоксильном конце остается участок С=О со свободным электроном около углерода карбоксильного остатка.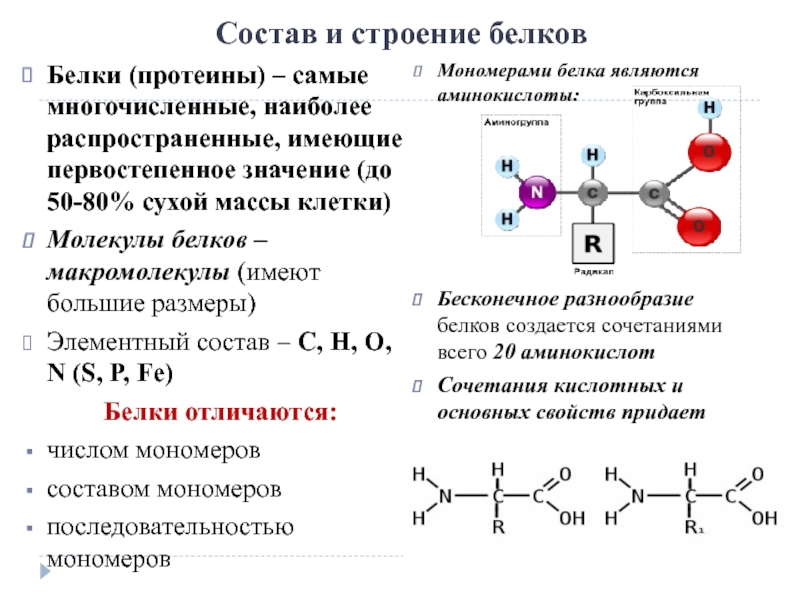 В аминогруппе другой кислоты имеется остаток (NH) с имеющимся свободным радикалом у азотного атома. Это позволяет соединить два радикала с образованием связи (CONH). Она называется пептидной.
В аминогруппе другой кислоты имеется остаток (NH) с имеющимся свободным радикалом у азотного атома. Это позволяет соединить два радикала с образованием связи (CONH). Она называется пептидной.
Варианты альфа-аминокислот
Всего известно 23 альфа-аминокислоты. Они представлены в виде списка: глицин, валин, аланин, изолецин, лейцин, глутамат, аспарагинат, орнитин, треонин, серин, лизин, цистин, цистеин, фенилаланин, метионин, тирозин, пролин, триптофан, оксипролин, аргинин, гистидин, аспарагин и глутамин. В зависимости от того, могут ли они синтезироваться организмом человека, эти аминокислоты делятся на заменимые и незаменимые.
Понятие о заменимых и незаменимых аминокислотах
Заменимые организм человека может синтезировать, тогда как незаменимые должны поступать только с пищей. При этом и незаменимые, и заменимые кислоты важны для биосинтеза белка, потому как без них синтез не может быть завершен. Без одной аминокислоты, даже если все остальные присутствуют, невозможно построить именно тот белок, который требуется клетке для выполнения своих функций.
Одна ошибка на любом из этапов биосинтеза — и белок уже непригоден, потому как не сможет собраться в нужную структуру из-за нарушения электронных плотностей и межатомных взаимодействий. Потому человеку (и прочим организмам) важно потреблять белковые продукты, в которых имеются незаменимые аминокислоты. Их отсутствие в пище приводит к ряду нарушений белкового обмена.
Процесс образования пептидной связи
Единственными мономерами белков являются альфа-аминокислоты. Они постепенно соединяются в цепочку полипетида, структура которой заранее сохранена в генетическом коде ДНК (или РНК, если рассматривается бактериальный биосинтез). При этом белок — это строгая последовательность аминокислотных остатков. Это цепочка, упорядоченная в определенную структуру, выполняющая в клетке заранее запрограммированную функцию.
Этапная последовательность белкового биосинтеза
Процесс образования белка состоит из цепи этапов: репликация участка ДНК (или РНК), синтез РНК информационного типа, ее выход в цитоплазму клетки из ядра, соединение с рибосомой и постепенное прикрепление аминокислотных остатков, которые поставляются транспортной РНК. Вещество, что является мономером белка, участвует в ферментативной реакции отщепления гидроксильной группы и протона водорода, а затем присоединяется к наращиваемой полипетидной цепочке.
Вещество, что является мономером белка, участвует в ферментативной реакции отщепления гидроксильной группы и протона водорода, а затем присоединяется к наращиваемой полипетидной цепочке.
Таким образом получается полипептидная цепочка, которая уже в клеточном эндоплазматическом ретикулуме упорядочивается в некую заранее заданную структуру и дополняется углеводным или липидным остатком, если это требуется. Это называется процессом «созревания» белка, после чего тот направляется транспортной клеточной системой к месту назначения.
Функции синтезированных белков
Мономерами белков являются аминокислоты, необходимые для построения их первичной структуры. Вторичная, третичная и четвертичная структура уже образуется сама, хотя иногда также требует участия ферментов и прочих веществ. Однако они уже не являются основными, хотя и крайне необходимы, чтобы белки выполняли свою функцию.
Аминокислота, что является мономером белка, может иметь места прикрепления углеводов, металлов или витаминов. Образование третичной или четвертичной структуры дает возможность найти еще больше мест для расположения вставочных групп. Это позволяет создать из белка производное, которое играет роль фермента, рецептора, переносчика веществ в клетку или из нее, иммуноглобулина, структурного компонента мембраны или клеточной органеллы, мышечного белка.
Образование третичной или четвертичной структуры дает возможность найти еще больше мест для расположения вставочных групп. Это позволяет создать из белка производное, которое играет роль фермента, рецептора, переносчика веществ в клетку или из нее, иммуноглобулина, структурного компонента мембраны или клеточной органеллы, мышечного белка.
Белки, образованные из аминокислот, являются единственной основой жизни. И сегодня считается, что жизнь как раз зародилась после появления аминокислоты и вследствие ее полимеризации. Ведь именно межмолекулярное взаимодействие белков и есть начало жизни, в том числе и разумной. Все остальные биохимические процессы, включая энергетические, нужны для реализации белкового биосинтеза, и как результат, дальнейшего продолжения жизни.
| БЕЛКИ Все белки — полимеры Мономер молекулы белка — аминокислота Разнообразие аминокислот зависит от радикалов (R).  В натуральных белках встречается только 20 аминокислот. Иногда их называют «магическими», иногда «стандартными». Одни и те же аминокислоты образуют белки всех живых существ на Земле (гомология). с карбоксильной группой другой аминокислоты. Пептидной называется ковалентная полярная химическая связь между С одной аминокислоты и N другой аминокислоты. Группа атомов О = С — N — H называется пептидной группой. многочисленными водородными связями (показаны пунктиром) между пептидными группами соседних витков. Образуется при сворачивании спирали вторичной структуры в глобулу (тело округлой формы). Может включать в себя неорганические компоненты, например атомы Fe, Cu. Такие белки называются глобины или глобулины. Миоглобин, транспортирующий кислород в мышцах — пример третичной структуры белка. Стабильность третичной структуры белка поддерживается уже упомянутыми водородными связями и так называемыми «дисульфидными мостиками» — ковалентными неполярными связями между атомами серы. Атомы серы имеются в аминокислоте цистеин. 4) Четвертичная структура белка Образуется при объединении нескольких третичных структур. Может включать в себя неорганические компоненты, например атомы Fe, Cu. Гемоглобин, транспортирующий кислород в крови — пример четвертичной структуры белка. 4 третичные структуры объединены в один белок. Красным цветом показан гем (компонент молекулы, содержащий железо) Денатурация и ренатурация белков Денатурация — изменение белком своей структуры от более высокой к более низкой. Ренатурация — обратный процесс. 1-я структура ренатурировать не может никогда. а) высокая температура б) ионизирующие излучения в) ультрафиолетовое излучение г) рентгеновское излучение д) кислоты, щелочи е) ионы тяжёлых металлов и другие. изменяются физические и химические свойства (размер молекулы, форма, цвет, прозрачность, агрегатное состояние, электропроводность, каталитическая активность и пр.) Пример денатурации альбумина (запасного белка яйца) от высокой температуры. Процессы денатурации и ренатурации белков лежат в основе сокращения мышц, свёртывания крови, действия ферментов и пр. Функции белков.
от них американские индейцы пьянеют от малейших доз алкоголя? Запомните название фермента: алкогольдегидрогеназа.  у вас в крови и вы трезвеете! А у упомянутых народов этот фермент не образуется. Каталог: lnip-bg -> Lections10Bio жүктеу/скачать 48.88 Kb. Достарыңызбен бөлісу: |
3.8: Белки — Аминокислоты
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 12699
- Boundless (теперь LumenLearning)
- Boundless 900 30
- Описать структуру аминокислоты и признаки, придающие ей специфические свойства
- Каждая аминокислота содержит центральный атом C, аминогруппу (Nh3), карбоксильную группу (COOH) и определенную группу R.
- Группа R определяет характеристики (размер, полярность и рН) для каждого типа аминокислоты.
- Пептидные связи образуются между карбоксильной группой одной аминокислоты и аминогруппой другой посредством синтеза дегидратации.
- Цепь аминокислот представляет собой полипептид.
- аминокислота : Любая из 20 встречающихся в природе α-аминокислот (имеющих амино- и карбоксильные группы на одном и том же атоме углерода) и различные боковые цепи, которые объединяются посредством пептидных связей.
 , для образования белков.
, для образования белков. - Группа R : Группа R представляет собой боковую цепь, специфичную для каждой аминокислоты, которая придает определенные химические свойства этой аминокислоте.
- полипептид : Любой полимер (одинаковых или разных) аминокислот, соединенных пептидными связями.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Безграничный
- Количество столбцов печати
- Два
- Печать CSS
- Плотный
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
- Теги
- Аминокислоты
Цели обучения
Структура аминокислоты
Аминокислоты представляют собой мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа (α) углерод, связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и атомом водорода. атом. В водной среде клетки как аминогруппа, так и карбоксильная группа ионизируются в физиологических условиях, поэтому имеют структуру -NH 3 + и -COO – соответственно. Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известным как группа R. Эта группа R, или боковая цепь, придает белкам каждой аминокислоты специфические характеристики, включая размер, полярность и рН.
Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа (α) углерод, связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и атомом водорода. атом. В водной среде клетки как аминогруппа, так и карбоксильная группа ионизируются в физиологических условиях, поэтому имеют структуру -NH 3 + и -COO – соответственно. Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известным как группа R. Эта группа R, или боковая цепь, придает белкам каждой аминокислоты специфические характеристики, включая размер, полярность и рН.

Типы аминокислот
Название «аминокислота» происходит от аминогруппы и карбоксильной группы в их основной структуре. В белках присутствует 21 аминокислота, каждая из которых имеет определенную группу R или боковую цепь. Десять из них считаются незаменимыми аминокислотами для человека, потому что человеческий организм не может их производить, и они должны поступать с пищей. Все организмы имеют разные незаменимые аминокислоты в зависимости от их физиологии.
Рисунок \(\PageIndex{1}\): Типы аминокислот. В белках обычно встречается 21 распространенная аминокислота, каждая из которых имеет свою R-группу (вариантную группу), которая определяет ее химическую природу. 21-я аминокислота, не показанная здесь, представляет собой селеноцистеин с R-группой -CH 2 -SeH.Характеристики аминокислот
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка и какие вы ожидаете найти внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в двойной липидный слой?
Химический состав боковой цепи определяет характеристики аминокислоты.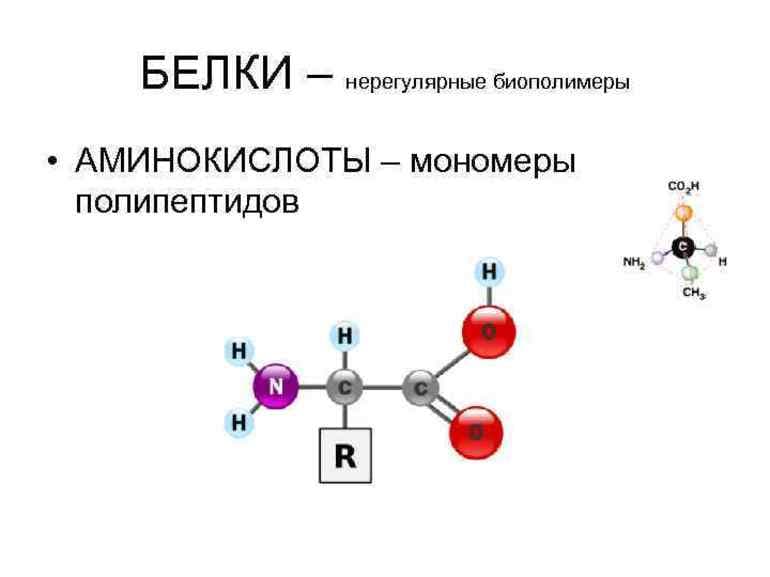 Аминокислоты, такие как валин, метионин и аланин, являются неполярными (гидрофобными), а такие аминокислоты, как серин, треонин и цистеин, являются полярными (гидрофильными). Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные (с высоким pH) аминокислоты. Пролин является исключением из стандартной структуры аминокислоты, поскольку его группа R связана с аминогруппой, образуя кольцеобразную структуру.
Аминокислоты, такие как валин, метионин и аланин, являются неполярными (гидрофобными), а такие аминокислоты, как серин, треонин и цистеин, являются полярными (гидрофильными). Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные (с высоким pH) аминокислоты. Пролин является исключением из стандартной структуры аминокислоты, поскольку его группа R связана с аминогруппой, образуя кольцеобразную структуру.
Аминокислоты обозначаются одной заглавной буквой или трехбуквенной аббревиатурой. Например, валин известен под буквой V или трехбуквенным символом val.
Пептидные связи
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота связана с другой аминокислотой ковалентной связью, известной как пептидная связь. Когда две аминокислоты ковалентно связаны пептидной связью, карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются и высвобождают молекулу воды. Любая реакция, которая объединяет два мономера в реакции, которая генерирует H 2 O как один из продуктов известен как реакция дегидратации, поэтому образование пептидной связи является примером реакции дегидратации.
Любая реакция, которая объединяет два мономера в реакции, которая генерирует H 2 O как один из продуктов известен как реакция дегидратации, поэтому образование пептидной связи является примером реакции дегидратации.
Полипептидные цепи
Полученная цепь аминокислот называется полипептидной цепью. Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. При чтении или представлении аминокислотной последовательности белка или полипептида принято использовать направление N-C. То есть предполагается, что первая аминокислота в последовательности находится на N-конце, а последняя аминокислота — на С-конце.
Хотя термины «полипептид» и «белок» иногда используются как взаимозаменяемые, полипептид технически представляет собой любой полимер аминокислот, тогда как термин «белок» используется для полипептида или полипептидов, которые имеют правильную укладку в сочетании с любыми дополнительными компонентами, необходимыми для правильного функционирования, и теперь функционирует.
Ключевые моменты
Ключевые термины
Эта страница под заголовком 3.8: Белки — Аминокислоты распространяется под лицензией CC BY-SA 4.0 и была создана, изменена и/или курирована Boundless.
Что такое мономеры белков
16 ноября 2016 г.
от Yashoda
Чтение через 4 минуты
Что такое белки
Прежде чем узнать о мономерах белков, давайте посмотрим, что такое белки. Белки – это природные полимеры, играющие жизненно важную роль в жизненных процессах. Белки составляют более 50% сухой массы клеток и присутствуют в большем количестве, чем любая другая биомолекула. Следовательно, они сильно отличаются от других основных типов биомолекул, включая липиды, углеводы и нуклеиновые кислоты. Самое главное, белки являются наиболее широко изучаемыми биомолекулами благодаря их структуре, функциям, физико-химическим свойствам, модификации и их применению, особенно в самых передовых областях науки, таких как генная инженерия, экологически чистые материалы, новые композиты на основе возобновляемых источников. Белки как биомолекулы отвечают за выполнение многих основных функций в биологических системах, включая катализ ферментов (с помощью ферментов), защиту (с помощью иммуноглобулинов, токсинов и антигенов клеточной поверхности), транспорт (с помощью циркулирующих переносчиков), поддержку (с помощью волокон), движение ( путем формирования мышечных волокон, таких как коллаген, кератин и фибрин), регуляции (с помощью осмотических белков, генных регуляторов и гормонов) и хранения (путем связывания ионов). Белки являются важными возобновляемыми ресурсами, производимыми животными, растениями и микроорганизмами, такими как вирусы и бактерии. Некоторые важные растительные белки включают зеин, соевые белки и белки пшеницы. Казеин и фиброин шелка — некоторые белки, обнаруженные у животных. Примеры основных бактериальных белков включают лактатдегидрогеназу, химотрипсин и фумаразу.
Белки являются важными возобновляемыми ресурсами, производимыми животными, растениями и микроорганизмами, такими как вирусы и бактерии. Некоторые важные растительные белки включают зеин, соевые белки и белки пшеницы. Казеин и фиброин шелка — некоторые белки, обнаруженные у животных. Примеры основных бактериальных белков включают лактатдегидрогеназу, химотрипсин и фумаразу.
Белки образуются путем соединения большого количества мономерных звеньев. Белки содержат один или несколько полипептидов. Каждая полипептидная цепь образована путем соединения большого количества аминокислот химическими связями, известными как пептидные связи. Ген, кодирующий этот конкретный белок, определяет последовательность аминокислот. Как только полипептидная цепь сформирована, она сворачивается, образуя специфическую трехмерную структуру, которая уникальна для этой конкретной полипептидной цепи. Конформация полипептидной цепи определяется в основном аминокислотной последовательностью и множественными слабыми взаимодействиями между частями полимерной цепи. Эти слабые взаимодействия могут быть нарушены применением тепла или добавлением химического вещества, которое в конечном итоге изменяет конформацию трехмерной структуры полипептида. Этот процесс разрушения известен как денатурация белков . Денатурация в конечном итоге остановит функциональную активность белков. Следовательно, структура белка очень важна для поддержания их роли.
Эти слабые взаимодействия могут быть нарушены применением тепла или добавлением химического вещества, которое в конечном итоге изменяет конформацию трехмерной структуры полипептида. Этот процесс разрушения известен как денатурация белков . Денатурация в конечном итоге остановит функциональную активность белков. Следовательно, структура белка очень важна для поддержания их роли.
Структура белка
Структуру белка можно рассматривать с точки зрения четырех уровней структуры; первичный, вторичный, третичный и четвертичный. Первичная структура белка представляет собой его аминокислотную последовательность. Существует два типа вторичных структур ; α-спираль и β-лист. третичная структура белков определяется трехмерной структурой, которая может быть как глобулярной, так и волокнистой. Третичная структура более сложная и компактная. Четвертичная структура белка гораздо сложнее из-за его более высокой степени сворачивания.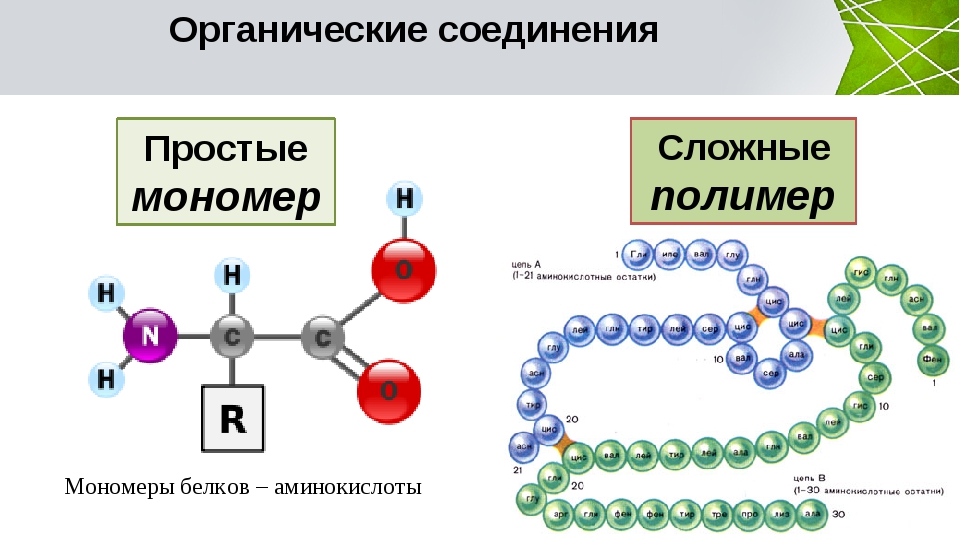 Большинство белков с четвертичной структурой содержат субъединицы, которые удерживаются между собой нековенантными связями. Например, гемоглобин состоит из четырех субъединиц.
Большинство белков с четвертичной структурой содержат субъединицы, которые удерживаются между собой нековенантными связями. Например, гемоглобин состоит из четырех субъединиц.
Что такое мономеры белков
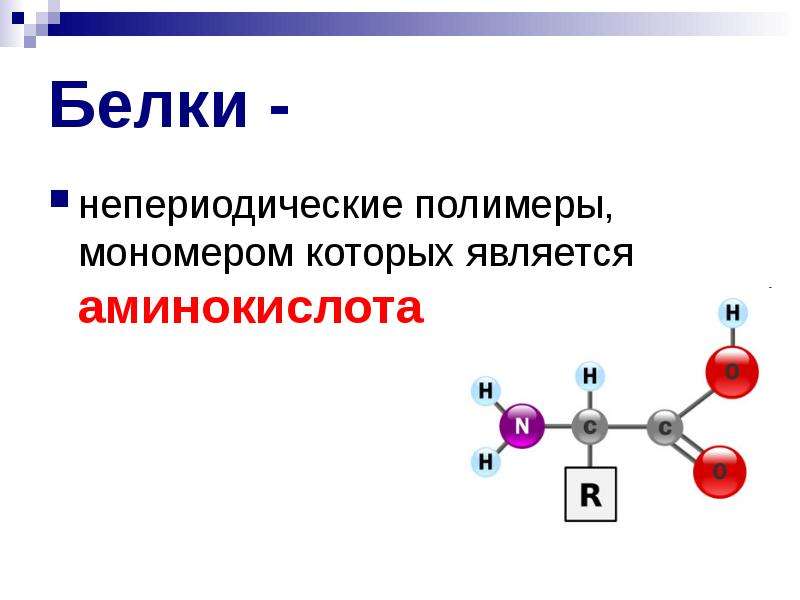
Мономер является основной функциональной и структурной единицей полимера. Они являются строительными блоками полимеров. Мономер белка – аминокислота. Большое количество молекул аминокислот соединяются пептидными связями, образуя полипептидные цепи. Две или более полипептидных цепей соединяются вместе, образуя большие белки. Последовательность аминокислот определяет структуру и функцию белка.
Общая структура аминокислоты
Существует 20 различных аминокислот, которые формируют все белки в биологической системе, располагаясь в различных последовательностях. Последовательность аминокислот известна как первичная структура белка. При рассмотрении химической формулы молекулы аминокислоты она содержит три группы; аминогруппа (-NH 2 ), группу карбоновой кислоты (-COOH) и боковую цепь (группу R), которая специфична для каждой аминокислоты.





 , для образования белков.
, для образования белков.
Leave A Comment