Молекулярное и немолекулярное строение | Дистанционные уроки
16-Май-2013 | Нет комментариев | Лолита Окольнова
Задание А6 ЕГЭ по химии —
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Темы, которые нужно знать:
- Закономерности изменения химических свойств элементов и их соединений
- Виды химической связи
Давайте определим свойства веществ молекулярного строения и немолекулярного.
| Вещества молекулярного строения | Вещества немолекулярного строения |
|
|
Типы кристаллических решеток
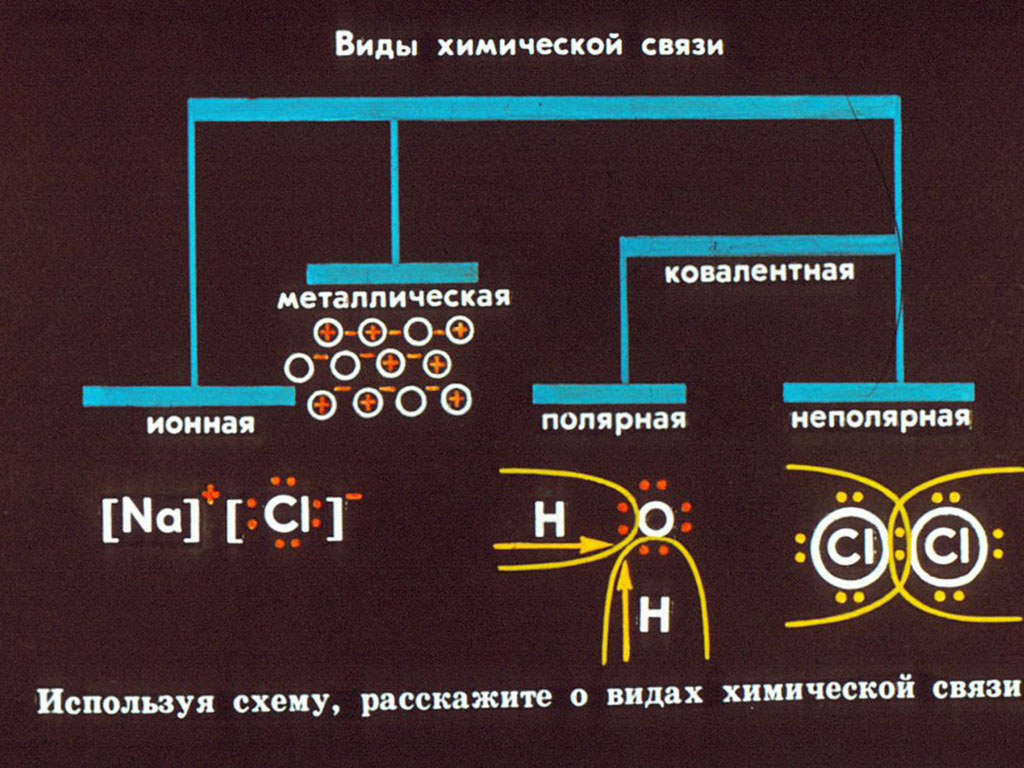
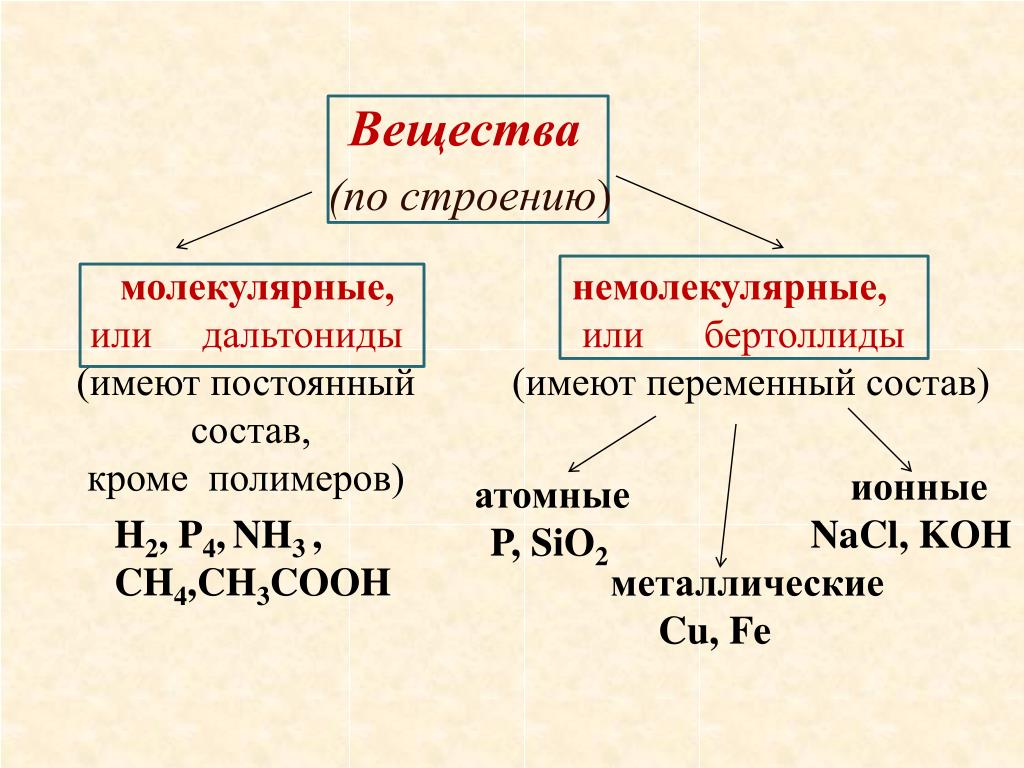
- Ионная кристаллическая решетка — характерна для соединений с ионной связью, в узлах решетки находятся, соответственно, ионы. Связи очень прочные, поэтому и температуры плавления высокие. Ее образуют неорганические
- Атомная кристаллическая решетка — связь — ковалентная, очень прочная. Примером может служить алмаз — вещество, имеющее максимальный показатель твердости, очень низкая растворимость, малореакционноспособны.

Характерна для B, Si, Ge, силициды (Si4- ), карбиды и нитриды бора, SiO2 - Молекулярная кристаллическая решетка — состоит из молекул, которые удерживаются между собой межмолекулярными связями, поэтому они непрочные — низкие температуры плавления, неэлектропроводны. Молекулярную кристаллическую решетку имеют все твердые вещества с полярной или неполярной ковалентной связью: J
- Металлическая кристаллическая решетка — в узлах содержит атомы и ионы металлов. Очень прочная металлическая связь со всеми характерными свойствами: делокализованное электронное облако, электро- и теплопроводность, металлический блеск, пластичность, ковкость.
Получается, что металлическая и атомарная кристаллические решетки схожи, но есть

Для определения типа кристаллической решетки необходимо сначала определить — имеет вещество молекулярное или немолекулярное строение, затем уже определить вид химической связи и по нему уже выбирать вариант решетки.
[TESTME 29]
- Подписка на рассылку
(Правила комментирования)
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения / Справочник :: Бингоскул
Неорганические и органические соединения отличаются по строению. Меньше веществ, образованных молекулами. Гораздо чаще встречается немолекулярные соединения. Частицы веществ могут быть упорядочены расположены в пространстве, образуют кристаллическую решетку. Тип структуры влияет на свойства различных химических соединений.
Молекулярное и немолекулярное строение веществ
Представления о существовании атомов возникли в древности.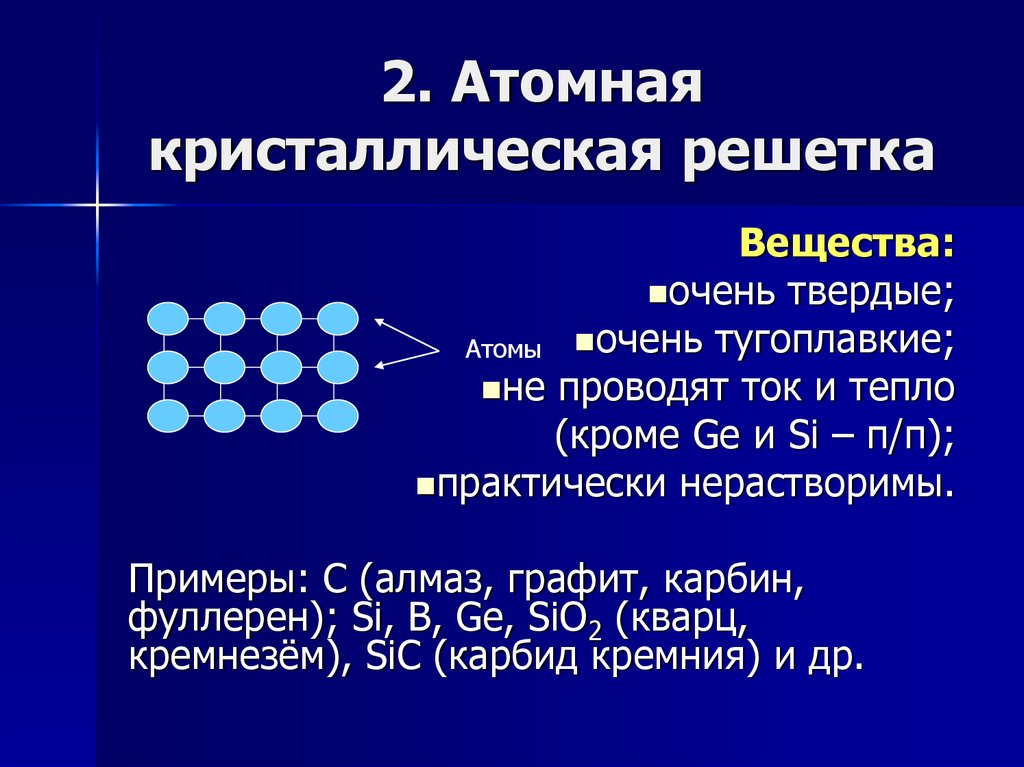 Греческое название переводится как «неделимые». Долгое время термины «атом», «корпускула», «молекула» были почти синонимами. Ясность внесли химики всего мира в 1860 году. Ученые приняли решение называть атомами мельчайшие частицы вещества. Они могут входить в состав молекул и немолекулярных структур.
Греческое название переводится как «неделимые». Долгое время термины «атом», «корпускула», «молекула» были почти синонимами. Ясность внесли химики всего мира в 1860 году. Ученые приняли решение называть атомами мельчайшие частицы вещества. Они могут входить в состав молекул и немолекулярных структур.
Строение — это характеристика структурных единиц вещества, их расположение в пространстве (кристаллическая решетка).
Таблица 1.
Типы веществ по строению
Типы | Общие признаки | Тип кристаллической решетки |
Вещества молекулярного строения. | Мельчайшие структурные единицы (частицы) — молекулы. | Молекулярная. |
Вещества немолекулярного строения. | Мельчайшие структурные частицы — атомы или ионы. | Атомная, ионная или металлическая. |
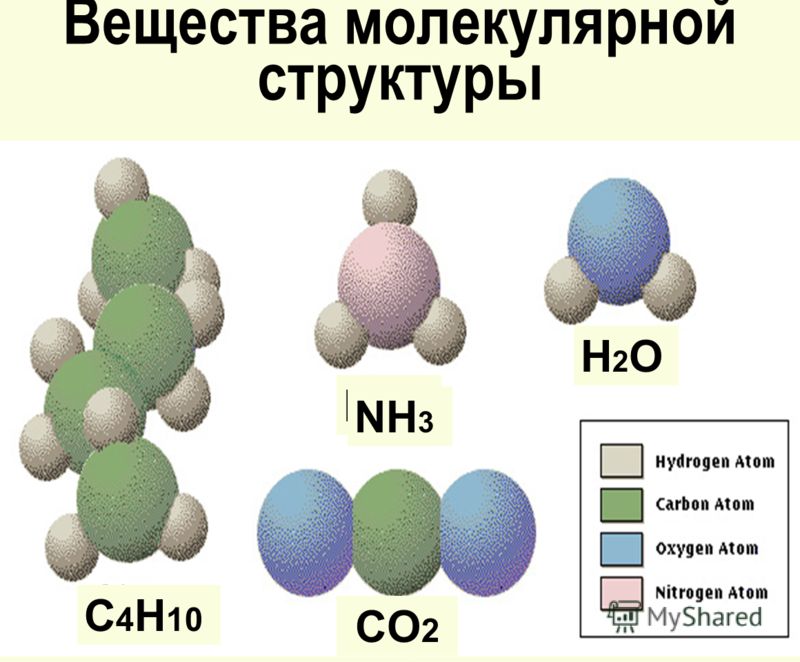
Неметаллы, их соединения — вещества преимущественно молекулярного строения. Водород, кислород, азот, хлор, моно- и диоксид углерода, аммиак состоят из молекул сравнительно небольшого размера. Состав отражают формулы Н2, О2, N2, Cl2, СО, СО2, NH3. Наиболее распространенное вещество молекулярного строения — вода (Н2О) (Рис. 1).
Рис. 1. Строение молекулы водыАгрегатное состояние при разных температурах отличается. В обычных условиях эти вещества являются газами. Вода при комнатной температуре — жидкость, при 0°С — превращается в лед, имеющий кристаллическое строение. При 100°С образуется газ (пар).
Сахар и другие твердые органические вещества тоже состоят из молекул. Состав глюкозы отражает формула С6Н12О6. На рис. 2 показано пространственное расположение атомов в молекуле.
На рис. 2 показано пространственное расположение атомов в молекуле.
Немолекулярных соединений в природе гораздо больше. К этой группе относятся инертные газы, алмаз, графит (аллотропные видоизменения, модификации углерода), минерал кварц, различные соли, металлы. Это преимущественно твердые вещества (при комнатной температуре). Исключение — ртуть, жидкий металл, затвердевающий лишь при –30°С. Среди веществ немолекулярного строения встречаются наиболее твердые и тугоплавкие, обладающие высокой тепло- и электропроводностью.
Кристаллические решетки: типы и примеры
Структурные частицы природных и искусственно полученных веществ находятся в определенных точках пространства, на расстоянии друг от друга. Упорядоченное расположение называют кристаллической решеткой. В ее узлах находятся атомы, ионы или молекулы. На рисунках они обычно изображены кружочками. Черточками между ними условно обозначают химические связи.
Шаро-стержневые объемные модели тоже помогают лучше представить расположение структурных единиц в пространстве. Шарики символизируют частицы вещества, стержни между ними — химическую связь, как на рис. 3.
Шарики символизируют частицы вещества, стержни между ними — химическую связь, как на рис. 3.
Вещества кристаллического строения широко распространены, имеют большое практическое значение. Они встречаются в природе, находят применение в промышленности, медицине, сельском хозяйстве, быту. (Рис. 4).
Рис. 4. Кристаллические решетки и примеры веществРассмотрим особенности четырех основных типов кристаллической решетки.
Атомная
Такие кристаллические структуры распространены среди простых веществ. В узлах находятся атомы. Примеры веществ: графит и алмаз (аллотропные видоизменения, модификации углерода), кремний.
Прочную атомную кристаллическую решетку также имеют горный хрусталь и кварц (минералы состоят из диоксида кремния). Отличие от простых веществ существенное — в узлах находятся атомы кремния и кислорода, т. е. разных элементов.
Вещества атомного строения обычно твердые (за исключением графита), нерастворимые в воде, тугоплавкие, являются изоляторами или полупроводниками.
Молекулярная
В узлах кристаллической решетки — молекулы. Простые вещества с этим типом пространственного строения: S8 — кристаллическая сера, Р4 — белый фосфор, Br2 — бром, I2 — кристаллический йод. Н2О в виде льда, СО2 («сухой лед») — сложные вещества с молекулярной кристаллической решеткой.
Силы притяжения между структурными единицами относительно слабые, поэтому связи легко разрушаются. Например, йод возгоняется — переходит из твердого состояния в газообразное при комнатной температуре. (Рис. 5, 6).
Рис. 5. Кристаллический йод и раствор в спиртеРис. 6. Строение кристаллов йодаТвердые органические соединения тоже имеют преимущественно молекулярную решетку. Это непрочные структуры, которые разрушаются при повышении температуры, растворении в воде.
Ионная
В узлах расположены ионы — заряженные частицы. Классический пример вещества с этим типом кристаллической решеткой — поваренная соль или хлорид натрия.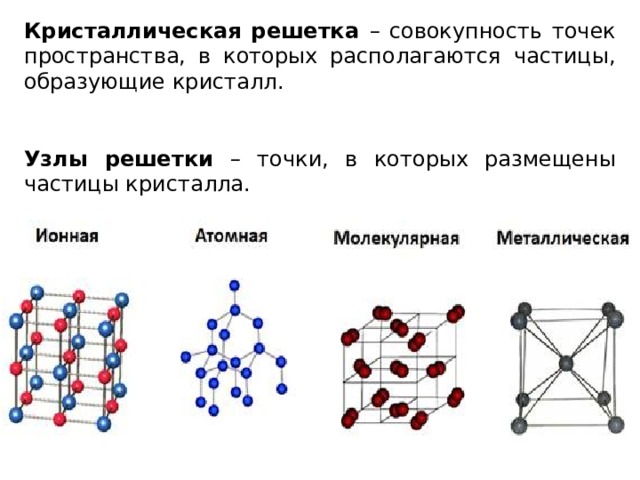 (Рис. 7).
(Рис. 7).
Катионы — положительно заряженные частицы. В электрическом поле они перемещаются к отрицательному полюсу источника тока (катоду). Отрицательные ионы движутся к аноду, имеющему заряд «+».
Ионная решетка характерна для солей, оксидов и гидроксидов металлов I–III групп периодической системы, большой группы соединений металлических элемент из других групп. Такие вещества обычно твердые и тугоплавкие.
Ионы высвобождаются при расплавлении и растворении. Расплавы и растворы являются электролитами, проводниками электрического тока, более слабыми, по сравнению с металлами.
Металлическая
Есть значительные отличия от трех предыдущих типов кристаллического строения. В узлах расположены нейтральные атомы и катионы. Между ними беспорядочно движутся электроны, образующие так называемый «электронный газ». (Рис. 8).
Рис. 8. Строение металлаМеталлы, их сплавы — твердые вещества, имеющие металлический блеск. Они тугоплавкие, обладают высокой тепло- и электропроводностью.
Они тугоплавкие, обладают высокой тепло- и электропроводностью.
Все известные соединения состоят из атомов, молекул либо ионов. Упорядоченное расположение структурных единиц в пространстве — кристаллическая решетка. Физические свойства веществ во многом определяются типом соединения частиц.
Труднее разрушается атомная, легче — молекулярная кристаллическая решетка. Чтобы «освободить» частицы в составе ионного кристалла, достаточно растворить или расплавить вещество. Особенностью металлической решетки является наличие «электронного газа», высокая электропроводность веществ.
Смотри также:
- Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
- Электроотрицательность. Степень окисления и валентность химических элементов
форм молекул
В молекулах с более чем одной связью обе формы и полярность связи определяют, является ли молекула полярной . А молекула должна содержат полярные связи, чтобы молекула была полярной, но если полярные связи выровнены точно напротив друг друга, или если они достаточно симметричны, полярность связи уравновешивается, что делает молекула неполярная. (Полярность является векторной величиной, поэтому оба величина и направление
Например, рассмотрим точечную структуру Льюиса для углекислый газ. Это линейная молекула, содержащая два полярных двойные связи углерод-кислород. Однако, поскольку полярные связи направлены ровно на 180 градусов друг от друга, полярности связей компенсируются, и молекула неполярна. (В качестве аналогии вы можете представить себе, что это как игра в перетягивание каната между двумя командами, которые тянут веревку одинаково тяжело.)
Молекула воды также содержит полярные связи, но
поскольку это изогнутая молекула, связи расположены под углом друг к другу
около 105.
Молекулы, в которых все атомы, окружающие центральные атомы одинаковы, имеют тенденцию быть неполярными, если нет неподеленных пар на центральном атоме. Если некоторые из атомов, окружающих центральный атом различны, однако молекула может быть полярной. например, углерод тетрахлорид, CCl
Полярность молекулы сильно влияет на ее
физические свойства. Молекулы, которые более полярны, имеют более сильную
межмолекулярные силы между ними и имеют, как правило, более высокую температуру кипения
точки (а также другие различные физические свойства).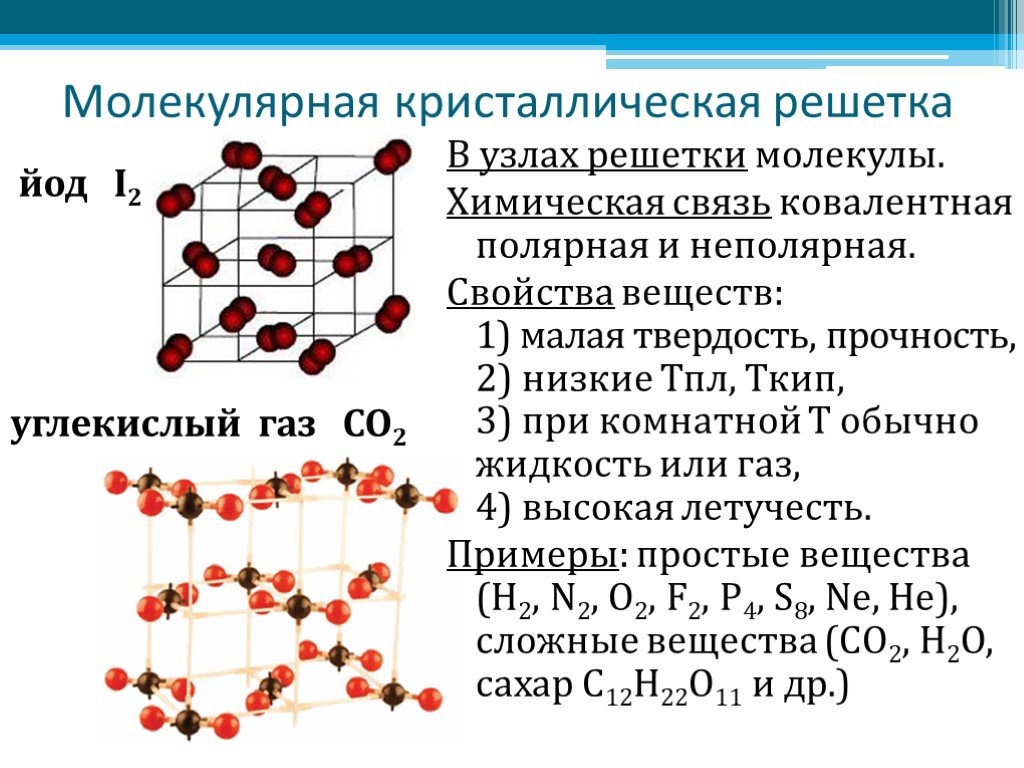
В таблице ниже показано, соответствуют ли примеры в предыдущие разделы являются полярными или неполярными. Для видов, имеющих общий заряд, вместо него используется термин «взимаемый», поскольку термины полярные и неполярные на самом деле не относятся к заряженным частицам; взимается виды по определению существенно полярны. Одиночные пары на некоторых внешних атомы опущены для ясности.
| Формула | Льюис Структура | 3D-структура Форма Полярность | Пояснение |
1. | Ч 4 | четырехгранный неполярный | Связь CH
неполярный, так как C и H отличаются всего на 0,35
единицы электроотрицательности. | |
2. | НХ 3 | треугольный пирамидальный полярный | С тех пор молекула не плоская, связи NH не направлены непосредственно друг на друга, и их полярности не отменяют вне. Кроме того, имеется небольшой диполь в направлении одинокой пары. | |
3. | Н 2 О | изогнутый полярный | С тех пор молекула изогнута, связи ОН не направлены прямо на друг друга, и их полярности не уравновешиваются. | |
4. | Н 3 О + | треугольный пирамидальный заряжен | С тех пор
виды заряжены, термины полярные и неполярные
не имеющий отношения. | |
5. | HCN | линейный полярный | Линейные молекулы обычно неполярны, но в этом случае не все атомы связанные с центральным атомом, одинаковы. Облигация CN полярна и не компенсируется неполярной связью CH. | |
6. | СО | линейный неполярный | Полярный C=O связи ориентированы на 180 градусов друг от друга. Полярность этих связей уравновешивается, делая молекулу неполярной. | |
7. | ККл 4 | четырехгранный неполярный | Полярный CCl
связи ориентированы на 109,5 друг от друга. | |
8. | COCl 2 | треугольная планарная полярный | Тригональная планарная молекулы обычно неполярны, но в этом случае не все атомы, связанные с центральным атомом, одинаковы. полярность связи не компенсируется полностью, и молекула полярна. (Если было три O или три Cls прикрепленный к центральному C, он был бы неполярным.) | |
9. | О 3 | изогнутый полярный | Изогнутые молекулы
всегда полярны. Хотя кислород-кислородные связи
неполярный, неподеленная пара на центральном O вносит некоторый вклад
полярность молекулы. | |
10. | СО 3 2- | треугольная планарная заряжен | С тех пор виды заряжены, термины полярные и неполярные не имеющий отношения. | |
11. | С 2 Н 6 | четырехгранный неполярный | Оба атома углерода четырехгранные; поскольку связи CH и связь CC неполярный, молекула неполярная. | |
12. | С 2 Н 4 | треугольная планарная неполярный | Оба атома углерода
тригонально-плоские; поскольку связи CH и связь CC
неполярны, молекула неполярна. | |
13. | CH 3 CH 2 ОН | C: тетраэдрический О: изогнутый полярный | CC и CH связи не влияют на полярность молекулы, но связи CO и OH полярны, так как форма вокруг атом О изогнут, молекула должна быть полярной. | |
14. | БФ 3 | треугольная планарная неполярный | С тех пор молекула плоская, все три полярные связи BF находятся в той же плоскости, ориентированной на 120° друг от друга, что делает молекула неполярная. | |
15. | № | линейный полярный | Так как есть
только одна связь в этой молекуле, и связь полярная, т. | |
16. | ПКл 5 | треугольный бипирамидальный неполярный | Связи PCl в экваториальные положения этой молекулы ориентированы на 120 друг от друга, и полярность их связей уравновешивается. Связи PCl в аксиальных положениях отстоят на 180° от друг друга, и полярность их связей также уравновешивается. | |
17. | СФ 6 | восьмигранный неполярный | Облигации SF в все эти молекулы находятся на расстоянии 90° друг от друга, и их полярность связи уравновешивается. | |
18. | СФ 4 | качели полярный | Облигации SF в
осевые положения отстоят друг от друга на 90°, а их полярность связи
отменяет. | |
19. | XEF 4 | квадратный плоский неполярный | Облигации XeF все ориентированы на 90° друг от друга, и их связь полярности уравновешиваются. Одинокие пары находятся на расстоянии 180° от друг друга, и их небольшие полярности также уравновешиваются. | |
20. | H 2 SO 4 | S: четырехгранный О: изогнутый полярный | Эта молекула полярны из-за изогнутых связей HOS, которые присутствуют в это. |
2.
 6: Молекулы и молекулярные соединения
6: Молекулы и молекулярные соединения- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21702
Цели обучения
- понять разницу между ковалентной и ионной связью.
Атомы всех веществ, содержащих несколько атомов, удерживаются вместе за счет электростатических взаимодействий — взаимодействий между электрически заряженными частицами, такими как протоны и электроны. Электростатическое притяжение между противоположно заряженными частицами (положительным и отрицательным) приводит к возникновению силы, которая заставляет их двигаться навстречу друг другу, подобно притяжению между противоположными полюсами двух магнитов.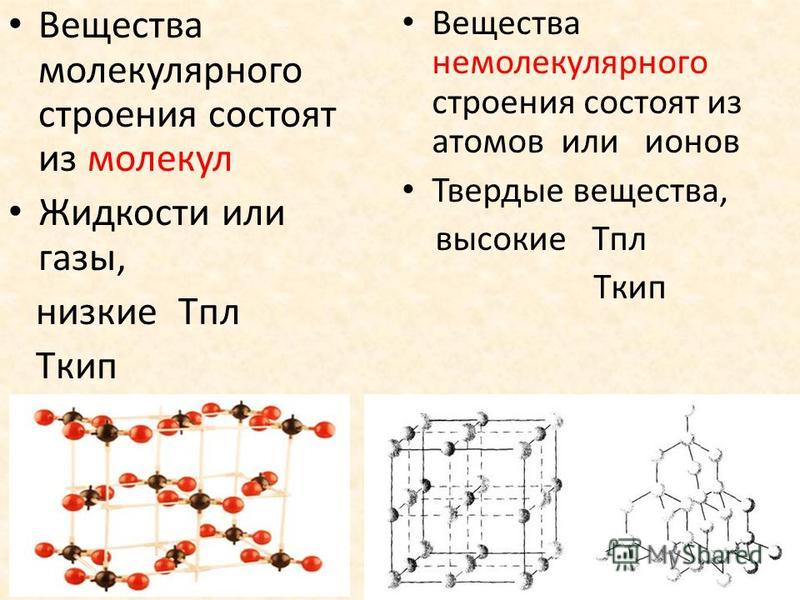 Напротив, электростатическое отталкивание между двумя видами с одинаковым зарядом (как положительным, так и отрицательным) приводит к силе, которая заставляет их отталкивать друг друга, как это делают одинаковые полюса двух магнитов. Атомы образуют химические соединения, когда электростатические взаимодействия притяжения между ними сильнее, чем взаимодействия отталкивания. В совокупности притягивающие взаимодействия между атомами называются химическими связями.
Напротив, электростатическое отталкивание между двумя видами с одинаковым зарядом (как положительным, так и отрицательным) приводит к силе, которая заставляет их отталкивать друг друга, как это делают одинаковые полюса двух магнитов. Атомы образуют химические соединения, когда электростатические взаимодействия притяжения между ними сильнее, чем взаимодействия отталкивания. В совокупности притягивающие взаимодействия между атомами называются химическими связями.
Химические связи обычно делятся на два принципиально разных типа: ионные и ковалентные. В действительности, однако, связи в большинстве веществ не являются ни чисто ионными, ни чисто ковалентными, а лежат в спектре между этими крайностями. Хотя чисто ионные и чисто ковалентные связи представляют собой крайние случаи, редко встречающиеся в каких-либо, кроме очень простых веществ, краткое обсуждение этих двух крайностей помогает объяснить, почему вещества с различными видами химических связей обладают очень разными свойствами. Ионные соединения состоят из положительно и отрицательно заряженных ионов, удерживаемых вместе сильными электростатическими силами, тогда как ковалентные соединения обычно состоят из молекул, представляющих собой группы атомов, в которых одна или несколько пар электронов являются общими для связанных атомов. В ковалентной связи атомы удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, которые они разделяют. Это обсуждение структур и формул начинается с описания ковалентных соединений. Энергетические факторы, участвующие в образовании связи, более подробно описаны ниже.
Ионные соединения состоят из положительно и отрицательно заряженных ионов, удерживаемых вместе сильными электростатическими силами, тогда как ковалентные соединения обычно состоят из молекул, представляющих собой группы атомов, в которых одна или несколько пар электронов являются общими для связанных атомов. В ковалентной связи атомы удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, которые они разделяют. Это обсуждение структур и формул начинается с описания ковалентных соединений. Энергетические факторы, участвующие в образовании связи, более подробно описаны ниже.
Ионные соединения состоят из ионов с противоположными зарядами, удерживаемых вместе сильными электростатическими силами, тогда как пары электронов являются общими для связанных атомов в ковалентных соединениях.
Ковалентные молекулы и соединения
Точно так же, как атом является простейшей единицей, обладающей фундаментальными химическими свойствами элемента, молекула является простейшей единицей, обладающей фундаментальными химическими свойствами ковалентного соединения. Некоторые чистые элементы существуют в виде ковалентных молекул. Водород, азот, кислород и галогены встречаются в природе в виде двухатомных («два атома») молекул H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 и I 2 Индекс ). Точно так же несколько чистых элементов существуют в виде многоатомных («многоатомных») молекул, таких как элементарный фосфор и сера, которые встречаются как P 4 и S 8 (часть (b) на рисунке \(\PageIndex{1} \)).
Некоторые чистые элементы существуют в виде ковалентных молекул. Водород, азот, кислород и галогены встречаются в природе в виде двухатомных («два атома») молекул H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 и I 2 Индекс ). Точно так же несколько чистых элементов существуют в виде многоатомных («многоатомных») молекул, таких как элементарный фосфор и сера, которые встречаются как P 4 и S 8 (часть (b) на рисунке \(\PageIndex{1} \)).
Каждое ковалентное соединение представлено молекулярной формулой, которая дает атомный символ для каждого составляющего элемента в установленном порядке, сопровождаемый нижним индексом, указывающим количество атомов этого элемента в молекуле. Нижний индекс записывается только в том случае, если количество атомов больше 1. Например, вода с двумя атомами водорода и одним атомом кислорода на молекулу записывается как \(H_2O\). Точно так же углекислый газ, который содержит один атом углерода и два атома кислорода в каждой молекуле, записывается как \(CO_2\).
Ковалентные соединения, содержащие преимущественно углерод и водород, называются органическими соединениями. При представлении формул органических соединений принято сначала писать углерод, затем водород, а затем любые другие элементы в алфавитном порядке (например, CH 4 O — метиловый спирт, топливо). Соединения, которые состоят в основном из элементов, отличных от углерода и водорода, называются неорганическими соединениями; они включают как ковалентные, так и ионные соединения. В неорганических соединениях составные элементы перечислены, начиная с самого левого в периодической таблице, как в CO 2 или SF 6 . Те, кто находится в одной группе, перечислены, начиная с нижнего элемента и вверх, как в ClF. Однако по соглашению, когда неорганическое соединение содержит как водород, так и элемент из групп 13–15, водород обычно указывается в формуле последним. Примерами являются аммиак (NH 3 ) и силан (SiH 4 ). Такие соединения, как вода, состав которых был установлен задолго до того, как было принято это соглашение, всегда пишутся сначала с водородом: вода всегда пишется как H 2 О, а не ОН 2 . Условные обозначения для неорганических кислот, таких как соляная кислота (HCl) и серная кислота (H 2 SO 4 ), описаны в разделе 2.
Соединения, которые состоят в основном из элементов, отличных от углерода и водорода, называются неорганическими соединениями; они включают как ковалентные, так и ионные соединения. В неорганических соединениях составные элементы перечислены, начиная с самого левого в периодической таблице, как в CO 2 или SF 6 . Те, кто находится в одной группе, перечислены, начиная с нижнего элемента и вверх, как в ClF. Однако по соглашению, когда неорганическое соединение содержит как водород, так и элемент из групп 13–15, водород обычно указывается в формуле последним. Примерами являются аммиак (NH 3 ) и силан (SiH 4 ). Такие соединения, как вода, состав которых был установлен задолго до того, как было принято это соглашение, всегда пишутся сначала с водородом: вода всегда пишется как H 2 О, а не ОН 2 . Условные обозначения для неорганических кислот, таких как соляная кислота (HCl) и серная кислота (H 2 SO 4 ), описаны в разделе 2. 8.
8.
Для органических соединений: сначала напишите C, затем H, а затем остальные элементы в алфавитном порядке. Для молекулярных неорганических соединений: начните с крайне левого элемента периодической таблицы; перечислите элементы в той же группе, начиная с нижнего элемента и работая вверх.
Пример \(\PageIndex{1}\)
Напишите молекулярную формулу каждого соединения.
- Соединение фосфора и серы, ответственное за воспламенение так называемых зажигательных спичек, содержит 4 атома фосфора и 3 атома серы на молекулу.
- Этиловый спирт, спирт алкогольных напитков, имеет 1 атом кислорода, 2 атома углерода и 6 атомов водорода на молекулу. Фреон-11
- , когда-то широко использовавшийся в автомобильных кондиционерах и причастный к повреждению озонового слоя, имеет 1 атом углерода, 3 атома хлора и 1 атом фтора на молекулу.
Дано : идентификация присутствующих элементов и число атомов каждого
Запрошено : молекулярная формула
Стратегия :
- Определите символ для каждого элемента в молекуле.
 Затем идентифицируйте вещество как органическое или неорганическое соединение.
Затем идентифицируйте вещество как органическое или неорганическое соединение. - Если вещество является органическим соединением, расположите элементы в порядке, начиная с углерода и водорода, а затем перечислите остальные элементы в алфавитном порядке. Если это неорганическое соединение, перечислите элементы, начиная с самого левого в периодической таблице. Перечислите элементы в одной группе, начиная с нижнего элемента и вверх.
- Из предоставленной информации добавьте нижний индекс для каждого вида атома, чтобы написать молекулярную формулу.
Раствор
a
- В молекуле 4 атома фосфора и 3 атома серы. Поскольку соединение не содержит в основном углерод и водород, оно является неорганическим.
- Фосфор находится в группе 15, а сера в группе 16. Поскольку фосфор находится слева от серы, он пишется первым.
- Запись количества атомов каждого вида в правом нижнем индексе дает P 4 S 3 в качестве молекулярной формулы.

б.
- Этиловый спирт содержит преимущественно углерод и водород, поэтому он является органическим соединением.
- Формула органического соединения записывается так, чтобы сначала число атомов углерода, затем число атомов водорода и остальные атомы в алфавитном порядке: CHO.
- Добавление нижних индексов дает молекулярную формулу ]\(C_2H_6O\).
c
- Фреон-11 содержит углерод, хлор и фтор. Его можно рассматривать либо как неорганическое соединение, либо как органическое соединение (в котором фтор заменил водород). Таким образом, формула для фреона-11 может быть записана с использованием любого из двух соглашений.
- Согласно соглашению для неорганических соединений, углерод пишется первым, потому что он находится дальше слева в таблице Менделеева. Фтор и хлор находятся в одной группе, поэтому они перечислены, начиная с низшего элемента и вверх: CClF. Добавление нижних индексов дает молекулярную формулу CCl 3 F.

- Получим такую же формулу для фреона-11, используя условное обозначение для органических соединений. Сначала записывается число атомов углерода, затем число атомов водорода (ноль), а затем остальные элементы в алфавитном порядке, что также дает CCl 9.0003 3 Факс
Упражнение \(\PageIndex{1}\)
Напишите молекулярную формулу каждого соединения.
- Закись азота, также называемая «веселящим газом», имеет 2 атома азота и 1 атом кислорода на молекулу. Закись азота используется в качестве мягкого анестетика при небольших хирургических вмешательствах и в качестве пропеллента в банках со взбитыми сливками.
- Сахароза, также известная как тростниковый сахар, имеет 12 атомов углерода, 11 атомов кислорода и 22 атома водорода.
- Гексафторид серы, газ, используемый для создания давления в теннисных мячах без давления и в качестве охлаждающей жидкости в ядерных реакторах, содержит 6 атомов фтора и 1 атом серы на молекулу.

- Ответить на
Н 2 О
- Ответ б
С 12 Н 22 О 11
- Ответ c
СФ 6
Представление молекулярных структур
Молекулярные формулы дают только элементный состав молекул. Напротив, структурные формулы показывают, какие атомы связаны друг с другом, а в некоторых случаях и приблизительное расположение атомов в пространстве. Знание структурной формулы соединения позволяет химикам создать трехмерную модель, которая предоставляет информацию о том, как это соединение будет вести себя физически и химически.
Рисунок \(\PageIndex{2}\): Молекулы, содержащие одинарные, двойные и тройные связи. Водород (H 2 ) имеет одинарную связь между атомами. Кислород (O 2 ) имеет двойную связь между атомами, обозначенную двумя линиями (=). Азот (N 2 ) имеет тройную связь между атомами, обозначенную тремя линиями (≡). Каждая связь представляет собой электронную пару.
Азот (N 2 ) имеет тройную связь между атомами, обозначенную тремя линиями (≡). Каждая связь представляет собой электронную пару. Структурная формула для H 2 может быть представлена как H–H, а для I 2 – как I–I, где линия указывает на одну пару общих электронов, одинарную связь. Две пары электронов являются общими в двойной связи, что обозначено двумя линиями, например, O 2 равно О=О. Три пары электронов являются общими в тройной связи, что обозначено тремя линиями — например, N 2 — это N≡N (см. рисунок \(\PageIndex{2}\)). Углерод уникален тем, что он образует одинарные, двойные и тройные связи с самим собой и другими элементами. Количество связей, образуемых атомом в его ковалентных соединениях, не является произвольным. Водород, кислород, азот и углерод имеют очень сильную склонность к образованию веществ, в которых они имеют соответственно одну, две, три и четыре связи с другими атомами (таблица \(\PageIndex{1}\)).
| Атом | Количество облигаций |
|---|---|
| H (группа 1) | 1 |
| О (группа 16) | 2 |
| Н (группа 15) | 3 |
| С (группа 14) | 4 |
Структурную формулу воды можно изобразить следующим образом:
Поскольку последняя аппроксимирует экспериментально определенную форму молекулы воды, она более информативна. Точно так же аммиак (NH 3 ) и метан (CH 4 ) часто записывают в виде плоских молекул: куб. Многие соединения, в частности соединения углерода, имеют четыре связанных атома, расположенных вокруг центрального атома и образующих тетраэдр. Рисунок \(\PageIndex{3}\): Трехмерные структуры воды, аммиака и метана. а) Вода представляет собой молекулу V-образной формы, в которой все три атома лежат в одной плоскости. (b) Напротив, аммиак имеет пирамидальную структуру, в которой три атома водорода образуют основание пирамиды, а атом азота находится в вершине. в) четыре атома водорода метана образуют тетраэдр; атом углерода находится в центре. A: Изогнутая конфигурация H 2 O. B: Тригонально-пирамидальная конфигурация аммиака. C: Тетраэдрическая конфигурация метана. Метан \(CH_4\) имеет трехмерную тетраэдрическую структуру.
Многие соединения, в частности соединения углерода, имеют четыре связанных атома, расположенных вокруг центрального атома и образующих тетраэдр. Рисунок \(\PageIndex{3}\): Трехмерные структуры воды, аммиака и метана. а) Вода представляет собой молекулу V-образной формы, в которой все три атома лежат в одной плоскости. (b) Напротив, аммиак имеет пирамидальную структуру, в которой три атома водорода образуют основание пирамиды, а атом азота находится в вершине. в) четыре атома водорода метана образуют тетраэдр; атом углерода находится в центре. A: Изогнутая конфигурация H 2 O. B: Тригонально-пирамидальная конфигурация аммиака. C: Тетраэдрическая конфигурация метана. Метан \(CH_4\) имеет трехмерную тетраэдрическую структуру.
Рисунки \(\PageIndex{1}\), \(\PageIndex{2}\) и \(\PageIndex{3}\) иллюстрируют различные способы представления структуры молекул. Должно быть ясно, что не существует единственного «наилучшего» способа изобразить структуру молекулы; используемый метод зависит от того, какой аспект структуры следует подчеркнуть и сколько времени и усилий требуется. На рисунке \(\PageIndex{4}\) показаны различные способы изображения структуры несколько более сложной молекулы: метанола. Эти представления сильно различаются по своей информативности. Например, молекулярная формула метанола (рис. \(\PageIndex{4a}\)) дает только количество атомов каждого вида; запись метанола как CH 4 O ничего не говорит о его структуре. Напротив, структурная формула (рис. \(\PageIndex{4b}\)) показывает, как связаны атомы, но метанол выглядит плоским (что на самом деле не так). И шаростержневая модель (часть (c) на рисунке \(\PageIndex{4}\)) и перспективный рисунок (рисунок \(\PageIndex{4d}\)) показывают трехмерную структуру молекулы. . Последнее (также называемое клино-штриховым представлением) — самый простой способ зарисовать структуру молекулы в трех измерениях. Он показывает, какие атомы находятся выше и ниже плоскости бумаги, используя клинья и штрихи соответственно; центральный атом всегда предполагается находящимся в плоскости бумаги. Модель заполнения пространства (часть (e) на рисунке \(\PageIndex{4}\)) иллюстрирует приблизительные относительные размеры атомов в молекуле, но не показывает связи между атомами.
На рисунке \(\PageIndex{4}\) показаны различные способы изображения структуры несколько более сложной молекулы: метанола. Эти представления сильно различаются по своей информативности. Например, молекулярная формула метанола (рис. \(\PageIndex{4a}\)) дает только количество атомов каждого вида; запись метанола как CH 4 O ничего не говорит о его структуре. Напротив, структурная формула (рис. \(\PageIndex{4b}\)) показывает, как связаны атомы, но метанол выглядит плоским (что на самом деле не так). И шаростержневая модель (часть (c) на рисунке \(\PageIndex{4}\)) и перспективный рисунок (рисунок \(\PageIndex{4d}\)) показывают трехмерную структуру молекулы. . Последнее (также называемое клино-штриховым представлением) — самый простой способ зарисовать структуру молекулы в трех измерениях. Он показывает, какие атомы находятся выше и ниже плоскости бумаги, используя клинья и штрихи соответственно; центральный атом всегда предполагается находящимся в плоскости бумаги. Модель заполнения пространства (часть (e) на рисунке \(\PageIndex{4}\)) иллюстрирует приблизительные относительные размеры атомов в молекуле, но не показывает связи между атомами.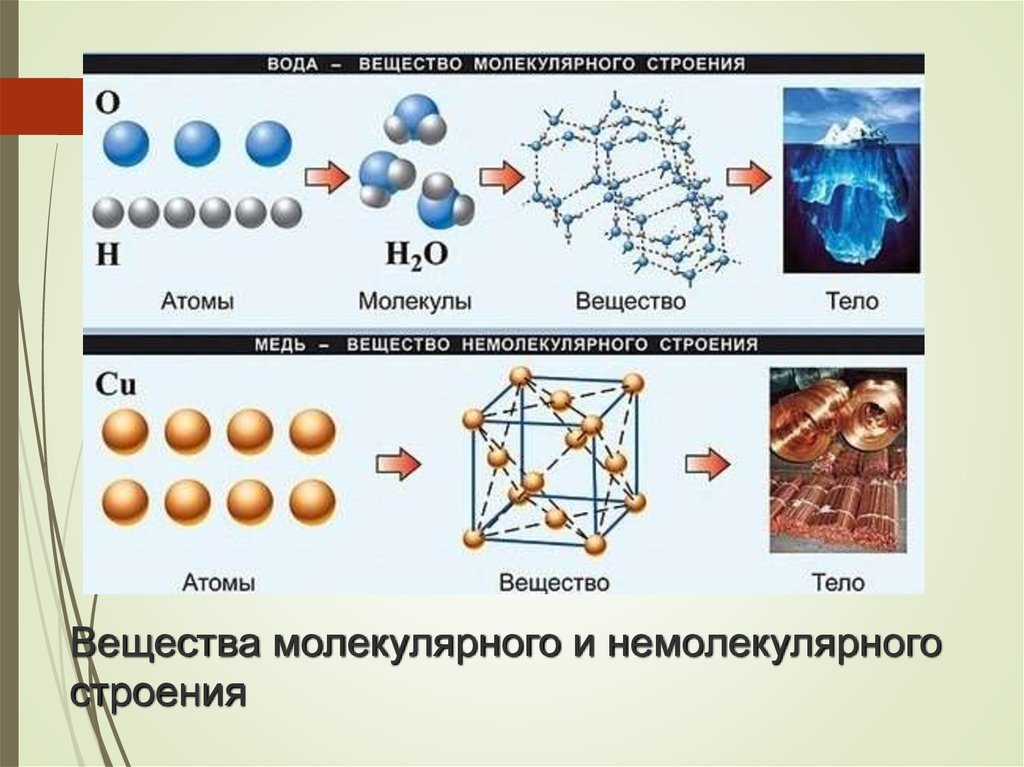 Кроме того, в модели заполнения пространства атомы «впереди» молекулы могут заслонять атомы «сзади».
Кроме того, в модели заполнения пространства атомы «впереди» молекулы могут заслонять атомы «сзади».
Хотя структурная формула, шаростержневая модель, перспективный чертеж и модель заполнения пространства предоставляют значительный объем информации о структуре молекулы, каждая из них требует времени и усилий. Следовательно, химики часто используют сокращенную структурную формулу (часть (f) на рисунке \(\PageIndex{4}\)), в которой опущены линии, представляющие связи между атомами, и просто перечислены атомы, связанные с данным атомом рядом с ним. Несколько групп, присоединенных к одному и тому же атому, показаны в круглых скобках, за которыми следует нижний индекс, указывающий количество таких групп. Например, сокращенная структурная формула метанола — CH 3 OH, что указывает на наличие в молекуле звена CH 3 , похожего на фрагмент метана (CH 4 ). Таким образом, метанол можно рассматривать либо как молекулу метана, в которой один атом водорода заменен группой –ОН, либо как молекулу воды, в которой один атом водорода заменен фрагментом –СН 3 . Из-за простоты использования и информативности мы используем сокращенные структурные формулы для молекул в этом тексте. Шарико-стержневые модели используются, когда необходимо проиллюстрировать трехмерную структуру молекул, а заполняющие пространство модели используются только тогда, когда необходимо визуализировать относительные размеры атомов или молекул, чтобы понять важный момент.
Несколько групп, присоединенных к одному и тому же атому, показаны в круглых скобках, за которыми следует нижний индекс, указывающий количество таких групп. Например, сокращенная структурная формула метанола — CH 3 OH, что указывает на наличие в молекуле звена CH 3 , похожего на фрагмент метана (CH 4 ). Таким образом, метанол можно рассматривать либо как молекулу метана, в которой один атом водорода заменен группой –ОН, либо как молекулу воды, в которой один атом водорода заменен фрагментом –СН 3 . Из-за простоты использования и информативности мы используем сокращенные структурные формулы для молекул в этом тексте. Шарико-стержневые модели используются, когда необходимо проиллюстрировать трехмерную структуру молекул, а заполняющие пространство модели используются только тогда, когда необходимо визуализировать относительные размеры атомов или молекул, чтобы понять важный момент.
Пример \(\PageIndex{2}\): Молекулярные формулы
Напишите молекулярную формулу для каждого соединения..jpeg) Приведена сокращенная структурная формула.
Приведена сокращенная структурная формула.
- Монохлорид серы (также называемый дихлоридом серы) представляет собой коррозионно-желтую жидкость с неприятным запахом, используемую в производстве синтетического каучука. Его сокращенная структурная формула ClSSCl.
- Этиленгликоль является основным компонентом антифриза. Его сокращенная структурная формула HOCH 2 CH 2 9.0004 ОН.
- Триметиламин – одно из веществ, ответственных за запах испорченной рыбы. Его сокращенная структурная формула (CH 3 ) 3 N.
Дано : сокращенная структурная формула
Запрошено : молекулярная формула
Стратегия :
- Определите каждый элемент в сокращенной структурной формуле, а затем определите, является ли соединение органическим или неорганическим.
- При необходимости используйте органические или неорганические обозначения для перечисления элементов.
 Затем добавьте соответствующие нижние индексы, чтобы указать количество атомов каждого элемента, присутствующего в молекулярной формуле.
Затем добавьте соответствующие нижние индексы, чтобы указать количество атомов каждого элемента, присутствующего в молекулярной формуле.
Решение :
Молекулярная формула содержит список элементов в молекуле и количество атомов каждого из них.
- A Каждая молекула монохлорида серы содержит два атома серы и два атома хлора. Поскольку он не содержит в основном углерод и водород, это неорганическое соединение. B Сера находится слева от хлора в таблице Менделеева, поэтому в формуле она пишется первой. Добавление нижних индексов дает молекулярную формулу S 2 Cl 2 .
- A Подсчитав количество атомов в этиленгликоле, мы получаем шесть атомов водорода, два атома углерода и два атома кислорода на молекулу. Соединение состоит в основном из атомов углерода и водорода, поэтому оно является органическим. B Как и во всех органических соединениях, С и Н в молекулярной формуле пишутся первыми.
 Добавление соответствующих индексов дает молекулярную формулу C 2 Н 6 О 2 .
Добавление соответствующих индексов дает молекулярную формулу C 2 Н 6 О 2 . - A Сокращенная структурная формула показывает, что триметиламин содержит три звена CH 3 , поэтому у нас есть один атом азота, три атома углерода и девять атомов водорода на молекулу. Поскольку триметиламин содержит в основном углерод и водород, это органическое соединение. B Согласно соглашению об органических соединениях C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 Н.
Упражнение \(\PageIndex{2}\): Молекулярные формулы
Напишите молекулярную формулу для каждой молекулы.
- Хлороформ, который был одним из первых анестетиков и до недавнего времени использовался во многих сиропах от кашля, содержит один атом углерода, один атом водорода и три атома хлора. Его сокращенная структурная формула \(\ce{CHCl3}\).
- Гидразин используется в качестве топлива в реактивных двигателях космического корабля «Шаттл».
 Его сокращенная структурная формула: \(\ce{h3NNh3}\).
Его сокращенная структурная формула: \(\ce{h3NNh3}\). - Путресцин — это соединение с резким запахом, впервые выделенное из экстрактов гниющего мяса. Его сокращенная структурная формула: h3NCh3Ch3Ch3Ch3Nh3. Это часто записывается как \(\ce{h3N(Ch3)4Nh3}\), чтобы указать, что есть четыре фрагмента Ch3, связанные вместе.
- Ответить
CHCl 3
- Ответ б
Н 2 Н 4
- Ответ c
С 4 Н 12 С 2
Резюме
Существует два принципиально разных типа химических связей (ковалентная и ионная), которые придают веществам очень разные свойства. Атомы в химических соединениях удерживаются вместе притягивающими электростатическими взаимодействиями, известными как химические связи. Молекулярная формула ковалентного соединения указывает типы и количество присутствующих атомов.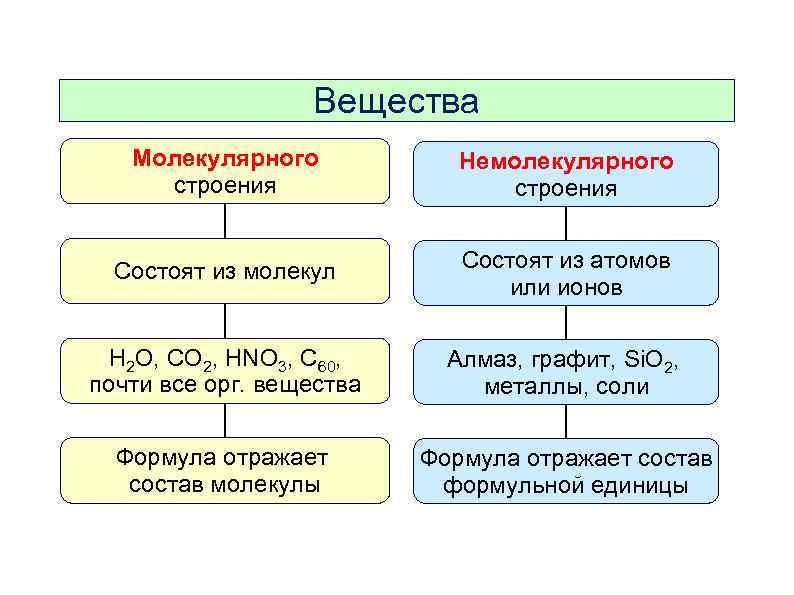






 Полярность
этих связей уравновешивается, делая молекулу неполярной.
Полярность
этих связей уравновешивается, делая молекулу неполярной.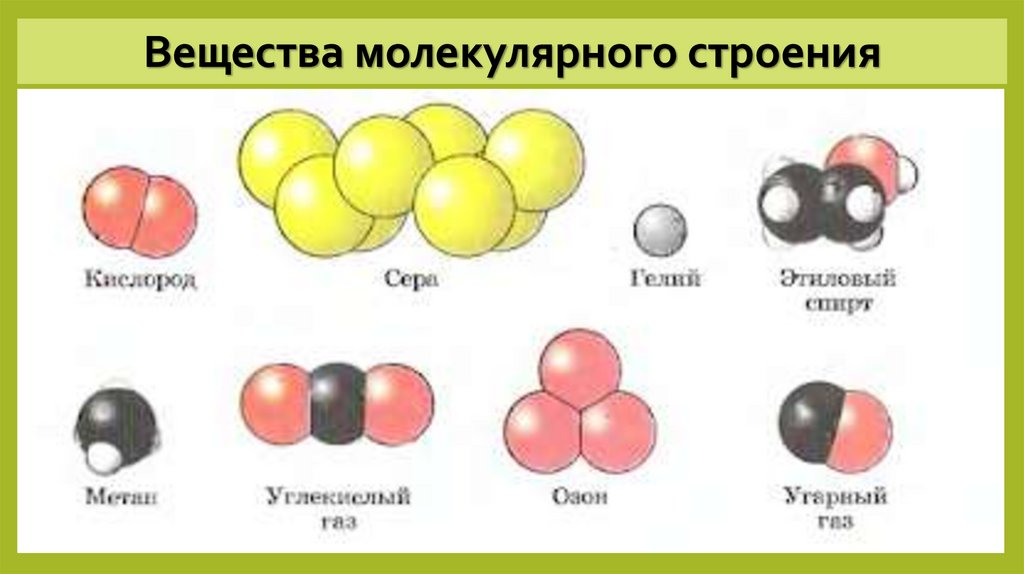

 молекула должна быть полярной.
молекула должна быть полярной. В экваториальных положениях, начиная с одного положения
занимает одинокая пара, они не компенсируются, и
молекула полярна.
В экваториальных положениях, начиная с одного положения
занимает одинокая пара, они не компенсируются, и
молекула полярна. Затем идентифицируйте вещество как органическое или неорганическое соединение.
Затем идентифицируйте вещество как органическое или неорганическое соединение.


 Затем добавьте соответствующие нижние индексы, чтобы указать количество атомов каждого элемента, присутствующего в молекулярной формуле.
Затем добавьте соответствующие нижние индексы, чтобы указать количество атомов каждого элемента, присутствующего в молекулярной формуле. Добавление соответствующих индексов дает молекулярную формулу C 2 Н 6 О 2 .
Добавление соответствующих индексов дает молекулярную формулу C 2 Н 6 О 2 . Его сокращенная структурная формула: \(\ce{h3NNh3}\).
Его сокращенная структурная формула: \(\ce{h3NNh3}\).
Leave A Comment