Молекулярное и немолекулярное строение | Дистанционные уроки
16-Май-2013 | Нет комментариев | Лолита Окольнова
Задание А6 ЕГЭ по химии —
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Темы, которые нужно знать:
Давайте определим свойства веществ молекулярного строения и немолекулярного.
| Вещества молекулярного строения | Вещества немолекулярного строения |
|
|
Типы кристаллических решеток
- Ионная кристаллическая решетка — характерна для соединений с ионной связью, в узлах решетки находятся, соответственно, ионы. Связи очень прочные, поэтому и температуры плавления высокие. Ее образуют неорганические
- Атомная кристаллическая решетка — связь — ковалентная, очень прочная. Примером может служить алмаз — вещество, имеющее максимальный показатель твердости, очень низкая растворимость, малореакционноспособны.
Характерна для B, Si, Ge, силициды (Si4- ), карбиды и нитриды бора, SiO2 - Молекулярная кристаллическая решетка — состоит из молекул, которые удерживаются между собой межмолекулярными связями, поэтому они непрочные — низкие температуры плавления, неэлектропроводны. Молекулярную кристаллическую решетку имеют все твердые вещества с полярной или неполярной ковалентной связью: J
- Металлическая кристаллическая решетка — в узлах содержит атомы и ионы металлов. Очень прочная металлическая связь со всеми характерными свойствами: делокализованное электронное облако, электро- и теплопроводность, металлический блеск, пластичность, ковкость.
Получается, что металлическая и атомарная кристаллические решетки схожи, но есть основное отличие — вещества с металлической решеткой проводят электрический ток и пластичны.
Для определения типа кристаллической решетки необходимо сначала определить — имеет вещество молекулярное или немолекулярное строение, затем уже определить вид химической связи и по нему уже выбирать вариант решетки.
Еще на эту тему:
Обсуждение: «Молекулярное и немолекулярное строение»
(Правила комментирования)distant-lessons.ru
Строение веществ » HimEge.ru
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества
Это вещества, состоящие из молекул. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (С, Si, Li, Na, К, Си, Fe, W), среди них есть металлы и неметаллы.
Немолекулярное строение веществ
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K
Твердые вещества: кристаллические и аморфные
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
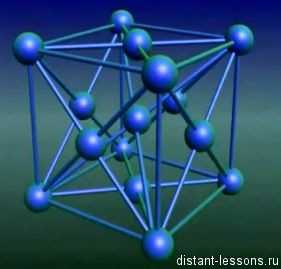
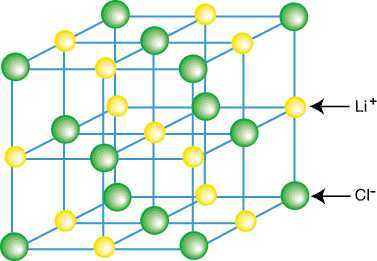
Ионные кристаллические решетки
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Сl—, так и сложные S042-, ОН—
Ионная кристаллическая решетка поваренной соли
Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решетки
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Атомная кристаллическая решетка алмаза
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы.
Молекулярная кристаллическая решетка йода
Химические связи в этих молекулах могут быть и полярными (НСl, Н
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические кристаллические решетки.
Металлическая кристаллическая решетка
В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
himege.ru
Молекулярные и немолекулярные вещества — урок. Химия, 8–9 класс.
Существуют вещества с молекулярным и немолекулярным строением.
Между молекулами возникают силы взаимного притяжения и отталкивания. Наиболее выражены эти силы в твёрдых веществах, а наименее — в газах.
Силы взаимодействия между молекулами слабые, поэтому молекулярные вещества летучи, имеют низкие температуры плавления и кипения. Все газообразные и жидкие при обычных условиях вещества состоят из молекул. Молекулярные вещества могут быть и твёрдыми, но узнать их можно по легкоплавкости.
Обрати внимание!
Газы, жидкости и легкоплавкие твёрдые вещества имеют молекулярное строение.
Все вещества, имеющие запах, имеют молекулярное строение.
Атомы могут соединяться друг с другом и другим способом. Так, в кристаллах алмаза, графита, песка все атомы соединены в единое целое, и молекулу выделить в них невозможно.
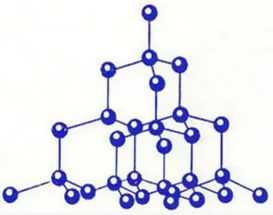
Строение алмаза
Подобное строение имеют железо, медь, цинк, алюминий и другие металлы.
В некоторых сложных веществах атомы превращаются в заряженные частицы — ионы — и тоже молекул не образуют. Противоположно заряженные ионы притягиваются друг к другу и образуют твёрдое тугоплавкое вещество. Такое строение имеют поваренная соль, мел, питьевая сода, медный купорос, щёлочь.
Строение поваренной соли
Такие вещества называют немолекулярными. В их кристаллах связи между частицами прочные, поэтому все немолекулярные вещества твёрдые, нелетучие, тугоплавкие.
www.yaklass.ru
Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки — ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ — ХИМИЯ — УНИВЕРСАЛЬНЫЙ СПРАВОЧНИК ШКОЛЬНИКА
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы.
К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них есть металлы и неметаллы.
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K
Твердые вещества: аморфные и кристаллические
Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
— ЗАПОМНИ. Кристаллы — твердые вещества, частицы которых образуют периодически повторяющуюся в пространстве структуру — кристаллическую решетку.
Ионные кристаллические решетки
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl—, так и сложные SO42-, ОН—. Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na+ и отрицательных Cl—, образующих решетку в форме куба (рис. 8). Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Рис. 8. Ионная кристаллическая решетка поваренной соли
Атомные кристаллические решетки
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями.
Примером веществ с таким типом кристаллических решеток может служить алмаз (рис. 9) — одно из аллотропных видоизменений углерода.
Рис. 9. Атомная кристаллическая решетка алмаза
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы (рис. 10).
Рис. 10. Молекулярная кристаллическая решетка йода
Химические связи в этих молекулах могут быть и полярными (HCl, H2O), и неполярными (N2, O2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи.
— ЗАПОМНИ. Кристаллические вещества, содержащие молекулы воды, называют кристаллогидратами, а воду, в их составе, — кристаллизационной.
Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические кристаллические решетки (рис. 11). В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Рис. 11. Металлическая кристаллическая решетка
compendium.su
1.3.3 Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Видеоурок: Типы кристаллических решёток
Лекция: Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Молекулярные и немолекулярные вещества
По строению химические вещества делятся на две группы: те, которые состоят из молекул называются молекулярными, а содержащие атомы и ионы – немолекулярными.
Молекулярные вещества имеют низкие t плавления/кипения. Они могут находится в трех агрегатных состояниях: жидком, твердом, газообразном. К этой группе относятся большинство простых веществ неметаллов, а также их соединений друг с другом. Связи между атомами молекулярных веществ являются ковалентными.
Немолекулярные вещества имеют высокие t плавления/кипения. Находятся в твердом состоянии. Это, как вы догадались, простые вещества металлы, их соединения с неметаллами, из неметаллов относятся бор, углерод – алмаз, фосфор (черный и красный), кремний. Немолекулярные вещества образуют ионные, атомные, молекулярные кристаллы, расположение частиц которых имеет четкую последовательность и образует решетку.
Типы кристаллических решетокСуществуют четыре типа кристаллических решеток, зависящих от располагающихся в узлах решетки типов частиц:
1) Ионная кристаллическая решетка характерна для соединений с ионным типом химической связи. В узлах решетки располагаются катионы и анионы. Примерами веществ с данным типом кристаллической решетки являются соли, оксиды и гидроксиды типичных металлов. Это твердые, но хрупкие вещества. Им свойственна тугоплавкость. Растворяются в воде и обладают электропроводностью.
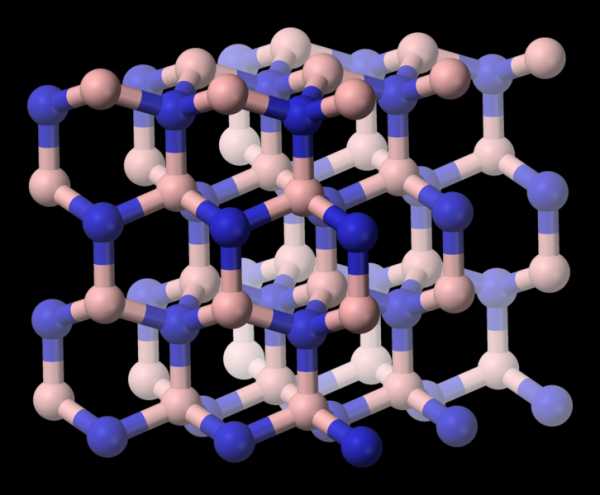
2) Атомная решетка имеет в узлах атомы. Частицы образуют ковалентную неполярную и полярную связи. Из простых веществ данный тип кристаллической решетки принадлежит углероду в состоянии графита и алмаза, бору, кремнию, германию. Из сложных веществ атомной решеткой обладают, к примеру, оксиду кремния (кварц, горный хрусталь). Это очень твердые тугоплавкие вещества, мало распространенные в природе. Не растворяются в воде.
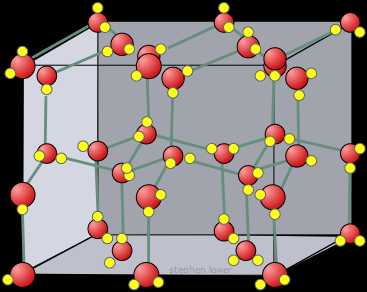
3) Молекулярная кристаллическая решетка образуется молекулами, удерживаемые слабыми силами межмолекулярного притяжения. Поэтому вещества данного типа решетки отличаются малой твердостью, непрочностью и низкими t плавления. К примеру, это вода в ледяном состоянии. Большинство твердых органических соединений имеют этот тип решетки. Тип связи в соединении – ковалентная.
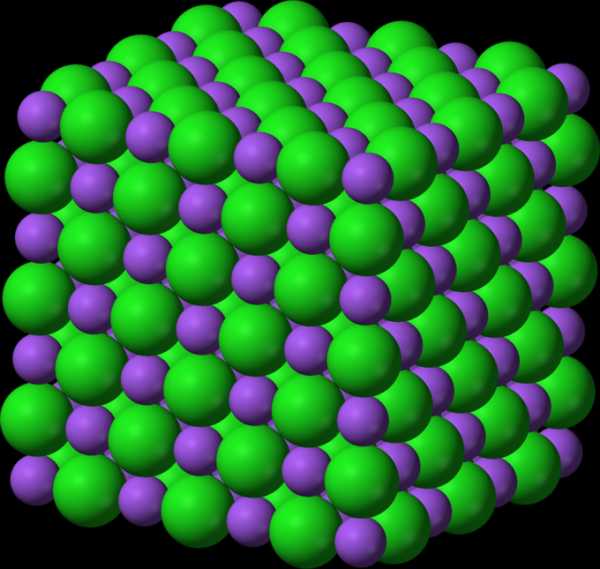
4) Металлическая. В узлах расположены атомы и катионы металла. Это металлы и их сплавы, соединения с металлической связью. А, как известно, атомы металла легко расстаются со своими электронами на внешнем уровне. Поэтому такой тип решетки определяет пластичность и ковкость веществ.
cknow.ru
Вещество — немолекулярное строение — Большая Энциклопедия Нефти и Газа, статья, страница 1
Вещество — немолекулярное строение
Cтраница 1
Вещества немолекулярного строения не обладают строго постоянным составом. Их состав зависит от условий получения. [1]
Если вещество немолекулярного строения состоит из атомов нескольких элементов, например S1O2, его формульной единицей является условная частица, состоящая из 1-го атома Si и 2 — х атомов О. Она является условной потому, что в кристалле оксида кремния ( IV) нет отдельных молекул SiC, он состоит из множества атомов кремния и кислорода. Но весь кристалл можно условно разделить на группы атомов, в каждой из которых будет один атом Si и два атома О. [2]
Если вещество немолекулярного строения образует ионную кристаллическую решетку, например NaCl, его формульной единицей будет условная частица, состоящая из одного иона Na и одного иона СГ. Но весь этот кристалл можно условно разделить на группы ионов, в каждой из которых будет 1 ион Na и 1 ион СГ. Следовательно, формульной единицей хлорида натрия является условная частица, состоящая из 2 — х ионов. [3]
К веществам немолекулярного строения относятся вещества, в узлах кристаллических решеток которых находятся атомы или ионы. Эти вещества, как правило, обладают высокими температурами плавления и при комнатной температуре всегда находятся в твердом агрегатном состоянии. [4]
Чем отличаются вещества молекулярного и немолекулярного строения. [5]
Чем отличаются вещества молекулярного строения от веществ немолекулярного строения. Какие физические свойства присущи тем и другим веществам. Какие частицы являются их структурными единицами. [6]
По современным представлениям, из молекул состоят лишь вещества молекулярного строения, например неметаллы ( кроме углерода и кремния), двуокись углерода, вода, органические соединения с неионной связью. Вещества немолекулярного строения состоят не из молекул, а из других частиц ( атомов, ионов), химически связанных друг с другом, например алмаз, кремний, многие оксиды, сульфиды металлов, большинство солей. У первых веществ химическая связь между молекулами менее прочная, чем между атомами. Поэтому они имеют сравнительно низкие температуры плавления и кипения. У вторых веществ — с немолекулярным строением — химическая связь между частицами весьма прочная. Поэтому они имеют высокие температуры плавления и кипения. [7]
Однако не всякое вещество состоит из молекул. Известно много веществ немолекулярного строения. Это благородные газы, а также вещества, образующие ионные или атомные кристаллы. [8]
Однако не всякое вещество состоит из молекул. Известно много веществ немолекулярного строения, к ним относятся ионные или атомные кристаллы. [9]
Вместо него используется понятие формульная единица вещества. Химические формулы веществ немолекулярного строения являются простейшими, или эмпирическими, формулами. [10]
В настоящее время известно около 23 миллионов веществ. Все они делятся на 2 группы — вещества молекулярного и немолекулярного строения. [11]
Большинство твердых веществ имеет кристаллические решетки, образованные атомами или ионами; выделить отдельные молекулы в таких структурах нельзя, Такие вещества обычно называют веществами с немолекулярной структурой. Немолекулярную структуру имеют многие вещества в кристаллическом состоянии, например металлы, кислоты, гидроксиды, соли. Для веществ немолекулярного строения принято записывать формулу условной молекулы, которая показывает соотношение числа атомов в веществе. [13]
Правда, необходимо отметить, что все представления этой теории были сформулированы по отношению к веществам, имеющим молекулярное строение. В настоящее время известно громадное число веществ немолекулярного строения. Это, как правило, твердые тугоплавкие неорганические вещества, к которым законы стехиометрии либо вообще неприменимы, либо применимы только как существенно приближенные. Но все-таки подавляющее большинство известных человечеству веществ состоит из молекул, и поэтому законы стехиометрии до сих пор сохраняют свое значение. [14]
Закон постоянства состава веществ был открыт и сформулирован на основе представлений, что все вещества состоят из молекул. Дальнейшие исследования показали, что лишь около 5 % из всех неорганических веществ имеет молекулярное строение. И только для них справедлив закон постоянства состава. Вещества немолекулярного строения этому закону в полной мере не подчиняются. Так, например, на основе точных современных исследований установлено, что состав сульфида железа ( II) следует изображать не формулой FeS, а формулой Fei S, где х меняет значения от 0 до 0 05, а оксида титана ( IV) — не формулой TiCb, a формулой TiOli9 2 o Но эти отклонения незначительны, и при составлении химических формул мы их учитывать не будем. [15]
Страницы: 1 2
www.ngpedia.ru
Молекулярное строение вещества :: SYL.ru
Довольно длительное время ученые создавали теории и модели, которые бы помогали объяснить основные свойства веществ и материй, из которых состоит окружающий мир.
В ходе истории было проведено множество опытов, экспериментов; были открыты новые законы и физико-химические свойства материалов. Во многом это происходило благодаря открытию понятий «молекула» и «атомно-молекулярное строение вещества». Поговорим о них подробнее в данной статье.
Появление понятия «атомно-молекулярное строение вещества»
Еще во времена Древней Греции появилась мысль о том, что всё на свете состоит из мельчайших частей. Эти частицы греки называли молекулами и атомами. Автором данной гипотезы был Демокрит, который впоследствии стал родоначальником атомистической теории. Но эти знания в те времена особо не развивались вплоть до 17 столетия. Все исследования материалов снова приводили к тому, что многие вещества состоят из молекул, структурной единицей которых являются атомы.
Позднее ученые стали приходить к выводам, что один тип минерала состоит, например, из железа на 38 % и из кислорода на 62 %, и каждый из образцов покажет такой химический состав. А вот если взять другое тело, с отличными свойствами, то анализ атомно-молекулярного строения вещества покажет, что оно состоит на 60 % из железа и на 40 % из кислорода.
Таким образом, несмотря на то что определенной концепции всё же не было, в ходе исследований начала появляться теория о том, что каждое вещество является разным набором молекул и атомов, которые определяют его основные свойства.
Развитие понятия «молекулярное строение вещества»
 Впервые термин «молекула» был введен в 1811 году итальянским физико-химиком Амадео Авогадро. Именно он стал зачинателем теории атомно-молекулярного строения.
Впервые термин «молекула» был введен в 1811 году итальянским физико-химиком Амадео Авогадро. Именно он стал зачинателем теории атомно-молекулярного строения.Подтверждения этой теории появились только в 1860-е годы, когда русский химик Бутлеров А. М. сформировал и сумел объяснить молекулярную теорию строения вещества. В соответствии с его работами свойства любого вещества определяются тем, как связаны между собой атомы в молекулах, их взаимодействием. Ученый выдвинул гипотезу относительно того, что молекула – это микрочастица материала, состоящая из атомов, которая способна существовать самостоятельно.
Закрепилось понятие молекулы благодаря трудам еще одного русского ученого. Речь идет о М. В. Ломоносове.
В развитии атомистического учения участвовало множество ученых со всего мира: Дж. Максвелл, Л. Больцман, Дж. Гиббс, Р. Клаузиус, Дж. Дальтон, Д. И. Менделеев, В. Рентген, А. Беккерель, Дж. Томсон, М. Планк и многие другие. Вклад этих людей в молекулярную физику и химию бесценен.
Суть молекулярной теории строения вещества
 На основании комплекса учений за долгие годы была выведена молекулярная теория строения вещества. Существует несколько основных положений этой теории, а именно три базовых утверждения, которые были доказаны неоднократно путем проведения лабораторных исследований:
На основании комплекса учений за долгие годы была выведена молекулярная теория строения вещества. Существует несколько основных положений этой теории, а именно три базовых утверждения, которые были доказаны неоднократно путем проведения лабораторных исследований:- Любое тело состоит из самых мелких частиц – молекул и атомов, которые также состоят из более мелких элементов. Структура всех веществ прерывиста.
- Атомы и молекулы находятся в непрестанном движении хаотической природы.
- Все вещества взаимодействуют между собой на основании электромагнитных сил притяжения и отталкивания.
Обоснование тез молекулярно-кинетической теории
Первым подтверждением положений теории является броуновское движение, что было открыто в 1827 году известным ботаником Р. Броуном. Причина такого явления – хаотический ход молекул в разных направлениях, который происходит вследствие ударов их между собой.
Вторым подтверждением этой теории будут бессчётные опыты с процессом диффузии, то есть способности одного вещества проникать во второе. Ярким примером такого опыта из повседневной жизни являются духи или любое ароматное вещество. Если в помещении поместить такое вещество, через некоторый период аромат рассеется по всей его площади.
Атом и молекула
Сегодня эти термины уже обоснованы и выведены точно и аргументированно. Простым языком, атом – это химически неделимая частица любого вещества или материала, составляющая молекулы. А молекула – это также мельчайшая частичка чего-либо, но важно то, что именно она задает основные свойства тела. Молекулярное строение вещества является каркасом определенного материала, в соединениях которого находятся молекулы.

Если для материала характерна молекулярная кристаллическая решетка, то он, как правило, обладает невысокой твердостью, его легко расплавить; такое вещество будет летучим или растворимым в воде, электричество не проводит.
Наука, изучающая силу взаимодействия этих частиц и молекулярное строение тел, называется молекулярной физикой. Тут исследуются многообразные свойства тел в разных агрегатных состояниях.
Какие вещества имеют молекулярное строение?
Молекулярная связь, как правило, слабая и преобладает в органических веществах. Молекулярное строение имеют многие известные нам вещества. Например, вода (Н2О), водород (Н2), хлор (Cl2), углекислый газ (СО2), кислород (О2), этанол, или спирт этиловый (С2Н5ОН), органические полимеры и многие другие.
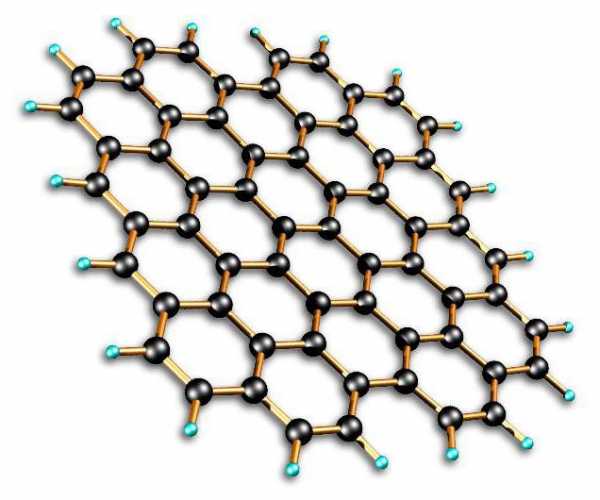
Другими словами, вещества, имеющие молекулярное строение, — это в основном газы. В них молекулы находятся далеко друг от друга и взаимодействуют слабо. Тесная связь между частницами того или иного вещества образует твердые тела. Единственная жидкость, которая имеет молекулярное строение, – это Br2. Это вещество обладает высокой летучестью.
К неметаллам с молекулярным строением относятся такие твердые вещества, как I2, P4, S8. Эти материалы легкоплавки и могут сублимироваться.
www.syl.ru

Leave A Comment