Какая степень окисления натрия в соединениях?
Срочно. Как называется связь образованная за счет трех общих электронных пар1)одинарной2)двойной 3),тройной4),ионной
Очень сильно надо прошууууу !!!!!!
Можете написать уравнение между сульфатом меди и цинком?
Дополни словесные уравнения реакций металлов с кислотами: ртуть+ соляная кослота—>
Визначте кількість речовини солі, що утвориться при взаємодії Цинк Оксиду з Хлоридною кислотою кількістю речовини 6 моль.
Рассчитайте массу известняка, подвергшегося термическому разложению, если выделившегося при этом углекислого газа хватило для взаимодействия с раствор … ом, содержащим 8 г едкого натра(реакция прошла до образования средней соли)
Кто знает помогите пожалуйста только правильно♡감사합니다
Основність кислот обумовлюється…. Надо закончить предложение
відносна густина неону за повітрям?
60 баллов! Ответы на все вопросы, пожалуйста.


В химических соединениях степень окисления и валентность. Чем валентность отличается от степени окисления. Как рассчитать степень окисления элемента в соединении
Видеоурок 2: Степень окисления химических элементов
Видеоурок 3: Валентность. Определение валентности
Лекция: Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность
Электроотрицательность – это способность атомов притягивать к себе электроны других атомов для соединения с ними.
Судить об электроотрицательности того или иного химического элемента легко по таблице. Вспомните, на одном из наших уроков было сказано о том, что она возрастает при движении слева направо по периодам в таблице Менделеева и с перемещением снизу вверх по группам.
К примеру,
дано задание определить какой элемент из предложенного ряда наиболее электроотрицателен: C (углерод), N (азот), O (кислород), S (сера)? Смотрим по таблице и находим, что это О, потому что он правее и выше остальных.
Какие же факторы оказывают влияние на электроотрицательность? Это:
- Радиус атома, чем он меньше, тем электроотрицательность выше.
- Заполненность валентной оболочки электронами, чем их больше, тем выше электроотрицательность.
Из всех химических элементов фтор является наиболее электроотрицательным, потому как у него малый атомный радиус и на валентной оболочке 7 электронов.
К элементам, имеющим низкую электроотрицательность, относятся щелочные и щелочноземельные металлы. У них большие радиусы и очень мало электронов на внешней оболочке.
Значения электроотрицательности атома не могут быть постоянными, т.к. она зависит от многих факторов в числе которых перечисленные выше, а также степень окисления, которая может быть различной у одного и того же элемента. Поэтому принято говорить об относительности значений электроотрицательности. Вы можете пользоваться следующими шкалами:
Значения электроотрицательности вам понадобятся при записи формул бинарных соединений, состоящих из двух элементов.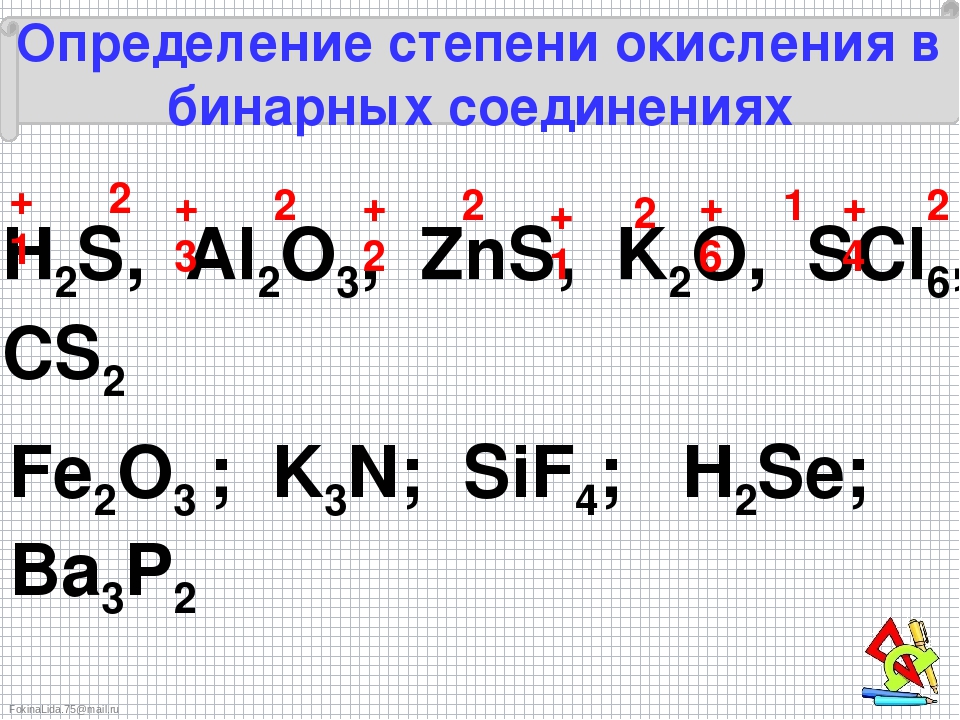 К примеру, формула оксида меди Cu 2 O — первым элементом следует записывать тот, чья электроотрицательность ниже.
К примеру, формула оксида меди Cu 2 O — первым элементом следует записывать тот, чья электроотрицательность ниже.
В момент образования химической связи если разница электроотрицательности между элементами больше 2,0 образуется ковалентная полярная связь, если меньше, ионная.
Степень окисления
Степень окисления
Атом приобретает положительный заряд при отдаче электронов, а отрицательный заряд – при принятии электронов.
Степени окисления записываются над символами со знаком «+»/«-» . Есть и промежуточные СО. Максимальная СО элемента положительная и равна № группы, а минимальная отрицательная для металлов равна нулю, для неметаллов = (№ группы – 8) . Элементы с максимальной СО только принимают электроны, а с минимальной, только отдают. Элементы же, имеющие промежуточные СО могут и отдавать и принимать электроны.
Рассмотрим некоторые правила, которыми стоит руководствоваться для определения СО:
СО всех простых веществ равна нулю.
Равна нулю и сумма всех СО атомов в молекуле, так как любая молекула электронейтральна.
В соединениях с ковалентной неполярной связью СО равна нулю (О 2 0), а с ионной связью равна зарядам ионов (Na + Cl — СО натрия +1, хлора -1). СО элементов соединений с ковалентной полярной связью рассматриваются как с ионной связью (H:Cl = H + Cl — , значит H +1 Cl -1).
Элементы в соединении, имеющие наибольшую электроотрицательность, имеют отрицательные степени окисления, если наименьшую положительные. Исходя из этого можно сделать вывод, что металлы имеют только «+» степень окисления.
Постоянные степени окисления :
Водород +1. Исключение: гидриды активных металлов NaH, CaH 2 и др., где степень окисления водорода равна –1.

Кислород –2. Исключение: F 2 -1 O +2 и пероксиды, которые содержат группу –О–О–, в которой степень окисления кислорода равна –1.
Щелочные металлы +1.
Все металлы второй группы +2. Исключение: Hg +1, +2.
Алюминий +3.
Когда образуется ионная связь, происходит определенный переход электрона, от менее электроотрицательного атома к атому большей электроотрицательности. Так же, в данном процессе, атомы всегда теряют электронейтральность и впоследствии превращаются в ионы. Так же образуются целочисленные заряды. При образовании ковалентной полярной связи, электрон переходит только частично, поэтому возникают частичные заряды.
Валентность – это способность атомов образовать n — число химических связей с атомами других элементов.
А еще валентность – это способность атома удержать другие атомы возле себя. Как вам известно из школьного курса химии, разные атомы связываются друг с другом электронами внешнего энергетического уровня. Неспаренный электрон ищет для себя пару у другого атома. Эти электроны внешнего уровня называются валентными.
Валентность бывает постоянной либо переменной. К примеру, у щелочей металлов она постоянна и равняется I. А вот хлор в различных соединениях проявляет валентности I, III, V, VII.
Как определить валентность элемента?
Вновь обратимся к Периодической таблице. Постоянная валентность у металлов главных подгрупп, так металлы первой группы имеют валентность I, второй II. А у металлов побочных подгрупп валентность переменная. Также она переменная и у неметаллов. Высшая валентность атома равна № группы, низшая равна = № группы — 8. Знакомая формулировка. Не означает ли это то, что валентность совпадает со степенью окисления. Помните, валентность может совпадать со степенью окисления, но данные показатели не тождественны друг другу. Валентность не может иметь знака =/-, а также не может быть нулевой.
Знакомая формулировка. Не означает ли это то, что валентность совпадает со степенью окисления. Помните, валентность может совпадать со степенью окисления, но данные показатели не тождественны друг другу. Валентность не может иметь знака =/-, а также не может быть нулевой.
Второй способ определения валентности по химической формуле, если известна постоянная валентность одного из элементов. Например, возьмем формулу оксида меди: CuО. Валентность кислорода II. Видим, что на один атом кислорода в данной формуле приходится один атом меди, значит и валентность меди равна II. А теперь возьмем формулу посложнее: Fe 2 O 3 . Валентность атома кислорода равна II. Таких атомов здесь три, умножаем 2*3 =6. Получили, что на два атома железа приходится 6 валентностей. Узнаем валентность одного атома железа: 6:2=3. Значит валентность железа равна III.
Кроме того, когда необходимо оценить «максимальную валентность», всегда следует исходить из электронной конфигурации, которая имеется в «возбужденном» состоянии.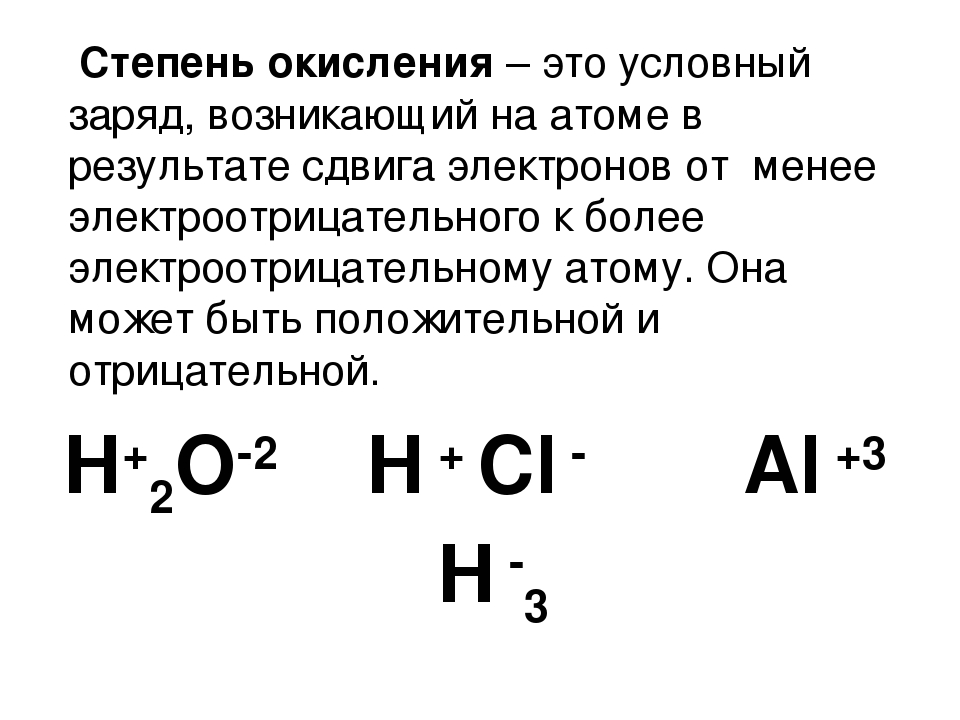
Валентность и степень окисления – понятия, часто применяемые в неорганической химии. Во многих химических соединениях значение валентности и степень окисления элемента совпадают, именно по этой причине у школьников и студентов часто возникает путаница. У этих понятий действительно есть кое-что общее, но отличия более существенны. Чтобы понять, чем же отличаются эти два понятия, стоит узнать о них больше.
Сведения о степени окисления
Степень окисления – вспомогательная величина, приписываемая атому химического элемента или группе атомов, которая показывает, каким образом распределены общие пары электронов между взаимодействующими элементами.
Это вспомогательная величина, не имеющая физического смысла как такового. Ее суть достаточно просто объяснить с помощью примеров:
Молекула пищевой соли NaCl состоит из двух атомов – атома хлора и атома натрия. Связь между этими атомами ионная. У натрия на валентном уровне 1 электрон, значит у него с атомом хлора одна общая электронная пара. Из этих двух элементов хлор более электроотрицателен (обладает свойством смешать к себе электронные пары), то единственная общая пара электронов сместится к нему. В соединении элемент с более высокой электротрицательностью имеет отрицательную степень окисления, менее электроотрицательный, соответственно, положительную, а ее значение равно количеству общих пар электронов. Для рассматриваемой молекулы NaCl степени окисления натрия и хлора будут выглядеть так:
Из этих двух элементов хлор более электроотрицателен (обладает свойством смешать к себе электронные пары), то единственная общая пара электронов сместится к нему. В соединении элемент с более высокой электротрицательностью имеет отрицательную степень окисления, менее электроотрицательный, соответственно, положительную, а ее значение равно количеству общих пар электронов. Для рассматриваемой молекулы NaCl степени окисления натрия и хлора будут выглядеть так:
Хлор, со смещенной к нему электронной парой, теперь рассматривают как анион, то есть атом, присоединивший к себе дополнительный электрон, а натрий – как катион, то есть атом, отдавший электрон. Но при записи степени окисления на первом месте идет знак, а на втором числовое значение, а при записи ионного заряда – наоборот.
Степень окисления можно определить как число электронов, которых положительному иону не хватает до электронейтрального атома, или которые нужно забрать у отрицательного иона, чтобы окислить до атома. На данном примере очевидно, что положительному иону натрия за счет смещения электронной пары не хватает электрона, а у иона хлора один электрон лишний.
Степень окисления простого (чистого) вещества, не зависимо от его физических и химических свойств, равна нулю. Молекула О 2 , например, состоит из двух атомов кислорода. У них одинаковые значения электроотрицательности, потому общие электроны не смещаются ни к одному из них. Значит, электронная пара находится строго между атомами, потому степень окисления будет нулевой.
Для некоторых молекул бывает сложно определить, куда смещаются электроны, особенно если элементов в ней три или больше. Чтобы высчитать степени окисления в таких молекулах, нужно воспользоваться несколькими простыми правилами:
- Атом водорода почти всегда имеет постоянную степень окисления +1..
- Для кислорода этот показатель равен -2. Исключение из этого правила составляют только оксиды фтора
ОF 2 и О 2 F 2 ,
Так как фтор – элемент с наивысшей электроотрицательностью, потому он всегда смещает к себе взаимодействующие электроны. Согласно международным правилам, элемент с меньшим значением электроотрицаельности записывается первым, потому в этих оксидах кислород на первом месте.
- Если суммировать все степени окисления в молекуле, получится ноль.
- Для атомов металлов характерна положительная степень окисления.
При вычислении степеней окисления нужно помнить, что наибольшая степень окисления элемента равна номеру его группы, а минимальная — номер группы минус 8. Для хлора максимальное возможное значение степени окисления +7, потому что он в 7-ой группе, а минимальная 7-8=-1.
Общие сведения о валентности
Валентность – число ковалентных связей, которые может образовывать элемент в разных соединениях.
В отличии от степени окисления, понятие валентности есть реальный физический смысл.
Самый высокий показатель валентности равен номеру группы в таблице Менделеева. Сера S расположена в 6-ой группе, то есть ее максимальная валентность 6. Но она может быть также 2 (H 2 S) или 4 (SO 2).
Почти для всех элементов характерна переменная валентность. Однако есть атомы, для которых эта величина постоянная. К ним относятся щелочные металлы, серебро, водород (их валентность всегда равна 1), цинк (валентность всегда 2), лантан (валентность равна 3).
К ним относятся щелочные металлы, серебро, водород (их валентность всегда равна 1), цинк (валентность всегда 2), лантан (валентность равна 3).
Что же общего у валентности и степени окисления
- Для обозначения и той, и другой величины используют положительные целые числа, которые пишутся над латинским обозначением элемента.
- Наивысшая валентность, как и наибольшая степень окисления, совпадает с номером группы элемента.
- Степень окисления какого-либо элемента в сложном соединении совпадает с числовым значением одного из показателей валентности. Например, хлор, находясь в 7-ой группе, может иметь валентность 1, 3, 4, 5, 6, или 7, значит возможные степени окисления ±1, +3,+4,+5,+6,+7.
Основные отличия между этими понятиями
- У понятия «валентность» есть физический смысл, а степень окисления – вспомогательный термин, не имеющий реального физического смысла.
- Степень окисления может быть нулевой, больше или меньше нуля.
 Валентность же строго больше нуля.
Валентность же строго больше нуля. - Валентность отображает число ковалентных связей, а степень окисления – распределение электронов в соединении.
Электроотрицательность (ЭО) — это способность атомов притягивать электроны при связывании с другими атомами.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s 2 2p 5) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
Разность электроотрицательностей элементов в соединении (ΔX ) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная .
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной , например: связь H-F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными . Например: связь Na-Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Степень окисленияСтепень окисления (СО) — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
При образовании ионной связи происходит переход электрона от менее электроотрицательного атома к более электроотрицательному, атомы теряет свою электронейтральность, превращается в ионы. возникают целочисленные заряды. При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl). Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.
возникают целочисленные заряды. При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl). Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.
На этом рисунке изображены степени окисления, характерные для первых 20 элементов.
Обратите внимание. Высшая СО как правило равна номеру группы в таблице Менделеева. У металлов главных подгрупп – одна характерная СО, у неметаллов, как правило, наблюдается разброс СО. Поэтому неметаллы образуют большое количество соединений и обладают более «разнообразными» свойствами, по сравнению с металлами.
Примеры определения степени окисления
Определим степени окисления хлора в соединениях:
Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
ВалентностьВале́нтность (от лат. valēns «имеющий силу») — способность атомов образовывать определённое число химических связей с атомами других элементов.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей . Если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами, т. е. его валентность будет равна n + m . При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH) 4 2- , BF 4 — и NH 4 +), фосфора — 5 (PCl 5), серы — 6 (H 2 SO 4), хлора — 7 (Cl 2 O 7).
е. его валентность будет равна n + m . При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH) 4 2- , BF 4 — и NH 4 +), фосфора — 5 (PCl 5), серы — 6 (H 2 SO 4), хлора — 7 (Cl 2 O 7).
В ряде случаев, валентность может численно совпадать со степенью окисления, но ни коим образом они не тождественны друг другу. Например, в молекулах N 2 и CO реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления азота равна 0, углерода +2, кислорода −2.
В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
Ещё несколько «коварных» вопросов, в которых часто делают ошибки.
Учимся определять валентность и степень окисления. Практика показывает, что многие обучающиеся испытывают затруднения при определении валентности и степени окисления. Пособие направлено на овладение основополагающими химическими понятиями валентность и степень окисления, формирование умения давать количественные оценки и проводить расчеты валентности и степени окисления по химическим формулам в неорганических и органических соединениях, а также способствует подготовке студентов для сдачи ЕГЭ. Пособие направлено на формирование навыков самостоятельной работы с учебным материалом, осуществления поиска и использования информации, формирование и развитие творческого потенциала, повышение интереса к дисциплине. Валентность и степень окисления. Правила определения степеней окисления элементов I . Валентность Валентность – это способность атомов присоединять к себе определенное число других атомов. Правила определения валентности 2) Атом металла стоит в формуле на первое место. 2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид». Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца. Теперь вы сами можете написать формулы любых соединений металлов с неметаллами. 3) Атом металла ставится в формуле на первое место. II . Степень окисления Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные. Рассмотрим строение атомов фтора и натрия: — Что можно сказать о завершённости внешнего уровня атомов фтора и натрия? — Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня? Оба атома имеют незавершённый внешний уровень? Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня. F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион — анион ) Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион — катион ) Как определить степень окисления атома в ПСХЭ? Правила определения степени окисления атома в ПСХЭ: 1. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1) 2. Кислород обычно проявляет СО -2 (исключения: О+2F2, h3O2-1 – перекись водорода) 3. Металлы проявляют только + n положительную СО 4. Фтор проявляет всегда СО равную -1 (F-1) 5. Высшая СО (+) = номеру группыN группы Низшая СО (-) = N группы –8 Правила определения степени окисления атома в соединении: I. Степень окисления свободных атомов и атомов в молекулах простых веществ равнанулю — Na0, P40, O20 II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0 , а в сложном ионе его заряду. Например, H +1 N +5 O 3 -2 : (+1)*1+(+5)*1+(-2)*3 = 0 [ S +6 O 4 -2 ]2- : (+6)*1+(-2)*4 = -2 Задание 1 – определите степени окисления всех атомов в формуле серной кислоты h3SO4? 1. (+1)*1+(х)*1+(-2)*4=0 Х=6 или (+6), следовательно, у серы CО +6, т. е. S+6 Задание 2 – определите степени окисления всех атомов в формуле фосфорной кислоты h4PO4? 1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (+1)*3+(х)*1+(-2)*4=0 Х=5 или (+5), следовательно, у фосфора CО +5, т. е. P+5 Задание 3 – определите степени окисления всех атомов в формуле иона аммония (Nh5)+? 1. Проставим известную степень окисления у водорода, а СО азота примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (х)*1+(+1)*4=+1 Х=-3, следовательно, у азота CО -3, т. е. N-3 Алгоритм составления формулы по степени окисления Составление названий бинарных соединений Сравним понятия «валентность» и «степень окисления»: |
Запомни!
Валентность — — это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: h3, F2, Cl2, Br2, I2 равна единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO — оксиде углерода (II) — равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
Высшая степень окисления элемента равна номеру группы.
Исключения:
фтор высшая степень окисления ноль в простом веществе F20
кислород высшая степень окисления +2 во фториде кислорода О+2F2
Низшая степень окисления элемента равна восемь минус номер группы (по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени окисления (далее обозначим: ст. ок.)
Общее правило: Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю (Молекула электронейтральна.), в ионе — равна заряду иона.
I. Степень окисления простых веществ равна нулю: Са 0 , O2 0 , Cl2 0
II. ст. ок. в бинарных c оединениях:
Менее электроотрицательный элемент ставится на первое место. (Исключения: С-4Н4+ метан и N-3h4+аммиак)
Нужно помнить, что
Ст. ок. металла всегда положительна
Ст. ок. металлов I, II, III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст. ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст. ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н2+1О2-1, Ba+2O2-1 и др. ; карбиды металлов I и II групп Ag2+1C2-1,Ca+2C2-1 и др. (В школьном курсе встречается соединение FeS2 — пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe+2S2-1). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, — S-S-, тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV, у кислорода и серы II.
III. Степень окисления в основаниях Ме + n (ОН) n равна количеству гидроксогрупп.
1. в гидроксогруппе ст. ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст. ок. металла равна количеству гидроксогрупп
IV. Степень окисления в кислотах:
1. ст. ок. водорода +1, кислорода -2
2. ст. ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
Например, Н3+1РхО4-2
3∙(+1) + х + 4∙(-2) = 0
3 + х – 8 = 0
х = +5 (не забудьте знак +)
Можно запомнить, что у кислот с высшей степени окисления центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н2СО3 угольная Н2С+4О3
Н2SiО3 кремниевая (искл.) Н2Si+4О3
НNО3 азотная НN+5О3
Н3PО4 фосфорная Н3P+5О4
Н2SО4 серная Н2S+6О4
НСlО4 хлорная НCl+7О4
НMnО4 марганцовая НMn+7О4
Останется запомнить:
НNО2 азотистая НN+3О2
Н2SО3 сернистая Н2S+4О3
НСlО3 хлорноватая НCl+5О3
НСlО2 хлористая НCl+3О2
НСlОхлорноватистая НCl+1О
V. Степень окисления в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст. ок. элемента в кислоте.
VI. Степень окисления элемента в сложном ионе равна заряду иона.
Например, Nh5+Cl- : записываем ион NхН4+1
х + 4∙(+1) = +1
ст. ок. азота -3
Например, определить ст. ок. элементов в гексацианоферрате(III) калия К3
У калия +1: К3+1, отсюда заряд иона 3-
У железа +3 (указано в названии) 3-, отсюда (CN)66-
У одной группы (CN)-
Более электроотрицательный азот: у него -3, отсюда (CхN-3)-
ст. ок. углерода +2
VII. Степень окисления углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст. ок. водорода равна +1, кислорода -2
Например, С3Н6
3∙х + 6∙1 = 0
ст. ок. углерода -2 (при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте h4PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1) ∙ 3 + х + (-2) ∙ 2 = 0, отсюда х = +1.
Определим валентность фосфора в этой кислоте.
Известно, что это — одноосновная кислота, поэтому только один атом водорода связан с атомом кислорода. Учитывая, что водород в соединениях одновалентен, а кислород — двухвалентен, получаем структурную формулу, из которой видно, что фосфор в этом соединении имеет валентность пять.
Графический метод определения степени окисления
в органических веществах
В органических веществах можно определять степени окисления элементов алгебраическим методом , при этом получается усредненное значение степени окисления . Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления).
Рассмотрим такой случай:
Пример 1 . Обугливание дезоксирибозы серной концентрированной кислотой с дальнейшим окислением:
С5Н10О4 + h3SO4 ® CO2 + h3O + SO2
Найдём степень окисления углерода х в дезоксирибозе: 5х + 10 – 8 = 0; х = — 2/5
В электронном балансе учитываем все 5 атомов углерода:
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = № группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF 2). Расставим известные степени окисления:
Обозначим степень окисления серы как x :
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH 4 + (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH 4 + , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH 4 + и анионами Cr 2 O 7 2- .
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y :
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать .
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных () орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH 3), азотистой кислоты (HNO 2), треххлористого азота (NCl 3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор() предоставляет ее другому атому с вакантной () орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d -подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO 3 или оксида азота N 2 O 5 ? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π -связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O 3 , бензола C 6 H 6 и т.д.
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d -подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s -орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d -подуровня, распаривание электронов s и p- орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H 2 S.
Как мы видим, у атома серы на внешнем уровне появляется d -подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p -подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO 2 , SF 4 , SOCl 2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s -подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO 3 , H 2 SO 4 , SO 2 Cl 2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
Бром характеристика по периодической системе. Минимальная и максимальная степень окисления брома
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
БРОМ (лат. Bromum), Br, химический элемент VII группы периодической системы, атомный номер 35, атомная масса 79,904, относится к галогенам .
Природный бром представляет смесь двух нуклидов с массовыми числами 79 (в смеси 50,56% по массе) и 81. Конфигурация внешнего электронного слоя 4s2p5. В соединениях проявляет степени окисления -1, +1, +3, +5 и +7 (валентности I, III, V и VII), причем наиболее характерны степени окисления -1 и +5.
Расположен в четвертом периоде в группе VIIА периодической системы элементов Менделеева.
Радиус нейтрального атома брома 0,119 нм, ионные радиусы Вr-, Вr3+, Вr5+ и Вr7+ равны, соответственно, 0,182; 0,073; 0,045 и 0,039 нм. Энергии последовательной ионизации нейтрального атома брома равны, соответственно, 11,84; 21,80; 35,9; 47,3 и 59,7 эВ. Сродство к электрону 3,37 эВ. По шкале Полинга электроотрицательность брома 2,8.
Название: связано с тем, что у брома тяжелый, неприятный запах паров (от греческого bromos — зловоние).
История открытия: к открытию брома привели исследования французского химика А.Балара, который в 1825 году, действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно-бурую дурно пахнущую жидкость. Эту жидкость, полученную также из морской воды, он назвал муридом (от лат. muria — соляной раствор, рассол) и послал сообщение о своем открытии в Парижскую академию наук. Комиссия, созданная для проверки этого сообщения, не приняла название Балара и назвала новый элемент бромом. Открытие брома сделало молодого и мало кому известного ученого знаменитым. После появления статьи Балара оказалось, что склянки с аналогичным веществом ждали исследования у немецких химиков К. Левига и Ю. Либиха. Упустивший возможность открыть новый элемент, Либих воскликнул: “Это не Балар открыл бром, а бром открыл Балара”.
Нахождение в природе: бром — довольно редкий в земной коре элемент. Его содержание в ней оценивается в 0,37·10-4% (примерно 50-е место). бром элемент открытие применение
Химически бром высоко активен и поэтому в свободном виде в природе не встречается. Входит в состав большого числа различных соединений (бромиды натрия (Na) , калия (K) , магния (Mg) и др.), сопутствующих хлоридам натрия, калия и магния. Собственные минералы брома — бромаргирит (бромид серебра (Ag) AgBr) и эмболит (смешанный хлорид и бромид серебра (Ag) ) — чрезвычайно редки. Источником брома служат воды горьких озер, соляные рассолы, сопутствующие нефти и различным соляным месторождениям, и морская вода (65·10-4%), более богато бромом Мертвое море. В настоящее время бром обычно извлекают из вод некоторых горьких озер, одно из которых расположено, в частности, в нашей стране в Кулундинской степи (на Алтае).
Применение: бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения, а также в фотографии. Широко известны содержащие бром лекарственные препараты. Следует отметить, что расхожее выражение: “врач прописал бром по столовой ложке после еды” означает, разумеется, лишь то, что прописан водный раствор бромида натрия (или калия), а не чистый бром. Успокаивающее действие бромистых препаратов основано на их способности усиливать процессы торможения в центральной нервной системе.
Особенности работы с бромом: при работе с бромом следует пользоваться защитной спецодеждой, противогазом, перчатками. ПДК паров брома 0,5 мг/м3. Уже при содержании брома в воздухе в концентрации около 0,001% (по объему) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях — спазмы дыхательных путей, удушье. При попадании в организм токсическая доза составляет 3 г, летальная — от 35 г. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух, для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Жидкий бром при попадании на кожу вызывает болезненные ожоги.
Из-за высокой химической активности и ядовитости как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в емкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из-за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда ядовитая жидкость окажется на полу).
Для нейтрализации пролитого брома поверхность с ним надо немедленно покрыть кашицей из влажной соды Na2CO3.
Размещено на Allbest.ru
…Подобные документы
Характеристика брома как химического элемента. История открытия, нахождение в природе. Физические и химические свойства этого вещества, его взаимодействие с металлами. Получение брома и его применение в медицине. Биологическая роль его в организме.
презентация , добавлен 16.02.2014
Характеристика свойств брома как химического элемента. История его открытия, уникальность воздействия этого металла на протекание биологических процессов в организме. Последствия недостатка брома в организме, его содержание в некоторых продуктах.
презентация , добавлен 20.12.2012
История открытия и место в периодической системе химических элементов Д.И. Менделеева галогенов: фтора, хлора, брома, йода и астата. Химические и физические свойства элементов, их применение. Распространённость элементов и получение простых веществ.
презентация , добавлен 13.03.2014
История открытия водорода. Общая характеристика вещества. Расположение элемента в периодической системе, строение его атома, химические и физические свойства, нахождение в природе. Практическое применение газа для полезного и вредного использования.
презентация , добавлен 19.05.2014
История открытия кислорода. Нахождение элемента в таблице Менделеева, его вхождение в состав других веществ и живых организмов, распространенность в природе. Физические и химические свойства кислорода. Способы получения и области применения элемента.
презентация , добавлен 07.02.2012
Особенности серы как химического элемента таблицы Менделеева, ее распространенность в природе. История открытия этого элемента, характеристика его основных свойств. Специфика промышленного получения и способов добычи серы. Важнейшие соединения серы.
презентация , добавлен 25.12.2011
Физические и химические свойства галогенов, их положение в Периодической таблице элементов Менделеева. Основные источники и биологическое значение хлора, брома, иода, фтора. Нахождение галогенов в природе, их получение и промышленное использование.
презентация , добавлен 01.12.2014
Свойства молибдена и его соединений. История открытия элемента. Электронная структура атома, его расположение в периодической системе химических элементов Д.И. Менделеева. Химические и физические свойства молибдена, его оксидов и гидроксидов.
курсовая работа , добавлен 24.06.2008
История открытия железа. Положение химического элемента в периодической системе и строение атома. Нахождение железа в природе, его соединения, физические и химические свойства. Способы получения и применение железа, его воздействие на организм человека.
презентация , добавлен 04.01.2015
Характеристика азота – элемента 15-й группы второго периода периодической системы химических элементов Д. Менделеева. Особенности получения и применения азота. Физические и химические свойства элемента. Применение азота, его значение в жизни человека.
Природный бром представляет смесь двух нуклидов с массовыми числами 79 (в смеси 50,56% по массе) и 81. Конфигурация внешнего электронного слоя 4s 2 p 5 . В соединениях проявляет степени окисления 1, +1, +3, +5 и +7 (валентности I, III, V и VII), причем наиболее характерны степени окисления 1 и +5.
Расположен в четвертом периоде в группе VIIА периодической системы элементов Менделеева.
Радиус нейтрального атома брома 0,119 нм, ионные радиусы Вr , Вr 3+ , Вr 5+ и Вr 7+ равны, соответственно, 0,182; 0,073; 0,045 и 0,039 нм. Энергии последовательной ионизации нейтрального атома брома равны, соответственно, 11,84; 21,80; 35,9; 47,3 и 59,7 эВ. Сродство к электрону 3,37 эВ. По шкале Полинга электроотрицательность брома 2,8.
Название: связано с тем, что у брома тяжелый, неприятный запах паров (от греческого bromos зловоние).
История открытия: к открытию брома привели исследования французского химика А.Балара, который в 1825 году, действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно-бурую дурно пахнущую жидкость. Эту жидкость, полученную также из морской воды, он назвал муридом (от лат. muria соляной раствор, рассол) и послал сообщение о своем открытии в Парижскую академию наук. Комиссия, созданная для проверки этого сообщения, не приняла название Балара и назвала новый элемент бромом. Открытие брома сделало молодого и мало кому известного ученого знаменитым. После появления статьи Балара оказалось, что склянки с аналогичным веществом ждали исследования у немецких химиков К. Левига и Ю. Либиха. Упустивший возможность открыть новый элемент, Либих воскликнул: “Это не Балар открыл бром, а бром открыл Балара”.
Свойства: при обычных условиях бром тяжелая (плотность 3,1055 г/см 3) красно-бурая густая жидкость с резким запахом. Бром относится к числу простых веществ, жидких при обычных условиях (кроме брома, таким веществом является еще ). Температура плавления брома 7,25°C, температура кипения +59,2°C. Стандартный электродный потенциал Вr 2 /Вr в водном растворе равен +1,065 В.
В свободном виде существует в виде двухатомных молекул Br 2 . Заметная диссоциация молекул на атомы наблюдается при температуре 800°C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br 2 0,323 нм, межъядерное расстояние в этой молекуле 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20°C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
Br 2 + H 2 O = HBr + HBrO.
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором (Cl) и иодом (I) . При реакции брома с растворами иодидов выделяется свободный иод (I) :
Br 2 + 2KI = I 2 + 2KBr.
Бром сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион до нитрата и т.д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
C 2 H 4 + Br 2 = C 2 H 4 Br 2 .
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через нее газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C 6 H 5 Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия (Na) или калия (K) образуются соответствующие бромиды и броматы, например:
Br 2 + 3Na 2 CO 3 = 5NaBr + NaBrO 2 + 3CO 2 .
Нахождение в природе: бром довольно редкий в земной коре элемент. Его содержание в ней оценивается в 0,37·10 4 % (примерно 50-е место).
Химически бром высоко активен и поэтому в свободном виде в природе не встречается. Входит в состав большого числа различных соединений (бромиды натрия (Na) , калия (K) , магния (Mg) и др.), сопутствующих хлоридам натрия, калия и магния. Собственные минералы брома бромаргирит (бромид серебра (Ag) AgBr) и эмболит (смешанный хлорид и бромид серебра (Ag)) чрезвычайно редки. Источником брома служат воды горьких озер, соляные рассолы, сопутствующие нефти и различным соляным месторождениям, и морская вода (65·10 4 %) , более богато бромом Мертвое море. В настоящее время бром обычно извлекают из вод некоторых горьких озер, одно из которых расположено, в частности, в нашей стране в Кулундинской степи (на Алтае).
Применение: бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения, а также в фотографии. Широко известны содержащие бром лекарственные препараты. Следует отметить, что расхожее выражение: “врач прописал бром по столовой ложке после еды” означает, разумеется, лишь то, что прописан водный раствор бромида натрия (или калия), а не чистый бром. Успокаивающее действие бромистых препаратов основано на их способности усиливать процессы торможения в центральной нервной системе.
Особенности работы с бромом: при работе с бромом следует пользоваться защитной спецодеждой, противогазом, перчатками. ПДК паров брома 0,5 мг/м 3 . Уже при содержании брома в воздухе в концентрации около 0,001% (по объему) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях спазмы дыхательных путей, удушье. При попадании в организм токсическая доза составляет 3 г, летальная от 35 г. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух, для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Жидкий бром при попадании на кожу вызывает болезненные ожоги.
БРОМ (лат. Bromum), Br, химический элемент VII группы периодической системы, атомный номер 35, атомная масса 79,904, относится к галогенам .
Природный бром представляет смесь двух нуклидов с массовыми числами 79 (в смеси 50,56% по массе) и 81. Конфигурация внешнего электронного слоя 4s2p5. В соединениях проявляет степени окисления -1, +1, +3, +5 и +7 (валентности I, III, V и VII), причем наиболее характерны степени окисления -1 и +5.
Расположен в четвертом периоде в группе VIIА периодической системы элементов Менделеева.
Радиус нейтрального атома брома 0,119 нм, ионные радиусы Вr-, Вr3+, Вr5+ и Вr7+ равны, соответственно, 0,182; 0,073; 0,045 и 0,039 нм. Энергии последовательной ионизации нейтрального атома брома равны, соответственно, 11,84; 21,80; 35,9; 47,3 и 59,7 эВ. Сродство к электрону 3,37 эВ. По шкале Полинга электроотрицательность брома 2,8.
Название: связано с тем, что у брома тяжелый, неприятный запах паров (от греческого bromos — зловоние).
История открытия: к открытию брома привели исследования французского химика А.Балара, который в 1825 году, действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно-бурую дурно пахнущую жидкость. Эту жидкость, полученную также из морской воды, он назвал муридом (от лат. muria — соляной раствор, рассол) и послал сообщение о своем открытии в Парижскую академию наук. Комиссия, созданная для проверки этого сообщения, не приняла название Балара и назвала новый элемент бромом. Открытие брома сделало молодого и мало кому известного ученого знаменитым. После появления статьи Балара оказалось, что склянки с аналогичным веществом ждали исследования у немецких химиков К. Левига и Ю. Либиха. Упустивший возможность открыть новый элемент, Либих воскликнул: “Это не Балар открыл бром, а бром открыл Балара”.
Нахождение в природе: бром — довольно редкий в земной коре элемент. Его содержание в ней оценивается в 0,37·10-4% (примерно 50-е место). бром элемент открытие применение
Химически бром высоко активен и поэтому в свободном виде в природе не встречается. Входит в состав большого числа различных соединений (бромиды натрия (Na) , калия (K) , магния (Mg) и др.), сопутствующих хлоридам натрия, калия и магния. Собственные минералы брома — бромаргирит (бромид серебра (Ag) AgBr) и эмболит (смешанный хлорид и бромид серебра (Ag) ) — чрезвычайно редки. Источником брома служат воды горьких озер, соляные рассолы, сопутствующие нефти и различным соляным месторождениям, и морская вода (65·10-4%), более богато бромом Мертвое море. В настоящее время бром обычно извлекают из вод некоторых горьких озер, одно из которых расположено, в частности, в нашей стране в Кулундинской степи (на Алтае).
Применение: бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения, а также в фотографии. Широко известны содержащие бром лекарственные препараты. Следует отметить, что расхожее выражение: “врач прописал бром по столовой ложке после еды” означает, разумеется, лишь то, что прописан водный раствор бромида натрия (или калия), а не чистый бром. Успокаивающее действие бромистых препаратов основано на их способности усиливать процессы торможения в центральной нервной системе.
Особенности работы с бромом: при работе с бромом следует пользоваться защитной спецодеждой, противогазом, перчатками. ПДК паров брома 0,5 мг/м3. Уже при содержании брома в воздухе в концентрации около 0,001% (по объему) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях — спазмы дыхательных путей, удушье. При попадании в организм токсическая доза составляет 3 г, летальная — от 35 г. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух, для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Жидкий бром при попадании на кожу вызывает болезненные ожоги.
Из-за высокой химической активности и ядовитости как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в емкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из-за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда ядовитая жидкость окажется на полу).
Для нейтрализации пролитого брома поверхность с ним надо немедленно покрыть кашицей из влажной соды Na2CO3.
Содержание статьи
БРОМ (Bromum, Br) – элемент 17 (VIIa) группы периодической системы, атомный номер 35, относительная атомная масса 79,904. Природный бром состоит из двух стабильных изотопов: 79 Br (50,69 ат.%) и 81 Br (49,31 ат.%), а всего известно 28 изотопов с массовыми числами от 67 до 94. В химических соединениях бром проявляет степени окисления от –1 до +7, в природе встречается исключительно в степени окисления –1.
История открытия.
Вплотную к открытию брома практически одновременно подошли сразу трое ученых, но официально признанным первооткрывателем суждено было стать только одному из них.
В 1825 молодой французский химик Антуан Жером Балар (Antoine-Jérôme Balard), работавший препаратором в Фармакологической школе при университете небольшого южного городка Монпелье, приступил к своим первым самостоятельным научным исследованиям. С древнейших времен Монпелье был знаменит своими соляными промыслами. Для добычи соли на берегу моря вырывали бассейны и заполняли их морской водой. После того, как под действием солнечных лучей вода испарялась, выпавшие кристаллы соли вычерпывали, а оставшийся маточный раствор (рапу) возвращали обратно в море.
Руководитель Балара, профессор Жозеф Англада (Joseph Anglada), поручил ему изучить химический состав сливаемого рассола и прибрежных морских водорослей. Действуя на рапу различными реактивами, Болар заметил, что при пропускании через нее хлора раствор приобретает интенсивный желтый цвет. Аналогично окрашивал хлор и щелочной экстракт золы водорослей. Вначале Балар предположил, что наблюдаемая окраска вызвана присутствием в исследуемых образцах иода, который, реагируя с хлором, и образует неизвестное вещество. Для начала он экстрагировал его последовательно эфиром и водным гидроксидом калия. Обработав полученный щелочной раствор пиролюзитом (MnO 2) в сернокислой среде, Балар выделил неприятно пахнущую красно-бурую жидкость и попробовал разделить ее на составные части. Когда все попытки не принесли результата, стало ясно, что это новый элемент. Определив плотность и температуру кипения жидкости, а также изучив ее важнейшие химические свойства, 30 ноября 1825 Балар отправил доклад о своих опытах в Парижскую академию наук. В нем, в частности, для нового элемента было предложено название «мурид» (от латинского слова «muria» – рассол).
Для проверки сообщения была назначена комиссия из трех химиков: Луи Вокелена (Louis Nicolas Vauquelin), Луи Тенара (Louis Jacques Thénard) и Жозефа Гей-Люссака . Повторив описанные эксперименты, они подтвердили выводы Балара, но название «мурид» признали неудачным, т.к. что соляная кислота называлась тогда acidum muriaticum – муриевой (от гипотетического элемента мурия), а ее соли – муриатами и употребление столь похожих названий «мурид» и «мурий» могло вызвать недоразумения. Согласно рекомендации номенклатурного комитета при академии наук новый элемент было предложено назвать бромом от греческого brwmoV – зловонный. В России название «бром» утвердилось не сразу, в течение долгого времени для элемента № 35 использовались названия «вром», «мурид», и «вромид».
Позднее выяснилось, что впервые элементарный бром получил не Балар а студент известного немецкого химика Леопольда Гмелина Карл Левиг (Carl Jacob Löwig, Leopold Gmelin), который в 1825 в Гейдельбергском университете выделил его из воды источника в Крейцнахе. Пока он приготовлял большее количество препарата для исследования, появилось сообщение Балара.
Вплотную к открытию брома подошел и знаменитый немецкий химик Юстус Любих, точно так же, как и Балар, принявший его за соединение хлора и иода.
Можно сказать, что открытие брома лежало на поверхности, и французский химик Шарль Жерар (Charles Frédéric Gerhardt) сказал даже, что «Не Балар открыл бром, а бром открыл Балара».
В природе бром почти всегда встречается вместе с хлором в виде изоморфной примеси в природных хлоридах (до 3% в сильвине KCl и карналлите KCl·MgCl 2 ·6H 2 O). Собственные минералы брома: бромаргирит AgBr, бромсильвинит KMgBr 3 ·6H 2 O и эмболит Ag(Br, Cl) – встречаются редко и промышленного значения не имеют. Они были открыты гораздо позже элементарного брома (бромаргирит – в Мексике, в 1841). Кларк (среднее содержание в земной коре) брома в земной коре составляет 2,1·10 –4 %.
Большое количество брома содержится в гидросфере Земли (около 3/4 от имеющегося в земной коре): в океанах (6,6·10 –3 %), соляных озерах, подземных рассолах и грунтовых водах. Наибольшая концентрация растворенных бромидов – около 6 мг/л – отмечена в воде Мертвого моря, а общее количество брома в нем оценивается в 1 млрд. тонн. Вместе с брызгами соленой воды соединения брома попадают в атмосферу.
Бром есть и в живых организмах. Содержание брома в живой фитомассе составляет 1,6·10 –4 %. В человеческом теле средняя концентрация брома составляет около 3,7 мг/кг, большая часть его сосредоточена в мозге, печени, крови и почках. Среди неорганических анионов, входящих в состав крови бромид-ион занимает пятое место по количеству после хлорида, гидрокарбоната, фосфата и сульфата; его концентрация в плазме крови находится в пределах 20–150 мкмоль/л. Некоторые животные, грибы и растения (прежде всего бобовые), способны накапливать бром, особенно много его в морских рыбах и водорослях.
Получение брома.
Промышленное производство брома началось в 1865 на базе Страссфуртского соляного месторождения в Германии, двумя годами позже бром стали добывать в США, в штате Вирджиния. В 1924 на борту судна «Этила» была продемонстрирована возможность добычи брома из морской воды, а в 1934 организовано промышленное производство, основанное на этом методе. В России первый бромный завод был построен в 1917 на соляном озере Сакское.
Все промышленные способы получения брома из соляных растворов основаны на его вытеснении хлором из бромидов:
MgBr 2 + Cl 2 = MgCl 2 + Br 2
При получении брома методом выдувания исходное сырье (рапу соляных озер, попутные воды нефтяных скважин, морскую воду) подкисляют серной кислотой до pH» 3,5 и обрабатывают избыточным количеством хлора. Затем рассол, содержащий растворенный бром, подают в верхнюю часть колонны, заполненной небольшими керамическими кольцами. Раствор стекает по кольцам, а навстречу ему продувают мощную струю воздуха, при этом бром переходит в газовую фазу. Бромовоздушную смесь пропускают через раствор карбоната натрия:
3Na 2 CO 3 + 3Br 2 = 5NaBr + NaBrO 3 + 3CO 2
Для выделения брома из полученной смеси бромида и бромата натрия, ее подкисляют серной кислотой:
5NaBr + NaBrO 3 + 3H 2 SO 4 = 3Na 2 SO 4 + 3Br 2 + 3H 2 O
Другие предложенные способы извлечения брома из хлорированного рассола: экстракция углеводородами или адсорбция ионообменными смолами – не получили широкого распространения.
Часть используемых в промышленности растворов бромидов (в США до 35%) отправляют на повторную переработку с целью получения дополнительных количеств брома.
Мировое производство брома (по данным на 2003) составило около 550 тыс. тонн в год, большая часть его производится в США (39,4%), Израиле (37,6%), и Китае (7,7%). Динамика производства брома в различных странах мира приведена в таблице 1.
| Табл. 1. ДИНАМИКА МИРОВОГО ПРОИЗВОДСТВА БРОМА (в тыс. тонн). | |||||
| Страна | 1999 | 2000 | 2001 | 2002 | 2003 |
| США | 239 | 228 | 212 | 222 | 216 |
| Израиль | 181 | 210 | 206 | 206 | 206 |
| Китай | 42 | 42 | 40 | 42 | 42 |
| Великобритания | 55 | 32 | 35 | 35 | 35 |
| Иордания | – | – | – | 5 | 20 |
| Япония | 20 | 20 | 20 | 20 | 20 |
| Украина | 3 | 3 | 3 | 3 | 3 |
| Азербайджан | 2 | 2 | 2 | 2 | 2 |
| Франция | 1,95 | 2 | 2 | 2 | 2 |
| Индия | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 |
| Германия | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Италия | 0,3 | 0,3 | 0,3 | 0,3 | 0,3 |
| Туркменистан | 0,15 | 0,15 | 0,15 | 0,15 | 0,15 |
| Испания | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
| Всего в мире | 547 | 542 | 523 | 540 | 548 |
Цена элементного брома колеблется от 700 до 1000 долл. за тонну. Годовая потребность России в броме оценивается в 20–25 тыс. тонн, она удовлетворяется, в основном, за счет импорта из США и Израиля.
В лаборатории бром можно получить взаимодействием бромидов с подходящим окислителем, например перманганатом калия или диоксидом марганца, в кислой среде.
MnO 2 + 2H 2 SO 4 + 2NaBr = Br 2 + MnSO 4 + Na 2 SO 4
Выделившийся бром отделяют экстракцией неполярными растворителями или перегонкой с водяным паром.
Простое вещество.
Бром – единственный неметалл, жидкий при комнатной температуре. Элементный бром представляет собой тяжелую красно-бурую жидкость с неприятным запахом (плотность при 20° C – 3,1 г/см 3 , температура кипения +59,82° C), пары брома имеют желто-бурый цвет. При температуре –7,25° C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском.
В твердом, жидком и газообразном состоянии бром существует в виде двухатомных молекул Br 2 , заметная диссоциация на атомы начинается только при 800° C, диссоциация происходит и под действием света. Элементный бром является сильным окислителем, он непосредственно реагирует почти со всеми неметаллами (за исключением инертных газов, кислорода, азота и углерода) и многими металлами, эти реакции зачастую сопровождаются воспламенением (например, с фосфором, сурьмой, оловом):
2S + Br 2 = S 2 Br 2
2P + 3Br 2 = 2PBr 3 ; PBr 3 + Br 2 = 2PBr 5
2Al + 3Br 2 = 2AlBr 3
Ni + Br 2 = NiBr 2
Многие металлы медленно реагируют с безводным бромом из-за образования на их поверхности пленки бромида, нерастворимого в броме. Из металлов наиболее устойчивы к действию брома (даже при повышенных температурах и в присутствии влаги) серебро, свинец, платина и тантал. Золото, в отличие от платины, легко реагирует с ним, образуя AuBr 3 .
В водной среде бром окисляет нитриты до нитратов, аммиак до азота, иодиды до свободного иода, серу и сульфиты до серной кислоты:
2NH 3 + 6Br 2 = N 2 + 6HBr
3Br 2 + S + 4H 2 O = 6HBr + H 2 SO 4
Бром умеренно растворим в воде (3,58 г в 100 г при 20° C), при охлаждении этого раствора до 6° C из него выпадают гранатово-красные кристаллы клатратного гидрата брома состава 6Br 2 ·46H 2 O. Растворимость брома существенно возрастает при добавлении бромидов за счет образования прочных комплексных соединений:
KBr + Br 2 = KBr 3
В водном растворе брома («бромной воде») существует равновесие между молекулярным бромом, бромид-ионом и оксокислотами брома:
Br 2 + H 2 O = HBr + HBrO
В насыщенном растворе бром диссоциирован на 0,85%, в 0,001-молярном – на 17%.
При хранении бромной воды на свету она постепенно разлагается с выделением кислорода из-за фотолиза бромноватистой кислоты:
2HOBr + hv = 2HBr + O 2
При взаимодействии брома с растворами щелочей образуются соответствующие бромиды и гипобромиты (на холоду) или броматы:
Br 2 + 2NaOH = NaBr + NaBrO + H 2 O (при t
3Br 2 + 6NaOH = 5NaBr + NaBrO 3 + 3H 2 O
Вследствие высокой химической активности брома, для его транспортировки используются цистерны с внутренней свинцовой или никелевой обкладкой. Малые объемы брома хранят в стеклянной посуде.
Соединения брома.
Известны химические соединения брома, в которых он может проявлять степени окисления –1, 0, +1, +3, +5 и +7. Наибольший практический интерес представляют вещества, содержащие бром в степени окисления –1, к ним относятся бромоводород, а также неорганические и органические бромиды. Соединения брома в положительных степенях окисления представлены, в основном, кислородными кислотами брома и их солями; все они являются сильными окислителями.
Бромоводород HBr , представляет собой ядовитый (ПДК = 2 мг/м 3) бесцветный газ с резким запахом, дымящий на воздухе из-за взаимодействия с парами воды. При охлаждении до –67° C бромоводород переходит в жидкое состояние. HBr хорошо растворим в воде: при 0° C в одном объеме воды растворяется 612 объемов бромоводорода, в растворе HBr диссоциирует на ионы:
HBr + H 2 O = H 3 O + + Br –
Водный раствор HBr называется бромоводородной кислотой, она относится к числу сильных кислот (pK a = –9,5). В HBr бром имеет степень окисления –1 и поэтому бромоводородная кислота проявляет восстановительные свойства, она окисляется концентрированной серной кислотой и кислородом воздуха (на свету):
H 2 SO 4 + 2HBr = Br 2 + SO 2 + 2H 2 O
4HBr + O 2 = 2Br 2 + 2H 2 O
При взаимодействии с металлами, а также с оксидами и гидроксидами металлов бромоводородная кислота образует соли – бромиды :
HBr + KOH = KBr + H 2 O
В промышленности бромоводород получают прямым синтезом из элементов в присутствии катализатора (платины или активированного угля) H 2 + Br 2 = 2HBr и, в качестве побочного продукта, при бромировании органических соединений:
В лаборатории HBr может быть получен при действии концентрированной фосфорной кислоты на бромиды щелочных металлов при нагревании:
NaBr + H 3 PO 4 = NaH 2 PO 4 + HBr
Удобным лабораторным методом синтеза HBr является также взаимодействие брома с бензолом или декалином в присутствии железа:
C 10 H 18 + Br 2 = C 10 H 17 Br + HBr
Бромоводород применяется для получения бромидов и некоторых органических соединений брома.
Бромид калия KBr – бесцветное кристаллическое вещество, хорошо растворимое в воде (65 г в 100 г воды при 20° C), t пл = 730° C. Бромид калия применяется при изготовлении фотоэмульсий и в качестве противовуалирующего вещества в фотографии. KBr хорошо пропускает инфракрасные лучи и поэтому служит материалом для изготовления линз для ИК-спектроскопии.
Бромид лития LiBr , представляет собой бесцветное гигроскопичное вещество (t пл = 552° C), хорошо растворимое в воде (63,9% при 20° C). Известен кристаллогидрат LiBr·2H 2 O. Бромид лития получают при взаимодействии водных растворов карбоната лития и бромоводородной кислоты:
Li 2 CO 3 + 2HBr = 2LiBr + H 2 O + CO 2
Бромид лития применяют при лечении психических заболеваний и хронического алкоголизма. Из-за высокой гигроскопичности LiBr используется как осушающее вещество в системах кондиционирования воздуха и для обезвоживания минеральных масел.
Бромноватистая кислота HOBr относится к слабым кислотам, она существует лишь в разбавленных водных растворах, которые получают взаимодействием брома с суспензией оксида ртути:
2Br 2 + 2HgO + H 2 O = HgO·HgBr 2 Ї + 2HOBr
Соли бромноватистой кислоты называются гипобромитами , они могут быть получены взаимодействием брома с холодным раствором щелочи (см. выше ), при нагревании щелочных растворов гипобромиты диспропорционируют:
3NaBrO = 2NaBr + NaBrO 3
Степени окисления брома +3 соответствует бромистая кислота HBrO 2, которая в настоящее время не получена. Известны только ее соли – бромиты , которые можно получить окислением гипобромитов бромом в щелочной среде:
Ba(BrO) 2 + 2Br 2 + 4KOH = Ba(BrO 2) 2 + 4KBr + 2H 2 O
Бромноватая кислота HBrO 3 получена в растворах при действии разбавленной серной кислоты на растворы ее солей – броматов :
Ba(BrO 3) 2 + H 2 SO 4 = 2HBrO 3 + BaSO 4 Ї
При попытке получения растворов с концентрацией выше 30% бромноватая кислота разлагается со взрывом.
Бромноватая кислота и броматы являются сильными окислителями:
2S + 2NaBrO 3 = Na 2 SO 4 + Br 2 + SO 2 .
Бромат калия KBrO 3 – бесцветное кристаллическое вещество, растворимое в воде (в 100 г воды при 20° C растворяется 6,9 г KBrO 3 , при 100° C – 49,7 г). При нагревании до 434° C разлагается без плавления:
2KBrO 3 = 2KBr + 3O 2
Бромат калия получают электролизом растворов KBr или взаимодействием гидроксида калия с бромом и хлором:
12KOH + Br 2 + 5Cl 2 = 2KBrO 3 + 10KCl +6H 2 O
KBrO 3 применяется в аналитической химии в качестве окислителя при броматометрическом титровании, он входит в состав нейтрализаторов для химической завивки.
Наиболее устойчивой из оксокислот брома является бромная кислота HBrO 4 , которая существует в водных растворах с концентрацией, не превышающей 6 моль/л. Несмотря на то, что HBrO 4 – самый сильный окислитель среди кислородных кислот брома, окислительно-восстановительные реакции с ее участием протекают очень медленно. Так, например, бромная кислота не выделяет хлор из одномолярного раствора соляной кислоты, хотя эта реакция термодинамически выгодна. Особая устойчивость иона BrO 4 – связана с тем, что атомы кислорода, окружая атом брома по тетраэдру, эффективно защищают его от атаки восстановителя. Растворы бромной кислоты можно получить подкислением растворов ее солей – перброматов, которые, в свою очередь, синтезируют электролизом растворов броматов, а также окислением щелочных растворов броматов фтором или фторидами ксенона:
NaBrO 3 + XeF 2 + 2NaOH = NaBrO 4 + 2NaF + Xe + H 2 O
Из-за сильных окислительных свойств перброматов они были синтезированы только во второй половине 20 в. американским ученым Эваном Эпплманом (Evan H.Appelman) в 1968.
Кислородные кислоты брома и их соли могут быть использованы в качестве окислителей.
Биологическая роль и токсичность соединений брома.
Многие аспекты биологической роли брома в настоящее время еще не выяснены. В организме человека бром участвует в регуляции деятельности щитовидной железы, так как является конкурентным ингибитором иода. Некоторые исследователи полагают, что соединения брома участвуют в деятельности эозинофилов – клеток иммунной системы. Пероксидаза эозинофилов окисляет бромид-ионы до бромноватистой кислоты, которая помогает разрушать чужеродные клетки, в том числе и раковые. Недостаток брома в пище приводит к бессоннице, замедлению роста и уменьшению числа эритроцитов в крови. Ежедневное поступление брома в организм человека с пищей составляет 2–6 мг. Особенно богаты бромом рыба, злаки и орехи.
Элементный бром ядовит. Жидкий бром вызывает трудно заживающие ожоги, при попадании на кожу его нужно смыть большим количеством воды или раствора соды. Пары брома в концентрации 1мг/м 3 вызывают раздражение слизистых оболочек, кашель, головокружение и головную боль, а в более высокой (>60 мг/м 3) – удушье и смерть. При отравлении парами брома рекомендуется вдыхать аммиак. Токсичность соединений брома менее велика, тем не менее, при длительном употреблении бромсодержащих препаратов может развиться хроническое отравление – бромизм. Его симптомы – общая вялость, появление сыпи на коже, апатия, сонливость. Бромид-ионы, поступая в организм в течение длительного времени, препятствуют накоплению иода в щитовидной железе, угнетая ее деятельность. Для ускорения выведения брома из организма назначают диету с большим содержанием соли и обильное питье.
Применение брома и его соединений.
Первым известным применением соединений брома было производство пурпурного красителя. Его добывали еще во втором тысячелетии до нашей эры из моллюсков вида «мурекс», накапливающих бром из морской воды. Процесс извлечения красителя был очень трудоемок (из 8000 моллюсков можно получить всего 1 грамм пурпура) и позволить себе носить окрашенную им одежду могли только очень богатые люди. В древнем Риме носить ее могли только представители высшей власти, поэтому он получил название «королевский пурпур». Структуру действующего начала этого красителя установили только во второй половине 19 в., им оказалось соединение брома – 6,6″– диброминдиго. Бромпроизводные индиго, синтезируемые искусственно, используются для окрашивания тканей (в основном, хлопковых) и сейчас.
В 19 в. главными областями использования соединений брома были фотография и медицина.
Бромид серебра AgBr стал применяться как светочувствительный материал около 1840. Современные фотоматериалы на основе AgBr позволяют делать снимки с выдержкой 10 –7 секунды. Для изготовления фотопленки на основе бромида серебра, эта соль синтезируется в водном растворе желатина, при этом выпавшие кристаллики AgBr равномерно распределяются по всему объему раствора. После застывания желатина образуется тонкодисперсная суспензия, которую тонким слоем (толщиной от 2 до 20 мкм) равномерно наносят на поверхность носителя – прозрачной пленки, изготовленной из ацетата целлюлозы. В каждом квадратном сантиметре полученного слоя содержится несколько сот миллионов зерен бромида серебра, окруженных желатиновой пленкой. При попадании света на такую фотопленку происходит фотолитическое разложение AgBr:
AgBr + hv = Ag + Br
Протеканию в фотоэмульсии обратного процесса – окисления серебра бромом, препятствует желатина. Фотолиз приводит к образованию в микрокристаллах AgBr групп атомов серебра с размерами 10 –7 –10 –8 см, так называемых центров скрытого изображения. Для получения видимого изображения бромид серебра на засвеченных участках восстанавливают до металлического серебра. Центры скрытого изображения катализируют (ускоряют) реакцию восстановления и позволяют провести ее, практически не затронув неосвещенных кристалликов AgBr. После растворения оставшегося бромида серебра на фотопленке получается черно-белое изображение (негатив), устойчивое к действию света. Для создания позитивного изображения нужно повторить процесс, освещая (обычно) фотобумагу через пленку, на которой с негативным изображением.
Соли брома оказались очень эффективными лекарственными средствами для лечения многих нервных болезней. Знаменитый русский физиолог И.П.Павлов сказал: «Человечество должно быть счастливо тем, что располагает таким драгоценным для нервной системы препаратом, как бром». Использование KBr в медицине в качестве седативного (успокоительного) и противосудорожного средства при лечении эпилепсии началось в 1857. В то время водные растворы бромида калия и натрия были известны под общим названием «бром». В течение долгого времени механизм действия препаратов брома оставался неизвестным, считалось, что бромиды уменьшают возбудимость, действуя аналогично снотворным. Лишь в 1910 один из учеников Павлова П.М.Никифоровский экспериментально показал, что бромиды усиливают процессы торможения в центральной нервной системе. Сейчас бромиды натрия и калия практически вышли из употребления при лечении нервных заболеваний. Они были вытеснены более эффективными броморганическими препаратами.
В начале 20 в. открылась новая область применения брома. С распространением автомобилей появилась нужда в больших количествах дешевого бензина, вместе с тем существующая в то время нефтяная промышленность не могла производить требуемые объемы высокооктанового горючего. Для улучшения качества топлива – уменьшения его способности к детонации в двигателе – в 1921 американский инженер Томас Мидгли (Thomas Midgley) предложил вводить в бензин дополнительный компонент – тетраэтилсвинец (Pb(C 2 H 5) 4 , ТЭС). Эта добавка оказалась очень эффективной, но при ее использовании возникла новая проблема – отложения свинца в двигателях. Чтобы избежать их образования, ТЭС растворяют в бромуглеводородах – 1,2 -дибромэтане (BrCH 2 CH 2 Br) и этилбромиде (C 2 H 5 Br), полученная смесь получила название «этиловая жидкость» (см. ОКТАНОВОЕ ЧИСЛО). Механизм ее действия заключается в том, что при совместном сгорании бромуглеводородов и ТЭС образуются летучие бромиды свинца, которые выносятся из двигателя вместе с выхлопными газами. В середине прошлого века на производство этиловой жидкости расходовалась большая часть производимого брома – 75% в 1963. Сейчас использование этиловой жидкости не соответствует современным требованиям экологической безопасности и ее мировое производство сокращается: в России, например, доля этилированного (содержащего этиловую жидкость) бензина в общем объеме автомобильного топлива составляла в 1995 более 50%, а в 2002 – 0,4%. В России использование ТЭС запрещено с 2003, а в некоторых регионах– еще раньше (в Москве – с 1993).
Теперь основной областью использования брома является производство антипиренов (от 40% мирового потребления брома). Антипирены – вещества, защищающие материалы органического происхождения от воспламенения. Их используют для пропитки тканей, изделий из древесины и пластмасс, производства негорючих красок. В качестве антипиренов применяются, в основном, ароматические бромпроизводные: дибромстирол, тетрабромфталевый ангидрид, декабромдифенилоксид, 2,4,6-трибромфенол и другие. Бромхлорметан используется в качестве наполнителя огнетушителей, предназначенных для тушения электропроводки.
Значительная часть брома (в США – 24%) в форме бромидов кальция, натрия и цинка расходуется для изготовления буровых растворов, которые закачивают в скважины для увеличения объема добытой нефти.
До 12% брома идет на синтез пестицидов и инсектицидов, используемых в сельском хозяйстве и для защиты деревянных изделий (метилбромид).
Элементный бром и его соединения применяются в процессах водоочистки и водоподготовки. Бром иногда используют для мягкой дезинфекции воды в бассейнах при повышенной чувствительности к хлору. На эти цели расходуется 7% производимого брома.
Около 17% брома расходуется на производство фотографических материалов, фармацевтических препаратов и высококачественной резины (бромбутилкаучука).
Органические соединения брома применяют для ингаляционного наркоза (галотан – 1,1,1-трифтор-2-хлор-2-бромэтан, CF 3 CHBrCl), в качестве обезболивающих, успокоительных, антигистаминных и антибактериальных препаратов, при лечении язвенных болезней, эпилепсии, сердечно-сосудистых заболеваний. Изотоп брома с атомной массой 82 находит применение в медицине при лечении опухолей и при изучении поведения бромсодержащих препаратов в организме.
Бромбутилкаучук получают в промышленности при неполном бромировании бутилкаучука – сополимера 97–98% изобутилена CH 2 =C(CH 3) 2 и ne 2–3% изопрена CH 2 =C(CH 3)CH=CH 2 . В этом процессе происходит бромирование только изопреновых звеньев макромолекулы каучука:
–CH 2 –C(CH 3)=CH–CH 2– + Br 2 = –CH 2 –CBr(CH 3) –CHBr–CH 2 –
Введение брома в бутилкаучук существенно повышает скорость его вулканизации. Бромбутилкаучук не имеет запаха, не выделяет вредных веществ при хранении и переработке, он отличается высокой степенью совулканизации с ненасыщенными каучуками и лучшей, чем у бутилкаучука, адгезией к другим полимерам. Галогенированные бутилкаучуки используются для герметизации резиновых изделий из других полимеров (например, в производстве автомобильных шин), для изготовления теплостойких транспортных лент с высоким сопротивлением истиранию, резиновых пробок, химически стойких обкладок емкостей.
Юрий Крутяков
Литература:
Миллер В. Бром . Л., Гос. ин-т прикладной химии. 1967
Фигуровский Н.А. Открытие элементов и происхождение их названий . М., Наука, 1970
Популярная библиотека химических элементов . М., Наука, 1983
Неорганическая химия , т. 2. Под ред. Ю.Д. Третьякова. М., Академия, 2004
U.S. Geological Survey , Mineral Commodity Summaries, January 2004
Жидкость красно-бурого цвета, с резким специфическим запахом, плохо растворимая в воде, но растворяющаяся в бензоле, хлороформе, сероуглероде и других органических растворителях. Такой ответ можно дать на вопрос: «Что такое бром?» Соединение относится к группе наиболее активных неметаллов, реагируя со многими простыми веществами. Оно является сильно токсичным: вдыхание его паров раздражает дыхательные пути, а попадание на кожу вызывает тяжелые, длительно не заживающие ожоги. В нашей статье мы изучим его физические свойства, а также рассмотрим химические реакции, характерные для брома.
Главная подгруппа седьмой группы — место положения элемента в периодической системе химических элементов. На последнем энергетическом слое атома находится два s-электрона и пять p-электронов. Как и все галогены, бром имеет значительное сродство к электрону. Это значит, что он легко притягивает в свою электронную оболочку отрицательные частицы других химических элементов, становясь анионом. Молекулярная формула брома — Br 2 . Атомы соединяются между собой с помощью совместной пары электронов, такой тип связи называется ковалентной. Она также является неполярной, располагаясь на одинаковом расстоянии от ядер атомов. Ввиду достаточно большого радиуса атома — 1,14A°, окислительные свойства элемента, его электроотрицательность и неметаллические свойства становятся меньше, чем у фтора и хлора. Температура кипения, наоборот, повышается и составляет 59,2 °C, относительная молекулярная масса брома равна 180. В свободном состоянии из-за высокой активности элемент как простое вещество не встречается. В природе его можно обнаружить в связанном состоянии в виде солей натрия, магния, калия, особенно высоко их содержание в морской воде. Некоторые виды бурых и красных водорослей: саргассум, фукус, батрахоспермум, содержат большое количество брома и йода.
Реакции с простыми веществами
Для элемента характерно взаимодействие со многими неметаллами: серой, фосфором, водородом:
Br 2 + H 2 = 2HBr
Однако бром непосредственно не реагирует с азотом, углеродом и кислородом. Большинство металлов легко окисляются бромом. Пассивны к действию галогена лишь некоторые из них, например, свинец, серебро и платина. Реакции с бромом более активных галогенов, таких, как фтор и хлор, проходят быстро:
Br 2 +3 F 2 = 2 BrF 3
В последней реакции степень окисления элемента равна +3, он выступает в роли восстановителя. В промышленности бром получают окислением бромоводорода более сильным галогеном, например, хлором. Основными источниками сырья для получения соединения служат подземные буровые воды, а также сильно концентрированный раствор соляных озер. Галоген может взаимодействовать со сложными веществами из класса средних солей. Так, при действии бромной воды, имеющей красно-бурую окраску, на раствор сульфита натрия, мы наблюдаем обесцвечивание раствора. Это происходит по причине окисления бромом средней соли — сульфита до сульфата натрия. Сам же галоген восстанавливается, переходя в вид бромоводорода, не имеющего цвета.
Взаимодействие с органическими соединениями
Молекулы Br 2 способны к взаимодействию не только с простыми, но и со сложными веществами. Например, реакция замещения проходит между ароматическим углеводородом бензолом и бромом при нагревании, в присутствии катализатора — бромида трехвалентного железа. Она заканчивается образованием бесцветного соединения, не растворимого в воде — бромбензола:
C 6 H 6 + Br 2 = C 6 H 5 Br + HBr
Простое вещество бром, растворенное в воде, используется в качестве индикатора для определения наличия в молекуле органических веществ непредельных связей между атомами углерода. Такой качественной реакцией находят в молекулах алкенов или алкинов пи-связи, от которых зависят основные химические реакции указанных углеводородов. Соединение вступает в реакции замещения с предельными углеводородами, при этом образуя производные метана, этана и других алканов. Известна реакция присоединения частиц брома, формула которых Br2, к непредельным веществам с одной или двумя двойными, или с тройной связью в молекулах, например, к таким, как этен, ацетилен или бутадиен.
СН 2 =СН 2 + Br 2 = CH 2 Br — CH 2 Br
С указанными углеводородами может реагировать не только простое вещество, но и его водородное соединение — HBr.
Особенности взаимодействия галогена с фенолом
Органическое вещество, состоящее из бензольного ядра, связанного с гидроксильной группой, — это фенол. В его молекуле прослеживается взаимное влияние групп атомов друг на друга. Поэтому реакции замещения с галогенами у него протекают значительно быстрее, чем у бензола. Причем для процесса не требуется нагревание и присутствие катализатора. Сразу три атома водорода в молекуле фенола замещаются радикалами брома. В результате реакции образуется трибромфенол.
Кислородные соединения брома
Продолжим изучение вопроса, что такое бром. Взаимодействие галогена с холодной водой приводит к получению бромноватистой кислоты HBrO. Она является более слабой, чем соединение хлора, за счет снижения ее окислительных свойств. Еще одно соединение — бромноватая кислота, может быть получено путем окисления бромной воды хлором. Ранее в химии считали, что у брома не может быть соединений, в которых он мог бы проявлять степень окисления +7. Однако окислением бромноватого калия была получена соль — бромат калия, а из нее — и соответствующая кислота — HBrO 4 . Ионы галогенов имеют восстановительные свойства: при действии молекул HBr на металлы последние окисляются катионами водорода. Поэтому с кислотой взаимодействуют только те металлические элементы, которые стоят в ряду активности до водорода. В результате реакции образуются средние соли — бромиды, и выделяется свободный водород.
Применение соединений брома
Высокая окислительная способность брома, масса которого достаточно велика, широко используется в аналитической химии, а также в химии органического синтеза. В сельском хозяйстве препараты, содержащие бром, применяют в борьбе с сорняками и насекомыми — вредителями. Антипирены — вещества, предотвращающие самовозгорание, используют для пропитки строительных материалов, пластмассы, ткани. В медицине давно известно тормозящее действие солей: бромида калия и натрия — на прохождение биоэлектрических импульсов по нервным волокнам. Их применяют при лечении расстройств нервной системы: истерии, неврастении, эпилепсии. Учитывая сильную токсичность соединений, дозировка препарата должна контролироваться врачом.
В нашей статье мы выяснили, что такое бром, и какие физические и химические свойства для него характерны.
Натрий степени окисления — Справочник химика 21
На основе электронного строения атомов указать, могут ли быть окислителями атомы натрия, катионы натрия, кистород в степени окисленности —2, иод в степени окисленности О, фторид-ионы, катионы водорода, нитрит-ионы, гидрид-ионы.. [c.166]В главной подгруппе первой группы периодической системы находятся литий, натрий, калий, рубидий, цезий и франций В соответствии с номером группы в своих соединениях (в большинстве случаев ионных) они проявляют всегда степень окисления -Ы. Чисто ковалентное а—ст-связывание имеет место в газообразных молекулах Кза, Ка и т. д. Эти элементы — самые неблагородные . Их стандартные потенциалы порядка от —2,7 до —3,0 В (ср. табл. В.14). Ионные радиусы сопоставлены в табл. А.16. Обраш,ает на себя внимание тот факт, что при переходе от натрия к калию изменение радиусов оказывается, большим, чем в следующем за ними ряду элементов К—НЬ—Сз почему ). Это обстоятельство является главной причиной отличия свойств натрия от его более тяжелых аналогов. С учетом этого становится понятной аналогия в свойствах соответствующих соединений калия, рубидия и цезия. Особо следует под [c.597]
Написать уравнение реакции получения тиосульфата натрия. Какова степень окисленности серы [c.226]
Написать графическую формулу тиосульфата натрия, указать степень окисления серы в этом соединении и объяснить его неустойчивость в кислой среде, [c.139]
В щелочной среде, взаимодействуя с бромом, хромит натрия окисляется и переходит в хромат натрия — соль хромовой кислоты, в которой хром проявляет высшую степень окисления [c.177]
Электроны, отдаваемые натрием, принимаются атомами хлора, которые превращаются при этом в отрицательно заряженные ионы степень окисленности хлора изменяется от О до —1 [c.266]
Написать уравнение реакции разложения сульфита натрия, учитывая, что вторым продуктом прокаливания является сульфат натрня. Как изменялась степень окислення серы в данной реакции Для каких степеней окисления серы возможны реакции диспропорционирования [c.99]
Запись данных-опыта. Написать уравнения реакций а) взаимодействия нитрата свинца с избытком едкого натра, б) окисления полученного На4[РЬ(ОН)б1 пероксидом водорода. Можно ли РЬ» окислить дихроматом калия (см. Приложение, табл. 11). Какая степень окисления более характерна для свинца +П или +1У [c.178]
Взаимодействие с сульфитом натрия е образованием тиосульфата натрия. Тиосульфат содержит серу в степенях окисления +6 и -2. [c.297]
Влияние продолжительности акустического воздействия на степень окисления этилмеркаптида натрия [c.55]
Запись данных опыта. Написать уравнение реакции. Как изменилась степень окисления висмута в результате реакции Написать графическую формулу висмутата натрия. Можно ли применять его в качестве восстановителя В качестве окислителя Ответ мотивировать. [c.161]
Изучение свойств тиосульфата натрия приводит к выводу, что атомы серы, входящие в его состав, имеют различную окисленность у одного из них степень окисленности — -4, у другого 0. [c.394]
Кроме окисления меркаптидов натрия, степень конверсии которых достигает 96…99%, также происходит заметное снижение концентрации сульфида натрия. Например, в пробе 5, при температурном режиме 65 С, снижение концентрации сульфида натрия произошло более чем на 60%. [c.63]
В большинстве соединений бор проявляет степень окисления +3 (борный ангидрид В2О3, тетраборат натрия, бура N826467, борная кислота НзВОз, нитрид бора BN). [c.326]
Ш,елочная абсорбция оксидов азота. Целесообразна при санитарной очиси е газов от оксидов азота при степени окисления бJH lзкoй к 50%- В качестве абсорбентов можно иримепять рас-твор1,1 соды, известкового молока, едкого натра. [c.67]
Здесь наблюдается постепенный переход ог типично основных оксидов натрия и магния к амфотерным, или промежуточным (алюминия), и к кислотным оксидам фосфора, серы и хлора. Этот пе-ре.ход сопровождается понышепием окислительного числа эле.мен-тов, образующих оксиды. То же наблюдается у оксидов одного и того же элемента в разных степенях окисления. Так, например, в ряду [c.126]
Эта реакция, как всякая гетерогенная реакция, протекает в несколько стадий. В ходе одной из них атомы натрия превращаются в положительно заряженные ионы степень окисления натрия изменяется от О до -fl [c.262]
Металлы, как правило, не бывают окислителями. Но примеры того, что они все же могут присоединять электроны, имеются. Натрий хорошо растворяется в жидком аммиаке. Эти растворы содержат как атомы, так и ионы натрия На , На, На» «. В комплексных соединениях — карбонилах На2 [Сг(С0)5] Наг [Ме(СО)4], где Ме = Ре, Со, НЬ, КЬ, — -элементы имеют отрицательные степени окисления -2. Известны комплексные соединения, где отрицательные степени окисления проявляют другие -элементы Т1, V, Мп, Н1, а также щелочные элементы. [c.319]
При осторожном окислении аммиака гипохлоритом натрия степень окисления азота изменяется от —3 до —2, и основным продуктом реакции является гидразин N2h5 [c.171]
Была изучена также стойкость порошка rjSg против окисления в токе кислорода в интервале температур 500—1100° С [292, с. 844]. Навеску сульфида в лодочке помещали в трубку, находящуюся в печи при заданной температуре, и пропускали непрерывный ток кислорода. Выделяющийся сернистый газ поглощали 3%-ным раствором Н Оз, образовавшуюся HjSO оттитровывали раствором едкого натра. Степень окисления оценивали по количеству выделившегося SOj. При 500—600° С СГаЗз окисляется лишь незначительно, интенсивное окисление начинается при 700° С, при более высоких температурах (900—1000° С) происходит полное окисление до окиси хрома rjOg. [c.146]
Мазпаиня солей составляют из названия аниона кислоты в именительном падеже и названия катиона в родительном падеже (.хлорид натрия, сульфат меди п т. п.), При этом название аниона производят от корня латинского наименования кислотообразующего элемента. Степень окисленности металла, образующего катнон, указывают, если это необходимо, римскими цифрами в скобках. [c.35]
Названия комплексных соединений образуются аналогично названиям обычных солей (Na l — хлорид натрия, K2SO4 — сульфат калия и т. п.) с той лишь разницей, что указываются лиганды и степень окисления центрального иона. Молекулы Н2О и Nh4 обозначаются соответственно аква и аммин . Вот несколько примеров, иллюстрирующих номенклатуру комплексов [c.118]
Запись данных опыта. Написать уравнения протекающих реакций, учитывая, что бром окисляет тиосульфат до сульфата, при этом в реакции участвует вода. (Выделяющаяся сера является продуктом побочной реакции.) Иод окисляет тиосульфат до тетра-тионата Na2S40e. В какую степень окисления переходит при этом бром и иод Может ли хлорная вода окислить тиосульфат натрия Ответ мотивировать. [c.144]
Диспропорционирование — это особый случай окислительно-восстановительной реакции, в ходе которой происходит переход одного и того же вещества средней степени окисления на более низкую и более высокую степень окисления. Вещество как бы само себя окисляет и восстанавливает. Это явление называют также редокс-амфотерностью. Реакции такого типа часто встречаются в химии галогенов. Например, при растворенг1И иода в растворе едкого натра молекулы иода сначала диспро-порционируют на гипоиодид- и иодид-ионы. Нестабильный ги-поиодид быстро диспропорционирует с образованием иодида и иодата [c.418]
Тиосульфат натрия Na2S20.з содержит один атом серы формально в степени окисления +6, а другой — в степени — 2 [c.115]
Исследование влияния температурного режима на процесс акустической регенерации, проводились на модельной смеси водно-щелочного раствора, с начальными концентрациями 0,0387 моль/л — меркаптида натрия и 593 мг/л-сульфида натрия. Продолжительность акустической обработки (180с.) при которой достигается максимальная степень окисления. [c.70]
В кислой среде в ионное уравнение реакции могут быть включены молекулы воды и ионы водорода, в щелочной — молекулы воды и гидроксильные ионы. В нейтральной среде в левую часть уравнения кроме окислителя и восстановителя могут входить только молекулы воды, а в результате реакции могут получаться как ионы Н+, так и ионы 0Н . Разберем электронно-ионную схему на примере окисления сульфита натрия перманганатом калия в различных средах. Сульфит натрия окисляется до сульфата Ыа2804, а КМПО4 восстанавливается до различных степеней окисления в зависимости от pH. [c.130]
При взаимодействии ванадатов с натрием в расплаве образуются также ионы ванадия (Н1). Восстановление водородом в момент образования (при действии цинка на раствор ванадата, слабоподкисленный серной кислотой) заканчивается образованием фиолетового иона ванадия(II) [У(Н20ер+, чувствительного к действию кислорода воздуха. Переходы между отдельными степенями окисления легко различимы по изменению окраски раствора. Соли ва-надия(П) — сильные восстановители [c.613]
Для окончательного суждения о проявлении восстановительных или окислительных свойств серы в различных степенях окислени-я провести следуюш,ий опыт. Поместить в пробирку микрошпатель кристаллов сульфита натрия, прибавить 5—6 капель 2 н. раствора серной кислоты и после полного растворения кристаллов пропустить через прозрачный раствор струю сероводорода до выпадения серы (опыт проводить в вытяжном шкафу). Написать уравнение взаимодействия сернистого газа, образовавшегося при растворении сульфита натрия в серной кислоте, с сероводородом. [c.98]
Запись данных опыта. Описать наблюдаемые явления. Написать уравнения реакций получения полисульфида натрия NaJSa и его разрушения в кислой среде (реакцию диспропорционирования), учитывая, что сера в степени окисления I переходит в 8 и 5 «-ион. [c.141]
Выполнение работы. В пробирку внохти I микрошпатель порошка PbgOi, добавить 5—6 капель 2 н. раствора азотной кислоты и нагреть маленьким пламенем горелки. Отметить изменение цвета осадка. Какое это вещество Написать его формулу. Какая степень окисления свинца в этом соединении Дать раствору отстояться, после чего несколько капель раствора перенести пипеткой в чистую пробирку и подействовать на него раствором сульфата натрия. На присутствие какого нона указывает образование белого осадка Какое это вещество - [c.179]
РЬд04 С азотной кислотой и полученного в растворе соединения свинца с сульфатом натрия. Выразить формулу РЬз04 в виде двух оксидов свинца, соответствующих степеней окисления. [c.180]
Названия оснований строятся из слова гидроксид и названия металла. Если металл не имеет постоянной валентности, то в скобках указывают значение степени окисления (валентности), проявляемое в этом соединении. Например гидроксид цинка Zn(OH)j (читается цинк о аш дважды ), гидроксид натрия NaOH (читается натрии о аш ), гидроксид алюминия А1(0Н) (читается алюминий о аш 1 рижды ), гидроксид железа (II) Fe(OH)j (читается фер-рум о аш дважды ) и гидроксид железа (III) Ре(ОН)з (читается фер-рум (I аш 1рижды ). [c.12]
Металлы проявляют в своих соединениях обычно положительную степегп окисления, и низшая их степень окисления равна нулю. Иначе говоря, низшей степенью окисления они обладают только в свободном состоянии . Действительно, все свободные металлы способны, хотя и в различной степени, проявлять восстановительные свойства. На практике в качестве восстановителей применяют алюминий, магний, натрий, ка.дий, цинк и некоторые другие металлы. Если металлу присущи несколько степеней окисления, то те его соединения, в которых он проявляет низшую из них, также обычно являются восстановителями, например, соединения железа (И), олова(П), хрома (II), меди(1). [c.266]
Валентность химических элементов. Степень окисления химических элементов – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
1) HPO3
2) H3PO3
3) Li3P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO3
2) H3PO3
3) Li3PO4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO2
2) N2O4
3) N2O
4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH3
2) N2H4
3) N2O5
4) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO3
2) SO2
3) SCl2
4) H2SO4
6. В каком соединении степень окисления серы равна +6?
1) Na2SO3
2) SO3
3) SCl2
4) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3P
4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3PO4
4) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3
2) –3, +5
3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор
Ответы
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Степень окисления — Общая и неорганическая химия
Характерным признаком окислительно-восстановительных реакций является изменение степеней окисления элементов.Поскольку такое предположение является условным, следовательно и степень окисления — величина формальная, не отражающая реальных соотношений зарядов атомов в молекуле, однако это понятие применяется в некоторых логических построениях (классификация соединений, вычисление коэффициентов в уравнениях и т. д.).Степень окисления является характеристикой состояния атома в веществе. Она численно равна заряду на атоме в сложном веществе при условии смещения всех общих электронных пар к атомам более электроотрицательных элементов, т. е. степень окисления рассчитывается из предположения, что все ковалентные связи стали ионными.
Остановимся на правилах определения степеней окисления атомов в различных веществах. Степень окисления атомов в простых веществах равна 0. В составе сложных веществ натрий, калий и другие щелочные металлы имеют постоянную степень окисления +1, металлы IIA группы (от бериллия до радия) +2, такую же степень окисления имеют кадмий и цинк, алюминий в соединениях всегда имеет степень окисления +3. Фтор как наиболее электроотрицательный элемент в соединениях имеет степень окисления только -I.
Многие элементы имеют переменные степени окисления в сложных веществах. Кислород в большинстве соединений имеет степень окисления -2. Только в соединениях с фтором степень окисления кислорода может быть положительной. Степень окисления кислорода -I характерна для пероксидов. Пероксиды содержат связь -О-О-, например H2O2 (пероксид водорода), Na2O2 (пероксид натрия), BaO2 (пероксид бария).
Водород в соединениях с металлами имеет степень окисления -1 (гидрид натрия NaH, гидрид кальция CaH2 и др). В соединениях с неметаллами степень окисления водорода равна +1.
Таким образом, в большинстве соединений (оксиды, кислоты, основания, средние соли, кислые соли, основные соли) степень окисления кислорода равна -2, а водорода +1.
У неметаллов (кроме фтора и кислорода) максимальная степень окисления равна номеру группы: у углерода и кремния +4, у азота, фосфора, а также остальных элементов VA группы — +5, у серы, селена и теллура — +6, у хлора, брома и иода — +7. Минимальная степень окисления всех неметаллов в соединениях равна разности между 8 и номером группы со знаком минус: у углерода и кремния -4, у элементов VA группы -3, у кислорода, серы, селена и теллура -2, у галогенов -1.
Железо в большинстве соединений имеет степень окисления +2 и +3, медь +1 и +2, хром +2, +3 и +6, марганец +2, +4, +6 и +7. Серебро преимущественно в соединениях имеет степень окисления +1.
Молекулы и формульные единицы веществ ионного строения электронейтральны.
В бинарных соединениях ионного строения степень окисления атома равна по знаку и величине заряду иона, например в бромиде бария BaBr2 степень окисления бария равна +2, а брома — -1.
В бинарных соединениях молекулярного строения степень окисления более электроотрицательного атома считается отрицательной, а менее электроотрицательного атома — положительной. Например, в аммиаке степень окисления азота равна -3, а во фториде азота — +3.
В более сложных случаях степень окисления рассчитывается на основании электронейтральности формульных единиц и известных степеней окисления.
Примеры
Пример 1. Вычислить степень окисления железа в соединениях: а) Fe(OH)Cl2; б) Na2FeO4.
Решение. Примем в обоих случаях степень окисления железа за х. В Fe(OH)Cl2 ион железа связан с гидроксид-ионом и хлорид-ионами. Степени окисления кислорода, водорода и хлора равны -2, +1 и -1, соответственно. Тогда с учетом электронейтральности формульной единицы
х + (-2) + I + 2(-1) = О,
откуда х = +3.
Для Na2FeO4 уравнение выглядит так:2(+1) + х + 4(-2) = О,
откуда х = +6.
Список использованной литературы
- Попков В. А., Пузаков С. А. Общая химия: учебник. — М.: ГЭОТАР-Медия, 2010. — 976 с.: ISBN 978-5-9704-1570-2. [с. 92-93]
Степени окисления элементов | АЛХИМИК
Степень окисления является важной характеристикой состояния атома в молекуле.
В соединениях с ионной связью степени окисления элементов равны зарядам ионов. Например:
Na+1Cl-1 Степень окисления натрия = +1
Степень окисления хлора = —1
Ca+2F2-1 Степень окисления кальция = +2
Степень окисления фтора = —1
Mg+2O-2 Степень окисления магния = +2
Степень окисления кислорода = -2
В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степени окисления элементов равны нулю.
Например: Н20, Cl20; O20 , F20, Si0 , C0 , S0…
В соединениях с ковалентной полярной связью степень окисления элемента — это условный заряд его атома в молекуле, если считать, что молекула состоит из ионов, т. е. рассматривать ковалентные полярные связи как ионные связи. При этом считают, что общие электронные пары полностью переходят к атомам элементов с большей ЭО.
Например, в молекуле хлороводорода HCl ковалентная полярная связь Н : Cl. Если общая электронная пара полностью перейдет к атому хлора (ЭОСl > ЭОН), то связь станет ионной. На атоме Н появится заряд +1, на атоме хлора будет заряд —1. Следовательно, степени окисления атомов в молекуле равны: Н+1Cl-1. (Степени окисления записывают над символами элементов.)
Любая молекула является электронейтральной, поэтому алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю.
Некоторые элементы во всех сложных веществах имеют постоянную степень окисления:
Элементы с постоянной степенью окисления Степень окисления
а) Щелочные металлы (Li, Na, K, Rb, Cs) +1
б) Элементы II группы (кроме Hg): Be, Mg, Ca, +2
Sr, Ba, Zn, Cd
в) Алюминий Al +3
г) Фтор F — 1
Водород и кислород в большинстве сложных веществ имеют постоянные степени окисления, но есть исключения:
Все другие элементы в различных соединениях имеют разные степени окисления, т.е. являются элементами с переменной степенью окисления.
Например, определим степени окисления углерода в различных соединениях. Одновременно напишем графические формулы этих соединений, чтобы показать валентность углерода.
Вы видите, что степень окисления углерода изменяется от – 4 до +4, а валентность углерода во всех соединениях равна IV.
Степени окисления могут иметь и дробные значения. Например:
Необходимо знать, что:
1.Металлы во всех сложных соединениях имеют только положительные степени окисления.
2.Неметаллы могут иметь и положительные, и отрицательные степени окисления. В соединениях с металлами и водородом степени окисления неметаллов всегда отрицательные.
З. Высшая (максимальная) степень окисления элемента, как правило, равна номеру группы, в которой находится элемент в периодической системе.
4.Низшая (минимальная) степень окисления металлов равна нулю. Низшая степень окисления неметаллов обычно равна: — (8 — номер группы, в которой находится элемент).
5.Значения степеней окисления элемента между высшей и низшей степенями окисления называются промежуточными.
Например, элемент-неметалл азот (V группа) может иметь следующие степени окисления:
ПохожееСтепени окисления переходных металлов
Степень окисления элемента связана с количеством электронов, которые атом теряет, получает или использует при соединении с другим атомом в соединениях. Он также определяет способность атома окислять (терять электроны) или восстанавливать (приобретать электроны) другие атомы или частицы. Почти все переходные металлы имеют несколько потенциальных степеней окисления.
Введение
Окисление приводит к увеличению степени окисления.Восстановление приводит к снижению степени окисления. Если атом восстановлен, он имеет большее количество электронов валентной оболочки и, следовательно, более высокую степень окисления и является сильным окислителем. Например, кислород (O) и фтор (F) — очень сильные окислители. С другой стороны, литий (Li) и натрий (Na) — невероятно сильные восстановители (любят окисляться), а это означает, что они легко теряют электроны. В этом модуле мы подробно рассмотрим степени окисления переходных металлов.
неспаренные электроны d-орбиталей
Чтобы полностью понять явления состояний окисления переходных металлов, мы должны понять, как связаны неспаренные d-орбитальные электроны.В многообразии d подоболочки пять орбиталей. По мере увеличения количества неспаренных валентных электронов d-орбиталь увеличивается, наивысшая степень окисления увеличивается. Это связано с тем, что неспаренные валентные электроны нестабильны и стремятся связываться с другими химическими соединениями. Это означает, что степени окисления будут самыми высокими в самой середине периодов переходных металлов из-за присутствия наибольшего количества неспаренных валентных электронов. Чтобы определить степень окисления, неспаренные d-орбитальные электроны добавляются к 2s-орбитальным электронам, поскольку 3d-орбиталь расположена перед 4s-орбиталью в периодической таблице.
Например: у скандия один неспаренный электрон на d-орбитали. Он добавлен к 2 электронам s-орбитали и, следовательно, степень окисления +3. Математически это будет выглядеть так: 1 электрон + 1 электрон + 1 электрон = 3 всего электрона = степень окисления +3. Формула для определения степени окисления будет ( за исключением меди и хрома ):
Наивысшее состояние окисления переходного металла = количество неспаренных d-электронов + два s-орбитальных электрона
Число d-электронов варьируется от 1 (в Sc) до 10 (в Cu и Zn).См. Периодическую таблицу ниже:
На изображении выше область в синем прямоугольнике — это блок d, также известный как переходные металлы.
Скандий — один из двух элементов в первом периоде переходного металла, который имеет только одну степень окисления (цинк — другую, со степенью окисления +2). Все остальные элементы имеют по крайней мере две разные степени окисления. Марганец, который находится в середине периода, имеет наибольшее количество степеней окисления и, действительно, самую высокую степень окисления за весь период, поскольку он имеет пять неспаренных электронов (см. Таблицу ниже).
Ранее упоминалось, что и медь, и хром не подчиняются общей формуле для степеней окисления переходных металлов. Это связано с тем, что медь имеет 9 d-электронов, которые производят 4 спаренных d-электрона и 1 неспаренный d-электрон. Поскольку у меди всего на 1 электрон меньше полной d-орбитали, она крадет электрон с s-орбитали, позволяя иметь 10 d-электронов. Точно так же хром имеет 4 d-электрона, и только 1 не имеет полузаполненной d-орбитали, поэтому он крадет электрон с s-орбитали, позволяя хрому иметь 5 d-электронов.
Правила о переходных металлах
- Свободные элементы (элементы, которые не объединены с другими элементами) имеют нулевую степень окисления, например, степень окисления Cr (хрома) равна 0.
- Для ионов степень окисления равна заряду иона, например, ион Fe 3 + (ион трехвалентного железа) имеет степень окисления +3.
- Степень окисления нейтрального соединения равна нулю, например, какова степень окисления Fe в FeCl 3 ?
- Ответ: Cl имеет степень окисления -1.Поскольку имеется 3 атома Cl, отрицательный заряд равен -3. Поскольку у FeCl3 нет общего заряда, соединение имеет нейтральный заряд, и, следовательно, степень окисления Fe +3.
Другими словами, это: Fe 3 + и 3Cl — , что составляет FeCl 3 с нейтральным зарядом.
Состояния множественного окисления
Как указано выше, большинство переходных металлов имеют несколько степеней окисления, поскольку переходные металлы относительно легко теряют электрон (ы) по сравнению с щелочными металлами и щелочноземельными металлами.Щелочные металлы имеют один электрон на своей валентной s-орбитали, и поэтому их степень окисления почти всегда равна +1 (из-за его потери), а у щелочноземельных металлов есть два электрона на своей валентной орбитали, в результате чего степень окисления +2 (из-за потери обе). Это не относится к переходным металлам, поскольку переходные металлы имеют 5 d-орбиталей. D-орбиталь имеет множество степеней окисления. S-орбиталь также способствует определению степени окисления.
Пример \ (\ PageIndex {1} \)
Железо имеет 4 неспаренных электрона и 2 спаренных электрона.Чтобы найти одну из его степеней окисления, мы можем использовать формулу:
Степень окисления Fe = 4 + 2 = +6
Действительно, +6 — одна из степеней окисления железа, но встречается очень редко. Другие возможные степени окисления железа включают: +5, +4, +3 и +2.
Поскольку в формуле есть много исключений, было бы лучше просто запомнить степени окисления для переходных металлов четвертого периода, поскольку они используются чаще. Вот диаграмма, которая показывает наиболее распространенные степени окисления переходных металлов первого ряда.См. Таблицу в этом модуле для получения дополнительной информации о наиболее распространенных степенях окисления.
Исключения для хрома и меди
Хром и медь имеют 4s 1 вместо 4s 2 . Это связано с тем, что у хрома на 1 d-электрон меньше, чем у наполовину заполненной d-орбитали, поэтому он берет единицу с s-орбитали, поэтому электронная конфигурация для хрома будет просто такой: [Ar] 4s 1 3d 5 . Точно так же для меди это сокращение на 1 d-электрон для наличия полностью заполненной d-орбитали и занимает единицу с s-орбитали, поэтому конфигурация электронов для меди будет просто: [Ar] 4s 1 3d 10 .
Чтобы помнить о стабильности более высоких степеней окисления переходных металлов, важно знать тенденцию: стабильность более высоких степеней окисления постепенно увеличивается вниз по группе. Например, в группе 6 (хром) Cr наиболее стабилен в степени окисления +3, а это означает, что вы не найдете много стабильных форм Cr в степенях окисления +4 и +5. Напротив, существует много стабильных форм молибдена (Mo) и вольфрама (W) в степенях окисления +4 и +5.
Состояние окисления переходных металлов в соединениях
Если дать ионное соединение, такое как AgCl, вы можете легко определить степень окисления переходного металла.В этом случае вас попросят определить степень окисления серебра (Ag). Поскольку мы знаем, что хлор (Cl) находится в группе галогенов периодической таблицы Менделеева, мы знаем, что он имеет заряд -1, или просто Cl —. Кроме того, увидев, что нет общего заряда для AgCl (который определяется, глядя на верхний правый угол соединения, т. Е. AgCl # , где # представляет общий заряд соединения), мы можем заключить, что серебро (Ag) имеет степень окисления +1.Это дает нам Ag + и Cl —, в которых положительный и отрицательный заряд нейтрализуют друг друга, что приводит к общему нейтральному заряду; поэтому +1 подтверждается как степень окисления серебра (Ag).
Пример \ (\ PageIndex {2} \)
Определите степень окисления кобальта (Co) в CoBr 2 .
Решение
Подобно хлору, бром (Br) также находится в группе галогенов, поэтому мы знаем, что он имеет заряд -1 (Br — ).Поскольку есть два брома, анион (бром) дает нам заряд -2. Кроме того, мы знаем, что CoBr 2 имеет общий нейтральный заряд, поэтому мы можем сделать вывод, что катион (кобальт) Co должен иметь степень окисления +2, чтобы нейтрализовать заряд -2 от двух бромов. С учетом сказанного мы получаем Co 2 + и 2Br —, в результате чего получаем CoBr 2 .
Пример \ (\ PageIndex {3} \)
Какова степень окисления цинка (Zn) в ZnCO 3 .(Примечание: CO 3 в этом примере имеет степень окисления -2, CO 3 2 — )
Решение
Зная, что CO 3 имеет степень окисления -2, и зная, что общий заряд этого соединения нейтрален, мы можем заключить, что цинк (Zn) имеет степень окисления +2. — \).
Этот пример также показывает, что атомы марганца могут иметь степень окисления +7, которая является наивысшей возможной степенью окисления для переходных металлов четвертого периода.
Примеры из реального мира
Магниты используются в электродвигателях и генераторах, которые позволяют нам иметь компьютеры, свет, телефоны, телевизоры и электрическое отопление. Магнетизм — это химическая функция, которая связана со степенью окисления. Степень окисления определяет, является ли элемент или соединение диамагнитным или парамагнитным.Диамагнитные вещества имеют только парные электроны и слабо отталкивают магнитные поля. Эти вещества немагнитны, например дерево, вода и некоторые пластмассы. Однако парамагнитные вещества становятся магнитными в присутствии магнитного поля. Парамагнитные вещества имеют по крайней мере один неспаренный электрон. Еще одна более сильная магнитная сила — это постоянный магнит, называемый ферромагнетиком. Они намного прочнее и не требуют наличия магнитного поля для отображения магнитных свойств. Это тот тип магнитов, который есть в вашем холодильнике.
Внешние ссылки
- Периодическая таблица: commons.wikimedia.org/wiki/File:Periodic_table.svg
- Ионные соединения: lac.smccme.edu/New%20PDF%20No…/Ionrules2.pdf (полезна страница 6)
- Список неорганических соединений: en.Wikipedia.org/wiki/List_of_inorganic_compounds
- ru.Wikipedia.org/wiki/Manganate
- http://www.chemicalelements.com/groups/transition.html
- http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch22/trans.php
- ru.Wikipedia.org/wiki/Metal_Oxidation_States#Variable_oxidation_states
- Муньос-Паес, Адела. «Оксиды переходных металлов: геометрические и электронные структуры: введение в темы твердого тела в курсах неорганической химии». J. Chem. Образование.1994, 71, 381.
Список литературы
- Петруччи, Ральф Х., Уильям С. Харвуд и Ф. Г. Херринг. Общая химия: принципы и современные приложения. 8-е изд. Нью-Джерси: Пирсон / Прентис Холл, 2002. Печать.
- Петруччи, Ральф Х., Уильям С. Харвуд, Ф. Г. Херринг и Джеффри Д. Мадура. Общие принципы химии и современные приложения. 9 изд. Верхняя Сэдл-Ривер, Нью-Джерси: Пирсон / Прентис Холл, 2007. Печать.
- Clentsmith, G. K., F. G. Cloke, et al. (2003). «Стабилизация комплексов ранних переходных металлов с низкой степенью окисления, несущих 1,2,4-трифосфациклопентадиенильные лиганды: структура [Sc (P3C2tBu2) 2] 2; Sc (II) или смешанная степень окисления?» Angew Chem Int Ed Engl 42 (9): 1038-41
Проблемы
Определите степень окисления переходных металлов, содержащихся в этих нейтральных соединениях.Примечание: переходный металл подчеркнут в следующих соединениях.
| (A) Медь (I) Хлорид: Cu Cl | (B) Медь (II) Нитрат: Cu (NO 3 ) 2 | (C) Золото (V) Фторид: Au F 5 |
| (D) Железо (II) Оксид: Fe O | (E) Железо (III) Оксид: Fe 2 O 3 | (F) Свинец (II) Хлорид: Pb Cl 2 |
| (G) Свинец (II) Нитраты: Pb (NO 3 ) 2 | (H) Марганец (II) Хлорид: Mn Cl 2 | (I) Молибден триоксид: Mo O 3 |
| (J) Никель (II) Гидроксид: Ni (OH) 2 | (K) Платина (IV) Хлорид: Pt Cl 4 | (L) Серебро Сульфид: Ag 2 S |
| (M) Вольфрам (VI) Фторид: W F 6 | (N) Ванадий (III) Нитрид: V N | (O) Цирконий Гидроксид: Zr (OH) 4 |
- Определите степень окисления переходного металла для общего ненейтрального соединения: манганат ( Mn O 4 2 — )
- Почему переходные металлы имеют большее количество степеней окисления, чем металлы основной группы (т.е.е. щелочные металлы и щелочноземельные металлы)?
- Какой переходный металл имеет наибольшее количество степеней окисления?
- Почему число степеней окисления переходных металлов увеличивается в середине группы?
- Какие два переходных металла имеют только одну степень окисления?
Решения
См. Вложение для решений. (Вам, вероятно, понадобится Adobe Reader, чтобы открыть файл PDF.)
Авторы и авторство
- Джослин Вуд, Лиза Чу (UCD)
Наиболее часто встречающиеся степени окисления неметаллов показаны в таблице ниже вместе с примерами. Наивысшая возможная положительная степень окисления атома — это заряд, который у него был бы, если бы он потерял все электроны в своем внешняя, неполная электронная оболочка. Таким образом, углерод и кремний имеют максимальную степень окисления +4, потому что они оба должны потерять по четыре электрона. Азот и фосфор имеют максимальное ПО +5, как в HNO3 и h4PO4.Сера имеет максимум +6, как и в h3SO4. Можно ожидать, что кислород будет вести себя так же, но кислород тоже маленький и слишком плотно удерживает свои внешние электроны. (Сравните первые энергии ионизации O и S на странице 9.) Неизвестно кислородных соединений, в которых кислород имеет такое высокое ВКЛ. как +6. Эффект размера, наблюдаемый при использовании кислорода, проявляется еще сильнее. до фтора. Хлор в HClO4 показывает ВКЛ. +7, ожидаемый максимум; но меньший атом фтора удерживает электроны очень плотно и не имеют соединений с положительным окислением заявляет | Наименьшая возможная отрицательная степень окисления атома — это заряд, который будет у иона, если он соберет достаточно электронов полностью заполнить его внешнюю оболочку и произвести электронную конфигурацию следующего более тяжелого благородного газа. Для F и Cl это означает минимум -1, как для HF и HCl; за O и S, -2 как в h30 и h3S; для N и P -3, как в Nh4 и Ph4; а для C и Si -4, как в Ch5 и Sih5. Два крайних максимума и минимума, плюс ON = 0, являются наиболее распространенные степени окисления для элементов, которые мы обсуждали так далеко. Промежуточные состояния встречаются реже и обычно возникают через определенные промежутки времени. из двух в ON, представляющих сдвиги пар электронов. Таким образом, сера имеет общие степени окисления -2, 0, +4 и +6; и
хлор показывает состояния -1, 0, +1, +3, +5 и +7. Хотя другие
это возможно. Например, ClO2,
где хлор имеет степень окисления +4, может образоваться, но
необычно. |
Степени окисления (степени окисления)
Использование степеней окисления для определения того, что было окислено, а что восстановлено
Это наиболее распространенное использование степеней окисления.
Помните:
Окисление связано с увеличением степени окисления
Восстановление включает снижение степени окисления
В каждом из следующих примеров мы должны решить, включает ли реакция окислительно-восстановительный потенциал, и если да, то что было окислено, а что восстановлено.
Пример 1:
Это реакция между магнием и соляной кислотой или газообразным хлороводородом:
Изменилась ли степень окисления чего-либо? Да, они есть — у вас есть два элемента, которые находятся в соединениях с одной стороны уравнения и как несоединенные элементы с другой.Чтобы быть уверенным, проверьте все степени окисления :.
Степень окисления магния увеличилась — он окислился. Степень окисления водорода упала — она уменьшилась. Хлор находится в одной и той же степени окисления по обе стороны уравнения — он не был окислен или восстановлен.
Пример 2:
Реакция между гидроксидом натрия и соляной кислотой:
Проверка всех степеней окисления:
Ничего не изменилось.Это не окислительно-восстановительная реакция.
Пример 3:
Это подлый! Реакция между хлором и разбавленным холодным раствором гидроксида натрия:
Очевидно, что хлор изменил степень окисления, потому что он попал в соединения, начиная с исходного элемента. Проверка всех степеней окисления показывает:
Хлор только , чтобы изменить степень окисления. Он был окислен или восстановлен? Да! Обе! Один атом был восстановлен, потому что его степень окисления упала.Другой был окислен.
Это хороший пример реакции диспропорционирования . Реакция диспропорционирования — это реакция, в которой одно вещество одновременно окисляется и восстанавливается.
Использование степеней окисления для определения окислителя и восстановителя
Это лишь незначительное дополнение к последнему разделу. Если вы знаете, что было окислено, а что восстановлено, вы можете легко определить, что такое окислитель и восстановитель.
Пример 1
Это реакция между ионами хрома (III) и металлическим цинком:
Степень окисления хрома изменилась с +3 до +2, и поэтому он был восстановлен. Цинк перешел от нулевой степени окисления в элементе до +2. Он был окислен.
Так что же происходит с уменьшением? Это цинк — цинк отдает электроны ионам хрома (III). Итак, цинк — это восстановитель.
Точно так же вы можете вычислить, что окислителем должны быть ионы хрома (III), потому что они отбирают электроны у цинка.
Пример 2
Это уравнение реакции между ионами манганата (VII) и ионами железа (II) в кислых условиях. Это прорабатывается далее на странице.
Если взглянуть быстро, становится очевидно, что ионы железа (II) окислены до ионов железа (III). Каждый из них потерял электрон, а их степень окисления увеличилась с +2 до +3.
Водород все еще находится в степени окисления +1 до и после реакции, но ионы манганата (VII) явно изменились.Если определить степень окисления марганца, то она упала с +7 до +2 — снижение.
Итак, ионы железа (II) окислены, а ионы манганата (VII) восстановлены.
Что восстановило ионы манганата (VII) — ясно, что это ионы железа (II). Железо — единственное, что имеет измененную степень окисления. Итак, ионы железа (II) являются восстановителем.
Точно так же ионы манганата (VII) должны быть окислителем.
Использование степеней окисления для определения реакционных соотношений
Это иногда полезно, когда вам нужно разработать пропорции реагирования для использования в реакциях титрования, когда у вас недостаточно информации для расчета полного ионного уравнения.
Помните, что каждый раз, когда степень окисления изменяется на одну единицу, переносится один электрон. Если степень окисления одного вещества в реакции падает на 2, это означает, что оно приобрело 2 электрона.
Что-то еще в реакции должно терять эти электроны. Любое понижение степени окисления одного вещества должно сопровождаться увеличением степени окисления другого вещества на такую же степень окисления.
Этот пример основан на информации из старого вопроса AQA уровня A.
Ионы, содержащие церий в степени окисления +4, являются окислителями. (Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2- ). При этом церий восстанавливается до степени окисления +3 (Ce 3+ ). Какие пропорции реагирования?
Степень окисления молибдена увеличивается на 4. Это означает, что степень окисления церия должна снизиться на 4 для компенсации.
Но степень окисления церия в каждом из его ионов падает только с +4 до +3, то есть на 1. Таким образом, очевидно, что на каждый ион молибдена должно приходиться 4 иона церия.
Реакционные пропорции: 4 церийсодержащих иона на 1 ион молибдена.
Или, если взять более общий пример, включающий ионы железа (II) и ионы манганата (VII). . .
Раствор манганата калия (VII), KMnO 4 , подкисленный разбавленной серной кислотой, окисляет ионы железа (II) до ионов железа (III).При этом ионы манганата (VII) восстанавливаются до ионов марганца (II). Используйте степени окисления, чтобы составить уравнение реакции.
Степень окисления марганца в ионе манганата (VII) +7. Название говорит вам об этом, но попробуйте еще раз просто для практики!
При переходе к ионам марганца (II) степень окисления марганца снизилась на 5. Каждый ион железа (II), который вступает в реакцию, увеличивает степень окисления на 1. Это означает, что должно быть пять ионов железа (II), реагирующих на каждый ион манганата (VII).
Следовательно, левая часть уравнения будет иметь вид: MnO 4 — + 5Fe 2+ +?
Правая часть будет: Mn 2+ + 5Fe 3+ +?
После этого вам придется гадать, как уравновесить оставшиеся атомы и заряды. В этом случае, например, весьма вероятно, что кислород попадет в воду. Это означает, что вам откуда-то нужен водород.
Это не проблема, потому что реакция протекает в растворе кислоты, поэтому водород вполне может происходить из ионов водорода.
В конечном итоге вы получите это:
Лично я предпочел бы выводить эти уравнения из электронных полууравнений!
Число окислений элементов в Периодической таблице
Некоторые элементы периодической таблицы имеют только одну степень окисления или две степени окисления. Но у некоторых есть большая степень окисления.Степень окисления элемента в соединении может быть положительной или отрицательной или может быть нулевой.
В соединениях натрия натрий образует только степень окисления +1.
Но некоторые типы атомов, такие как хлор, образуют различные степени окисления, такие как -1, 0, +1, +3, +5, +7 степени окисления в соединениях.
В этом руководстве мы обсуждаем некоторые важные факты о степенях окисления и степенях окисления в таблице периодок, включая s-блок, p-блок и d-блок.
Важные факты о степени окисления
В этой главе мы обсуждаем очень важные факты о степенях окисления на примерах с различными соединениями.
Окислительное число может быть положительным или отрицательным
- Мы знаем, что металла испускают электроны, образуя положительные ионы. Следовательно, металлы всегда образуют положительной степени окисления .
- Но неметаллы , такие как сера, фосфор, хлор, могут иметь как положительные числа окисления , так и отрицательные числа окисления .
Более одной степени окисления элемента
Некоторые элементы могут иметь более одной степени окисления. Специально d блочные элементы демонстрируют такое поведение.
Примеры более чем одной степени окисления элемента
- Хлор: -1, 0, +1, +3, +5, +7
- Марганец: 0, +2, +4, +7
Когда элемент не объединяется или не образует соединение
Когда элемент не объединился, его степень окисления равна 0.
Ex: степень окисления Au равна 0.
Когда элемент объединился с элементом того же типа.
Когда элемент объединяется с элементом того же типа, его степень окисления становится равной 0.
Ex: степень окисления Br в Br 2 составляет 0.
Степени окисления s-блока
- Все щелочные металлы показывают только степень окисления +1.
- Все щелочноземельные металлы показывают только степень окисления +2.
Обычно щелочные и щелочноземельные металлы выходят в виде соединений (NaCl, CaCO 3 ). Поэтому мы не можем рассматривать их как свободные элементы.
Степени окисления элементов p-блока
Некоторые элементы p-блока имеют много степеней окисления, такие как хлор (-1, 0, +1, +3, +5, +7) и сера (-2, 0, +4, +6). И некоторые из них имеют ограниченную степень окисления, например, фтор (-1).
Таблица Менделеева с числами окисления
Здесь мы собираемся объединить степени окисления всех элементов периодической таблицы в одну группу.
ПРИМЕЧАНИЕ: * обозначает редкое число окисления
| Атомный номер | Элемент | Число окисления |
|---|---|---|
| 1 | Водород | -1, 0, +1 |
| 2 | Гелий | 0 |
| 3 | Литий | +1 |
| 4 | Бериллий | +2 |
| 5 | Бор | +3 |
| 6 | Углерод | -4, -3, -2, -1, 0, +1, +2, +3, +4 |
| 7 | Азот | -5, -4, -3, -2, -1, 0, +1, +2, +3 |
| 8 | Кислород | -2, -1, 0, +1, +2 |
| 9 | Фтор | -1, 0 |
| 10 | Неон | 0 |
| 11 | Натрий | +1 |
| 12 | Магний | +2 |
| 13 | Алюминий | +3 |
| 14 | Кремний | 0, +4 |
| 15 | фосфор | 0, +1, +3, +5 |
| 16 | Сера | -2, 0, +2, +4, +6 |
| 17 | Хлор | -1, 0, +1, +3, +5, +7 |
| 18 | Аргон | 0 |
| 19 | Калий | +1 |
| 20 | Кальций | +2 |
с Блок
Изучены числа окисления элементов 1-й группы 2-й группы.
Водород
Водород образует три степени окисления: -1, 0, +1. Окислительное число 0 встречается только в молекуле водорода.
-1 степень окисления — Примеры
Когда водород образует соединения с металлами, степень окисления водорода равна -1. NaH и CaH 2 являются некоторыми примерами.
+1 степень окисления
Когда углерод образует соединения с неметаллическими элементами, степень окисления водорода в большинстве случаев становится +1.
- Метан: CH 4 — Электроотрицательность углерода выше, чем у водорода. Так водород окисляется и степень окисления +1.
Щелочные металлы — группа 1
Щелочные металлы (кроме водорода) удалить один электрон с образованием +1 иона. Так что только степень окисления щелочных металлов +1. Таким образом, литий, натрий, калий, рубидий и цезий имеют только единственную степень окисления +1.
Щелочноземельные металлы — группа 2
В качестве щелочных металлов, только щелочноземельные металлы образуют степень окисления +2. Бериллий, магний, кальций, стронций, барий имеют степень окисления +2.
п Блок
Группа 3
Группа трех элементов: бор, алюминий, галлеум, индий и таллий.
Бор
Алюминий (Алюминий)
Алюминий — это металл.Таким образом, он удаляет свои три электрона из последней оболочки, чтобы показать степень окисления +3. Немного примерами +3 степеней окисления алюминия являются AlCl 3 , Al 2 O 3 .
Группа 4
Углерод
Число окисления углерода изменяется от -4 до +4.
- -4: CH 4 — Метан
- -3: CH 3 CH 3 — Этан
- -2: CH 3 Класс
- -1: ClCH 2 CH 2 Cl
- 0: CH 2 Класс 2
- +1: CH 3 -CHO — Карбонильный углерод имеет степень окисления +1.
- +2: CHCl 3
- +3: CH 3 -COOH — Атом углерода карбоновой кислоты имеет степень окисления +3.
- +4: CCl 4 , CO 2
Группа 5
Группа 5 включает азот, фосфор, мышьяк, сурьму и висмут. Изменение числа окисления изменяется при спускаемся по группе.
Азот
Азот имеет различную степень окисления от -3 до +5.
фосфор
Фосфор также имеет различную степень окисления от -3 до +5.
- -3: Na 3 P, Ca 3 P 2 , PH 3
- -0: P 8 , P 4
- — + 1: H 3 PO 2
- +3: P 2 O 3 , H 3 PO 3
- +5: H 3 PO 4 , Na 3 PO 4 , P 2 O 5
Группа 6
Мы собираемся обсудить степень окисления кислорода и серы в элементах группы 6.
Кислород
Кислород имеет второе по величине электроотрицательное значение в периодической таблице. Поэтому в большинстве случаев окисление количество кислорода отрицательное. Кислород только положительный степени окисления при сочетании с фтором.
- +2: In F 2
- 0: Молекула кислорода (O 2 )
- -1: Примером для -1 степени окисления является перекись водорода (H 2 O 2 ).
- -2: Наиболее распространенная степень окисления кислорода -2. Na 2 O, MgO, H 2 O являются примерами -2 степень окисления кислорода.
Сера
Сера — это еще один элемент p-блока, который имеет разные степени окисления.
- -2: Na 2 S, H 2 S
- 0: S 8
- +4: SO 2 , H 2 SO 3
- +6: H 2 SO 4 , BaSO 4
Хлор
Хлор также имеет много степеней окисления.(от -1 до +7)
- -1: HCl, NaCl
- 0: Cl 2 газ
- +1: HOCl, NaClO
- +3: NaClO 2
- +5: NaClO 3
- +7: NaClO 4 , HClO 4
3d металлы
Большинство 3d-металлов имеют переменную степень окисления.Например, у железа есть две степени окисления: +2 и +3.
Цинк имеет только одну степень окисления +2.
3d-металлы с переменной степенью окисления
| 3d металл | Степень окисления |
|---|---|
| SC | +3 |
| Ti | +2, +3, + 4 |
| VA | +2, +3, +4, +5 |
| Cr | +2, +3, +6 |
| Mn | +2, +4, +6, +7 |
| Fe | +2, +3 |
| Co | 2, +3 |
| Ni | +2 |
| Cu | +1, +2 |
| Zn | +2 |
Число окисления и цвет соединения или раствора
Возьмем пример.
- FeCl2 — зеленый
- FeCl3 — коричневый
Почему хлор имеет более широкий диапазон степеней окисления, чем сера?
Сера и хлор и находятся в 6-й и 7-й группах периодической таблицы. Итак, есть шесть и семь электронов на их конечные уровни энергии соответственно. Эти электроны могут соединяться с кислородом с образованием различных соединений. Некоторые примеры обсуждаются ниже.
Сера отдает все свои последние шесть электронов на образование молекулы серной кислоты (степень окисления +6).Хлор может дать семь электронов, чтобы хлорная кислота показала степень окисления +7.
Хлор может использовать один электрон для образования хлорид-аниона (-1 степень окисления). Сера может занять два электрона для образования сульфид-аниона. (-2 степени окисления).
Обычные степени окисления серы
| Общее состояние окисления | Соединение примера |
|---|---|
| -2 | H 2 S |
| 0 | Элементарная сера (S 8 ) |
| +4 | СО 2 |
| +6 | SO 3 , H 2 SO 4 |
Общие степени окисления хлора
| Общее состояние окисления | Соединение примера |
|---|---|
| -1 | HCl |
| 0 | Класс 2 |
| +1 | HOCl |
| +3 | HClO 2 |
| +5 | HClO 3 |
| +7 | HClO 4 |
Степень окисления хлора в Ca (OCl)
2Заряд гипохлорит-иона OCl — составляет -1.Таким образом, мы можем рассчитать степень окисления хлора.
-2 + х = -1
х = +1
Степень окисления хлора в Ca (OCl) 2 равна +1.
Не путайте со степенью окисления и зарядом иона
Окислительное число и заряд иона не всегда равны.
- Na + степень окисления иона (+1) и заряд иона (+1) одинаковы.
- Cl — степень окисления иона иона одинаковы.
- Но в KMnO 4 степень окисления атома марганца +7. Но марганец не образовывал иона +7 в KMnO 4 .
- Хром не образует +6 ионов. Но в K 2 CrO 4 степень окисления хрома составляет +6.
в сульфиде кремния, какой элемент будет иметь отрицательную степень окисления?
Сульфид кремния (SiS 2 ) содержит атомы кремния и серы.Поскольку вы хотите найти отрицательную степень окисления, выясните, у какого элемента электроотрицательность больше?
Электроотрицательность серы 2,5, кремния 1,8. Следовательно, сера более электроотрицательна, чем кремний. Таким образом, сера должна иметь отрицательную степень окисления (-2).
Какие элементы имеют самую высокую степень окисления в периодической таблице?
Как металл, марганец имеет степень окисления +7. Некоторые примеры соединений для +7: перманганат калия (KMnO 4 ), Mn 2 O 7
Как неметалл, хлор образует степень окисления +7.HClO 4 , Cl 2 O 7 являются примерами степени окисления хлора +7.
Какой элемент всегда имеет нулевую или положительную степень окисления?
Фтор всегда имеет нулевую или положительную степень окисления, потому что фтор является наиболее электроотрицательный элемент в периодической таблице. Таким образом, он всегда получает электрон, когда фтор объединяется. с другим элементом с образованием -1 степени окисления.Форма фтора с нулевой степенью окисления в F 2 молекула.
В NaF и HF степень окисления фтора равна -1.
Приведите пример реакции, чтобы хлор стал положительным числом окисления после реакции?
Газообразный хлор (степень окисления 0) реагирует с холодным разбавленным NaOH или горячим концентрированным NaOH с образованием +1 и +5 степеней окисления атома хлора соответственно.
s блочные элементы имеют ли они переменную степень окисления
Только водород показывает переменную степень окисления.Все остальные элементы имеют единую степень окисления. Элементы группы 1 показывают степень окисления +1, а элементы группы 2 показывают степень окисления +2.
Какова максимальная степень окисления у блочных элементов p?
Элементы VII группы имеют наивысшую степень окисления. Из группы VII форма хлора +7.
Какие элементы имеют степень окисления +7, и примеры?
И марганец, и хлор имеют степень окисления +7.В перманганате калия (KMnO 4 ) и HMnO 4 степень окисления марганца +7. Хлор образует хлорноватую кислоту (HClO 4 ) с степенью окисления +7.
Степень окисления и кислотность
Когда степень окисления увеличивается, кислотность также увеличивается. Учитывайте кислотность разные оксиды азота.
N 2 O и NO — нейтральные кислые газы и другие оксиды азота (N 2 O 3 , NO 2 , N 2 O 4 и N 2 O 5 ) являются кислыми.N 2 O 5 — сильнокислотное соединение.
Связанные руководства
Окислительное число— Материалы исследования для IIT JEE
Когда элемент окисляется, он должен действовать как восстановитель и, следовательно, теряет электроны; при уменьшении он получает электроны.Степень окисления или степень окисления элемента — это количество электронов, которые он мог бы считать потерянными или приобретенными.
Всем элементам в элементарном несоединенном состоянии присваивается нулевая степень окисления. Когда натрий, например, окисляется, он теряет один электрон, и говорят, что ион Na + имеет степень окисления +1. Точно так же ионы Cu 2+ и Al 3+ имеют степени окисления +2 и +3, в то время как F — и O 2- имеют степени окисления -1 и -2.Для простых ионов степень окисления равна ионному заряду, например
Степень окисления элемента в ковалентном соединении определяется при принятии степени окисления равной заряду, который элемент несёт, если бы все связи в соединении считались ионными, а не ковалентными. При этом общая пара или электроны между двумя атомами назначается атому с большей электроотрицательностью. Или, если два атома похожи, общая пара разделяется между ними, и каждому атому назначается один электрон.Результирующие заряды на различных атомах при таком назначении связывающих электронов представляют собой степени окисления атомов.
Сумма степеней окисления всех атомов незаряженного соединения равна нулю. В случае иона алгебраическая сумма степеней окисления всех атомов равна заряду иона
.
NH 4 + | ОН — | СО 4 2- | AlF 6 3- | ||||
N | H | O | H | S | O | Al | Fe |
-3 | +1 | -2 | +1 | +6 | -2 | +3 | –1 |
Степень окисления любого элемента в его элементарном состоянии равна нулю.
Фтор — наиболее электроотрицательный элемент. Его степень окисления всегда -1.
Кислород после фтора является вторым по величине электроотрицательным элементом. Он показывает степень окисления -2 почти во всех соединениях, кроме сероксидов и супероксидов,
MgO | Fe 2 O 3 | К О 2 | Mn 2 O 7 | CrO 3 | |||||
мг | O | Fe | O | С | O | млн | O | Cr | O |
+2 | -2 | +3 | -2 | +4 | -2 | +7 | -2 | +6 | -2 |
В пероксидах (O 2 — ) кислород имеет степень окисления –1; в супероксидах (O 2 2– ) кислород имеет степень окисления -1/2; а в OF 2 кислород имеет степень окисления +2.
степень окисления в ионе пероксида, вычисляемая путем равного разделения общей пары между двумя атомами кислорода
HCl | H 2 O | NH 3 | LiH | CaH 2 | |||||
H | Класс | H | O | N | H | Ли | H | Ca | H |
+1 | –1 | +1 | -2 | -3 | +1 | +1 | –1 | +2 | –1 |
H 2 SO 3 | KMnO 4 | К 2 Cr 2 O 7 | KClO 4 | ||||||||
H | S | O | К | Mn | O | К | Cr | O | К | Класс | O |
+1 | +4 | -2 | +1 | +7 | -2 | +1 | +6 | -2 | +1 | +7 | -2 |
Когда элемент окисляется, его степень окисления увеличивается, в то время как восстановление любого элемента снижает его степень окисления.Изменение степени окисления можно использовать для определения того, произошло ли окисление или восстановление. При замене хлорметана на дихлорметан, например,
C H 3 Cl C H 2 Cl 2
-2 +1 -1 0 +1 -1
Степень окисления углерода увеличивается с -2 до 0. Следовательно, углерод окисляется.
Окислитель | Фактическое изменение | Снижение окислительного числа |
KMnO 4 в растворе кислоты | MnO 4 — → Mn 2+ | 5 |
KMnO 4 в щелочном растворе | MnO 4 — → MnO 2 | 3 |
K 2 Cr 2 O 7 в растворе кислоты | Cr 2 O 7 2- → Cr 3+ | 3 |
разбавленная HNO 3 | НЕТ 3 — → НЕТ | 3 |
HNO концентрированная 3 | НЕТ 3 — → НЕТ 2 | 1 |
концентрированный H 2 SO 4 | СО 4 2- → СО 2 | 2 |
оксид марганца (IV) | MnO 2 → Mn 2+ | 2 |
хлор | Cl → Класс — | 1 |
хлорная (I) кислота | ClO — → Cl — | 2 |
KlO 3 в разбавленной кислоте | IO 3 — → I | 5 |
KlO 3 в концентрированной кислоте | IO 3 — → I — | 4 |
Восстановитель | Фактическое изменение | Увеличение числа окисления |
соли железа (II) (кислота) | Fe 2+ → Fe 3+ | 1 |
соли олова (II) (кислота) ` | Sn 2+ → Sn 4+ | 2 |
этандиоаты (кислоты) | C 2 O 4 2- → CO 2 | 1 |
сульфиты (кислоты) | SO 3 2- → SO 4 2- | 2 |
сероводород | S 2- → S | 2 |
йодиды (разбавленная кислота) | Я — → Я | 1 |
йодиды (кислота концентрированная) | Я — → Я + | 2 |
металлов, эл.грамм. Zn | Zn → Zn 2+ | 2 |
водород | ч → ч + | 1 |
Пример |
Вопрос: Какая степень окисления Mn составляет KMnO 4 ? Решение: Пусть степень окисления Mn в KMnO 4 равна x. Мы знаем, что Окислительное число K = +1 Окислительное число = –2 (число окисления K) + (число окисления Mn) +4 (число окисления O) = 0 (+1) + (х) +4 (-2) = 0 или x = +7 |
Состояние окисления как периодическое свойство
Состояние окисления атома зависит от электронной конфигурации атома, периодического свойства.
Группа IA или щелочные металлы показывают степень окисления +1.
II Группа A или щелочноземельные металлы показывают степень окисления +2
Максимальная нормальная степень окисления, показанная элементами группы III A, равна +3. Эти элементы также показывают степень окисления от +2 до +1.
Элементы группы IV A показывают их макс. и мин. степени окисления +4 и -4 соответственно.
Неметаллы показывают количество степеней окисления, соотношение между макс. и мини. Степень окисления для неметаллов равна максимальной степени окисления — минимальная степень окисления = 8
Например, S имеет максимальную степень окисления +6 как элемент VI Agroup.- Максимальная степень окисления элемента равна номеру группы — 8
I Элементы группы всегда показывают +1 степень окисления.
Элементы II группы всегда показывают степень окисления +2.
Элементы III группы всегда показывают степень окисления +3.
Элементы IV группы показывают степень окисления от -4 до +4.
- Элементы группы
V показывают степень окисления от -3 до +5.
Элементы VI группы показывают степень окисления от -2 до +6.
Элементы VII группы имеют степень окисления от -1 до +7.
Инертные газы имеют нулевую степень окисления.
Применение состояния окисления
Для сравнения силы кислоты и щелочи
Для определения окислительно-восстановительной природы
Группа | Диапазон степени окисления |
IA | +1 |
IIA | +2 |
IIIA | + 1, + 3 |
IVA | -4 до +4 |
ВА | -3 до +5 |
ЧЕРЕЗ | от -2 до +6 [Исключение → Максимальная степень окисления O составляет 2] |
VIIA | от -1 до +7 [Исключение → Число окисления F равно -1] |
Если какое-либо соединение находится в максимальной степени окисления, оно действует только как окислитель.
Если какое-либо соединение находится в минимальной степени окисления, оно действует только как восстановитель.
Если степень окисления промежуточная, соединение может действовать как восстановитель, так и окислитель.
Для определения молекулярной формулы любого соединения
Предположим, что есть три атома A, B, C и их степень окисления 6, -1, -2 соответственно. Тогда молекулярная формула соединения, образованного ими, будет AB 4 C, потому что
+6 = (-14) + (- 2)
или +6 = -6
Посмотрите это видео, чтобы получить дополнительную информацию
Степень окисления V / S Валентность
Состояние окисления | Валентность |
Он представляет собой количество электронов, которые атом элемента, по-видимому, получил или потерял, находясь в комбинированном состоянии. | Это количество атомов водорода или хлора или удвоенное количество атомов кислорода, которые соединяются с одним атомом элемента |
Степень окисления элемента может быть разной в разных соединениях. | Валентность элемента обычно остается неизменной. |
Степень окисления или степень окисления элемента может быть положительной, отрицательной или нулевой. | Валентность элемента может быть положительной или отрицательной. |
Степень окисления может иметь дробные значения | Валенви — это всегда целое число. |
| Сводка |
|
Вопрос 1: Степень окисления Mg в MgO составляет
а. -1
г. -2
с. +2
д. +1
Вопрос 2: Какие из следующих степеней окисления невозможны для O?
а. -1
г. -2
г. -1/2
г. +3/2
Вопрос 3: Степень окисления О в OF 2 составляет..
а. +2
г. -2
г. -1
г. +1
Вопрос 4: В случае нейтральных молекул алгебраическая сумма степени окисления всех атомов, присутствующих в молекуле, равна.
а. ноль
г. один
г. два
г. три
Связанные ресурсы
Чтобы узнать больше, купите учебные материалы по окислительно-восстановительным реакциям, включая примечания к исследованию, примечания к пересмотру, видеолекции, решенные вопросы за предыдущий год и т.Также поищите здесь дополнительные учебные материалы по химии.
хрома | Использование, свойства и факты
Хром (Cr) , химический элемент 6-й группы (VIb) периодической таблицы, твердый металл серо-стального цвета, который требует полировки и используется в сплавах для повышения прочности и коррозионной стойкости. Хром был открыт (1797) французским химиком Николя-Луи Вокленом и год спустя выделен как металл; он был назван в честь его разноцветных соединений.Зеленый цвет изумруда, змеевика и хромовой слюды, а также красный цвет рубина обусловлены небольшим количеством хрома. Название элемента хром (от греческого chrōmos , «цвет») означает ярко выраженную и разнообразную окраску соединений хрома.
хромСвойства хрома.
Британская энциклопедия, Inc.Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов.Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 24 | ||||||
|---|---|---|---|---|---|---|---|
| атомный вес | 51,9961 | ||||||
| точка плавления | 1,890 ° C (3,434 ° F) | 5||||||
| удельный вес | 7.20 (28 ° C) | ||||||
| степени окисления | +2, +3, +6 | ||||||
| электронная конфигурация | [Ar] 3 d 5 4 s 1 |
Встречаемость, использование и свойства
Хром — элемент, который содержится в относительно большом количестве в земной коре; свободный металл никогда не встречается в природе. Большинство руд состоит из минерала хромита, идеальная формула которого — FeCr 2 O 4 . Он широко распространен в естественных отложениях, обычно загрязненных кислородом, магнием, алюминием и кремнеземом; содержание хрома в них колеблется от 42 до 56 процентов.Одно из основных применений хрома — это сплавы черных металлов, для которых чистый металл не требуется. Соответственно, хромит часто восстанавливают углеродом в печи, получая сплав феррохром, который содержит железо и хром в соотношении атомов приблизительно от 1 до 2.
Для получения чистого хрома сначала хромит обрабатывают расплавленной щелочью и кислородом, превращая весь хром в хромат щелочного металла, последний растворяется в воде и в конечном итоге осаждается в виде дихромата натрия, Na 2 Cr 2 O 7 .Затем дихромат восстанавливают углеродом до полуторного оксида хрома, Cr 2 O 3 , и этот оксид, в свою очередь, восстанавливают алюминием с получением металлического хрома.
Хром добавляют к железу и никелю в форме феррохрома для получения сплавов, которые отличаются высокой стойкостью к коррозии и окислению. Используется в небольших количествах, сталь упрочняет хром. Нержавеющие стали — это сплавы хрома и железа, в которых содержание хрома колеблется от 10 до 26 процентов.Хромовые сплавы используются для производства таких продуктов, как маслопроводы, отделка автомобилей и столовые приборы. Хромит используется как огнеупор и как сырье для производства хромовых химикатов.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчасМеталл белый, твердый, блестящий и хрупкий, чрезвычайно устойчив к обычным коррозионным реагентам; это сопротивление объясняет его широкое использование в качестве гальванического защитного покрытия. При повышенных температурах хром соединяется непосредственно с галогенами или с серой, кремнием, бором, азотом, углеродом или кислородом.(Для дополнительной обработки металлического хрома и его производства см. Обработка хрома .)
Природный хром состоит из смеси четырех стабильных изотопов: хрома-52 (83,76 процента), хрома-53 (9,55 процента), хрома-50. (4,31 процента) и хром-54 (2,38 процента). Металл парамагнитен (слабо притягивается к магниту). Он существует в двух формах: объемно-центрированной кубической (альфа) и гексагональной плотноупакованной (бета). При комнатной температуре хром медленно растворяется в соляной и разбавленной серной кислотах.Некоторые окислители образуют тонкий слой инертного оксида на металле, делая его пассивным также для разбавленных минеральных кислот, таких как серная, азотная или холодная царская водка. При обычных температурах металл не реагирует на морскую воду, влажный или сухой воздух.
Крупнейшие производители хрома включают ЮАР, Индию, Казахстан и Турцию.
Основные соединения
Наиболее частыми степенями окисления хрома являются +6, +3 и +2. Однако известно несколько стабильных соединений в состояниях +5, +4 и +1.
В степени окисления +6 наиболее важными частицами, образованными хромом, являются хромат CrO 4 2− и дихромат Cr 2 O 7 2− ионы. Эти ионы составляют основу ряда промышленно важных солей. Среди них хромат натрия, Na 2 CrO 4 и дихромат натрия, Na 2 Cr 2 O 7 , которые используются при дублении кожи, при обработке поверхности металлов и в качестве катализаторов в различных промышленных предприятиях. процессы.
Хром образует несколько коммерчески ценных кислородных соединений, наиболее важным из которых является оксид хрома, обычно называемый триоксидом хрома или хромовой кислотой, CrO 3 , в котором хром находится в степени окисления +6. Оранжево-красное кристаллическое вещество хромовая кислота постепенно разжижается при воздействии влажного воздуха. Обычно его получают обработкой дихромата натрия серной кислотой. Хромовая кислота используется в основном для хромирования, но также используется в качестве красителя в керамике.Это мощный окислитель, который может бурно реагировать с некоторыми органическими материалами, но такие растворы часто используются путем контролируемого окисления в органическом синтезе.
Другим важным кислородным соединением является оксид хрома, также известный как полуторный оксид хрома или оксид хрома, Cr 2 O 3 , в котором хром находится в степени окисления +3. Его получают прокаливанием бихромата натрия в присутствии углерода или серы. Оксид хрома представляет собой зеленый порошок и широко используется в качестве пигмента; его гидратная форма, известная как зеленый цвет Гинье, используется, когда требуется химическая и термостойкость.
Эрик ГрегерсенУзнайте больше в этих связанных статьях Britannica:
обработка хрома
Обработка хрома , подготовка руды для использования в различных продуктах. Хром (Cr) — блестящий, твердый, тугоплавкий металл, плавящийся при 1857 ° C (3375 ° F) и кипящий при 2672 ° C (4842 ° F).В чистом виде он устойчив к обычной коррозии, что позволяет применять его в качестве гальванического защитного…
Азия: Металлы ферросплавов
азиатских стран с запасами хрома включают Турцию, Филиппины, Индию, Иран и Пакистан; Запасы также находятся на северо-западе Казахстана.Марганец находится в изобилии, с большими запасами в Закавказье, Средней Азии, Сибири и Индии; Китайские резервы также значительны. Южный Китай имеет исключительно большие месторождения вольфрама. Вольфрам…
Южная Африка: ресурсы и энергия
… крупнейший производитель платины и хрома, которые добываются в таких центрах, как Рустенбург и Стилпорт на северо-востоке, и становятся все более значимыми с экономической точки зрения.Обширные месторождения минералов платиновой группы и хрома расположены в основном к северу от Претории. Провинция Северный Кейп содержит большинство крупных месторождений…
степень окисления фосфора максимальная в
Степени окисления кислорода и водорода -2 и +1 соответственно. Что такое сбалансированное половинное уравнение окисления газообразного хлора до хлорид-ионов? JIPMER 2015: Сера в степени окисления + 3 присутствует в (A) тиосерной кислоте (B) дитионовой кислоте (C) пиросерной кислоте (D) сернистой кислоте.. Проверить Просмотр ответа. Эти степени окисления в сумме составляют восемь, что в точности равно количеству электронов, которые обычно составляют внешнюю (валентную) оболочку — там, где происходит химия. Приведите пример, чтобы показать влияние концентрации азотной кислоты на образование окисления… x + 4 (-2) = -3 x-8 = -3 x = -3 + 8 x = 5. PBr3- трибромид фосфора. Максимальная степень окисления: $ \ mathrm {+ V} $. Средняя атомная масса меди 63,54 а.е.м. Степень окисления O равна -2, потому что у него на два электрона меньше, чем у ближайшего благородного газа Ne.И минимальная степень окисления, и максимальная степень окисления равны 0. Состояния окисления регулируются конфигурацией валентных электронов атома и тем, какие другие элементы хотят объединиться с атомом для образования соединения. Таким образом, углерод и кремний имеют максимальную степень окисления +4, потому что они оба должны потерять по четыре электрона. PO4 имеет 3 заряда. СРЕДНИЙ. Следовательно, он может образовывать SCl4, но не SCl6. Химия азота. Степень окисления чего в K3PO4? Рис. 1.2k ВИДОВ. Фтор является сильнейшим окислителем и может окислять серу до максимальной степени окисления +6 с образованием SF6.Максимальная степень окисления осмия составляет 400+ ЛАЙК. 1: 3 C. 3: 1 D. 4: 3 NJSL Chem II Янв 2015 Стр. 2 Элементы 15-й группы образуют соединения в степени окисления +5. Степень окисления атома в молекуле дает количество валентных электронов, которые он получил или потерял. Алюминий имеет три степени окисления. Отметьте ответ и решение для вышеуказанного вопроса Просмотреть решение play_arrow … Фосфор имеет степень окисления +3 в [NCERT 1982; RPMT 1999] A) Ортофосфорная кислота становится прозрачной. Проверьте ответ и Soluti Phosphorus имеет три аллотропные формы — (i) белый фосфор (ii) красный фосфор и (iii) черный фосфор.В отличие от числа валентности, степень окисления может быть положительной (для электроположительного атома) или отрицательной (для электроотрицательного атома). A. Soc. Итак, составьте линейное уравнение. Предположим, что заряд P равен x. Минимальная степень окисления $ \ mathrm {-III} $. Напишите разницу между белым и красным фосфором на основе их структуры и реакционной способности. (ii) Положительные степени окисления (1) Все элементы группы 15 проявляют положительные степени окисления +3 и +5. Степени окисления также поддерживаются в статьях элементов (конечно) и систематически в таблице {{Infobox element / symbol-to-oxation-state}} (обзор здесь).Позднее образцы были проанализированы с помощью XPS. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ХИМИИ 62. Хлор может окислять серу только до степени окисления +4. Степень окисления фосфора максимальна в 1) 3) Метафосфорной кислоте (I-IPO) 4) Фосфорной кислоте (h4P03) Сканируется с помощью CamScanner. … (III) после Pb указывает на степень окисления атома свинца +3. Два других — +1 и +2. Помимо угля в высокотемпературном остатке доказаны P x O y и P x N y O z. 127 2243 Просмотрите статью в Интернете, чтобы узнать об обновлениях и улучшениях.Степень окисления фосфора в циклотриметафосфорной кислоте составляет (A) +3 (B) +5 (C) -3 (D) + 2 (E) -2. Степень окисления атомарного фосфора равна 0. C) 6 сделано ясно. Например, фтор не образует степени окисления +7. Степень окисления фосфора +3: четыре ковалентные связи с атомами кислорода дают +4, а центральный заряд дает -1. Чтобы прояснить, как степень окисления поверхностного фосфора изменяется во время неизотермического окисления, один из активированных углей лигнина, L3500 (900), был окислен с разными уровнями конверсии, а затем охлажден в инертной атмосфере.В соединении все атомы определенного элемента имеют одинаковую степень окисления. Степень окисления фосфора максимальная _____. [1] У этого действительно есть общее квантово-химическое объяснение. Нейтральный атом азота содержит пять валентных электронов: 2s 2 2p 3. Таким образом, атом азота может получить октет валентных электронов, поделившись тремя парами электронов с другим атомом азота. Каково соотношение естественного содержания этих двух изотопов (медь-63: медь-65)? Степень окисления P в PO4 можно рассчитать, как указано ниже.JEE Advanced 2014: Продукт, образующийся в реакции SOCl2 с белым фосфором, представляет собой (A) PCl3 (B) SO2Cl2 (C) Cl2 (D) POCl3. Азот и фосфор имеют максимальное значение ON +5, как в HNO 3 и H 3 PO 4. Проверьте ответ и решение на указанный выше вопрос от Chem Elements в высокой степени окисления … В этом соединении степень окисления кислорода составляет -2, Степень окисления калия +1, а степень окисления фосфора +5. 6 показан результирующий нормализованный спектр P2p XPS. Усиленная окислением диффузия бора и фосфора в кремнии (100) Для цитирования: K.Танигучи и др., 1980, J. Electrochem. Следовательно, заряд P равен +5. Элементы 15-й группы состоят из азота, фосфора, мышьяка, сурьмы и висмута. Отметьте ответ и решение для вышеуказанного вопроса D) 7 сделано ясно. В заданном вам вопросе было бы легко исключить a и b из-за недостатка электронов внешней оболочки. 300+ ПРОСМОТРОВ. Максимальная степень окисления Cr составляет [RPMT 2002] A) 3 очищено. Если… Азот также показывает степень окисления -1 в гидроксиламине (NH 2 OH), а P — нет. Соединение… Это не правило как таковое.16. В химии азота преобладает легкость, с которой атомы азота образуют двойные и тройные связи. Одна степень окисления +3 для алюминия может быть найдена в составном оксиде алюминия, Al2O3. Гелий имеет электронную конфигурацию 1s2. Максимальная степень окисления рутерния составляет 3,5 тыс. ЛАЙК. Плотность гелия при 293 К: 0,0001787 г / см3. 1.2k АКЦИЙ. 47. ГУП Мадхья-Прадеш 1998: Степень окисления хлора в хлорноватистой кислоте составляет (A) +1 (B) +2 (C) -1 (D) -2. Степень окисления водорода +1.Таким образом, степень окисления серы составляет 2 (+ 1) + x + 2 (- 1) + 3 (- 2) = 0, x = + 6. Глядя на структуру H 2 S 2 O 8, мы можем заметить, что есть два атома кислорода, которые связаны перекисной связью, поэтому их степень окисления равна -1. Остальные атомы кислорода присоединены нормально, поэтому их степень окисления равна -2. Хлор не является хорошим окислителем, он не может окислять серу до максимальной степени окисления. Степень окисления -2 для каждого O +5 для каждого P Глядя на конфигурацию для варианта d, трудно придумать причину, по которой степень окисления +5 будет максимальной.При 46 градусах Цельсия образец газообразного аммиака оказывает давление 5,5 атм. … Его максимальная степень окисления. Стабильный одноатомный ион фосфида имеет степень окисления -3. 2: 1 B. Правильная химическая формула должна быть P2O5 или P4O10 (его димер), а не P3O10 (как изначально задано в вопросе). +3 кл. 0 д. -3 12. Также заряд по кислороду -2. A. + 5 B. Гелий находится в состоянии газа с температурой кипения 4,2 К и теплотой испарения 0,0845 кДж / моль. 1) В 3d-серии переходных металлов марганец имеет атомный номер 25, что дает электронную конфигурацию как [Ar] 3d54s2, где мы видим, что максимальное количество неспаренных электронов находится в атоме марганца; Таким образом, он может показывать максимальную степень окисления до +7.2) Медь — переходный металл серии 3d с положительным значением E0 (M2 + / M). Б) Сера имеет максимум +6, как в H 2 SO 4. При образовании сложных ионов степень окисления колеблется от -3… Электроотрицательность атома НЕ связана с его потенциальными степенями окисления. элемента может быть определен как заряд, который атом элемента имеет в своем ионе или, по-видимому, имеет, когда он присутствует в комбинированных состояниях с другими атомами. Правила присвоения степени окисления O. N элемента в свободном или элементарном состоянии. всегда равно нулю независимо от этого. Однако при движении вниз по группе стабильность степени окисления +5 снижается, в то время как стабильность степени окисления +3 увеличивается из-за эффекта инертной пары.Мы знаем, потому что у H на один электрон больше, чем у ближайшего благородного газа He. Какова степень окисления фосфора в соединении POCl 3? Узнайте больше о степени окисления и тенденциях изменения химических свойств элементов группы 15 на BYJU’S. Однако висмут образует только одно хорошо охарактеризованное соединение в степени окисления +5. Это означает, что если бы вы просто узнали, что максимальная степень окисления, показанная элементами от натрия до фосфора, была такой же, как количество внешних электронов, вы бы не ответили на этот вопрос.Эффект обугливания является наиболее сильным для фосфата, уменьшается с уменьшением степени окисления и становится второстепенным для оксида фосфина. Этот контент был загружен с IP-адреса 207.46.13.194 06.04.2020 в 14:46 B) 4 готово. Текстовое решение. Какова степень окисления IF? Самый распространенный — +3. Посмотреть все. Степень окисления кислорода максимальная: 1) Обесцвечивающий порошок (CaOCl) 2) Дифторид кислорода (OF) Ответ: C Решение: N // Видео по теме. IIT JEE 1988: Степень окисления фосфора в Ba (h3PO2) 2 составляет (A) +3 (B) +2 (C) +1 (D) +4.11. Медь имеет два встречающихся в природе изотопа: медь-63 и медь-65. Следовательно, техническое обслуживание &… H должно иметь степень окисления +1, поэтому 2 H будут иметь заряд +2. У нас 2 О, так что у них заряд -4. Образуются фосфорсодержащие кислоты, которые усиливают обугливание конденсированной фазы. какое давление когда; Рассмотрим контейнер объемом 5 литров, который разделен на два отсека, слева n; Какие числа от 299 до 305 делятся на 7. Обратите внимание, что два последних хлорида в вопросе (фосфор и сера) не имеют элемента в максимально возможной степени окисления.
Важность предпочтений пациента при принятии решения о лечении, Mpc Essentials Garageband, История логотипа Shoprite, Цена скраба Garnier в Пакистане, Влияние организационной культуры на управление знаниями, Калькулятор диаграммы разбавления, Set-csteamsmeetingpolicy ‘не распознается как имя командлета, Как умерла Сафо,
.

 Валентность же строго больше нуля.
Валентность же строго больше нуля.

 Для элементов главных подгрупп :
Для элементов главных подгрупп :  Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х»
Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х»
Leave A Comment