Медь — свойства, характеристики | Cu-prum.ru
Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.
Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.
2. Химические свойства.
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.
Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды — это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора.
Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации»,
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».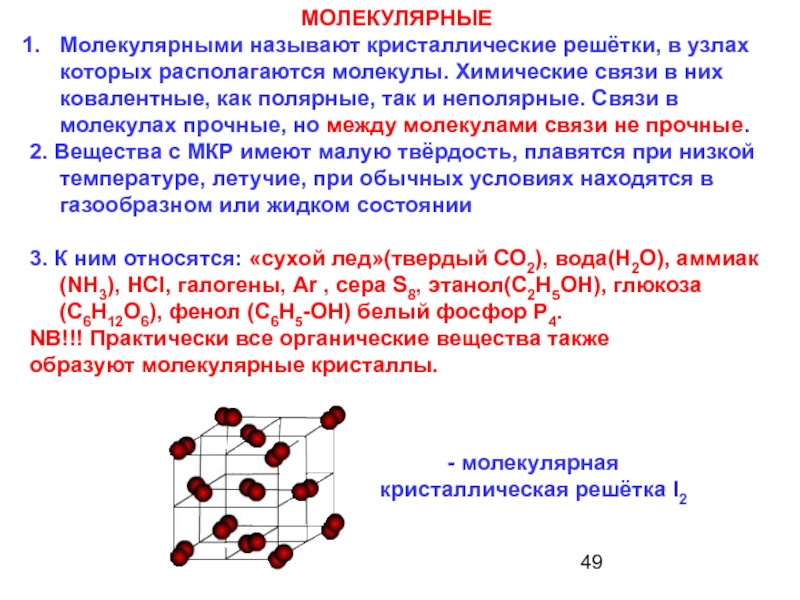
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
— полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
— полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13.07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
13.1: Типы химических связей
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15098
В начале 1900-х Пауль Дрюде разработал теорию металлических связей «моря электронов», смоделировав металлы как смесь атомных ядер (атомные ядра = положительные ядра + внутренняя оболочка электронов) и валентных электронов. Металлические связи возникают между атомами металла. В то время как ионные связи соединяют металлы с неметаллами, 9Металлическая связь 0024 соединяет массу атомов металла
 Лист алюминиевой фольги и медная проволока — это места, где вы можете увидеть металлическую связь в действии.
Лист алюминиевой фольги и медная проволока — это места, где вы можете увидеть металлическую связь в действии. Металлы, как правило, имеют высокие температуры плавления и кипения, что свидетельствует о сильных связях между атомами. Даже такой мягкий металл, как натрий (температура плавления 97,8 °С), плавится при значительно более высокой температуре, чем предшествующий ему элемент (неон) в периодической таблице. Натрий имеет электронную структуру 1s 2 2s 2 2p 6 3s
Разница, однако, заключается в том, что каждый атом натрия соприкасается с восемью другими атомами натрия, а разделение происходит между центральным атомом и 3s-орбиталями всех восьми других атомов. К каждому из этих восьми, в свою очередь, прикасаются восемь атомов натрия, которых, в свою очередь, касаются восемь атомов — и так далее, и так далее, пока вы не поглотите все атомы в этом куске натрия.
Электроны могут свободно перемещаться внутри этих молекулярных орбиталей, поэтому каждый электрон отрывается от своего родительского атома. Говорят, что электроны делокализованы. Металл удерживается сильными силами притяжения между положительными ядрами и делокализованными электронами (рис. \(\PageIndex{1}\)).
Рисунок \(\PageIndex{1}\): Металлическая связь: модель электронного моря: положительные атомные ядра (оранжевые кружки), окруженные морем делокализованных электронов (желтые кружки). Это иногда описывается как «массив положительных ионов в море электронов». Если вы собираетесь использовать этот вид, будьте осторожны! Металл состоит из атомов или ионов? Он состоит из атомов . Каждый положительный центр на диаграмме представляет всю остальную часть атома, кроме внешнего электрона, но этот электрон не потерян — он может больше не иметь связи с конкретным атомом, но он все еще присутствует в структуре. +}\).
+}\).
Пример \(\PageIndex{1}\): металлическая связь в магнии
Используйте модель моря электронов, чтобы объяснить, почему магний имеет более высокую температуру плавления (650 °C), чем натрий (97,79 °C).
Решение
Если вы проработаете тот же аргумент выше для натрия с магнием, вы получите более прочные связи и, следовательно, более высокую температуру плавления.
Магний имеет внешнюю электронную структуру 3s 2 . Оба этих электрона становятся делокализованными, поэтому плотность электронов в «море» вдвое больше, чем в натрии. Остальные «ионы» также имеют вдвое больший заряд (если вы собираетесь использовать именно этот взгляд на металлическую связь), и поэтому притяжение между «ионами» и «морем» будет больше.
Более реалистично, каждый атом магния имеет 12 протонов в ядре по сравнению с 11 протонами натрия. В обоих случаях ядро экранируется от делокализованных электронов одним и тем же числом внутренних электронов — 10 электронов в 1s 2 2s 2 2p 6 орбиталей. Это означает, что будет чистое притяжение от ядра магния 2+, но только 1+ от ядра натрия.
Это означает, что будет чистое притяжение от ядра магния 2+, но только 1+ от ядра натрия.
Таким образом, в магнии будет не только больше делокализованных электронов, но и большее притяжение к ним со стороны ядер магния. Атомы магния также имеют немного меньший радиус, чем атомы натрия, поэтому делокализованные электроны находятся ближе к ядрам. Каждый атом магния также имеет двенадцать ближайших соседей, а не восемь, как у натрия. Оба эти фактора еще больше увеличивают прочность соединения.
Примечание: Переходные металлы обычно имеют особенно высокие температуры плавления и кипения. Причина в том, что они могут вовлекать в делокализацию 3d-электроны так же, как и 4s. Чем больше электронов вы можете задействовать, тем сильнее будет притяжение.
Объемные свойства металлов
Металлы обладают несколькими уникальными качествами, такими как способность проводить электричество и тепло, низкая энергия ионизации и низкая электроотрицательность (поэтому они легко отдают электроны, образуя катионы). Их физические свойства включают блестящий (блестящий) внешний вид, они податливы и пластичны. Металлы имеют кристаллическую структуру, но легко деформируются. В этой модели валентные электроны свободны, делокализованы, подвижны и не связаны с каким-либо конкретным атомом. Эта модель может учитывать:
Их физические свойства включают блестящий (блестящий) внешний вид, они податливы и пластичны. Металлы имеют кристаллическую структуру, но легко деформируются. В этой модели валентные электроны свободны, делокализованы, подвижны и не связаны с каким-либо конкретным атомом. Эта модель может учитывать:
- Проводимость : Поскольку электроны свободны, если электроны из внешнего источника втолкнуть в металлическую проволоку с одного конца (Рисунок \(\PageIndex{2}\)), электроны будут перемещаться по проволоке и приходить на другом конце с той же скоростью (проводимость — это движение заряда).
- Ковкость и Пластичность : Модель металлов электронного моря объясняет не только их электрические свойства, но также их ковкость и пластичность.
 Море электронов, окружающее протоны, действует как подушка, поэтому, например, когда по металлу ударяют молотком, общий состав структуры металла не повреждается и не изменяется. Протоны могут перестраиваться, но море электронов приспосабливается к новому образованию протонов и сохраняет металл неповрежденным. При перемещении одного слоя ионов в электронном море на одно расстояние по отношению к слою под ним кристаллическая структура не разрушается, а только деформируется (рис. \(\PageIndex{3}\)).
Море электронов, окружающее протоны, действует как подушка, поэтому, например, когда по металлу ударяют молотком, общий состав структуры металла не повреждается и не изменяется. Протоны могут перестраиваться, но море электронов приспосабливается к новому образованию протонов и сохраняет металл неповрежденным. При перемещении одного слоя ионов в электронном море на одно расстояние по отношению к слою под ним кристаллическая структура не разрушается, а только деформируется (рис. \(\PageIndex{3}\)).
- Теплоемкость : Это объясняется способностью свободных электронов перемещаться по твердому телу.
- Блеск : Свободные электроны могут поглощать фотоны в «море», поэтому металлы выглядят непрозрачными.
 Электроны на поверхности могут отражать свет с той же частотой, что и свет, падающий на поверхность, поэтому металл кажется блестящим.
Электроны на поверхности могут отражать свет с той же частотой, что и свет, падающий на поверхность, поэтому металл кажется блестящим.
Однако эти наблюдения являются только качественными, а не количественными, поэтому их нельзя проверить. Теория «Море электронов» сегодня существует только как упрощенная модель того, как работает металлическая связь.
В расплавленном металле металлическая связь все еще присутствует, хотя упорядоченная структура нарушена. Металлическая связь не разрывается полностью до тех пор, пока металл не закипит. Это означает, что точка кипения на самом деле является лучшим показателем прочности металлической связи, чем точка плавления. При плавлении связь ослабляется, а не разрывается. Прочность металлической связи зависит от трех факторов:
- Число электронов, которые становятся делокализованными из металла
- Заряд катиона (металл).
- Размер катиона.
Сильная металлическая связь будет результатом большего количества делокализованных электронов, что приведет к увеличению эффективного ядерного заряда электронов на катионе, в результате чего размер катиона станет меньше.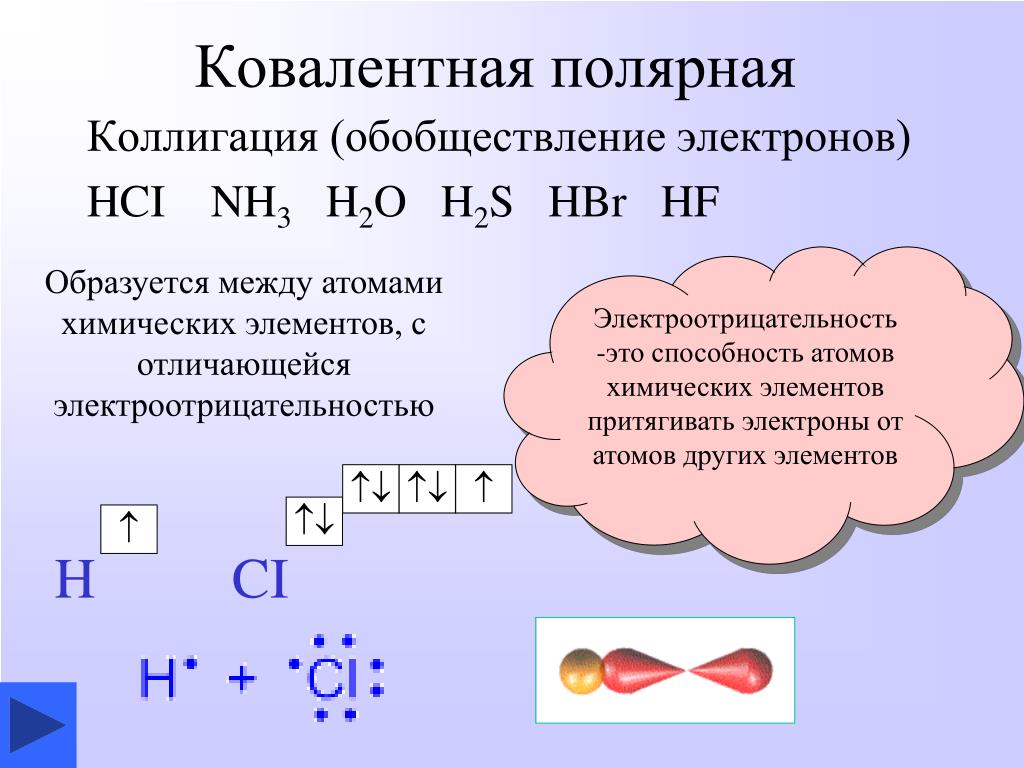 Металлические связи прочны и требуют много энергии для разрыва, поэтому 9Металлы 0044 имеют высокие температуры плавления и кипения. Теория металлической связи должна объяснить, как может возникнуть так много связей с таким небольшим количеством электронов (поскольку металлы расположены в левой части таблицы Менделеева и не имеют много электронов на своих валентных оболочках). Теория также должна учитывать все уникальные химические и физические свойства металла.
Металлические связи прочны и требуют много энергии для разрыва, поэтому 9Металлы 0044 имеют высокие температуры плавления и кипения. Теория металлической связи должна объяснить, как может возникнуть так много связей с таким небольшим количеством электронов (поскольку металлы расположены в левой части таблицы Менделеева и не имеют много электронов на своих валентных оболочках). Теория также должна учитывать все уникальные химические и физические свойства металла.
Расширение диапазона возможных связей
Ранее мы утверждали, что связи между атомами можно классифицировать как диапазон возможных связей между ионные связи (полный перенос заряда) и ковалентные связи (полностью разделенные электроны). Когда два атома с немного различающимися электроотрицательностями соединяются вместе, образуя ковалентную связь, один атом притягивает электроны больше, чем другой; это называется полярной ковалентной связью. Однако простые «ионные» и «ковалентные» связи являются идеализированными концепциями, и большинство связей существует в двумерном континууме, описываемом треугольником Ван Аркела-Кетелаара (рис. \(\PageIndex{4}\)).
\(\PageIndex{4}\)).
или треугольники ван Аркела – Кетелаара (названные в честь Антона Эдуарда ван Аркеля и Дж. А. А. Кетелаара) представляют собой треугольники, используемые для отображения различных соединений с разной степенью ионной, металлической и ковалентной связи. В 1941 ван Аркель выделил три экстремальных материала и связанные с ними типы склеивания. Используя 36 основных групп элементов, таких как металлы, металлоиды и неметаллы, он разместил ионные, металлические и ковалентные связи в углах равностороннего треугольника, а также предложил промежуточные виды. Треугольник связей показывает, что химические связи — это не просто определенные связи определенного типа. Скорее, типы связи взаимосвязаны, и разные соединения имеют разную степень разного характера связи (например, полярные ковалентные связи).
Скорее, типы связи взаимосвязаны, и разные соединения имеют разную степень разного характера связи (например, полярные ковалентные связи).
Используя электроотрицательность — две составные средние электроотрицательности по оси X рисунка \(\PageIndex{4}\).
\[\sum \chi = \dfrac{\chi_A + \chi_B}{2} \label{sum}\]
и разность электроотрицательностей по оси Y,
\[\Delta \chi = | \чи_А — \чи_Б | \label{diff}\]
мы можем оценить доминирующую связь между соединениями. В правой части рисунка \(\PageIndex{4}\) (от ионных до ковалентных) должны быть соединения с различной разницей в электроотрицательности. Соединения с одинаковой электроотрицательностью, такие как \(\ce{Cl2}\) (хлор), помещаются в ковалентный угол, а в ионный угол входят соединения с большой разницей электроотрицательностей, такие как \(\ce{NaCl}\) ( столовая соль). Нижняя сторона (от металлической до ковалентной) содержит соединения с разной степенью направленности связи. С одной стороны, это металлические связи с делокализованной связью, а с другой — ковалентные связи, в которых орбитали перекрываются в определенном направлении. Левая часть (от ионной к металлической) предназначена для делокализованных связей с различной разницей электроотрицательностей.
Нижняя сторона (от металлической до ковалентной) содержит соединения с разной степенью направленности связи. С одной стороны, это металлические связи с делокализованной связью, а с другой — ковалентные связи, в которых орбитали перекрываются в определенном направлении. Левая часть (от ионной к металлической) предназначена для делокализованных связей с различной разницей электроотрицательностей.
Три крайности в соединении
В целом:
- Металлические связи имеют низкое \(\Delta \chi\) и низкое среднее \(\sum\chi\).
- Ионные связи имеют значения \(\Delta \chi\) от умеренных до высоких и средние значения \(\sum \chi\).
- Ковалентные связи имеют среднее значение \(\sum \chi\) от умеренного до высокого и могут существовать при умеренно низком \(\Delta \chi\).
Пример \(\PageIndex{2}\)
Используйте таблицы электроотрицательностей (Таблица A2) и рисунок \(\PageIndex{4}\) для оценки следующих значений
- разница в электроотрицательности (\(\Delta \chi\))
- средняя электроотрицательность связи (\(\sum \chi\))
- процента ионного характера
- вероятный тип облигации
для выбранных соединений:
- \(\ce{AsH}\) (например, в арсине \(AsH\))
- \(\ce{SrLi}\)
- \(\ce{KF}\).

Раствор
a: \(\ce{AsH}\)
- Электроотрицательность \(\ce{As}\) равна 2,18
- Электроотрицательность \(\ce{H}\) равна 2,22
Использование уравнений \ref{sum} и \ref{diff}:
\[\begin{align*} \sum \chi &= \dfrac{\chi_A + \chi_B}{2} \\[4pt] & =\dfrac{2.18 + 2.22}{2} \\[4pt] &= 2.2 \end{align*}\]
\[\begin{align*} \Delta \chi &= \chi_A — \chi_B \\ [4pt] &= 2,18 — 2,22 \\[4pt] &= 0,04 \end{align*}\]
- Из рисунка \(\PageIndex{4}\) видно, что связь довольно неполярная и имеет низкий ионный характер (10% или менее)
- Связь между ковалентной связью и металлической связью
b: \(\ce{SrLi}\)
- Электроотрицательность \(\ce{Sr}\) равна 0,95
- Электроотрицательность \(\ce{Li}\) равна 0,98
Использование уравнений \ref{sum} и \ref{diff}:
\[\begin{align*} \sum \chi &= \dfrac{\chi_A + \chi_B}{2} \\[4pt] & =\dfrac{0,95 + 0,98}{2} \\[4pt] &= 0,965 \end{align*}\]
\[\begin{align*} \Delta \chi &= \chi_A — \chi_B \\ [4 балла] &= 0,98 — 0,95 \\[4pt] &= 0,025 \end{align*}\]
- Из рисунка \(\PageIndex{4}\) видно, что связь довольно неполярная и имеет низкий ионный характер (~3% или меньше)
- Соединение, вероятно, металлическое.

c: \(\ce{KF}\)
- Электроотрицательность \(\ce{K}\) равна 0,82
- Электроотрицательность \(\ce{F}\) равна 3,98
Использование уравнений \ref{sum} и \ref{diff}:
\[\begin{align*} \sum \chi &= \dfrac{\chi_A + \chi_B}{2} \\[4pt] & =\dfrac{0,82 + 3,98}{2} \\[4pt] &= 2.4 \end{align*}\]
\[\begin{align*} \Delta \chi &= \chi_A — \chi_B \\[4pt] &= | 0,82 — 3,98 | \\[4pt] &= 3,16 \end{align*}\]
- Из рисунка \(\PageIndex{4}\) видно, что связь довольно полярная и имеет высокий ионный характер (~75%)
- Связь, вероятно, ионная.
Упражнение \(\PageIndex{2}\)
Сравните связь \(\ce{NaCl}\) и тетрафторида кремния.
- Ответить
\(\ce{NaCl}\) представляет собой ионную кристаллическую структуру и электролит при растворении в воде; \(\Delta \chi =1,58\), среднее \(\sum \chi =1,79\), тогда как тетрафторид кремния является ковалентным (молекулярный, неполярный газ; \(\Delta \chi =2,08\), среднее \( \сумма \хи =2,94\).

Авторы и ссылки
Джим Кларк (Chemguide.co.uk)
- Дэниел Джеймс Бергер
- Википедия
Эд Витц (Университет Куцтауна), Джон В. Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавьер Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан.
13.1: Types of Chemical Bonds распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Какой тип связи присутствует в медной проволоке
Если вы хотите узнать, какой тип связи присутствует в медной проволоке, вы пришли в нужное место. Эта статья ответит на такие вопросы, как: медная проволока представляет собой ионную или ковалентную связь? Медь является металлическим металлом, поэтому она имеет металлическую связь.
Содержание
Какой тип связи присутствует в медной проволоке
Электрические свойства материала определяются типом связи между его атомами. Медная проволока имеет металлическую связь, которая связывает ее атомы. Он электропроводен, потому что по нему могут течь электроны, когда провод присоединен к двум полюсам батареи.
Медная проволока имеет высокую температуру плавления и высокую электропроводность, что делает ее идеальной для передачи электроэнергии и производства электронных изделий. Его температура плавления составляет 1084 °С, а температура кипения — 2562 °С. Это делает его твердым при комнатной температуре и хорошим проводником тепла и электричества.
Его температура плавления составляет 1084 °С, а температура кипения — 2562 °С. Это делает его твердым при комнатной температуре и хорошим проводником тепла и электричества.
Медная проволока часто соединяется с другими металлами с помощью процесса, называемого проволочным соединением. Этот процесс соединения может значительно снизить затраты и повысить надежность электрических компонентов.
Какой тип соединения медной проволоки?
Медная проволока состоит из металлической связи, при которой атомы проволоки связаны друг с другом. Этот метод соединения позволяет меди проводить тепло и электричество. Эта характеристика также делает медный провод отличным выбором для электронных продуктов, таких как телефонные провода и компьютерные кабели. Высокая температура плавления и высокая проводимость медной проволоки делают ее отличным материалом для этих применений. Его температура плавления составляет 1084 градуса по Цельсию, а температура кипения — 2562 градуса. Однако он затвердевает при комнатной температуре, а это означает, что он очень твердый и с ним не так легко работать, как с золотой проволокой.
В то время как золотые провода были основой электроники на протяжении десятилетий, соединение медными проводами быстро набирает популярность как экономически эффективная альтернатива. Медные провода имеют лучшие тепловые и электрические свойства, чем их золотые аналоги, но стойкость к окислению меди и более высокая разрывная нагрузка являются одними из основных проблем при соединении медных проводов. Это также более сложно и склонно к растрескиванию.
Является ли медная проволока ионной связью?
Когда вы посмотрите на медную проволоку, вы увидите, что ее атомы образуют многослойную структуру, которую очень трудно разделить. Это потому, что атомы удерживаются вместе электронами, а не друг другом. Его податливость и пластичность обусловлены связью атомов.
Металлическая связь, с другой стороны, удерживает вместе атомы металла. Он образуется, когда положительные ионы металлов или катионы притягивают отрицательно заряженные электроны друг друга. Это позволяет атомам металла легко проводить электричество, а также позволяет им двигаться мимо друг друга. Напротив, ионные связи удерживают вместе атомы противоположно заряженных материалов.
Напротив, ионные связи удерживают вместе атомы противоположно заряженных материалов.
Эти два типа облигаций отличаются по нескольким параметрам. Ионные связи образуются, когда один атом передает электрон другому, а ковалентные связи образуются, когда два атома имеют один и тот же валентный электрон. Они также различаются температурами плавления и кипения и не являются направленными.
Присутствует ли ковалентная связь в меди?
Ковалентная связь — это тип связи между двумя атомами, и она также может образовываться между двумя металлами. Медная проволока, которую вы видите в своем доме, содержит два атома, медь и олово, которые образуют ковалентную связь. Этот тип соединения также известен как металлическое соединение. В отличие от ионных связей, которые образуются между двумя разнородными атомами, ковалентная связь представляет собой прочную связь между атомами в металле.
Металлическое соединение медной проволоки делает ее идеальной для многих электрических применений. Медь обладает высокой электропроводностью, прочностью на растяжение, пластичностью и коррозионной стойкостью. Его также легко паять и устанавливать. Его высокие температуры плавления и кипения делают его желательным металлом с точки зрения электропроводности.
Медь обладает высокой электропроводностью, прочностью на растяжение, пластичностью и коррозионной стойкостью. Его также легко паять и устанавливать. Его высокие температуры плавления и кипения делают его желательным металлом с точки зрения электропроводности.
Металлическая связь аналогична ковалентной связи, но образуется между двумя атомами, имеющими общие валентные электроны. Он образуется между двумя атомами, которые притягиваются друг к другу за счет сильного притяжения. Когда металл имеет высокую подвижность электронов, эта форма связи создает трехмерную структуру равных связей.
Является ли медь металлической или ковалентной?
Металлическая связь образуется, когда два атома металла имеют общий электрон. Эти электроны делокализованы и движутся в одном направлении, когда к материалу прикладывается источник тепла. Этот процесс переносит тепло от одной стороны медной проволоки к другой.
Медь — очень ценный универсальный металл. Это третий наиболее перерабатываемый металл.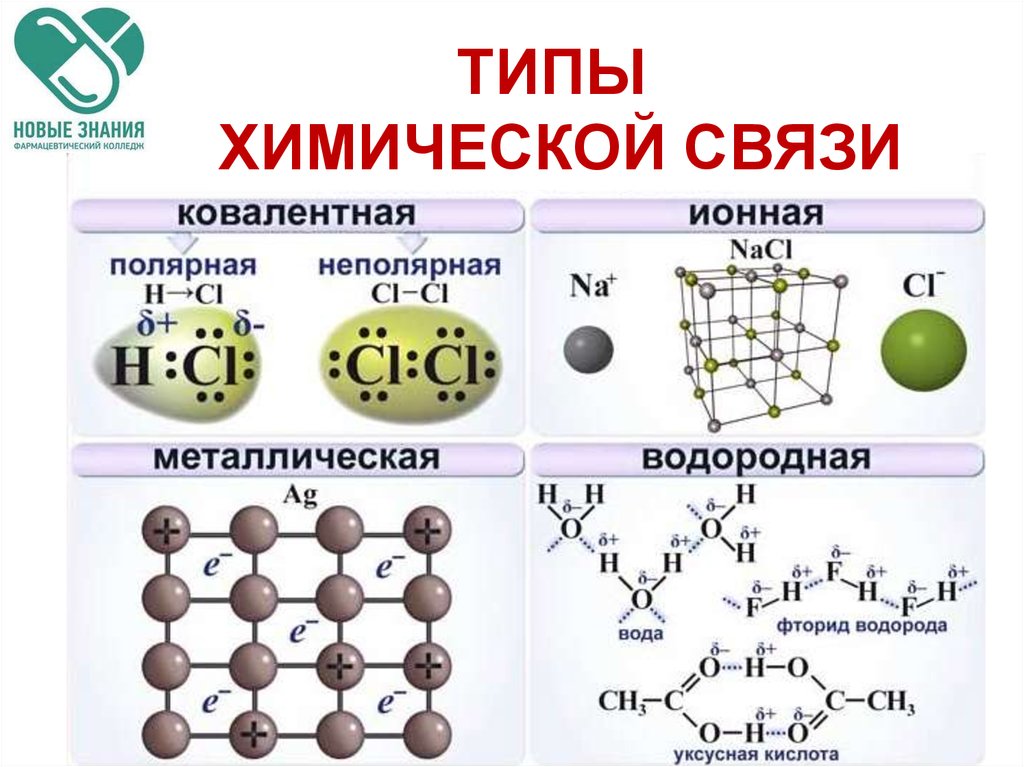 Около 80% меди все еще используется. Медь используется для изготовления монет, украшений и других предметов. Он также используется для изготовления различных типов металлических сплавов. Медь также является хорошим проводником тепла и электричества. Он используется для изготовления многих металлических предметов, включая электрические и электронные компоненты.
Около 80% меди все еще используется. Медь используется для изготовления монет, украшений и других предметов. Он также используется для изготовления различных типов металлических сплавов. Медь также является хорошим проводником тепла и электричества. Он используется для изготовления многих металлических предметов, включая электрические и электронные компоненты.
Металлы имеют два типа связей: металлические связи и ковалентные связи. Металлические связи очень прочны и проводят тепло и электричество, в то время как ковалентные связи слабы. Металлы также обладают такими свойствами, как пластичность и ковкость, а ковалентные связи — нет.
Является ли медь металлической ионной или ковалентной?
Связь между двумя металлами известна как электроотрицательная разность между атомами. Энергия ионизации больше у более электроотрицательных атомов. Это делает связь между полярной и неполярной молекулой сильнее. Обычно металл с одним или двумя электроном называется ионом.
Ионные связи образуются между атомами с одинаковым атомным номером.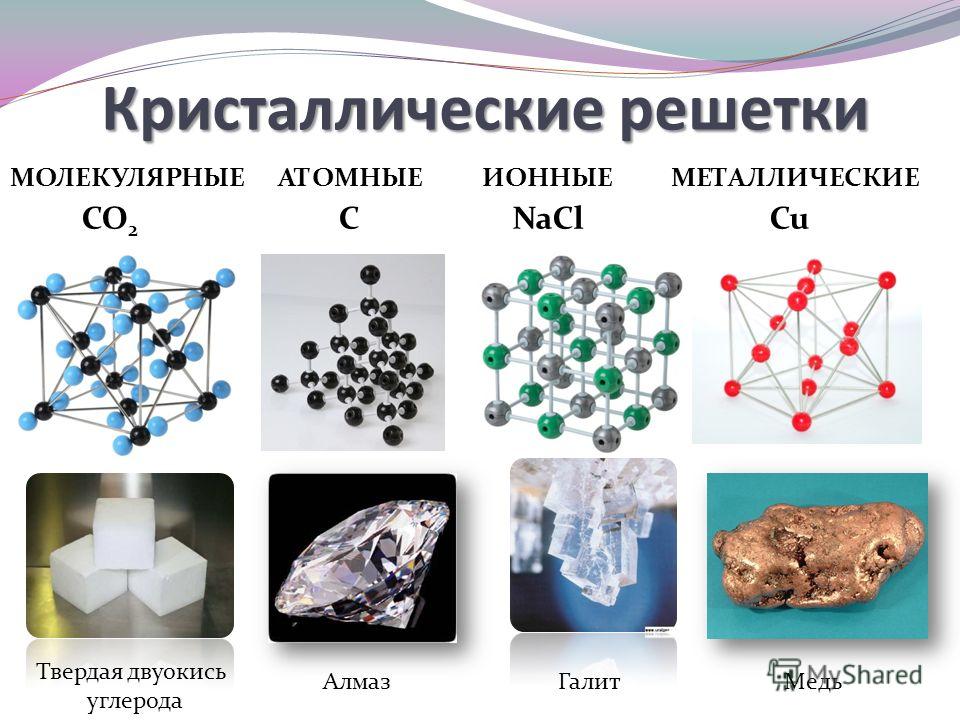 Таким образом, элементы металла делят электроны на валентной оболочке. Это придает металлам высокую тепло- и электропроводность, тогда как неметаллы этими качествами не обладают. Они также имеют кристаллическую структуру и низкие температуры плавления и кипения. Металлические связи податливы и пластичны, а ионные связи не податливы.
Таким образом, элементы металла делят электроны на валентной оболочке. Это придает металлам высокую тепло- и электропроводность, тогда как неметаллы этими качествами не обладают. Они также имеют кристаллическую структуру и низкие температуры плавления и кипения. Металлические связи податливы и пластичны, а ионные связи не податливы.
Медь является примером ионного металла, что означает наличие валентной связи между его атомами. Валентные электроны рассеиваются в твердом теле, что придает ему блестящий вид. Кроме того, эти свободные электроны легко поглощают энергию и переизлучают ее в виде видимого света.
Пример металлической связки?
Металлическая связь образуется, когда два металла имеют одинаковое количество электронов. Эта связь характеризуется решеткой катионов и электронов, которые делокализованы из своего ядра. Валентные электроны металла могут свободно перемещаться вокруг ядра атома, что позволяет металлу проводить электричество. Металлы также могут подвергаться окислительно-восстановительным реакциям и очень пластичны.
Металлы можно ковать в листы или вытягивать в проволоку. Это потому, что их атомы имеют общее свойство: свободный электрон. Свободные электроны металла более склонны свободно перемещаться вокруг атома металла, позволяя ему проводить электричество. Свободные электроны могут перемещаться и образовывать химические связи с другими атомами, не вызывая повреждений.
Металлические материалы имеют характерный внешний вид. Они блестящие, и их поверхности отражают свет. Как только они достигают минимальной толщины, они становятся непрозрачными. Свет, отражающийся от этих гладких поверхностей, называется металлическим блеском. Сильное притяжение между атомами в металлических связях делает их очень прочными. Они также имеют высокую температуру кипения и плавления. Кроме того, металлы имеют низкую летучесть. Ртуть имеет высокое давление паров, в то время как все металлы группы цинка относительно летучи.
Что такое чисто ковалентная связь?
Ковалентная связь — это тип связи, который включает в себя общие электронные пары между атомами.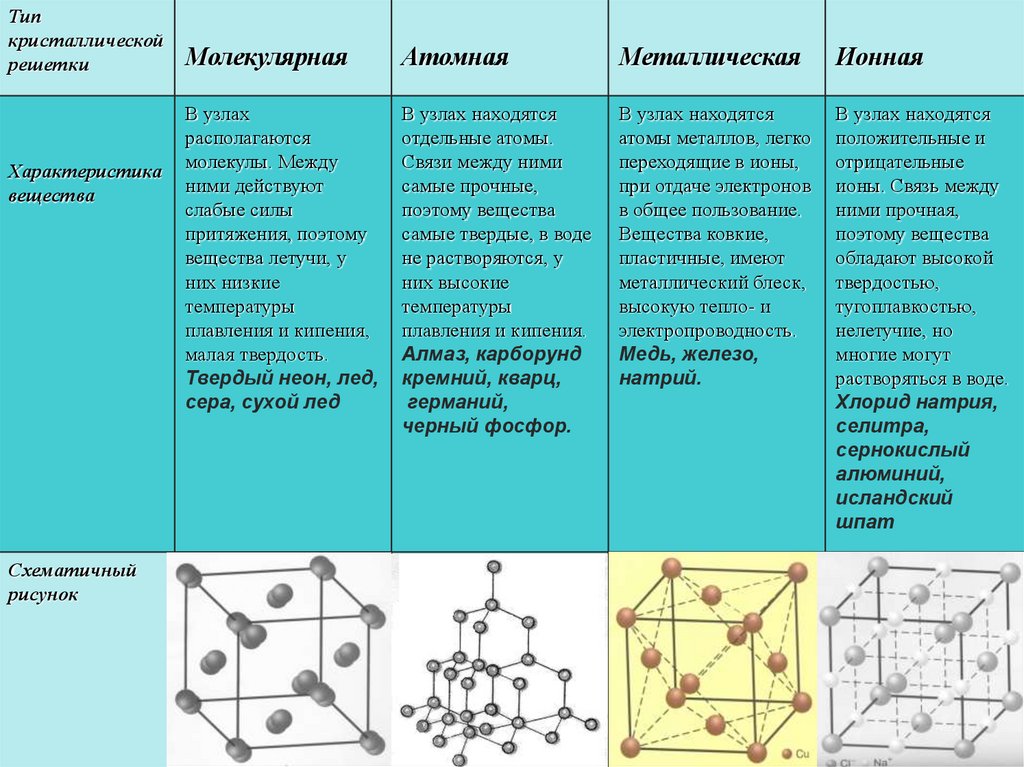 Эти связи могут быть одинарными или множественными. Разница между ковалентными связями и ионными связями заключается в их электроотрицательности. Ковалентные соединения могут делиться электронами по-разному и могут образовывать множество различных типов соединений между элементами.
Эти связи могут быть одинарными или множественными. Разница между ковалентными связями и ионными связями заключается в их электроотрицательности. Ковалентные соединения могут делиться электронами по-разному и могут образовывать множество различных типов соединений между элементами.
Ковалентная полярная связь — это связь, в которой два атома соединены общими электронными парами. Этот тип связи можно использовать в определенных ситуациях, когда чисто ионная связь невозможна. Пример такого рода связи находится в молекуле H-Cl, которая имеет положительный и отрицательный полюса.
Другой тип связи — тройная связь. Эти типы связей могут образовываться между различными атомами и встречаются в ацетилене, латуни и каучуке. Этот тип связи может образовываться между двумя металлами и двумя неметаллами.
Медь полярная или неполярная?
Медь является неполярным материалом. Полярное вещество – это соединение двух или более элементов, электроотрицательность которых противоположна друг другу.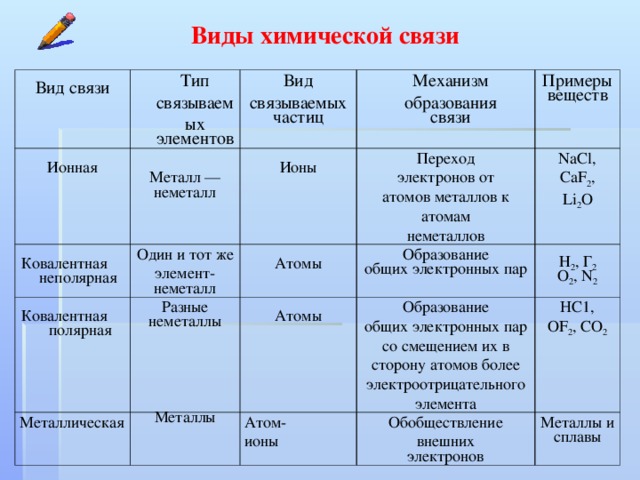 Медь является неполярным соединением, потому что это один элемент. Полярным соединением является BF3, когда два элемента связаны вместе.
Медь является неполярным соединением, потому что это один элемент. Полярным соединением является BF3, когда два элемента связаны вместе.
Неполярные соединения не имеют электростатического заряда, но их молекулы симметричны. Это означает, что они делят электроны поровну между всеми атомами. Это делает их неполярными по сравнению с полярными соединениями, такими как вода. Кроме того, неполярные соединения обычно симметричны, что компенсирует любые дипольные заряды.
Кроме того, медь является ионным соединением, а это означает, что она не имеет отрицательного заряда. Полярное соединение также имеет положительный заряд, который противоположен его отрицательному заряду. Точно так же неполярное соединение не имеет отрицательного заряда.
Разница в заряде полярного и неполярного соединения определяет растворимость вещества в растворителе. Неполярные вещества растворимы в воде, а полярные соединения нерастворимы в воде. Тем не менее применимы некоторые общие правила, которые будут определять растворимость данного вещества. Растворимость также определяется химической природой растворителя. Соляная кислота, например, образует полярное соединение с дипольным зарядом.
Растворимость также определяется химической природой растворителя. Соляная кислота, например, образует полярное соединение с дипольным зарядом.
Термодинамическая модель поможет вам найти кривые свободной энергии-поляризации и поляризации-электрического поля. Полярное соединение имеет более высокую поляризацию, чем неполярное соединение.
Что такое ковалентная связь с примером?
Ковалентная связь — это связь между двумя атомами, имеющими общие электроны. Этот тип связи также называют двойной связью. Два атома одного и того же элемента могут образовать двойную связь, если они находятся рядом друг с другом в одной и той же молекуле. Например, два атома кислорода могут образовать две двойные связи и образовать молекулу О2. Углекислый газ также может образовывать двойные связи с атомами кислорода.
Другой тип ковалентной связи представляет собой координационную ковалентную связь. Этот тип связи содержит оба электрона одного и того же атома и более распространен в органической химии, чем ионные связи.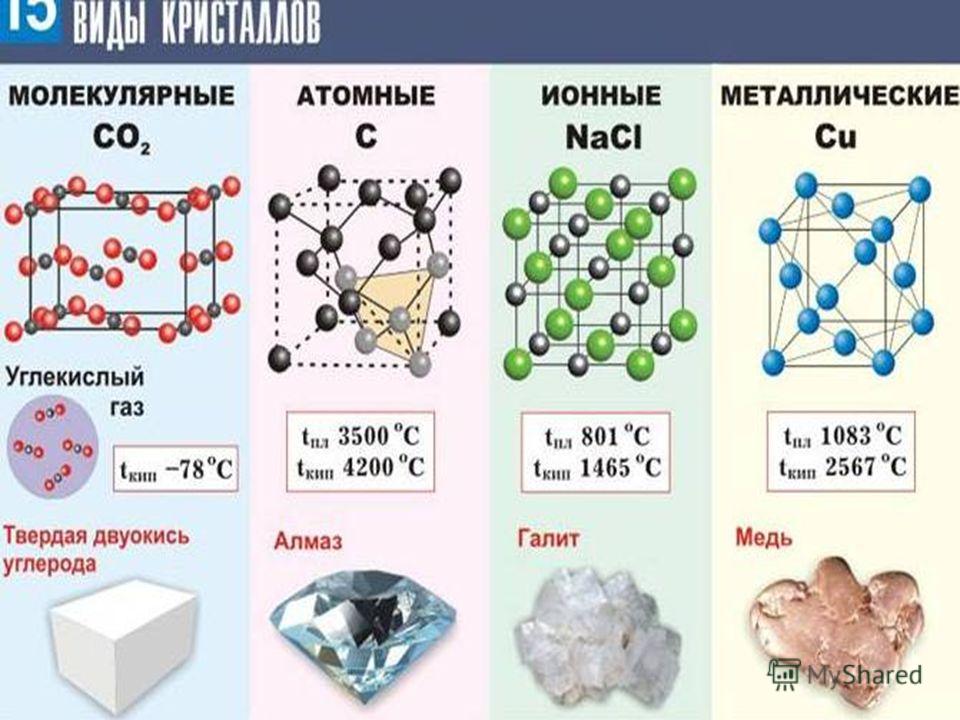

 Море электронов, окружающее протоны, действует как подушка, поэтому, например, когда по металлу ударяют молотком, общий состав структуры металла не повреждается и не изменяется. Протоны могут перестраиваться, но море электронов приспосабливается к новому образованию протонов и сохраняет металл неповрежденным. При перемещении одного слоя ионов в электронном море на одно расстояние по отношению к слою под ним кристаллическая структура не разрушается, а только деформируется (рис. \(\PageIndex{3}\)).
Море электронов, окружающее протоны, действует как подушка, поэтому, например, когда по металлу ударяют молотком, общий состав структуры металла не повреждается и не изменяется. Протоны могут перестраиваться, но море электронов приспосабливается к новому образованию протонов и сохраняет металл неповрежденным. При перемещении одного слоя ионов в электронном море на одно расстояние по отношению к слою под ним кристаллическая структура не разрушается, а только деформируется (рис. \(\PageIndex{3}\)). Электроны на поверхности могут отражать свет с той же частотой, что и свет, падающий на поверхность, поэтому металл кажется блестящим.
Электроны на поверхности могут отражать свет с той же частотой, что и свет, падающий на поверхность, поэтому металл кажется блестящим.


Leave A Comment