Вычисление массовой доли химического элемента в веществе
Вычисление массовой доли химического элемента в веществе.
Массовая доля кислорода в сульфате железа (III) равна: 1) 4,% 2) 16% 3) 48,0% 4) 56,2%
Массовая доля азота в нитрате алюминия равна: 1) 14,0%, 2) 19,7% 3) 6,6% 4) 21,3%
Массовая доля серы в сульфате алюминия равна: 1) 28,1% 2) 9,4% 3) 64,0% 4) 32,0%
Массовая доля кислорода в нитрате алюминия равна: 1) 7,5% 2) 22,5% 3) 42,4% 4) 67,6%
Массовая доля азота в нитрате железа(III) равна: 1) 5,8% 2) 17,4% 3) 28,0% 4) 59,5%
Массовая доля кислорода в нитрате железа (III) равна: 1) 59,5% 2) 6,6% 3) 16,0% 4) 56,1%
Массовая доля железа в нитрате железа(III) равна: 1) 46,2% 2) 17,4% 3) 23,1% 4) 56,0%
Массовая для кислорода в сульфате алюминия равна: 1) 4,7% 2)12,8% 3) 56,1% 4) 16,0%
Массовая доля кислорода в сульфате меди равна: 1) 10,0% 2) 32,0% 3) 16,0% 4) 40,0%
Массовая доля серы в сульфате железа (III) равна: 1) 24,0% 2) 32,0% 3) 8,0% 4) 33,3%
Массовая доля азота в нитрате алюминия равна: 1) 19,7% 2) 27,2% 3) 36,8% 4) 54,9%
Массовая доля серы в сульфате магния равна: 1) 30% 2) 28% 3) 27% 4) 22%
Массовая доля азота в хлориде аммония равна: 1) 26% 2) 35% 3) 14% 4) 28%
Массовая доля кислорода в гидроксиде алюминия равна: 1) 59% 2) 62% 3) 60% 4)70%
Массовая доля водорода в ортофосфорной кислоте равна: 1) 35% 2) 3% 3) 40% 4)30%
Массовая доля водорода в карбонате аммония равна: 1) 10% 2) 8% 3) 4% 4) 9%
Массовая доля кислорода в гидроксиде магния равна: 1) 35% 2) 55,2% 3) 48,5% 4)23,3%
Массовая доля железа в оксиде железа(III) равна: 1) 70% 2) 65% 3) 74% 4) 59%
Массовая доля углерода в этане равна: 1) 70% 2) 90% 3) 80% 4) 60%
Массовая доля водорода в молекуле этанола равна: 1) 13% 2) 15% 3) 25% 4) 23%
Массовая доля магния в сульфате магния равна: 1) 21% 2) 20% 3) 25% 4) 35%
1.
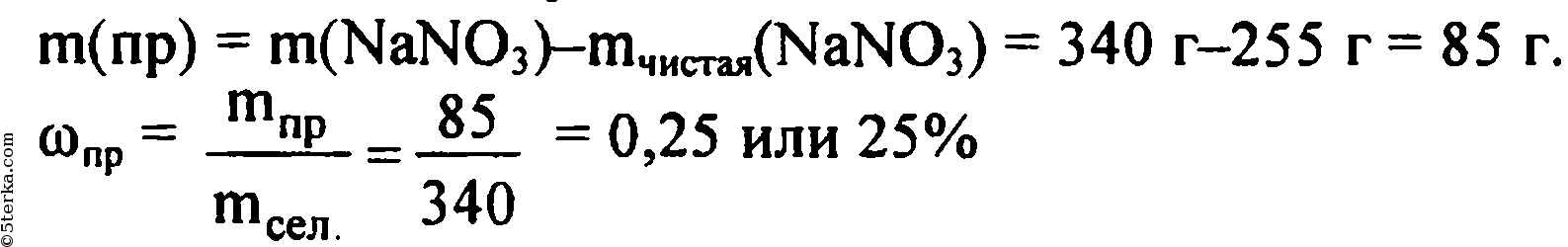 На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфита натрия?
На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфита натрия?Химические свойства оснований и кислот
Химические свойства оснований и кислот 1. В реакцию с раствором гидроксида калия вступает 2. Раствор серной кислоты реагирует с раствором 3. Раствор серной кислоты не реагирует 4. Гидроксид меди(ii) реагирует
Банк заданий химия 9 класс
Банк заданий химия 9 класс 1. Элемент имеет три электрона на 2-м энергетическом уровне. Порядковый номер элемента 3 5 7 13 2. Сколько электронов находится на внешнем уровне элемента с порядковым номером
ПодробнееЗадание 31 ЕГЭ по химии
Верное решение задания 31 должно содержать уравнения четырёх За верную запись каждого уравнения реакции можно получить 1 балл. Максимально за выполнение этого задания можно получить 4 балла. Каждое верное
Экзаменационная работа
Экзаменационная работа для проведения государственной (итоговой) аттестации выпускников IX классов общеобразовательных учреждений 2008 года (в новой форме) по ХИМИИ Демонстрационный вариант 2008 года Район
ПодробнееВариант 5 Вариант 6
Вариант 1 1. Вычислите массовую долю хлорида бария в растворе, приготовленном путем растворения 50г данной соли в 1л воды. 2. Определите молярную концентрацию 40% раствора серной кислоты, плотность которого
2. Определите молярную концентрацию 40% раствора серной кислоты, плотность которого
РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ
РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ Т А Петрова Вниманию читателей предлагаются тренировочные упражнения для учащихся по теме «Количество вещества Расчеты по химическим формулам», которые можно использовать на разных
ПодробнееБанк заданий 11 класс химия
Банк заданий 11 класс химия 1. Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
Подробнее Образовательный портал «РЕШУ ЕГЭ» (
Экзаменационные задания 1. Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили.
ПодробнееВарианты контрольных работ по «Химии»
Варианты контрольных работ по «Химии» Задание к контрольной работе составлено в 4 вариантах. Студент должен выполнить работу по варианту, номер которого соответствует начальной букве фамилии. Вариант 1
ПодробнееID_591 1/6 neznaika.pro
Вариант 3 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 На приведенном рисунке 1 изображен модель атома 1) кремния 2) серы 3) кислорода
Подробнее9 класс. Практическая работа 1. I вариант.
9 класс. Практическая работа 1. Решение экспериментальных задач по теме: «Основные классы неорганических соединений». I вариант. Цель работы: выполняя экспериментальные задачи, повторить свойства оксидов,
I вариант. Цель работы: выполняя экспериментальные задачи, повторить свойства оксидов,
Вариант 2. CuS + HNO 3 Cu(NO 3 ) 2 + H 2 SO 4 + NO 2 + H 2 O
Вариант 1 1. Составьте молекулярные и ионно-молекулярные уравнения реакций, протекающих до образования средних солей, между веществами: а) нитрат цинка + гидроксид калия; б) гидроксид кальция + серная
ПодробнееID_591 1/6 neznaika.pro
Вариант 3 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 На приведенном рисунке 1 1 2 3 4 изображен модель атома 1) кремния 2) серы 3)
характеризующие металл:
Расчетные задачи в неорганической химии 1. Массовая доля металла в оксиде состава характеризующие металл: равна 71,4 %. Выберите утверждения, а) НЕ восстанавливается водородом из оксида б) используется
ПодробнееОЗАДАЧЕННАЯ ХИМИЯ (1-Й ГОД ОБУЧЕНИЯ)
ОЗАДАЧЕННАЯ ХИМИЯ (1-Й ГОД ОБУЧЕНИЯ) Главным критерием отбора учащихся в группы является желание ребенка приобрести навыки решения теоретических задач, выполнения практических работ по определению веществ.
ПодробнееПроверочная работа по химии 9 класс «Подготовка к ОГЭ»
- Пять электронов находятся во внешнем электронном слое атома
1) бора 2) стронция
3) фосфора 4) неона
- Наиболее сильными основными свойствами обладает оксид
1) магния 2) бериллия
3) алюминия 4) натрия
- Веществами с ионной и ковалентной неполярной связью являются соответственно
1) хлорид натрия и хлор 2) водород и хлор
3) хлорид меди(II) и хлороводород 4) вода и магний
- Степень окисления атомов азота в соединении Nh5NO3 равна соответственно
1) −3 и +3 2) −4 и +5
3) +3 и −3 4) −3 и +5
- Названия только простых веществ записаны в ряду:
1) оксид магния, оксид серы(IV) 2) углекислый газ, угарный газ
3) железо, аммиак 4) алмаз, графит
- Взаимодействие раствора сульфата меди(II) с железом относится к реакциям
1) замещения 2) соединения
3) обмена 4) разложения
- Наибольшее число анионов образуется при полной диссоциации 1 моль
1) фосфата калия 2) нитрата натрия
3) сульфата меди(II) 4) хлорида железа(III)
- Осадок образуется при взаимодействии водных растворов
1) нитрата аммония и гидроксида калия 2) соляной кислоты и гидроксида бария
3) нитрата серебра и бромида кальция 4) азотной кислоты и карбоната натрия
- Оксид серы(IV) реагирует с
1) сульфидом меди(II) 2) углеродом
3) кислородом 4) хлоридом железа(II)
- Гидроксид меди(II) реагирует с
1) оксидом бария 2) соляной кислотой
3) хлоридом калия 4) гидроксидом натрия
- В отличие от сульфата натрия, сульфат меди реагирует с
1) водой 2) хлоридом бария
3) нитратом кальция 4) гидроксидом калия
- Верны ли суждения о правилах применения и хранения препаратов бытовой химии?
А. Аэрозоли, использующиеся в качестве средств для борьбы с бытовыми насекомыми, безопасны для детей и животных.
Аэрозоли, использующиеся в качестве средств для борьбы с бытовыми насекомыми, безопасны для детей и животных.
Б. Растворители и моющие средства допускается хранить в доступных для детей местах.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
- Сера является окислителем в реакции
- 2.
- Массовая доля кислорода в гидроксиде железа(II) равна
1) 24,2% 2) 35,6%
3) 56,8% 4) 71,2%
- К раствору сульфата алюминия массой 68,4 г и массовой долей 8% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
Проверочная работа ВАРИАНТ 2
- Три электрона находятся во внешнем электронном слое атома
1) углерода 2) мышьяка
3) алюминия 4) лития
- Наиболее сильными кислотными свойствами обладает высший оксид
1) фосфора 2) кремния
3) хлора 4) алюминия
Соединениями с ковалентной неполярной и ионной связью являются соответственно
- 1) оксид фосфора и оксид натрия 2) хлорид натрия и хлор
3) азот и сульфид натрия 4) хлорид кальция и хлороводород
Валентность хлора в соединениях Cl2O7 и FeCl2 соответственно, равна
- 1) I и II 2) VII и II
3) VII и I 4) VII и III
- К сложным веществам относится
1) иод 2) графит
3) воздух 4) сода
- При нагревании гидроксид меди(II) вступает в реакцию
1) соединения 2) замещения
3) разложения 4) горения
- Наибольшее число анионов образуется при полной диссоциации 1 моль
1) фосфата калия 2) нитрата натрия
3) сульфата меди(II) 4) хлорида железа(III)
8. Для растворения гидроксида железа(II) можно использовать раствор
Для растворения гидроксида железа(II) можно использовать раствор
1) хлорида бария 2) серной кислоты
3) гидроксида натрия 4) нитрата натрия
9. Оксид железа(III) реагирует с
1) гидроксидом меди(II) 2) хлоридом магния
3) серной кислотой 4) оксидом алюминия
10. Раствор серной кислоты взаимодействует
1) только с основными оксидами 2) только с кислотными оксидами
3) с основными и кислотными оксидами 4) с основными и амфотерными оксидами
11. С нитратом меди(II) может взаимодействовать
1) оксид углерода(IV) 2) гидроксид кальция
3) гидроксид железа(II) 4) соляная кислота
12. Верны ли суждения о правилах применения и опасности для здоровья препаратов бытовой химии?
А. Стиральные порошки нельзя использовать для мытья посуды.
Б. Работать с хлорсодержащими дезинфицирующими средствами следует при плотно закрытой двери в помещении.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. N2 является окислителем в реакции с
1. O2 2. h3
h3
14. Массовая доля кислорода в нитрате железа(II) равна
1) 26,7% 2) 34,2%
3) 53,3% 4) 64,6%
15. К раствору силиката калия массой 20,53 г и массовой долей 15% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
ОТВЕТЫ
|
1 ВАРИАНТ |
2 ВАРИАНТ |
||
|
1 |
3 |
1 |
3 |
|
2 |
4 |
2 |
3 |
|
3 |
1 |
3 |
3 |
|
4 |
4 |
4 |
3 |
|
5 |
4 |
5 |
4 |
|
6 |
1 |
6 |
3 |
|
7 |
2 |
7 |
4 |
|
8 |
3 |
8 |
2 |
|
9 |
3 |
9 |
3 |
|
10 |
2 |
10 |
4 |
|
11 |
4 |
11 |
2 |
|
12 |
4 |
12 |
A |
|
13 |
1 |
13 |
2 |
|
14 |
2 |
14 |
3 |
|
15 |
11,184 |
15 |
2,32 |
Тест на химические свойства соединений меди, цинка и железа.

Задание №1
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с железом.
1) сера
2) азот
3) рубидий
4) бром
5) водород
РешениеЗадание №2
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с медью.
1) гелий
2) аргон
3) йод
4) кислород
5) азот
РешениеЗадание №3
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с цинком.
1) водород
2) хлор
3) неон
4) алюминий
5) кислород
РешениеЗадание №4
Из приведенного списка простых веществ выберите два таких, которые не взаимодействуют с железом.
1) кислород
2) йод
3) азот
4) хлор
5) графит
РешениеЗадание №5
Из приведенного списка простых веществ выберите те, которые не взаимодействуют с медью. Число верных ответов может оказаться любым.
1) сера
2) хлор
3) бром
4) кислород
5) азот
РешениеЗадание №6
Из приведенного списка простых веществ выберите те, которые не взаимодействуют с цинком. Число верных ответов может оказаться любым.
1) натрий
2) бром
3) водород
4) кислород
5) озон
РешениеЗадание №7
Из приведенного списка простых веществ выберите два таких, которые не взаимодействуют с железом.
1) йод
2) азот
3) бром
4) сера
5) гелий
РешениеЗадание №8
Из приведенного списка простых веществ выберите те, которые взаимодействуют с медью. Число верных ответов может оказаться любым.
1) азот
2) углерод
3) кремний
4) магний
5) йод
РешениеЗадание №9
Из приведенного списка простых веществ выберите те, которые взаимодействуют с цинком. Число верных ответов может оказаться любым.
1) кислород
2) водород
3) калий
4) фтор
5) хлор
РешениеЗадание №10
Из приведенного списка простых веществ выберите те, которые не взаимодействуют с железом. Число верных ответов может оказаться любым.
Число верных ответов может оказаться любым.
1) марганец
2) сера
3) водород
4) свинец
5) кислород
РешениеЗадание №11
Из приведенного списка веществ выберите такие, которые взаимодействуют с железом. Число верных ответов может оказаться любым.
- 1. HCl(конц.)
- 2. HCl(разб.)
- 3. H2SO4(разб.)
- 4. HBr(конц.)
- 5. NaOH(конц.)
Задание №12
Из приведенного списка веществ выберите такие, которые взаимодействуют с медью. Число верных ответов может оказаться любым.
- 1. HNO3(разб.)
- 2. HNO3(конц.)
- 3. HCl(р-р)
- 4. HBr(р-р)
- 5. H3PO4(оч. разб.)
Задание №13
Из приведенного списка сложных веществ выберите те, которые взаимодействуют с цинком. Число верных ответов может оказаться любым.
- 1. HCl(разб.)
- 2. HNO3(оч. разб.)
- 3. HBr(конц.)
- 4. NaOH(конц.)
- 5. H2SO4(разб.)
Задание №14
Из приведенного списка сложных веществ выберите те, которые не взаимодействуют с железом. Число верных ответов может оказаться любым.
- 1. KOH
- 2. FeCl2
- 3. Al2O3
- 4. Al(OH)3
- 5. FeCl3
Задание №15
Из приведенного списка сложных веществ выберите те, которые не взаимодействуют с медью. Число верных ответов может оказаться любым.
- 1. HBr(р-р)
- 2. HI(р-р)
- 3. FeCl3(р-р)
- 4. FeCl2(р-р)
- 5. ZnO
Задание №16
Из приведенного списка сложных веществ выберите те, которые не взаимодействуют с цинком. Число верных ответов может оказаться любым.
- 1. Al2O3
- 2. KOH
- 3. HBr
- 4. Al2S3
- 5. HNO2
Задание №17
Из приведенного списка сложных веществ выберите те, которые взаимодействуют с железом. Число верных ответов может оказаться любым.
- 1. FeO
- 2. Fe2O3
- 3. H2SO4(хол. конц.)
- 4. RbOH
- 5. CuSO4
Задание №18
Из приведенного списка веществ выберите те, которые взаимодействуют с медью. Число верных ответов может оказаться любым.
- 1. HBr(р-р)
- 2. HNO3(конц.)
- 3. FeBr3
- 4. CrBr3
- 5. AlBr3
Задание №19
Из приведенного списка сложных веществ выберите те, которые взаимодействуют с цинком. Число верных ответов может оказаться любым.
- 1. HI
- 2. CuCl2
- 3. FeCl3
- 4. ZnO
- 5. NaOH
Задание №20
Из приведенного списка сложных веществ выберите те, которые не взаимодействуют с железом. Число верных ответов может оказаться любым.
- 1. HNO3(хол. конц.)
- 2. HNO3(гор. конц.)
- 3. H2SO4(хол. конц.)
- 4. H2SO4(гор. конц.)
- 5. H2SiO3
Задание №21
Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом железа (III).
1) железо
2) нитрат серебра
3) нитрат меди(II)
4) медь
5) хлорид хрома(III)
РешениеЗадание №22
Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом железа(II).
1) азотная кислота
2) серная кислота(разб.)
3) серная кислота(конц.)
4) нитрат железа(III)
5) нитрат цинка
РешениеЗадание №23
Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом меди.
1) цинк
2) нитрат цинка
3) нитрат свинца
4) сероводород
5) бромоводород
РешениеЗадание №24
Из приведенного списка веществ выберите два таких, которые взаимодействуют с раствором нитрата цинка.
1) хлорид калия
2) карбонат кальция
3) карбонат натрия
4) медь
5) сульфид натрия
РешениеЗадание №25
Из приведенного списка веществ выберите два таких, которые взаимодействуют с бромидом железа(III).
1) золото
2) медь
3) нитрат меди
4) нитрат серебра
5) йод
РешениеЗадание №26
Из приведенного списка веществ выберите два таких, которые взаимодействуют с хлоридом железа(II).
1) хлор
2) медь
3) железо
4) нитрат серебра
5) сульфид меди (II)
РешениеЗадание №27
Из приведенного списка веществ выберите два таких, которые взаимодействуют с бромидом меди(II).
1) серебро
2) медь
3) йодоводородная кислота
4) бромоводородная кислота
5) хлороводородная кислота
РешениеЗадание №28
Из приведенного списка веществ выберите два таких, которые взаимодействуют с йодидом цинка.
1) хлорид калия
2) карбонат кальция
3) хлорид меди(II)
4) хлорид железа(III)
5) хлорид хрома(III)
РешениеЗадание №29
Из приведенного списка веществ выберите два таких, которые не взаимодействуют с водным раствором нитрата железа (II).
1) азотная кислота
2) йодид калия
3) сульфат натрия
4) бром
5) алюминий
РешениеЗадание №30
Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом меди в водном растворе.
1) перекись водорода
2) серная кислота (разб.)
3) сероводород
4) хлор
5) йодид аммония
РешениеЗадание №31
Из предложенного перечня выберите те пары реагентов, между которыми в водном растворе протекает реакция с выделением газа. Число верных ответов может оказаться любым.
Число верных ответов может оказаться любым.
1) карбонат свинца + нитрат железа(II)
2) карбонат калия + нитрат железа(III)
3) карбонат аммония + едкий натр
4) едкий натр + цинк
5) едкий натр + медь
РешениеЗадание №32
Из предложенного перечня выберите те пары реагентов, между которыми в водном растворе протекает реакция, сопровождающаяся образованием осадка. Число верных ответов может оказаться любым.
1) нитрат железа(II) + йодид натрия
2) нитрат железа(III) + йодид калия
3) сульфат меди + бромид аммония
4) сульфат меди + бромид бария
5) сульфат меди + иодид натрия
РешениеЗадание №33
Из предложенного перечня выберите те пары реагентов, между которыми в водном растворе протекает реакция, сопровождающаяся растворением осадка. Число верных ответов может оказаться любым.
1) гидроксид меди + гидроксид натрия
2) гидроксид железа (II) + гидроксид цезия
3) гидроксид хрома (III) + поташ
4) гидроксид железа (II) + едкое кали
5) гидроксид цинка + гидроксид стронция
РешениеЗадание №34
Из предложенного перечня выберите те пары реагентов, при смешении которых в водном растворе не наблюдается выделение газа. Число верных ответов может оказаться любым.
1) нитрат алюминия + сульфид натрия
2) нитрат меди + сульфид натрия
3) нитрат железа(III) + сульфид натрия
4) гидроксид цинка + нитрат аммони
5) хлорид железа(III) + карбонат калия
РешениеЗадание №35
Из предложенного перечня выберите те пары реагентов, при смешении которых в водном растворе не наблюдается образование осадка.
1) нитрат меди + сероводород
2) нитрат железа(III) + сероводород
3) нитрат цинка + сероводород
4) хлорид меди(II) + едкий натр(избыток)
5) едкий натр(избыток) + бромид цинка
РешениеЗадание №36
Из приведённого перечня выберите те реагенты, между которыми невозможна реакция в водном растворе.
1) сульфат цинка + сернистый газ
2) сульфат железа (III) + сернистый газ
3) сульфат железа (II) + сернистый газ
4) сульфат железа (III) + сероводород
5) сульфат цинка + сероводород
РешениеЗадание №37
Из предложенного перечня выберите те реагенты, при смешении которых не наблюдается растворение осадка.
Число верных ответов может оказаться любым.
1) сульфид меди (II) + соляная кислота
2) сульфид цинка + соляная кислота
3) сульфид железа (II) + соляная кислота
4) сульфид меди (I) + азотная кислота(конц.)
5) сульфид меди (II) + азотная кислота(конц.)
РешениеЗадание №38
Из приведённого перечня выберите те реагенты, при смешении которых в водном растворе наблюдается выделение газа.
Число верных ответов может оказаться любым.
1) сульфат железа (III) + карбонат калия
2) сульфат меди (II) + карбонат кальция
3) сульфид цинка + бромоводородная кислота
4) сульфид меди + фосфорная кислота
5) карбонат цинка + азотная кислота
РешениеЗадание №39
Из приведённого перечня выберите такое вещество, с которым способно реагировать железо.
1) аргон
2) бром
3) водород
4) гелий
5) фосфор
Запишите уравнение этой реакции
РешениеОтвет: 2Fe + 3Br2 = 2FeBr3
Задание №40
В какой из приведенных пар веществ возможна окислительно-восстановительная реакция?
1) гидроксид железа (III) + соляная кислота
2) гидроксид железа (II) + соляная кислота
3) гидроксид железа (III) + бромоводородная кислота
4) гидроксид железа (II) + плавиковая кислота
5) гидроксид железа (III) + йодоводородная кислота
Запишите уравнение этой реакции
РешениеОтвет: 2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
Задание №41
В какой из приведенных пар веществ возможна окислительно-восстановительная реакция?
1) хлорид железа(III) + нитрат серебра
2) бромид железа(II) + нитрат свинца
3) хлорид железа(III) + сульфид натрия
4) бромид железа(II) + сульфид калия
5) хлорид железа(III) + нитрат меди
Запишите уравнение этой реакции
РешениеОтвет: 2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
Задание №42
В какой из приведенных пар веществ возможна окислительно-восстановительная реакция?
1) сульфат железа(III) + карбонат калия
2) сульфат железа(II) сульфат аммония
3) сульфат железа(III) + сульфит натрия
4) сульфат железа(II) + карбонат цинка
5) сульфат железа(III) + нитрат меди
Запишите уравнение этой реакции
РешениеОтвет: Fe2(SO4)3 + Na2SO3 + H2O = 2FeSO4 + Na2SO4 + H2SO4
Задание №43
Из приведенного перечня веществ выберите такое, с которым способна взаимодействовать металлическая медь.
1) хлорид хрома (II)
2) бромид марганца (II)
3) йодид калия
4) бромид железа (II)
5) хлорид железа (III)
Запишите уравнение этой реакции
РешениеОтвет: Cu + 2FeCl3 = CuCl2 + 2FeCl2
Задание №44
Из приведенного перечня выберите такую пару реагентов, между которыми возможна окислительно-восстановительная реакция.
1) хлорид меди(II) + нитрат серебра
2) бромид меди(II) + фторид аммония
3) сульфат меди(II) + иодид калия
4) нитрат меди(II) + сульфат бария
5) хлорид меди(II) + бромид железа (III)
Запишите уравнение этой реакции
РешениеОтвет: 2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4
Задание №45
Из приведенного перечня веществ выберите такое, которое способно вступать в реакцию с металлической медью.
1) водород
2) азот
3) йод
4) аргон
5) графит
Запишите уравнение этой реакции
РешениеОтвет: 2Cu + I2 = 2CuI
Задание №46
Из приведенного перечня веществ выберите такое, которое способно вступать в реакцию с металлическим цинком.
1) гидроксид алюминия
2) гидроксид бериллия
3) гидроксид железа(II)
4) гидроксид калия(раствор)
5) гидроксид меди(II)
Запишите уравнение этой реакции
РешениеОтвет: Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Задание №47
Железо растворили в горячей концентрированной серной кислоте.
Запишите уравнение этой реакции
РешениеОтвет: 2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Задание №48
Железо растворили в горячей концентрированной азотной кислоте.
Запишите уравнение этой реакции
РешениеОтвет: Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O
Задание №49
Запишите уравнение реакции, протекающей при обжиге сульфида железа(II).
Ответ: 4FeS + 7O2 = 2Fe2O3 + 4SO2
Задание №50
Запишите уравнение реакции, протекающей при обжиге пирита.
РешениеОтвет: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Задание №51
Запишите уравнение реакции, протекающей при образовании железной окалины из простых веществ.
РешениеОтвет: 3Fe + 2O2 = Fe3O4
Задание №52
Запишите уравнение реакции, протекающей между железной окалиной и избытком соляной кислоты.
РешениеОтвет: Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
Задание №53
Запишите уравнение реакции, протекающей между железной окалиной и концентрированной азотной кислотой.
РешениеОтвет: Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Задание №54
Запишите уравнение реакции, протекающей между железной окалиной и йодоводородной кислотой.
РешениеОтвет: Fe3O4 + 8HI = 3FeI2 + I2 + 4H2O
Задание №55
Запишите уравнение реакции, протекающей между оксидом железа(II) и концентрированной азотной кислотой.
РешениеОтвет: FeO + 4HNO3 = Fe(NO3)3 + NO2 + 2H2O
Задание №56
Запишите уравнение реакции, протекающей при сплавлении порошков железа и оксида железа(III)
РешениеОтвет: Fe2O3 + Fe = 3FeO
Задание №57
Запишите уравнение реакции, протекающей при сплавлении едкого натра и оксида железа(III).
РешениеОтвет: Fe2O3 + 2NaOH = 2NaFeO2+ H2O
Задание №58
Запишите уравнение реакции, протекающей между медным порошком и концентрированной азотной кислотой.
Ответ: Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Задание №59
Запишите уравнение реакции, протекающей между медным порошком и разбавленной азотной кислотой.
РешениеОтвет: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Задание №60
Запишите уравнение реакции, протекающей между оксидом меди(I) и концентрированной азотной кислотой.
РешениеОтвет: Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2 + 3H2O
Задание №61
Запишите уравнение реакции, протекающей между оксидом меди(I) и концентрированной серной кислотой.
РешениеОтвет: Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
Задание №62
Запишите уравнение реакции, протекающей между концентрированной азотной кислотой и сульфидом меди(II).
РешениеОтвет: CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O
Задание №63
Запишите уравнение реакции, протекающей при обжиге сульфида меди(II) в токе кислорода.
РешениеОтвет: 2CuS + 3O2 = 2CuO + 2SO2
Задание №64
Запишите уравнение реакции, протекающей между металлическим цинком и раствором гидроксида натрия.
РешениеОтвет: Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Задание №65
Запишите уравнение реакции, протекающей при сплавлении оксида цинка с гидроксидом калия.
РешениеОтвет: 2KOH + ZnO = K2ZnO2 + H2O
Задание №66
Запишите уравнение реакции, протекающей при обжиге сульфида цинка в токе кислорода.
РешениеОтвет: 2ZnS + 3O2 = 2ZnO + 2SO2
Задание №67
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) CuCl Б) Fe В) ZnO | 1) Cl2, CuCl2, Pb(NO3)2 2) Br2, He, AgNO3 3) KOH, HCl, H2SO4 4) Cl2, Br2, HNO3(холконц.) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №68
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) CuO Б) FeO В) ZnO | 1) H2O, HCl, HNO3 2) H2, HBr, KOH 3) Cu, HCl, H2SO4 4) Al, O2, CO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №69
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) CuO Б) FeS В) ZnS | 1) O2, HCl, HNO3 2) O3, HBr, Cu 3) CO, HI, Ag 4) CO, HCl, H2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №70
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) CuSO4 Б) FeSO4 В) ZnS | 1) H2O2, H2SO4(конц), BaCl2 2) KOH, SrCl2, H2S 3) NaOH, H2S, HNO3(конц) 4) HCl, O2, HBr |
Запишите в таблицу выбранные цифры под соответствующими буквами.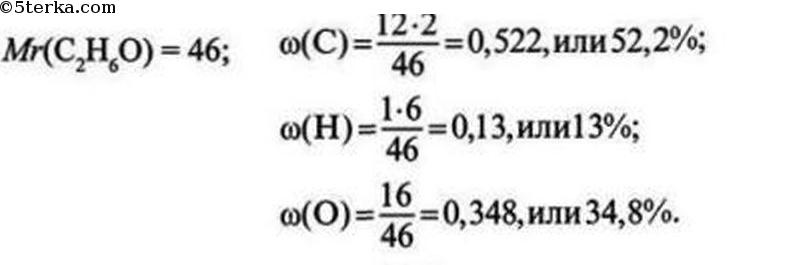
Задание №71
Установите соответствие между формулой/названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) CuCl2 Б) ZnI2 В) FeBr3 | 1) KOH, Cl2, KF 2) NaOH, H2S, Zn 3) ZnS, Br2, HI 4) AgNO3, Cl2, CuSO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №72
Установите соответствие между формулой/названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) Fe(OH)2 Б) Fe В) Fe(OH)3 | 1) HCl, H2O2, HNO3 2) HBr, S, CuSO4 3) H2SO4(разб), HI, He 4) HCl, KOH, HNO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №73
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) Cu Б) CuO В) Cu2O | 1) H2, Cu, HNO3 2) H2, O2, HNO3 3) N2, HCl, HBr 4) O2, HNO3, FeCl3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №74
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) ZnSO4 Б) Cu(NO3)2 В) FeI2 | 1) HI, O2, N2 2) KOH, KI, H2S 3) Br2, Cl2, AgNO3 4) NaOH, BaCl2, Sr(NO3)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №75
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) Zn(OH)2 Б) Fe(OH)2 В) Cu | 1) H2, O2, HNO3 2) HCl, HI, KOH 3) HNO3, HBr, H2O2 4) O2, Br2, HNO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №76
Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) Li2ZnO2 Б) Ba[Zn(OH)4] В) Zn(OH)2 | 1) HCl, H2O, HNO3 2) HNO3, H2O, H2 3) HBr, K2SO4, SO2 4) HI, KOH, H2SO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №77
Навеску сплава меди и цинка массой 10 г растворили в необходимом количестве концентрированной азотной кислоты. Определите массовую долю цинка в сплаве, если при пропускании через полученный раствор сероводорода выпало 9,6 г черного осадка. Ответ округлите до целых.
Определите массовую долю цинка в сплаве, если при пропускании через полученный раствор сероводорода выпало 9,6 г черного осадка. Ответ округлите до целых.
Задание №78
Навеску смеси железного и цинкового порошков массой 2,33 г обработали избытком разбавленной соляной кислоты. При этом выделилось 896 мл газа. При обработке такой же навески избытком раствора едкого кали выделилось 224 мл газа. Определите массовую долю железа в сплаве. Ответ укажите в процентах и округлите до десятых.
РешениеЗадание №79
При полном окислении навески порошков меди и железа было израсходовано 4,48 л хлора. При внесении такой же навески в избыток бромоводородной кислоты выделилось 2,24 л газа. Определите массовую долю меди в сплаве. Ответ округлите до десятых.
РешениеЗадание №80
Смесь железных и цинковых опилок массой 1,815 г растворили в 200 г 18,25% соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе, если известно, что массовая доля железа в исходной смеси 46,28%. Ответ округлите до целых.
РешениеЗадание №81
Рассчитайте массу угарного газа, необходимого для полного восстановления твердого остатка, полученного при прокаливании смеси 9 г нитрата железа(II) и 9,4 г нитрата меди. Ответ округлите до десятых.
РешениеЗадание №82
Рассчитайте объем 30%-ного раствора серной кислоты, необходимой для растворения твердого остатка, полученного при разложении смеси 2,1 г карбоната магния и 18,9 г нитрата цинка. Плотность раствора серной кислоты 1,3 г/см3. Ответ округлите до десятых.
РешениеЗадание №83
Вычислите массу осадка, который выпадет при пропускании 11,2 л сероводорода через раствор, полученный при взаимодействии 3,2 г меди и 10,87 мл 80%-ного раствора азотной кислоты (плотность 1,45 г/см3). Ответ округлите до десятых.
РешениеЗадание №84
Навеску меди массой 12,8 г внесли в 300 мл 70% раствора азотной кислоты (плотность 1,35 г/мл). После окончания реакции к раствору добавили 100 мл 10% поташа (плотность 1,1 г/см3). Определите массовую долю кислоты в полученном растворе. Ответ округлите до десятых.
После окончания реакции к раствору добавили 100 мл 10% поташа (плотность 1,1 г/см3). Определите массовую долю кислоты в полученном растворе. Ответ округлите до десятых.
Задание №85
Навеску оксида меди(I) массой 3,6 г полностью растворили в избытке концентрированной серной кислоты. Полученный раствор имел массу 50 г. Далее в раствор погрузили графитовые электроды и проводили процесс электролиза до выделения на аноде 112 мл газа. Определите массовую долю соли в полученном растворе. Ответ округлите до сотых.
РешениеЗадание №86
При электролизе раствора хлорида меди(II) на аноде выделилось 6,72 л газа. Полученный на катоде металл растворили в необходимом количестве концентрированной азотной кислоты. Рассчитайте объем сероводорода, необходимый для полного осаждения меди из полученного раствора. Ответ округлите до сотых.
РешениеЗадание №87
Навеску нитрата серебра массой 17 г растворили в воде и проводили электролиз полученного раствора до выделения на аноде 224 мл газа. Определите массу хлороводорода, необходимого для полного осаждения оставшегося серебра из раствора. Ответ округлите до сотых.
РешениеЗадание №88
Навеску нитрата меди массой 9,4 г растворили в воде и проводили электролиз полученного раствора до выделения на аноде 448 мл газа. Определите массу 20% раствора гидроксида натрия, необходимую для полного осаждения оставшегося металла из раствора. Ответ округлите до целых.
РешениеЗадание №89
При электролизе 100 г раствора сульфата меди масса на электродах выделилось 1,6 г веществ. Определите массу 10 %-ного раствора нитрата бария, необходимую для полного осаждения сульфат-ионов из исходного раствора. Ответ округлите до десятых.
РешениеЗадание №90
Навеску бромида меди(II) растворили в 50 мл воды и проводили электролиз полученного раствора до полного расходования соли. Определите массовую долю соли в исходном растворе, если полученное на аноде вещество может прореагировать с 30 мл 10% раствора гидроксида калия (плотность 1,12 г/см3). Ответ округлите до сотых.
Ответ округлите до сотых.
Задание №91
Навеску нитрата железа (III) массой 12,1 г подвергли термическому разложению. Определите объем газа, который выделится при сплавлении полученного твердого остатка с поташом. Ответ укажите в литрах и округлите до сотых.
РешениеЗадание №92
Навеску смеси нитрата меди и нитрата цинка с массовой долей нитрата цинка 50% полностью разложили при нагревании. Определите суммарный объем выделившихся газов, если известно, что полученный твердый остаток может прореагировать с 100 г 10%-ного раствора гидроксида натрия. Ответ округлите до целых.
РешениеЗадание №93
Навеску смеси карбоната и нитрата цинка обработали избытком соляной кислоты. При этом выделилось 6,72 л газа. При прокаливании такой же навески выделилось 17,92 л газов. Определите массовую долю карбоната цинка в исходной смеси. Ответ округлите до десятых.
РешениеЗадание №94
Навеску нитрата меди массой 47 г подвергли частичному разложению при нагревании. Полученный твердый остаток внесли в 200 мл 20% раствора гидроксида натрия (плотность 1,1 г/см3). Определите массовую долю щелочи в полученном растворе, если известно, что при прокаливании навески выделилось 11,2 л газов. Ответ округлите до десятых.
РешениеМолекулярная масса нитрата железа (ii)
Молярная масса of Fe (NO3) 2 = 179,8548 г / моль
Перевести граммы нитрата железа (ii) в моль или моль нитрата железа (ii) в граммы
Расчет молекулярной массы:
55,845 + (14,0067 + 15,9994 * 3) * 2
| Элемент | Условное обозначение | Атомная масса | Количество атомов | Массовый процент |
| Железо | Fe | 55. 845 845 | 1 | 31,050% |
| Азот | N | 14.0067 | 2 | 15.576% |
| Кислород | O | 15,9994 | 6 | 53,374% |
Обратите внимание, что все формулы чувствительны к регистру.
Вы хотели найти молекулярную массу одной из этих похожих формул?
Fe (NO3) 2
Fe (No3) 2
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Массовый процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества.Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Как рассчитать массовый процентный состав
Это отработанный пример задачи, показывающий, как рассчитать массовый процентный состав. Процентный состав указывает относительные количества каждого элемента в соединении. Для каждого элемента формула массового процента:
% массы = (масса элемента в 1 моль соединения) / (молярная масса соединения) x 100%
или же
массовый процент = (масса растворенного вещества / масса раствора) x 100%
Единицами массы обычно являются граммы.Массовый процент также известен как массовый процент или мас.%. Молярная масса — это сумма масс всех атомов в одном моль соединения. Сумма всех массовых процентов должна составлять в сумме 100%. Следите за ошибками округления в последней значащей цифре, чтобы убедиться, что все проценты суммируются.
Ключевые выводы
- Состав в массовых процентах описывает относительные количества элементов в химическом соединении.
- Состав в массовых процентах также известен в процентах по массе.Это сокращенно обозначается как мас. / Мас.%.
- Для раствора массовый процент равен массе элемента в одном моль соединения, деленной на молярную массу соединения, умноженную на 100%.
Задача массового процентного состава
Бикарбонат соды (гидрокарбонат натрия) используется во многих коммерческих препаратах. Его формула — NaHCO 3 . Найдите массовые проценты (мас.%) Na, H, C и O в гидрокарбонате натрия.
Его формула — NaHCO 3 . Найдите массовые проценты (мас.%) Na, H, C и O в гидрокарбонате натрия.
Решение
Сначала найдите атомные массы для элементов Периодической таблицы.Найдены атомные массы:
- Na — 22,99
- H — 1,01
- C — 12,01
- O — 16,00
Затем определите, сколько граммов каждого элемента содержится в одном моль NaHCO 3 :
- 22,99 г (1 моль) Na
- 1,01 г (1 моль) H
- 12,01 г (1 моль) C
- 48,00 г (3 моль x 16,00 грамм на моль) O
Масса одного моля NaHCO 3 составляет:
22.99 г + 1,01 г + 12,01 г + 48,00 г = 84,01 г
И массовые проценты элементов равны
- масс.% Na = 22,99 г / 84,01 г x 100 = 27,36%
- масс.% H = 1,01 г / 84,01 г x 100 = 1,20%
- масс% C = 12,01 г / 84,01 г x 100 = 14,30%
- масс% O = 48,00 г / 84,01 г x 100 = 57,14%
Ответ
- мас.% Na = 27,36%
- мас.% H = 1,20%
- мас.% C = 14,30%
- мас.% O = 57.14%
При вычислении массовых процентов всегда рекомендуется проверять, чтобы ваши массовые проценты в сумме составляли 100% (помогает отловить математические ошибки):
27,36 + 14,30 + 1,20 + 57,14 = 100,00
Процентный состав воды
Другой простой пример — определение массового процентного содержания элементов в воде, H 2 O.
Сначала найдите молярную массу воды, сложив атомные массы элементов.Используйте значения из периодической таблицы:
- H составляет 1,01 грамма на моль
- O составляет 16,00 граммов на моль
Получите молярную массу, сложив все массы элементов в соединении. Нижний индекс после водорода (H) указывает на наличие двух атомов водорода. После кислорода (O) нет индекса, что означает, что присутствует только один атом.
- молярная масса = (2 x 1,01) + 16,00
- молярная масса = 18,02
Теперь разделите массу каждого элемента на общую массу, чтобы получить массовые проценты:
мас.% H = (2 x 1.01) / 18,02 x 100%
мас.% H = 11,19%
% масс O = 16,00 / 18,02
% масс O = 88,81%
Сумма массовых процентов водорода и кислорода составляет 100%.
Массовый процент диоксида углерода
Каковы массовые проценты углерода и кислорода в двуокиси углерода, CO 2 ?
Массово-процентный раствор
Шаг 1: Найдите массу отдельных атомов.
Найдите атомные массы углерода и кислорода в Периодической таблице.На этом этапе рекомендуется определиться с количеством значащих цифр, которые вы будете использовать. Найдены атомные массы:
- C составляет 12,01 г / моль
- O составляет 16,00 г / моль
Шаг 2: Найдите количество граммов каждого компонента, составляющего один моль CO 2.
Один моль CO 2 содержит 1 моль атомов углерода и 2 моля атомов кислорода.
- 12,01 г (1 моль) C
- 32,00 г (2 моль x 16.00 грамм на моль) O
Масса одного моля CO 2 составляет:
- 12,01 г + 32,00 г = 44,01 г
Шаг 3: Найдите массовый процент каждого атома.
% масс = (масса компонента / масса в целом) x 100
И массовые проценты элементов равны
Для углерода:
- мас.% C = (масса 1 моля углерода / масса 1 моль CO 2 ) x 100
- мас.% C = (12.01 г / 44,01 г) x 100
- мас.% C = 27,29%
Для кислорода:
- мас.% O = (масса 1 моль кислорода / масса 1 моль CO 2 ) x 100
- мас.% O = (32,00 г / 44,01 г) x 100
- мас.% O = 72,71%
Ответ
- мас.
 % C = 27,29%
% C = 27,29% - мас.% O = 72,71%
Опять же, убедитесь, что ваши массовые проценты в сумме составляют 100%. Это поможет отловить любые математические ошибки.
Сумма ответов составляет 100%, чего и следовало ожидать.
Советы по расчету массового процента
- Вам не всегда будет дана общая масса смеси или раствора. Часто вам нужно складывать массы. Это может быть неочевидно. Вам могут быть заданы мольные доли или моль, а затем необходимо преобразовать их в единицу массы.
- Следите за своими значащими цифрами.
- Всегда проверяйте, чтобы сумма массовых процентов всех компонентов в сумме составляла 100%.Если этого не произошло, вам нужно вернуться и найти свою ошибку.
8,03: Молярная масса — Chemistry LibreTexts
Теперь, когда мы знаем, как преобразовывать атомы в молекулы, из молекул в моли и из молей в граммы, мы можем связать эти коэффициенты преобразования вместе для решения более сложных задач.
Пример \ (\ PageIndex {6} \): преобразование граммов в атомы
Сколько атомов водорода в 4,6 г CH 3 OH?
Решение
Сначала нам нужно определить массу одного моля метана (CH 3 OH).
Используя таблицу Менделеева, чтобы найти массу каждого моля наших элементов, мы имеем:
\ [1 \, мол \, C \, = 1 \, \ cancel {мол \, C} \, \ times \ left (\ frac {12.011 \, g \, C} {1 \, \ cancel {мол \, C}} \ right) \, = 12.011 \, g \, C \]
\ [4 \, мол \, H \, = 4 \, \ cancel {мол \, H} \, \ times \ left (\ frac {1.008 \, g \, H} {1 \, \ cancel {мол \, H}} \ right) \, = 4.032 \, g \, H \]
\ [1 \, мол \, O \, = 1 \, \ cancel {мол \, O} \, \ times \ left (\ frac {15.999 \, g \, O} {1 \, \ cancel {мол \, O}} \ right) \, = 15.999 \, г \, О \]
Добавление масс наших отдельных элементов:\ [12.011 \, g \, + \, 4.032 \, g \, + \, 15.999 \, g \, = \, 32.042 \, g \, CH_ {3} OH \]
Поскольку мы вычисляли молярную массу CH 3 OH, мы имеем
\ [32. 042 \, г \, CH_ {3} OH \, = \, 1 \, моль \, CH_ {3} OH \]
042 \, г \, CH_ {3} OH \, = \, 1 \, моль \, CH_ {3} OH \]
Что мы можем использовать в качестве коэффициента преобразования
\ [\ frac {32.042 \, g \, CH_ {3} OH} {1 \, моль \, CH_ {3} OH} \ или \, \ frac {1 \, моль \, CH_ {3} OH } {32.042 \, g \, CH_ {3} OH} \]
Мы также знаем, что на каждую молекулу CH 3 OH приходится 4 атома H.{23} \, atom \, H \]
Пример \ (\ PageIndex {7} \): преобразование граммов в граммы
Сколько граммов кислорода содержится в 3,45 г H 3 PO 4
Решение
Сначала нам нужно определить массу одного моля фосфорной кислоты \ (\ ce {H_ {3} PO_ {4}} \)
У нас:
\ [3 \, мол \, H \, = 3 \, \ cancel {мол \, H} \, \ times \ left (\ frac {1.008 \, g \, H} {1 \, \ cancel {мол \, H}} \ right) \, = 3.024 \, g \, H \]
\ [1 \, мол \, P \, = 1 \, \ cancel {мол \, P} \, \ times \ left (\ frac {30.974 \, g \, P} {1 \, \ cancel {мол \, P}} \ right) \, = 30.974 \, g \, P \]
\ [4 \, мол \, O \, = 4 \, \ cancel {мол \, O} \, \ times \ left (\ frac {15.999 \, g \, O} {1 \, \ cancel {мол \, O}} \ right) \, = 63.996 \, g \, O \]
Добавление масс наших отдельных элементов:\ [3.024 \, g \, + \, 30.974 \, g \, + \, 63.996 \, g \, = \, 97.994 \, g \, H_ {3} PO_ {4} \]
Поскольку мы вычисляли молярную массу CH 3 OH, мы имеем
\ [97.994 \, g \, H_ {3} PO_ {4} \, = \, 1 \, mol \, H_ {3} PO_ {4} \]
Что мы можем использовать в качестве коэффициента преобразования
\ [\ frac {97.994 \, g \, H_ {3} PO_ {4}} {1 \, мол \, H_ {3} PO_ {4}} \ или \, \ frac {1 \, мол \, H_ {3} PO_ {4}} {97.994 \, g \, H_ {3} PO_ {4}} \]
Для расчета молярной массы \ (\ ce {H_ {3} PO_ {4}}) \ мы использовали идею, что у нас есть 3 моля H, 1 моль P и 4 моля O на каждый моль \ (\ ce {H_ {3} PO_ {4}}). Напоминаем, что мы можем создавать собственные коэффициенты пересчета, если верхняя и нижняя границы равны друг другу. Точно так же я могу дать вам четыре четверти или 1 доллар, если я передам вам моль \ (\ ce {H_ {3} PO_ {4}}). Я передал вам 3 моля H, 1 моль P и 4 моля O.Поскольку это правда, мы можем использовать дополнительный набор коэффициентов преобразования:
Точно так же я могу дать вам четыре четверти или 1 доллар, если я передам вам моль \ (\ ce {H_ {3} PO_ {4}}). Я передал вам 3 моля H, 1 моль P и 4 моля O.Поскольку это правда, мы можем использовать дополнительный набор коэффициентов преобразования:
\ [\ left (\ frac {3 \, моль \, H} {1 \, моль \, H_ {3} PO_ {4}} \ right) \ и \, \ left (\ frac {1 \, моль \, P} {1 \, моль \, H_ {3} PO_ {4}} \ right) \ и \, \ left (\ frac {4 \, моль \, O} {1 \, моль \, H_ {3} PO_ {4}} \ right) \]
Теперь мы можем вернуться к начальному значению, указанному в вопросе:
\ [3.45 \, \ cancel {g \, H_ {3} PO_ {4}} \, \ times \, \ left (\ frac {1 \, \ cancel {мол \, H_ {3} PO_ {4}) }} {97.994 \, \ cancel {g \, H_ {3} PO_ {4}}} \ right) \ times \ left (\ frac {4 \, \ cancel {мол \, O}} {1 \, \ отменить {\, мол \, H_ {3} PO_ {4}}} \ right) \ times \ left (\ frac {15.999 \, g \, O} {1 \ cancel {мол \, O}} \ right) = 2.25 \, g \, O \]
Материалы в конце главы
Пожалуйста, убедитесь, что вы знакомы с темами, обсуждаемыми в разделе «Основные навыки 2» (раздел 3.7 «Основные навыки 2»), прежде чем переходить к проблемам приложения. Проблемы, отмеченные знаком ♦, связаны с несколькими концепциями.
Сероводород — ядовитый и токсичный газ, образующийся при разложении органических веществ, содержащих серу.Смертельная концентрация у крыс соответствует вдыхаемой дозе 715 молекул на миллион молекул воздуха. Сколько молекул это соответствует на моль воздуха? Сколько молей сероводорода приходится на моль воздуха?
Бром, который иногда получают из рассолов (соленых озер) и океанской воды, можно использовать для отбеливания волокон и шелка. Сколько молей атомов брома содержится в 8,0 г молекулярного брома (Br 2 )?
Парижский желтый — соединение свинца, которое используется в качестве пигмента; он содержит 16. 09% хрома, 19,80% кислорода и 64,11% свинца. Какова эмпирическая формула парижского желтого цвета?
09% хрома, 19,80% кислорода и 64,11% свинца. Какова эмпирическая формула парижского желтого цвета?
Конкретное соединение хрома, используемое для окрашивания и гидроизоляции тканей, имеет элементный состав 18,36% хрома, 13,81% калия, 45,19% кислорода и 22,64% серы. Какова эмпирическая формула этого соединения?
Соединения с алюминием и кремнием обычно встречаются в глинистых фракциях почв, образованных из вулканического пепла.Одним из этих соединений является вермикулит , который образуется в реакциях, вызванных воздействием погоды. Вермикулит имеет следующую формулу: Ca 0,7 [Si 6,6 Al 1,4 ] Al 4 O 20 (OH) 4 . (Содержание кальция, кремния и алюминия не отображается в виде целых чисел, поскольку относительные количества этих элементов варьируются от образца к образцу.) Каков массовый процент каждого элемента в этом образце вермикулита?
♦ Феромоны — это химические сигналы, выделяемые членом одного вида, чтобы вызвать реакцию у другого члена того же вида.Один феромон медоносной пчелы — это органическое соединение, известное как феромон тревоги, который пахнет бананами. Он вызывает агрессивную атаку со стороны других медоносных пчел, заставляя рой разъяренных пчел атаковать того же агрессора. В состав этого феромона тревоги входят 64,58% углерода, 10,84% водорода и 24,58% кислорода по массе, а его молекулярная масса составляет 130,2 а.е.м.
- Рассчитайте эмпирическую формулу этого феромона.
- Определите его молекулярную формулу.
- Если предположить, что пчела выделяет 1,00 × 10 −11 г чистого феромона, сколько молекул феромона выделяется?
Амоксициллин — это лекарство, отпускаемое по рецепту, которое используется для лечения широкого спектра бактериальных инфекций, включая инфекции среднего уха, верхних и нижних дыхательных путей. Он разрушает клеточные стенки бактерий, что приводит к их гибели. Элементный состав амоксициллина 52.59% углерода, 5,24% водорода, 11,50% азота, 21,89% кислорода и 8,77% серы по массе. Какова его эмпирическая формула?
Он разрушает клеточные стенки бактерий, что приводит к их гибели. Элементный состав амоксициллина 52.59% углерода, 5,24% водорода, 11,50% азота, 21,89% кислорода и 8,77% серы по массе. Какова его эмпирическая формула?
Глутамат натрия (глутамат натрия; молярная масса = 169 г / моль) используется в качестве усилителя вкуса при приготовлении пищи. Известно, что у некоторых людей он вызывает головные боли и боли в груди, так называемый синдром китайской еды. В его составе было 35,51% углерода, 4,77% водорода, 8,28% азота и 13,59% натрия по массе.Если «недостающая» масса — это кислород, какова эмпирическая формула глутамата натрия?
Риталин — это мягкий стимулятор центральной нервной системы, который назначают для лечения синдрома дефицита внимания и нарколепсии (неконтролируемого желания спать). Его химическое название — гидрохлорид метилфенидата, а его эмпирическая формула — C 14 H 20 ClNO 2 . Если бы вы отправили образец этого соединения в коммерческую лабораторию для элементного анализа, каких результатов вы ожидаете в отношении массовых процентов углерода, водорода и азота?
Фруктоза, сахар, содержащийся во фруктах, содержит только углерод, кислород и водород.Он используется в мороженом для предотвращения песчаной текстуры. Полное сгорание 32,4 мг фруктозы в кислороде дает 47,6 мг CO 2 и 19,4 мг H 2 O. Какова эмпирическая формула фруктозы?
Кониин, основной токсин болиголова, содержит только углерод, азот и водород. При попадании внутрь вызывает паралич и в конечном итоге смерть. Полное сгорание 28,7 мг кониина дает 79,4 мг CO 2, и 34.4 мг H 2 O. Какова эмпирическая формула кониина?
Сплавы меди и олова (бронзы) с высоким содержанием мышьяка предположительно использовались металлургами бронзового века, потому что бронза, полученная из богатых мышьяком руд, имела превосходные литейные и рабочие свойства. Состав некоторых типичных представителей бронзы этого типа следующий:
Состав некоторых типичных представителей бронзы этого типа следующий:
| Происхождение | % Состав | |
|---|---|---|
| Cu | As | |
| Мертвое море | 87.0 | 12,0 |
| Центральная Америка | 90,7 | 3,8 |
Если бы древние металлурги использовали минерал As 2 S 3 в качестве источника мышьяка, сколько As 2 S 3 потребовалось бы для обработки 100 г куприта (Cu 2 O) бронзы с этими композициями?
♦ Фраза безумный как шляпник относится к психическим расстройствам, вызванным воздействием нитрата ртути (II) при производстве фетровых шляп в 18-19 веках.Однако еще большую опасность для человека представляют алкильные производные ртути.
- Приведите эмпирическую формулу нитрата ртути (II).
- Одно из алкильных производных, диметилртуть, является высокотоксичным соединением, которое может вызывать отравление ртутью у людей. Сколько молекул содержится в образце 5,0 г диметилртути?
- Какое процентное содержание ртути в образце?
Карбонат магния, гидроксид алюминия и бикарбонат натрия обычно используются в качестве антацидов. Приведите эмпирические формулы и определите молярные массы этих соединений. Основываясь на их формулах, предложите другое соединение, которое могло бы быть эффективным антацидом.
Приведите эмпирические формулы и определите молярные массы этих соединений. Основываясь на их формулах, предложите другое соединение, которое могло бы быть эффективным антацидом.
♦ Сообщалось о том, что ацетат никеля (II), фосфат свинца (II), нитрат цинка и оксид бериллия вызывают рак у экспериментальных животных.
- Приведите эмпирические формулы для этих соединений.
- Рассчитайте их формулы масс.
- Основываясь на расположении кадмия в периодической таблице, можете ли вы предсказать, что хлорид кадмия также может вызывать рак?
♦ Метан, основной компонент природного газа, находится в атмосферах Юпитера, Сатурна, Урана и Нептуна.
- Какая структура у метана?
- Рассчитайте молекулярную массу метана.
- Рассчитайте массовые проценты обоих элементов, присутствующих в метане.
Сахарин натрия, который примерно в 500 раз слаще сахарозы, часто используется в качестве заменителя сахара. Какое процентное содержание углерода, кислорода и серы в этом искусственном подсластителе?
Молочная кислота, содержащаяся в простокваше, соленых огурцах и квашеной капусте, имеет функциональные группы как спирта, так и карбоновой кислоты.Эмпирическая формула этого соединения — CH 2 O, а его молярная масса составляет 90 г / моль. Если бы это соединение было отправлено в лабораторию для элементного анализа, каких результатов вы бы ожидали в отношении содержания углерода, водорода и кислорода?
Состав 2-ноненал — репеллент от тараканов, который содержится в огурцах, арбузе и моркови. Определите его молекулярную массу.
Определите его молекулярную массу.
Вы получили образец 720 мг того, что вы считаете чистой фруктозой, хотя возможно, что образец был загрязнен формальдегидом.И фруктоза, и формальдегид имеют эмпирическую формулу CH 2 O. Не могли бы вы использовать результаты анализа горения, чтобы определить, является ли ваш образец чистым?
♦ Ракеты-носители космических кораблей использовали смесь металлического алюминия и перхлората аммония в качестве топлива. При воспламенении эта смесь может реагировать согласно химическому уравнению
. Al (s) + NH 4 ClO 4 (s) → Al 2 O 3 (s) + AlCl 3 (г) + NO (г) + H 2 O (г)Уравновесите уравнение и постройте таблицу, показывающую, как интерпретировать эту информацию в следующих терминах:
- Количество отдельных атомов, молекул и ионов
- моль реактивов и продуктов
- грамм реактивов и продуктов
- чисел молекул реагентов и продуктов на 1 моль металлического алюминия
♦ Одним из побочных продуктов производства мыла является глицерин.В 1847 году было обнаружено, что реакция глицерина с азотной кислотой дает нитроглицерин в соответствии со следующим несбалансированным химическим уравнением:
Нитроглицерин — это взрывоопасная жидкость и расширитель кровеносных сосудов, который используется для лечения сердечного заболевания, известного как стенокардия.
- Выровняйте химическое уравнение и определите, сколько граммов нитроглицерина будет произведено из 15.00 г глицерина.
- Если в реакции было использовано 9,00 г азотной кислоты, какой реагент был бы ограничивающим?
- Каков теоретический выход нитроглицерина в граммах?
- Если 9,3 г нитроглицерина было произведено из 9,0 г азотной кислоты, каков был бы процент выхода?
- Учитывая данные в части d, как бы вы оценили успех этой реакции в соответствии с критериями, упомянутыми в этой главе?
- Получите общее выражение для теоретического выхода нитроглицерина в виде x граммов глицерина.
♦ Существенной реакцией выветривания в геохимии является гидратация – обезвоживание. Примером может служить преобразование гематита (Fe 2 O 3 ) в ферригидрит (Fe 10 O 15 · 9H 2 O), когда относительная влажность почвы приближается к 100%:
Fe 2 O 3 (с) + H 2 O (л) → Fe 10 O 15 · 9H 2 O (с)Эта реакция происходит на поздних стадиях процесса выветривания.
- Выровняйте химическое уравнение.
- Это окислительно-восстановительная реакция? Поясните свой ответ.
- Если 1 т гематитовой породы выветривается таким образом, сколько килограммов ферригидрита образовалось бы?
♦ Гидразин (N 2 H 4 ) используется не только в качестве ракетного топлива, но и в промышленности для удаления токсичных хроматов из сточных вод в соответствии со следующим химическим уравнением:
4CrO 4 2- (вод. ) + 3N 2 H 4 (л) + 4H 2 O (л) → 4Cr (OH) 3 (т) + 3N 2 (г ) + 8OH — (водн.)
) + 3N 2 H 4 (л) + 4H 2 O (л) → 4Cr (OH) 3 (т) + 3N 2 (г ) + 8OH — (водн.)Определите виды, которые подвергаются окислению, и виды, которые восстанавливаются.Какая масса воды нужна для полной реакции 15,0 кг гидразина? Напишите общее уравнение для массы гидроксида хрома (III) [Cr (OH) 3 ], полученного из x граммов гидразина.
♦ Коррозия — это термин, обозначающий разрушение металлов в результате химической реакции с окружающей средой. Особенно сложной проблемой для химика-археолога является образование CuCl, нестабильного соединения, которое образуется в результате коррозии меди и ее сплавов.Хотя медные и бронзовые предметы могут пережить захоронение в течение столетий без значительного ухудшения, воздействие воздуха может вызвать реакцию хлорида меди с атмосферным кислородом с образованием Cu 2 O и хлорида меди. Затем хлорид меди вступает в реакцию со свободным металлом с образованием хлорида меди. Продолжающаяся реакция кислорода и воды с хлоридом меди вызывает «бронзовую болезнь», которая состоит из пятен бледно-зеленого порошкообразного осадка [CuCl 2 · 3Cu (OH) 2 · H 2 O] на поверхности. объекта, который продолжает расти.Используя эту серию описанных реакций, заполните и уравновесите следующие уравнения, которые вместе приводят к бронзовой болезни:
Уравнение 1: ___ + O 2 → ___ + ___
Уравнение 2: ___ + Cu → ___
Уравнение 3: ___ + O 2 + H 2 O → CuCl2 · 3Cu (OH) 2 · h3O Бронзовая болезнь + CuCl2
- Какие разновидности являются окислителями и восстановителями в каждом уравнении?
- Если 8.
 0% по массе медной статуи массой 350,0 кг состояло из CuCl, а статуя умерла от бронзовой болезни, сколько фунтов порошкообразного зеленого гидрата могло бы образоваться?
0% по массе медной статуи массой 350,0 кг состояло из CuCl, а статуя умерла от бронзовой болезни, сколько фунтов порошкообразного зеленого гидрата могло бы образоваться? - Какие факторы могут повлиять на скорость разрушения недавно обнаруженного бронзового артефакта?
♦ Погруженное в морскую воду железо будет реагировать с растворенным кислородом, но когда железный объект, например корабль, опускается на морское дно, где мало или совсем нет свободного кислорода, железо остается свежим до тех пор, пока не будет вынесено на поверхность.Однако даже на морском дне железо может реагировать с соленой водой в соответствии со следующим несбалансированным химическим уравнением:
Fe (т.) + NaCl (водн.) + H 2 O (л) → FeCl 2 (т.) + NaOH (водн.) + H 2 (г)Хлорид железа и вода затем образуют гидратированный хлорид железа в соответствии со следующим уравнением:
FeCl 2 (т) + 2H 2 O (л) → FeCl 2 · 2H 2 O (т)Когда затопленный железный предмет удаляется с морского дна, дигидрат хлорида железа вступает в реакцию с атмосферной влагой с образованием раствора, который просачивается наружу, образуя характерный «пот», который может продолжаться в течение многих лет.Кислород из воздуха окисляет раствор до трехвалентного железа, что приводит к образованию так называемой ржавчины (оксида железа):
FeCl 2 (водн.) + O 2 (г) → FeCl 3 (водн.) + Fe 2 O 3 (т) Слой ржавчины будет продолжать расти, пока не остановится.
- Сбалансируйте каждое химическое уравнение.
- Учитывая 10.0 На корабле, из которого 2,60% сейчас ржавчина, сколько килограммов железа было преобразовано в FeCl 2 , если предположить, что корабль был чистым железом?
- Какая масса ржавчины в граммах будет в результате?
- Каково общее изменение степени окисления железа для этого процесса?
- Какие виды были сокращены в первом приведенном уравнении? Какие виды были окислены?
♦ В стекольной промышленности оксид свинца используется для производства мелкого хрусталя, такого как хрустальные бокалы.Оксид свинца может быть образован по следующей реакции:
PbS (т) + O 2 (г) → PbO (т) + SO 2 (г)Уравновесите уравнение и определите, что было окислено, а что восстановлено. Сколько граммов диоксида серы можно получить из 4,0 × 10 3 г сульфида свинца? Обсудите некоторые потенциальные опасности для окружающей среды, связанные с этой реакцией.
♦ Процесс Deacon — это один из способов регенерации Cl 2 на промышленных предприятиях, где при хлорировании углеводородов образуется HCl.В реакции используется кислород для окисления HCl до хлора, как показано.
HCl (г) + O 2 (г) → Cl 2 (г) + H 2 O (г)Реакцию часто проводят в присутствии NO в качестве катализатора.
- Выровняйте химическое уравнение.
- Какое соединение является окислителем, а какое — восстановителем?
- Если во время реакции хлорирования образовалось 26 кг HCl, сколько килограммов воды получилось бы в результате процесса Дикона?
В 1834 году Эйлхард Митчерлих из Берлинского университета синтезировал бензол (C 6 H 6 ) путем нагревания бензойной кислоты (C 6 H 5 COOH) с оксидом кальция в соответствии с этим сбалансированным химическим уравнением:
C6H5COOH (т) + CaO (т) → ΔC6H6 (л) + CaCO3 (т) (Нагрев обозначается символом Δ. ) Сколько бензола вы ожидаете от реакции 16,9 г бензойной кислоты и 18,4 г оксида кальция? Какой ограничивающий реагент? Сколько граммов бензола вы ожидаете получить в результате этой реакции, если исходить из 73% выхода?
) Сколько бензола вы ожидаете от реакции 16,9 г бензойной кислоты и 18,4 г оксида кальция? Какой ограничивающий реагент? Сколько граммов бензола вы ожидаете получить в результате этой реакции, если исходить из 73% выхода?
Аспирин (C 9 H 8 O 4 ) синтезируется реакцией салициловой кислоты (C 7 H 6 O 3 ) с уксусным ангидридом (C 4 H 6 O 3 ) в соответствии со следующим уравнением:
C 7 H 6 O 3 (s) + C 4 H 6 O 3 (l) → C 9 H 8 O 4 (s) + H 2 O (л)Уравновесите уравнение и найдите ограничивающий реагент с учетом 10.0 г уксусного ангидрида и 8,0 г салициловой кислоты. Сколько граммов аспирина вы ожидаете от этой реакции, если исходить из 83%?
♦ Плавиковая кислота травит стекло, поскольку растворяет диоксид кремния, как показано в следующем химическом уравнении:
SiO 2 (т) + HF (водн.) → SiF 6 2- (водн.) + H + (водн.) + H 2 O (л)- Сбалансируйте уравнение.
- Сколько граммов диоксида кремния прореагирует с 5,6 г HF?
- Сколько граммов HF необходимо для удаления 80% диоксида кремния из 4,0-килограммового куска стекла? (Предположим, что стекло представляет собой чистый диоксид кремния.)
♦ Сульфид свинца и пероксид водорода реагируют с образованием сульфата свинца и воды. Эта реакция используется для очистки масляных картин, которые почернели из-за реакции красок на основе свинца с атмосферным сероводородом.
Эта реакция используется для очистки масляных картин, которые почернели из-за реакции красок на основе свинца с атмосферным сероводородом.
- Напишите сбалансированное химическое уравнение окисления сульфида свинца перекисью водорода.
- Какая масса перекиси водорода потребуется для удаления 3,4 г сульфида свинца?
- Если бы картина изначально была покрыта 5,4 г сульфида свинца, а у вас было 3,0 г перекиси водорода, какой процент сульфида свинца можно было бы удалить?
♦ Было высказано предположение, что диацетилен (C 4 H 2 , HC≡C – C≡CH) может быть озоном внешних планет.Диацетилен — самый крупный углеводород, обнаруженный в планетных атмосферах, защищает поверхности планет от ультрафиолетового излучения и сам реагирует на свет. Одна реакция диацетилена является важным путем образования высших углеводородов, как показано в следующих химических уравнениях:
C 4 H 2 (г) + C 4 H 2 (г) → C 8 H 3 (г) + H (г) C 8 H 3 (г) + C 4 H 2 (г) → C 10 H 3 (г) + C 2 H 2 (г)Рассмотрим вторую реакцию.
- Учитывая 18,4 моль C 8 H 3 и 1000 г C 4 H 2 , какой реагент является ограничивающим?
- Учитывая 2,8 × 10 24 молекулы C 8 H 3 и 250 г C 4 H 2 , что является ограничивающим реагентом?
- Дано 385 г C 8 H 3 и 200 г C 4 H 2 , что излишне? Сколько грамм избыточного реагента останется?
- Подскажите, почему эта реакция может заинтересовать ученых.

♦ Глюкоза (C 6 H 12 O 6 ) может быть преобразована в этанол и диоксид углерода с помощью определенных ферментов. Однако по мере увеличения концентрации алкоголя каталитическая активность подавляется, и производство алкоголя прекращается.
- Напишите сбалансированное химическое уравнение превращения глюкозы в этанол и диоксид углерода.
- Дано 12.6 г глюкозы, сколько граммов этанола будет произведено при условии полного преобразования?
- Если бы было произведено 4,3 г этанола, каков был бы процент выхода этой реакции?
- Используется ли в этой реакции гетерогенный или гомогенный катализатор?
- Вас попросили найти способ увеличить скорость этой реакции с учетом стехиометрических количеств каждого реагента. Как бы ты это сделал?
Ранние космические корабли, разработанные Национальным управлением по аэронавтике и исследованию космического пространства для пилотируемых полетов, использовали капсулы с атмосферой чистого кислорода.Эта практика была прекращена, когда искра от короткого замыкания в проводке внутри капсулы космического корабля Аполлон 1 воспламенила ее содержимое. В результате взрыва и пожара три находившихся на борту астронавта погибли за считанные минуты. Какие химические меры можно было предпринять, чтобы предотвратить эту катастрофу?
Стехиометрия — уровень AP
Стехиометрия — уровень APСтехиометрия — уровень AP
Задачи № 11-25
Десять примеров
Проблемы №1-10
Проблемы № 26-50
Все примеры и проблемы (без решений)
Вернуться в меню стехиометрии
Проблема № 11: Хлорид гидроксиламмония реагирует с хлоридом железа (III), FeCl 3 , в растворе с образованием хлорида железа (II), HCl, H 2 O и соединения азота. Было обнаружено, что 2,00 г хлорида железа (III) прореагировали таким образом с 31,0 мл 0,200 М хлорида гидроксиламмония. Предложите возможную формулу полученного таким образом соединения азота.
Было обнаружено, что 2,00 г хлорида железа (III) прореагировали таким образом с 31,0 мл 0,200 М хлорида гидроксиламмония. Предложите возможную формулу полученного таким образом соединения азота.
Решение:
1) Определите количество молей хлорида гидроксиламмония (NH 3 OH + Cl¯) и хлорида железа (III):
(0,0310 л) (0,200 моль / л) = 0,0062 моль NH 3 OH + Cl ¯2,00 г / 162,204 г / моль = 0,01233 моль FeCl 3
Ключ состоит в том, чтобы увидеть, что количество молей FeCl 3 вдвое больше, чем у хлорида гидроксиламмония.
2) Определите степень окисления N в хлориде гидроксиламмония:
N = -1Определение этого оставлено на усмотрение читателя.
Между прочим, мы знаем, что железо восстанавливается, поэтому азот ДОЛЖЕН окисляться.
3) Позвольте 0,0062 молям атомов азота перейти от -1 степени окисления к нулю:
при этом высвобождается 0,0062 моль электронов, которые идут на восстановление 0,0062 моль ионов Fe 3+ (что составляет только половину имеющихся ионов)
4) Разрешить 0.0062 моль атомов N (из-за шага 3 чуть выше, теперь с нулевой степенью окисления) для перехода от нуля до степени окисления +1:
это высвобождает еще 0,0062 моль электронов, которые идут на восстановление 0,0062 моль ионов Fe 3+ (что составляет другую половину имеющихся ионов)
5) Нам нужен азот со степенью окисления +1 в нашем соединении:
N 2 O
Задача № 12: Сколько ионов фосфата содержится в образце гидроксиапатита [Ca 5 (PO 4 ) 3 OH], который содержит 5.50 x 10 -3 грамма кислорода?
Решение:
1) Определите количество молей кислорода:
5,50 x 10 -3 г разделить на 16,00 г / моль = 3,4375 x 10 -4 моль
2) Определите количество молей гидроксиапатита:
молярное соотношение между гидроксиапатитом и кислородом составляет 1:13.3,4375 x 10 -4 моль разделить на 13 = 2,64423 x 10 -5 моль гидроксиапатита
3) Определите количество молей фосфат-ионов:
молярное соотношение между гидроксиапатитом и фосфатом составляет 1: 3.(2.64423 x 10 -5 моль) (3) = 7,
23 x 10 -5 моль фосфат-ионов
4) Определите количество ионов:
(7,23 x 10 -5 моль) (6,022 x 10 23 моль ¯ 1 ) = 4,78 x 10 19
Задача № 13: Смесь, состоящая только из хлорида натрия (NaCl) и хлорида калия (KCl), весит 1,0000 г. Когда смесь растворяется в воде и добавляется избыток нитрата серебра, все хлорид-ионы, связанные с исходной смесью, осаждаются в виде нерастворимого хлорида серебра (AgCl).Масса хлорида серебра составляет 2,1476 г. Рассчитайте массовые проценты хлорида натрия и хлорида калия в исходной смеси.
Решение № 1:
1) Задайте это уравнение:
(x) (граммы Cl из NaCl) + (1 — x) (граммы Cl из KCl) = общее количество хлорида в граммахx = граммы NaCl в исходной смеси
1 — x = граммы KCl в исходной смесиграмма Cl из NaCl = 35,5 / 58,4
граммов Cl из KCl = 35.5 / 74,6
граммов хлорида = (2,1476 г) (35,5 / 143,3)Цифры в знаменателе — это молярные массы NaCl, KCl и AgCl. Эти три соотношения называются «гравиметрическими факторами».
(x) (35,5 / 58,4) + (1 — x) (35,5 / 74,6) = (2,1476 г) (35,5 / 143,3)
2) Решить:
(x) (35,5 / 58,4) + (1 — x) (35,5 / 74,6) = (2,1476 г) (35,5 / 143,3)0.6079x + 0,4759 — 0,4759x = 0,532
0,132х = 0,0561
x = 0,425 г
Масса NaCl в исходной смеси.Это составляет 43% от исходной смеси.
Решение № 2:
1) Задайте это уравнение:
масса NaCl + масса KCl = 1.000 г
x = граммы NaCl в исходной смеси
1 — x = граммы KCl в исходной смесиСледовательно:
(x) + (1 — x) = 1.000 г
2) Преобразуйте x и 1 — x следующим образом:
(x / 58,442 г / моль) (143,321 г / моль) = 2,452x((1 — x) / 74,551 г / моль) (143.321 г / моль) = 1,992 (1 — x)
Комментарий: на примере NaCl преобразование делает следующее:
а) Сначала мы вычисляем количество молей NaCl.
b) Поскольку молярное соотношение между NCl и AgCl составляет 1: 1, это также количество моль произведенного AgCl.
c) Умножьте на молярную массу AgCl, чтобы получить граммы AgCl, полученные из x граммов NaCl.
3) Напишите (а затем решите) это уравнение:
2,452x + 1,992 (1 — x) = 2,14762.452x + 1.922 — 1,922x = 2,1476
0,53x = 0,2256
x = 0,426 г
Решение № 3:
Изобразите теоретический выход AgCl из одного грамма 100% KCl через один грамм 100% NaCl с несколькими промежуточными смесями, чтобы продемонстрировать линейность (или нет) и интерполировать свой ответ.
Комментарий: Когда-нибудь это будет интересно сделать в электронной таблице.
Задача № 14: Аммиак промышленно получают в результате реакции:
N 2 + 3H 2 —> 2NH 3
Предполагая выход 100%, какая масса аммиака будет произведена из смеси с молярным соотношением 1: 1 в реакторе объемом 8.75 x 10 3 л при общем давлении 2,75 x 10 7 Па при 455 ° C.
Решение:
1) Молярное соотношение 1: 1 означает, что водород является ограничивающим реагентом. Это связано с тем, что для полной реакции всего азота требуется соотношение азота к водороду 1: 3.
2) Определите начальное давление водорода:
2,75 x 10 7 Па = 2,75 x 10 4 кПа2,75 x 10 4 кПа / 101,325 кПа / атм = 271,404 атм
271.
404 атм / 2 = 135,702 атм
Деление на два сделано потому, что водород составляет 50% реакционной смеси.
3) Используйте PV = nRT:
(135,702 атм) (8,75 x 10 3 L) = (x) (0,08206) (728 K)x = 19876,111 моль водорода
4) Перевести в количество аммиака:
Молярное соотношение 3: 2 для H 2 : NH 3моль NH 3 = (19876,111 x 2) / 3 = 13250,74 моль
13250,74 моль x 17.0307 г / моль = 225669,4 г = 2,26 x 10 5 г
Задача № 15: При нагревании образец 4,250 г теряет 0,314 грамма. Предполагая, что образец представляет собой BaCl 2 · 2H 2 O и NaCl, рассчитайте массовый процент BaCl 2 · 2H 2 O.
Решение:
1) При нагревании теряется только вода. Определите количество потерянных молей:
0,314 г / 18,015 г / моль = 0,01743 моль воды
2) Из формулы BaCl 2 · 2H 2 O, мы знаем:
2 моля воды на один моль BaCl 2, следовательно, 0.008715 моль BaCl 2
3) Определите граммы, а затем процентное содержание хлорида бария:
0,008715 моль x 244,2656 г / моль = 2,128775 г BaCl 2 · 2H 2 O2,128775 / 4,250 = 50,09%
Задача № 16: Образец весом 0,6118 г, содержащий только MgCl 2 и NaCl, был проанализирован путем добавления 145,0 мл 0,1006 M AgNO 3 . Образовавшийся осадок AgCl (s) имел массу 1,7272 г.Рассчитайте массу каждого компонента (MgCl 2 и NaCl) в исходной пробе.
Решение:
1) Используя гравиметрический коэффициент, определите количество выпавшего хлорид-иона:
(1,7272 г) (35,453 / 143,321) = 0,42725366 г
2) Определите относительный вклад хлорида MgCl 2 и NaCl:
на каждые три Cl¯, которые реагируют с Ag + :два из MgCl 2
один из NaClСледовательно:
Доля хлорида магния составляет 2/3
Вклад хлорида натрия составляет 1/3Пожалуйста, поймите, этот вклад выражен в молях.
Так . . . .
3) Перевести граммы хлорида в моль:
0,42725366 г / 35,453 г / моль = 0,01205127 моль
4) Определите количество молей NaCl в образце:
(0,01205127 моль) (1/3) = 0,00401709 моль
5) Определите количество граммов NaCl в образце:
(0,00401709 моль) (58,443 г / моль) = 0,23477 г— инжир с четырьмя сигами: 0,2348 г
Масса MgCl 2 может быть получена вычитанием.
Проблема № 17: Нитрат аммония и хлорат калия при разложении при нагревании выделяют газообразный кислород.Не делая подробных расчетов, определите, какой из двух дает больший
(а) количество молей O 2 на моль твердого и
(b) количество граммов O 2 на грамм твердого вещества.
Несбалансированные уравнения:
NH 4 NO 3 (s) —> N 2 (g) + O 2 (g) + H 2 O
KClO 3 (т) —> KCl (т) + O 2 (г)
Решение:
1) Уравновесить оба уравнения:
2NH 4 NO 3 (s) —> 2N 2 (g) + O 2 (g) + 4H 2 O
2KClO 3 (т) —> 2KCl (т) + 3O 2 (г)
2) Запишите молярные отношения:
NH 4 NO 3 до O 2 составляет 2: 1
KClO 3 до O 2 равно 2: 3
3) Пусть мольные отношения выражаются в одном моль твердого вещества:
NH 4 NO 3 до O 2 равно 1: 0.5
KClO 3 до O 2 составляет 1: 1,5
4) Ответ на вопрос (а):
В молях KClO 3 производит больше O 2 , чем NH 4 NO 3 .Фактически, KClO 3 производит в три раза больше кислорода (сравните 1,5: 0,5).
5) Преобразуйте моль каждого молярного отношения в граммы:
NH 4 NO 3 от до O 2 от 80,04 до 16,00
KClO 3 — O 2 — 122.55 к 48,0 9 10 176) Пусть соотношение в граммах выражается в одном грамме вещества:
NH 4 NO 3 от до O 2 от 1 до 0,20
KClO 3 от до O 2 от 1 до 0,394) Ответ на вопрос (б):
В граммах KClO 3 производит кислород примерно в два раза быстрее (от 0,30 до 0,20), чем NH 4 NO 3 .Проблема № 18: Элемент X образует как дихлорид (XCl 2 ), так и тетрахлорид (XCl 4 ). Обработка 10.00 г XCl 2 с избытком хлора образует 12,55 г XCl 4 . Вычислите атомную массу X и определите X.
Решение:
1) Напишите вычисленное уравнение реакции:
XCl 2 + Cl 2 —> XCl 42) Определите граммы, а затем моль Cl 2 , которые реагируют:
12,55 г минус 10,00 г = 2,55 г2,55 г / 70,906 г / моль = 0,035963 моль
3) Определите количество молей XCl 2 присутствующих:
Из-за молярного отношения 1: 1 между XCl 2 и Cl 2 моль XCl 2 равняется 0.035963 моль4) Определите молекулярную массу XCl 2 :
10,00 г / 0,035963 моль = 278,06 г / моль5) Определите атомный вес и идентичность X:
278,06 г / моль минус 70,906 г / моль = 207,2 г / моль (округлено до 0,1 разряда)X свинцовый.
Задача № 19: Добавляют воду к 4,267 г UF 6 .
Единственными продуктами реакции являются 3,730 г твердого вещества, содержащего только уран, кислород и фтор, и 0.970 г газа. Газ на 95,0% состоит из фтора, а остальное — из водорода.
a) Какая доля фтора исходного вещества находится в твердом веществе, а какая — в газе после реакции?
б) Какова формула твердого продукта?Решение для:
1) Рассчитать моль UF 6 присутствует:
4,267 г / 352,018 г / моль = 0,01212154 моль2) Вычислить граммы фтора в UF 6 :
(0.01212154 моль) (113,988 г / моль) = 1,38171 г113.988 происходит из того факта, что 6 F находятся в UF 6
3) Рассчитайте массу фтора в газе
(0,970 г) (0,950) = 0,9215 г4) Рассчитайте массу фтора в твердом веществе:
1,38171 г — 0,9215 г = 0,46021 г5) Рассчитайте процентное содержание фтора в твердом веществе:
0,46021 г / 1,38171 г = 33,307%6) Рассчитайте процентное содержание фтора в газе:
100% — 33.307% = 66,693%Решение для b:
1) Рассчитайте массу H 2 O прореагировавшего:
(3,730 г + 0,970 г) — 4,267 г = 0,433 г2) Рассчитайте массу кислорода в твердом продукте:
(0,433 г / 18,015 г / моль) (15,999 г / моль) = 0,38454438 г3) Рассчитайте массу урана в твердом продукте:
3,730 г — (0,38454438 г + 0,46021 г) = 2,88524562 г4) Рассчитайте количество молей U, F и O в твердом продукте:
У: 2.88524562 г / 238,029 г / моль = 0,01212 мольF: 0,4604 г / 18,998 г / моль = 0,02423 моль
O: 0,38454438 г / 15,999 г / моль = 0,02403 моль
5) Чтобы более четко увидеть соотношение 1: 2: 2, просто разделите на наименьшее число:
Ед .: 0,01212 / 0,01212 = 1
F: 0,02423 / 0,01212 = 1,999
O: 0,02403 / 0,01212 = 1,98Формула неизвестного: UF 2 O 2 , а общая реакция такова:
UF 6 + 2H 2 O -> UF 2 O 2 + 4HFЗадача № 20: Соединение, содержащее титан и хлор, анализируется путем преобразования всего титана в 1.20 г диоксида титана и весь хлор в 6,45 г AgCl. Какая самая простая (эмпирическая) формула исходного соединения?
Решение:
Кстати, обратите внимание на использование миллимолей, а не молей. Помните, что 1 моль равен 1000 миллимолей.
1) Такая реакция бывает:
Ti x Cl y —-> x TiO 2 + y AgCl2) Определите количество образовавшихся молей TiO 2 :
1,20 г / 79.90 г моль ¯ 1 = 15,02 ммоль3) Определите количество молей образовавшегося AgCl:
6,45 г / 143,32 г моль ¯ 1 = 45,00 ммоль4) Определите миллимоли Ti и Cl в исходном соединении:
молярное соотношение Ti: TiO 2 составляет 1: 1, следовательно, 15,02 ммоль Ti
Молярное соотношение Cl: AgCl составляет 1: 1, следовательно, 45,00 ммоль Cl5) Мольное отношение Ti к Cl в соединении составляет 15:45 или 1: 3. Следовательно:
формула соединения — TiCl 3Проблема № 21: Неизвестный элемент X обнаружен в двух соединениях, XCl 2 и XBr 2 .В следующей реакции:
XBr 2 + Cl 2 —> XCl 2 + Br 2при использовании 1,5000 г XBr 2 образуется 0,8897 г XCl 2 . Определите элемент X.
Решение:
моль XBr 2 = моль XCl 21,500 / (x + 159.
808) = 0,8897 / (x + 70,906)
(0,8897) (x + 159.808) = (1.500) (x + 70.906)
0,8897x + 142.1811776 = 1,5x + 106,359
0,6103x = 35,8221776
х = 58,70
Элемент X — Ni.
Кстати, будьте осторожны. Взгляните на Co, вы увидите 58,93 и подумайте, что это достаточно близко. Никель — 58,69. Спаривание Co / Ni — одно из трех, атомный вес которого уменьшается по мере того, как вы переходите от элемента к элементу. Ar / K и Te / I — два других.
Проблема № 22: Когда подача кислорода ограничена, металлическое железо реагирует с кислородом с образованием смеси FeO и Fe 2 O 3 .В определенном эксперименте 20,00 г металлического железа прореагировало с 11,20 г газообразного кислорода. После эксперимента железо было полностью израсходовано, и осталось 3,24 г газообразного кислорода. Вычислите количества FeO и Fe 2 O 3 , образовавшихся в этом эксперименте.
Решение:
1) Определите количество молей O 2 , которые прореагировали:
11,20 г — 3,24 г = 7,96 г7,96 г / 31,99886 г / моль = 0,248759 моль
2) Одновременно протекают две независимые реакции:
2Fe + O 2 —> 2FeO
4Fe + 3O 2 —> 2Fe 2 O 3Кстати, у вас может возникнуть соблазн написать одно уравнение:
3Fe + 2O 2 -> FeO + Fe 2 O 3
Это было бы неверно, поскольку это маскирует тот факт, что два молярных отношения кислорода к оксиду железа различны.Поскольку соотношения разные, расчет для FeO и Fe 2 O 3 должен выполняться отдельно.
3) Пусть z будет массовой долей Fe, которое произвело FeO. Тогда 1-z — это массовая доля Fe, которое произвело Fe 2 O 3 Определите количество потребляемого кислорода, когда (а) часть Fe переходит в FeO и (б) часть Fe переходит в Fe 2 O 3 :
(а) расчет FeO:
1 моль Fe 1 моль O 2 (20. 00 г Fe) (z)
х ––––––––––– х ––––––– = 0,179067z (моль O 2 израсходовано на производство FeO) 55,8 450 г Fe 2 моль Fe (б) расчет Fe 2 O 3
1 моль Fe 3 моль O 2 (20.00 г Fe) (1-z) х ––––––––––– х ––––––– = (0,268601 — 0,268601z) (моль O 2 , затраченное на производство Fe 2 O 3 ) 55,8 450 г Fe 4 моль Fe Обратите внимание, что количество потребляемого кислорода выражается через (неизвестную) массовую долю «z». Следующий шаг определит значение z.
4) Добавьте два количества израсходованного O 2 и установите его равным общему количеству молей прореагировавшего O 2 . Решите для ‘z’:
(0,179067z) + (0,268601 — 0,268601z) = 0,248759-0,089534z = -0,019842
г = 0,221614
5) Определите (а) количество произведенного FeO и (б) количество произведенного Fe 2 O 3 :
(а) расчет FeO:
1 моль Fe 2 моль FeO 71. 8444 г Fe
(20,00 г Fe) (0,221614) х ––––––––––– х –––––––––– х ––––––––––– = 5,702 г произведено FeO 55,8 450 г Fe 2 моль Fe 1 моль Fe (б) расчет Fe 2 O 3 :
1 моль Fe 2 моль Fe 2 O 3 159.6882 г Fe 2 O 3 (20,00 г Fe) (0,778386) х ––––––––––– х –––––––––– х ––––––––––– = 22,258 г Fe 2 O 3 произведено 55,8 450 г Fe 4 моль Fe 1 моль Fe 6) Посмотрим, работает ли Закон сохранения массы:
20.00 г + 11,2 г — 3,24 г = 27,96 г
22,258 г + 5,702 г = 27,96 гУра!
7) Вот неправильное решение этой проблемы.
Проблема № 23: Лист железа с площадью поверхности 525 см 2 покрыт слоем ржавчины со средней толщиной 0,0021 см.
Какой минимальный объем раствора HCl в мл, имеющего плотность 1,07 г / мл и состоящего из 14% HCl по массе, необходим для очистки поверхности металла путем взаимодействия с ржавчиной? Предположим, что ржавчина — это Fe 2 O 3 (s), что она имеет плотность 5.2 г / см 3 , и что реакция:
Fe 2 O 3 (т.) + 6HCl (водн.) —> 2FeCl 3 (водн.) + 3H 2 O ()Решение:
1) Объем ржавого покрытия:
525 см 2 x 0,0021 см = 1,1025 см 32) Масса ржавчины:
1,1025 см 3 x 5,2 г / см 3 = 5,733 г3) Родинки ржавчины:
5,733 г / 159,687 г / моль = 0.035моль 4) Требуется моль HCl:
Из вычисленного уравнения молярное отношение Fe 2 O 3 к HCl составляет 1: 6.1 равно 6 как 0,035
моль равно x x = 0,21540888 моль
5) Необходимая масса HCl:
0,21540888 моль x 36,4609 г / моль = 7,854 г6) Требуемая масса 14% раствора:
14 равно 100, как 7,854 — xx = 56,1 г
7) Требуемый объем раствора:
56.1 г / 1,07 г / мл = 52,43 млКомментарий: есть те учителя, которые категорически настаивают на написании проблемы, подобной описанной выше, в «стиле анализа измерений». Это означает объединить все вычисления в одну строку. Вот это делается двумя разными способами:
(525 см 2 x 0,0021 см) (5,2 г / см 3 ) (1 моль / 159,687 г) (6 моль HCl / 1 моль Fe 2 O 3 ) (36,4609 г / 1 моль ) (100/14) (1 мл / 1,07 г)
5.2 г 1 моль 6 36,4609 г 100 1 мл (525 см 2 x 0,0021 см) ––––– х –––––– х –––– х –––––––––– х –––– х ––––– = 52,43 мл 1 см 3 159. 687 г
1 1 моль 14 1,07 г Убедитесь, что 159.687 используется в дивизии. Также обратите внимание на 100/14. Вы должны умножить на 100, затем разделить на 14, прежде чем двигаться дальше.
Есть те, кто настаивает на том, что стиль DA более ясен, что делает его педагогически более разумным для обучения. ChemTeam не входит в эту группу.
Проблема № 24: A 1.42 г образца чистого соединения формулы M 2 SO 4 растворяли в воде и обрабатывали избытком водного хлорида кальция, что приводило к осаждению всех сульфат-ионов в виде сульфата кальция. Осадок собирали, сушили и его вес составлял 1,36 г. Определите атомную массу М. Что это за элемент?
Решение:
Заряд -2 на сульфат-ионе игнорируется.
1) Моли осажденного сульфата:
(1.36 г CaSO 4 ) / (136,1406 г CaSO 4 / моль) x (1 моль SO 4 /1 моль CaSO 4 ) = 0,0099897 моль SO 4(1,36 г CaSO 4 ) / (136,1406 г CaSO 4 / моль) —> переводит граммы в моль
(1 моль SO 4 /1 моль CaSO 4 ) —> на каждый моль произведенного сульфата кальция использовался один моль сульфат-иона2) Моль M 2 SO 4 , содержащая такое количество молей сульфата:
(0.0099897 моль SO 4 ) x (1 моль M 2 SO 4 /1 моль SO 4 ) = 0,0099897 моль M 2 SO 43) Молярная масса of M 2 SO 4 :
1,42 г / 0,0099897 моль = 142,1 г / моль4) Молярная масса of M:
SO 4 = 96,0626 г / моль142,1 г / моль M 2 SO 4 — 96,0626 г / моль SO 4 = 46,0 г / моль M 2
(46,0 г / моль M 2 ) / 2 = 23.
0 г / моль М
натрия.
Задача № 25: Рассчитайте изменение объема при окислении железа до Fe 2 O 3 (d = 5,24 г / см 3 ). Плотность Fe 7,787 г / см 3 .
Решение:
1) Напишите вычисленное химическое уравнение реакции:
2Fe + 3 ⁄ 2 O 2 —> Fe 2 O 3Я решил уравновесить его фракцией, чтобы использовать Fe в Fe 2 O 3 мольное соотношение 2: 1.Если бы я уравновесил уравнение целыми числами, я бы использовал соотношение 4: 2. Это не повлияло бы на ответ, мой выбор баланса был чисто стилистическим.
2) Начнем с 7,787 г (это 1,00 см 3 железа). Преобразуйте его в родинки:
7,787 г / 55,845 г / моль = 0,13944 моль3) Используйте молярное соотношение 2: 1:
2 0,13944 моль ––– = ––––––––––– 1 х x = 0.06972 моль (произведено Fe 2 O 3 )
4) Преобразуйте моль Fe 2 O 3 в граммы:
(0,06972 моль) (159,687 г / моль) = 11,1334 г5) Преобразовать в см 3 :
11,1334 г / 5,24 г / см 3 = 2,12 см 3Объем изменяется от 1,00 см 3 до 2,12 см 3 .
Десять примеров
Проблемы №1-10
Проблемы № 26-50
Все примеры и проблемы (без решений)
Вернуться в меню стехиометрии
Крот | Химия для неосновных
- Определите родинку.
- Определите число Авогадро.
Есть ли более простой способ загрузить этот грузовик?
В хорошую погоду многие люди начинают работать над своими дворами и домами. Для многих проектов песок необходим в качестве основы для прогулки или для добавления к другим материалам. Вы можете заказать двадцать миллионов песчинок, и люди действительно будут смотреть на вас. Вы можете заказать за фунт, но это займет много времени, чтобы взвесить. Лучше всего заказывать по двору, то есть кубическому ярду.Погрузчик может легко собрать все, что вам нужно, и положить прямо в грузовик.
Число Авогадро
Определенно легко сосчитать бананы или сосчитать слонов (если вы не мешаете им). Однако вам придется долго-долго считать сахарные зерна из своей канистры с сахаром. Атомы и молекулы чрезвычайно малы — намного меньше, чем крупинки сахара. Считать атомы или молекулы не только неразумно, но и совершенно невозможно. Одна капля воды содержит около 10 22 молекул воды.Если бы вы считали 10 молекул каждую секунду в течение 50 лет без остановки, вы бы насчитали только 1,6 × 10 10 молекул. Другими словами, при такой скорости счета вам потребуется более 30 триллионов лет, чтобы подсчитать молекулы воды в одной крошечной капле.
Химикам требовалось имя, которое могло бы обозначать очень большое количество предметов. Амедео Авогадро (1776 — 1856), итальянский ученый, назвал именно такое число. Он отвечает за счетную единицу измерения, называемую кротом. моль (моль) — это количество вещества, которое содержит 6,02 × 10 23 репрезентативных частицы этого вещества. Моль — это единица СИ для количества вещества. Так же, как «дюжина» и «брутто», это имя обозначает число. Следовательно, в моль молекул воды имеется 6,02 × 10 23 молекулы воды. Также было бы 6,02 × 10 23 банана в моле бананов, если бы такое огромное количество бананов когда-либо существовало.
Рисунок 10.1
Итальянский ученый Амедео Авогадро, работа которого привела к концепции моль как счетной единицы в химии.
Число 6,02 × 10 23 называется числом Авогадро , числом типичных частиц в кроте. Это экспериментально определенное число. Типичная частица — это наименьшая единица, в которой вещество существует в природе. Для большинства элементов характерной частицей является атом. Железо, углерод и гелий состоят из атомов железа, углерода и гелия соответственно.В природе существует семь элементов в виде двухатомных молекул: H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 и I 2 . Типичной частицей этих элементов является молекула. Точно так же все молекулярные соединения, такие как H 2 O и CO 2 , существуют в виде молекул, и поэтому молекула является их типичной частицей. Для ионных соединений, таких как NaCl и Ca (NO 3 ) 2 , типичной частицей является формульная единица.Моль любого вещества содержит число Авогадро (6,02 × 10 23 ) репрезентативных частиц.
Рисунок 10.2
Животный крот сильно отличается от счетной единицы крота. Тем не менее химики сделали крота своим неофициальным талисманом. Национальный день кротов — это праздник химии, который проводится 23 октября (23 октября) каждого года.
Резюме
- Моль любого вещества содержит число Авогадро (6.02 × 10 23 ) репрезентативных частиц.
Практика
Вопросы
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://www.scientificamerican.com/article.cfm?id=how-was-avogadros-number
- Какова была гипотеза Авогадро?
- Кто первым вычислил это число?
- Кто придумал термин «число Авогадро»?
- Какой вклад внес Роберт Милликен в определение значения числа?
Обзор
Вопросы
- Что такое единица СИ для количества вещества?
- Что представляет собой типичная частица для элемента?
- Формульная единица — репрезентативная частица для чего?
- Число Авогадро: Число типичных частиц в кроте, 6.02 × 10 23 .
- моль (моль): количество вещества, которое содержит 6,02 × 10 23 репрезентативных частицы этого вещества.
- репрезентативная частица : наименьшая единица, в которой вещество существует в природе.
- Выполните вычисления, включающие преобразования между числом молей и числом атомов или молекул.
Большие числа или маленькие числа?
Вы ненавидите набирать нижние и верхние индексы? Даже с хорошей программой обработки текстов необходимость щелкнуть значок, чтобы получить верхний индекс, а затем не забыть щелкнуть после ввода числа, может быть настоящей проблемой.Если бы мы не знали о молях и просто знали о количестве атомов или молекул (те большие числа, которые требуют большого количества надстрочных индексов), жизнь была бы намного сложнее, и мы допустили бы намного больше ошибок при вводе.
Преобразования между молями и атомами
Преобразование между молями и числом частиц
Используя наши методы преобразования единиц измерения, мы можем использовать метку «моль» для преобразования количества частиц в количество молей и обратно.
Пример задачи 1: преобразование числа частиц в моль
Элемент углерод существует в двух основных формах: графит и алмаз.Сколько молей атомов углерода составляет 4,72 × 10 24 атомов углерода?
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- число атомов C = 4,72 × 10 24
- 1 моль = 6,02 × 10 23 атома
Неизвестно
Один коэффициент преобразования позволит нам преобразовать количество атомов углерода в моль атомов углерода.
Шаг 2: Расчет.
Шаг 3. Подумайте о своем результате.
Указанное число атомов углерода было больше числа Авогадро, поэтому число молей атомов C превышает 1 моль. Поскольку число Авогадро представляет собой измеряемую величину с тремя значащими цифрами, результат вычисления округляется до трех значащих цифр.
Предположим, вы хотите знать, сколько атомов водорода содержится в одном моле молекул воды. Во-первых, вам нужно знать химическую формулу воды: H 2 O. В каждой молекуле воды есть два атома водорода.Сколько атомов водорода было бы в двух молекулах воды? Было бы 2 × 2 = 4 атома водорода. Как насчет дюжины? В этом случае дюжина равна 12, так что 12 × 2 = 24 атома водорода в дюжине молекул воды. Чтобы получить ответы (4 и 24), вам нужно было умножить данное количество молекул на два атома водорода на молекулу. Таким образом, чтобы найти количество атомов водорода в одном моле молекул воды, проблему можно решить, используя коэффициенты пересчета.
Первый коэффициент преобразования конвертирует из молей частиц в количество частиц.Второй коэффициент преобразования отражает количество атомов, содержащихся в каждой молекуле.
Рисунок 10.3
Две молекулы воды содержат 4 атома водорода и 2 атома кислорода. Моль молекул воды содержит 2 моля атомов водорода и 1 моль атомов кислорода.
Пример задачи 2: атомы, молекулы и родинки
Серная кислота имеет химическую формулу H 2 SO 4 . В определенном количестве серной кислоты содержится 4.89 × 10 25 атомов кислорода. Сколько молей серной кислоты в образце?
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- 4,89 × 10 25 = атомы O
- 1 моль = 6,02 × 10 23 молекулы H 2 SO 4
Неизвестно
- моль H 2 SO 4 молекулы
Будут использоваться два коэффициента преобразования.Во-первых, превратите атомы кислорода в молекулы серной кислоты. Затем преобразуйте молекулы серной кислоты в моль серной кислоты.
Шаг 2: Расчет.
Шаг 3. Подумайте о своем результате.
Первоначальное количество атомов кислорода было примерно в 80 раз больше, чем число Авогадро. Поскольку каждая молекула серной кислоты содержит 4 атома кислорода, имеется около 20 молей молекул серной кислоты.
Резюме
- Описаны методы превращений между молями, атомами и молекулами.
Практика
Прочтите соответствующие части следующей статьи и выполните задачи 3, 5, 9, 13 и 18. Не беспокойтесь о расчетах, связанных с преобразованием молярной массы (это будет дальше).
http://faculty.rcc.edu/freitas/1AWorksheets/14GramsToMolesToMolecules.pdf
Обзор
Вопросы
- Какое важное число нам нужно знать, чтобы выполнять эти преобразования?
- Я хочу преобразовать атомы в моли.Мой друг говорит мне умножить количество атомов на 6,02 × 10 23 атома / моль. Это верно?
- Почему я должен знать формулу молекулы, чтобы вычислить количество молей одного из атомов?
- Определите молярную массу.
- Выполните вычисления с использованием молярной массы.
Как мне узнать, сколько каждого вещества добавить при создании раствора?
Я хочу приготовить решение, содержащее 1.8 моль дихромата калия. У меня нет весов, откалиброванных в молекулах, но у меня есть весы, откалиброванные в граммах. Если я знаю соотношение между родинками и количеством граммов в родинке, я могу использовать весы, чтобы отмерить необходимое количество материала.
Молярная масса
Молярная масса определяется как масса одного моля типичных частиц вещества. Посмотрев на таблицу Менделеева, можно сделать вывод, что молярная масса лития составляет 6,94 г, молярная масса цинка — 65.38 г, а молярная масса золота 196,97 г. Каждая из этих величин содержит 6,02 × 10 23 атомов этого конкретного элемента. Единицы измерения молярной массы — граммы на моль или г / моль.
Молярные массы соединений
Молекулярная формула двуокиси углерода CO 2 . Одна молекула углекислого газа состоит из 1 атома углерода и 2 атомов кислорода. Мы можем вычислить массу одной молекулы углекислого газа, сложив массы 1 атома углерода и 2 атомов кислорода.
Молекулярная масса соединения — это масса одной молекулы этого соединения. Молекулярная масса диоксида углерода составляет 44,01 а.е.м.
Молярная масса любого соединения — это масса в граммах одного моля этого соединения. Один моль молекул диоксида углерода имеет массу 44,01 г, а один моль формульных единиц сульфида натрия имеет массу 78,04 г. Молярные массы составляют 44,01 г / моль и 78,04 г / моль соответственно. В обоих случаях это масса 6,02 × 10 23 репрезентативных частиц.Типичная частица CO 2 — это молекула, а для Na 2 S — формульная единица.
Пример задачи: молярная масса соединения
Нитрат кальция, Ca (NO 3 ) 2 , используется в качестве компонента удобрения. Определите молярную массу нитрата кальция.
Шаг 1. Составьте список известных и неизвестных количеств и спланируйте проблему.
Известный
- формула = Ca (NO 3 ) 2
- молярная масса Ca = 40.08 г / моль
- молярная масса N = 14,01 г / моль
- молярная масса O = 16,00 г / моль
Неизвестно
Сначала нам нужно проанализировать формулу. Поскольку у Ca отсутствует нижний индекс, на формульную единицу приходится один атом Ca. Число 2 за скобками означает, что на формульную единицу приходится два нитрат-иона, и каждый нитрат-ион состоит из одного атома азота и трех атомов кислорода. Следовательно, всего на формульную единицу приходится 1 × 2 = 2 атома азота и 3 × 2 = 6 атомов кислорода.Таким образом, 1 моль нитрата кальция содержит 1 моль атомов Ca, 2 моль атомов N и 6 моль атомов O.
Шаг 2: Расчет.
Используйте молярные массы каждого атома вместе с числом атомов в формуле и сложите.
Резюме
- Расчеты описаны для определения молярной массы атома или соединения.
Практика
Прочтите материал по ссылке ниже и решите задачи в конце:
http: // misterguch.brinkster.net/molarmass.html
Обзор
Вопросы
- Какова молярная масса Pb?
- Почему нам нужно включать единицы измерения в наш ответ?
- Я хочу рассчитать молярную массу CaCl 2 . Сколько молей Cl содержится в одном моле соединения?
- Сколько молей H содержится в соединении (NH 4 ) 3 PO 4 ?
- молярная масса : масса одного моля типичных частиц вещества.
- молекулярная масса : масса одной молекулы этого соединения.
- Выполните вычисления, касающиеся преобразования между молями и массой.
Как мы можем получить больше продукции?
Химические предприятия всегда стремятся улучшить свои процессы. Один из способов достижения этого улучшения — измерение количества материала, образующегося в реакции. Зная, сколько производится, ученые и инженеры могут пробовать разные способы получения большего количества продукции с меньшими затратами.
Преобразование молей в массу
Молярная масса любого вещества — это масса одного моля репрезентативных частиц этого вещества в граммах. Типичные частицы могут быть атомами, молекулами или формульными единицами ионных соединений. Это соотношение часто используется в лаборатории. Предположим, что для определенного эксперимента вам нужно 3,00 моль хлорида кальция (CaCl 2 ). Поскольку хлорид кальция является твердым веществом, было бы удобно использовать весы для измерения необходимой массы.Молярная масса CaCl 2 составляет 110,98 г / моль. В таком случае коэффициент преобразования, который можно использовать, основан на том, что 1 моль = 110,98 г CaCl 2 . Анализ размеров позволит вам рассчитать массу CaCl 2 , которую вы должны измерить.
Когда вы измеряете массу 333 г CaCl 2 , вы получаете 3,00 моля CaCl 2 .
Рисунок 10.4
Хлорид кальция используется в качестве осушителя и антиобледенителя.
Пример задачи: преобразование родинок в массу
Хром металлический применяется для декоративной гальваники автомобильных бамперов и других поверхностей. Найдите массу 0,560 моль хрома.
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- молярная масса Cr = 52,00 г моль
- 0,560 моль Cr
Неизвестно
Один коэффициент преобразования позволит нам преобразовать из молей Cr в массу.
Шаг 2: Расчет.
Шаг 3. Подумайте о своем результате.
Поскольку желаемое количество составляло чуть больше половины моля, масса должна быть чуть больше половины молярной массы. Ответ состоит из трех значащих цифр из-за 0,560 мол.
Аналогичный коэффициент преобразования, использующий молярную массу, можно использовать для преобразования массы вещества в моль. В лабораторных условиях вы можете провести реакцию и произвести определенное количество продукта, которое можно массировать.Часто бывает необходимо определить количество молей образовавшегося продукта. Следующая проблема иллюстрирует эту ситуацию.
Пример задачи: преобразование массы в моли
Определенная реакция дает 2,81 г гидроксида меди (II), Cu (OH) 2 . Определите количество молей, образующихся в реакции.
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
Неизвестно
Один коэффициент преобразования позволит нам перевести массу в моль.
Шаг 2: Расчет.
Сначала необходимо вычислить молярную массу Cu (OH) 2 из молярных масс Cu, O и H. Молярная масса составляет 97,57 г / моль.
Шаг 3. Подумайте о своем результате.
Относительно небольшая масса образующегося продукта приводит к небольшому количеству молей.
Резюме
- Описываются расчеты, включающие преобразования между молями материала и массой этого материала.
Практика
Прочтите материал по ссылке ниже и решите задачи в конце.
http://www.occc.edu/kmbailey/chem1115tutorials/Stoichiometry_Molar_Mass_Calculations.htm
Обзор
Вопросы
- Зачем нужно рассчитывать массу материала?
- Зачем вам определять, сколько молей материала вы образовали в результате реакции?
- У вас есть 19,7 грамма материала и вы задаетесь вопросом, сколько родинок образовалось.Ваш друг говорит вам умножить массу на грамм / моль. Ваш друг прав?
- Выполнение расчетов, включающих преобразование массы и количества частиц.
Сколько там газа?
Авогадро интересовался газами. Он предположил, что равные объемы газов при одинаковых условиях содержат одинаковое количество частиц. Другие исследователи изучали, сколько частиц газа содержится в определенном объеме газа.В конце концов, ученые смогли установить взаимосвязь между количеством частиц и массой, используя идею молей.
Преобразование между массой и числом частиц
В разделе «Преобразования между молями и массой» вы узнали, как преобразовывать туда и обратно между молями и количеством типичных частиц. Теперь вы увидели, как переводить между молями и массой вещества в граммах и обратно. Мы можем объединить два типа проблем в одну. И масса, и количество частиц связаны с граммами.Чтобы преобразовать массу в число частиц или наоборот, сначала потребуется преобразование в моль.
Рисунок 10,5
Для преобразования числа частиц в массу или из массы в число частиц требуется два шага
Пример задачи: преобразование массы в частицы
Сколько молекул в 20,0 г газообразного хлора, Cl 2 ?
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- молярная масса Cl 2 = 70,90 г / моль
- 20,0 г Cl 2
Неизвестно
- количество молекул Cl 2
Используйте два коэффициента преобразования. Первый преобразует граммы Cl 2 в моль. Второй преобразует моли Cl 2 в количество молекул.
Шаг 2: Расчет.
Задача решается с использованием двух последовательных коэффициентов пересчета.Нет необходимости явно рассчитывать моль Cl 2 .
Шаг 3. Подумайте о своем результате.
Поскольку данная масса меньше половины молярной массы хлора, результирующее количество молекул будет меньше половины числа Авогадро.
Резюме
- Расчеты проиллюстрированы для преобразования между массой и количеством частиц.
Практика
Прочтите материал по ссылке ниже, а затем выполните задачи на странице 9 и задачу на странице 17 (не вдавайтесь в подробности, пока не попробуете задачи).
http://schools.fwps.org/decatur-old/staff/adewaraja/chemistry/curriculum%20units/chapter%2010/Lesson5/particle_mole_mass_calcu.pdf
Обзор
Вопросы
- Почему мы не можем напрямую преобразовать количество частиц в граммы?
- Сколько атомов хлора присутствует в указанной выше задаче?
- Согласно периодической таблице, атомный вес хлора равен 35,5. Почему я не могу использовать это значение в своих расчетах?
- Государственная гипотеза Авогадро.
- Определите стандартные температуру и давление.
- Определите молярный объем.
Как аквалангисты узнают, кончится ли у них бензин?
Знание того, сколько газа доступно для погружения, имеет решающее значение для выживания дайвера. Баллон на спине дайвера оборудован датчиками, показывающими, сколько газа присутствует и какое давление. Базовые знания о поведении газа позволяют дайверу оценить, как долго оставаться под водой, не создавая проблем.
Гипотеза Авогадро и молярный объем
Объем — это третий способ измерения количества вещества после подсчета и массы предметов. Объем жидкостей и твердых тел сильно зависит от плотности вещества. Это связано с тем, что твердые и жидкие частицы упакованы близко друг к другу, а между ними очень мало места. Однако газы в основном состоят из пустого пространства между фактическими частицами газа (см. Рисунок ниже).
Рисунок 10.6
Частицы газа очень маленькие по сравнению с большим количеством пустого пространства между ними.
В 1811 году Амедео Авогадро объяснил, что объемы всех газов можно легко определить. Гипотеза Авогадро утверждает, что равные объемы всех газов при одинаковой температуре и давлении содержат одинаковое количество частиц. Поскольку общий объем, занимаемый газом, состоит в основном из пустого пространства между частицами, фактический размер самих частиц практически ничтожен.Данный объем газа с небольшими легкими частицами, такими как водород (H 2 ), содержит такое же количество частиц, как такой же объем тяжелого газа с крупными частицами, такими как гексафторид серы, SF 6 .
Газы сжимаются, что означает, что при воздействии высокого давления частицы сближаются друг с другом. Это уменьшает количество пустого пространства и уменьшает объем газа. На объем газа также влияет температура. Когда газ нагревается, его молекулы движутся быстрее, и газ расширяется.Из-за изменения объема газа из-за изменений давления и температуры сравнение объемов газа необходимо проводить при одной стандартной температуре и давлении. Стандартная температура и давление (STP) определяется как 0 ° C (273,15 K) и давление 1 атм. Молярный объем газа — это объем одного моля газа на STP. В STP один моль (6,02 × 10 23 типичных частиц) любого газа занимает объем 22,4 л ( Рисунок ниже).
Рисунок 10.7
Моль любого газа занимает 22,4 л при стандартной температуре и давлении (0 ° C и 1 атм).
Рисунок ниже показывает, как можно увидеть молярный объем при сравнении различных газов. Образцы гелия (He), азота (N 2 ) и метана (CH 4 ) находятся на СТП. Каждый содержит 1 моль или 6,02 × 10 23 частиц. Однако масса каждого газа разная и соответствует молярной массе этого газа: 4.00 г / моль для He, 28,0 г / моль для N 2 и 16,0 г / моль для CH 4 .
Рисунок 10.8
Гипотеза Авогадро утверждает, что равные объемы любого газа при одинаковой температуре и давлении содержат одинаковое количество частиц. При стандартной температуре и давлении 1 моль любого газа занимает 22,4 л.
Резюме
- Одинаковые объемы газов при одинаковых условиях содержат одинаковое количество частиц.
- Определены стандартные температура и давление.
Практика
Вопросы
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://chemed.chem.purdue.edu/demos/main_pages/4.6.html
- Каков был объем каждого взвешенного газа?
- Что обнаружил эксперимент?
- Какая связь между массой газа и молекулярной массой?
Обзор
Вопросы
- Что мы знаем о пространстве, фактически занимаемом газом?
- Почему нам нужно проводить все сравнения при одинаковой температуре и давлении?
- Как мы можем использовать эту информацию?
- Гипотеза Авогадро: Равные объемы всех газов при одинаковой температуре и давлении содержат равное количество частиц.
- мольный объем: Объем одного моля газа на STP.
- стандартные температура и давление (STP): 0 ° C (273,15 K) и давление 1 атм.
- Преобразует объем газа в количество молей этого газа.
Как узнать, сколько газа в этих баллонах?
Небольшие газовые баллоны часто используются для подачи газов для химических реакций. Газомер даст некоторую информацию о том, сколько находится в резервуаре, но необходимы количественные оценки, чтобы реакция могла продолжаться до завершения.Знание того, как рассчитать необходимые параметры для газов, очень полезно, чтобы не закончиться слишком рано.
Преобразование молей в объем газа
Молярный объем в STP можно использовать для преобразования из молей в объем газа и из объема газа в моли. Равенство 1 моль = 22,4 л является основанием для коэффициента преобразования.
Пример задачи один: преобразование объема газа в моль
Многие металлы реагируют с кислотами с образованием газообразного водорода. Определенная реакция производит 86.5 л газообразного водорода на СТП. Сколько молей водорода было произведено?
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- 86,5 л В 2
- 1 моль = 22,4 л
Неизвестно
Примените коэффициент преобразования для перевода литров в моль.
Шаг 2: Расчет.
Шаг 3. Подумайте о своем результате.
Объем произведенного газа почти в четыре раза превышает молярный объем.Тот факт, что газ является водородом, не играет роли в расчетах.
Пример второй задачи: преобразование молей в объем газа
Какой объем занимает 4,96 моль O 2 на STP?
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- 4,96 моль O 2
- 1 моль = 22,4 л
Неизвестно
Шаг 2: Расчет.
Шаг 3. Подумайте о своем результате.
Объем кажется правильным с учетом количества молей.
Пример задачи 3: преобразование объема в массу
Если мы знаем объем пробы газа на STP, мы можем определить ее массу. Предположим, у нас есть 867 литров N 2 на STP. Какова масса газообразного азота?
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- 867 L N 2
- 1 моль = 22.4 л
- молярная масса N 2 = 28,02 г / моль
Неизвестно
Шаг 2: Расчет.
Начнем с определения количества присутствующих молей газа. Мы знаем, что 22,4 литра газа на СТП равны одному моль, поэтому:
Нам также известна молекулярная масса N 2 (28,0 г / моль), поэтому мы можем рассчитать вес газообразного азота в 867 литрах:
Шаг 3. Подумайте о своем результате.
В многоэтапной задаче убедитесь, что проверяют блоки.
Резюме
- Показаны преобразования между молями и объемом газа.
Практика
Выполните практические задания по ссылке ниже. Сосредоточьтесь на преобразованиях между объемом и молями, но попробуйте другие:
http://www.sciencegeek.net/Chemistry/taters/Unit4GramMoleVolume.htm
Обзор
Вопросы
- Почему газы должны быть на СТП?
- Когда идентичность газа становится важной?
- Выполните расчеты молярной массы и плотности газа.
Почему углекислый газ опускается в воздух?
Когда мы запускаем реакцию по выделению газа, мы ожидаем, что он поднимется в воздух. Многие студенты проводили эксперименты, в которых образуются такие газы, как водород. Газ может быть захвачен в пробирке, перевернутой над реакцией. С другой стороны, углекислый газ тонет при высвобождении. Двуокись углерода имеет плотность больше, чем воздух, поэтому она не поднимается, как другие газы.
Плотность газа
Как известно, плотность определяется как масса единицы объема вещества.Поскольку все газы занимают один и тот же объем на моль, плотность конкретного газа зависит от его молярной массы. Газ с небольшой молярной массой будет иметь меньшую плотность, чем газ с большой молярной массой. Плотность газа обычно указывается в г / л. Плотность газа можно рассчитать по молярной массе и молярному объему.
Рисунок 10.9
Воздушные шары, наполненные газом гелием, плавают в воздухе, потому что плотность гелия меньше плотности воздуха.
Пример проблемы один: плотность газа
Какова плотность газообразного азота на СТП?
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- N 2 = 28,02 г / моль
- 1 моль = 22,4 л
Неизвестно
Молярная масса, разделенная на молярный объем, дает плотность газа в STP.
Шаг 2: Расчет.
При настройке с коэффициентом преобразования, моль отменяется, оставляя г / л в качестве единицы в результате.
Шаг 3. Подумайте о своем результате.
Молярная масса азота немного больше молярного объема, поэтому плотность немного больше 1 г / л.
В качестве альтернативы, молярная масса газа может быть определена, если плотность газа в STP известна.
Пример второй задачи: молярная масса по плотности газа
Какова молярная масса газа, плотность которого составляет 0,761 г / л на STP?
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- N 2 = 28,02 г / моль
- 1 моль = 22,4 л
Неизвестно
Молярная масса равна произведению плотности на молярный объем.
Шаг 2: Расчет.
Шаг 3. Подумайте о своем результате.
Поскольку плотность газа меньше 1 г / л, молярная масса меньше 22,4.
Резюме
- Приведены расчеты, показывающие преобразования между молярной массой и плотностью для газов.
Практика
Вопросы
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://employees.oneonta.edu/viningwj/sims/gas_de density_s.html
- Какой из газов имеет самую высокую плотность?
- Какой газ имеет самую низкую плотность?
- Можно ли ожидать, что у азота плотность выше или ниже, чем у кислорода? Почему?
Обзор
Вопросы
- Как рассчитывается плотность?
- Как рассчитывается молярная масса?
- Какой бы объем 3.5 молей газа?
- Выполните расчеты, включающие взаимное преобразование массы, молей и объема газа.
Как мне добраться отсюда туда?
Если я хочу посетить город Мантео, Северная Каролина, на побережье, мне понадобится карта, как туда добраться. У меня может быть распечатанная карта или я могу загрузить маршруты из Интернета, но мне нужно что-то, что поможет мне двигаться в правильном направлении. Дорожные карты по химии служат той же цели.Как вести себя с определенным типом расчетов? Есть процесс и набор инструкций, которые могут помочь.
Mole Дорожная карта
Ранее мы видели, как преобразование между массой и числом частиц требовало двух шагов, с промежуточными молями. Теперь эту концепцию можно расширить, включив также объем газа на СТП. Получившаяся диаграмма называется «дорожной картой» (см. Рисунок ниже).
Рисунок 10.10
Дорожная карта крота показывает коэффициенты пересчета, необходимые для взаимного преобразования между массой, количеством частиц и объемом газа.
Моль находится в центре любого расчета количества вещества. Приведенный ниже пример проблемы является одной из многих различных проблем, которые можно решить с помощью дорожной карты крота.
Пример проблемы 1: Дорожная карта Mole
Какой объем неонового газа на СТП составляет 79,3 г?
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- Ne = 20,18 г / моль
- 1 моль = 22,4 л
Неизвестно
Коэффициенты пересчета будут: граммы → моль → объем газа.
Шаг 2: Расчет.
Шаг 3. Подумайте о своем результате.
Данная масса неона равна примерно 4 молям, в результате объем примерно в 4 раза превышает молярный объем.
Резюме
- Приведен общий процесс расчетов, включающих моль, граммы и объем газа.
Практика
Воспользуйтесь ссылкой ниже, чтобы выполнить некоторые практические расчеты. Выполните задачи 1, 2 и 5 (вы можете попробовать другие, если чувствуете себя особенно храбрым):
http: // www.docbrown.info/page04/4_73calcs/MVGmcTEST.htm
Обзор
Вопросы
- Какова формула веса неона в приведенной выше задаче?
- Какая стоимость находится в центре всех расчетов?
- Если бы у нас было 79,3 грамма Xe, ожидали бы мы объем больше или меньше, чем полученный с неоном?
- Определите процентный состав.
- Выполните расчет процентного состава.
Есть ли в этой банке что-нибудь полезное?
Упакованные продукты, которые вы едите, обычно содержат информацию о пищевой ценности на этикетке.Этикетка на банке с арахисовым маслом (показанная выше) показывает, что размер одной порции составляет 32 г. На этикетке также указаны массы различных типов соединений, которые присутствуют в каждой порции. Одна порция содержит 7 г белка, 15 г жира и 3 г сахара. Вычисляя долю белка, жира или сахара в одной порции арахисового масла и переводя его в процентные значения, мы можем определить состав арахисового масла в процентах по массе.
Процентный состав
Химикам часто нужно знать, какие элементы присутствуют в соединении и в каком процентном соотношении.Состав на процентов — это массовый процент каждого элемента в соединении. Он рассчитывается аналогично тому, как мы только что указали для арахисового масла.
Процентный состав по массовым данным
Пример задачи ниже показывает расчет процентного состава соединения на основе данных о массе.
Пример первой задачи: процентный состав от массы
Известно, что недавно синтезированное соединение содержит элементы цинк и кислород.Когда 20,00 г образца разлагается, остается 16,07 г цинка. Определите процентный состав соединения.
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- масса соединения = 20,00 г
- масса Zn = 16,07 г
Неизвестно
- процентов Zn =? %
- процентов O =? %
Вычтите, чтобы найти массу кислорода в соединении. Разделите массу каждого элемента на массу соединения, чтобы найти процент по массе.
Шаг 2: Расчет.
Шаг 3. Подумайте о своем результате.
Расчеты имеют смысл, потому что сумма двух процентов в сумме дает 100%. По массе это преимущественно цинк.
Процентный состав химической формулы
Процентный состав соединения также можно определить по формуле соединения. Нижние индексы в формуле сначала используются для расчета массы каждого элемента в одном моль соединения.Это делится на молярную массу соединения и умножается на 100%.
Процентный состав данного соединения всегда один и тот же, если соединение чистое.
Пример второй задачи: процентный состав химической формулы
Дихлоргептоксид (Cl 2 O 7 ) представляет собой высокореактивное соединение, используемое в некоторых реакциях органического синтеза. Рассчитайте процентный состав дихлоргептоксида.
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- Масса Cl в 1 моль Cl 2 O 7 = 70,90 г
- масса O в 1 моль Cl 2 O 7 = 112,00 г
- молярная масса Cl 2 O 7 = 182,90 г / моль
Неизвестно
- процентов Cl =? %
- процентов O =? %
Рассчитайте массовый процент каждого элемента, разделив массу этого элемента в 1 моль соединения на молярную массу соединения и умножив на 100%.
Шаг 2: Расчет.
Шаг 3. Подумайте о своем результате.
Сумма процентов составляет 100%.
Процентный состав также можно использовать для определения массы определенного элемента, который содержится в любой массе соединения. В предыдущем примере задачи было обнаружено, что процентный состав дихлоргептоксида составляет 38,76% Cl и 61,24% O. Предположим, вам нужно знать массы хлора и кислорода, присутствующие в 12.50 г образца дихлоргептоксида. Вы можете установить коэффициент преобразования, основанный на массовых процентах каждого элемента.
Сумма двух масс составляет 12,50 г, что соответствует массе пробы.
Резюме
- Описаны процессы расчета процентного состава материала на основе массы или химического состава.
Практика
Воспользуйтесь ссылкой ниже, чтобы просмотреть материал и произвести расчеты. Прочтите обе части урока и сделайте столько расчетов, сколько у вас будет времени.
http://www.chemteam.info/Mole/Percent-Composition-Part1.html
Обзор
Вопросы
- Какова формула расчета процентного состава?
- Какая информация вам нужна для расчета процентного состава по массе?
- О чем говорят индексы в химической формуле?
- процент состава: Массовый процент каждого элемента в соединении.
- Определите гидрат.
- Рассчитайте процентное содержание воды в гидрате, если предоставите соответствующие данные.
Почему меняется цвет?
Если вы посмотрите на обычную бутылку медного купороса, она будет голубовато-зеленой. Если кто-то скажет вам, что сульфат меди белого цвета, вы им не поверите. Вы оба правы; это просто зависит от сульфата меди. К вашему сине-зеленому сульфату меди присоединено несколько молекул воды, в то время как сульфат меди вашего друга безводный (без воды).В чем разница? Молекулы воды взаимодействуют с некоторыми d-электронами в ионе меди и создают цвет. Когда вода удаляется, электронная конфигурация меняется, и цвет исчезает.
Процент воды в гидрате
Многие ионные соединения в природе содержат воду как часть кристаллической решетки. Гидрат — это соединение, которое имеет одну или несколько молекул воды, связанных с каждой формульной единицей. Ионные соединения, содержащие переходный металл, часто сильно окрашены.Интересно, что гидратированная форма соединения обычно имеет другой цвет, чем безводная форма , которая не имеет воды в своей структуре. Гидрат обычно можно превратить в безводное соединение нагреванием. Например, безводный хлорид кобальта (II) имеет синий цвет, а гидрат — характерный пурпурный цвет.
Рисунок 10.11
Слева — безводный хлорид кобальта (II), CoCl 2 .Справа представлена гидратированная форма соединения, называемого гексагидратом хлорида кобальта (II), CoCl 2 • 6H 2 O.
Гидратированная форма хлорида кобальта (II) содержит шесть молекул воды в каждой формульной единице. Название соединения — гексагидрат хлорида кобальта (II), а его формула — CoCl 2 • 6H 2 O. Формула воды выделена в конце формулы точкой, за которой следует коэффициент, представляющий количество молекул воды на формульную единицу.
Полезно знать процент воды, содержащейся в гидрате. В приведенном ниже примере проблемы демонстрируется процедура.
Пример первой проблемы: процент воды в гидрате
Найдите процент воды в гексагидрате хлорида кобальта (II), CoCl 2 • 6H 2 O.
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Масса воды в гидрате — это коэффициент (6), умноженный на молярную массу H 2 O.Молярная масса гидрата равна молярной массе CoCl 2 плюс масса воды.
Известный
- Масса H 2 O в 1 моль гидрата = 108,12 г
- молярная масса гидрата = 237,95 г / моль
Неизвестно
Рассчитайте массовый процент воды, разделив массу H 2 O в 1 моль гидрата на молярную массу гидрата и умножив на 100%.
Шаг 2: Расчет.
Шаг 3. Подумайте о своем результате.
Почти половина массы гидрата состоит из молекул воды внутри кристалла.
Резюме
- Описан процесс вычисления процента воды в гидрате.
Практика
Воспользуйтесь следующей ссылкой, чтобы попрактиковаться в вычислении процента воды в гидрате:
http://www.sd84.k12.id.us/shs/departments/science/martz/2007_ssem2/Chemistry/hydrate.htm
Обзор
Вопросы
- Что такое гидрат?
- Как превратить гидрат в безводное соединение?
- Что означает гексагидрат?
- Безводный: Без воды.
- Гидрат: Соединение, которое имеет одну или несколько молекул воды, связанных с каждой формульной единицей
- Определите эмпирическую формулу.
- Рассчитайте эмпирическую формулу соединения, используя элементный анализ соединения.
Что происходит на этой картинке?
На заре химии инструментов для детального изучения соединений было немного. Большая часть информации о составе соединений пришла из элементного анализа неорганических материалов. «Новая» область органической химии (изучение соединений углерода) столкнулась с проблемой невозможности полностью охарактеризовать соединение. Относительные количества элементов можно было определить, но очень многие из этих материалов содержали углерод, водород, кислород и, возможно, азот в простых соотношениях.Мы не знали точно, сколько этих атомов на самом деле было в конкретной молекуле.
Определение эмпирических формул
Эмпирическая формула — это формула, которая показывает наименьшее целочисленное отношение элементов в соединении. Поскольку структура ионных соединений представляет собой расширенную трехмерную сеть положительных и отрицательных ионов, все формулы ионных соединений являются эмпирическими. Однако мы также можем рассмотреть эмпирическую формулу молекулярного соединения.Этен представляет собой небольшое углеводородное соединение с формулой C 2 H 4 (см. рисунок ниже). Хотя C 2 H 4 является его молекулярной формулой и представляет его истинную молекулярную структуру, он имеет эмпирическую формулу CH 2 . Простейшее отношение углерода к водороду в этене составляет 1: 2. Это соотношение можно посмотреть двумя способами. Рассматривая одну молекулу этена, соотношение составляет 1 атом углерода на каждые 2 атома водорода.Рассматривая один моль этена, соотношение составляет 1 моль углерода на каждые 2 моля водорода. Таким образом, нижние индексы в формуле представляют мольное соотношение элементов в этой формуле.
Рисунок 10.12
Шарообразная модель этена, C 2 H 4 .
В процедуре под названием элементный анализ неизвестное соединение может быть проанализировано в лаборатории, чтобы определить процентное содержание каждого элемента, содержащегося в нем.Эти проценты можно преобразовать в мольное соотношение элементов, что приводит к эмпирической формуле. Шаги, которые необходимо предпринять, изложены ниже.
- Предположим, что проба соединения составляет 100 г, чтобы данные проценты можно было напрямую преобразовать в граммы.
- Используйте молярную массу каждого элемента, чтобы преобразовать граммы каждого элемента в моль.
- Чтобы найти целочисленное соотношение, разделите моли каждого элемента на то, какое из молей из шага 2 является наименьшим.
- Если все родинки в этой точке являются целыми числами (или очень близкими), эмпирическая формула может быть записана с молями в качестве нижнего индекса каждого элемента.
- В некоторых случаях одно или несколько молей, вычисленных на шаге 3, не будут целыми числами. Умножьте каждую из родинок на наименьшее целое число, которое превратит каждую из них в целое число. Напишите эмпирическую формулу.
Пример первой задачи: определение эмпирической формулы соединения
Соединение железа и кислорода проанализировано и обнаружено, что оно содержит 69.94% железа и 30,06% кислорода. Найдите эмпирическую формулу соединения.
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- % Fe = 69,94%
- % O = 30,06%
Неизвестно
- Эмпирическая формула = Fe ? O ?
Действия, которые необходимо выполнить, изложены в тексте.
Шаг 2: Расчет.
1. Возьмем образец весом 100 г.
2. Перевести в моли.
3. Разделите обе родинки на наименьшее из результатов.
4/5. Поскольку моли O, по-прежнему не являются целым числом, оба моли можно умножить на 2, округлив при этом до целого числа.
Эмпирическая формула соединения: Fe 2 O 3 .
Шаг 3. Подумайте о своем результате.
Нижние индексы представляют собой целые числа и представляют мольное соотношение элементов в соединении.Соединение представляет собой ионное соединение оксида железа (III).
Резюме
- Описан процесс расчета эмпирической формулы для соединения на основе процентного содержания этого соединения.
Практика
Воспользуйтесь ссылкой ниже, чтобы прочитать о вычислении эмпирических формул и попрактиковаться в решении некоторых задач:
http://www.chemteam.info/Mole/EmpiricalFormula.html
Обзор
Вопросы
- Что такое эмпирическая формула?
- Что вам говорит эмпирическая формула?
- О чем он вам не говорит?
- элементный анализ: Определяет процентное содержание каждого элемента в соединении.
- эмпирическая формула: Показывает наименьшее целочисленное отношение элементов в соединении.
- Определите молекулярную формулу.
- Определите молекулярную формулу, указав эмпирическую формулу и молярную массу соединения.
Как определить разницу между этими двумя молекулами?
Выше мы видим два углевода: глюкозу и сахарозу. Сахароза почти в два раза больше глюкозы, хотя их эмпирические формулы очень похожи.Некоторые люди могут различить их на основе вкуса, но не рекомендуется пробовать химические вещества на вкус. Лучший способ — определить молекулярную массу — этот подход позволяет легко определить, какое соединение является каким.
Молекулярные формулы
Молекулярные формулы дают вид и количество атомов каждого элемента, присутствующего в молекулярном соединении. Во многих случаях молекулярная формула совпадает с эмпирической формулой. Молекулярная формула метана — CH 4 , и поскольку он содержит только один атом углерода, это также его эмпирическая формула.Однако иногда молекулярная формула представляет собой простое целое число, кратное эмпирической формуле. Уксусная кислота — это органическая кислота, которая является основным компонентом уксуса. Его молекулярная формула: C 2 H 4 O 2 . Глюкоза — это простой сахар, который клетки используют в качестве основного источника энергии. Его молекулярная формула: C 6 H 12 O 6 . Структуры обеих молекул показаны на рисунке ниже. Это очень разные соединения, но оба имеют одну и ту же эмпирическую формулу CH 2 O.
Рисунок 10.13
Уксусная кислота (слева) имеет молекулярную формулу C 2 H 4 O 2 , а глюкоза (справа) имеет молекулярную формулу C 6 H 12 O 6 . Оба имеют эмпирическую формулу CH 2 O.
Эмпирические формулы могут быть определены на основе процентного содержания соединения. Чтобы определить его молекулярную формулу, необходимо знать молярную массу соединения.Химики используют инструмент, называемый масс-спектрометром, для определения молярной массы соединений. Чтобы перейти от эмпирической формулы к молекулярной формуле, выполните следующие действия:
- Рассчитайте эмпирической формулы массы (EFM) , которая представляет собой просто молярную массу, представленную эмпирической формулой.
- Разделите молярную массу соединения на массу, полученную по эмпирической формуле. Результат должен быть целым числом или очень близким к целому числу.
- Умножьте все индексы в эмпирической формуле на целое число, полученное на шаге 2.Результатом является молекулярная формула.
Пример задачи один: определение молекулярной формулы соединения
Эмпирическая формула соединения бора и водорода: BH 3 . Его молярная масса составляет 27,7 г / моль. Определите молекулярную формулу соединения.
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- эмпирическая формула = BH 3
- молярная масса = 27.7 г / моль
Неизвестно
Действия, которые необходимо выполнить, изложены в тексте.
Шаг 2: Расчет.
1. Эмпирическая формула массы (EFM) = 13,84 г / моль
2.
3.
Молекулярная формула соединения: B 2 H 6 .
Шаг 3. Подумайте о своем результате.
Молярная масса молекулярной формулы соответствует молярной массе соединения.
Резюме
- Описана процедура, позволяющая вычислить точную молекулярную формулу соединения.
Практика
Используйте ссылку ниже, чтобы получить доступ к практическим задачам. Попробуйте столько, сколько у вас есть на:
http://chemistry.about.com/od/chemistry-test-questions/tp/Molecular-Formula-Practice-Test-Questions.htm
Обзор
Вопросы
- В чем разница между эмпирической формулой и молекулярной формулой?
- Что нужно знать, помимо элементного анализа, для расчета молекулярной формулы?
- Что вам говорит эмпирическая формула массы?
- эмпирическая формула масса (EFM): Молярная масса, представленная эмпирической формулой.
- Молекулярная формула: Указывает тип и количество атомов каждого элемента, присутствующего в молекулярном соединении.
Нонагидрат нитрата железа (III) | AMERICAN ELEMENTS ®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Нонагидрат нитрата железа (III)
Номер продукта: Все применимые коды продуктов American Elements, например FE3-NAT-02-C.9HYD , FE3-NAT-03-C.9HYD , FE3-NAT-04-C.9HYD , FE3-NAT-05-C.9HYD
Номер CAS: 7782-61-8
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел .: +1 310-208-0551
Факс: +1 310-208-0351Телефон экстренной связи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887РАЗДЕЛ 2.ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
2.1 Классификация вещества или смеси
Классификация GHS в соответствии с 29 CFR 1910 (OSHA HCS)
Разъедание кожи (Категория 1B), h414
Серьезное повреждение глаз (Категория 1), h4182.2 Элементы маркировки GHS, включая меры предосторожности
Пиктограмма
Сигнальное слово Опасно
Краткая характеристика опасности
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
h418 Вызывает серьезное повреждение глаз.
Меры предосторожности
P260 Избегать вдыхания пыли или тумана.
P264 После работы тщательно вымыть кожу.
P280 Пользоваться защитными перчатками / защитной одеждой / средствами защиты глаз / лица.
Защита лица.
P301 + P330 + P331 ПРИ ПРОГЛАТЫВАНИИ: Прополоскать рот. Не вызывает рвоту.
P303 + P361 + P353 ПРИ ПОПАДАНИИ НА КОЖУ (или волосы): немедленно снять всю загрязненную одежду.
Промыть кожу водой / принять душ.
P304 + P340 + P310 ПРИ ВДЫХАНИИ: Вывести человека на свежий воздух и обеспечить ему комфорт для дыхания
. Немедленно обратитесь в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР или к врачу / терапевту.
P305 + P351 + P338 + P310 ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промыть глаза водой в течение нескольких минут. Снимите контактные линзы
, если они есть, и это легко сделать. Продолжайте полоскание. Немедленно
позвоните в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР или к врачу / терапевту.
P363 Постирать загрязненную одежду перед повторным использованием.
P405 Хранить под замком.
P501 Удалить содержимое / контейнер на утвержденный завод по утилизации отходов.
2.3 Опасности, не классифицированные иным образом (HNOC) или не охваченные GHS — нетРАЗДЕЛ 3. СОСТАВ / ИНФОРМАЦИЯ ОБ ИНГРЕДИЕНТАХ
3.1 Вещества
Синонимы: Нитрат железа
Формула: FeN3O9 9h3O
Молекулярный вес: 404,00 г / моль
CAS-Номер. : 7782-61-8
EC-No. : 233-899-5
Опасные компоненты
Классификация компонентов Концентрация
Нонагидрат нитрата железа
Skin Corr. 1B; Eye Dam. 1;
h414, h418РАЗДЕЛ 4. ПЕРВАЯ ПОМОЩЬ
4.1 Описание мер первой помощи
Общие рекомендации
Проконсультируйтесь с врачом. Покажите этот паспорт безопасности лечащему врачу.Выйти из опасной зоны.
При вдыхании
При вдыхании вывести человека на свежий воздух. Если нет дыхания проведите искусственную вентиляцию легких. Проконсультируйтесь с врачом.
При попадании на кожу
Немедленно снять загрязненную одежду и обувь. Смыть большим количеством воды с мылом. Проконсультируйтесь с врачом.
При попадании в глаза
Тщательно промыть большим количеством воды не менее 15 минут и обратиться к врачу. Продолжайте промывать глаза во время транспортировки
в больницу.
При проглатывании
НЕ вызывать рвоту.Никогда ничего не давайте человеку без сознания. Прополоскать рот водой. Проконсультируйтесь с врачом
.
4.2 Наиболее важные симптомы и эффекты, как острые, так и замедленные
Наиболее важные известные симптомы и эффекты описаны в маркировке (см. Раздел 2.2) и / или в разделе 11
4.3 Указание на необходимость немедленной медицинской помощи и специального лечения
Нет имеющиеся данныеРАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
5.1 Средства пожаротушения
Подходящие средства пожаротушения
Используйте водяной спрей, спиртоустойчивую пену, сухой химикат или двуокись углерода.
5.2 Особые опасности, создаваемые веществом или смесью
Оксиды азота (NOx), оксиды серы, оксиды борана / бора, оксиды железа
5.3 Рекомендации для пожарных
При необходимости надеть автономный дыхательный аппарат для тушения пожара.
5.4 Дополнительная информация
Данные отсутствуютРАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
6.1 Меры личной безопасности, защитное снаряжение и порядок действий в чрезвычайной ситуации
Используйте средства индивидуальной защиты. Избегайте образования пыли.Избегайте вдыхания паров, тумана или газа. Обеспечьте соответствующую вентиляцию
. Эвакуируйте персонал в безопасные зоны. Избегайте вдыхания пыли.
Информацию о личной защите см. В разделе 8.
6.2 Меры по защите окружающей среды
Не допускать попадания продукта в канализацию.
6.3 Методы и материалы для локализации и очистки
Подобрать и организовать утилизацию без образования пыли. Подмести и лопатой. Хранить в подходящих закрытых контейнерах для утилизации
.
6.4 Ссылка на другие разделы
Для утилизации см. Раздел 13.РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
7.1 Меры предосторожности для безопасного обращения
Избегайте образования пыли и аэрозолей. Дальнейшая обработка твердых материалов может привести к образованию горючей пыли
. Перед дополнительной обработкой
следует принять во внимание возможность образования горючей пыли.
Обеспечьте соответствующую вытяжную вентиляцию в местах образования пыли.
Меры предосторожности см. В разделе 2.2.
7.2 Условия для безопасного хранения с учетом любых несовместимостей.
Хранить контейнер плотно закрытым в сухом и хорошо вентилируемом месте.
гигроскопичный Хранить в инертном газе.
Класс хранения (TRGS 510): негорючие, коррозионные опасные материалы
7.3 Конечное (ые) использование (я)
За исключением случаев использования, упомянутых в разделе 1.2, другие специальные применения не предусмотреныРАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ / ИНДИВИДУАЛЬНАЯ ЗАЩИТА
8.1 Параметры контроля
Компоненты с параметрами контроля рабочего места
Компонент CAS-№. Параметр Value Control
Basis
Нитрат железа
нонагидрат
7782-61-8 TWA 1.000000
мг / м3
США. Пороговые значения ACGIH
(TLV)
Примечания Раздражение верхних дыхательных путей
Раздражение кожи
варьируется
TWA 1.000000
мг / м3
США. Рекомендуемый NIOSH
Пределы воздействия
TWA 1 мг / м3 США. Пороговые значения ACGIH
(TLV)
Раздражение верхних дыхательных путей
Раздражение кожи
варьируется
TWA 1 мг / м3 США. Рекомендуемые NIOSH пределы воздействия
8.2 Средства контроля воздействия
Соответствующие технические средства контроля
Обращаться в соответствии с надлежащей практикой промышленной гигиены и техники безопасности.Мыть руки перед перерывами и по окончании
рабочего дня.
Средства индивидуальной защиты
Защита глаз / лица
Защитная маска и защитные очки Используйте средства защиты глаз, протестированные и одобренные в соответствии с соответствующими государственными стандартами
, такими как NIOSH (США) или EN 166 (ЕС).
Защита кожи
Работать в перчатках. Перед использованием перчатки необходимо проверить. Используйте надлежащую технику снятия перчатки (не касайтесь
внешней поверхности перчатки), чтобы избежать контакта кожи с этим продуктом. Утилизируйте загрязненные перчатки после использования
в соответствии с применимыми законами и надлежащей лабораторной практикой.Вымойте и высушите руки.
Полный контакт
Материал: нитриловый каучук
Минимальная толщина слоя: 0,11 мм
Время прорыва: 480 мин
Испытанный материал: Dermatril® (KCL 740 / Aldrich Z677272, размер M)
Контакт с брызгами
Материал: нитриловый каучук
Минимальная толщина слоя : 0,11 мм
Время прорыва: 480 мин
Испытанный материал: Dermatril® (KCL 740 / Aldrich Z677272, размер M)
Источник данных: KCL GmbH, D-36124 Eichenzell, телефон +49 (0) 6659 87300, электронная почта [email protected], метод испытания:
EN374
При использовании в растворе или в смеси с другими веществами и в условиях, отличных от EN 374, свяжитесь с поставщиком
перчаток, одобренных CE.Эта рекомендация носит рекомендательный характер и должна быть оценена специалистом по промышленной гигиене и безопасности
, знакомым с конкретной ситуацией предполагаемого использования нашими клиентами. Его
не следует толковать как одобрение какого-либо конкретного сценария использования.
Body Protection
Полный костюм, защищающий от химикатов. Тип защитного снаряжения должен выбираться в соответствии с
концентрацией и количеством опасного вещества на конкретном рабочем месте.
Защита органов дыхания
Если оценка риска показывает, что подходят воздухоочистительные респираторы, используйте респираторные респираторы, закрывающие все лицо, типа
N100 (США) или типа P3 (EN 143) в качестве резервного средства инженерного контроля.Если респиратор является единственным средством защиты
, используйте респиратор с подачей воздуха, полностью закрывающий лицо. Используйте респираторы и компоненты, протестированные и одобренные
в соответствии с соответствующими государственными стандартами, такими как NIOSH (США) или CEN (ЕС).
Контроль воздействия на окружающую среду
Не допускать попадания продукта в канализацию.РАЗДЕЛ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
9.1 Информация об основных физико-химических свойствах
a) Внешний вид Форма: твердый
b) Запах Нет данных
c) Порог восприятия запаха Нет данных
d) pH 1.5 при 20 ° C (68 ° F)
e) Точка плавления / замерзания
точка
Точка плавления / диапазон: 47 ° C (117 ° F) — горит.
f) Начальная точка кипения и интервал кипения
Данные отсутствуют
g) Температура вспышки Нет данных
h) Скорость испарения Данные отсутствуют
i) Воспламеняемость (твердое тело, газ) Данные отсутствуют
j) Верхний / нижний предел воспламеняемости
или
пределы взрываемости
k) Давление пара Нет данных
l) Плотность пара Нет данных
м) Относительная плотность 1,68 г / см3 при 20 ° C (68 ° F)
n) Растворимость в воде растворим
o) Коэффициент распределения: ноктанол /
вода
Данные отсутствуют
p) Самовоспламенение
температура
Данные отсутствуют
q) Разложение
температура
> 100 ° C (> 212 ° F) —
r) Вязкость Нет данных
s) Взрывоопасные свойства Нет данных
т) Окисляющие свойства Вещество или смесь не относятся к классу окислителей.
9.2 Другая информация по безопасности
Данные отсутствуютРАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
10.1 Реакционная способность
Данные отсутствуют
10.2 Химическая стабильность
Стабилен при рекомендуемых условиях хранения.
10.3 Возможность опасных реакций
Данные отсутствуют
10.4 Условия, которых следует избегать
Данные отсутствуют
10.5 Несовместимые материалы
Органические материалы, порошковые металлы
10.6 Опасные продукты разложения
Другие продукты разложения — данные отсутствуют
В случае пожара: см. РАЗДЕЛ 5РАЗДЕЛ 11.ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
11.1 Информация о токсикологическом воздействии
Острая токсичность
LD50 Устно — Крыса — 3,250 мг / кг
Кожный: данные отсутствуют
Данные отсутствуют
Разъедание / раздражение кожи
Вызывает ожоги кожи.
Серьезное повреждение / раздражение глаз
Риск серьезного повреждения глаз.
Респираторная или кожная сенсибилизация
Нет данных
Мутагенность зародышевых клеток
Нет данных
Канцерогенность
IARC: Ни один из компонентов этого продукта не присутствует в количествах, превышающих или равных 0.1% идентифицирован IARC как
вероятных, возможных или подтвержденных канцерогенов для человека.
NTP: Ни один компонент этого продукта, присутствующий в количествах, превышающих или равных 0,1%, не определен NTP как известный или ожидаемый канцероген
.
OSHA: Никакой компонент этого продукта, присутствующий в концентрациях, превышающих или равных 0,1%, не определен OSHA как канцероген
или потенциальный канцероген.
Репродуктивная токсичность
Нет данных
Нет данных
Специфическая избирательная токсичность, поражающая отдельные органы-мишени при однократном воздействии
Нет данных
Специфическая избирательная токсичность, поражающая отдельные органы-мишени при многократном воздействии
Нет данных
Опасность при аспирации
Нет данных
Дополнительная информация
RTECS: Нет данных
Поглощение в организме приводит к образованию метгемоглобина, который в достаточной концентрации вызывает цианоз.
Начало может быть отложено на 2–4 часа или дольше., Тошнота, головокружение, головная боль, слабость, несогласованность., Спутанность сознания.,
Цианоз, комаРАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
12.1 Токсичность
12.2 Стойкость и разлагаемость
данные доступны
12.3 Потенциал биоаккумуляции
Данные отсутствуют
12.4 Мобильность в почве
Данные отсутствуют
12.5 Результаты оценки PBT и vPvB
Оценка PBT / vPvB недоступна, поскольку оценка химической безопасности не требуется / не проводилась
12.6 Другие побочные эффекты
Нет данныхРАЗДЕЛ 13. УТИЛИЗАЦИЯ
13.1 Методы обработки отходов
Продукт
Предложите излишки и решения, не подлежащие переработке, лицензированной компании по утилизации. Обратитесь в лицензированную службу утилизации профессиональных отходов
, чтобы утилизировать этот материал. Растворите или смешайте материал с горючим растворителем и сожгите в химическом мусоросжигателе
, оборудованном дожигателем и скруббером.
Загрязненная упаковка
Утилизировать как неиспользованный продукт.РАЗДЕЛ 14. ТРАНСПОРТНАЯ ИНФОРМАЦИЯ
DOT (США)
Номер ООН: 3260 Класс: 8 Группа упаковки: II
Надлежащее отгрузочное наименование: Коррозийное твердое вещество, кислотное, неорганическое, н.у.к. (Нонагидрат нитрата железа)
Отчетное количество (RQ): 1000 фунтов
Опасность отравления при вдыхании: Нет
IMDG
Номер ООН: 3260 Класс: 8 Группа упаковки: II EMS-номер: FA, SB
Надлежащее отгрузочное наименование: CORROSIVE SOLID, ACIDIC , НЕОРГАНИЧЕСКИЙ, БДУ (Нонагидрат нитрата железа)
IATA
Номер ООН: 3260 Класс: 8 Группа упаковки: II
Надлежащее отгрузочное наименование: Коррозионное твердое вещество, кислотное, неорганическое, n.Операционные системы. (Нонагидрат нитрата железа)РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
SARA 302, компоненты
Никакие химические вещества в этом материале не подпадают под требования к отчетности SARA Title III, раздел 302.

 % C = 27,29%
% C = 27,29% 0% по массе медной статуи массой 350,0 кг состояло из CuCl, а статуя умерла от бронзовой болезни, сколько фунтов порошкообразного зеленого гидрата могло бы образоваться?
0% по массе медной статуи массой 350,0 кг состояло из CuCl, а статуя умерла от бронзовой болезни, сколько фунтов порошкообразного зеленого гидрата могло бы образоваться?

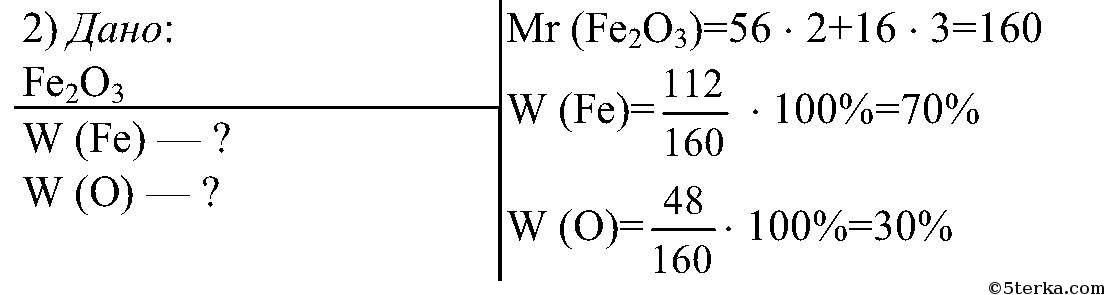 000 г
000 г 404 атм / 2 = 135,702 атм
404 атм / 2 = 135,702 атм Так . . . .
Так . . . . Фактически, KClO 3 производит в три раза больше кислорода (сравните 1,5: 0,5).
Фактически, KClO 3 производит в три раза больше кислорода (сравните 1,5: 0,5). Единственными продуктами реакции являются 3,730 г твердого вещества, содержащего только уран, кислород и фтор, и 0.970 г газа. Газ на 95,0% состоит из фтора, а остальное — из водорода.
Единственными продуктами реакции являются 3,730 г твердого вещества, содержащего только уран, кислород и фтор, и 0.970 г газа. Газ на 95,0% состоит из фтора, а остальное — из водорода. : 0,01212 / 0,01212 = 1
: 0,01212 / 0,01212 = 1  808) = 0,8897 / (x + 70,906)
808) = 0,8897 / (x + 70,906) 00 г Fe) (z)
00 г Fe) (z) 8444 г Fe
8444 г Fe Какой минимальный объем раствора HCl в мл, имеющего плотность 1,07 г / мл и состоящего из 14% HCl по массе, необходим для очистки поверхности металла путем взаимодействия с ржавчиной? Предположим, что ржавчина — это Fe 2 O 3 (s), что она имеет плотность 5.2 г / см 3 , и что реакция:
Какой минимальный объем раствора HCl в мл, имеющего плотность 1,07 г / мл и состоящего из 14% HCl по массе, необходим для очистки поверхности металла путем взаимодействия с ржавчиной? Предположим, что ржавчина — это Fe 2 O 3 (s), что она имеет плотность 5.2 г / см 3 , и что реакция: 687 г
687 г 0 г / моль М
0 г / моль М
Leave A Comment