Барий азотнокислый — ООО «Химпродукт»
Описание и свойстваБарий азотнокислый (нитрат бария) – это соль бария и нитрат-иона. Выглядит как белое кристаллическое твердое вещество.
Есть два способа производства нитрата бария. Первый процесс включает растворение небольших кусочков карбоната бария в азотной кислоте, что позволяет осаждать любые примеси железа. Затем его фильтруют, упаривают и кристаллизуют. Другой способ производства нитрата бария – объединение хлорида бария с нагретым раствором нитрата натрия. Это вызывает разделение кристаллов нитрата бария.
Применение:Зеленые фейерверки и ракеты используют нитрат бария.
Фейерверки прошли долгий путь с момента их изобретения в Китае 12 века. Благодаря достижениям в области пиротехники сегодняшние дисплеи с взрывчаткой стали ярче, чем когда-либо. Например, хлорид натрия дает желтый фейерверк, хлорид меди горит синим, а нитрат бария дает зеленый цвет.
Нитрат бария можно использовать для производства других соединений бария.
Нитрит бария (Ba (NO₃) ₂) используется для производства таких соединений, как хлорид бария (BaCl₂) и гидроксид бария (Ba (OH)).
Используется для производства изделий из стекла.
Нитрат бария также используется для производства высококачественных изделий из стекла с низким тепловым расширением. Кислород в нитрате бария помогает сделать стекло более прозрачным и не обесцвеченным. Нитрат бария также используется в производстве оптического стекла. Он улучшает показатель преломления стекла, используемого в таких изделиях, как объективы фотоаппаратов.
Нитрит бария используется в военных целях.
Военные используют нитрат бария для сигнальных ракет в полевых условиях, он также используется для производства трассирующих пуль. Нитрат бария способствует образованию небольшого пиротехнического заряда в основании пули.
Профиль безопасностиНегорючий, но ускоряет горение горючих материалов. При попадании в огонь больших количеств или мелком измельчении горючего материала может произойти взрыв. Может взорваться при продолжительном воздействии тепла или огня. Токсичные оксиды азота образуются при пожарах.
Может взорваться при продолжительном воздействии тепла или огня. Токсичные оксиды азота образуются при пожарах.
Хранить нитрит бария необходимо вдали от горючих веществ, продуктов и металлических порошков так как существует высокий риск возгорания. Хранить только в закрытой таре вдали от солнца и влаги.
Купить барий азотнокислый (нитрит бария)Вы можете купить барий азотнокислый (нитрит бария) оптом и в розницу в Украине с наших складов в городах Киев, Харьков, Днепр, Одесса и Львов.
Свяжитесь с нашими менеджерами по телефонам:
+38 (068) 671-90-70 (Viber)
+38 (095) 671-90-70
+38 (063) 671-90-70
+38 (044) 338-38-56
и получите подробную информацию касательно наличия, цены бария азотнокислого (нитрита бария) и сопутствующих компонентов.
Наши менеджеры проконсультируют Вас и помогут приобрести барий азотнокислый (нитрит бария), а также организовать доставку в Ваш город.
Подробную информацию Вы так же сможете получить на нашем сайте tdchem.com.ua или задать вопрос на электронную почту [email protected].
Доставка заказов по Украине осуществляется службами доставки и собственным транспортом.
Основные характеристики
Показатели
Норматив
Испытание
Массовая доля основного вещества, %
99,0
99,40
Влажность, %
0,1
0,04
Нерастворимость вещества в воде, %
0,5
0,03
Хлориды (СI), %
0,05
0,002
Размер частиц, mm
20 — 40
20 — 40
Вычисление массовой доли химического элемента в веществе – HIMI4KA
ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
Одним из основных законов химии является закон постоянства состава вещества (рассмотрен ранее в уроке 5).
На основании данного закона проводятся различные практически значимые вычисления, в том числе вычисления массовой доли химического элемента в веществе.
Массовой долей вещества ω(X) называют отношение массы данного вещества в системе к массе всей системы. Для некоего вещества X:
где ω(Х) — массовая доля вещества Х, m(X) — его масса; M — масса всей системы.
Массовая доля является величиной безразмерной. Ее выражают в долях от единицы или в процентах, если долю от единицы умножить на 100:
В качестве системы может выступать как молекула химического соединения, так и смесь, раствор и т. д. Рассмотрим несколько типовых заданий.
Пример 1. Рассчитайте массовую долю серы в оксиде серы (VI).
Решение: Молярная масса оксида серы (VI) M(SO3) = 80 г/моль, атомная масса серы в этом соединении 32 г/ моль. Для расчётов выбираем образец оксида серы количеством вещества 1 моль. Масса этого вещества составит:
Исходя из формулы SO3 можно заключить, что в 1 моль SO3 будет содержаться 1 моль серы, масса которой составит:
Тогда массовая доля серы в оксиде серы (VI) будет равна:
Ответ: 0,4, или 40%.
Пример 2. Рассчитайте массовые доли элементов в фосфате калия K3PO4.
Решение: Молярная масса M(K3PO4) = 212 г/моль. Для расчётов выбираем образец фосфата калия количеством вещества 1 моль. Масса этого вещества составит:
Исходя из формулы K3PO4 можно заключить, что в 1 моль этого соединения будет содержаться 3 моль калия, 1 моль фосфора и 4 моль кислорода, масса которых составит:
Определим массовые доли элементов:
Тренировочные задания
1. Количественное содержание элементов калия, серы и кислорода в сульфите калия равно
1) 20,2; 30,4; 49,4
2) 49,4; 20,2; 30,4
3) 30,4; 49,4; 20,2
4) 49,4; 30,4; 20,2
2. Количественное содержание элементов бария, серы и кислорода в сульфите бария равно
1) 63,1; 22,1; 14,8
2) 63,1; 14,8; 22,1
3) 14,8; 22,1; 63,1
4) 22,1; 63,1; 14,8
3. Количественное содержание элементов кальция, фосфора и кислорода в фосфате кальция равно
Количественное содержание элементов кальция, фосфора и кислорода в фосфате кальция равно
1) 20,0; 41,3; 38,7
2) 38,7; 20,0; 41,3
3) 38,7; 41,3; 20,0
4) 41,3; 38,7; 20,0
4. Количественное содержание элементов натрия, фосфора и кислорода в фосфате натрия равно
1) 42,1; 18,9; 39,0
2) 18,9; 39,0; 42,1
3) 39,0; 42,1; 18,9
4) 18,9; 42,1; 39,0
5. Количественное содержание элементов калия, фосфора и кислорода в фосфате калия равно
1) 14,6; 30,2; 55,2
2) 30,2; 55,2; 14,6
3) 55,2; 14,6; 30,2
4) 55,2; 30,2; 14,6
6. Количественное содержание элементов алюминия, серы и кислорода в сульфате алюминия равно
1) 15,8; 56,1; 28,1
2) 28,1; 56,1; 15,8
3) 56,1; 15,8; 28,1
4) 15,8; 28,1; 56,1
7. Количественное содержание элементов кальция, углерода и кислорода в карбонате кальция равно
1) 18,0; 48,0; 40,0
2) 48,0; 40,0 18,0
3) 40,0; 48,0; 12,0
4) 40,0 12,0; 48,0
8. Количественное содержание элементов алюминия, фосфора и кислорода в фосфате алюминия равно
Количественное содержание элементов алюминия, фосфора и кислорода в фосфате алюминия равно
1) 22,1; 25,4; 52,5
2) 22,1; 52,5; 25,4
3) 52,5; 25,4; 22,1
4) 25,4; 52,5; 22,1
9. Количественное содержание элементов кальция, азота и кислорода в нитрате кальция равно
1) 24,4; 17,1; 58,5
2) 17,1; 58,5; 24,4
3) 58,5; 24,4; 17,1
4) 24,4; 58,5; 24,4
10. Количественное содержание элементов магния, азота и кислорода в нитрате магния равно
1) 16,2; 64,9; 18,9
2) 16,2; 18,9; 64,9
3) 18,9; 64,9; 16,2
4) 64,9; 16,2; 18,9
Ответы
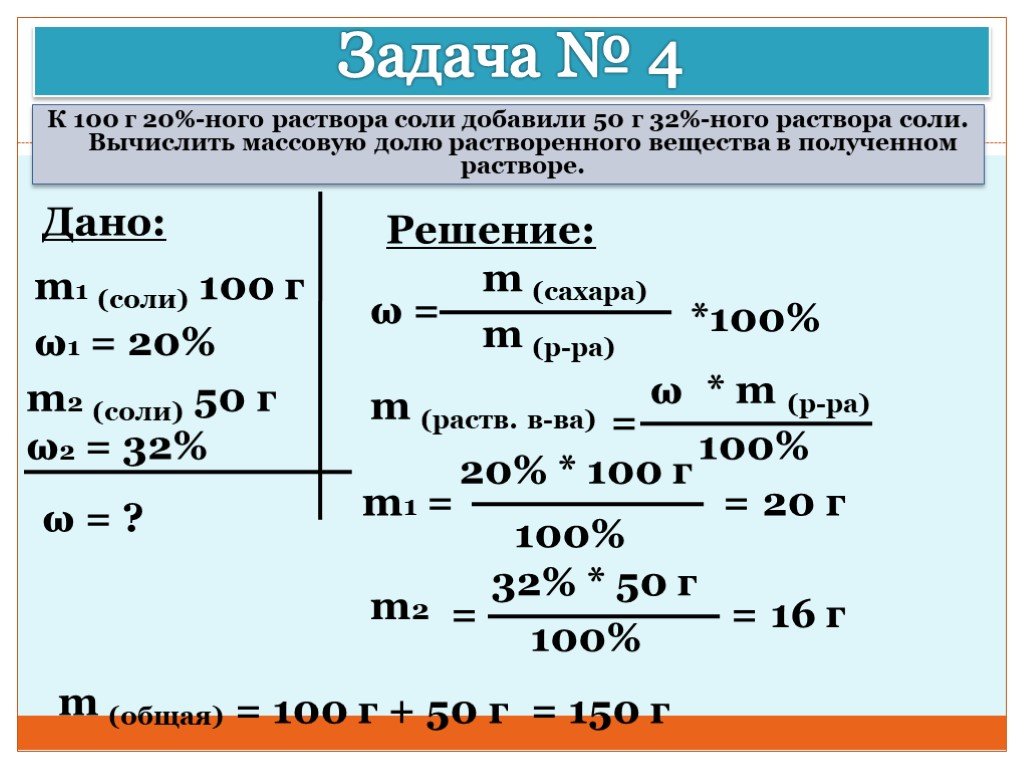
Вычисление массовой доли растворенного вещества в растворе →
← Проведение расчетов на основе формул и уравнений реакций
6.9: Состав в массовых процентах по химической формуле
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 289389
⚙️ Цели обучения
- Определить процентное содержание каждого элемента в соединении по химической формуле.

Азот является питательным веществом, необходимым для роста растений. Фермеры используют два распространенных удобрения для подачи азота: аммиак (NH 3 ) и нитрат аммония (NH 4 NO 3 ). Аммиак применяется в виде газа под давлением, называемого безводным аммиаком. Аммиачная селитра применяется в твердом виде. Оба имеют особые меры предосторожности при обращении. Аммиак хорошо растворяется в воде и быстро растворяется в любой воде, которая подвергается воздействию. В больших концентрациях можно быстро победить аммиак, так как он растворяется в воде во рту, носу, легких и глазах. С другой стороны, нитрат аммония очень взрывоопасен и стал причиной нескольких крупных взрывов со смертельным исходом за последние несколько десятилетий.
Рисунок \(\PageIndex{1}\): Резервуары с безводным аммиаком на поле фермы (Андреа Ганц через Flickr).

Несмотря на опасность, оба удобрения по-прежнему широко используются, поскольку каждое из них содержит значительный процент азота по массе. Но какой из двух поставляет наибольшее количество азота по массе? Самый простой способ сделать это — рассчитать молярную массу каждого соединения и использовать часть этой массы, обеспечиваемую азотом, для расчета процентного содержания.
\[\text{% элемента по массе}=\frac{\text{масса элемента в соединении}}{\text{молярная масса соединения}}\times100\%\]
✅ Пример \(\PageIndex{1}\)
Какое вещество обеспечивает наибольший процент азота по массе, NH 3 или NH 4 NO 3 ? Приведите расчеты, подтверждающие ваш ответ.
Решение
| НХ 3 | NH 4 НЕТ 3 | |
|---|---|---|
| 1 N = 1(14,01) = 14,01 г N 3 H = 3(1,008) = 3,024 г H | 2 N = 2(14,01) = 28,02 г N |
| молярная масса = 17,03 г NH 3 | молярная масса = 80,05 г NH |
| \(\%\mathrm N=\dfrac{14.01\;\cancel{\mathrm g}}{17.03\;\cancel{\mathrm g}}\times100\%=\boxed{82. | \(\text{\%N=}\dfrac{28,02\;\cancel{\mathrm g}}{80,05\;\cancel{\mathrm g}}\times100\%=\boxed{35,00\%\ ;\mathrm N}\) |
| Из расчетов выше видно, что NH 3 поставляет наибольшее процентное содержание азота по массе. | |
Процентный состав также можно использовать для определения массы определенного элемента, содержащегося в любой массе соединения.
В примере \(\PageIndex{1}\) было обнаружено, что нитрат аммония состоит из 35,00% N. Это означает, что на каждые 100,00 г NH приходится 35,00 г N 4 NO 3 . Поскольку массовые отношения остаются неизменными независимо от размера образца, это также означает, что на каждые 100,00 кг NH 9 приходится 35,00 кг N.
✅ Пример \(\PageIndex{2}\)
Используя результаты примера \(\PageIndex{1}\), какая масса азота содержится в 50,0-килограммовом мешке азотно-аммиачного удобрения? (Фото: Майк Спиллер через Flickr)
Раствор
Нитрат аммония состоит из 35,00% N. Это означает, что на каждые 100,00 г NH приходится 35,00 г N 4 NO 3 . Поскольку массовые соотношения остаются одинаковыми независимо от размера пробы, это также означает, что на каждые 100,00 кг NH 4
\(50,0\;\cancel{\mathrm{kg}\;{\mathrm{NH}}_4{\mathrm{NO}}_3}\times\dfrac{35,00\;\mathrm{kg}\ ;\mathrm N}{100.00\cancel{\;\mathrm{kg}\;{\mathrm{NH}}_4{\mathrm{NO}}_3}}=\boxed{17,5\;\mathrm{kg}\ ;\mathrm N}\)
Решение также можно найти, используя массы из расчета молярной массы для NH 4 NO 3 в Примере \(\PageIndex{1}\), в котором было обнаружено, что на каждые 80,05 г NH 4 NO 3 приходится 28,02 г N. Поскольку массовые соотношения остаются неизменными независимо от размера образца, это также означает, что на каждые 80,05 кг NH
Поскольку массовые соотношения остаются неизменными независимо от размера образца, это также означает, что на каждые 80,05 кг NH
\(50,0\;\cancel{\mathrm{kg}\;{\mathrm{NH}}_4{\mathrm{NO}}_3}\times\dfrac{28,02\;\mathrm{kg}\ ;\mathrm N}{80,05\отмена{\;\mathrm{кг}\;{\mathrm{NH}}_4{\mathrm{NO}}_3}}=\в коробках{17,5\;\mathrm{кг}\ ;\mathrm N}\)
Обратите внимание, что ответы совпадают.
✏️ Упражнение \(\PageIndex{1}\)
Фторид бария — это прозрачный кристалл, который можно найти в природе в виде минерала франкдиксонита. Определите процентный состав фторида бария.
- Ответить
- 78,32% Ba и 21,67% F
✏️ Упражнения \(\PageIndex{2}\)
Добавка железа содержит 25,0 мг FeSO 4 . Какова масса железа в этом образце?
- Ответить
- 9,19 мг Fe
Резюме
- Описаны процессы расчета процентного состава соединения на основе химической формулы.

Вклады и атрибуции
Эта страница была создана на основе контента следующих авторов и отредактирована (тематически или подробно) командой разработчиков LibreTexts в соответствии со стилем, презентацией и качеством платформы:
- Лэнс С. Лунд (Общественный колледж Анока-Рамси)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- нет на странице
- Теги
- источник[2]-хим-47493
Нитрат бария | 31128 | Honeywell Research Chemicals
Puriss. в год, реагент ACS, ≥99%, ≥52% Ba на основе
в год, реагент ACS, ≥99%, ≥52% Ba на основе
- Обзор
- Документы
- Технические характеристики
- Свойства
- Информация о безопасности
Размер пакета
Выберите опцию …
Тип контейнера
Выберите опцию …
Количество
Проверьте доступность
. Запросить Quote
7 6667006700.Skip to the end of the images gallery
Skip to the beginning of the images gallery
| Brand Fluka | CAS Numbers (All) 10022-31-8 | EC Номер 233-020-5 | Линейная формула BA (№ 3 ) 2 | MDL Number MFCCD0000344424444444444244444444444444444444444444444444444444444444444444444444444444442н0066 Molar Mass 261. |
Documents
Safety Data Sheet (SDS)
Specifications
| Property | Value |
|---|---|
| Assay | Min. 99,0 % |
| Анализ Ba | Мин. 52 % |
| Нерастворимое в воде вещество | Макс. 0,005 % |
| pH (5 %, 25 °C) | 5,0–8,0 |
| Кальций (Ca) | Макс. 0,002 % |
| Медь (Cu) | Макс. 5 частей на миллион |
| Железо (Fe) | Макс. 2 ppm |
| Калий (K) | Макс. 0,005 % |
| Магний (Mg) | Макс. 0,002 % |
| Натрий (Na) | Макс. 0,005 % |
| Стронций (Sr) | Макс. 0,05 % |
| Тяжелые металлы (ICP) ACS | Макс. 5 частей на миллион |
| Аммоний (NH 4 ) | Макс. 0,001 % 0,001 % |
| Хлорид (Cl) | Макс. 5 ppm |



 27\%\;\mathrm Н}\)
27\%\;\mathrm Н}\)
 34 g/mol
34 g/mol
Leave A Comment