Летучее водородное соединение — Большая Энциклопедия Нефти и Газа, статья, страница 3
Cтраница 3
Запишите формулу высшего оксида, формулу летучего водородного соединения ( если оно существует) и укажите, пользуясь периодической таблицей, порядковый номер, период, группу, подгруппу и принадлежность к металлам или неметаллам для следующих элементов: а) магний; б) кремний; в) рений; г) рутений; д) теллур; е) радий. [31]
Какие закономерности наблюдаются в изменении свойств летучих водородных соединений в периодах и группах. [32]
Проследим сначала, как изменяются свойства летучих водородных соединений неметаллов в периодах слева направо. [33]
Найдите в периодической таблице элемент, образующий летучее водородное соединение, плотность паров которого почти равна плотности неона. [34]
Почему нелетучие водородные соединения так резко отличаются от летучих водородных соединений. [35]
[35]
Следовательно, в периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливаются. [36]
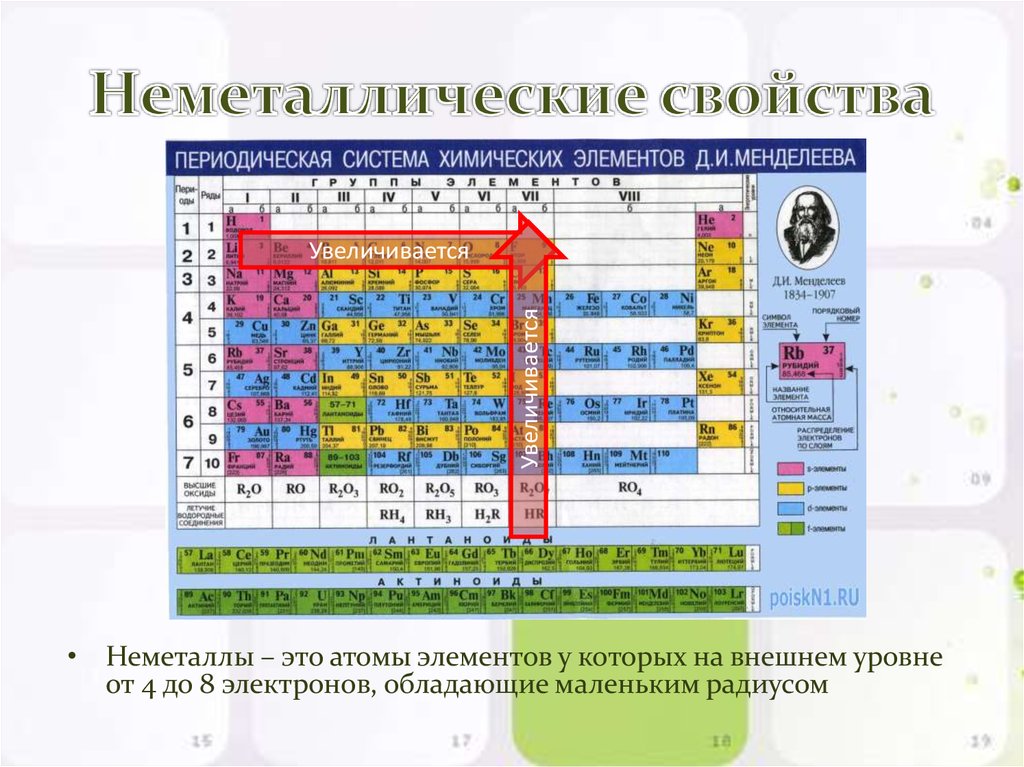
Элементы главных подгрупп, начиная с IV группы, образуют летучие водородные соединения. [37]
Элементы главных подгрупп, начиная с IV группы, образуют летучие водородные соединения. Их также изображают общими формулами в последовательности: Rh5, Rh4, Rh3, RH. Формулы водородных соединений ставятся под элементами главных подгрупп и только к ним относятся. [38]
Элементы главных подгрупп, начиная с IV группы, образуют летучие водородные соединения. Их также изображают общими формулами в последовательности: Rh5, Rh4, RHo, RH. Формулы водородных соединений ставятся под элементами главных подгрупп и только к ним относятся. [39]
В отличие от рассмотренных нами неметаллов, для которых характерны немногочисленные летучие водородные соединения, углерод способен образовывать с водородом обширный класс соединений, так называемых углеводородов. [40]
[40]
Интересно, что косвенные экспериментальные доказательства реальности водородных связей впервые были получены сравнительным анализом некоторых физических свойств летучих водородных соединений. Хорошо известен факт аномально высоких температур кипения Н2О, HF, Nh4 и отчасти НС1 и h3S ( рис. 134), который обусловлен ассоциацией их молекул за счет водородных связей с образованием ди -, три — и полимеров в жидкой фазе. [41]
Одновременно примеси, содержащиеся в угле, — кислород, сера и углекислый газ — были бы восстановлены до летучих водородных соединений, и удалить их из угля было бы просто. Такие опыты были проведены Бергиусом летом 1913 года. Он получил весьма обнадеживающие результаты: твердый уголь на 80 % был превращен в газообразные и жидкие углеводороды. Те же результаты были получены и для природного угля. В том же году под номером 301231 был зарегистрирован патент на гидрирование угля под давлением. [42]
Во главных подгруппах II и III групп имеются твердые водородные соединения, которые занимают промежуточное положение между солеобразными гидридами и летучими водородными соединениями. [43]
[43]
| Водородные соединения элементов главных подгрупп периодической системы. [44] |
В главных подгруппах II и III групп имеются твердые водородные соединения, которые занимают промежуточное положение между солеобразными гидридами и
Страницы: 1 2 3 4
Ответы на итоговую контрольную работу по теме «Неметаллы»(Габриелян) решебник
Вариант 1.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Символ элемента, образующего простое вещество — неметалл:
А. Вг.
Вг.
2. Распределение электронов по энергетическим уровням в ионе серы S2-:
А. 2е, 8е, 8е.
3. Формулы высшего оксида и летучего водородного соединения элемента Э с распределением электронов по энергетическим уровням 2е, 5:
Б. Э205 и ЭН3.
4. Способность атомов принимать электроны увеличивается в ряду:
Б. Те—Se—S—О.
5. Коэффициент перед формулой вещества X в схеме превращения
Н2 + N2 -> X:
Б. 2.
6. Закономерность изменения неметаллических свойств атомов химических элементов в пределах периода с увеличением порядкового номера:
A. Увеличиваются.
7. Оксид углерода (IV) не взаимодействует с веществом, формула которого:
Б. S02.
8. Схеме превращения
Р -3 ► Р +5
соответствует химическое уравнение:
Г. Са3Р2 + 402 = Р205 + ЗСаО.
9. Простое вещество сера взаимодействует с каждым из веществ группы:
В. 02, Mg, Н2.
10. Ион СО3 -2 можно обнаружить с помощью раствора, содержащего:
Б.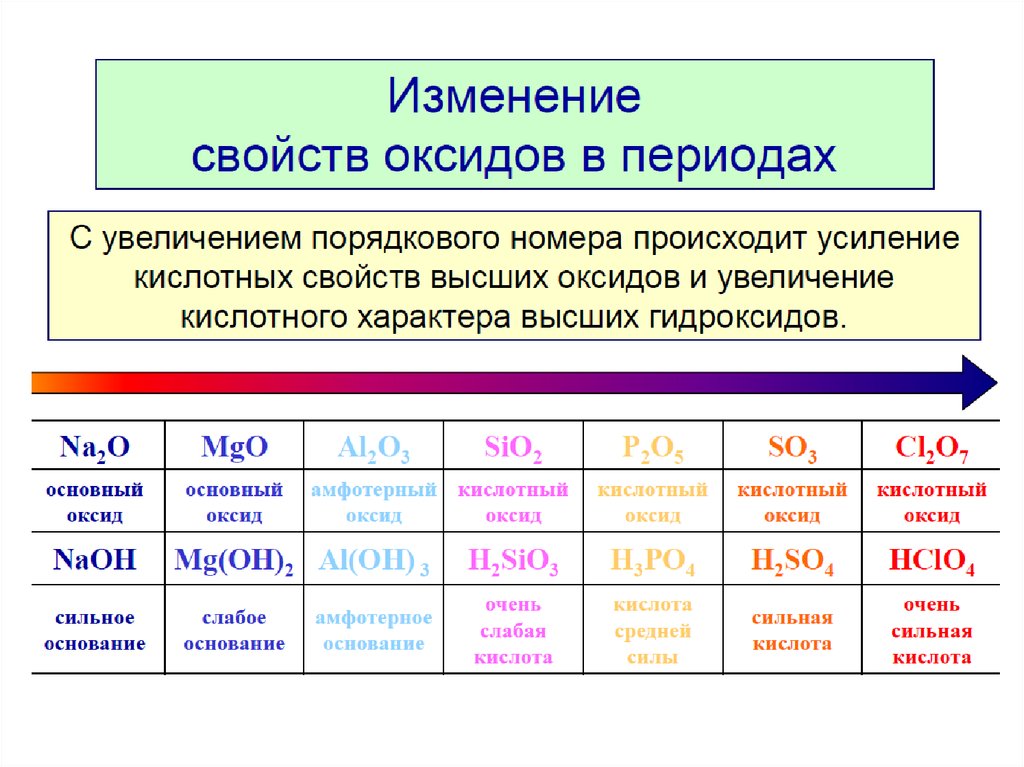 Катион водорода.
Катион водорода.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте формулы водородных соединений: хлора, серы, углерода. Выберите из них соединение с наиболее ярко выраженными кислотными свойствами.
HCl, h3S, Ch5
12. Дайте характеристику вещества с формулой Nh4 по следующему плану:
1) качественный состав;
2) количественный состав;
3) степень окисления каждого элемента;
4) относительная молекулярная и молярная массы;
5) массовая доля каждого элемента;
6) отношение масс элементов.
1. азот, водород
2. 1 атом азота и 3 атома водорода
3. азот -3, водород +1
4. Mr=17 и М=17г/моль
5. W(N)=14*1/17=0,8235=82,35%
W(H)=1-W(N)=1-0,8235=0,1765=17,65%
6. соотношение масса азот: водород = 14:3
13. Запишите химические формулы и названия веществ А и В в схеме превращений:
NO —> А —> В.
А- NO2 оксид азота 4,
B- HNO3 азотная кислота
14. По уравнению реакции N2 + 02 = 2N0 рассчитайте объемы исходных веществ для получения 1 моль газа оксида азота (II).
n(N2) = n(O2) = 0.5 моль(NO2) = 0.5 моль
V (N2) = V (O2) = 0.5*22.4= 11.2л
15. Запишите формулы и названия аллотропных модификаций кислорода.
кислород О2 и озон О3
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Символ элемента, образующего простое вещество — неметалл:
В. С.
2. Распределение электронов по энергетическим уровням в ионе хлора Сl-:
А. 2е, 8е, 8е.
3. Формулы высшего оксида и летучего водородного соединения элемента Э с распределением электронов по энергетическим уровням 2е, 6е:
В. Э03 и Н2Э.
4. Способность атомов принимать электроны уменьшается в ряду:
A. F—CI—Br—I.
5. Коэффициент перед формулой вещества X в схеме превращения
N2 + 02 -> X:
Б. 2.
6. Закономерность изменения неметаллических свойств атомов химических элементов в пределах главной подгруппы с увеличением порядкового номера:
Б. Уменьшается.
7. Оксид серы (VI) не взаимодействует с веществом, формула которого:
А. С02.
8. Схеме превращения
N +2 -> N +4
соответствует химическое уравнение:
Г. 2NO + 02 = 2N02.
9. Сера взаимодействует с каждым из веществ группы:
В. 02, Н2, Си.
10. Ион SiO3 2- можно обнаружить с помощью раствора, содержащего катион:
Б. Водорода.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте формулы водородных соединений химических элементов-неметаллов: азота, иода, кислорода. Укажите соединение с наиболее ярко выраженными кислотными свойствами.
Nh4, HI, h3O
12. Составьте характеристику вещества, формула которого С02, по плану:
1) качественный состав;
2) количественный состав;
3) степень окисления каждого элемента;
4) относительная молекулярная и молярная массы;
5) массовая доля каждого элемента;
6) отношение масс элементов;
7) название.
1.углерод, кислород
2. 1 атом углерода, 2 атом кислорода
1 атом углерода, 2 атом кислорода
3. углерод +4, кислород -2
4. Mr=44 и М=44 г/моль
5. ω(с) = 12/44 *100%=27,3%. ω(о) = 32/44 *100%=72,7%
6.С: О = 12: 32 = 3:8
7. углекислый газ, оксид углерода 4.
13. Запишите химические формулы и названия веществ А и В в схеме превращений:
SO2 -> A -> B.
А – SO3 окид серы 6,
В – h3SO4 серная кислота
14. По уравнению реакции 2СО + 02 = 2С02
рассчитайте объемы исходных веществ (н. у.) для получения 1,5 моль газа оксида углерода (IV).
n(CO) = n(CO2) = 1,5 моль
V(CO) = 1,5*22,4 =33,6 л
n(O2) = 0,5 *n(CO2) = 0,75 моль
V(O2) = 0,75*22,4 = 16,8 л
15. Запишите названия аллотропных модификаций серы.
пластическая, ромбическая, моноклинная.
Вариант 3.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Символ элемента, образующего простое вещество — неметалл:
Г. F.
2. Распределение электронов по энергетическим уровням в ионе азота N3-:
Г. 2е, 8е.
2е, 8е.
3. Формулы высшего оксида и летучего водородного соединения элемента Э с распределением электронов по энергетическим уровням 2е, 8е, 7е:
Г. Э207 и НЭ.
4. Способность атомов принимать электроны уменьшается в ряду:
A. F—О—N—С.
5. Коэффициент перед формулой вещества X в схеме превращения
Р + 02 -> X:
Б. 2.
6. Закономерность изменения электроотрицательности атомов химических элементов в пределах периода с увеличением порядкового номера:
A. Увеличивается.
7. Аммиак взаимодействует с веществом, формула которого:
А. НСl.
8. Схеме превращения
S -2 -> S +4
соответствует химическое уравнение:
Г. 2h3S + 302 = 2S02 + 2Н20.
9. Простое вещество азот взаимодействует с каждым из веществ группы:
В. Li, Н2, 02.
10. Ион можно обнаружить с помощью раствора, содержащего катион:
А. Бария.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте формулы водородных соединений химических элементов-неметаллов: фосфора, кислорода, брома. Укажите соединение с наиболее ярко выраженными кислотными свойствами.
Составьте формулы водородных соединений химических элементов-неметаллов: фосфора, кислорода, брома. Укажите соединение с наиболее ярко выраженными кислотными свойствами.
Ph4, h3O, HBr
12. Составьте характеристику вещества, формула которого СН4, по следующему плану:
1) качественный состав;
2) количественный состав;
3) степень окисления каждого элемента;
4) относительная молекулярная и молярная массы;
5) массовая доля каждого элемента;
6) отношение масс элементов.
1. углерод, водород
2. 1 атом углерода, 4 атома водорода
3. С-4, Н+1
4. Mr=16 и М=16 г/моль
5. W=n*Ar*100%/Mr
W(H)=4*1*100%/16=25%
W(С)=12*100/16=75%
6. С:Н = 12:4 = 3:1
13. Запишите химические формулы и названия веществ А и В в схеме превращений: P -> A -> B.
А – Р2О5 – оксид фосфора 5,
В – Н3РО4 – фосфорная кислота
14. По уравнению реакции
Н2 + Сl2 = 2НСl
рассчитайте объемы исходных веществ (н. у.), которые необходимы для получения 3 моль газа хлороводорода.
n(h3) = n(Cl2) = 0,5*m(HCl) = 1,5 моль
V(h3) = V(Cl2) = 1,5*22,4 = 33,6 л
15. Запишите названия аллотропных модификаций фосфора.
белый, красный и черный.
Вариант 4.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Символ элемента, образующего простое вещество — неметалл:
В. О.
2. Распределение электронов по энергетическим уровням в ионе кислорода О2-:
Г. 2е, 8е.
3. Формулы высшего оксида и летучего водородного соединения элемента Э с распределением электронов по энергетическим уровням 2е, 4е:
А. Э02 и ЭН4.
4. Способность атомов принимать электроны увеличивается в ряду:
В. Si—Р—S—Сl.
5. Коэффициент перед формулой вещества X в схеме превращения S02 + 02 -> X:
Б. 2.
6. Закономерность изменения электроотрицательности атомов химических элементов в пределах главной подгруппы с увеличением порядкового номера:
Б. Уменьшается.
7. Оксид серы (IV) не взаимодействует с веществом, формула которого:
Оксид серы (IV) не взаимодействует с веществом, формула которого:
В. С02.
8. Схеме превращения С 0-> С +4 соответствует химическое уравнение:
Г. С + 2Н2 = СН4.
9. Простое вещество фосфор взаимодействует с каждым из веществ группы:
Б. 02, Сl2, Са.
10. Ион SO4 2-можно обнаружить с помощью раствора, содержащего катион:
А. Бария.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте формулы водородных соединений химических элементов-неметаллов: кремния, азота, серы. Укажите соединение с наиболее ярко выраженными кислотными свойствами.
Sih5, Nh4, h3S
12. Составьте характеристику вещества с формулой Н20 по следующему плану:
1) качественный состав;
2) количественный состав;
3) степень окисления каждого элемента;
4) относительная молекулярная и молярная массы;
5) массовая доля каждого элемента;
6) отношение масс элементов.
1.водород, кислород
2. один атом кислорода, два атома водорода
3. водород +1, кислород -2
водород +1, кислород -2
4. Mr=18 и М=18 г/моль
5. w ( H ) = 2 / 18 = 0,11 = 11%
w ( O ) = 16 / 18 = 0,89 = 89 %
6. О:Н = 16:2 = 8:1
13. Запишите химические формулы и названия веществ А и В в схеме превращений:
Cl2 -> A -> B.
HCl хлороводород, AgCl хлорид серебра (HNO2 азотистая кислота)
14 . По уравнению реакции N2 + ЗН2 2Nh4
рассчитайте объемы исходных веществ (н. у.), необходимые для получения 2 моль аммиака.
n(h3) = 1,5*n(Nh4) = 3 моль
V (h3) = 3*22,4 = 67,2 л
n(N2) = 0,5 *n(Nh4) = 1 моль
V (N2) = 1*22,4 = 22,4 л.
15. Запишите названия аллотропных модификаций углерода.
графит, карбин, алмаз, фуррелены
Химия магния (Z=12) — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 597
Магний является элементом второй группы и восьмым по распространенности элементом в земной коре. Магний легкий, серебристо-белый и прочный. Как и алюминий, он образует вокруг себя тонкий слой, предотвращающий ржавление при контакте с воздухом. Мелкие частицы магния также могут загореться на воздухе. Магний необходим в питании животных и растений. Он также используется в качестве сплава для соединения с другими металлами, чтобы сделать их легче и легче сваривать, в аэрокосмической промышленности и других отраслях. Он также используется в медицине в виде гидроксидов, сульфатов, хлоридов и цитратов магния.
Магний легкий, серебристо-белый и прочный. Как и алюминий, он образует вокруг себя тонкий слой, предотвращающий ржавление при контакте с воздухом. Мелкие частицы магния также могут загореться на воздухе. Магний необходим в питании животных и растений. Он также используется в качестве сплава для соединения с другими металлами, чтобы сделать их легче и легче сваривать, в аэрокосмической промышленности и других отраслях. Он также используется в медицине в виде гидроксидов, сульфатов, хлоридов и цитратов магния.
Общая информация
- Обозначение: Mg
- Атомный номер: 12
- Атомная/Молярная масса: 24,31
- Температура плавления: 648,8°C, 921,8K
- Точка кипения: 1090°C, 1363K
- Плотность: 1,738 г/куб.см
- Степени окисления: +2
- Конфигурация электронной оболочки: [Ne]3s 2
Характеристики
Магний получил свое название от магнезитовой руды, названной в честь района Магнезия в Фессалии, Греция. Магний — прочный металл, легкий и серебристо-белый. Признанный элементом еще в 1775 году, он был впервые выделен в чистом виде Дэви в 1805 году. Магний обладает способностью тускнеть, что создает вокруг себя оксидный слой, предотвращающий его ржавчину. Он также обладает способностью реагировать с водой при комнатной температуре. При воздействии воды вокруг металла образуются пузыри. Повышение температуры ускоряет эту реакцию.
Магний — прочный металл, легкий и серебристо-белый. Признанный элементом еще в 1775 году, он был впервые выделен в чистом виде Дэви в 1805 году. Магний обладает способностью тускнеть, что создает вокруг себя оксидный слой, предотвращающий его ржавчину. Он также обладает способностью реагировать с водой при комнатной температуре. При воздействии воды вокруг металла образуются пузыри. Повышение температуры ускоряет эту реакцию.
Огненный магний
Одним из свойств магния является высокая воспламеняемость. Как и многие другие вещества, магний более легко воспламеняется, когда у него более высокое отношение площади поверхности к объему. Пример отношения площади поверхности к объему можно увидеть при зажигании дров. Легче поджечь хворост и более мелкие ветки, чем целое бревно. Это свойство магния используется в войне, фотографии и в лампочках. Магний используется на войне для изготовления зажигательных бомб, сигнальных ракет и трассирующих пуль. Когда это оружие используется, оно немедленно воспламеняется и вызывает пожары.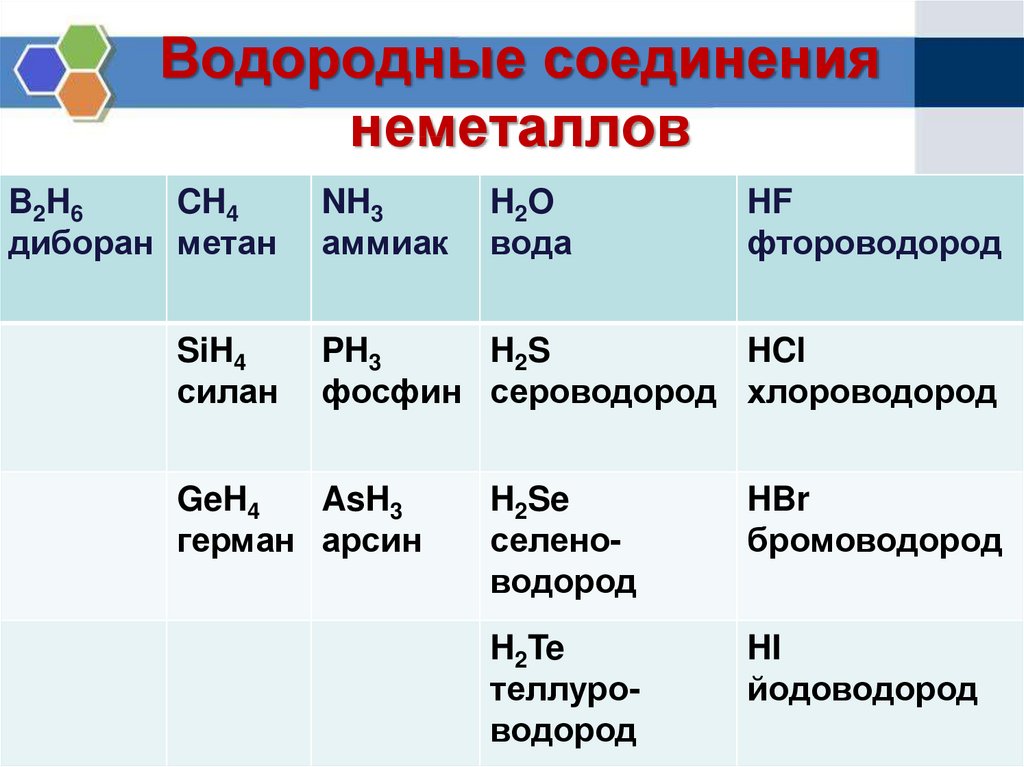 Единственный способ потушить горящий магний — засыпать его песком. Вода не гасит огонь, так как вода вступает в реакцию с горячим магнием и выделяет еще больше водорода.
Единственный способ потушить горящий магний — засыпать его песком. Вода не гасит огонь, так как вода вступает в реакцию с горячим магнием и выделяет еще больше водорода.
Области применения
Магний является одним из самых легких металлов, и при использовании в виде сплава он обычно используется в автомобильной и авиационной промышленности. Использование магния увеличилось и достигло своего пика в 1943 году. Одна из причин увеличения использования магния заключается в том, что он используется в сплавах. Сплавы с магнием лучше поддаются сварке и легче, что идеально подходит для металлов, используемых в производстве самолетов и других товаров военного назначения.
Еще одной характеристикой магния является то, что он помогает пищеварению. Магний обычно используется в молоке из солей магнезии и Эпсома. Эти формы магния могут варьироваться от гидроксида магния, сульфата магния, хлорида магния и цитрата магния. Магний помогает не только людям и животным, но и растениям. Он используется для преобразования солнечного света в энергию для растений в процессе, известном как фотосинтез. Основным компонентом этого процесса является хлорофилл. Это молекула пигмента, состоящая из магния. Без магния фотосинтез, каким мы его знаем, был бы невозможен.
Он используется для преобразования солнечного света в энергию для растений в процессе, известном как фотосинтез. Основным компонентом этого процесса является хлорофилл. Это молекула пигмента, состоящая из магния. Без магния фотосинтез, каким мы его знаем, был бы невозможен.
Изотопы
Магний имеет три стабильных изотопа: Mg-24, Mg-25, Mg-26. Наиболее распространенным изотопом является Mg-24, который составляет 79% всего Mg, обнаруженного на Земле. Mg25 и Mg26 используются для изучения всасывания и метаболизма магния в организме человека. Они также используются для изучения сердечных заболеваний.
Магний имеет не только стабильные изотопы, но и радиоактивные изотопы, то есть изотопы с нестабильными ядрами. Это изотопы Mg-22, Mg-23, Mg-27, Mg-28 и Mg-29. Mg-28 широко использовался на ядерных объектах для научных экспериментов с 19 века.50-х по 1970-е годы.
Реакции с
Вода: При воздействии пара магний превращается из магния в оксид магния и водород.
\[Mg(s) +H_2O(g) \rightarrow MgO(s) + H_2(g) \]
При воздействии холодной воды реакция немного отличается. Реакция не останавливается, потому что гидроксид магния становится нерастворимым в воде.
\[Mg(s) +2H_2O(g) \rightarrow Mg(OH)_2(s) + H_2(g)\]
Кислород: Под воздействием кислорода магний превращается в оксид магния.
\[2Mg(s) +O_2(g) \rightarrow 2MgO(s)\]
Водород: При воздействии водорода магний превращается в гидрид магния.
\[Mg(s) + H_2(g) \rightarrow MgH_2(s)\]
Азот: При взаимодействии с азотом магний превращается в нитрид магния.
\[3Mg(s) + N_2(g) \rightarrow Mg_3N_2(s)\]
Галогены: При реакции с галогеном магний очень активен. Пример будет с хлоридом. При взаимодействии с хлоридом образуется хлорид магния (II). 9-(aq) + H_2(g)\]
Основания: При взаимодействии с основаниями магний реагирует.
Ссылки
- Аведезян М.М. и Хью Бейкер. Магний и сплавы магния . Парк материалов, Огайо: ASM International, 1999. Печать.
Внешние ссылки
- http://science.jrank.org/pa ges/4064/Magnesium.html
- http://www.chemicool.com/elements/magnesium.html
- http://chemistry.about.com/od/elemen…/magnesium.htm
- http://en.Wikipedia.org/wiki/Магний
- http://www.webelements.com/магний/
Проблемы
- Почему магний не ржавеет?
- Почему нельзя тушить магний водой?
- Какие изотопы используются для исследования сердца?
- Почему магний обычно используется для создания автомобилей и самолетов?
Решения
- Поскольку он способен тускнеть — способность создавать тонкий оксидный слой вокруг металла.

- Потому что вода выделяет водород при контакте с горячим магнием.
- мг25 и мг26
- Потому что его можно комбинировать с другими металлами, чтобы сделать их легче и легче сваривать.
- +2
Авторы и авторство
- Райан Ким (Калифорнийский университет в Дэвисе)
- Авнит Кахлон (Калифорнийский университет в Дэвисе)
Chemistry of Magnesium (Z=12) распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- кислоты
- баз
- воспламеняемость
- Галогены
- Водород
- зажигательный
- изотопов
- Магнезия
- Магний
- Огненный магний
- Азот
- Кислород
- Вода
Магний | Описание, свойства и соединения
магний
Посмотреть все СМИ
- Ключевые люди:
- сэр Хамфри Дэви Иоганн Вольфганг Доберейнер
- Похожие темы:
- химический элемент щелочноземельный металл переработка магния дефицит магния магнезит
См.
магний (Mg) , химический элемент, один из щелочноземельных металлов группы 2 (IIa) периодической таблицы и самый легкий структурный металл. Его соединения широко используются в строительстве и медицине, а магний является одним из элементов, необходимых для всей клеточной жизни.
| атомный номер | 12 |
|---|---|
| атомный вес | 24,305 |
| температура плавления | 650 °C (1202 °F) |
| температура кипения | 1090 °C (1994 °F) | удельный вес | 1,74 при 20° C (68 °F) |
| степень окисления | +2 |
| электронная конфигурация | 1 s 2 2 s 901 18 2 2 р 6 3 с 2 |
Возникновение, свойства и использование
Первоначально известный благодаря таким соединениям, как соли Эпсома (сульфат), магнезия или белая магнезия (оксид) и магнезит (карбонат), серебристо-белый элемент сам по себе не встречается в природе в свободном виде. Впервые он был выделен в 1808 году сэром Хамфри Дэви, который испарил ртуть из амальгамы магния, полученной путем электролиза смеси влажной магнезии и оксида ртути. Название магний происходит от Магнезии, района Фессалии (Греция), где впервые был обнаружен минерал магнезия белая.
Впервые он был выделен в 1808 году сэром Хамфри Дэви, который испарил ртуть из амальгамы магния, полученной путем электролиза смеси влажной магнезии и оксида ртути. Название магний происходит от Магнезии, района Фессалии (Греция), где впервые был обнаружен минерал магнезия белая.
Викторина «Британника»
Факты, которые вы должны знать: Викторина по периодической таблице
Магний является восьмым по распространенности элементом в земной коре (около 2,5 процента) и третьим по распространенности конструкционным металлом после алюминия и железа. Его космическое содержание оценивается как 9,1 × 10 5 атомов (по шкале, где содержание кремния = 10 6 атомов). Встречается в виде карбонатов — магнезита, MgCO 3 , и доломита, CaMg(CO 3 ) 2 — и во многих обычных силикатах, включая тальк, оливин и большинство видов асбеста. Он также встречается в виде гидроксида (бруцит), хлорида (карналлит, KMgCl 3 ∙6H 2 O) и сульфата (кизерит). Он распространен в таких минералах, как змеевик, хризолит и пенка. Морская вода содержит около 0,13% магния, в основном в виде растворенного хлорида, что придает ей характерный горький вкус.
Он распространен в таких минералах, как змеевик, хризолит и пенка. Морская вода содержит около 0,13% магния, в основном в виде растворенного хлорида, что придает ей характерный горький вкус.
Магний в промышленных масштабах производится электролизом расплавленного хлорида магния (MgCl 2 ), перерабатываемый в основном из морской воды и прямым восстановлением ее соединений подходящими восстановителями, например, в результате реакции оксида магния или прокаленного доломита с ферросилицем (процесс Пиджена). ( См. обработка магния.)
Когда-то магний использовался для фотовспышек и порошка, потому что в тонкоизмельченном виде он горит на воздухе интенсивным белым светом; он до сих пор находит применение во взрывных и пиротехнических устройствах. Из-за своей низкой плотности (всего две трети плотности алюминия) он нашел широкое применение в аэрокосмической промышленности. Однако, поскольку чистый металл имеет низкую структурную прочность, магний в основном используется в виде сплавов — в основном с 10 или менее процентами алюминия, цинка и марганца — для улучшения его твердости, прочности на растяжение и способности к литью, сварке. , и обработаны. Со сплавами применяются методы литья, прокатки, экструзии и ковки, а дальнейшее изготовление полученных листов, пластин или экструзии осуществляется путем обычных операций формования, соединения и механической обработки. Магний является самым легким конструкционным металлом для обработки и часто используется, когда требуется большое количество операций механической обработки. Магниевые сплавы имеют ряд применений: они используются для изготовления деталей самолетов, космических кораблей, машин, автомобилей, портативных инструментов и бытовой техники.
, и обработаны. Со сплавами применяются методы литья, прокатки, экструзии и ковки, а дальнейшее изготовление полученных листов, пластин или экструзии осуществляется путем обычных операций формования, соединения и механической обработки. Магний является самым легким конструкционным металлом для обработки и часто используется, когда требуется большое количество операций механической обработки. Магниевые сплавы имеют ряд применений: они используются для изготовления деталей самолетов, космических кораблей, машин, автомобилей, портативных инструментов и бытовой техники.
Тепло- и электропроводность магния и его температура плавления очень схожи с алюминием. В то время как алюминий подвергается воздействию щелочей, но устойчив к большинству кислот, магний устойчив к большинству щелочей, но легко подвергается воздействию большинства кислот с выделением водорода (хромовая и плавиковая кислоты являются важными исключениями). При нормальных температурах он стабилен на воздухе и в воде из-за образования тонкой защитной пленки из оксида, но подвергается воздействию пара. Магний является сильным восстановителем и используется для получения других металлов из их соединений (например, титана, циркония и гафния). Он непосредственно реагирует со многими элементами.
Магний является сильным восстановителем и используется для получения других металлов из их соединений (например, титана, циркония и гафния). Он непосредственно реагирует со многими элементами.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться сейчас
Магний встречается в природе в виде смеси трех изотопов: магния-24 (79,0%), магния-26 (11,0%) и магния-25 (10,0%). Было приготовлено 19 радиоактивных изотопов; магний-28 имеет самый длинный период полураспада, 20,9 часов, и является бета-излучателем. Хотя магний-26 не радиоактивен, это дочерний нуклид алюминия-26 с периодом полураспада 7,2×10 5 лет. В некоторых метеоритах были обнаружены повышенные уровни магния-26, и для определения их возраста использовалось отношение магния-26 к магнию-24.
В число крупнейших производителей магния ко второму десятилетию 21 века вошли Китай, Россия, Турция и Австрия.
Основные соединения
В соединениях магний практически всегда проявляет степень окисления +2 из-за потери или совместного использования двух 3 s электронов. Однако известно небольшое количество координационных соединений со связью магний-магний, LMg-MgL, в которых центры магния имеют формальную степень окисления +1. Карбонат магния, MgCO 3 , встречается в природе в виде минерального магнезита и является важным источником элементарного магния. Его можно получить искусственно, воздействуя углекислым газом на различные соединения магния. Белый порошок без запаха имеет множество промышленных применений, например, в качестве теплоизолятора для котлов и труб, а также в качестве добавки к продуктам питания, фармацевтическим препаратам, косметике, каучукам, чернилам и стеклу. Поскольку карбонат магния гигроскопичен и нерастворим в воде, он был оригинальной добавкой, используемой для придания поваренной соли сыпучести даже в условиях высокой влажности.
Гидроксид магния, Mg(OH) 2 , представляет собой белый порошок, получаемый в больших количествах из морской воды путем добавления известкового молока (гидроксида кальция). Это основное сырье для производства металлического магния, которое используется в качестве огнезащитной добавки. В воде он образует суспензию, известную как магнезиальное молоко, которое издавна используется как антацид и слабительное.
Действие соляной кислоты на гидроксид магния дает хлорид магния, MgCl 2 , бесцветное расплывающееся (водопоглощающее) вещество, используемое в производстве металлического магния, в производстве цемента для тяжелых полов и в качестве добавки в текстильном производстве. Он также используется для коагуляции соевого молока при производстве тофу.
При обжиге карбоната магния или гидроксида магния образуется кислородное соединение оксида магния, обычно называемое магнезией, MgO. Это белое твердое вещество, используемое в производстве жаропрочных огнеупорных кирпичей, электрических и теплоизоляционных материалов, цементов, удобрений, резины и пластмасс. Он также используется в медицине как слабительное и антацид.
Он также используется в медицине как слабительное и антацид.
Сульфат магния, MgSO 4 , представляет собой бесцветное кристаллическое вещество, образованное реакцией гидроксида магния с диоксидом серы и воздухом. Гидратная форма сульфата магния, называемая кизеритом, MgSO 4 ∙H 2 O, встречается в виде месторождения полезных ископаемых. Синтетически полученный сульфат магния продается в виде английской соли, MgSO 4 ∙7H 2 O. В промышленности сульфат магния используется при производстве цемента и удобрений, при дублении и окрашивании; в медицине он служит слабительным. Из-за способности легко поглощать воду безводная форма используется в качестве осушителя (осушителя).
Среди металлоорганических соединений магния важные реагенты Гриньяра, состоящие из органической группы (например, алкилов и арилов), атома галогена, отличного от фтора, и магния. Они используются в производстве многих других видов органических и металлоорганических соединений.



Leave A Comment