Подобное растворяется в подобном • Джеймс Трефил, энциклопедия «Двести законов мироздания»
200 законов мироздания > Химия
Вещество лучше растворяется в жидкости, если оно обладает той же полярностью и сходными прочими характеристиками.
Всем известно, что масло и вода не смешиваются: если мы добавим каплю масла в стакан с водой, с этой каплей ничего не произойдет, она не растворится. С другой стороны, если в воду капнуть спирт (или этанол, как говорят химики), капля сразу исчезнет, потому что она растворилась. Это можно проверить, добавив каплю красного вина в стакан с водой. Химики объясняют такое поведение веществ эмпирическим правилом «подобное растворяется в подобном».
Дело в том, что вода — полярная молекула. Электроны в молекуле воды большую часть времени проводят около кислорода, и, хотя суммарный электрический заряд всей молекулы равен нулю, молекула воды со стороны водорода становится положительно заряженной. Молекула этанола также полярная, и поэтому между молекулами воды и этанола могут образовываться водородные связи (см.
С другой стороны, масло состоит из неполярных молекул, поэтому между ними и молекулами воды нет связей. И вода не может «схватиться» за углеводородные молекулы масла. В свою очередь, масло не может присоединиться достаточно прочно к какой-либо молекуле воды, чтобы оттолкнуть другие молекулы воды, как происходило бы при растворении. Масло не «подобно» воде и не растворяется в ней.
В обычной жизни мы часто используем правило «подобное растворяется в подобном», хотя, наверное, не отдаем себе в этом отчет. Мы применяем моющие вещества — молекулы с особой структурой. У них длинный углеводородный хвост (неполярный, как и у масла) присоединен к сильно полярной головке. И, когда такая молекула встречается со слоем жира на поверхности, которую мы моем, хвост проникает внутрь этого слоя, а полярные головки торчат наружу.
4
Показать комментарии (4)
Свернуть комментарии (4)
Стас 17.09.2007 13:17 Ответить
Не дано определение полярности. Что имеется ввиду: дипольный момент, диэлектрическая проницаемость или иное. Дипольный момент молекул спиртов и воды ~1,7 Дебай. Но в бутаноле масло растворяется, а в ряду пропанол — этанол — метанол — вода растворимость постепенно уменьшается до практически нуля при равной полярности (дипольный момент)молекул. Так что определяет растворимость?
Ответить
Inna Стас 02.07.2008 15:56 Ответить
думаю, что растворимость определяет соотношение величины заряда диполя и размера неполярного углевода.

Ответить
Inna 02.07.2008 16:03 Ответить
Наверное нужно уточнить, что подразумевается под «маслом». Нефть (oil) растекается тонким слоем по поверхности воды из-за того, что неполярные хвосты молекул выталкиваются из воды (энтропийными «силами»), а полярные «головки» притягиваются к воде. Тот же эффект, что и с моющими средствами.
Ответить
mikad Inna 10.07.2008 13:12 Ответить
Под маслом подразумевается масло и тому подобные масляные вещества. Включая нефть.
 Но любое другое — тоже. Нефть растекается тонким слоем по поверхности воды абсолютно не по той причине, что моющие средства. У нефти нет гидрофильных головок (точнее, есть, конечно, в малой и не особо интересной концентрации. Просто потому, что в нефти много чего есть, и полярные и амфифильные соединения в том числе).
Но любое другое — тоже. Нефть растекается тонким слоем по поверхности воды абсолютно не по той причине, что моющие средства. У нефти нет гидрофильных головок (точнее, есть, конечно, в малой и не особо интересной концентрации. Просто потому, что в нефти много чего есть, и полярные и амфифильные соединения в том числе).Ответить
Написать комментарий
1877
Постоянная Больцмана
начало XIX в.
Поверхностное натяжение
Новостная рассылка
«Элементы» в соцсетях:
Вода – главный инструмент экстракции кофе — The Welder Catherine
вода – главный инструмент экстракции кофе
Когда мы готовим кофе, мы растворяем вкусовые вещества: вода подхватывает с поверхности молотого кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.вкусовые молекулы и уносит их за собой в чашку; этот процесс, как все мы знаем, и называется экстракцией. Неважно, каким методом мы готовим
 – с помощью эспрессо-машины или через какую-нибудь воронку, – нашим главным инструментом всегда остается вода, пускай она попадает в разные условия и приобретает разные свойства. Сегодня мы постараемся разобраться, какие свойства воды дают ей растворять всякие штуки и каким образом разный состав воды будет влиять на вкус кофе, который мы с её помощью готовим. Для начала давайте разберемся, что у нас происходит на молекулярном уровне. Как все мы знаем, молекулы воды состоят из двух молекул водорода и одной молекулы кислорода.
– с помощью эспрессо-машины или через какую-нибудь воронку, – нашим главным инструментом всегда остается вода, пускай она попадает в разные условия и приобретает разные свойства. Сегодня мы постараемся разобраться, какие свойства воды дают ей растворять всякие штуки и каким образом разный состав воды будет влиять на вкус кофе, который мы с её помощью готовим. Для начала давайте разберемся, что у нас происходит на молекулярном уровне. Как все мы знаем, молекулы воды состоят из двух молекул водорода и одной молекулы кислорода.
Молекулы воды полярные: кислород сильнее притягивает общие электроны, чем водород, так что у молекулы появляются места, где электронов не хватает, и места, где их слишком много. Эти места могут ненадолго притягивать другие молекулы с похожими свойствами, почти как магниты притягивают другие магниты. Их (места с частичным зарядом) удобно представлять себе как маленькие крючки, которые могут зацепиться за другие крючки на других похожих молекулах.
Связи, которые молекулы воды устанавливают между собой и с другими молекулами, называются водородными связями. За счет их молекулы воды существуют в основном в виде жидкости – они активно цепляются друг за друга, так что нужно много энергии, чтобы эти связи порвались, и вода испарилась.
По той же причине вода хорошо растворяет другие вещества – её молекулам есть чем уцепиться за другие полярные молекулы. Если другая молекула неполярная и у неё нет «крючков», за которые можно уцепиться воде (например, молекула жира), то вода всё равно может удержать её в себе, хоть и до некоторого предела. Молекулы воды сцепляются между собой и образовывают вокруг такой молекулы «хороводы», не давая ей выпасть в осадок или всплыть на поверхность.
Когда с водой контактирует другое вещество, может произойти две вещи. Допустим, мы растворили молекулу сахара.
Она остается невредимой и сохраняет свои свойства (сахар и дальше будет сахаром), но за неё своими «крючками» зацепляются молекулы воды и утаскивают её всё дальше и дальше от твердого куска в раствор. Сахар растворится быстрее, если воду помешивать: так к куску сахара будут быстрее добираться ещё незанятые молекулы воды и прицепляться к другим молекулам сахара. То же происходит с большинством вкусовых частичек на поверхности молотого кофе. Чем выше температура воды, тем быстрее двигаются молекулы, а чем быстрее они двигаются, тем быстрее они отрываются от твердого куска – поэтому в горячей воде всё растворяется быстрее.
Сахар растворится быстрее, если воду помешивать: так к куску сахара будут быстрее добираться ещё незанятые молекулы воды и прицепляться к другим молекулам сахара. То же происходит с большинством вкусовых частичек на поверхности молотого кофе. Чем выше температура воды, тем быстрее двигаются молекулы, а чем быстрее они двигаются, тем быстрее они отрываются от твердого куска – поэтому в горячей воде всё растворяется быстрее.
Второй вариант развития событий произойдет, если мы растворили в воде кристалл соли.
Это ионное соединение – атом хлора гораздо сильнее притягивает электроны, чем атом натрия, поэтому он полностью отбирает у него его электрон, и они оба становятся ионами (атомами с зарядом). На письме ионы можно вычислить по тому, что рядом с ними указан их заряд – например, Mg2+ значит, что у магния отобрали два электрона, и теперь у него есть два положительных заряда (протонов в ядре больше, чем электронов в оболочке). Если у атома наоборот больше электронов, чем протонов, то его заряд будет отрицательным (как у иона хлора Cl—).
Химический состав воды, которую мы используем для приготовления кофе, волнует нас сразу по нескольким причинам.
• Во-первых, вода – один из двух главных ингредиентов любого кофейного напитка. Поэтому она должна отвечать ряду параметров: прежде всего не иметь выраженного цвета или привкуса, потому что эти привкусы могут перейти в наш

• Во-вторых, вода – основной инструмент экстракции. В любой воде, кроме дистиллированной, всегда находится сколько-то твердых веществ, молекулы которых ведут себя не так, как молекулы воды. Минеральный состав воды влияет на то, как вода достает вкусы из кофе, а также на то, как вкус меняется уже в чашке. Если состав воды будет неоптимальным, мы получим или плоский и пыльный, или слишком резкий и кислый вкус.
• В-третьих, вода постоянно контактирует с нашим оборудованием (прежде всего с эспрессо-машиной), и твердые вещества из воды образуют накипь, а это может снизить эффективность работы машины и даже привести к поломке. Накипь ухудшает теплопроводимость и блокирует отверстия (трубы, рестрикторы и т.д.), вплоть до полной остановки оборудования. Как правило, чем больше минерализация воды, тем больше вероятность образования накипи, но здесь есть нюансы. Также нужно избегать коррозии, которая вызвана отклонениями кислотности.
три ключевых персонажа в воде
Среди всех минералов, которые могут находиться в воде, есть три ключевых для нас персонажа. Это кальций Ca2+, магний Mg2+ и гидрокарбонат-ионы HCO3—. Изначально они попадают в воду из каменных пород, которые растворяет дождевая вода. Чем больше в воде кальция и магния, тем хуже в ней мылится мыло и тем больше эта вода сушит кожу; поэтому её называют «жесткой», а сумму концентраций кальция и магния обычно называют общей жесткостью (general hardness или GH). Концентрацию гидрокарбонат-ионов часто называют щелочностью. Но из этого названия непонятно что это за штука, поэтому в кофейном мире чаще используют название «буферная емкость» (имея в виду способность гидрокарбонат-ионов нейтрализовать кислоты и быть буферами pH). В разных источниках та же самая вещь называться по-разному – «щелочность», «карбонатная жесткость», «KH», «буферная емкость» или просто «буфер», «концентрация гидрокарбонат-ионов» или «временная жесткость». На английском языке это всё звучит как alkalinity, carbonate/Karbonate hardness, buffer capacity, temporary hardness и bicarbonate content/concentration. Главное помнить, что это всё – одно и то же, концентрация гидрокарбонат-ионов.
Это кальций Ca2+, магний Mg2+ и гидрокарбонат-ионы HCO3—. Изначально они попадают в воду из каменных пород, которые растворяет дождевая вода. Чем больше в воде кальция и магния, тем хуже в ней мылится мыло и тем больше эта вода сушит кожу; поэтому её называют «жесткой», а сумму концентраций кальция и магния обычно называют общей жесткостью (general hardness или GH). Концентрацию гидрокарбонат-ионов часто называют щелочностью. Но из этого названия непонятно что это за штука, поэтому в кофейном мире чаще используют название «буферная емкость» (имея в виду способность гидрокарбонат-ионов нейтрализовать кислоты и быть буферами pH). В разных источниках та же самая вещь называться по-разному – «щелочность», «карбонатная жесткость», «KH», «буферная емкость» или просто «буфер», «концентрация гидрокарбонат-ионов» или «временная жесткость». На английском языке это всё звучит как alkalinity, carbonate/Karbonate hardness, buffer capacity, temporary hardness и bicarbonate content/concentration. Главное помнить, что это всё – одно и то же, концентрация гидрокарбонат-ионов.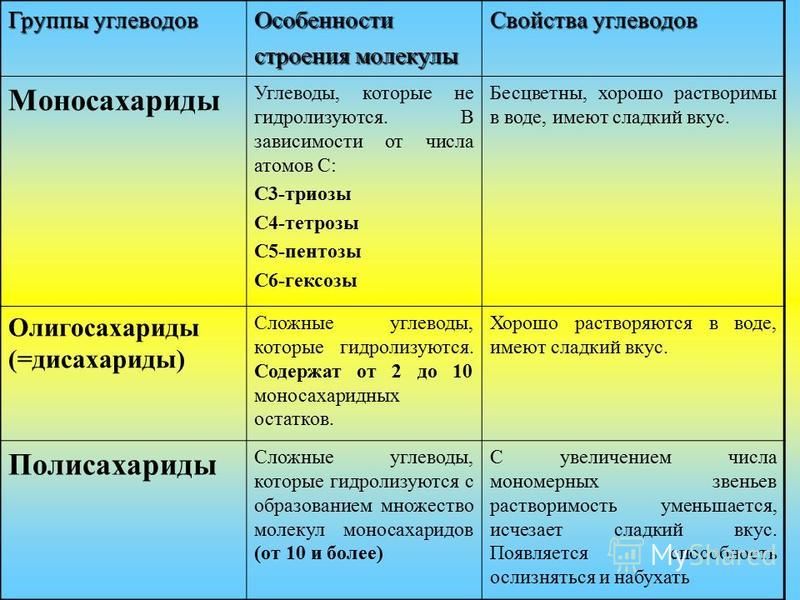
общая жесткость
Общая жесткость прямо влияет на то, сколько всего мы достанем из кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.(то есть на степень экстракции). Кофе можно приготовить и на дистиллированной воде – мы уже разобрались, каким именно образом молекулы воды присоединяют к себе вкусовые соединения. Но вещества, которые содержатся в кофе, могут увеличивать или уменьшать степень экстракцию и кардинально менять вкус чашки, даже если остальные переменные остаются одинаковыми.
Влияние общей жесткости на экстракцию кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.изучали Кристофер Хэндон и Максвелл Колонна-Дэшвуд. Они экспериментально сравнили, как магний, кальций и натрий будут связываться с несколькими типичными для кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста. молекулами вкуса – фруктовыми кислотами, кофеином и так далее. В результате эксперимента выяснилось несколько вещей.
молекулами вкуса – фруктовыми кислотами, кофеином и так далее. В результате эксперимента выяснилось несколько вещей.
• По сравнению с кальцием и магнием, натрий еле-еле присоединяется ко вкусовым молекулам кофе, так что его можно в принципе не учитывать.
• Наоборот, магний будет интенсивно доставать из кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.все вкусовые молекулы – причем скорее вкусные, чем невкусные (например, хлорогеновую и хинную кислоты). Но суммарно он достанет из кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.больше, чем кальций, так что кислотность кислотность кофейных зёрен варьируется от 4, 85 до 5, 10. Такая среда является достаточно кислой. На вкус необработанное кофейное зерно отдалённо напоминает вишню. В состав кофейного зерна входит около 30 видов кислот.придется чем-то балансировать (например, буфером).
• Кальций менее эффективен в плане экстракции, чем магний, но более эффективен, чем натрий, а калий вообще не принимает в ней участия.
• Также кальций – это одна из двух составляющих накипи. Поэтому Хэндон и Колонна в целом рекомендуют по возможности замещать кальций в вашей воде магнием, но из-за этого вода не станет идеальной – она просто даст высокую степень экстракции (не факт, что это будет вкусно и сбалансированно) и меньше накипи.
Очень сложно сказать, что произойдет, если мы добавим столько-то магния и столько-то кальция. Вкус чашки точно поменяется – сместится баланс, поменяется интенсивность элементов вкуса; но многое зависит и от вкусового профиля самого кофе, и от разницы способов приготовления, и от профиля обжарки.
Общий заряд воды всегда должен оставаться нейтральным – количество положительно и отрицательно заряженных ионов должно оставаться одинаковым. Например, Ca2+ с двойным положительным зарядом должен соответствовать двойной отрицательный заряд – это могут быть два гидрокарбонат-иона HCO3— или один сульфат-ион SO42-.
Общая жесткость и буферная емкость необязательно равны: положительные заряды кальция и магния могут уравниваться отрицательными зарядами хлоридов или сульфатов (которые не являются буферами), а отрицательный заряд гидрокарбонат-ионов – положительными зарядами натрия или калия (которые не входят в жесткость). Обычно буферная емкость меньше общей жесткости, но в некоторых природных водах (Evian, Боржоми) и в воде, очищенной с помощью системы ионного обмена (и богатой натрием и калием), гидрокарбонат-ионов может быть больше, чем жесткости.
Обычно буферная емкость меньше общей жесткости, но в некоторых природных водах (Evian, Боржоми) и в воде, очищенной с помощью системы ионного обмена (и богатой натрием и калием), гидрокарбонат-ионов может быть больше, чем жесткости.
Накипь (карбонат кальция, CaCO3) – это результат реакции кальция (Ca2+) и карбонат-ионов (CO32-, получаются из гидрокарбонат-ионов). Чем больше в воде кальция и гидрокарбоната, тем больше накипи из неё может выпасть. Если жесткости больше, чем буфера, то какое-то её количество после реакции останется в воде; эта жесткость будет называться постоянной жесткостью, а та жесткость, что образовала накипь – временной жесткостью (потому что она «ушла» из воды). Если буфера больше, чем жесткости, то в воде останется какое-то количество гидрокарбонат-ионов. Получается, что возможное количество выпавшей накипи ограничивается тем, чего меньше – жесткости или буфера.
«жесткая» / «мягкая» вода
Лучше не использовать понятия «жесткая» или «мягкая» вода. По идее, в жесткой воде много минералов, а в мягкой – мало. Но когда мы говорим о жесткой воде, то чаще всего мы имеем в виду воду, которая образовывает накипь – а этого не случится, если в воде не будет гидрокарбонат-ионов (а такое бывает, хотя и редко). Общая жесткость у такой воды будет высокой, но накипи из неё не выпадет.
По идее, в жесткой воде много минералов, а в мягкой – мало. Но когда мы говорим о жесткой воде, то чаще всего мы имеем в виду воду, которая образовывает накипь – а этого не случится, если в воде не будет гидрокарбонат-ионов (а такое бывает, хотя и редко). Общая жесткость у такой воды будет высокой, но накипи из неё не выпадет.
Другой пример: если в воде будет много калия и натрия, но совсем не будет кальция и магния, то в ней будет целая куча растворенных веществ (и ваш TDS-метр покажет большую цифру), но при этом ни общей жесткости, ни буфера. С точки зрения кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.такая вода будет почти такой же «мягкой», как и дистиллированная, хотя TDS у неё и будет высоким. Поэтому лучше описывать состав воды более конкретно и приводить четкие цифры общей жесткости и буферной емкости.
индекс Ланжелье
Вода может как оставлять накипь, так и растворять её (а также другие металлы – например, нержавейку в нашей эспрессо-машине). Как она себя поведет – зависит от её pH, общей минерализации, концентрации кальция и гидрокарбоната, а также температуры. Из этих переменных можно рассчитать так называемый индекс насыщения Ланжелье и узнать, что будет делать ваша вода, когда попадет в бойлер эспрессо-машины. Если индекс равен нулю, вода не будет ни оставлять, ни растворять накипь; если он больше нуля, накипь будет образовываться, если меньше – растворяться. Лучше всего, чтобы индекс был равен +0.2 – +0.7; так накипь будет выпадать, но её будет не слишком много, и опасность коррозии будет минимальной.
Как она себя поведет – зависит от её pH, общей минерализации, концентрации кальция и гидрокарбоната, а также температуры. Из этих переменных можно рассчитать так называемый индекс насыщения Ланжелье и узнать, что будет делать ваша вода, когда попадет в бойлер эспрессо-машины. Если индекс равен нулю, вода не будет ни оставлять, ни растворять накипь; если он больше нуля, накипь будет образовываться, если меньше – растворяться. Лучше всего, чтобы индекс был равен +0.2 – +0.7; так накипь будет выпадать, но её будет не слишком много, и опасность коррозии будет минимальной.
Если индекс Ланжелье положительный, накипь будет выпадать, пока концентрации кальция и буфера не упадут так, что индекс станет равен нулю. Так что с точки зрения накипи неважно, выключаете ли вы машину на ночь или нет – важно только количество воды, которое сквозь неё проходит, и её характеристики. Зная количество воды, которое расходуется на один напиток, можно рассчитать примерное количество накипи в месяц, которое выпадет в осадок в эспрессо-машине.
что же такое буфер?
Гидрокарбонат-ион HCO3— довольно хитро ведёт себя в воде: он может как воровать у других молекул протоны водорода H+, так и отдавать эти протоны кому-то ещё. Поэтому в воде он существует вместе с двумя своими формами: угольной кислотой h3CO3 и карбонат-ионом CO32-.
За счет этого гидрокарбонат-ионы могут нейтрализовать кислоты и основания, таким образом поддерживая pH воды на одном уровне.
Для нас здесь важнее всего то, что если в воду с буфером попадает кислота, буфер отбирает у неё протон водорода. Так кислота перестает быть кислотой и теряет свой вкус – она становится конъюгатным основанием («злым близнецом» кислоты). Кофе без кислотности — плоский и неинтересный, а конъюгатные основания горькие на вкус. Однако полное отсутствие буфера в воде может сделать кислотность кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.слишком интенсивной, прямой и неприятной. Можете приготовить кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста. на дистиллированной воде (необязательно получится невкусно, но кислотность кислотность кофейных зёрен варьируется от 4, 85 до 5, 10. Такая среда является достаточно кислой. На вкус необработанное кофейное зерно отдалённо напоминает вишню. В состав кофейного зерна входит около 30 видов кислот.скорее всего выйдет из баланса), а потом добавить в эту чашку пищевой соды на кончике ложки – картина резко поменяется, потому что пищевая сода (гидрокарбонат натрия, NaHCO3) распадется на катионы натрия и гидрокарбонат-ионы (вот вам и буфер).
на дистиллированной воде (необязательно получится невкусно, но кислотность кислотность кофейных зёрен варьируется от 4, 85 до 5, 10. Такая среда является достаточно кислой. На вкус необработанное кофейное зерно отдалённо напоминает вишню. В состав кофейного зерна входит около 30 видов кислот.скорее всего выйдет из баланса), а потом добавить в эту чашку пищевой соды на кончике ложки – картина резко поменяется, потому что пищевая сода (гидрокарбонат натрия, NaHCO3) распадется на катионы натрия и гидрокарбонат-ионы (вот вам и буфер).
В интернете можно встретить «народную мудрость» о том, что содержание магния влияет на интенсивность сладости, кальция – на тело, а гидрокарбонат-ионов – на кислотность. В ней есть доля правды: при низкой экстракции (если у воды низкая общая жесткость) сложно добиться высокой сладости, но степень экстракции можно повысить, (в том числе) добавив в воду магний. Кальций, встретившись с карбонат-ионами, скорее всего формирует накипь и в чашке, и прямо у нас во рту, а нерастворимая в воде накипь добавляет веса кофе. И конечно же, как мы увидели выше, буфер прямо влияет на интенсивность воспринимаемой кислотности.
И конечно же, как мы увидели выше, буфер прямо влияет на интенсивность воспринимаемой кислотности.
Ещё один связанный с буфером момент, который стоит прояснить – вопрос точки предельного насыщения воды. Если готовить кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.на воде с очень высоким уровнем минерализации (так что TDS-метр покажет больше 200 или 300), то очень вероятно, что мы получим чашку с очень плоским, пустым и пыльным вкусом. Согласно ещё одной городской легенде, это происходит из-за того, что вода уже «переполнена» и кофейные вкусо-ароматические молекулы в неё уже «не помещаются». Но в воду может влезть очень и очень много – она очень далека от точки предельного насыщения, когда мы готовим кофе.
Что же происходит? На самом деле виноват, конечно же, буфер. Гидрокарбонат-ион – самый распространенный отрицательно заряженный ион в природных водах, так что чем больше в воде веществ, тем больше вероятность того, что в ней много буфера. Он нейтрализует кислоты – они остаются в чашке, но воспринимаются они теперь совсем иначе, как плоские, пыльные и землистые соединения.
Он нейтрализует кислоты – они остаются в чашке, но воспринимаются они теперь совсем иначе, как плоские, пыльные и землистые соединения.
как же узнать, что находится в нашей воде?
Лучше всего это сделать с помощью так называемого титрования. Цветной раствор определенного вещества по капелькам добавляют в воду. Это вещество реагирует с тем веществом, которое мы хотим измерить; когда второе вещество заканчивается, вода приобретает изначальный цвет раствора. Нам понадобятся два набора для титрования: тест GH (general hardness, общей жесткости) и тест KH (от немецкого Karbonathärte, карбонатной жесткости). Пользоваться ими очень просто: нужно набрать определенное количество воды, состав которой вы хотите узнать, в тестовый флакон и добавлять туда по капле тестового раствора, считая капли и встряхивая флакон после каждой, пока раствор не поменяет цвет. От размера сэмпла зависит точность измерения: если воды будет в два раза больше, измерение будет в два раза точнее, и так далее. Их главный плюс – возможность отдельно измерить общую жесткость и буферную емкость.
Их главный плюс – возможность отдельно измерить общую жесткость и буферную емкость.
У титрования есть свои недостатки, но оно гораздо эффективнее, чем измерение проводимости воды – хоть это и популярный метод оценивания минерального состава воды среди бариста. Проводимость – способность воды проводить электрический ток, – прямо зависит от количества ионов, растворенных в воде. Дистиллированная вода – очень плохой проводник; чем больше в воде растворено ионов, тем больше появляется потенциальных путей для передачи электронов. Кондуктометр (более известный как TDS-метр, хоть это и не совсем правильное название) измеряет именно проводимость. Недостатков у кондуктометров сразу несколько:
• разные ионы по-разному проводят электрический ток – а кондуктометры не различают между разными ионами, так что и кальций, и магний, и натрий, и гидрокарбонат-ионы (при всех их супер-важных для нас различиях) сведутся к одной и той же абстрактной цифре;
• кондуктометры калибруют на растворах с «типичным» ионным составом, хотя состав воды даже в разных районах одного города будет очень сильно отличаться. А вода с другим составом будет проводить ток уже иначе;
А вода с другим составом будет проводить ток уже иначе;
• проводимость воды будет серьезно повышаться с ростом температуры.
TDS как единица почти полностью бесполезна для кофейной индустрии – равняться исключительно на неё ошибочно. Представим воду с высокой жесткостью, но практически без буфера: её TDS может сильно превышать стандарт, но если мы попробуем «упасть» до стандарта, обращая внимание только на TDS, и смягчить эту воду, то буфер совсем исчезнет. Результат – резкая кислотность, несбалансированная чашка.
Или наоборот: TDS может быть вполне в рамках стандарта, но буфера может быть куда больше, чем нужно; результат – плоский, пыльный, горький вкус.
До какой-то степени кондуктометры можно использовать для отслеживания прыжков состава воды: допустим, обычно ваш кондуктометр, опущенный в вашу рабочую воду, показывает 100 ppm; что-то явно пошло не так, если он вдруг стал показывать 400 ppm. Но мы не сможем сказать, что именно пошло не так, и не сможем делать каких-то выводов о конкретном составе этой воды ни до, ни после скачка.
какая же вода будет больше всего подходить для кофе?
Нам нужно остановиться на двух главных переменных: общей жесткости (сумме концентраций кальция и магния) и буферной емкости (концентрации гидрокарбонат-ионов). Рассмотрим четыре варианта соотношения их концентраций:
1) Очень много жесткости, очень мало буфера – высокая степень экстракции, нехватка буфера, резкая несбалансированная кислотность;
2) Очень мало жесткости, очень много буфера – низкая степень экстракции, нехватка тела, нехватка сложных вкусов, плоский, резкий и «обжарочный» вкус;
3) Очень мало жесткости, очень мало буфера – за степень экстракции отвечают только вода и температура; пустая чашка, некачественная кислотность, нехватка тела.
4) Очень много жесткости, очень много буфера – Начиная с 90 мг/л буфера, растет риск образования накипи; с точки зрения вкуса с таким количеством буфера можно справиться, но только с помощью высокой общей жесткости (которая увеличит степень экстракции).
Необходимо также рассмотреть вопрос связи химического состава воды и профилей обжарки. Мы уже поняли, что вкус кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.меняется в зависимости от воды, с помощью которой его готовят – но есть и обратная связь, потому что обжарщики пробуют свой кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.и корректируют его профили используя воду некоторого химического состава. По сути обжарщик всегда старается сделать так, чтобы его кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.был как можно вкуснее на той воде, на которой он его пробует сам – а значит, кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.всегда обжаривается под некоторый химический состав воды. На нашем производстве мы используем систему водоподготвки EVERPURE MRS 600 с возможностью делать как воду с низкой минерализацией для фильтра, так и с минерализацией 100-150 ppm для эспрессо.
Связь воды и профиля обжарки невероятно важна: не бывает идеального состава воды, который подходил бы под любой кофе. Вода с высокой буферной емкостью всегда будет давать плоский и пыльный кофе напиток из жареных и перемолотых зёрен кофейного дерева или кофейного куста.со сверхнизкой кислотностью, как бы обжарщик не подгонял под неё свой профиль – ему скорее всего придется сильно недоразвивать кофе, чтобы получить в чашке хоть какую-нибудь кислотность, а это даст очень низкое тело и практически полное отсутствие сладости. Вода с очень низкой минерализацией (например, из системы обратного осмоса без реминерализации) всегда будет давать низкую степень экстракции – с точки зрения обжарки это придется компенсировать увеличением растворимости кофе, то есть большей степенью развития.
При этом помните, что вода – это далеко не всегда корень всех проблем. На неё очень часто вешают вину за невкусный кофе, хотя проблема может заключаться совсем в другом.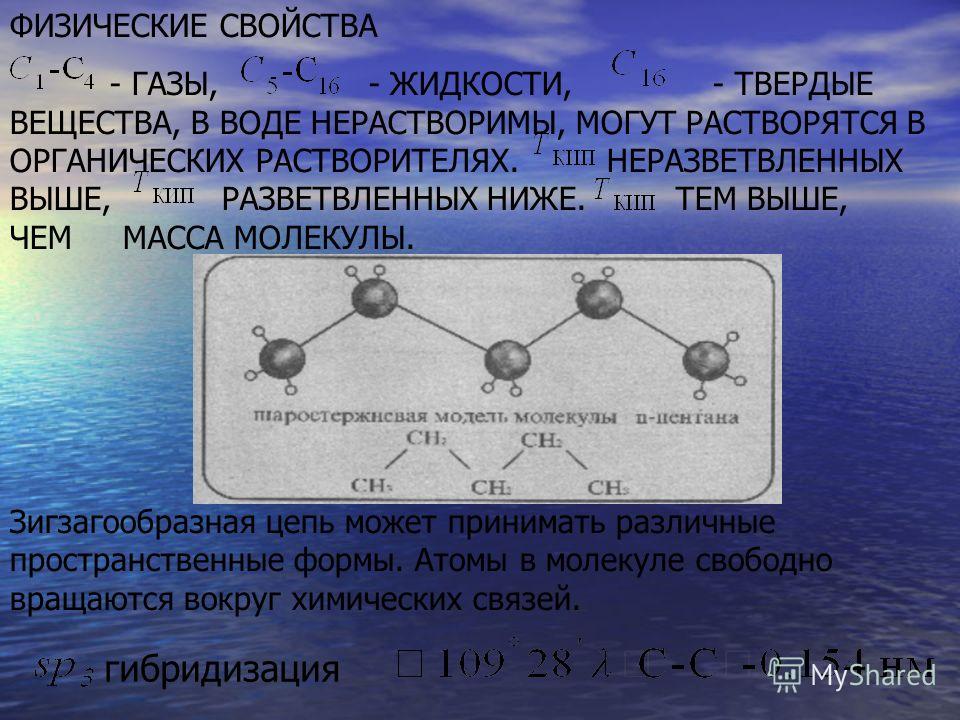 Но для того, чтобы диагностировать корень проблемы, нужно знать, как проверить состав своей воды, чтобы или подтвердить свои предположения, или исключить её из списка подозреваемых, чтобы начать искать проблему в другом месте.
Но для того, чтобы диагностировать корень проблемы, нужно знать, как проверить состав своей воды, чтобы или подтвердить свои предположения, или исключить её из списка подозреваемых, чтобы начать искать проблему в другом месте.
4.4 Растворимость — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 17044
Понимание диполей связи и различных типов нековалентных межмолекулярных сил позволяет нам объяснить на молекулярном уровне многие наблюдаемые физические свойства органических соединений. В этом разделе мы сосредоточимся на растворимости, температуре плавления и температуре кипения.
Растворимость
Практически вся органическая химия, которую вы увидите в этом курсе, проходит в фазе раствора. В органической лаборатории реакции часто проводят в неполярных или слабополярных растворителях, таких как толуол (метилбензол), гексан, дихлорметан или диэтиловый эфир. В последние годы было предпринято много усилий, чтобы адаптировать условия реакции, чтобы можно было использовать «более экологичные» (другими словами, более безвредные для окружающей среды) растворители, такие как вода или этанол, которые являются полярными и способны образовывать водородные связи. В органических реакциях, протекающих в цитозольной области клетки, растворителем, конечно же, является вода. Для любого химика-органика крайне важно понимать факторы, влияющие на растворимость различных молекул в различных растворителях.
В органической лаборатории реакции часто проводят в неполярных или слабополярных растворителях, таких как толуол (метилбензол), гексан, дихлорметан или диэтиловый эфир. В последние годы было предпринято много усилий, чтобы адаптировать условия реакции, чтобы можно было использовать «более экологичные» (другими словами, более безвредные для окружающей среды) растворители, такие как вода или этанол, которые являются полярными и способны образовывать водородные связи. В органических реакциях, протекающих в цитозольной области клетки, растворителем, конечно же, является вода. Для любого химика-органика крайне важно понимать факторы, влияющие на растворимость различных молекул в различных растворителях.
Вы, наверное, помните правило, которое вы узнали из общей химии относительно растворимости: «подобное растворяется в подобном» (и даже до того, как вы вообще занялись какой-либо химией, вы, вероятно, в какой-то момент своей жизни заметили, что масло не смешивается с водой). Давайте вернемся к этому старому правилу и задействуем наши знания о ковалентных и нековалентных связях.
Представьте, что у вас есть колба, наполненная водой, и набор веществ, которые вы будете проверять, насколько хорошо они растворяются в воде. Первым веществом является поваренная соль, или хлорид натрия. Как вы почти наверняка догадались, особенно если вы когда-либо случайно набирали глоток воды во время плавания в океане, это ионное соединение легко растворяется в воде. Почему? Потому что вода, как очень полярная молекула, способна образовывать множество ион-дипольных взаимодействий как с катионом натрия, так и с анионом хлорида, энергии от которых более чем достаточно, чтобы компенсировать энергию, необходимую для разрыва ион-ионных взаимодействий. в кристалле соли и некоторых водородных связях вода-вода.
Конечным результатом является то, что вместо кристаллов хлорида натрия у нас есть отдельные катионы натрия и анионы хлорида, окруженные молекулами воды – соль теперь в растворе . Заряженные виды, как правило, хорошо растворяются в воде, другими словами, они очень гидрофильны (водолюбивы).
Теперь попробуем соединение под названием бифенил, которое, как и хлорид натрия, представляет собой бесцветное кристаллическое вещество (однако два соединения легко различимы на вид — кристаллы выглядят совершенно по-разному).
Бифенил вообще не растворяется в воде. Почему это? Потому что это очень неполярная молекула, имеющая только связи углерод-углерод и углерод-водород. Он способен очень хорошо связываться сам с собой за счет неполярных ван-дер-ваальсовых взаимодействий, но не способен формировать значительные притягивающие взаимодействия с очень полярными молекулами растворителя. Таким образом, энергетические затраты на разрушение взаимодействий бифенила и бифенила в твердом теле высоки, и очень мало выиграно с точки зрения новых взаимодействий бифенил-вода. Вода — ужасный растворитель для неполярных молекул углеводородов: они очень гидрофобный (водоотталкивающий).
Затем вы пробуете серию все более крупных спиртовых соединений, начиная с метанола (1 атом углерода) и заканчивая октанолом (8 атомов углерода).
Вы обнаружите, что более мелкие спирты — метанол, этанол и пропанол — легко растворяются в воде. Это связано с тем, что вода способна образовывать водородные связи с гидроксильной группой в этих молекулах, и суммарная энергия образования этих водно-спиртовых водородных связей более чем достаточна для восполнения энергии, теряемой при взаимодействии спирта со спиртом. водородные связи разрываются. Однако когда вы пробуете бутанол, вы начинаете замечать, что по мере того, как вы добавляете в воду все больше и больше, он начинает формировать свой собственный слой поверх воды.
Спирты с более длинной цепью – пентанол, гексанол, гептанол и октанол – становятся все более нерастворимыми. Что здесь происходит? Ясно, что такие же благоприятные водородные связи вода-спирт все еще возможны с этими более крупными спиртами. Разница, конечно, в том, что более крупные спирты имеют более крупные неполярные гидрофобные области в дополнение к их гидрофильной гидроксильной группе. Примерно при четырех-пяти атомах углерода гидрофобный эффект начинает преобладать над гидрофильным эффектом, и растворимость в воде теряется.
Примерно при четырех-пяти атомах углерода гидрофобный эффект начинает преобладать над гидрофильным эффектом, и растворимость в воде теряется.
Теперь попробуйте растворить глюкозу в воде — хотя она имеет шесть атомов углерода, как и гексанол, она также имеет пять гидрофильных гидроксильных групп, образующих водородные связи, в дополнение к шестому кислороду, который способен быть акцептором водородных связей.
Мы склонили чашу весов в сторону гидрофильности и обнаружили, что глюкоза хорошо растворима в воде.
Мы видели, что этанол очень хорошо растворим в воде (в противном случае пить пиво или водку было бы довольно неудобно!) А как насчет диметилового эфира, который является структурным изомером этанола, но с функциональной группой эфира, а не спирта? Мы находим, что диэтиловый эфир гораздо менее растворим в воде. Способен ли он образовывать водородные связи с водой? Да, действительно, кислород эфира может выступать акцептором водородной связи. Однако разница между эфирной группой и спиртовой группой состоит в том, что спиртовая группа одновременно является донором водородной связи 9. Акцептор 0036 и .
Акцептор 0036 и .
В результате спирт способен образовывать более энергетически выгодные взаимодействия с растворителем по сравнению с эфиром, и поэтому спирт более растворим.
Вот еще один простой эксперимент, который можно провести (при должном надзоре) в органической лаборатории. Попробуйте растворить кристаллы бензойной кислоты в воде комнатной температуры — вы обнаружите, что она не растворяется. Как мы узнаем из одной из последующих глав, изучая кислотно-основную химию, карбоновые кислоты, такие как бензойная кислота, являются относительно слабыми кислотами и, таким образом, существуют в основном в кислой (протонированной) форме при добавлении к чистой воде.
Уксусная кислота, однако, хорошо растворима. Это легко объяснить, используя аргумент небольшого спирта против большого спирта: гидрофильный эффект водородной связи группы карбоновой кислоты достаточно силен, чтобы преодолеть гидрофобный эффект одной метильной группы на уксусную кислоту, но не больший гидрофобный эффект 6-углеродная бензольная группа бензойной кислоты.
Теперь попробуйте медленно добавить немного водного раствора гидроксида натрия в колбу с нерастворенной бензойной кислотой. По мере того как растворитель становится все более щелочным, бензойная кислота начинает растворяться, пока полностью не растворится.
Здесь происходит превращение бензойной кислоты в сопряженное с ней основание, бензоат. Нейтральная карбоксильная группа не была достаточно гидрофильной, чтобы компенсировать гидрофобное бензольное кольцо, но карбоксилатная группа с ее полным отрицательным зарядом гораздо более гидрофильна. Теперь чаша весов склоняется в пользу растворимости в воде, так как сильно гидрофильная анионная часть молекулы тащит гидрофобную часть, брыкаясь и крича (если бензольное кольцо может брыкаться и кричать) в раствор. Если вы хотите снова осадить бензойную кислоту из раствора, вы можете просто добавить достаточное количество соляной кислоты, чтобы нейтрализовать раствор и повторно протонировать карбоксилат.
Если вы изучаете лабораторный компонент курса органической химии, вы, вероятно, проведете по крайней мере один эксперимент, в котором будете использовать это явление для отделения органической кислоты, такой как бензойная кислота, от углеводородного соединения, такого как бифенил.
Аналогичные аргументы можно привести для объяснения растворимости различных органических соединений в неполярных или слабополярных растворителях. В общем, чем выше содержание заряженных и полярных групп в молекуле, тем менее растворима она в таких растворителях, как гексан. Ионный и очень гидрофильный хлорид натрия, например, совсем не растворяется в растворителе гексане, тогда как гидрофобный бифенил хорошо растворяется в гексане.
| Пример |
|---|
Упражнение 2.12 . Витамины можно классифицировать как водорастворимые и жирорастворимые (считайте жир очень неполярным, гидрофобным «растворителем»). Определите классификацию для каждого из них. Упражнение 2.13 : И анилин, и фенол нерастворимы в чистой воде. Предскажите растворимость этих двух соединений в 10% водном растворе соляной кислоты и объясните свои рассуждения. Подсказка – в данном контексте анилин является основным, фенол – нет! Растворы |
Иллюстрации концепций растворимости: промежуточные продукты метаболизма, липидные двухслойные мембраны, мыла и детергенты
Поскольку вода является биологическим растворителем, большинство биологических органических молекул для поддержания растворимости в воде содержат один или более заряженных функциональных групп. Чаще всего это фосфат, аммоний или карбоксилат, все они заряжаются при растворении в водном растворе, забуференном до pH 7.
Сахарам часто не хватает заряженных групп, но, как мы обсуждали в нашем «мысленном эксперименте» с глюкозой, они вполне растворимы в воде благодаря наличию нескольких гидроксильных групп.
Некоторые биомолекулы, напротив, содержат отчетливо гидрофобные компоненты. Мембраны «липидного двойного слоя» клеток и субклеточных органелл служат для заключения объемов воды и множества биомолекул в растворе. Молекулы липидов (жиров), из которых состоят мембраны, являются амфипатическими : они имеют заряженную гидрофильную «голову» и гидрофобный углеводородный «хвост».
Мембраны «липидного двойного слоя» клеток и субклеточных органелл служат для заключения объемов воды и множества биомолекул в растворе. Молекулы липидов (жиров), из которых состоят мембраны, являются амфипатическими : они имеют заряженную гидрофильную «голову» и гидрофобный углеводородный «хвост».
интерактивное трехмерное изображение мембранного фосфолипида (BioTopics)
Обратите внимание, что вся молекула построена на «основе» глицерина, простой трехуглеродной молекулы с тремя спиртовыми группами. В структуре биологической мембраны молекулы липидов располагаются в виде сферического бислоя: гидрофобные хвосты направлены внутрь и связываются между собой силами Ван-дер-Ваальса, а гидрофильные головные группы образуют внутреннюю и внешнюю поверхности, контактирующие с водой.
Интерактивное трехмерное изображение липидного двойного слоя (BioTopics)
Поскольку внутренняя часть двойного слоя чрезвычайно гидрофобна, биомолекулы (которые, как мы знаем, обычно являются заряженными частицами) не могут диффундировать через мембрану – они просто не растворяется в гидрофобном интерьере. Таким образом, транспорт молекул через мембрану клетки или органеллы может осуществляться контролируемым и специфическим образом с помощью специальных трансмембранных транспортных белков — увлекательная тема, о которой вы узнаете больше, если будете посещать занятия по биохимии.
Таким образом, транспорт молекул через мембрану клетки или органеллы может осуществляться контролируемым и специфическим образом с помощью специальных трансмембранных транспортных белков — увлекательная тема, о которой вы узнаете больше, если будете посещать занятия по биохимии.
Аналогичный принцип лежит в основе действия мыла и моющих средств. Мыла состоят из жирных кислот, которые представляют собой длинные (обычно 18-углеродные) гидрофобные углеводородные цепи с (заряженной) карбоксилатной группой на одном конце,
Жирные кислоты получают из животных и растительных жиров и масел. В водном растворе молекулы жирных кислот в мылах спонтанно образуют мицелл , сферическую структуру, которая позволяет гидрофобным хвостам избегать контакта с водой и одновременно образовывать благоприятные ван-дер-ваальсовые контакты.
Интерактивные трехмерные изображения молекулы мыла жирной кислоты и мыльной мицеллы (Edutopics)
Поскольку внешняя часть мицеллы заряжена и гидрофильна, структура в целом растворима в воде. Мицеллы спонтанно образуются вокруг небольших частиц масла, которые обычно не растворяются в воде (например, жирное пятно на вашей рубашке от ломтика пепперони, отпавшего от пиццы), и уносят частицу с собой в раствор. Мы узнаем больше о химии мыловарения в следующей главе (раздел 12.4B).
Мицеллы спонтанно образуются вокруг небольших частиц масла, которые обычно не растворяются в воде (например, жирное пятно на вашей рубашке от ломтика пепперони, отпавшего от пиццы), и уносят частицу с собой в раствор. Мы узнаем больше о химии мыловарения в следующей главе (раздел 12.4B).
Синтетические моющие средства представляют собой ненатуральные амфипатические молекулы, работающие по тому же принципу, что и мыло.
Органическая химия с акцентом на биологию Тима Содерберга (Университет Миннесоты, Моррис)
Водородная связь и растворимость
На физические свойства спиртов влияет способность группы -ОН образовывать водородные связи. Группы -ОН могут связываться водородом друг с другом и с другими молекулами.
Водородная связь метанола
Водородная связь повышает температуру кипения спиртов. Это происходит из-за объединенной силы столь многих водородных связей, образующихся между атомами кислорода одной молекулы спирта и гидроксильными атомами H другой. Чем длиннее углеродная цепь в спирте, тем ниже растворимость в полярных растворителях и выше растворимость в неполярных растворителях.
Чем длиннее углеродная цепь в спирте, тем ниже растворимость в полярных растворителях и выше растворимость в неполярных растворителях.
| Compound | IUPAC Name | Common Name | Melting Poing ( o C) | Boiling Point ( o C) | Solubility in H 2 O at 23 o C |
| CH 3 OH | Methanol | Methyl alcohol | -97.8 | 65.0 | Infinite |
| CH 3 Cl | Chloromethane | Methyl chloride | -97.7 | -24.2 | 0. 74 g/100 mL 74 g/100 mL |
| CH 4 | Methane | -182.5 | -161.7 | 3.5 mL (gas)/ 100 mL | |
| CH 3 CH 2 OH | Ethanol | Ethyl alcohol | -114.7 | 78.5 | Infinite |
| CH 3 CH 2 Cl | Chloroethane | Ethyl chloride | -136.4 | 12.3 | 0.447 g/100 mL |
| CH 3 CH 3 | Ethane | -183.3 | -88.6 | 4.7 mL (gas)/ 100 mL | |
| CH 3 CH 2 CH 2 OH | 1-Propanol | Propyl alcohol | -126.5 | 97.4 | Infinite |
| CH 3 CH 2 CH 3 | Propane | -187. 7 7 | -42.1 | 6.5 mL (gas) / 100 mL | |
| CH 3 CH 2 CH 2 CH 2 OH | 1-Butanol | Butyl alcohol | -89.5 | 117.3 | 8.0 g/100 mL |
| CH 3 (CH 2 ) 4 OH | 1-Pentanol | Pentyl alcohol | -79 | 138 | 2.2 g/100 mL |
Эта таблица показывает, что спирты (выделены красным) имеют более высокие температуры кипения и большую растворимость в H 2 O, чем галогеналканы и алканы с таким же числом атомов углерода. Это также показывает, что температура кипения спиртов увеличивается с увеличением числа атомов углерода.
Ссылки
- Шор, Нил Э. и Фоллхардт, К. Питер К. Органическая химия: структура и функции . Нью-Йорк: Блейер, Бреннан, 2007.
- Аллен, Фрэнк; Кеннард.
 Ольга; Уотсон, Дэвид Г .; Браммер, Ли; Орпен, Гай; Тейлор, Робин, J. Chem Soc. Перкин Транс II , 1987, S1-S19.
Ольга; Уотсон, Дэвид Г .; Браммер, Ли; Орпен, Гай; Тейлор, Робин, J. Chem Soc. Перкин Транс II , 1987, S1-S19.
Внешние ссылки
- http://en.wikipedia.org/wiki/Alcohol#Physical_and_chemical_properties
- http://www.chemguide.co.uk/organicprops/alcohols/background.html
Проблемы
Расположить по возрастанию температуры кипения. (start with lowest boiling point)
- CH 4 , CH 3 OH, CH 3 CH 3
- CH 3 CH 2 Cl, CH 3 CH 2 CH 2 OH, CH 3 CH 2 CH 3
- CH 3 CH 2 OH, CH 3 CH 2 Cl, CH 4
Arrange according to increasing solubility (start with lowest solubility)
- CH 4 , CH 3 OH, CH 3 CH 3
- CH 4 , CH 3 CH 2 Cl, CH 3 CH 2 OH,
- CH 3 CH 2 Cl, CH 3 CH 2 CH 2 OH, CH 3 CH 2 CH 3
Ответы
- Ch 4 , Ch 3 CH 3 , CH 3 OH
- CH 3 CH 2 CH 3 , Ch 3 CH 2 2 2 2 2 2 2 2 2 .
 CH 2 CH 2 OH
CH 2 CH 2 OH - CH 3 CH 2 Cl, CH 4 , CH 3 CH 2 OH
- CH 3 CH 3 , CH 4 , CH 3 OH
- CH 3 CH 2 Cl, CH 4 , CH 3 CH 2 OH,
- CH 3 CH 2 Cl, CH 3 CH 2 CH 3 , CH 3 CH 2 CH 2 OH
Авторы
- Джасприт Дери
4.4 Растворимость распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Какая молекула, по вашему мнению, будет более растворима в воде: Ch4…
Какая молекула, по вашему мнению, будет более растворима в воде: Ч4… | Каналы для Pearson+Недавние каналы
- Общая химия
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Biology
- Microbiology
- Anatomy & Physiology
- Genetics
- Cell Biology
Математика
- Алгебра колледжа
- Тригонометрия
- Предварительное исчисление
Физика
- Физика
Бизнес
- Microeconomics
- Macroeconomics
- Financial Accounting
Social Sciences
- .
 ОБЩЕСТВЕННЫЙ СПИСОК.
ОБЩЕСТВЕННЫЙ СПИСОК.Общая химия14. РешенияРешения: растворимость и межмолекулярные силы
1:50
минут
Задача 31
Вопрос из учебника
Проверенное решение
Это видео-решение было рекомендовано нашими преподавателями как полезное для описанной выше проблемы.
979просмотров
Было ли это полезно?
Смотреть следующие
Master Решения: Растворимость и межмолекулярные силы 1 с помощью видео -объяснений от Jules Bruno
.0023 173Views
Межмолекулярные силы
Pearson
63Views
Ионные дипольные силы и индуцированные ионы дипольные взаимодействия —
Органическая химия.
Растворимость и цикл Борна-Габера
Профессор Дэйв объясняет
109views
Реакции в водном растворе
00π производств
156просмотров
Когда два вещества образуют раствор (часть 1) | Решения | Химия | Не запоминать
Не запоминать
53просмотров
Как растворенное вещество растворяется в растворителе? | Решения | Химия | Не запоминать
Не запоминать
0024
Органическая химия
191views
Решения: Растворимость и межмолекулярные силы.


 Но любое другое — тоже. Нефть растекается тонким слоем по поверхности воды абсолютно не по той причине, что моющие средства. У нефти нет гидрофильных головок (точнее, есть, конечно, в малой и не особо интересной концентрации. Просто потому, что в нефти много чего есть, и полярные и амфифильные соединения в том числе).
Но любое другое — тоже. Нефть растекается тонким слоем по поверхности воды абсолютно не по той причине, что моющие средства. У нефти нет гидрофильных головок (точнее, есть, конечно, в малой и не особо интересной концентрации. Просто потому, что в нефти много чего есть, и полярные и амфифильные соединения в том числе).
 Ольга; Уотсон, Дэвид Г .; Браммер, Ли; Орпен, Гай; Тейлор, Робин, J. Chem Soc. Перкин Транс II , 1987, S1-S19.
Ольга; Уотсон, Дэвид Г .; Браммер, Ли; Орпен, Гай; Тейлор, Робин, J. Chem Soc. Перкин Транс II , 1987, S1-S19. CH 2 CH 2 OH
CH 2 CH 2 OH
Leave A Comment