10 Билет
А1. Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1) Са0 2) К+ 3) Сl+1 4) Sс0
А2. Легче всего присоединяет электроны атом
1) серы 2) хлора 3) селена 4) брома
А3. Вещество SO3 1) кислотный оксид 2) основный оксид 3) амфотерный оксид 4) несолеобразующий оксид
А4. Наименьшей электроотрицательностью обладает
1) Ве 2) В 3) С 4) N
А5. Свойства веществ зависят не только от состава, но и от
1) условий получения вещества 2) порядка связи атомов в соединении
3) валентности химических элементов 4) агрегатного состояния вещества
A6.
К соединениям, имеющим общую формулу
С
1) бензол 2) циклогексан 3) гексан 4) гексин
А7. Схема превращений Э →
Э2О3 →
Э(ОН)3 соответствует генетическому ряду
Схема превращений Э →
Э2О3 →
Э(ОН)3 соответствует генетическому ряду
1) натрий → оксид натрия → гидроксид натрия 2) алюминий → оксид алюминия → гидроксид алюминия
3) кальций → оксид кальция → гидроксид кальция 4) азот → оксид азота (5) → азотная кислота
А8. У атомов химических элементов, расположенных в ряду: Р – S – Сl, увеличивается
1) радиус 2) окислительная способность
А9. В разбавленной серной кислоте растворяется
1) Сu 2) Zn 3)Аg 4)Аu
А10. Оксид серы (6) взаимодействует с каждым из двух веществ:
1) вода и кислород 2) оксид магния и азотная кислота
3) оксид кальция и гидроксид натрия 4) вода и водород
А11. Концентрированная азотная кислота при обычных условиях на взаимодействует с
1) магнием 2) гидроксидом натрия 3) железом 4) оксидом магния
А12.
1) CaCO3 2) К2SO3 3) Nа2SO4 4) Аl2(SO4)3
А13. В схеме превращений FeСl3 → Х1 → Х2 →Fe(ОН)3 веществами «Х1» и «Х2» могут быть, соответственно,
1) Fe2(SO4)3 и Fe2O3 2) FeРO4 и Fe3O4
3)
Fe(NO
А14. Транс –бутен- 2 и цис- бутен-2 являются
1) гомологами 2) структурными изомерами
3) геометрическими изомерами 4) одним и тем же веществом
А15. В результате реакции пропена с водой
образуется
В результате реакции пропена с водой
образуется
1) пропаналь 2) пропанол-1 3) пропанол-2 4) ацетон
А16. Гидроксильная группа имеется в молекулах
1) спиртов и карбоновых кислот 2) альдегидов и простых эфиров
3) аминокислот и сложных эфиров 4) жиров и спиртов
А17. Кислотные свойства наиболее выражены у
1) фенола 2) метанола 3) этанола 4) глицерина
А18. В схеме превращений этанол → Х → бутан веществом «Х» является
1) бутанол-1 2) бромэтан 3) этан 4) этилен
А19. К необратимым реакциям относится взаимодействие между
1)
N2 и
Н2 2)
SO2 и O
А20. В перечне веществ: А) СH4 Б) H2S В) СH3COOH Г) NH3 Д) H5IO6 Е) K2HPO4
кислотами являются 1) АБВ 2) БBД 3) БГД 4) ВДЕ
А21. Электроны атома фосфора, находящегося
в основном состоянии, расположены на
орбиталях так:
Электроны атома фосфора, находящегося
в основном состоянии, расположены на
орбиталях так:
1) 5s25p5 2) 3s23p5
А22. Какие из утверждений о диссоциации оснований в водных растворах верны?
А. Основания в воде диссоциируют на катионы металла (или подобный им катион NН4+) и гидроксид анионы ОН—.
Б. Никаких других анионов, кроме ОН—, основания не образуют.
Готовимся к ЕГЭ по химии с 8 класса | Тест по химии по теме:
Опубликовано 08.10.2012 — 0:36 — Сизова Татьяна Васильевна
Готовимся к ЕГЭ по химии с 8 класса. Тесты с ответами.
Скачать:
Предварительный просмотр:
Тест по теме
«Строение атома.
Структура периодической системы химических элементов Д. И. Менделеева»
И. Менделеева»
1. Изотопы одного и того же элемента отличаются друг от друга
числом нейтронов 2) числом электронов 3) числом протонов 4) зарядом ядра
2. Ядра атомов изотопов различаются числом
протонов 2) нейтронов 3) протонов и нейтронов 4) протонов и электронов
3. Одинаковое число протонов и нейтронов содержится в атоме
1) железа-56 2) иода-127 3) кобальта-59 4) углерода-12
4. Наибольший радиус имеет атом 1) брома 2) мышьяка 3) бария 4) олова
5.Число энергетических уровней и число внешних электронов атома хлора равны соответственно
1) 4, 6 2) 2, 5 3) 3, 7 4) 4, 5
6.В порядке возрастания атомного радиуса химические элементы расположены в ряду
Be, В, С, N 2) Rb, К, Na, Li 3) О, S, Se, Те 4) Mg, Al, Si, P
7.Из приведенных химических элементов самый большой радиус атома имеет
1) Bi 2) N 3) As 4) Р
8. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
Na, Mg, Al, Si 2) Li, Be, В, С 3) P, S, CI, Ar 4) F, O, N, С
9.В ряду Mg —> Са —> Sr —> Ва способность металлов отдавать электроны
ослабевает 2) возрастает 3) не изменяется 4) изменяется периодически
10. Легче всего присоединяет электроны атом 1) серы 2) хлора 3) селена 4) брома
11. В ряду Li —> Na —> К —> Rb способность металлов отдавать электроны
Возрастает 2) ослабевает 3) не изменяется 4) изменяется периодически
12. Наибольший радиус имеет атом 1)олова 2) кремния 3) свинца 4) углерода
13.Распределению электронов по энергетическим уровням в атоме элемента соответствует ряд чисел: 2, 8, 6. В Периодической системе этот элемент расположен в группе
1) VA 2) VIA 3) VB 4) VIB
14. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
Mg, Са, Ва 2) Na, Mg, Al 3) К, Са, Fe 4) Sc, Са, Mg
15. Неметаллические свойства элементов усиливаются в ряду:
Неметаллические свойства элементов усиливаются в ряду:
CI—S—Р—Si 2) N—Р—As—Se 3) В—С—N—О 4) С—Si—P—N
16. Установите соответствие:
элемент | число занятых электронами энергетических уровней в атоме |
А) кремний | 1) один |
Б) кислород | 2) четыре |
В) гелий | 3) три |
Г)калий | 4)два |
17. Установите соответствие:
элемент | число протонов в ядре атома |
А) фосфор | 1) 19 |
Б) бор | 2) 10 |
В) неон | 3) 15 |
Г)калий | 4) 5 |
18. Установите соответствие:
Установите соответствие:
элемент | Электронная схема атома |
А) бериллий | 1) 2 ē 8 ē |
Б) магний | 2) 2ē 8ē 7 ē |
В) неон | 3) 2 ē 2 ē |
Г)хлор | 4) 2 ē 8ē 2 ē |
18. Установите соответствие:
элемент | Электронная схема атома |
А) фтор | 1) 2 ē 8 ē 3 ē |
Б)алюминий | 2) 2ē 8ē 8ē |
В) аргон | 3) 2 ē 8 ē 8 ē 1 ē |
Г)калий | 4) 2 ē 7ē |
Бланк ответов
1 | |
2 | |
4 | |
3 | |
3 | |
3 | |
1 | |
4 | |
2 | |
2 | |
1 | |
3 | |
2 | |
1 | |
3 |
На установление соответствия
А | Б | В | Г | |
16 | 3 | 4 | 1 | 2 |
17 | 3 | 4 | 2 | 1 |
18 | 3 | 2 | 1 | 4 |
19 | 4 | 1 | 2 | 3 |
Предварительный просмотр:
Степень окисления
1. Степень окисления +3 атомы неметаллов проявляют в каждом из двух веществ, формулы которых:
Степень окисления +3 атомы неметаллов проявляют в каждом из двух веществ, формулы которых:
1) N203 и Р205; 2)А1203 и Р203; 3) В203 и Вг203; 4) Fe203 и N203.
2. Формулы соединений, в которых атомы проявляют степени окисления соответственно +1 и -2, записаны в ряду:
1) НС1, Na2S, 02, SO; 2)Nh4, NO, KF, OF2; 3) Н20, С120, N20, Li2S; 4) h3, HBr, CO, N02.
3. Формулы соединений, в которых атомы проявляют степени окисления соответственно +3 и -2, записаны в ряду:
1) Р205, Сг203, C1205, N02; 2)N203, A12S3, P2S3, Р2Оэ; 3) А1203, NO, N2, CS2; 4) HN02, CaS, C1205, C02.
4 В какой молекуле степ. окисления элемента равна нулю, а валентность равна единице? 1) 02 2) СаС2 3) С12 4) СО
5. Степень окисления азота в атоме Nh4 равна 1) -1 2) -3 3) +3 4) +5
6. Степень окисления, равную +4, атом серы имеет в соединении 1)h3S04 2) FeS2 3) h3S03 4) NaHS04
7. Наименьшей электроотрицательностью обладает элемент 1) Be 2) В 3) С 4) N
Наименьшей электроотрицательностью обладает элемент 1) Be 2) В 3) С 4) N
8. Наибольшей электроотрицательностью среди элементов IVA группы обладает
1) кремний 2) германий 3) олово 4) углерод
9. Наибольшую степень окисления азот проявляет в соединении 1) Nh4 2) N2 3) N02 4) N205
10. Наибольшую степень окисления марганец проявляет в соединении 1) MnS04 2) Mn02 3) К2Мп04 4) Мп203
11. Промежуточную степень окисления атом азота проявляет в каждом из двух веществ, формулы которых
1) N2 и HNO3, 2) NO и NO2, 3) Nh4 и NO2, 4) N2O5 и N2О3
12. Максимальную степень окисления атом азота проявляет в каждом из двух веществ, формулы которых
1) N2 и NO2, 2) N2O5 и HNO3, 3) N2О3 и NO, 4) NO2 и Nh4
13. Минимальную степень окисления атом серы проявляет в каждом из двух веществ, формулы которых
1) S8 и SO; 2) SO2 и Н2SO4; 3) Н2S и Na2S; 4) Н2SO4 и S8 .
14. Установите соответствие:
Химическая формула | Степень окисления атомов азота |
А) Mg3 N2 | 1) +5 |
Б) N2О3 | 2) +4 |
В) HNO3 | 3) -3 |
Г) NO2 | 4) +3 |
15. Установите соответствие:
Химическая формула | Степень окисления атомов марганца |
А) MnO | 1) +7 |
Б) MnO2 | 2) +6 |
В) Mn2O7 | 3) +2 |
Г) MnO3 | 4) +4 |
16. Для элементов второго периода установите соответствие:
Символ элемента | Минимальная степень окисления атомов |
А) С | 1) -1 |
Б) N | 2) -2 |
В) O | 3) -4 |
Г) F | 4) -3 |
17. Для элементов третьего периода установите соответствие:
Для элементов третьего периода установите соответствие:
Символ элемента | Максимальная степень окисления атомов |
А) Na | 1) +4 |
Б) Mg | 2) +1 |
В) Al | 3) +2 |
Г) Si | 4) +3 |
Бланк ответов
3 | |
3 | |
2 | |
3 | |
2 | |
3 | |
1 | |
4 | |
4 | |
3 | |
2 | |
2 | |
3 |
На установление соответствия
А | Б | В | Г | |
14. | 3 | 4 | 1 | 2 |
15. | 3 | 4 | 1 | 2 |
16. | 3 | 4 | 2 | 1 |
17. | 2 | 3 | 4 | 1 |
Предварительный просмотр:
Тест
«Виды химических связей»
1. Соединением с ковалентной неполярной связью является
1) НС1 2) 02 3) СаС12 4) Н20
2. Путем соединения атомов одного и того же химического элемента образуется связь
ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
3. В аммиаке Nh4 и хлориде бария ВаС12 химическая связь соответственно
ионная и ковалентная полярная
ковалентная полярная и ионная
ковалентная неполярная и металлическая
ковалентная неполярная и ионная
4.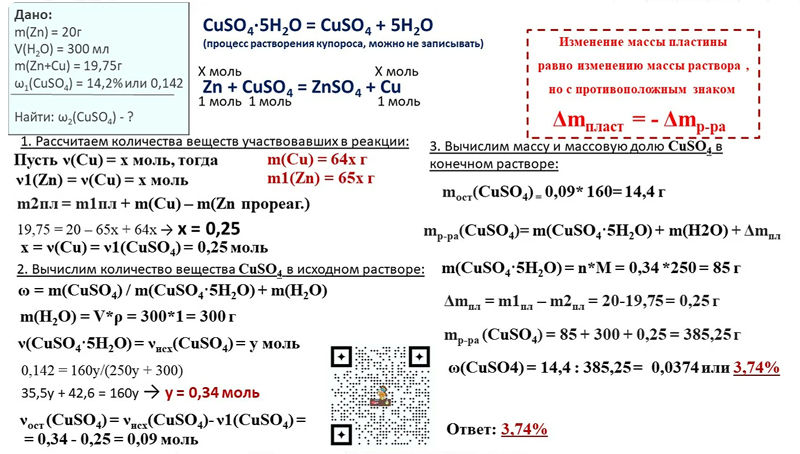 Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
вода Н20 и сероводород Н2S 3) аммиак Nh4 и водород h3
бромид калия KBr и азот N2 4) кислород 02 и метан Ch5
5. Атомы химических элементов второго периода Периодической системы Д.И. Менделеева образуют соединения с ионной химической связью состава 1) BaS 2) С02 3) А1203 4) LiF
6. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
Cl2, Nh4, HCl 2) HBr, NO, Br2 3) h3S, Н20, S8 4) HI, h30, Ph4
7. В каком ряду все вещества имеют ионную связь?
LiF, NaCl, СаО, 2) 02, Н20, С02 3) Н20, Nh4, Ch5 4) NaBr, HBr, СО
8. В молекуле фтора химическая связь
ковалентная полярная 2) ковалентная неполярная 3) ионная 4) водородная
9. Химическая связь в молекуле фтороводорода
ковалентная полярная 2) ковалентная неполярная 3) ионная 4) водородная
10. В иодиде калия химическая связь
В иодиде калия химическая связь
ковалентная неполярная 2) ковалентная полярная 3) металлическая 4) ионная
11. Между атомами элементов с порядковыми номерами 11 и 17 возникает связь
1) металлическая 2) ионная 3) ковалентная 4) водородная
12. Общие электронные пары не смещены к атому кислорода в молекуле, формула которой:
1) С120; 2)Н20; 3)NO; 4) OF2.
13. Полярность ковалентной связи в ряду молекул HF – Н20 – Nh4 – Ch5
1) возрастает, 2) убывает, 3) не изменяется, 4) сначала возрастает, потом убывает
14. Ионную кристаллическую решетку имеет каждое из двух веществ, названия и формулы которых:
1) хлорид калия КС1 и оксид натрия Na20; 3) водород Н2 и сульфид калия K2S;
2) вода Н20 и оксид кальция СаО; 4) поваренная соль NaCl и азот N2.
15. Молекулярную кристаллическую решетку в твердом состоянии имеет каждое из двух веществ, названия и формулы которых:
1) аммиак Nh4 и поваренная соль NaCl; 3) хлороводород НС1 и углекислый газ С02;
2) негашеная известь СаО и кислород 02; 4) угарный газ СО и хлорид кальция СаС12.
16. Установите соответствие:
название и формула вещества | вид химической связи |
А) угарный газ СО | 1) ковалентная неполярная |
Б) хлорид калия КС1 | 2) ковалентная полярная |
В) кислород 02 | 3) ионная |
Г)сероводород h3S |
17. Установите соответствие:
название и формула вещества | вид химической связи |
А) фторид лития LiF | 1) ионная |
Б) хлор Сl2 | 2) ковалентная полярная |
В) сероуглерод С S2 | 3) ковалентная неполярная |
Г) хлорид кальция СаС12. |
18. Установите соответствие:
название и формула вещества | вид химической связи |
А) азот N2 | 1) ковалентная полярная |
Б) хлорид натрия NaС1 | 2) ковалентная неполярная |
В) хлороводород H С1 | 3) ионная |
Г) углекислый газ СО2 |
Бланк ответов
2 | |
3 | |
2 | |
3 | |
4 | |
4 | |
1 | |
2 | |
1 | |
4 | |
2 | |
4 | |
2 | |
1 | |
3 |
На установление соответствия
А | Б | В | Г | |
16 | 2 | 3 | 1 | 2 |
17 | 1 | 3 | 2 | 1 |
18 | 1 | 3 | 2 | 2 |
По теме: методические разработки, презентации и конспекты
Готовимся к ЕГЭ по химии — решаем задачи В9
Данные задания помогут при подготовке к ЕГЭ по химии. ..
..
Готовимся к ЕГЭ по химии — решаем задачи на нахождение молекулярной формулы вещества
Решаем задачи на нахождение молекулярной формулы вещества — С5…
Готовимся к ЕГЭ по химии — решаем задачи на нахождение массы, объема и количества вещества
задачи на нахождение массы, объема и количества вещества…
Готовимся к ЕГЭ по химии — окислительно — восстановительные реакции
Окислительно — восстановительные реакции — задания С1…
Готовимся к ЕГЭ по химии — задачи на избыток — недостаток
Подборка задач на избыток — недостаток…
готовимся к егэ по химии (органическая химия)
Каждый ученик мечтает сдать экзамен хорошо, но есть такие учащиеся, которые уверены в своих знаниях. Данный материал поможет ученикам обратить внимание на вопросы, встречающиеся в экзаменационной рабо…
готовимся к егэ по химии (органическая химия)
Каждый ученик мечтает сдать экзамен хорошо, но есть такие учащиеся, которые уверены в своих знаниях.
Поделиться:
Химическое соединение | Определение, примеры и типы
молекула метана
Посмотреть все СМИ
- Ключевые люди:
- Антуан Лавуазье Луи Бернар Гайтон де Морво Карл Вильгельм Шееле Мартин Генрих Клапрот Николя-Луи Воклен
- Похожие темы:
- химическая связь химический анализ координационное соединение металлоорганическое соединение химическая реакция
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
Вся материя во Вселенной состоит из атомов более 100 различных химических элементов, которые встречаются как в чистом виде, так и в виде химических соединений. Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы, составляющие углерод, отличаются от атомов, составляющих железо, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно. Символом железа является Fe, от его первоначального латинского названия 9.0029 железо
Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы, составляющие углерод, отличаются от атомов, составляющих железо, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно. Символом железа является Fe, от его первоначального латинского названия 9.0029 железо

Исследуйте магнитоподобную ионную связь, образующуюся при переносе электронов от одного атома к другому
Просмотреть все видео к этой статьеПосмотрите, как работают молекулярные связи, когда два атома водорода соединяются с атомом серы, образуя сероводород
Просмотреть все видео к этой статье Вода , представляющий собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются, образуя тысячи слов, атомы элементов могут соединяться различными способами, образуя множество соединений. . На самом деле известны миллионы химических соединений, и возможно еще много миллионов, но еще не открытых и не синтезированных. Большинство встречающихся в природе веществ, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества можно разделить на составляющие их соединения физическими методами, то есть методами, которые не изменяют способ агрегации атомов внутри соединений. Соединения можно разложить на составляющие их элементы путем химических превращений. Химическое изменение (то есть химическая реакция) — это изменение организации атомов. Примером химической реакции является горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды.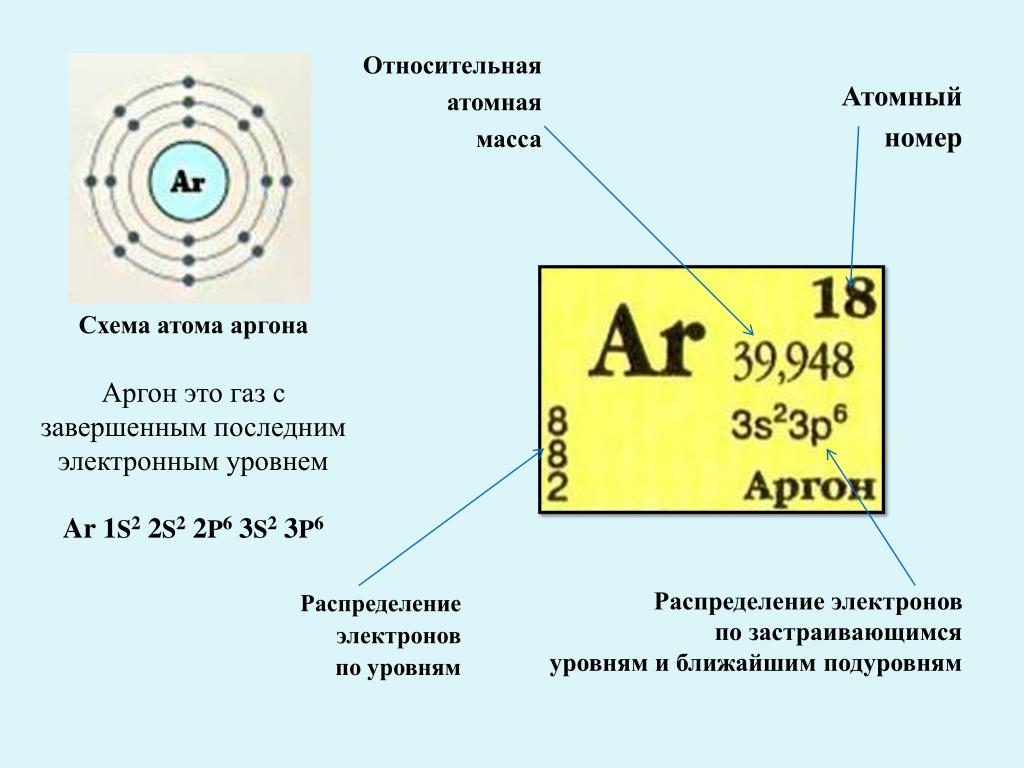 CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
Britannica Quiz
Типы химических реакций
Химические соединения демонстрируют ошеломляющий набор характеристик. При обычных температурах и давлениях некоторые из них являются твердыми, некоторые — жидкими, а некоторые — газообразными. Цвета различных соединений охватывают цвета радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества. Для того чтобы из этого большого разнообразия можно было извлечь некоторый смысл, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также классифицируются как органические или неорганические. Органические соединения ( см. ниже Органические соединения), названные так потому, что многие из них были первоначально выделены из живых организмов, обычно содержат цепочки или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений. Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. ниже Неорганические соединения).
Органические соединения ( см. ниже Органические соединения), названные так потому, что многие из них были первоначально выделены из живых организмов, обычно содержат цепочки или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений. Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. ниже Неорганические соединения).
В широких классификациях органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат O 2- ионов или атомов кислорода, гидриды содержат ионы H — или атомы водорода, сульфиды содержат ионы S 2- и так далее. К подклассам органических соединений относятся спирты (содержащие группу «ОН»), карбоновые кислоты (содержащие группу «СООН»), амины (содержащие группу «NH 2 ») и т. д.
д.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Различные способности различных атомов объединяться в соединения можно лучше всего понять с точки зрения периодической таблицы. Периодическая таблица была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития науки химии было замечено, что элементы можно группировать в соответствии с их химической реакционной способностью. Элементы со схожими свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. По мере раскрытия деталей строения атома стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента (9).0029 см. атом). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его самой внешней оболочке. Такие электроны называются валентными электронами.
Такие электроны называются валентными электронами.
Например, атомы элементов 1-й группы периодической таблицы имеют один валентный электрон, атомы элементов 2-й группы имеют два валентных электрона и так далее до 18-й группы, элементы которой содержат восемь валентных электронов. , достигается. Самое простое и наиболее важное правило для предсказания того, как атомы образуют соединения, состоит в том, что атомы склонны объединяться таким образом, что позволяют им либо опустошить свою валентную оболочку, либо заполнить ее (то есть заполнить ее), в большинстве случаев имея в общей сложности восемь электронов. . Элементы в левой части периодической таблицы имеют тенденцию терять свои валентные электроны в химических реакциях. Например, натрий (в группе 1) имеет тенденцию терять свой единственный валентный электрон, образуя ион с зарядом +1. Каждый атом натрия имеет 11 электронов ( e − ), каждый из которых имеет заряд -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e — . Калий, расположенный непосредственно под натрием в группе 1, также образует в своих реакциях ионы +1 (K + ), как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы, как правило, вступают в реакции, в результате которых они получают (или делят) достаточное количество электронов, чтобы завершить свою валентную оболочку. Например, кислород в 16-й группе имеет шесть валентных электронов и, следовательно, нуждается в еще двух электронах, чтобы завершить свою внешнюю оболочку. Кислород достигает такого расположения, реагируя с элементами, которые могут терять или делиться электронами. Атом кислорода, например, может реагировать с атомом магния (Mg) (в группе 2), принимая два валентных электрона магния, образуя Mg 9ионы 0043 2+ и О 2– .
Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e — . Калий, расположенный непосредственно под натрием в группе 1, также образует в своих реакциях ионы +1 (K + ), как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы, как правило, вступают в реакции, в результате которых они получают (или делят) достаточное количество электронов, чтобы завершить свою валентную оболочку. Например, кислород в 16-й группе имеет шесть валентных электронов и, следовательно, нуждается в еще двух электронах, чтобы завершить свою внешнюю оболочку. Кислород достигает такого расположения, реагируя с элементами, которые могут терять или делиться электронами. Атом кислорода, например, может реагировать с атомом магния (Mg) (в группе 2), принимая два валентных электрона магния, образуя Mg 9ионы 0043 2+ и О 2– . (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2– .) Образующиеся Mg 2+ и O 2- затем объединяют в соотношении 1:1, чтобы получить ионное соединение MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, он не имеет суммарного заряда, поскольку содержит равные количества Mg 2+ и O 2– ионов.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксида кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы данной группы имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
(Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2– .) Образующиеся Mg 2+ и O 2- затем объединяют в соотношении 1:1, чтобы получить ионное соединение MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, он не имеет суммарного заряда, поскольку содержит равные количества Mg 2+ и O 2– ионов.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксида кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы данной группы имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное деление элементов на металлы, составляющие большинство элементов, и неметаллы. Типичными физическими свойствами металлов являются блестящий внешний вид, ковкость (способность превращаться в тонкий лист), пластичность (способность вытягиваться в проволоку) и эффективная тепло- и электропроводность. Важнейшим химическим свойством металлов является склонность отдавать электроны с образованием положительных ионов. Медь (Cu), например, является типичным металлом. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко формуются изделия различной формы, такие как трубы для водопроводных систем. Медь содержится во многих ионных соединениях в виде Cu + или ион Cu 2+ .
Типичными физическими свойствами металлов являются блестящий внешний вид, ковкость (способность превращаться в тонкий лист), пластичность (способность вытягиваться в проволоку) и эффективная тепло- и электропроводность. Важнейшим химическим свойством металлов является склонность отдавать электроны с образованием положительных ионов. Медь (Cu), например, является типичным металлом. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко формуются изделия различной формы, такие как трубы для водопроводных систем. Медь содержится во многих ионных соединениях в виде Cu + или ион Cu 2+ .
Металлические элементы находятся слева и в центре таблицы Менделеева. Металлы групп 1 и 2 называются репрезентативными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Неметаллы, которых относительно немного, находятся в верхнем правом углу периодической таблицы, за исключением водорода, единственного неметаллического члена группы 1. Физические свойства, характерные для металлов, у неметаллов отсутствуют. В химических реакциях с металлами неметаллы приобретают электроны, образуя отрицательные ионы. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор — типичный неметалл. При обычных температурах элементарный хлор содержит Cl 2 и реагирует с другими неметаллами с образованием таких молекул, как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl —.
Разделение элементов на металлы и неметаллы является приблизительным. Несколько элементов вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
Великолепный элемент Селен | Периодическая таблица
Элемент Селен
Селен — интересный элемент периодической таблицы с широким спектром применения. Например, это жизненно важный микроэлемент, отличный фотопроводник и отличный катализатор химических реакций. Узнайте больше об этом уникальном неметалле ниже!
Например, это жизненно важный микроэлемент, отличный фотопроводник и отличный катализатор химических реакций. Узнайте больше об этом уникальном неметалле ниже!
Интересные факты о селене
- Селен назван в честь греческой богини луны Селены.
- Соли селена часто используются для борьбы с отравлением ртутью и перхотью.
- Элемент часто производится как побочный продукт рафинирования меди.
- Он имеет множество различных аллотропов, и они взаимопревращаются в зависимости от температуры.
- Этот элемент также является важным микроэлементом для животных, но в больших дозах токсичен.
Селен в периодической таблице
Селен, символ Se, находится в шестнадцатой группе периодической таблицы справа от мышьяка и слева от брома. Как халькоген, он имеет сходные свойства с теллуром под ним и серой над ним. Атом селена имеет электронную конфигурацию [Ar] 3d10 4s2 4p4
Имеет пять аллотропных форм, которые можно разделить на три типа: красный Se, серый Se и черный Se. Традиционно селен классифицируется как неметалл, но некоторые из его аллотропов обладают металлоидными характеристиками.
Традиционно селен классифицируется как неметалл, но некоторые из его аллотропов обладают металлоидными характеристиками.
Уникальные свойства селена
Благодаря своим полупроводниковым свойствам он уже почти столетие используется для выпрямления электрических цепей. Кроме того, он является фотопроводящим и фотогальваническим, что означает, что присутствие света увеличивает производство/проводимость электричества. По этой причине он часто используется в электронике, такой как фотоэлементы и солнечные батареи.
Аллотропы селена
Селен имеет три основные аллотропные формы: красный Se, серый Se и черный Se. Нормальным состоянием элемента является красный Se, и он выглядит как красное аморфное порошкообразное вещество. При быстром нагревании становится черным Se. Этот стекловидный аллотроп физически хрупкий и блестящий. С другой стороны, когда красный Se медленно нагревается, он образует серый Se. Более того, красная и черная аллотропные формы — отличные изоляторы, тогда как серый Se — отличный полупроводник. Серый Se также является наиболее стабильной формой, тогда как красный Se является наиболее реакционноспособным.
Серый Se также является наиболее стабильной формой, тогда как красный Se является наиболее реакционноспособным.
Селен в реальной жизни
Для чего используется селен?
Окрашивание стекла селеном
Примерно в 1910 году использование селена для изготовления стеклянной посуды стало более распространенным. На данный момент это самое крупное коммерческое использование элемента и составляет около 50% его потребления. В небольших концентрациях селен дает розовый цвет, который используется для обесцвечивания стекла, компенсируя зелено-желтый оттенок, который часто создается примесями железа. Обычно для этого используют селенит и селенатные соли. С другой стороны, большие концентрации могут создать приятный красный оттенок на стекле. Соединение, используемое для этого, часто представляет собой селенид кадмия.
Рак против селена
Хотя технически исследование еще не завершено, ведутся давние дебаты о том, есть ли связь между потреблением селена и раком. Селен является важным микроэлементом, и слишком большое или слишком малое воздействие этого минерала может нанести ущерб благополучию человека. В 1960-х годах были проведены различные обсервационные исследования, которые пришли к выводу об обратной зависимости, согласно которой повышенное потребление селена приводило к снижению риска рака крови.
Селен является важным микроэлементом, и слишком большое или слишком малое воздействие этого минерала может нанести ущерб благополучию человека. В 1960-х годах были проведены различные обсервационные исследования, которые пришли к выводу об обратной зависимости, согласно которой повышенное потребление селена приводило к снижению риска рака крови.
Однако более поздние исследования опровергли эту идею. Вместо этого теперь они предполагают, что высокое потребление может увеличить риск некоторых видов рака, таких как рак толстой кишки. В конце концов, исследования взаимосвязи между раком и селеном все еще неубедительны.
Добыча селена. Где находится селен?
Селеновые руды не встречаются, но минералы встречаются в следовых количествах, обычно там, где встречаются сульфиды, или в месторождениях меди, известных как медно-порфировые месторождения. Большая часть селена производится в Германии, Японии, США и Китае.
Добыча угля может привести к биоаккумуляции селена, который может представлять опасность для окружающей среды. Существуют приложения, которые могут обнаруживать селен на уровне всего 2 ppt в твердых и жидких веществах.
Существуют приложения, которые могут обнаруживать селен на уровне всего 2 ppt в твердых и жидких веществах.
История селена
Селен был открыт в 1817 году Йонсом Якобом Берцелиусом. Все началось с того, что на заводе по производству серной кислоты, которым он частично владел, внезапно вспыхнула болезнь среди рабочих. В конечном итоге было обнаружено, что химический раствор загрязнило определенное вещество. Берцелиус предположил, что загрязнение произошло из-за примесей во вновь импортированных рудах. Вещество имело свойства, сходные с теллуром и серой, но в конечном итоге было определено как новый элемент. Друг Берзеллиуса Мартин К. открыл элемент теллур и назвал его в честь богини земли. Чтобы соответствовать этому, Берцелиус назвал этот новый элемент селеном в честь греческой богини луны Селены.
Хотя официально селен не был открыт до 19 века, считается, что он был известен заранее. Например, Арнольд из Виллановы, средневековый испанский алхимик, однажды упомянул в своих трудах таинственное вещество и назвал его «красной серой». Считается, что это был селен, потому что его наиболее распространенный аллотроп представляет собой аморфное красное вещество, обладающее свойствами, подобными сере. Более того, американский биохимик Тресса Штадтман проложила путь исследованиям селена, определив различные биологические значения элементов.
Считается, что это был селен, потому что его наиболее распространенный аллотроп представляет собой аморфное красное вещество, обладающее свойствами, подобными сере. Более того, американский биохимик Тресса Штадтман проложила путь исследованиям селена, определив различные биологические значения элементов.
Селен – соединения, реакции, синтез и степени окисления
Селен в реакциях
Поскольку это довольно реакционноспособный элемент, селен часто используется в качестве катализатора в химических реакциях. Он легче всего сочетает водород и галогены, такие как фтор, хлор и бром. Кроме того, он реагирует с азотной и серной кислотами. Он также будет реагировать со многими различными металлами с образованием соединений, называемых селенидами.
Соединения селена
При образовании соединений селен склонен образовывать кислоты в более высоких степенях окисления. Общие степени окисления соединений селена -2, +4 и +6. Эти соединения часто токсичны в больших количествах.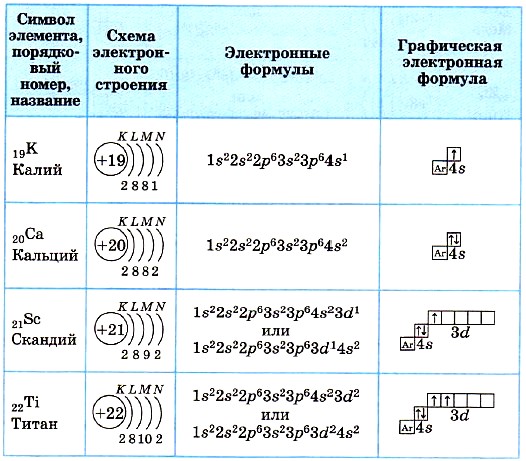 Кроме того, селен может реагировать с большинством металлов с образованием селенидов. Примером этого является селенид алюминия, который является предшественником селенида водорода. Он также любит объединяться с кислородом, образуя диоксид селена. Когда это соединение реагирует с водой, оно образует селенистую кислоту H 2 SeO 3 . Многие соединения селена содержат кислород и присоединенный галоген. Селен также образует катионы, называемые ионом селената, SeO 4 -2 , и ионом селенита, SeO 3 -2 , которые аналогичны иону сульфата и сульфита. Соединения селенита могут быть ярко окрашены, и оба могут быть очень токсичными.
Кроме того, селен может реагировать с большинством металлов с образованием селенидов. Примером этого является селенид алюминия, который является предшественником селенида водорода. Он также любит объединяться с кислородом, образуя диоксид селена. Когда это соединение реагирует с водой, оно образует селенистую кислоту H 2 SeO 3 . Многие соединения селена содержат кислород и присоединенный галоген. Селен также образует катионы, называемые ионом селената, SeO 4 -2 , и ионом селенита, SeO 3 -2 , которые аналогичны иону сульфата и сульфита. Соединения селенита могут быть ярко окрашены, и оба могут быть очень токсичными.
Выделение селена
Хотя селен встречается редко, он существует в природе в виде минералов селенида, селената и селенита. Этот элемент также можно найти в аминокислотах, таких как селенометионин, селеноцистеин и метилселеноцистеин. Однако чаще всего селен получают из селенида в сульфидных рудах, таких как медь и никель. Фактически, он часто производится как побочный продукт рафинирования меди. Здесь диоксид селена образуется при окислении карбоната натрия. Когда это соединение соединяется с водой, оно подкисляется до селенистой кислоты. С помощью диоксида серы в качестве восстановителя образуется элементарный селен.
Фактически, он часто производится как побочный продукт рафинирования меди. Здесь диоксид селена образуется при окислении карбоната натрия. Когда это соединение соединяется с водой, оно подкисляется до селенистой кислоты. С помощью диоксида серы в качестве восстановителя образуется элементарный селен.
Степени окисления селена
Степени окисления для этого элемента: Se -2 , Se +6 , Se +4 .
Физические свойства селена
- Точка плавления атомного символа: 221 ° C
- Точка кипячения: 685 ° C
- . : 2.4
- Классификация: Металлоид, металл группы 16, халькоген
- Содержание в земной коре: 0,05 ppm
- Конфигурация электронной оболочки: [Ar] 3d 10 4s 2 4p 4
- Изотопы: всего 9, 4 радиоактивны
- Токсичность: Токсичность селена возникает при чрезмерном приеме внутрь.
Где я могу купить Элемент Селен?
Вы можете купить селен практически везде в виде добавок.


Leave A Comment