Легче всего присоединить электроны атомов? 1) серы 2) хлора 3)селена4)брома
Объяснение:
1) 2) 3)
Ca₃(PO₄)₂ → P → P₂O₅ → H₃PO₄
1) 2Ca₂(PO₄)₂ + 10C + 6SiO₂ → 4P + 10CO + 6CaSiO₃
2) 4P + 5O₂ → 2P₂O₅
3) P₂O₅ + 3H₂O → 2H₃PO₄
M(по h3)=43*2=86 г/моль
n(C)=0.8372*86/12=6 моль
w%(H)=100-83.72=16.28%
n(H)=0.1628*86/1=14 моль
C6h24
При температуре выше 900°С разлагается:
СаСО3 = СаО + СО2↑
При взаимодействии с кислотами, вытесняется слабая угольная кислота, которая разлагается на воду и диоксид углерода:
CaCO3 + 2HCl = CaCl2 + h3O + CO2↑
CaCO3 + 2Ch4COOH = Ch4-C-O-Ca-O-C-Ch4 + CO2↑ + h3O
|| ||
O O
При взаимодействии с угольной кислотой или диоксидом углерода образуется кислая соль — гидрокарбонат кальция:
СаСO3 + h3CO3 = Ca(HCO3)2
CaCO3 + CO2 + h3O = Ca(HCO3)2
СaCO3 + 2Nh4 = CaCN2 + 3h3O
Общая формула вещества С4Н3+3 соответствует: г- арены
Ответ: Ca+2h3O=Ca(OH)2+h3
Сума коефициентов-14
Объяснение:
Легче всего присоединяет электроны атом 1) серы 2) хлора 3) селена 4) брома
У атомов As и Sb одинаковы: 1)радиусы атомов 2)степень неМе3)число электронов на вэу 4) заряды ядер
Изменение свойств ХЭ по положению в ПС для А2.
1.В ряду элементов 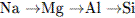 : 1) усиливаются неметаллические свойства2) уменьшается число электронов во внешнем электронном слое 3) увеличивается число электронных слоев 4) возрастают радиусы
: 1) усиливаются неметаллические свойства2) уменьшается число электронов во внешнем электронном слое 3) увеличивается число электронных слоев 4) возрастают радиусы
Среди перечисленных элементов наименьший радиус атома имеет:1) Li 2) Be 3) B 4) Al
Наименьший радиус имеет атом:1) Be 2) F 3) C 4) O
4.В порядке возрастания неметаллических свойств элементы расположены в ряду:
1.  2.
2. 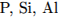 3.
3. 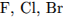

НеМе свойства наиболее выражены у: 1)кремния 2) кислорода 3)бора 4) серы
Среди перечисленных ХЭ наибольший радиус атома имеет1) H 2) Li 3) Na 4) Mg
7. В ряду химических элементов C → Si → Ge → Sn 1) увеличивается число электронных слоёв 2) увеличивается способность отнимать электроны 3) увеличиваются неметаллические свойства 4) уменьшается число протонов в ядре атома
8.В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?1. 
 3.
3. 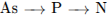 4.
4. 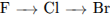
9. В ряду химических элементов: 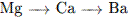 1) уменьшается число энергетических уровней в атомах 2) возрастает число внешних электронов 3) уменьшается число протонов в ядрах 4) увеличиваются радиусы
1) уменьшается число энергетических уровней в атомах 2) возрастает число внешних электронов 3) уменьшается число протонов в ядрах 4) увеличиваются радиусы
Тест по химии по теме: Готовимся к ЕГЭ по химии с 8 класса
Тест
«Виды химических связей»
1. Соединением с ковалентной неполярной связью является
1) НС1 2) 02 3) СаС12 4) Н20
2. Путем соединения атомов одного и того же химического элемента образуется связь
ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
3. В аммиаке Nh4 и хлориде бария ВаС12 химическая связь соответственно
ионная и ковалентная полярная
ковалентная полярная и ионная
ковалентная неполярная и металлическая
ковалентная неполярная и ионная
4. Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
вода Н20 и сероводород Н2S 3) аммиак Nh4 и водород h3
бромид калия KBr и азот N2 4) кислород 02 и метан Ch5
5. Атомы химических элементов второго периода Периодической системы Д.И. Менделеева образуют соединения с ионной химической связью состава 1) BaS 2) С02 3) А1203 4) LiF
6. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
Cl2, Nh4, HCl 2) HBr, NO, Br2 3) h3S, Н20, S8 4) HI, h30, Ph4
7. В каком ряду все вещества имеют ионную связь?
LiF, NaCl, СаО, 2) 02, Н20, С02 3) Н20, Nh4, Ch5 4) NaBr, HBr, СО
8. В молекуле фтора химическая связь
ковалентная полярная 2) ковалентная неполярная 3) ионная 4) водородная
9. Химическая связь в молекуле фтороводорода
ковалентная полярная 2) ковалентная неполярная 3) ионная 4) водородная
10. В иодиде калия химическая связь
ковалентная неполярная 2) ковалентная полярная 3) металлическая 4) ионная
11. Между атомами элементов с порядковыми номерами 11 и 17 возникает связь
1) металлическая 2) ионная 3) ковалентная 4) водородная
12. Общие электронные пары не смещены к атому кислорода в молекуле, формула которой:
1) С120; 2)Н20; 3)NO; 4) OF2.
13. Полярность ковалентной связи в ряду молекул HF – Н20 – Nh4 – Ch5
1) возрастает, 2) убывает, 3) не изменяется, 4) сначала возрастает, потом убывает
14. Ионную кристаллическую решетку имеет каждое из двух веществ, названия и формулы которых:
1) хлорид калия КС1 и оксид натрия Na20; 3) водород Н2 и сульфид калия K2S;
2) вода Н20 и оксид кальция СаО; 4) поваренная соль NaCl и азот N2.
15. Молекулярную кристаллическую решетку в твердом состоянии имеет каждое из двух веществ, названия и формулы которых:
1) аммиак Nh4 и поваренная соль NaCl; 3) хлороводород НС1 и углекислый газ С02;
2) негашеная известь СаО и кислород 02; 4) угарный газ СО и хлорид кальция СаС12.
16. Установите соответствие:
название и формула вещества | вид химической связи |
А) угарный газ СО | 1) ковалентная неполярная |
Б) хлорид калия КС1 | 2) ковалентная полярная |
В) кислород 02 | 3) ионная |
Г)сероводород h3S |
17. Установите соответствие:
название и формула вещества | вид химической связи |
А) фторид лития LiF | 1) ионная |
Б) хлор Сl2 | 2) ковалентная полярная |
В) сероуглерод С S2 | 3) ковалентная неполярная |
Г) хлорид кальция СаС12. |
18. Установите соответствие:
название и формула вещества | вид химической связи |
А) азот N2 | 1) ковалентная полярная |
Б) хлорид натрия NaС1 | 2) ковалентная неполярная |
В) хлороводород H С1 | 3) ионная |
Г) углекислый газ СО2 |
Бланк ответов
На установление соответствия
А | Б | В | Г | |
16 | 2 | 3 | 1 | 2 |
17 | 1 | 3 | 2 | 1 |
18 | 1 | 3 | 2 | 2 |
Срочно помогите пожалуйста! Тест по теме «Строение атома. Химическая связь» 2 ВАРИАНТ
1) кислорода 2) натрия 3) фтора 4) хлора
А2. Число нейтронов в ядре атома 39К равно:
1) 19 2) 20 3) 39 4) 58
А3. Химический элемент № 31 является:
1) s-элементом 2) p-элементом 3) d-элементом 4) f-элементом
А4. Число энергетических уровней и число внешних элек¬тронов атома хлора равны соответственно
1) 4,6 2) 2,5 3) 3,7 4) 4, 5
А5. Элемент, электронная конфигурация внешнего и предвнешнего уровня атома
которого 3s23p6 4s2 3d10, образует высший оксид:
а) K2O б) CaO в) ScO г) ZnO
А6. Химический элемент, формула высшего оксида которо¬го R2O7, имеет электронную
конфигурацию атома
2) ls22s22p63s23p5 4) ls22s22p6
А7. В ряду Mg —> Са —>Sr —> Ва способность металлов отда¬вать электроны
1) ослабевает3) не изменяется
2) возрастает 4) изменяется периодически
А8. В порядке возрастания неметаллических свойств эле¬менты расположены в ряд
1) В, С, О, F 3) С, Si, Ge, Sn
2) Li Na K Rb 4) Cl S P Si
А9. Химический элемент расположен в четвертом периоде, в IA группе. Распределению электронов в атоме этого элемен¬та соответствует ряд чисел
1) 2,8,8,2 3) 2,8,8,1
2) 2,8,18,1 4) 2,8,18,2
А10. Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
1) серы 2) селена 3)хлора 4)брома
А12. Соединением с ковалентной неполярной связью является
1)НС1 2)02 3)СаС12 4)Н20
А13. Водородная связь образуется между молекулами
1)С2Н6 2)С2Н5ОН 3)СН3ОСН3 4)СН3СОСН8
А14. В каком ряду все вещества имеют ковалентную поляр¬ную связь?
1) НС1, NaCl, С123) Н20, Nh4, Ch5
2) 02, Н20, С024) NaBr, HBr, CO
А15. Молекулярную кристаллическую решетку имеет:
1) HBr 2) Li2O 3) BaO 4)KCl
А16. Кристаллические решетки графита и железа соответственно:
1) ионная и молекулярная 3) металлическая и ионная
2) молекулярная и атомная 4) атомная и металлическая
В1. Установите соответствие между частицей и ее электрон¬ной конфигурацией.
Б) С1+5
В) С1°
Г) С1-1
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
1) l s22s22р63s23р5
2) l s22s22p63s23p6
3) ls22s22p6
4) l s22s22р63s2
Наиболее выражены неМе свойства у:1) фтора 2) кислорода 3) кремния 4) йода
11. В каком ряду химические элементы расположены в порядке возрастания неМе свойств1. 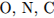 2.
2.  3.
3. 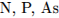 4.
4. 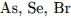
12.В ряду элементов  1) уменьшаются радиусы атомов 2) уменьшается число протонов в ядрах 3) увеличивается число электронных слоёв в 4) уменьшается число электронов на вэу
1) уменьшаются радиусы атомов 2) уменьшается число протонов в ядрах 3) увеличивается число электронных слоёв в 4) уменьшается число электронов на вэу
13. В ряду элементов 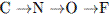 1) уменьшается число электронных слоев в атомах 2) увеличивается число внешних электронов в 3) уменьшается порядковый номер ХЭ 4) возрастают радиусы атомов
1) уменьшается число электронных слоев в атомах 2) увеличивается число внешних электронов в 3) уменьшается порядковый номер ХЭ 4) возрастают радиусы атомов
14. В порядке усиления неМе св-в элементы расположены в ряду:
1. 
 3.
3. 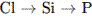 4.
4. 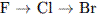
15. B порядке усиления неметаллических свойств элементы расположены в ряду:
1.  . 2.
. 2. 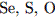 3.
3. 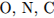
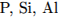
Легче всего присоединяет электроны атом 1) серы 2) хлора 3) селена 4) брома
У атомов As и Sb одинаковы: 1)радиусы атомов 2)степень неМе3)число электронов на вэу 4) заряды ядер
Электрофильные ароматические замены: хлорирование и бромирование
Теперь, когда мы потратили достаточно времени на изучение
, мы, наконец, готовы подробно изучить некоторые конкретные реакции. Первые: галогенирование . Как установить Cl, Br или I на ароматическое кольцо?
[краткое описание здесь:]
[А как насчет фтора? Если бы F 2 не был таким прожорливым зверем, мы бы его тоже включили, но в нынешнем виде фтор лучше всего вводить в ароматические кольца косвенно]
Содержание
- Галогенирование бензола через Электрофильное ароматическое замещение
- Кислоты Льюиса могут быть использованы для «активации» электрофилов.
- Электрофильное хлорирование бензола.
- Электрофильное бромирование бензола.
- (Продвинутый уровень) Ссылки и дополнительная литература
1.Галогенирование бензола посредством электрофильного ароматического замещения
Вы можете вспомнить, что алкены легко реагируют с Cl 2 , Br 2 и I 2 с образованием дигалогенидов.
Бензол? Не так много. И когда он реагирует с ароматическими кольцами, он дает продукты замещения, а не присоединения.
[Почему? Напомним, что резонансная энергия бензола составляет около 36 ккал / моль, а электрофильное ароматическое замещение нарушает ароматичность.]
2. Кислоты Льюиса могут быть использованы для «активации» электрофилов
Сам хлор будет реагировать с «активированными» производными бензола (такими как фенол и анилин), но для того, чтобы хлорирование происходило с электронно-нейтральным или бедные электронами ароматические вещества, ему нужен пинок.
Этот «удар в штаны» обеспечивается кислотой Льюиса. FeCl 3 или AlCl 3 являются отраслевым стандартом, но на практике можно использовать множество различных кислот Льюиса.
Из главы, посвященной спиртам, вы можете вспомнить, что протонные кислоты обычно используются для превращения бедных электрофилов (например, спиртов) в лучшие электрофилы путем преобразования спирта в сопряженную кислоту. [сообщение: Конъюгированная кислота — всегда лучший выход]. Затем «активированный» спирт может участвовать в реакциях нуклеофильного замещения или элиминирования, в которых он не смог бы участвовать в противном случае:
[Уходящая группа может даже полностью уйти с образованием карбокатиона, даже лучшего электрофила! ]
Примерно таким же образом координация кислоты Льюиса с одним из хлоринов превращает его в еще лучшую уходящую группу с чистым эффектом ослабления связи Cl-Cl.Атака на концевой Cl нуклеофилом приводит к потере [Cl-FeCl 3 ] –, даже лучшей уходящей группы, чем Cl –.
Иногда мы рисуем это как равновесие. Лично я предпочитаю показывать неповрежденную связь Cl – Cl, но учебники меняются.
3. Электрофильное хлорирование бензола
Этот «активированный» электрофил затем может быть атакован нуклеофилом (бензольным кольцом) в реакции электрофильного ароматического замещения.Здесь образуется C-Cl, и связь C-C (pi) разрывается!
На следующем этапе слабое основание удаляет протон из промежуточного карбокатиона, разрушая C-H и образуя C-C (pi).
Если это выглядит немного знакомо, это потому, что этот второй шаг очень похож на второй шаг в реакции E1. Как и в E1, для удаления протона, соседнего с карбокатионом, требуется только очень слабое основание. Хлорид-ион (Cl — ) подойдет.
[Примечание: есть много разных способов нарисовать это, я показал только один.См. Эту сноску].
Конечный продукт — хлорбензол плюс один эквивалент HCl. После этого FeCl 3 может свободно реагировать с другим эквивалентом Cl 2 . Другими словами, в этой реакции он ведет себя как катализатор .
4. Электрофильное бромирование бензола
Тот же набор принципов действует и для электрофильного бромирования. Здесь часто используются кислоты Льюиса: FeBr 3 или AlBr 3 . [Почему не FeCl3 или AlCl3? Хороший вопрос! См. Примечание ниже]
Первым шагом является активация Br 2 с последующей атакой и депротонированием, как и раньше:
По сути, это та же реакция, что и хлорирование, за исключением того, что галогены заменены.
5. Электрофильное йодирование бензола
Также возможно йодирование бензола с использованием I 2 , но стадия активации отличается. Здесь, однако, оказывается, что кислотного катализатора Льюиса недостаточно, чтобы сделать йод достаточно активным электрофилом, чтобы реагировать с большинством ароматических колец.
Вместо этого используется стехиометрическое количество окислителя для преобразования I 2 в I + . Типичным приведенным примером является HNO 3 , которая в присутствии дополнительной кислоты (например,грамм. H 2 SO 4 ) является источником очень активного окислителя [NO 2 ] + , который преобразует I2 в I +. [см. примечание ниже]
После образования бензольное кольцо затем реагирует с I + по двухстадийному электрофильному механизму ароматического замещения с образованием новой углерод-йодной связи.
Точная идентичность «B» будет зависеть от окислителя, используемого для преобразования I 2 в I +. Например, достаточно одного эквивалента воды.
6. Резюме: Галогенирование бензола
В случае хлора, брома и йода электрофильное ароматическое замещение происходит в три этапа.
- Активация электрофила кислотным катализатором Льюиса (или стехиометрическим окислителем в случае йода)
- Атака активированного электрофила ароматическим кольцом.
- Депротонирование для регенерации ароматического кольца.
В следующем посте мы рассмотрим еще две важные реакции электрофильного ароматического замещения: сульфонилирование и нитрование, и они также будут следовать этой трехступенчатой схеме!
Примечания
Примечание 1.Есть несколько разных способов изобразить это; На приведенном выше рисунке показана пара электронов в связи Fe-Cl, действующая как основание, что по существу аналогично диссоциации Cl- из FeCl 4 (-) с последующим его действием в качестве основания. Можно также извлечь неподеленную пару из Cl FeCl 4 , действующего в качестве основания, давая H-Cl-FeCl 3 , с последующим разрывом связи Fe-Cl с образованием FeCl 3 и HCl.
Примечание 2. В этой реакции нашли применение многие другие окислители.Другой — бромид меди (II) (CuBr 2 ).
Примечание 3. Дело не в том, что FeCl 3 или AlCl 3 недостаточно прочны для выполнения этой работы; проблема в том, что использование Br 2 в присутствии FeCl 3 приведет к некоторому перемешиванию галогенов, что приведет к небольшому количеству продуктов хлорирования. Использование солей бромида устраняет эту проблему.
Проверь себя!
(Advanced) Ссылки и дополнительная литература
Для получения более подробной информации по отдельным реакциям галогенирования (хлорирование, бромирование, йодирование) обратитесь к разделам в руководстве по реакциям.Ссылки здесь являются основными.
Возможно электрофильное ароматическое фторирование , и последние две статьи описывают это.
Электрофильное ароматическое хлорирование:
- Кинетика замещения ароматических галогенов. Часть IV. 1-галогенонафталины и родственные соединения
P. B. D. de la Mare и P. W. Robertson
J. Chem. Soc., 1948, 100-106
DOI: 10.1039 / JR9480000100
Ранняя работа, посвященная изучению кинетики электрофильного ароматического галогенирования. - Ароматическое замещение. XVII. Хлорирование бензола, алкилбензолов и галобензолов, катализируемое хлоридом железа и хлоридом алюминия
Джордж А. Олах, Стивен Дж. Кун и Барбара А. Харди
Журнал Американского химического общества 1964, 86 (6) , 1055-1060
DOI : 10.1021 / ja01060a017 - Скорости хлорирования бензола, толуола и ксилолов. Коэффициенты частичной скорости реакции хлорирования
Herbert C.Браун и Леон М. Сток
Журнал Американского химического общества 1957, 79 (19), 5175-5179
DOI: 1021 / ja01576a025 Электрофильное ароматическое бромирование: - Относительные скорости бромирования Бензол и метилбензолы. Коэффициенты частичной скорости реакции бромирования
Герберт С. Браун и Леон М. Сток
Журнал Американского химического общества 1957, 79 (6), 1421-1425
DOI: 1021 / ja01563a040 - Ароматическое замещение.XIV. Катализируемое хлоридом железа бромирование бензола и алкилбензолов бромом в растворе нитрометана
Джордж А. Олах, Стивен Дж. Кун, Сильвия Х. Флуд и Барбара А. Харди
Журнал Американского химического общества 1964, 86 (6), 1039-1044
DOI : 10.1021 / ja01060a014 - Ароматическое замещение. XV. Бромирование галобензолов в растворе нитрометана, катализируемое хлоридом железа,
Джордж А.Олах, Стивен Дж. Кун, Сильвия Х. Флуд и Барбара А. Харди
Журнал Американского химического общества 1964, 86 (6), 1044-1046
DOI: 1021 / ja01060a015 Электрофильный ароматическое йодирование: - Галогенирование галогенидами меди (II). Синтез арилиодидов
Уильям К. Бэрд и Джон Х. Сурридж
The Journal of Organic Chemistry 1970, 35 (10), 3436-3442
DOI : 10.1021 / jo00835a055
Простой и понятный способ синтеза монойодаренов с использованием CuI 2 в качестве йодирующего агента. - Электрофильное фторирование ароматических соединений с помощью Selectfluor ™ и трифторметансульфоновой кислоты
Татьяна Шамма, Хервиг Бухгольц, Г.К. Сурья Пракаш и Джордж А. Олах
Israel J. Chem . 1999 , 39 (2), 207-210
DOI: 1002 / ijch.1996
В этой статье описывается использование Selectfluor ™ в качестве реагента для электрофильного ароматического фторирования.Selectfluor — это коммерчески доступное твердое вещество, с которым легко обращаться, и удобный источник «F + » благодаря связи N-F. - Электрофильное ароматическое фторирование C – H с палладиевым катализатором
Кумико Ямамото, Джиакун Ли, Джеффри А.О. Гарбер, Джулиан Д. Рольфес, Грегори Б. Бурсалян, Янник К. Боргс, Кристоф Женикот, Жером Жак, Морис ван Гастель, Neese & Tobias Ritter
Nature 2018, 554 , 511–514
DOI: 10.1038 / nature25749
Эта статья является более сложной и охватывает актуальную тему в металлоорганической химии — использование фторидов Pd (IV) для фторирования. Для тех, кто следит за литературой, профессор Мелани Сэнфорд (Университет Мичигана) и профессор Тобиас Риттер (эта статья, Гарвард, теперь в Институте Макса Планка (Германия)) обсуждали эту тему взад и вперед.
Реакции нитрования и сульфирования при электрофильном ароматическом замещении
В этой статье мы рассмотрим нитрование и сульфирование бензола!
Содержание
- Резюме: Три стадии реакции электрофильного ароматического замещения
- Добавление NO 2 (Нитрование)
- Нитрование бензола
- Ион нитрония (NO 2 +) Является ключевым электрофилом в ароматическом нитровании
- Добавление SO 3 H (сульфирование)
- Резюме: ароматическое сульфирование и нитрование
- Дополнительная тема: Обратимость сульфирования
- Примечания
- Тестируйте сами!
- (Advanced) Ссылки и дополнительная литература
1.Резюме: три стадии реакций электрофильного ароматического замещения
В предыдущем посте, посвященном галогенированию посредством электрофильного ароматического замещения, мы видели, что эта реакция электрофильного ароматического замещения протекает в три отдельные стадии:
- Активация. Поскольку галогены (Cl 2 , Br 2 ) обычно не реагируют с ароматическими молекулами с разумной скоростью, добавляется кислотный катализатор Льюиса (например, FeCl 3 ), чтобы «активировать» электрофил для атаки
- Атака электрофила ароматическим кольцом. Активированный электрофил подвергается атаке ароматического кольца, в результате чего образуется промежуточный карбокатион (это этап, определяющий скорость, и этап 1 в общем механизме электрофильного ароматического замещения).
- Депротонирование. Промежуточный карбокатион депротонируется слабым основанием, восстанавливая ароматичность (стадия 2 в общем механизме электрофильного ароматического замещения).
В сегодняшнем посте мы расскажем о механизме двух других важных реакций электрофильного ароматического замещения, которые проходят через кислотный катализ Бренстеда — нитрования и сульфонилирования.
2. Добавление NO 2 (Нитрация)
Не пробуйте это дома
«Нитрация» — это название, которое мы даем процессу присоединения нитрогруппы (NO 2 ) к молекуле.
Если мы пропустили эту реакцию в предыдущих главах, это связано с тем, что нитрование функциональных групп, отличных от ароматических колец, приводит к довольно взрывоопасным продуктам. Например, нитрование триолглицерина дает печально известный нитроглицерин с тремя уходящими группами отличных (ONO 2 ; технически это «нитратные» группы, а не нитрогруппы ).Малейшее нарушение этой жидкости приводит к цепной реакции, приводящей к быстрому образованию горячего газа. [ Примечание 1 ]
4 моля жидкого нитрогилцерина создают 35 моль газа: 6 моль N 2 , 12 моль CO, 10 моль H 2 O и 7 моль O 2 .
[Примечание читателям: не пытайтесь делать нитроглицерин].
Мой отец и его друзья по соседству в детстве изготавливали черный порох и другие взрывчатые вещества, но изготовление нитро считалось Святым Граалем.Однажды мой отец подготовил весь материал для изготовления нитроглицерина, но в тот день, когда дело дошло до его изготовления, он струсил. Мудрый поступок, папа. Очень сложно сделать операцию, когда не хватает пары пальцев.
Аналогичным образом, нитрование целлюлозы (полимера сахарной глюкозы) дает «нитроцеллюлозу», которая, помимо использования в бездымном порохе, представляет собой полимер, который использовался в качестве материала пленки на заре создания пленки. «Целлулоид», как его называли, не является контактным взрывчатым веществом, но у него есть прискорбное свойство быть склонным к самовозгоранию.(Позже Голливуд перешел на ацетат целлюлозы, также известный как «защитная пленка».)
3. Нитрование бензола
В отличие от нитрования спиртов, нитрование бензола дает относительно стабильные нитросоединения, которые гораздо труднее взорвать. Например, фугасный тротил (2,4,6-тринитротолуол) образуется при тройном нитровании толуола. Другое взрывчатое вещество, гексоген, образуется в результате нитрования тригидро-1,3,5-триазина. [Примечание]
Ключевым реагентом для нитрования является азотная кислота, HNO 3 .Сама по себе азотная кислота является относительно медленно действующим электрофилом, особенно в присутствии плохого нуклеофила, такого как бензол. [Примечание — в случае фенола и других ароматических колец с сильно активирующими группами, для нитрования достаточно HNO 3 ].
Однако при добавлении кислоты — обычно выбирается серная кислота, H 2 SO 4 — происходит быстрая реакция с бензолом.
Ключом к процессу является протонирование ОН азотной кислотой, которое превращает его в Н 2 О.Поскольку H 2 O является гораздо более удаляемой уходящей группой, чем HO (-), он быстро теряется из азотной кислоты с образованием высокореактивного «иона нитрония» NO 2 + .
[примечание: механизм, изображенный выше, немного упрощен. Обычно лучше всего подходят два эквивалента H 2 SO 4 — протонировать HNO 3 дважды (не один раз) с последующей потерей воды, а затем депротонировать HNO 2 +. Щелкните, чтобы увидеть изображение механизма]
4.Ион нитрония (NO 2 +) — ключевой электрофил в ароматическом нитровании.
Ион нитрония — это то, что действительно выполняет здесь свою работу.
Вы можете вспомнить, что это похоже на то, что мы видели с галогенами, где использование кислоты Льюиса в этом случае приводило к образованию активированного электрофила, который гораздо быстрее реагировал с бензолом.
Так что же происходит, когда ион нитрония встречается с бензолом?
На первом (и определяющем скорость) этапе электрофильного ароматического замещения ион нитрония (NO 2 + ) подвергается атаке парой пи-электронов на ароматическом кольце с образованием промежуточного соединения карбокатиона с образованием C– N и разрушение C – C (pi) и N – O (pi).
Второй этап электрофильного ароматического замещения, который является относительно быстрым, представляет собой кислотно-щелочную реакцию. Слабое основание (такое как вода или ион HSO 4 — , оставшийся после протонирования HNO 3 ) удаляет протон из углерода, несущий нитрогруппу, разрушая C – H и повторно образуя C – C pi. Ароматичность восстанавливается.
Последние два этапа, которые мы рассмотрели ранее в общем механизме электрофильного ароматического замещения, на самом деле очень похожи для всех реакций электрофильного ароматического замещения.
5. Добавление SO 3 H (сульфирование)
Сульфонильная группа SO 3 H также может быть добавлена к ароматическому кольцу посредством электрофильного ароматического замещения.
В этом случае электрофильный реагент представляет собой триоксид серы, SO 3 (газ), который можно вводить путем барботирования через растворитель. Сам по себе SO 3 не особенно реагирует с ароматическими кольцами, но, как мы видели, добавление кислоты может значительно увеличить электрофильность (и скорость реакции).[см .: Сила кислотного катализа ]
Подобно азотной кислоте, триоксид серы «активируется» добавлением протона из серной кислоты. [Примечание: эта комбинация SO 3 и H 2 SO 4 называется «дымящей серной кислотой» или «олеумом», если вы хотите использовать некоторую действительно устаревшую номенклатуру. ]
На стадии определения скорости высокоэлектрофильный SO 3 H (+) затем подвергается атаке ароматического кольца с образованием промежуточного карбокатиона, образующего C-S и разрушающего C-C (pi).
Как и все электрофильные ароматические замещения, связь C-H затем депротонируется слабым основанием, чтобы регенерировать пи-связь C-C и восстановить ароматичность с получением продукта сульфоновой кислоты.
И… вот и все, что касается ключевых механизмов нитрования и сульфирования.
6. Резюме: ароматическое сульфирование и нитрование
Если вы начнете сравнивать реакции, вы должны увидеть, что ключевой механизм электрофильного ароматического замещения на самом деле не меняется, за исключением идентичности электрофила.
Что действительно придает каждой реакции свой уникальный вкус, так это то, как электрофил активируется либо посредством кислотного катализа Льюиса (хлорирование, бромирование), либо посредством кислотного катализа Бренстеда (нитрование, сульфирование).
В следующем посте мы расскажем о пятой и шестой из шести ключевых реакций электрофильного ароматического замещения: алкилировании Фриделя-Крафтса и ацилировании Фриделя-Крафтса, а также о том, как они используются для образования новых углерод-углеродных связей в ароматических кольцах.
Следующее сообщение: Фридель-Крафтс Алкилирование и ацилирование
7.Дополнительная тема: Обратимость сульфирования
[Мы еще поговорим об этом, когда будем говорить о синтезе ароматических молекул, но если вы не можете дождаться… читайте дальше!]
Ароматические сульфонильные группы обладают очень интересным свойством. Если обработать достаточно сильной кислотой в отсутствие SO 3 , группа сульфоновой кислоты может быть удалена.
Давайте посмотрим, как это происходит.
Мы были так заняты разговорами о различных электрофилах (хлор, бром, нитроний, сульфоний …), что забыли упомянуть, что H + также может действовать как электрофил.
Мы проигнорировали это, потому что реакция очень легко обратима — ожидается, что за протонированием ароматического кольца быстро последует депротонирование до (стабильного, ароматического) исходного материала. Это тупик.
Однако в частном случае сульфонильных групп (и еще одной группы, о которой я упомяну в следующем посте) протонирование кольца может иметь важные последствия, IF проводится в отсутствие SO3.
Во-первых, давайте посмотрим, как выглядит «протонирование кольца».
Если кольцо протонировано на том же атоме углерода, что и кольцо, несущее сульфонильную группу [ вам, вероятно, не нужно этого знать, но это называется «ipso» углеродом], мы генерируем промежуточный карбокатион.
Вам кажется продукт знакомым? Должен — это точно такой же промежуточный карбокатион, который образуется, когда бензол атакует протонированный SO 3 на «стадии 2» сульфирования.
В большинстве случаев это промежуточное соединение просто депротонируется для регенерации ароматической сульфоновой кислоты.
Однако в случае SO 3 H существует другой путь восстановления ароматичности, который энергетически недоступен в случае большинства других заместителей. Вместо потери H промежуточный продукт может терять SO 3 H (+), что приводит к образованию бензола.
Это реверс электрофильной атаки!
И вот здесь вступает в дело «отсутствие SO 3 ». В присутствии высокой концентрации SO 3 бензол просто снова атакует протонированный SO 3 и снова образует сульфоновую кислоту. ,
Но если мы просто добавим кислоту в отсутствие SO 3 , то это маловероятно. Кроме того, если мы вентилируем реакцию (например, пропуская через реакционную смесь инертный газ, такой как аргон, который в конечном итоге уносит с собой газообразный SO 3 ), то газообразный SO 3 будет медленно удаляться из система. Если вы вспомните принцип Ле Шателье, это означает, что наша сульфоновая кислота гарантированно медленно превратится обратно в бензол.
«Хорошо, хорошо. Это обратимо. Ну и что?» вы можете правильно спросить.
Ну, это означает, что SO 3 H может быть полезен в качестве «блокирующей группы» при некоторых условиях. Опять же, когда мы перейдем к синтетической стратегии, мы еще поговорим об этом, но я оставлю вас перед проблемой: как можно получить орто- хлорметилбензол из метилбензола без какого-либо продукта пара-?
Ответьте в комментариях.
Примечания
Примечание 1.Смесь азотной и серной кислоты получила название «царская водка» (латинское «королевская вода»], поскольку ион нитрония является настолько сильным окислителем, что удаляет электроны из золота и платины «благородных металлов».
Примечание о нитроглицерине.
Мне сказали, что если нитроглицерин нейтрализован бикарбонатом натрия, с ним «разумно» безопасно работать, , если вы не дышите им и не наносите им на кожу . («разумно безопасно» по-прежнему означает «не делай этого»). При длительном стоянии нитроглицерин приобретает коричнево-красный цвет, что является признаком того, что он «выходит из строя». Я не знаю, но мне интересно, начинается ли процесс детонации нитроглицерина с гомолитического расщепления слабой связи O-NO2 с образованием очень неприятного (и сильно окрашенного) радикала • NO2. Это может оторвать атом водорода от нитроглицерина, и тогда — шабанг! — везде гомолитическое расщепление.
Тетроксид азота (который находится в равновесии с 2 молями • NO2) является полезным ракетным топливом в космических зондах и т.п.
Примечание. Подготовка TNT и структура RDX.
Механизм здесь: (назад)
Проверь себя!
(Advanced) Ссылки и дополнительная литература
Для получения более подробной информации об этих реакциях обратитесь к разделам в руководстве по реакциям. Ссылки здесь являются основными.
Нитрование:
- Кинетика и механизм ароматического нитрования
J. GILLESPIE, E.D. HUGHES, CK INGOLD, DJ MILLEN & RI REED
Nature , том 163, страницы 599–600 ( 1949 )
DOI : 10.1038 / 163599b0
Проф. Кристофер Ингольд провел множество ранних механистических исследований электрофильное ароматическое нитрование и заложило основу для нашего нынешнего понимания реакции. Он первым предположил, что смесь азотной кислоты и серной кислоты (известная как «смешанная кислота»), используемая при нитровании, генерирует ион нитрония, [NO 2 ] + , и что это реактивные частицы при электрофильном нитровании.Покойный лауреат Нобелевской премии профессор Джордж А. Олах также опубликовал множество работ по изучению механизма нитрования, в результате чего было опубликовано по меньшей мере 50+ статей и книга по этой теме. Попутно он выделил ион нитрония в виде стабильной соли (которая сейчас коммерчески доступна) и продемонстрировал, что он претерпевает те же реакции, что и смешанная кислотная система.
- Ароматическое замещение. VII. Нитрование ароматических углеводородов по типу Friedel-Crafts
Стивен Дж. Кун и Джордж А. Олах
Журнал Американского химического общества 1961, 83 (22), 4564-4571
DOI: 1021 / ja01483a016 - Ароматическое замещение.XXVIII. Механизм электрофильных ароматических замещений
Джордж А. Олах
Acc. Химреагент Res., 1971, 4 (7), 240-248
DOI: 10.1021 / ar50043a002 - Единая механистическая концепция электрофильного ароматического нитрования: конвергенция результатов расчетов и экспериментальных данных
Пьер М. Эстевес , Хосе Вокимар де М. Карнейро, Шейла П. Кардосо, Андре Х. Барбоза, Кеннет К. Лаали, Голам Расул, Г.К. Сурья Пракаш и Джордж А. Олах
Журнал Американского химического общества 2003, 125 (16), 4836-4849
DOI: 10.1021 / ja021307w
Это статья о дедушке нитрование, подытоживающее всю работу над этой темой. Если у вас нет времени читать здесь другие статьи, прочтите это.Сульфирование:
- Ароматическое сульфирование триоксидом серы: механизм и кинетическая модель
Samuel L.К. Моорс, Ксавье Дераэ, Гай Ван Аше, Пол Герлингс и Фрэнк Де Профта
Sci., 2017 , 8 , 680
DOI: 10.1039 / c6sc03500k
Совсем недавняя статья о классической реакции. Эта статья представляет собой вычислительный анализ электрофильного ароматического сульфирования с целью прояснить кинетику и механизм реакции. - Электрофильное ароматическое сульфирование с SO 3 : Согласованный или классический механизм S E Ar?
Гергана Колева, Борис Галабов, Цзин Конг, Генри Ф.Шефер, III, и Пауль фон Р. Шлейер
Журнал Американского химического общества 2011, 133 (47), 19094-19101
DOI: 1021 / ja201866h
Покойный проф. Р. Шлейер был гигантом в области вычислительной физико-органической химии. Это вычислительное исследование ароматического сульфирования, которое пытается прояснить механизм. Расчетное моделирование показывает, что тримолекулярная реакция с молекулами 2 SO 3 действительно энергетически предпочтительна.Проф. Ханс Серфонтейн (Университет Амстердама) проделал большую работу по электрофильному ароматическому сульфированию, опубликовав более 100 статей по этой теме. Следующие две статьи являются лишь избранными:
- Ароматическое сульфирование. Часть 92. Сульфирование трех метилфенолов и шести диметилфенолов в концентрированной водной серной кислоте; и изомеризация некоторых образующихся сульфоновых кислот и м-ксилол-2- и о-ксилол-3-сульфоновой кислоты
Hans J. A. Lambrechts, Zwaan R.H. Schaasberg-Nienhuis и Hans Cerfontain
Chem. Soc., Perkin Trans. 2 , 1985 , 669-675
DOI: 10.1039 / P29850000669 - Кинетика десульфирования бензолсульфоновой кислоты и толуолсульфоновых кислот в водной серной кислоте
C. M. Wanders, H. 9080317 Rec. Trev. Хим. Pays-Bas 1967, 86 (11), 1199-1216
DOI: 10.1002 / recl.19670861106
Десульфирование арилсульфоновых кислот является синтетически полезной реакцией, и в этой статье исследуется кинетика реакции.Следующие две процедуры из Organic Syntheses подчеркивают полезность десульфирования, позволяя получить доступ к орто- -замещенным ароматическим соединениям. Будет ли такой путь действительно проведен или нет, зависит от целевого соединения. Благодаря доступным сегодня усовершенствованным методам хроматографического разделения можно просто отделить изомеры от сырой смеси.
- о-БРОМОФЕНОЛ
Ральф К. Хьюстон и Мурел М. Баллард
Org. Synth. 1934, 14 , 14
DOI: 10.15227 / orgsyn.014.0014 - 2,6-ДИНИТРОАНИЛИН
Гарри П. Шульц
Org. Synth. 1951 , 31 , 45
DOI: 10.15227 / orgsyn.031.0045
Галогенирование бензола и метилбензола
- Последнее обновление
- Сохранить как PDF
- Галогенирование бензола
- Реакции замещения
- Реакция с хлором
- Реакция с бромом
- Реакции присоединения
- Галогенирование метилбензола
- Реакции замещения
- Замещение в кольцо
метильная группа - Реакции присоединения
- Участники
На этой странице рассматриваются реакции бензола и метилбензола (толуола) с хлором и бромом в различных условиях.
Галогенирование бензола
Реакции замещения
Бензол реагирует с хлором или бромом в присутствии катализатора, заменяя один из атомов водорода в кольце на атом хлора или брома. Реакции происходят при комнатной температуре. Катализатором является либо хлорид алюминия (или бромид алюминия, если вы реагируете бензол с бромом), либо железо.
Строго говоря, железо не является катализатором, потому что оно постоянно изменяется в ходе реакции.Он реагирует с некоторым количеством хлора или брома с образованием хлорида железа (III), \ (FeCl_3 \), или бромида железа (III), \ (FeBr_3 \).
\ [2Fe + 3Cl_2 \ вправо 2FeCl_3 \]
\ [2Fe + 3Br_2 \ rightarrow 2FeBr_3 \]
Эти соединения действуют как катализаторы и в этих реакциях ведут себя точно так же, как хлорид алюминия \ (AlCl_3 \) или бромид алюминия \ (AlBr_3 \).
Реакция с хлором
Реакция между бензолом и хлором в присутствии хлорида алюминия или железа дает хлорбензол.

или, более компактно:
\ [C_6H_6 + Cl_2 \ вправо C_6H_5Cl + HCl \]
Реакция с бромом
Реакция между бензолом и бромом в присутствии бромида алюминия или железа дает бромбензол. Обычно используется железо, потому что оно дешевле и более доступно.

или
\ [C_6H_6 + Br_2 \ rightarrow C_6H_5Br + HBr \]
Реакции присоединения
В присутствии ультрафиолета (но без катализатора) горячий бензол также вступает в реакцию присоединения с хлором или бромом.Делокализация кольца постоянно нарушается, и к каждому атому углерода присоединяется атом хлора или брома.
Например, если вы барботируете газообразный хлор через горячий бензол, подвергнутый воздействию ультрафиолетового света в течение часа, вы получите 1,2,3,4,5,6-гексахлорциклогексан.

Бром ведет себя аналогичным образом.
Хлор и водород могут произвольно торчать вверх и вниз над и под кольцом, что приводит к образованию ряда геометрических изомеров. Хотя двойных связей углерод-углерод нет, они все еще «заблокированы» и не могут вращаться.Один из этих изомеров когда-то широко использовался в качестве инсектицида, известного под различными названиями BHC, HCH и гаммексан. Это один из «хлорированных углеводородов», нанесших столько вреда окружающей среде.
Галогенирование метилбензола
Реакции замещения
В зависимости от используемых условий возможно проведение двух совершенно разных реакций замещения между метилбензолом и хлором или бромом. Хлор или бром могут замещать кольцо или метильную группу.
Замена в кольцо
Замещение в кольце происходит в присутствии хлорида алюминия (или бромида алюминия, если вы используете бром) или железа, а также в отсутствие УФ-излучения. Реакции происходят при комнатной температуре. Это точно так же, как реакция с бензолом, за исключением того, что вам нужно беспокоиться о том, где атом галогена присоединяется к кольцу относительно положения метильной группы.
Метильные группы являются 2,4-направляющими, что означает, что входящие группы будут иметь тенденцию переходить в 2 или 4 положения кольца — при условии, что метильная группа находится в положении 1.Другими словами, новая группа w
.WebElements Периодическая таблица »Сера» радиусы атомов и ионов
-

N O F -P S Класс как SE рублей -

- Актиний ☢
- Алюминий
- Алюминий
- Америций ☢
- Сурьма
- Аргон
- Мышьяк
- Астатин ☢
- Барий
- Берклиум ☢
- Бериллий
- висмут
- Бориум ☢
- Бор
- Бром
- Кадмий
- Цезий
- Кальций
- Калифорний ☢
- Углерод
- Церий
- Цезий
- Хлор
- Хром
- Кобальт
- Copernicium ☢
- Медь
- Кюрий ☢
- Дармштадтиум ☢
- Дубний ☢
- Диспрозий
- Эйнштейний ☢
- Эрбий
- Европий
- Фермий ☢
- Флеровий ☢
- Фтор
- Франций
- Гадолиний
- Галлий
- Германий
- Золото
- Гафний
- Калий ☢
- Гелий
- Гольмий
- Водород
- Индий
- Йод
- Иридий
- Утюг
- Криптон
- Лантан
- Лоуренсий ☢
- Свинец
- Литий
- Ливерморий ☢
- Лютеций
- Магний
- Марганец
- Мейтнерий ☢
- Менделевий ☢
- Меркурий
- Молибден
- Московиум ☢
- Неодим
- Неон
- Нептуний
- Никель
- Нихоний ☢
- Ниобий
- Азот
- Нобелий
- Оганессон ☢
- Осмий
- Кислород
- Палладий
- фосфор
- Платина
- Плутоний ☢
- Полоний
- Калий
- Празеодим
- Прометий ☢
- Протактиний ☢
- Радий ☢
- Радон ☢
- Рений
- Родий
- Рентген ☢
- Рубидий
- Рутений
- Резерфорд ☢
- Самарий
- Скандий
- Сиборгий ☢
- Селен
- Кремний
- Серебро
- Натрий
- Стронций
- Сера
- Сера
- Тантал
- Технеций
- Теллур
- Теннессин
- Тербий
- Таллий
- Торий ☢
- Тулий
- Олово
- Титан
- Вольфрам
- Уран ☢
- Ванадий
- Ксенон
- Иттербий
- Иттрий
- Цинк
- Цирконий

Leave A Comment