Кристаллы
Валерия Сирота
«Квантик» №1, 2019
Нужно признаться, что в 10-м номере «Квантика» за 2018 год я вас немножко обманула. Не всех, а только тех, кто слепил из пластилина молекулы поваренной соли (NaCl) и оксида железа (Fe2O3). Дело в том, что таких молекул нет. Соль не состоит из молекул!
Если «посмотреть» на неё в очень сильный электронный микроскоп (в обычный оптический такие мелкие детали не разглядеть), окажется, что вместо того, чтобы попарно разделиться на молекулы — каждому атому натрия свой атом хлора, — все атомы построены, как солдаты на плацу! Да ещё и не на плоскости, а в пространстве. На одинаковых расстояниях друг от друга чередуются Na — Cl — Na — Cl —… Если этот строй и слепился из молекул, уже не различить, где какая, и не понять, с каким атомом хлора мог быть сцеплен этот атом натрия: все соседние атомы Cl находятся от него на равных расстояниях.
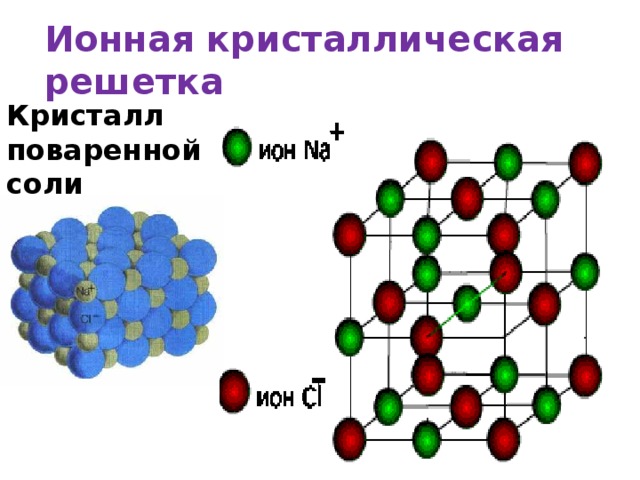
Это — ионный кристалл (рис. 1). Помните, что такое ионная связь? Атом хлора «отбирает» у атома натрия электрон, и оба атома становятся ионами — «дефектными» атомами с числом электронов, не равным числу протонов, и оттого заряженными: натрий положительным, а хлор отрицательным. Теперь они притягивают друг друга. Но если рядом много других таких же ионов, то ведь все отрицательные притягиваются ко всем положительным! Правда, от всех других отрицательных при этом отталкиваются. Получается, что им удобно расположиться в таком вот шахматном порядке. И хотя каждый отдельный хлор отобрал электрон у какого-то одного натрия, притягивается он ко всем своим соседям-натриям. Так что число связей-«ручек» оказывается намного больше.
Теперь они притягивают друг друга. Но если рядом много других таких же ионов, то ведь все отрицательные притягиваются ко всем положительным! Правда, от всех других отрицательных при этом отталкиваются. Получается, что им удобно расположиться в таком вот шахматном порядке. И хотя каждый отдельный хлор отобрал электрон у какого-то одного натрия, притягивается он ко всем своим соседям-натриям. Так что число связей-«ручек» оказывается намного больше.
Это соединение получается очень твёрдым и прочным. В магазинах в основном продают мелко помолотую соль, а если взять соль крупного помола или вообще «каменную» — необработанную, то раздробить её можно разве что молотком.
Оксид железа — тоже кристаллическое вещество, но ионы железа и кислорода выстраиваются иначе — кристаллическая решётка другая (рис. 2).
Кристаллы возникают не только у веществ с ионной связью между атомами. Они могут составляться и из таких атомов, которые делятся электронами друг с другом, а не отдают «насовсем» — это называется ковалентной связью. Так, углерод может образовывать даже несколько разных видов кристаллов, «под настроение» — смотря какие условия вокруг. И в зависимости от того, как построились атомы — одни и те же атомы углерода! — получаются совсем разные вещества. (А если атомы никак не построились, а «валяются» как попало — получается сажа.)
Так, углерод может образовывать даже несколько разных видов кристаллов, «под настроение» — смотря какие условия вокруг. И в зависимости от того, как построились атомы — одни и те же атомы углерода! — получаются совсем разные вещества. (А если атомы никак не построились, а «валяются» как попало — получается сажа.)
А бывает, что в кристаллы строятся не отдельные атомы, а целые молекулы. Например, лёд: это тоже кристаллическое вещество, но решётку образуют молекулы воды (рис. 4). В каждой молекуле воды кислород хоть и «делится» своими электронами с атомами водорода, но при этом «оттягивает» все общие электроны от ядер водорода — поближе к себе. Так что каждый электрон вроде бы вертится вокруг обоих ядер, но вокруг кислорода — больше. Получается, что кислород немножко заряжен отрицательно, а водород — положительно. И вот в результате кислородный «конец» одной молекулы притягивается к водородному «концу» другой. Это притяжение и удерживает их в решётке.
Но совсем особый вид связи, который бывает только в кристалле, придумали себе металлы.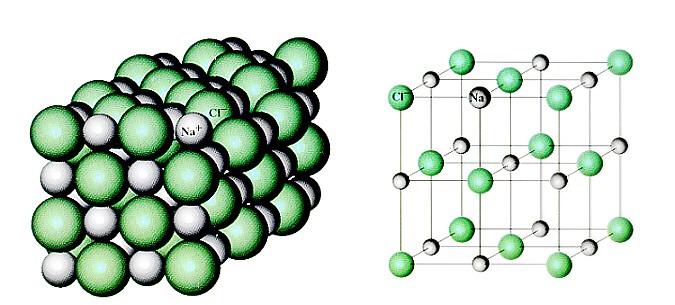 Это такие атомы, у которых по одному-два электрона на внешнем уровне-этаже1, и им их отдать вовсе не жалко. Такие атомы «делятся» своими электронами не просто с ближайшим соседом, а со всеми остальными атомами кристалла! То есть все эти «лишние» электроны становятся общими и летают по всему кристаллу. А ионы — ядра с оставшимися электронами — стоят «в строю» и образуют кристаллическую решётку.
Это такие атомы, у которых по одному-два электрона на внешнем уровне-этаже1, и им их отдать вовсе не жалко. Такие атомы «делятся» своими электронами не просто с ближайшим соседом, а со всеми остальными атомами кристалла! То есть все эти «лишние» электроны становятся общими и летают по всему кристаллу. А ионы — ядра с оставшимися электронами — стоят «в строю» и образуют кристаллическую решётку.
Большая свобода электронов обеспечивает одно из главных свойств металлов — способность проводить электрический ток. Ток — это упорядоченное (дружное, в одну сторону) движение заряженных частиц. Если присоединить кусок металла к батарейке, ионы решётки стоят неподвижно, а электроны бегут (точнее, дрейфуют — бегая туда-сюда, постепенно сдвигаются) все в одну сторону, к «плюсу» батарейки. Это не значит, что их в металле становится меньше: ведь ток течёт, только когда металлический провод подсоединён к батарейке. И вместо электронов, «убегающих» в батарейку на одном конце провода, из батарейки приходят новые электроны на другой конец. Провод при этом всегда остаётся незаряженным. Но если батарейку присоединить к куску пластмассы, резины или даже к сухой деревяшке — ток не потечёт: нет свободных электронов, все привязаны к своим молекулам, некому бежать.
Провод при этом всегда остаётся незаряженным. Но если батарейку присоединить к куску пластмассы, резины или даже к сухой деревяшке — ток не потечёт: нет свободных электронов, все привязаны к своим молекулам, некому бежать.
Ещё металлы хорошо проводят тепло: попробуешь нагреть один конец — нагревается весь кусок металла2. Это тоже из-за свободных электронов: летая между холодным и горячим концами, они переносят тепло и уравнивают температуру.
Кристаллическое или аморфное?
Вообще-то все «по-настоящему твёрдые» вещества, хорошо сохраняющие свою форму, — кристаллические. Хотя вот пластилин или глина например, когда засохнут, — вполне твёрдые, а вовсе не имеют кристаллической структуры. Такие вещества называются аморфными (не имеющими формы): молекулы (или атомы) в них не построены в строгом порядке, а «набросаны» более-менее как попало. Часто бывает, что одни и те же молекулы могут образовывать и кристаллическое вещество, и аморфное (вспомните алмаз, графит, уголь и сажу).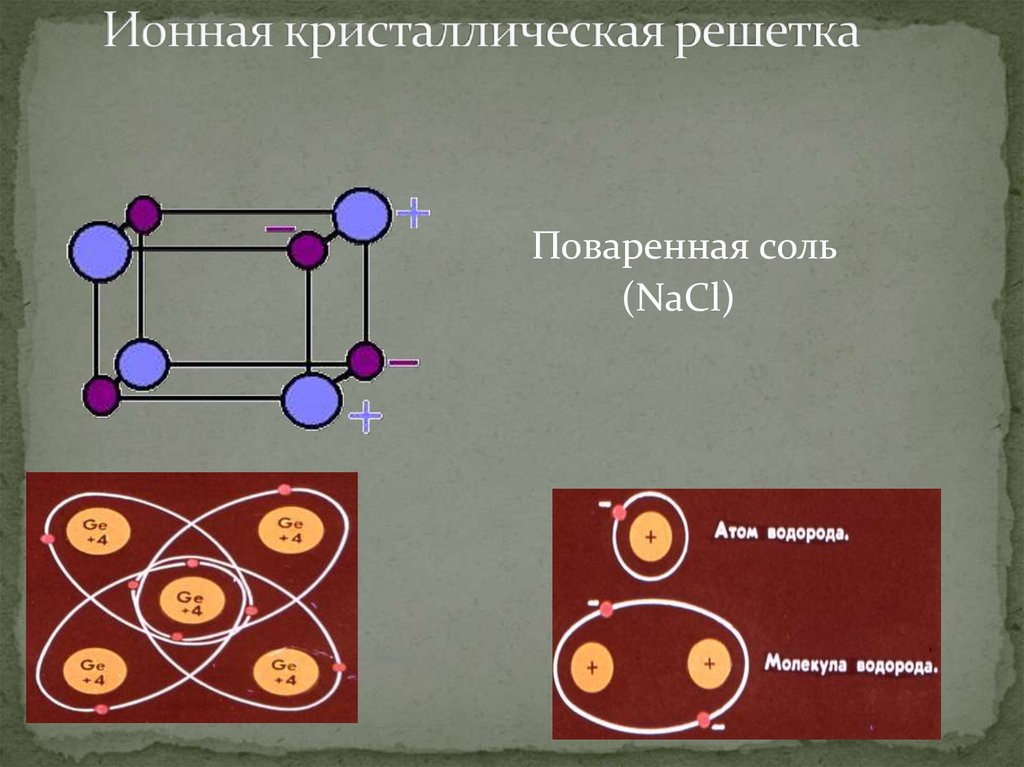 Чтобы атомы успели «построиться» в кристалл, расплавленное вещество должно остывать достаточно медленно. Если остужать его быстрее — получится аморфное тело.
Чтобы атомы успели «построиться» в кристалл, расплавленное вещество должно остывать достаточно медленно. Если остужать его быстрее — получится аморфное тело.
У кристаллических веществ есть определённая температура плавления, у каждого своя; если нагреть их до этой температуры, они резко меняют свои свойства и плавятся, превращаются в жидкость: кристалл разваливается на отдельные молекулы. У аморфных тел никакой определённой температуры плавления нет — при нагревании они плавно становятся всё более текучими. Молекулы (или атомы) в них и так уже расположены как в жидкости.
Элементарная ячейка и виды решёток
Мы говорили в № 10 «Квантика» за 2018 год, что молекула — «минимальный кусочек» вещества, который ещё определяет его химические свойства: взяв много таких кусочков, получим сколько угодно этого вещества3. У кристаллического вещества «минимальное количество», которое его всё ещё полностью определяет, — не молекула, а элементарная ячейка. Это самый маленький кусочек решётки, из копий которого можно составить всю решётку4.
Например, кристаллическая решётка поваренной соли получается многократным повторением такого кусочка: Na — Cl. Это и есть элементарная ячейка соли, в ней два атома. А в элементарной ячейке полония — всего один атом (рис. 5). Такая кристаллическая решётка называется простой кубической: весь кристалл можно составить из одинаковых кубиков, в каждом — один атом (на рисунке один из этих кубиков выделен синим). Это и есть элементарная ячейка.
Обратите внимание! Чёрные линии, которыми на этом и следующих рисунках изображены связи между ионами, тоже образуют кубики. Но «разрезать» (даже мысленно) кристалл на ячейки удобнее не по ним — а то атомы попадут на границы разрезов, и мы легко запутаемся, разбираясь, «считается» ли этот атом внутри того или этого кубика. Лучше просто сдвинуть нашу воображаемую (синюю) сетку из элементарных ячеек.
Следующий по сложности тип решётки — такой, в котором атомы расположены не только по вершинам кубиков, нарисованных чёрными палочками-связями, но и в центре каждого кубика (рис. 6, слева). Так устроены, например, кристаллы железа. А другие атомы — например, меди и золота — предпочитают строиться в гранецентрированные решётки, у которых атомы стоят в вершинах кубов и в центрах их граней (рис. 6, справа).
6, слева). Так устроены, например, кристаллы железа. А другие атомы — например, меди и золота — предпочитают строиться в гранецентрированные решётки, у которых атомы стоят в вершинах кубов и в центрах их граней (рис. 6, справа).
Как мы видели на примере углерода, бывают и некубические решётки: у графита, например, элементарная ячейка имеет форму шестиугольной призмы.
Художник Мария Усеинова
1 Или побольше, но у атомов с очень большим количеством электронов, так что на верхних этажах «электронного дома» до ядра уже очень далеко и внешние электроны держатся совсем непрочно. Из-за этого в нижних строках таблицы Менделеева почти все элементы — металлы.
2 Можете проверить это, нагревая один конец вилки или ложки над плитой или опуская их в горячую воду. Только не обожгитесь.
3 Имеются в виду «чистые» вещества, из одинаковых молекул. Смеси разных веществ (как воздух или дерево) мы сейчас не обсуждаем.
4 Самые маленькие — потому что две соседние элементарные ячейки, например, тоже можно копировать, и получится то же самое. Интересно найти самый маленький из всех возможных «кирпичиков». Но всё-таки такой, который «сохраняет симметрии решётки»: если вся решётка симметрична, например переходит сама в себя при повороте на 90°, то и элементарная ячейка должна быть так же симметрична. В частности, если решётка состоит из кубов, то и элементарная ячейка должна иметь форму куба.
Кристаллические решетки
Цели.
- Дать понятие о кристаллическом и аморфном состоянии твердых веществ; познакомиться с типами кристаллических решеток, их взаимосвязью с видами химической связи и влиянием на физические свойства веществ; дать представление о законе постоянства состава веществ.
- Развивать логическое мышление, умения наблюдать и делать выводы.
- Формировать эстетический вкус и коллективизм, расширять кругозор.

Оборудование и реактивы. Модели кристаллических решеток; пластилин, жевательная резинка, смолы, воск, поваренная соль NaCl, графит, сахар, вода; раздаточный материал, компьютер, презентация (приложение).
Тип урока: усвоение нового материала.
Форма организации работы. фронтальная, групповая.
Методы и приемы. объяснительно-иллюстративный, проблемный, демонстрационный опыт, лабораторная работа, самостоятельная работа.
Презентация к уроку
Ход урока
Сегодня я хочу начать урок со слов поэта Леонида Мартынова:
(Cлайд 1)
«В мире этом – я знаю –
нет счета сокровищам,
Но весьма поучительно
для очей заглянуть
повнимательнее в нутро вещам,
прямо в нутро вещей».
(Слайд 2) Тема урока: Кристаллические решетки
Цель урока– понять, что такое кристаллическое и аморфное состояние твердых веществ, познакомиться с типами кристаллических решеток, получить представление о законе постоянства состава веществ.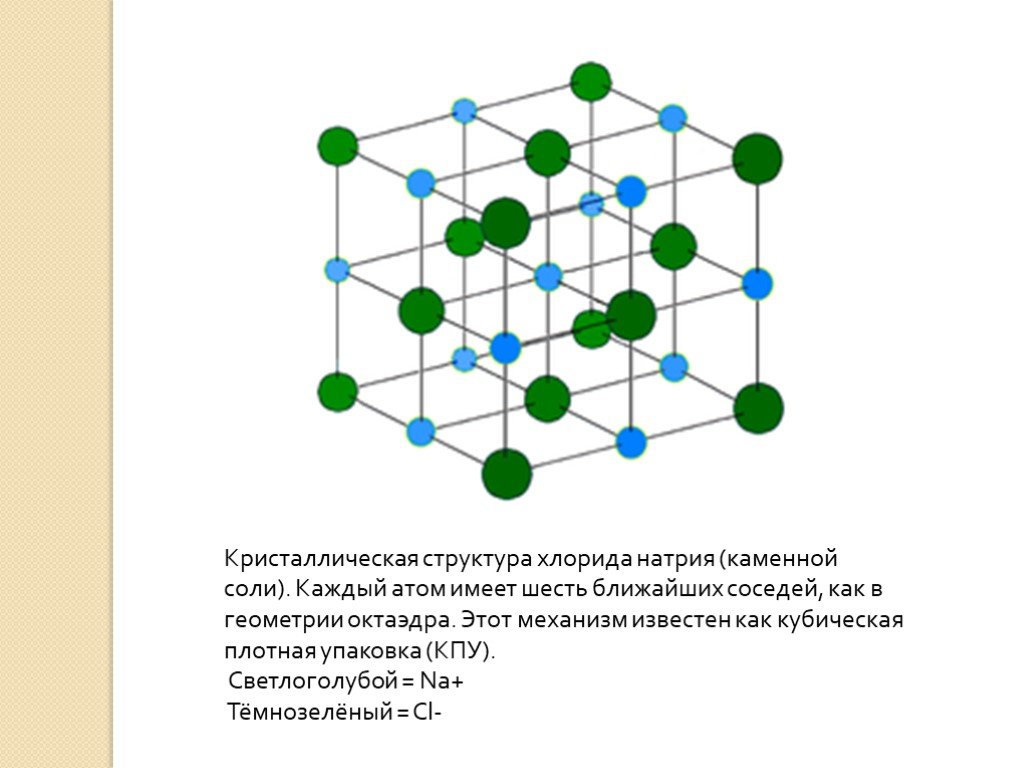
Посмотрите на слайд (3). На нем представлены вещества: алмаз, медный купорос, аметист, графит, алюминий, оксид углерода (IV), ртуть, каменная соль.
В конце урока вы должны ответить на вопрос:
(Слайд 3) Что общего у этих веществ?
Вспомните: Какие агрегатные состояния веществ известны?
(Ответ): Твердое, жидкое и газообразное.
(Слайд 4) Следовательно: вещества по агрегатному состоянию делят на газы, жидкости и твердые тела.
Приведите примеры веществ. (Слайд 4, продолжение)
Для нас важны все три агрегатных состояния, так как любое вещество может быть газом, жидкостью или твердым веществом.
Приведите примеры таких переходов:
Например: лед ↔ вода ↔ пар; твердый натрий легко плавится и может испарятся, т.е. быть газообразным. Газ кислород при низких температурах сначала превращается в жидкость, а при еще более низких – затвердевает в синие кристаллы.
Сегодня мы рассмотрим твердое состояние вещества.
(Лабораторная работа) Посмотрите на вещества на ваших столах и распределите их на две группы (по своему усмотрению). (на столе: пластилин, жевательная резинка, смола, воск, поваренная соль NaCl, графит, сахар)
(Ответ учащихся) Пластилин, жевательная резинка, смола, воск – это аморфные вещества. У них часто нет постоянной температуры плавления, наблюдается текучесть, нет упорядоченного строения. Напротив, соль NaCl, графит и сахар – кристаллические вещества. Для них характерны четкие температуры плавления, правильные геометрические формы, симметрия, упорядоченное строение.
(Слайд 5) Исходя из вашего ответа следует вывод, что все твердые вещества делятся на аморфные и кристаллические (их характеристика).
Что бы выяснить отличие аморфных и кристаллических веществ мы заглянем внутрь этих веществ.
Кристаллические вещества характеризуются правильным расположением частиц, из которых они построены: атомов, молекул или ионов.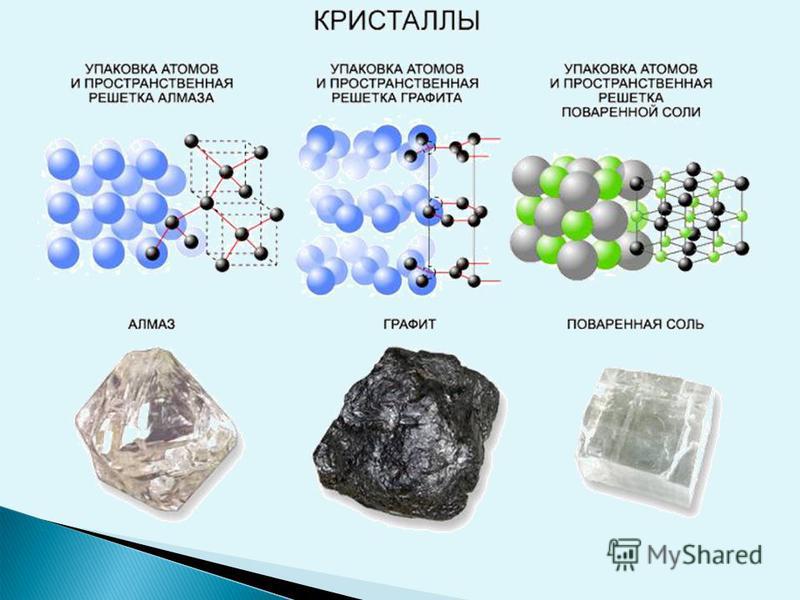 Эти частицы расположены в строго (Слайд 6) определенных точках пространства – называемыхузлами. Если соединить узлы прямыми линиями, то образуется пространственный каркас – кристаллическая решетка.
Эти частицы расположены в строго (Слайд 6) определенных точках пространства – называемыхузлами. Если соединить узлы прямыми линиями, то образуется пространственный каркас – кристаллическая решетка.
В соответствии с видом частиц можно выделить четыре типа кристаллических решеток.
Установим взаимосвязь между типом решетки, видом химической связи и свойствами веществ одновременно заполняя таблицу (приложение 1).
(слайды 7-10)
1 кристаллическая решетка – ИОННАЯ.
Виды частиц в узлах решетки? – ионы.
Вид связи между частицами – ионная, прочная.
Какие вещества могут иметь ионную кристаллическую решетку? – соли, оксиды и гидроксиды типичных металлов (I– III групп)
Какими физ. свойствами будут обладать такие вещества? – твердые, прочные, нелетучие, тугоплавкие.
Следующий тип кристаллической решетки – АТОМНАЯ.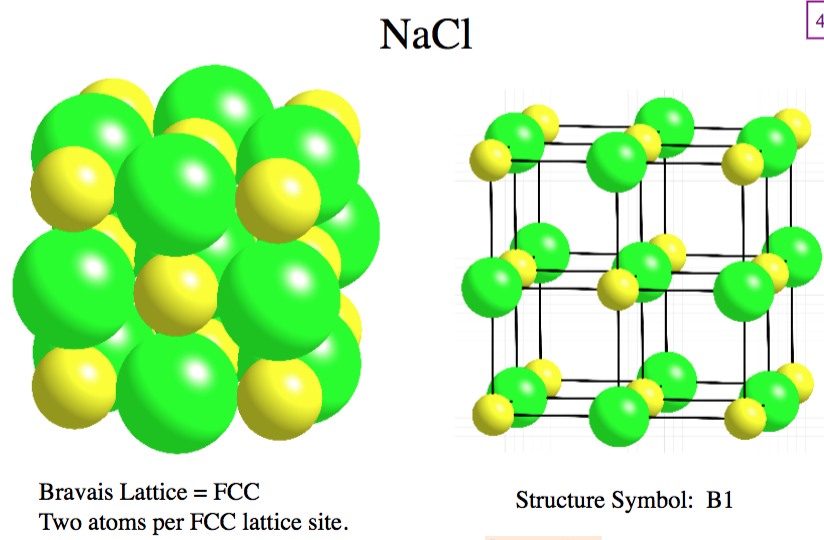
Виды частиц в узлах решетки – атомы.
Вид связи между частицами? – (атомная или) ковалентная.
Примеры – графит (его кристаллическая. решетка показана на слайде), кварц, алмаз.
Физические свойства веществ – такие же что и у веществ с ионной кристаллической решеткой – твердые, прочные, нелетучие, тугоплавкие, не растворимы в воде.
У алмаза кристаллическая решетка по структуре отличается от решетки графита. (демонстрация кристаллических решеток графита и алмаза) Она имеет тетраэдрическое строение. Из за такого своего строения алмаз – твердое, очень прочное вещество.
3 тип кристаллической решетки – МОЛЕКУЛЯРНАЯ.
В узлах такой решетки находятся – молекулы.
Между молекулами – слабые силы межмолекулярного притяжения, а внутри молекул – прочная ковалентная связь.
Примеры веществ –твердые при особых условиях вещества, которые при обычных условиях газы, жидкости; сера, иод, уксусная кислота.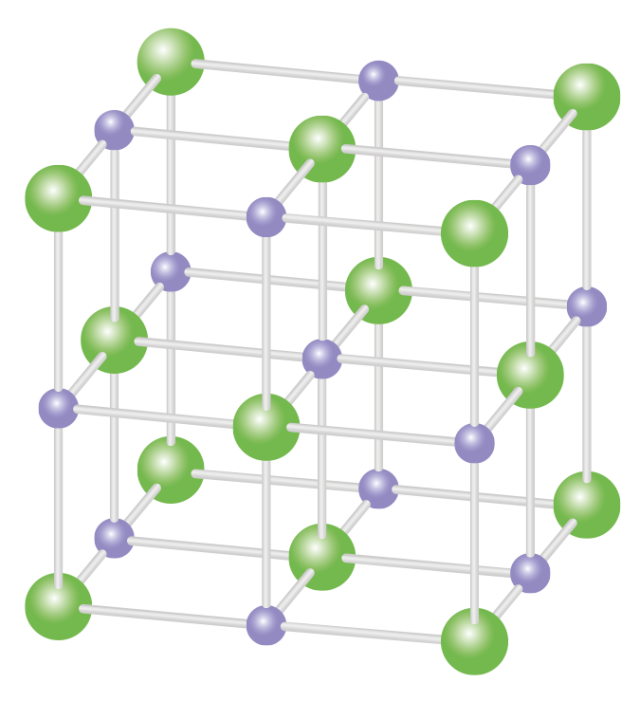
Характерные физические свойства таких веществ – непрочные, летучие, легкоплавкие, имеющие малую твердость.
На слайде приведена кристаллическая решетка углекислого газа – оксида углерода (IV). В узлах находится молекула состоящая из атома углерода и двух атомов кислород.
В кристаллических решетках простых веществ, например иода – в узлах находятся двухатомные молекулы иода. (Приложение 2)
И последняя кристаллическая решетка – МЕТАЛЛИЧЕСКАЯ.
В узлах находятся – атом – ионы (металлов).
Связь – металлическая, осуществляемая свободными обобществленными электронами (которые двигаются между атом – ионами).
(Демонстрация кристаллической решетки металлов, раздаточный материал) (приложение 3).
Примеры – металлы и сплавы.
Какими физ. свойствами будут обладать такие вещества? – ковкие, пластичные, электро – и теплопроводны, имеют мет.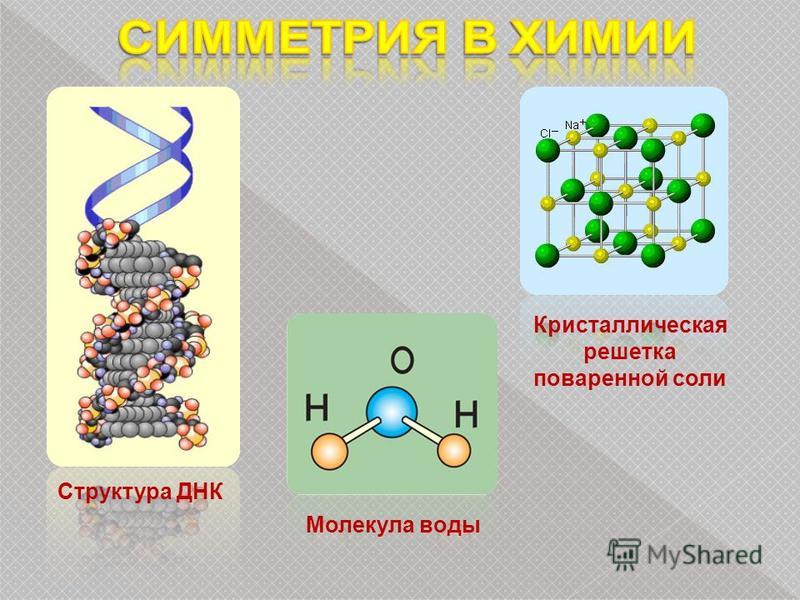 блеск ( все свойства металлов).
блеск ( все свойства металлов).
(слайды 11-12) Рассмотрев типы кристаллических решеток мы с вами установили взаимосвязь между строением атома, химическими связями, кристаллическими решетками и свойствами веществ.
Строение атома химическая связь кристаллическая решетка свойства вещества. |
Откройте учебник на стр. 80, табл. 6 и обратите внимание на типы кристаллических решеток простых веществ в зависимости от их положения в периодической системе.
Какой тип решетки не встречается в простых веществах?
Ответ учеников. У простых веществ не бывает ионных решеток.
Для веществ с молекулярной решеткой характерно явление возгонки (сублимации).
Демонстрационный опыт. Возгонка иода. (Возгонка – это превращение (при нагревании) твердого вещества в газ, минуя жидкую фазу, а затем снова кристаллизация в виде инея.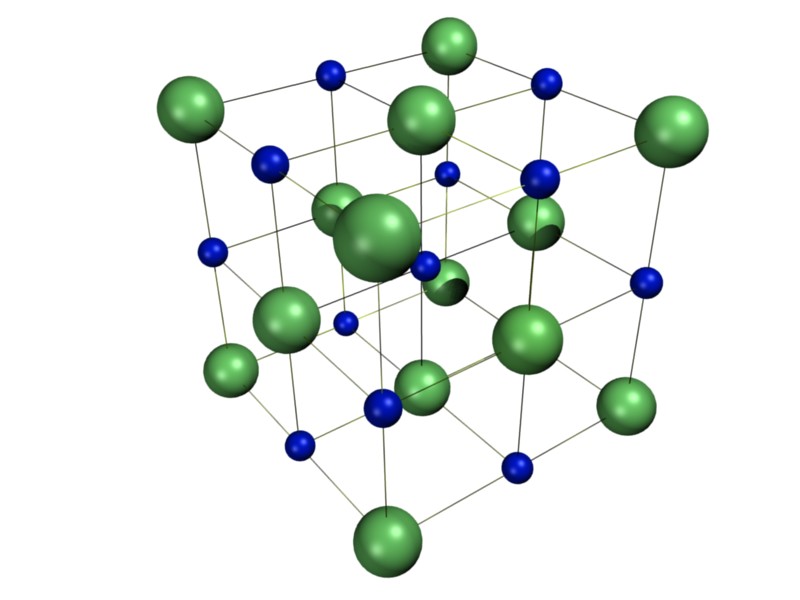
(слайд13) Остался еще один момент урока – закон постоянства состава вещества, которому подчиняются вещества с молекулярным строением.
Этот закон открыт французским химиком Ж.Л.Прустом.
Его формулировка такова: вещества молекулярного строения имеют постоянный состав независимо от способа их получения.
Н-р: вода – не зависимо от того как ее получают, в каком агрегатном состоянии она находится, состав ее не меняется – Н2О.
Для веществ с ионным строением закон Пруста не всегда выполняется.
ИТОГ: Мы заглянули в нутро вещей. Рассмотрели кристаллические решетки
А теперь отвечаем на вопрос, который был задан в начале урока.
(слайды 14-16) Что общего у этих веществ? (типы кристаллических решеток)
Закрепление материала
(слайд 17)
Какие кристаллические решетки у О2, Н2О, NaCl, С?
Ответ учеников. О2 и Н2О – молекулярные кристаллические решетки, NaCl – ионная решетка, С – атомная решетка.
Кремний имеет атомную кристаллическую решетку. Каковы его физические свойства?
Оксид СО2 имеет низкую tпл, а кварц SiO2 – очень высокую (кварц плавится при 1725°С). Какие кристаллические решетки они должны иметь?
Я на бумаге оставляю (слайд 18)
Конечно, очень жирный след.
И рисовать вам помогаю
Уже я много – много лет!
Не прочен я, не как гранит!
А называюсь я … (графит)
Какое строение (кристаллическую решетку) имеет это вещество? Какими свойствами он обладает?
Горжусь своим я блеском (слайд 19)
И тем, что очень твёрд.
Разрежу я железку
На тысячи кусков.
Я – камень драгоценный,
Чужих боюсь я глаз!
Надеюсь, догадались:
Меня зовут… (алмаз)
Какое строение (кристаллическую решетку) имеет это вещество? Какими свойствами он обладает?
(слайд 20) Самостоятельная работа
Определить тип кристаллической решетки для веществ:
- 1 вариант: Н2, Са, КСl, Si, Н2S
- 2 вариант: Сl2, NaNO3, Mg, Н2SO4, С
(слайд 21) Домашнее задание § 22, упр.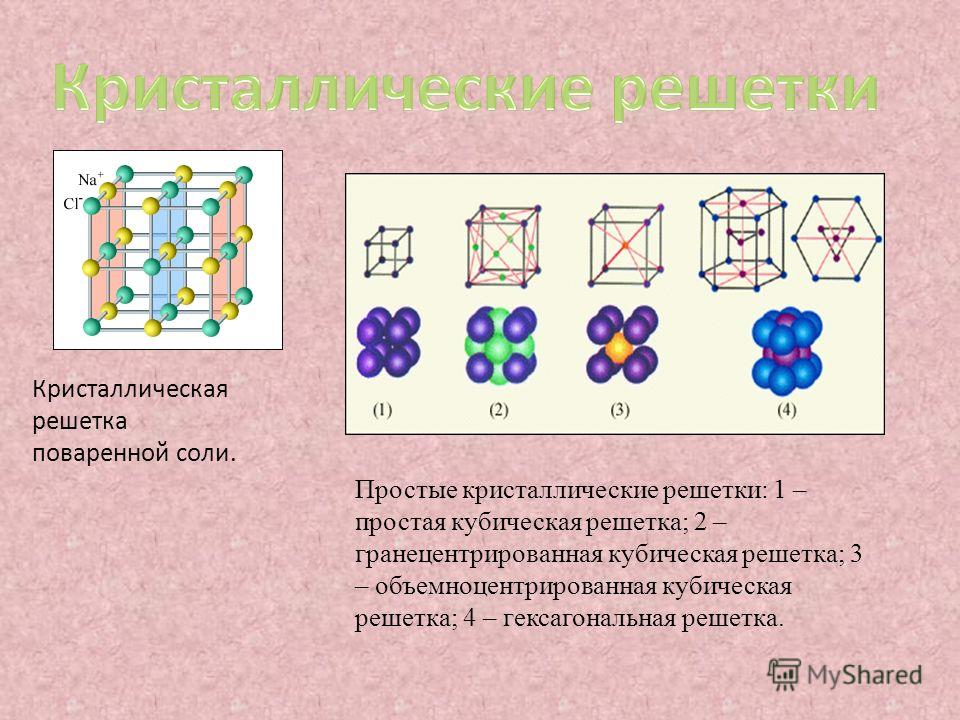 6
6
Используемая литература
- О.С.Габриелян и др. — Химия. 8 класс — М.: Дрофа, 2005.
- О.С.Габриелян и др.– Настольная книга учителя химии 8 класс – М.: Дрофа, 2005.
Решетки и элементарные ячейки соли
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 50849
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
- Цифровая библиотека химического образования (ChemEd DL)
Соль имеет решающее значение для людей на протяжении тысячелетий. Причина, по которой это так важно, заключается в том, что это позволило людям путешествовать на большие расстояния и использовать пищу, которой не было в вегетационный период.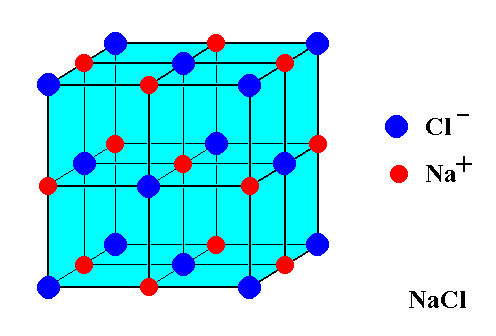 Соль также было очень трудно достать, и в результате возникли огромные торговые сети, пытающиеся получить доступ к драгоценному минералу. Соль была доступна только в определенных регионах мира из-за того, как она образовалась. Одним из способов его образования была морская вода. После испарения воды осталась только соль. Еще одним способом получения соли были подземные шахты. Соль в этих шахтах может быть добыта либо традиционным способом, либо водой. При добыче воды соль появляется в виде рассола, а затем вода снова испаряется, оставляя соль.
Соль также было очень трудно достать, и в результате возникли огромные торговые сети, пытающиеся получить доступ к драгоценному минералу. Соль была доступна только в определенных регионах мира из-за того, как она образовалась. Одним из способов его образования была морская вода. После испарения воды осталась только соль. Еще одним способом получения соли были подземные шахты. Соль в этих шахтах может быть добыта либо традиционным способом, либо водой. При добыче воды соль появляется в виде рассола, а затем вода снова испаряется, оставляя соль.
В древности много соли добывали из моря. В Риме доступом к соли было Адриатическое море. Адриатика была хороша для соли, потому что она была мелкой, поэтому концентрация соли выше. Соляные пруды были сформированы в пограничных районах Адриатики, чтобы соль могла быть сформирована, а затем перевезена в Рим. Соль была настолько важна для римлян, что сеть дорог, которыми славились римляне, была построена для перевозки соли.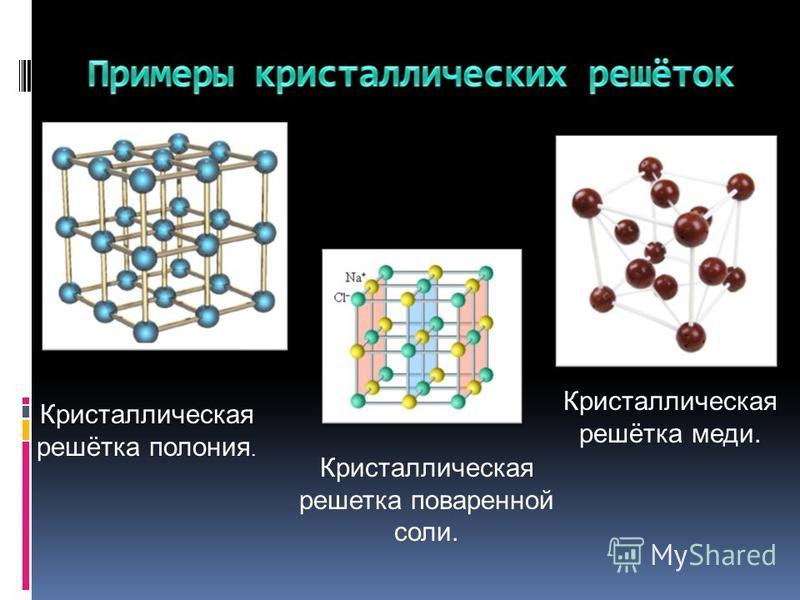 Римская империя так заботилась о минерале, что взяла на себя прямой контроль над ценами на него. Во время войны, когда денег не хватало, цена росла. Когда не было войн, цену устанавливали ниже, чтобы каждый снова мог купить. Соль имела решающее значение для каждого римского гражданина. Это позволяло им сохранять пищу, а также было очень важно есть достаточное количество соли для нормального функционирования организма. Повышение цены не позволило бы низшим классам купить его. Цены на соль можно сравнить с сегодняшними по аналогии с электричеством. Электричество нужно всем, и если цена поднимется, некоторые люди больше не смогут его получать.
Римская империя так заботилась о минерале, что взяла на себя прямой контроль над ценами на него. Во время войны, когда денег не хватало, цена росла. Когда не было войн, цену устанавливали ниже, чтобы каждый снова мог купить. Соль имела решающее значение для каждого римского гражданина. Это позволяло им сохранять пищу, а также было очень важно есть достаточное количество соли для нормального функционирования организма. Повышение цены не позволило бы низшим классам купить его. Цены на соль можно сравнить с сегодняшними по аналогии с электричеством. Электричество нужно всем, и если цена поднимется, некоторые люди больше не смогут его получать.
Нехватка соли или ее избыток привели к расцвету и падению многих империй. Народы Центральной Европы не могли добывать соль, если в этом районе не было соляных шахт или торговых путей к морю. Если торговые пути были ненадежны, то люди должны были выйти и найти соль самостоятельно. Польское королевство, возникшее в 1500-х годах, было основано исключительно на обширной сети соляных копей, доступных в регионе.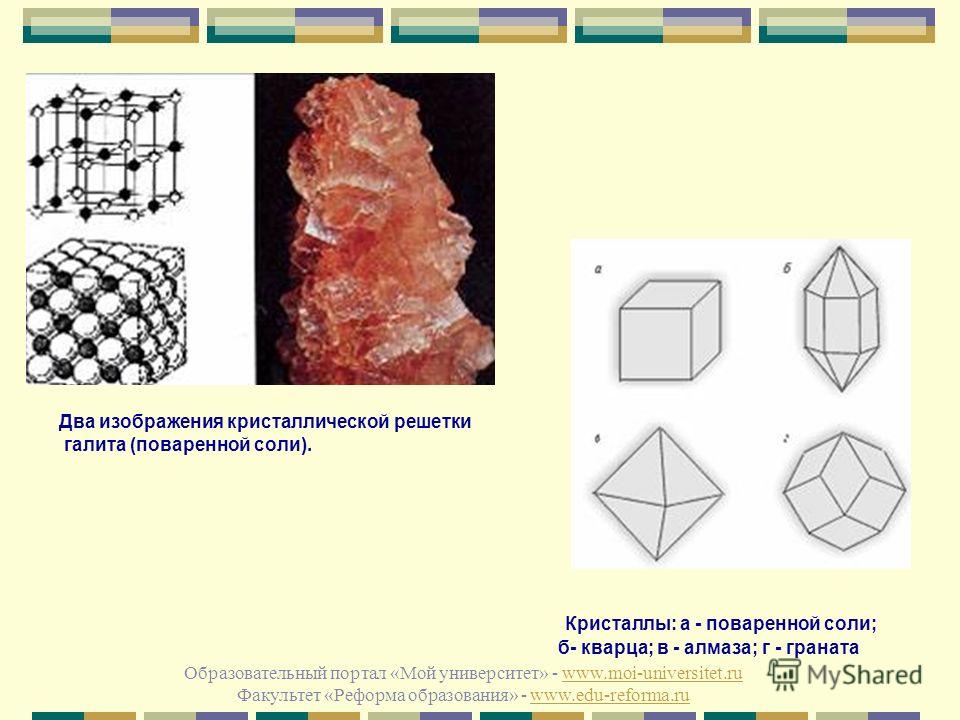 Однако крах наступил, когда немцы поняли, что им не нужна польская соль, а вместо этого можно делать свою собственную из моря. В Америке соляные маршруты имели решающее значение для победы в Войне за независимость. Без соли американцы не смогли бы консервировать продукты, и армия голодала бы. Британцы это поняли и постарались уничтожить как можно больше соляных маршрутов. Однако они не были очень успешными, и с потерей Америки Британская империя сильно ослабла.
Однако крах наступил, когда немцы поняли, что им не нужна польская соль, а вместо этого можно делать свою собственную из моря. В Америке соляные маршруты имели решающее значение для победы в Войне за независимость. Без соли американцы не смогли бы консервировать продукты, и армия голодала бы. Британцы это поняли и постарались уничтожить как можно больше соляных маршрутов. Однако они не были очень успешными, и с потерей Америки Британская империя сильно ослабла.
Соль была важной частью истории человечества. Это важное питательное вещество и, что более важно, пищевой консервант. Благодаря консервирующим свойствам соли люди могли путешествовать на большие расстояния с большим количеством еды. Без соли мир был бы совсем другим.
Кристаллическая решетка и элементарная ячейка соли
Правильное трехмерное расположение атомов или ионов в кристалле обычно описывается в терминах пространственной решетки и элементарной ячейки. В этой структуре также встречается соль. Формула соли – NaCl, состоящая из ионов натрия и хлора.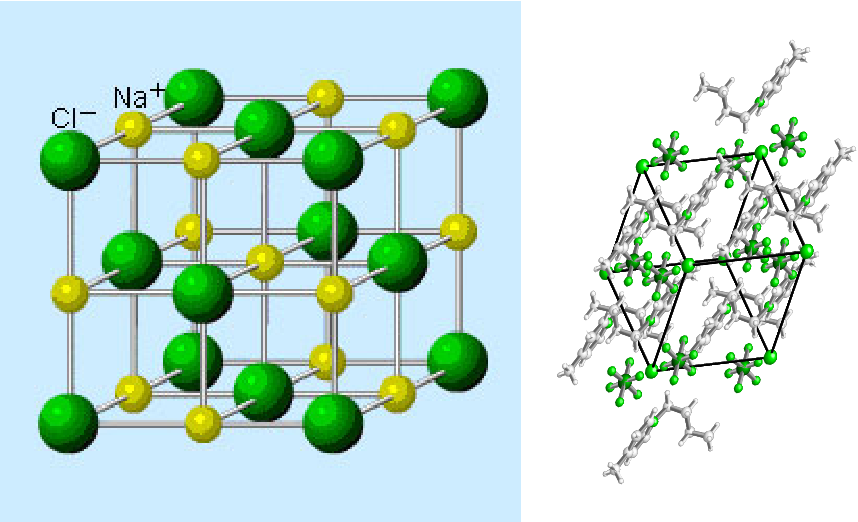 Эти два иона объединяются, образуя решетку. Чтобы понять, что означают эти два термина, давайте сначала рассмотрим двумерные паттерны, показанные на рис. 3. Мы можем думать о каждой из этих трех структур как о большом количестве повторений в двух направлениях фигуры с параллельными сторонами, показанной непосредственно под каждым из них. шаблон.
Эти два иона объединяются, образуя решетку. Чтобы понять, что означают эти два термина, давайте сначала рассмотрим двумерные паттерны, показанные на рис. 3. Мы можем думать о каждой из этих трех структур как о большом количестве повторений в двух направлениях фигуры с параллельными сторонами, показанной непосредственно под каждым из них. шаблон.
ДВУМЕРНЫЕ КРИСТАЛЛИЧЕСКИЕ СТРУКТУРЫ
Эта фигура с параллельными сторонами представляет собой элементарную ячейку . Он представляет собой самую простую, наименьшую форму, из которой может быть построена общая структура. Узор из точек , образованный углами элементарных ячеек, когда они упакованы вместе, называется пространственной решеткой. Линии, соединяющие точки пространственной решетки, показаны цветом. Без определенного опыта довольно легко выбрать неправильную элементарную ячейку для данной структуры. Некоторые неправильные варианты показаны непосредственно под правильным выбором на рисунке. Отметим, в частности, что элементарная ячейка для структуры б , в котором каждый круг окружен шестью другими по углам шестиугольника, является не шестиугольником, а параллелограммом равных сторон (ромбом) с углами 60 и 120°.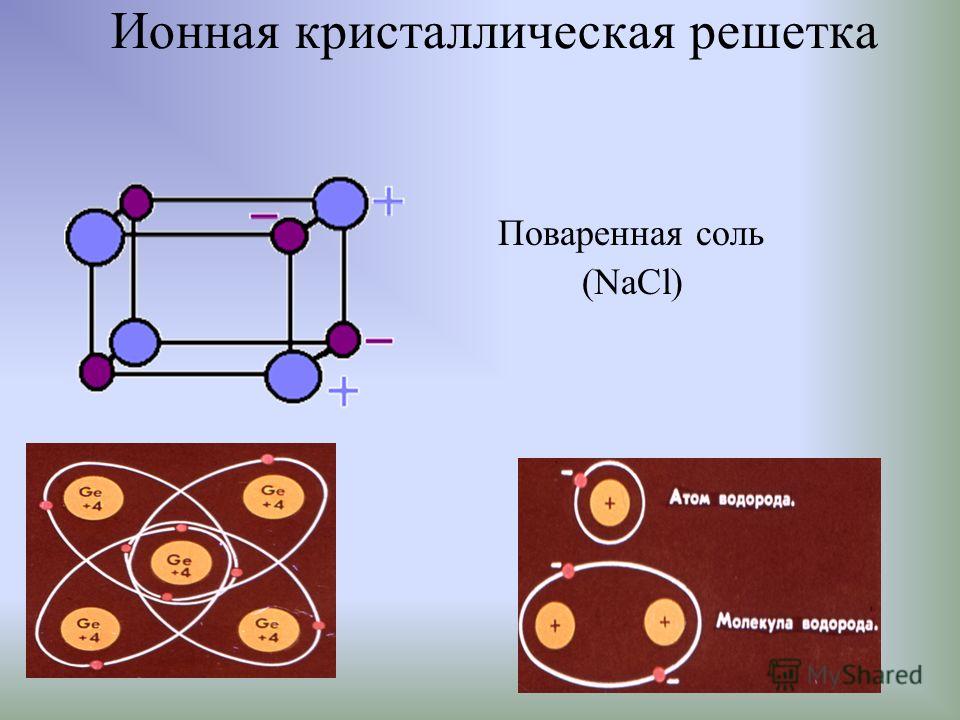
На рис. 2 показаны пространственная решетка и элементарная ячейка реальной трехмерной кристаллической структуры — хлорида натрия.
Это та же самая структура, которая была показана для гидрида лития, за исключением того, что размеры ионов другие. Элементарная ячейка этой структуры представляет собой куб, все углы которого заняты ионами натрия. В качестве альтернативы можно выбрать элементарную ячейку с ионами хлорида по углам.
Элементарная ячейка хлорида натрия содержит четыре иона натрия и четыре иона хлорида. Придя к такому ответу, мы должны иметь в виду, что многие ионы являются общими для нескольких соседних клеток (деталь c на рис. 2 это хорошо показывает). В частности, ионы натрия в центрах квадратных граней ячейки являются общими для двух ячеек, так что только половина каждой из них находится внутри элементарной ячейки. Поскольку у куба шесть граней, всего получается три иона натрия. В середине каждого края элементарной ячейки находится ион хлорида, который используется четырьмя соседними ячейками и, таким образом, составляет одну четверть. Поскольку ребер двенадцать, получается три иона хлорида. В каждом углу куба ион натрия используется восемью другими ячейками. Так как уголков восемь, получается еще один ион натрия. Наконец, в теле куба есть ион хлора, не разделенный ни с одной другой клеткой. Таким образом, общее количество составляет четыре иона натрия и четыре иона хлорида.
Поскольку ребер двенадцать, получается три иона хлорида. В каждом углу куба ион натрия используется восемью другими ячейками. Так как уголков восемь, получается еще один ион натрия. Наконец, в теле куба есть ион хлора, не разделенный ни с одной другой клеткой. Таким образом, общее количество составляет четыре иона натрия и четыре иона хлорида.
Общая формула может быть получена из только что представленных аргументов для подсчета N , количества атомов или ионов в элементарной ячейке. Это
\[N=N_{\text{body}}\text{ +}\dfrac{N_{\text{face}}}{\text{2}}\text{ + }\dfrac{N_{ \text{край}}}{\text{4}}\text{ + }\dfrac{N_{\text{угол}}}{\text{8}}\]
Рисунок \(\PageIndex{2}\ ). Кристаллическая решетка NaCl Рисунок \(\PageIndex{3}\). 2D Crystal StructureИз ChemPRIME: 10.2: Решетки и элементарные ячейки
Ссылки
1. www.salt.org.il/frame_econ.html
2. mygeologypage.ucdavis.edu/cow…l115/salt.html
Авторы и авторство
- Ed Vitztown (Kutztown) 9003 университет), Джон В.
 Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавье Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан.
Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавье Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан.Эта страница под названием «Решетки и элементарные ячейки соли» используется в соответствии с лицензией CC BY-NC-SA 4.0, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Теги
- Образец
6.
 11A: Структура – каменная соль (NaCl)
11A: Структура – каменная соль (NaCl)- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 2589
Каменная соль, также известная как NaCl, представляет собой ионное соединение. Встречается в природе в виде белых кубических кристаллов. Структура NaCl образована повторением элементарной ячейки. Он имеет организованную структуру и имеет соотношение Na:Cl 1:1.
Введение
Каменная соль (\(\ce{NaCl}\)) представляет собой ионное соединение, встречающееся в природе в виде белых кристаллов. Его извлекают из минеральной формы галита или выпариванием морской воды. Структура NaCl образована повторением элементарной гранецентрированной кубической ячейки.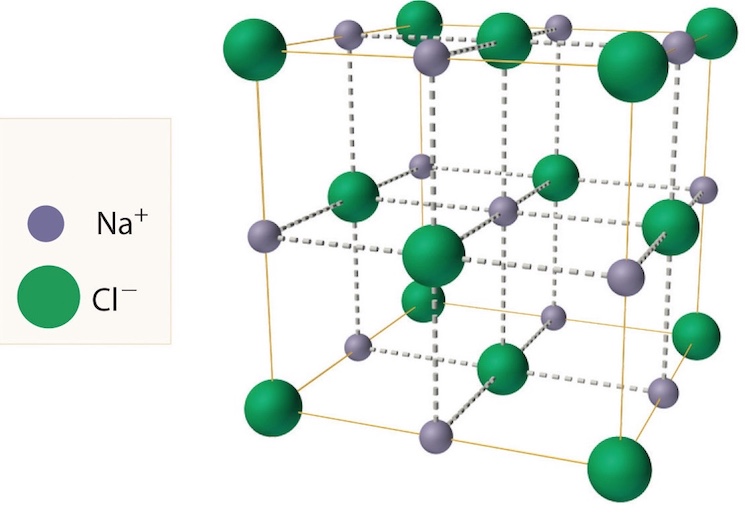 Он имеет стехиометрическое соотношение Na:Cl 1:1 с молярной массой 58,4 г/моль. Соединения со структурой хлорида натрия включают щелочные галогениды и оксиды металлов и соединения переходных металлов. Важную роль во многих важных приложениях играют структура и динамика воды. Некоторые приложения включают кристаллизацию белков и конформационное поведение пептидов и нуклеиновых кислот.
Он имеет стехиометрическое соотношение Na:Cl 1:1 с молярной массой 58,4 г/моль. Соединения со структурой хлорида натрия включают щелочные галогениды и оксиды металлов и соединения переходных металлов. Важную роль во многих важных приложениях играют структура и динамика воды. Некоторые приложения включают кристаллизацию белков и конформационное поведение пептидов и нуклеиновых кислот.
Структура
На рисунке \(\PageIndex{1}\) показано, как ионы Na + и Cl — занимают пространство. Ионы меньшего размера — это Na + с атомным радиусом 102 пм, а более крупные ионы — это ионы Cl — с атомным радиусом 181 пм. Поскольку NaCl в соединении находится в соотношении один к одному, координационные числа Na и Cl равны. Более крупные зеленые ионы представляют собой Cl —, а меньшие фиолетовые ионы представляют собой Na + . Однако структура этой молекулы позволяет менять их положение, поскольку координационные числа эквивалентны.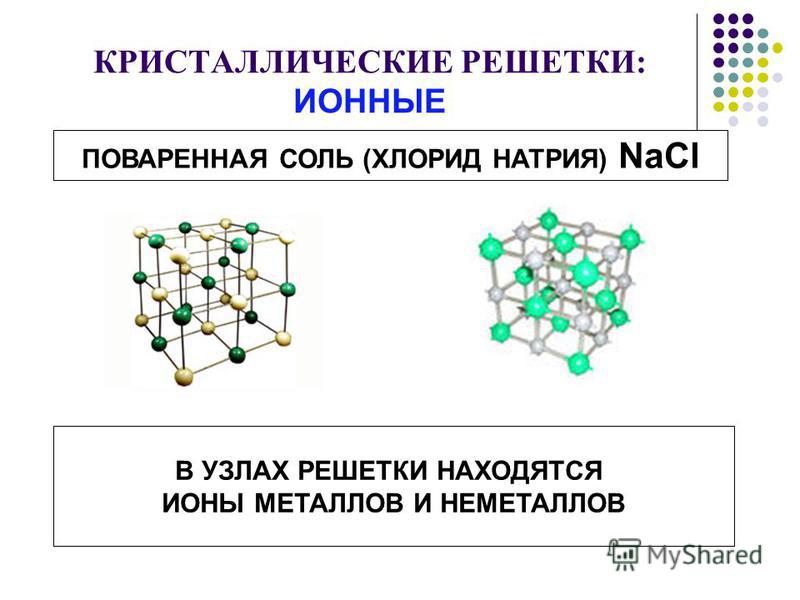 9{-}}\) ионов. Существует четыре типа позиций: уникальная центральная позиция, гранная позиция, краевые позиции и угловая позиция, которые используются для определения количества ионов Na + и ионов Cl — в элементарной ячейке NaCl. При подсчете количества ионов угловой участок будет общим для 7 других элементарных ячеек. Следовательно, 1 угол будет равен 1/8 части иона. Аналогичное явление происходит с гранями и краевыми узлами. Для лицевого участка он является общим для 1 другой элементарной ячейки, а для краевого узла ион используется 3 другими элементарными ячейками. \(\ce{NaCl}\) представляет собой гранецентрированную кубическую элементарную ячейку, состоящую из четырех катионов и четырех анионов. Это можно показать, подсчитав количество ионов и умножив их в зависимости от их положения. 9{-}}\): \[4_{грань} \times \dfrac{1}{2} + 8_{угол} \times \dfrac{1}{8} = 4\, \text{всего ионов хлора на ячейку } \номер\]
9{-}}\) ионов. Существует четыре типа позиций: уникальная центральная позиция, гранная позиция, краевые позиции и угловая позиция, которые используются для определения количества ионов Na + и ионов Cl — в элементарной ячейке NaCl. При подсчете количества ионов угловой участок будет общим для 7 других элементарных ячеек. Следовательно, 1 угол будет равен 1/8 части иона. Аналогичное явление происходит с гранями и краевыми узлами. Для лицевого участка он является общим для 1 другой элементарной ячейки, а для краевого узла ион используется 3 другими элементарными ячейками. \(\ce{NaCl}\) представляет собой гранецентрированную кубическую элементарную ячейку, состоящую из четырех катионов и четырех анионов. Это можно показать, подсчитав количество ионов и умножив их в зависимости от их положения. 9{-}}\): \[4_{грань} \times \dfrac{1}{2} + 8_{угол} \times \dfrac{1}{8} = 4\, \text{всего ионов хлора на ячейку } \номер\]
Каждый ион в этой решетке имеет шесть ионов другого типа в качестве ближайших соседей и двенадцать ионов того же типа в качестве вторых ближайших соседей.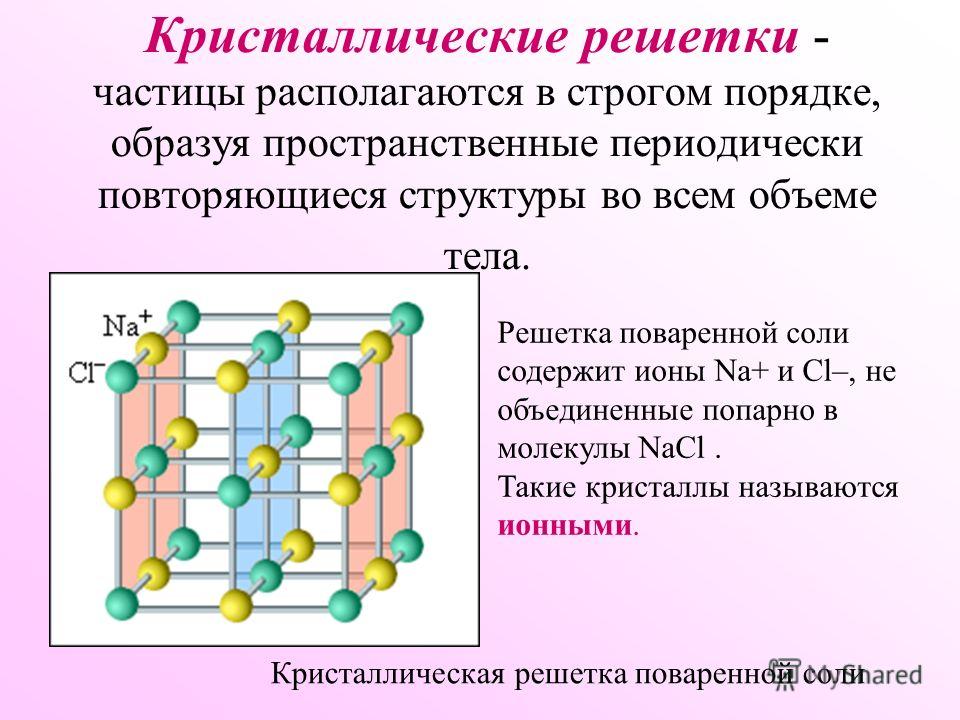 Есть много ионных соединений, которые принимают эту структуру, включая все другие галогениды Na, Li, K и Rb. CsF, AgF, AgCl, BaO, CoO и SrS также входят в число многих, которые образуют структуры, подобные NaCl.
Есть много ионных соединений, которые принимают эту структуру, включая все другие галогениды Na, Li, K и Rb. CsF, AgF, AgCl, BaO, CoO и SrS также входят в число многих, которые образуют структуры, подобные NaCl.
Внешние ссылки
- Видео о структуре NaCl: http://www.youtube.com/watch?v=csfOBynrF8E
- Элементарная ячейка. http://www.case.edu/artsci/chem/chim…ids/xtal1.html
Ссылки
- Gao, H.X., L.-M. Пэн и Дж. М. Цзо. «Динамика решетки и факторы Дебая-Валлера некоторых соединений со структурой хлорида натрия». Acta Crystallographica: Section A (Wiley-Blackwell) 55.6 (1999): 1014. Academic Search Complete . ЭБСКО. Веб.
- Хаускрофт, Кэтрин Э. и Алан Г. Шарп. Неорганическая химия . 3-е изд. Харлоу: Pearson Education, 2008. Печать.
- Джун Су, Ким и Йетирадж Арун. «Диффузионная аномалия воды в водных растворах хлорида натрия при низких температурах». Журнал физической химии B 112.




Leave A Comment